ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 2, с. 269-276
УДК 547.854
АНИЛ-СИНТЕЗ В КОНСТРУИРОВАНИИ ПУШ-ПУЛЬНЫХ
СИСТЕМ. СИНТЕЗ ЗАМЕЩЕННЫХ
2- И 4-(4-АРИЛСТИРИЛФЕНИЛ)ДИФЕНИЛПИРИМИДИНОВ
© 2020 г. А. А. Арутюнянa, b, *, Г. А. Паносянb, М. С. Сафарянa, b, Г. К. Арутюнянb,
Г. Т. Гукасяна, Г. Г. Данагулянa, b
a Российско-Армянский (Славянский) университет, 0051, Республика Армения, г. Ереван, ул. Овсепа Эмина 123
b Научно-технологический центр органической и фармацевтической химии НАН Республики Aрмения,
0014, Республика Армения, г. Ереван, пр. Азатутян 26
*e-mail: harutyunyan.arthur@yahoo.com
Поступила в редакцию 07 сентября 2019 г.
После доработки 18 октября 2019 г.
Принята к публикации 02 декабря 2019 г.
Изучены возможности анил-синтеза для получения
2,4,6-триaрилзамещенных пирими-динов с
протяженной цепью делокализованных π-связей. Взаимодействием (E)-3-фенил-1-(п-толил)проп-2-ен-1-
она или халкона с гидрохлоридами бензамидина, 4-метилбензамидина или 4-изобутоксибензамидина в
этаноле в присутствии KOH синтезированы 2,4-дифенил-6-(п-толил)пиримидин, 4,6-дифенил-2-(п-толил)
пиримидин и
2-(4-изобутоксифенил)-4-фенил-6-(п-толил)пиримидин. Взаимодействием исходных
пиримидинов с (E)-N-(фенил- или 2-хлорфенил)-1-арилметаниминами в ДМФА в присутствии смеси
KOH/LiH получены (E)-4,6-дифенил-2-[(4-стирил)фенил]пиримидины и (E)-2,6-дифенил-4-[(4-стирил)
фенил]пиримидины.
Ключевые слова: 2,4-дифенил-6-(п-толил)пиримидин, 4,6-дифенил-2-(п-толил)пиримидин, 2-(4-изобутокси-
фенил)-4-фенил-6-(п-толил)пиримидин, (E)-3-фенил-1-(п-толил)-проп-2-ен-1-он, халкон, конденсация,
ДМФА/KOH/LiH, (E)-4,6-дифенил-2-[(4-стирил)фенил]пиримидины, (E)-2,6-дифенил-4-[(4-стирил)фенил]-
пиримидины.
DOI: 10.31857/S0514749220020159
Возрастающий интерес к синтезу замещенных
Введение в ядро пиримидина полиненасыщенных
пиримидинов с протяженной цепью делокализо-
сопряженных цепей формально может быть осу-
ванных π-связей обусловлен возможностями соз-
ществлено двумя путями: конструированием кольца
дания на их основе новых разнообразных оптико-
из простых предшественников, несущих требуемый
органических материалов (органических свето-
набор функциональных групп и химической транс-
излучающих диодов (OLED), полевых транзис-
формацией имеющихся функциональных групп.
торов (ОFET), солнечных батарей, люминесцент-
Необходимо отметить, что первый упомянутый син-
ных сенсоров и др.) [1] и препаратов медико-
тетический подход к целевым пиримидинам из аци-
биологического применения [2]. π-Дефицитная аза-
клических предшественников ограничен получе-
ароматическая система пиримидина выполняет
нием 4(6)-(2-арилэтилен)пиримидинов по реакции
функцию электроноакцепторной части молекуляр-
Биджинелли из замещенных коричных альдегидов
ной системы (π-акцептор), которая после связыва-
[3]. По альтернативному пути, производные пирими-
ния с электронодонорной группой (π-донор), пос-
дина с цепями π-сопряжения могут быть получены
редством делокализованных π-связей, формирует
конденсацией метилпиримидинов с арил(гетарил)-
цельную пуш-пульную систему, в которой перенос
карбальдегидами [4], реакциями кросс-сочетания на
заряда между частями молекулы обусловливает
основе переходных металлов в различных вариантах
появление оптико-электронных свойств.
[5] и на основе так называемого анил-синтеза [6, 7].
269
270
АРУТЮНЯН и др.
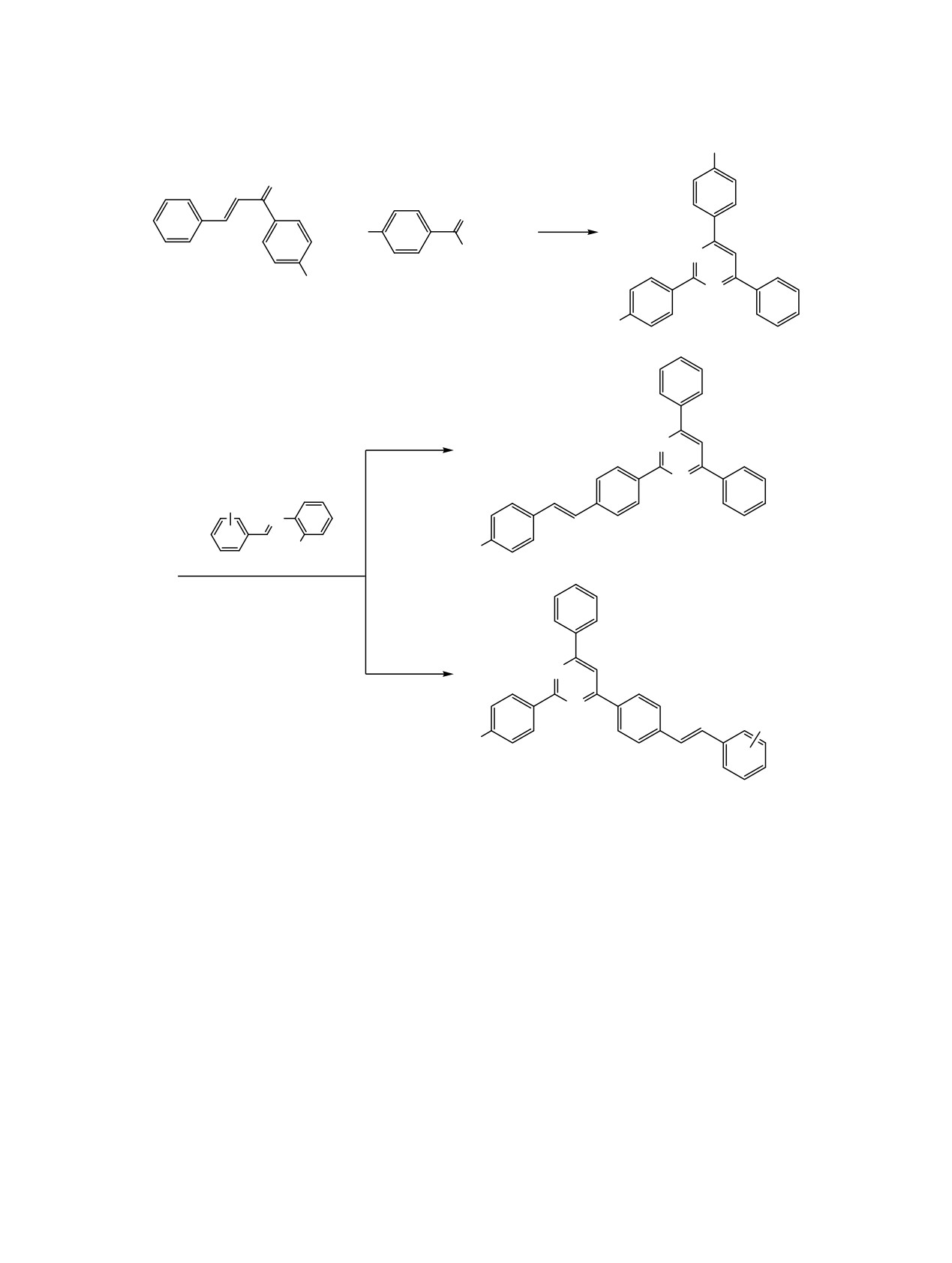
Схема 1.
R
O
NH
2 KOH
+
R1
HCl
EtOH
NH2
N
R
N
R1
1a, b
2a-c
3a-c
N
N
R2
N
R3
R2
4a-d
5a-d
KOH/LiH/DMF
N
N
R2
R1
6a-e
1a, b, R = H (a), Me (b). 2a-c, R1 = H (a), Me (b), i-BuО (c). 3a-c, R, R1 = H, Me (a), Me, H (b), Me, i-BuО (c). 4a-d, R2, R3 =
H, H (a), 4-MeO, Cl (b), 4-i-Pr, Cl (c), 3,4(CH2O2), Cl (d). 5a-d, R2 = H (a), MeO (b), i-Pr (c), 3,4-(CH2O2) (d). 6a-e, R1, R2 =
H, H (a), H, 4-MeO (b), H, 3,4-(CH2O2) (c), H, i-Pr (d), i-BuО, H (e).
Известно, что реакция анил-синтеза заклю-
жения, несмотря на возможность варьирования
чается во взаимодействии пара-толилзамещенных
вводимых в реакцию синтонов, доступность исход-
гетероциклов и, в частности, пиримидинов с осно-
ных реагентов и простоту экспериментального
ваниями Шиффа из ароматических и гетероцик-
исполнения, не получил широкого распростра-
лических альдегидов и анилина или 2- или 4-
нения. Отметим, что синтезированные по
хлоранилинов в среде безводного ДМФА в
последнему методу пиримидины с протяженными
присутствии ряда сильных оснований: щелочных
цепями π-сопряжения содержат в пиримидиновом
металлов, их гидроксидов, алкоксидов и амидов,
кольце одну фенильную или одну метильную
предпочтительнее в присутствии гидроксида- или
группу, либо фенильную группу в сочетании с
трет-бутилата калия
[6]. Однако несколько
алкильной или алкоксильной [7] и отсутствуют
удивительно, что обсуждаемый метод синтеза
производные с двумя фенильными группами в
пиримидинов с протяженными цепями π-сопря-
пиримидиновом кольце. В связи с этим, мы
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
АНИЛ-СИНТЕЗ В КОНСТРУИРОВАНИИ ПУШ-ПУЛЬНЫХ СИСТЕМ
271
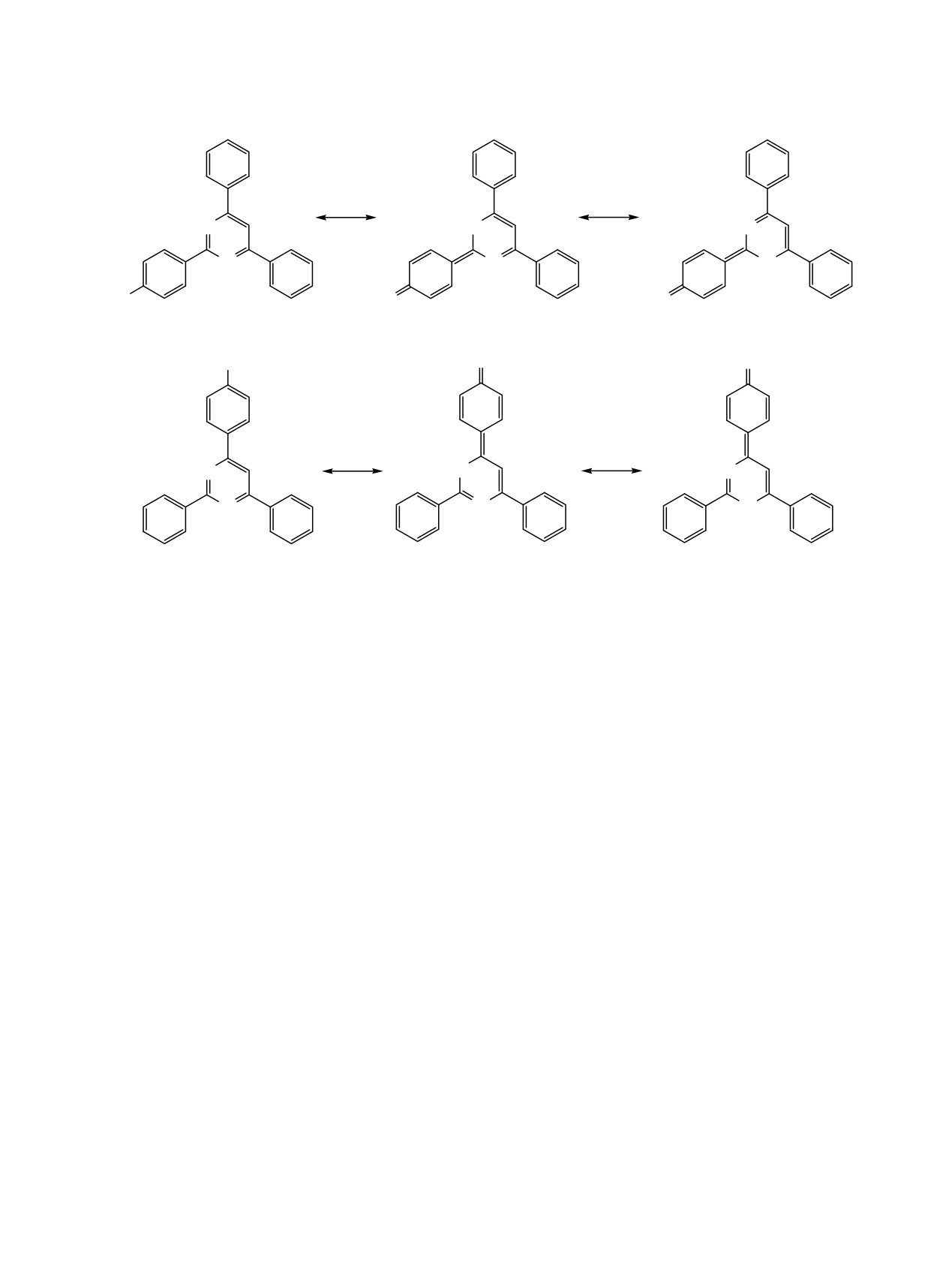
Схема 2.
_
N
N
N
N
N
N
_
H2C
H2C
H2C
A
A1
A2
_
CH2
CH2
CH2
_
N
N
N
N
N
N
B
B1
B2
сфокусировали внимание на реакции анил-синтеза
нии, за исключением (E)-N,1-дифенилметанимина
как удобного и эффективного метода получения
(4a) [9] не вполне удовлетворительны [10].
целевых пиримидинов, с вовлечением в реакцию
Основания Шиффа 4a-d нами синтезировались
изомерных
2,4,6-триарилзамещенных пиримиди-
из ароматических альдегидов и 2-хлоранилина, в
нов. Синтез проведен по схеме 1.
условиях совместного нагревания без раствори-
Взаимодействием (E)-3-фенил-1-арилпроп-2-ен-
телей и далее вводились в последующую реакцию
1-онов 1a, b с гидрохлоридами бензамидина 2a, 4-
без выделения и очистки. Из использованных в
метилбензамидина 2b или 4-изобутоксибензамиди-
оригинальной прописи оснований наш выбор был
на 2c в этаноле в присутствии KOH синтезированы
сделан в пользу гидроксида калия, однако для
исходные пиримидины 3a, b и пиримидин 3c,
удобства и упрощения процесса, вместо рекомен-
причем циклоконденсация протекает одновремен-
дуемого 7-10 мольного избытка обезвоженного
но с дегидрированием-ароматизацией с образова-
KOH в реакцию вводилась смесь 5 моль сухого
нием
2,4,6-тризамещенных пиримидинов
3a-c,
KOH и 5 моль гидрида лития в ДМФА.
после чего синтезированные пиримидины введены
Установлено, что 4,6-дифенил-2-(пара-толил)-
в реакцию анил-синтеза. Гидрохлорид
4-изобу-
пиримидин (3a), 2,4-дифенил-6-(пара-толил)пири-
токсибензамидина 2c получен аналогично методу
мидин (3b) и 4,6-дифенил-2-(4-изобутоксифенил)-
получения бензамидина [8]. Нами изучены условия
пиримидин
(3c) гладко реагируют с (E)-N-(2-
проведения анил-синтеза для пиримидинов 3a-c с
хлорфенил)-1-(арил)метаниминами 4a-d в смеси
основаниями Шиффа из анилина или 2- или-4-
KOH/LiH в ДМФА в интервале температур 95-
хлоранилинов и ароматических альдегидов и
105°С с образованием целевых тризамещенных пи-
внесены коррективы в методику выполнения
римидинов 5a-d и 6а-e.
эксперимента, что позволило несколько оптимизи-
ровать и упростить процесс синтеза без умень-
Для объяснения реакционной способности
шения выхода целевых соединений. Описанные в
изомерных пиримидинов 3a-c в условиях реакции
литературе методы получения и выделения осно-
анил-синтеза, протекающей в присутствии щело-
ваний Шиффа из анилина и 2- или 4-хлоранилина и
чей, нами в качестве рабочей гипотезы качественно
ароматических альдегидов в очищенном состоя-
рассмотрены возможные граничные мезомерные
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
272
АРУТЮНЯН и др.
структуры, образующиеся при отрыве протона от
кольца пиримидина обладают плоскостью симмет-
пара-толильной группы. В результате отрыва про-
рии, проходящей через метильную группу и атом
тона метильной группы толильного остатка, рас-
С5 пиримидинового кольца (соединение 3a) или
положенного в положении C2 пиримидинового
через метильную- и 2-(4-стирилфенильную) группы
кольца образуется карбанион А, в котором отрица-
(соединение 5a), в связи с чем количество сигналов
тельный заряд в обеих канонических формулах
в спектре ЯМР С13 соединений 3a и 5a равно, соот-
эффективно делокализуется атомами азота по цепи,
ветственно, только 11 и 17. В то же время в
включающей пять сопряженных двойных связей
спектрах ЯМР С13 изомерных пиримидинов 3b и
(граничные формулы А1, А2), в то время как
6a, в которых отсутствуют элементы симметрии,
карбанион B, образующийся за счет метильной
количество сигналов в спектре увеличивается до 17
группы толильного заместителя в положении C4
и 22, соответственно.
пиримидинового кольца, стабилизируется анало-
Конструкционные особенности синтезирован-
гичным образом в одной канонической формуле
ных рядов изомерных пиримидинов 5a-d и 6a-e
(граничная формула B1) и по цепи из четырех
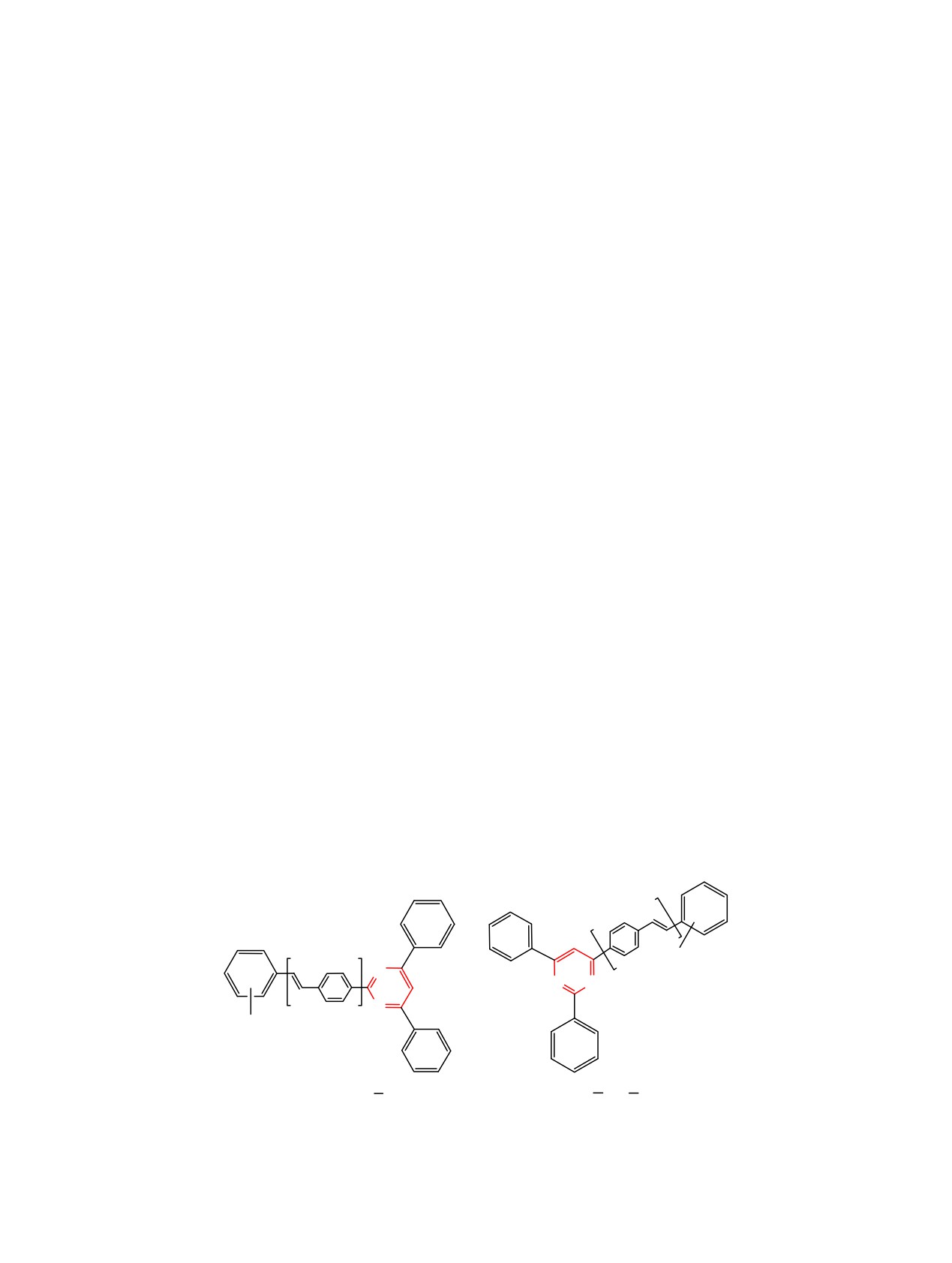
содержат основные элементы V-образных пуш-
сопряженных двойных связей - в другой (гра-
пульных систем, в которых имеется сопряжение
ничная формула B2) (схема 2).
между π-акцепторной (π-A) и π-донорной (π-D)
Можно учитывать и мезомерные формы с дело-
частями молекулы по типу π-A/D_ π-A_ π-A/D [11]
кализацией отрицательного заряда на атомах угле-
(см. рисунок).
рода фенильных групп и на aтоме C5 кольца пири-
Центральное положение в молекуле в обоих
мидина, хотя эти формы энергетически менее благо-
рядах соединений занимает π-дефицитный пири-
приятны и их относительный вклад в мезомерную
мидиновый цикл (π-А), который непосредственно
стабилизацию карбанионов существенно меньше.
соединен с незамещенной фенильной группой,
В ходе реакции возможно первоначальное обра-
проявляющей стабилизирующий ±M-эффект (π-A/
зование карбанионов из метильных групп пара-
D), с фенильной группой с ±M-эффектом (R1 = H,
толильных заместителей, в которых имеет место
π-A/D) или +M-эффектом (R1 = изобутил, π-D) и
энергетически выгодная резонансная стабилизация
связанной посредством спейсера с π-сопряженной
карбанионов с охватом широкой области π-
4-(4-стирил)фенильной группой, заместители в
сопряжения, которые вступают в дальнейшую
которой определяют электронные характеристики
реакцию с электрофильными иминами.
фрагмента.
Строение синтезированных соединений одноз-
Некоторые производные из обоих рядов пири-
начно подтверждено спектрами ИК и ЯМР 1Н и
мидинов проявляют выраженную флуоресценцию,
13С, причем анализ последнего упомянутого
что несомненно, является результатом высокой
спектра является весьма информативным.
степени подвижности электронного облака и подт-
Так, исходный пиримидин 3a и его производное
верждает пуш-пульный характер синтезированных
5a с пара-толильной группой в положении C2
сопряженных систем.
π-A
π-D
π-A/D
π-A/D
R2
π-A/D
N
π-A
π-D
N N
π-A
N
R2
π-A/D
π-A/D
π-D
π-D,
π-A/D π-A
π-A/D
π-D, π-A/D
π-A
π-D , π-A/D
Распределение электронного облака в синтезированных системах 5 и 6.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
АНИЛ-СИНТЕЗ В КОНСТРУИРОВАНИИ ПУШ-ПУЛЬНЫХ СИСТЕМ
273
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
5.77; N 8.45. C23H18N2. Вычислено, %: C 85.68; H
5.63; N 8.69.
ИК спектры сняты на приборе «Nicolet Avatar
2,4-Дифенил-6-(п-толил)пиримидин (3b). По-
330» в вазелиновом масле, спектры ЯМР 1Н - на
лучен из гидрохлорида бензамидина и (E)-3-фенил-
приборе «Varian Mercury-300» с рабочей частотой
1-(п-толил)проп-2-ен-1-она
[14]. Выход
72.3%,
300 МГц и «Avance Neo 400» с рабочей частотой
т.пл. 150-152°С, что соответствует литературе [15].
400 МГц, внутренний стандарт - ТМС. Элемент-
Спектр ЯМР 1H (ДМСО-d6-CCl4, 1:3), δ, м.д.: 2.48 с
ный анализ осуществлен на автоматическом эле-
(3H, CH3), 7.32-7.36 м (2H, H3',5', C6H4), 7.44-7.58 м
ментном анализаторе «ЕА 3000 Eurovector» (Италия).
(6H, 2H3',4',5', C6H5), 8.23 с (1H, H5пиримидин), 8.27-8.31
Восходящая тонкослойная хроматография прове-
м (4H, 2H2',6', C6H4), 8.36-8.41 м (2H, H2',6', C6H5),
дена на пластинках Silufol UV-254 в системе
8.65-8.70 м (2H, H2',6', C6H5). Спектр ЯМР 13C, δ,
этилацетат-гексан (1:8) (соединения 3a-c, 5a-c, 6a,
м.д.: 20.9 (CH3), 109.4, 126.80, 126.84, 127.7, 127.8,
6c-e) и этилацетат-гексан (1:4) (соединение 6b)
128.1, 128.9, 129.8, 130.0, 134.0, 136.8, 137.6, 140.1,
проявление _ в УФ-свете.
163.2, 163.7, 163.8.
Гидрохлорид 4-изобутоксибензамидина (2c).
2-(4-Изобутоксифенил)-4-фенил-6-(п-толил)-
В раствор 1.75 г. (0.01 моль) 4-изобутоксибензо-
пиримидин (3c). Выход 76.7%, т.пл. 120-122°С, Rf
нитрила [12] и 0.6 г (0.013 моль) абсолютного
0.80. ИК спектр, ν, см-1: 1607,1585 (C=C-C=N).
этанола в 5 мл сухого эфира при охлаждении на
Спектр ЯМР 1H (ДМСО-d6-CCl4, 1:3), δ, м.д. (J,
ледяной бане пропускают сухой HCl до привеса
Гц): 1.09 д (6H, Me2, J 6.7), 2.07-2.20 м (1H, CH),
около 0.5 г и оставляют при комнатной темпе-
2.47 с (3H, CH3), 3.83 д (2H, CH2, J 6.5), 6.95-7.00 м
ратуре на ночь. Из колбы под пониженным дав-
(2H, H3',5', C6H4O-i-Bu), 7.31-7.35 м
(2H, H3',5',
лением упаривают эфир и к содержимому при
C6H4Me), 7.47-7.57 м (3H, H3',4,5', C6H5), 8.14 с (1H,
охлаждении на ледяной бане прибавляют 20 мл
Hпиримидин), 8.24-8.28 м (2H, H2',6', C6H4Me), 8.33-8.38
абсолютного спирта, насыщенного газообразным
м (2H, H2',6', C6H5), 8.56-8.61 м (2H, H2',6', C6H4O-i-
аммиаком. Через 2 дня упаривают этанол, остаток
Bu). Спектр ЯМР 13C, δ, м.д.: 18.8 (Me2), 20.9 (CH3),
обрабатывают сухим эфиром и отфильтровывают
27.7 (CH), 73.5 (CH2), 108.6, 113.5 (2CH), 126.7
осадок. Выход 1.9 г (83.1%), т.пл. 238-240°С, ИК
(2CH), 126.8 (2CH), 128.1 (2CH), 128.8 (2CH), 129.3
спектр, ν, см-1: 3360, 3120, 2740 (NH3+, NH2+), 1669
(2CH), 129.9, 130.1, 134.1, 137.0, 139.9, 160.7, 163.1,
(NH2), 1608 (C=C-C=N). Полученный продукт без
163.5, 163.6. Найдено, %: C 82.43; H 6.52; N 7.27.
очистки используют в реакции.
C27H26N2O. Вычислено, %: C 82.20; H 6.64; N 7.10.
Общая методика получения пиримидинов
Пиримидины 5a-d, 6a-e. В круглодонной колбе
3a-c. Смесь 0.01 моль гидрохлорида амидина 2a-c,
емкостью 20 мл смешивают по 0.0055 моль арома-
0.01 моль (E)-1-арил-3-фенилпроп-2-ен-1-она 3a-c
тического альдегида и 2-хлоранилина и смесь наг-
и 1.12 г (0.02 моль) KOH в 30 мл абсолютного
ревают 4 ч при 140-150°С. Охлаждают до комнат-
этанола оставляют на ночь при комнатной темпе-
ной температуры и в эту же колбу вносят 1.61 г
ратуре, кипятят 3 ч с обратным холодильником и
(0.005 моль) пиримидина 3a, 3b или 3c, 1.4 г
содержимое выпаривают. К остатку приливают
(0.025 моль) однократно плавленого KOH, 0.20 г
50 мл воды, оставляют на холоду 3 ч и отфильтро-
(0.025 моль) LiH, 10 мл высушенного ДМФА и
вывают содержимое.
смесь нагревают 3 ч при 90-100°С, причем уже
через 5 мин желтоватый цвет раствора сменяется
4,6-Дифенил-2-(п-толил)пиримидин
(3a).
на темно-багровый. После достижения комнатной
Получен из гидрохлорида 4-метилбензамидина [13]
температуры смесь выливают на 50 г льда, остав-
и (E)-N,1-дифенилметанимина (4a). Выход 65.0%,
ляют на холоду, продукт отфильтровывают через
т.пл. 188-190°С, Rf 0.62. ИК спектр, ν, см-1: 1605,
бумажный фильтр и перекристаллизовывают из
1595 (C=C-C=N). Спектр ЯМР 1H (ДМСО-d6-CCl4,
80% AcOH.
1:3), δ, м.д.: 2.47 с (3H, CH3), 7.27-7.32 м (2H, H3',5',
C6H4), 7.48-7.58 м (6H, 2H3',4',5', C6H5), 8.24 с (1H,
(E)-4,6-Дифенил-2-(4-стирилфенил)пирими-
Hпиримидин), 8.34-8.42 м (4H, 2H2',6', C6H5), 8.54-8.59
дин (5a). Получен взаимодействием пиримидина
м (2H, H2',6', C6H4). Спектр ЯМР 13C, δ, м.д.: 21.0
3a с (E)-N,1-дифенилметанимином
(4a). Выход
(CH3), 109.5, 126.9, 127.8, 128.1, 128.4, 130.0, 134.9,
64.3%, т.пл. 202-204°С, Rf 0.64. ИК спектр, ν, см-1:
136.8, 139.6, 163.4, 163.7. Найдено, %: C 85.54; H
1585, 1574 (C=C-C=N). Спектр ЯМР 1H (ДМСО-d6-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
274
АРУТЮНЯН и др.
CCl4, 1:3), δ, м.д.: 7.21-7.27 м (1H, H4, C6H5CH=CH),
Выход 73.1%, т.пл. 183-185°С, Rf 0.28. ИК спектр,
7.25 с (2H, C6H5CH=CH), 7.32-7.38 м (2H, H3,5,
ν, см-1: 1586, 1573 (C=C-C=N). Спектр ЯМР 1H
C6H5CH=CH), 7.50-7.60 м (8H, H3,4,5, 2C6H5 и H2,6,
(ДМСО-d6-CCl4, 1:3), δ, м.д. (J, Гц): 6.01 с (2H,
C6H5CH=CH), 7.66-7.71 м (2H, H3,5, C6H4), 8.27 с
CH2), 6.80 д (1H, H7, C6H3, J 8.0), 7.01 д.д (1H, H7,
(1H, Hпиримидин), 8.38-8.43 м (4H, H2,6, 2C6H5), 8.66-
C6H3, J 8.0, 1.7), 7.08 д (1H, CH=CH, J 16.3), 7.18 д
8.71 м (2H, H2,6, C6H4). Спектр ЯМР 13C, δ, м.д.:
(1H, CH=CH, J 16.3), 7.18 д (1H, H4, C6H3, J 1.7),
109.7, 125.9, 126.1, 126.9, 127.1, 127.8, 128.0, 128.1,
7.50-7.60 м (6H, H3,4,5, 2C6H5), 7.62-7.66 м (2H, H3,5,
128.2, 129.2, 130.1, 136.6, 136.7, 136.8, 138.9, 163.1,
C6H4), 8.27 с (1H, Hпиримидин), 8.38-8.43 м (4H, H2,6,
163.8. Найдено,
%: C
88.15; H
5.32; N
6.64.
2C6H5), 8.63-8.67 (2H, H2,6, C6H4). Спектр ЯМР 13C,
C30H22N2. Вычислено, %: C 87.77; H 5.40; N 6.82.
δ, м.д.: 100.5 (CH2), 105.1 (CH), 107.7 (CH), 109.6
(CH), 121.3 (CH), 125.7 (2CH), 126.0 (CH), 126.9 (4CH),
(E)-4,6-Дифенил-2-[4-(4-метоксистирил)фенил]-
128.1 (2CH), 128.2 (4CH), 128.9 (CH), 130.1 (2CH),
пиримидин (5b). Получен взаимодействием пири-
131.1, 136.3, 136.8, 139.1, 146.9, 147.6, 163.1, 163.8.
мидина 3a с (E)-N-(2-хлорфенил)-1-(4-метоксифе-
Найдено, %: C 81.78; H 4.75; N 6.31. C31H22N2O2.
нил)метанимином (4b). Выход 77.6%, т.пл. 234-
Вычислено, %: C 81.92; H 4.88; N 6.16
236°С, Rf 0.24. ИК спектр, ν, см-1: (C=C-C=N).
Спектр ЯМР 1H (ДМСО-d6-CCl4, 1:3), δ, м.д. (J,
(E)-2,4-Дифенил-6-(4-стирилфенил)пирими-
Гц): 3.83 с (3H, OCH3), 6.86-6.91 м (2H, H3,5,
дин (6a). Получен конденсацией пиримидина 3b с
C6H4MeO), 7.08 д (1H, CH=CH, J 16.3), 7.20 д (1H,
(E)-N,1-дифенилметанимином (4a). Выход 63.8%,
CH=CH, J 16.3), 7.48-7.60 м (8H, H2,6, C6H4MeO,
т.пл. 186-188°С, Rf 0.59. ИК спектр, ν, см-1: 1600,
H3,4,5, 2C6H5), 7.62-7.66 м (2H, H3,5, C6H4), 8.26 с
1589 (C=C-C=N). Спектр ЯМР 1H (ДМСО-d6-CCl4,
(1H, Hпиримидин), 8.38-8.42 м (4H, H2,6, 2C6H5), 8.63-
1:3), δ, м.д. (J, Гц): 7.24 д (1H) и 7.29 д (1H, CH=CH,
8.67 м (2H, H2,6, C6H4). Спектр ЯМР 13C, δ, м.д.:
J 16.0), 7.22-7.27 м (1Наром), 7.32-7.39 м (2Наром),
54.5 (OCH3), 109.6 (C5Hпиримидин), 113.6 (2CH, C3,5,
7.48-7.60 м (8Наром), 7.70-7.75 м (2Наром), 8.30 с (1H,
C6H4MeO), 125.5 (CH), 125.6 (2CH), 126.9 (4CH),
Hпиримидин), 8.39-8.44 м (4Наром), 8.66-8.71 м (2Наром).
127.4 (2CH), 128.1 (2CH), 128.2 (4CH), 128.8 (CH),
Спектр ЯМР 13C, δ, м.д.: 109.6, 126.2, 126.3, 126.9,
129.3, 130.1 (2CH), 136.2, 136.8, 139.3, 158.9, 163.1,
127.2, 127.3, 127.4, 127.7, 127.8, 128.06, 128.14,
163.8. Найдено,
%: C
84.35; H
5.63; N
6.44.
129.6, 129.9, 130.1, 135.7, 136.5, 136.8, 137.6, 139.2,
C31H24N2О. Вычислено, %: C 84.52; H 5.49; N 6.36.
163.28, 163.32, 163.8. Найдено, %: C 87.62; H 5.27;
N 6.93. C30H22N2. Вычислено, %: C 87.77; H 5.40; N
(E)-4,6-Дифенил-2-[4-(4-изопропилстирил)фе-
6.82.
нил]пиримидин (5c). Получен взаимодействием
пиримидина 3a с (E)-N-(2-хлорфенил)-1-(4-изопро-
(E)-2,6-Дифенил-4-[4-(4-метоксистирил)фенил]-
пилфенил)метанимином (4e). Выход 72.2%, т.пл.
пиримидин (6b). Получен конденсацией пирими-
172-174°С, Rf 0.52. ИК спектр, ν, см-1: 1583, 1574
дина 3b с (E)-N-(2-хлорфенил)-1-(4-метоксифенил)-
(C=C-C=N). Спектр ЯМР 1H (ДМСО-d6-CCl4, 1:3),
метанимином (4b). Выход 78.5%, т.пл. 162-164°С,
δ, м.д. (J, Гц): 1.29 д (6H, Me2), 2.92 септет (1H,
Rf 0.42. ИК спектр, ν, см-1: 1601, 1590 (C=C-C=N).
CHMe2, J 6.9), 7.18 д (1H, CH=CH, J 16.3), 7.18-
Спектр ЯМР 1H (ДМСО-d6-CCl4, 1:3), δ, м.д. (J,
7.22 м (2H, H3,5, C6H4C3H7), 7.23 д (1H, CH=CH, J
Гц): 3.83 с (3H, CH3), 6.87-.92 м (2H, H3',5', C6H4MeO),
16.3), 7.46-7.51 м (2H, H2,6, C6H4C3H7), 7.52-7.60 м
7.08 д (2H, CH=СН, J 16.3), 7.24 д (2H, CH=СН, J
(8Наром), 7.64-7.68 м (2Н, H3,5, C6H4), 8.26 с (1H,
16.3), 7.45-7.60 м (8Наром), 7.66-7.71 м (2Наром), 8.30
Hпиримидин), 8.38-8.43 м (4H, H2,6, 2C6H5), 8.64-8.68
с (1H, Hпиримидин), 8.38-8.43 м (4Наром), 8.66-8.71 м
м (2H, H2,6, C6H4). Спектр ЯМР 13C, δ, м.д.: 23.5 (Me2),
(2Наром). Спектр ЯМР 13C, δ, м.д.: 54.5 (OCH3),
33.2 (CH), 109.6, 125.8, 126.0, 126.2, 126.8, 126.9
109.5 (CH), 113.6 (2CH), 125.1 (CH), 126.0 (2CH),
(4CH), 128.1, 128.2 (4CH), 129.1, 130.1, 134.2, 136.5,
126.9 (2CH), 127.1 (2CH), 127.4 (2CH), 127.7 (2CH),
136.8, 139.1, 147.6, 163.1, 163.8. Найдено, %: C
127.8 (2CH), 128.1 (2CH), 129.1, 129.3 (CH), 129.8
87.73; H 6.17; N 6.37. C33H28N2. Вычислено, %: C
(CH), 130.0 (CH), 135.1, 136.8, 137.6, 139.7, 159.0,
87.57; H 6.24; N 6.19.
163.2, 163.4, 163.7. Найдено, %: C 84.67; H 5.33; N
6.52. C31H24N2О. Вычислено, %: C 84.52; H 5.49; N
(E)-2-{4-[2-(Бензо[d][1,3]диоксол-5-ил)винил]-
6.36.
фенил}-4,6-дифенилпиримидин (5d). Получен кон-
денсацией пиримидина 3a с (E)-1-бензо[d][1,3]ди-
(E)-2,6-Дифенил-4-[4-(4-изопропилстирил)фе-
оксол-5-ил-N-(2-хлорфенил)метанимином
(4d).
нил]пиримидин (6c). Получен конденсацией пи-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
АНИЛ-СИНТЕЗ В КОНСТРУИРОВАНИИ ПУШ-ПУЛЬНЫХ СИСТЕМ
275
римидина 3b с (E)-N-(2-хлорфенил)-1-(4-изопро-
163.2, 163.3, 163.7. Найдено, %: C 84.80; H 6.06; N
пилфенил)метанимином (4c). Выход 73.0%, т.пл.
5.64. C34H30N2O. Вычислено, %: C 84.61; H 6.27; N
150-152°С, Rf 0.67. ИК спектр, ν, см-1: 1588 (C=C-
5.80.
C=N). Спектр ЯМР 1H (ДМСО-d6-CCl4, 1:3), δ, м.д.
(J, Гц): 1.28 д (6H, CH3, J 6.9), 2.91 септет (1H, CH,
ФОНДОВАЯ ПОДДЕРЖКА
J 6.9), 7.17 д (1H, CH=СН, J 16.4), 7.18-7.23 м
(2Hаром), 7.26 д (1H, CH=СН, J 16.4), 7.46-7.59 м
Работа выполнена в рамках гранта 18-Т-1D249
(8Наром), 7.69-7.73 м (2Hаром), 8.31 с (1H, Hпиримидин),
тематического финансирования Гос. Ком. Науки
8.40-8.44 м (4Наром), 8.67-8.71 м (2Наром). Спектр
Республики Армения и субсидии МОН РФ иссле-
ЯМР 13C, δ, м.д.: 23.6 (Ме2), 33.3 (CH), 109.6 (CH),
довательской деятельности Российско-Армянского
126.2
(2CH),
126.30
(2CH),
126.32
(2CH),
126.5
университета.
(CH), 127.0 (2CH), 127.3 (2CH), 127.8 (2CH), 127.9
(2CH), 128.3 (2CH), 129.6 (CH), 130.0 (CH), 130.2
КОНФЛИКТ ИНТЕРЕСОВ
(CH), 134.2, 135.5, 136.9, 137.7, 139.5, 147.9, 163.3,
163.4, 163.8. Найдено, %: C 87.40; H 6.35; N 6.07.
Авторы заявляют об отсутствии конфликта
интересов.
C33H28N2. Вычислено, %: C 87.57; H 6.24; N 6.19.
(E)-4-{4-[2-(Бензо[d][1,3]диоксол-5-ил)винил]-
СПИСОК ЛИТЕРАТУРЫ
фенил}-2,6-дифенилпиримидин (6d). Получен кон-
денсацией пиримидина 3b с (E)-1-бензо[d][1,3]ди-
1. Achelle S., Nooira I., Pfaffinger B., Ramondenc Y.,
оксол-5-ил-N-(2-хлорфенил)метанимином
(4d).
Ple N., Rodriquez-Lopez J. J. Org. Chem. 2009, 74,
Выход 60.4%, т.пл. 173-174°С, Rf 0.45. ИК спектр,
3711-3717. doi 10.1021/jo900107u
ν, см-1: 1589 (C=C-C=N). Спектр ЯМР 1H (ДМСО-
2. Svirpa V.M., Zhang W., Balia A.G., Tsodikov O.V.,
d6-CCl4, 1:3), δ, м.д. (J, Гц): 6.06 с (2H, CH2), 6.95 д
Nickell J.R., Gizard F., Yu T., Lee E.Y., Dwoskin L.P.,
(1H, H7', C6H3, J 8.0), 7.12 д.д (1H, H6', C6H3, J 8.0,
Watt D.S. J. Med. Chem. 2014, 57, 6083-6091. doi
10.1021/jm5004864
1.5), 7.25 д (1H, CH=СН, J 16.5), 7.35 д (1H, H4',
C6H3, J 1.5), 7.38 д (1H, CH=СН, J 16.5), 7.58-7.65 м
3. Dhanalakshmi P., Shanmugam S. RSC Adv. 2014, 4,
29493-29501. doi 10.1039/C4RA02891K
(6Наром), 7.77-7.81 м (2Hаром), 8.49-8.54 м (4Наром),
4. Арутюнян А.А. Автореф. дисс
докт. хим. наук.
8.55 с (1H, Hпиримидин), 8.64-8.69 м (2Наром). Спектр
Ереван. 2017.
ЯМР 13C, δ, м.д.: 101.1 (CH2), 105.4 (CH), 108.4
5. Hadad C., Achelle S., Garcia-Martinez J.C., Rodriguez-
(CH), 110.1 (CH), 122.1 (CH), 125.9 (CH), 126.6 (2CH),
Lopez J. J. Org. Chem. 2011, 76, 3837-3845. doi
127.3 (2CH), 127.7 (2CH), 128.0 (2CH), 128.6 (2CH),
10.1021/jo200204u
128.9 (2CH), 129.9 (CH), 130.8 (CH), 131.1 (CH),
6. Siegrist A.E. Helv. Chim. Acta. 1967, 50, 91, 906-957.
131.4, 135.1, 136.6, 137.5, 140.2, 147.3, 147.9, 163.3,
7. Burdeska K., Fuhrer H., Kabas G., Siegrist A. E. Helv.
163.7, 164.1. Найдено, %: C 82.15; H 4.65; N 5.98.
Chim. Acta. 1981, 64, 12, 113-152.
C31H22N2O2. Вычислено, %: C 81.92; H 4.88; N 6.16
8. Синтезы орг. преп. 1949, 1, 67.
(E)-2-(4-Изобутоксифенил)-4-(4-стирилфенил)-
9. Синтезы орг. преп. 1949, 1, 75.
6-фенилпиримидин (6e). Получен конденсацией
10. Порай-Кошиц Б.А., Познанская Э.М., Шевченко В.С.,
пиримидина 3c с (E)-N,1-дифенилметанимином (4a).
Павлова Л.А. ЖОХ. 1947, 17, 1774-1777.
Выход 64.7%, т.пл. 162-164°С, Rf 0.61. ИК спектр,
11. Verbitskiy E.V., Dinastiya E.M., Baranova A.A.,
ν, см-1: 1607 (C=C-C=N). Спектр ЯМР 1H (ДМСО-
Khokhlov K.O., Chuvashov R.D., Yakovleva Y.A.,
d6-CCl4, 1:3), δ, м.д. (J, Гц): 1.09 д (6H, 2CH3, J 6.7),
Makarova N.I., Vetrova E.V., Metelitsa A.V.,
2.14 м (1H, CH), 3.84 д (2H, CH2, J 6.4), 6.96-7.01 м
Slepukhin P.A., Rusinov G.L., Chupakhin O.N.,
(2H, C6H4O-i-Bu), 7.20-7.28 м (3Наром), 7.32-7.38 м
Charushin V.N. Dyes Pigm. 2018, 159, 35-44. doi
(2Наром), 7.50-7.60 м (5Наром), 7.69-7.74 м (2Наром),
10.1016/j.dyepig.2018.05.075
8.21 с (1H, Hпиримидин), 8.35-8.42 м (4Наром), 8.57-
12. Chem. Abstr. 1950, 44, 3933i.
8.62 м (2Наром). Спектр ЯМР 13C, δ, м.д.: 18.9 (Ме2),
13. Beilst. H. 9, 194.
27.7 (CH), 73.6 (OCH2), 108.8, 113.6 (2CH), 126.2
14. Beilst. H. 7, 490.
(2CH),
126.4
(2CH),
126.9
(2CH),
127.2
(2CH),
15. Vadagaonkar K.S., Kalmode H.P., Murugan K.M.,
127.3, 127.5, 128.1 (2CH), 128.2 (2CH), 128.3, 129.4
Chaskara A.C. Lett. Org. Chem. 2015, 12, 447-458. doi
(2CH), 129.6, 130.1, 135.9, 136.6, 137.0, 139.2, 160.8,
10.2174/1570178612666150425000023
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
276
АРУТЮНЯН и др.
Anil-Synthesis in the Design of Push-Pull Systems.
Synthesis of Substituted
2- and 4-(4-Arylstyrylphenyl)diphenylpyrimidines
A. A. Harutyunyana, b, *, H. A. Panosyanb, M. S. Safaryana, b,
G. K. Harutyunyanb, G. T. Gukasyana, and G. G. Danagulyana, b
a Russian-Armenian (Slavonic) University, 0051, Republic of Armenia, Yerevan, ul. Hovsep Emina 123
b Scientific Technological Center of Organic and Pharmaceutical Chemistry (STCOPHCH),
0014, Republic of Armenia, Yerevan, pr. Azatutyan 26
*e-mail: harutyunyan.arthur@yahoo.com
Received September 7, 2019; revised October 18, 2019; accepted December 2, 2019
The possibilities of anil-synthesis for the preparation of 2,4,6-triarylsubstituted pyrimidines with an extended
chain of delocalized π-bonds were studied. By the interaction of (E)-3-phenyl-1-(p-tolyl)prop-2-en-1-one or
chalcone with benzamidine, 4-methylbenzamidine or 4-isobutoxybenzamidine hydrochlorides in ethanol in the
presence of KOH, 2,4-diphenyl-6-(p-tolyl)pyrimidine, 4,6-diphenyl-2-(p-tolyl)pyrimidine and 2-(4-isobutoxy-
phenyl)-4-phenyl-6-(p-tolyl)pyrimidine were synthesized. By reacting the starting pyrimidines with (E)-N-
(phenyl- or 2-chlorophenyl)-1-arylmethanimines in DMF in the presence of a KOH/LiH mixture, (E)-4,6-
diphenyl-2-[(4-styryl)phenyl]pyrimidines and (E)-2,6-diphenyl-4-[4-(4-styryl)phenyl]pyrimidines were obtained.
Keywords: 2,4-diphenyl-6-(p-tolyl)pyrimidine, 4,6-diphenyl-2-(p-tolyl)pyrimidine, 2-(4-isobutoxyphenyl)-4-phenyl-
6-(p-tolyl)pyrimidine, (E)-3-phenyl-1-(p-tolyl)prop-2-en-1-one, chalcon, condensation, DMF/KOH/LiH, (E)-4,6-
diphenyl-2-[(4-styryl)phenyl]pyrimidine, (E)-2,6-diphenyl-4-[4-(4-styryl)phenyl]pyrimidine
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020