ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 2, с. 277-282
УДК 547.49 + 547.88 + 542.97
КАТАЛИТИЧЕСКОЕ ЦИКЛОТИОМЕТИЛИРОВАНИЕ
ДИАМИДОВ И ДИГИДРАЗИДОВ (ТИО)УГОЛЬНОЙ
КИСЛОТЫ С ПОМОЩЬЮ БИС(ДИМЕТИЛАМИНО)-
МЕТАНА, H2S И Na2S·9H2O
© 2020 г. Р. Р. Хайруллина*, Т. В. Тюмкина, Е. С. Мещерякова,
Л. Р. Якупова, А. Г. Ибрагимов
ФГБУН «Институт нефтехимии и катализа РАН»,
450075, Россия, Республика Башкортостан, г. Уфа, пр. Октября 141
*е-mail: reginessa@mail.ru
Поступила в редакцию 09 сентября 2019 г.
После доработки 05 декабря 2019 г.
Принята к публикации 05 декабря 2019 г.
Разработан эффективный способ получения N,S-гетероциклов с (тио)амидными фрагментами катали-
тической реакцией циклотиометилирования диамидов и дигидразидов (тио)угольной кислоты с
помощью бис(диметиламино)метана, H2S или Na2S·9H2O.
Ключевые слова: циклотиометилирование, тиомочевина, мочевина, тиокарбогидразид, карбогидразид,
бис(диметиламино)метан, сероводород, кристаллогидрат сульфида натрия, N,S-гетероциклы, катализ.
DOI: 10.31857/S0514749220020160
Реакция 1-фенилэтанона с формальдегидом и
разидов (тио)угольной кислоты с бис(диметил-
1,2-этандитиолом является одним из первых
амино)метаном и H2S, а также кристаллогидратом
примеров циклотиометилирования по C-H под-
Na2S·9H2O.
вижным атомам водорода и представляет собой
На примере циклотиометилирования тиомоче-
частный случай классической реакции аминоме-
вины с помощью H2S и бис(диметиламино)метана
тилирования по Манниху [1-3]. Каталитическое
(диамин) установили, что из числа испытанных
циклотиометилирование амидов и гидразидов
катализаторов на основе щелочных и редкоземе-
кислот с помощью CH2O или бис(диметиламино)
льных элементов наиболее эффективными
метана и H2S или бис-1,3-аминосульфидов позво-
являются Cs2CO3 (79%) и RbNO3 (80%). В условиях
лило осуществить синтез азот- и серасодержащих
[(тио)мочевина:диамин:H2S:RbNO3
=
10:20:20:2,
гетероциклов с ацильными или амидными фраг-
70°С, EtOH-CHCl3 = 2:1, 8 ч] реакция проходит с
ментами [4-7]. Атомы азота и серы в составе
селективным образованием
1,3,5-тиадиазинан-4-
молекул гетероциклов обуславливают высокую
тиона (1) и 1,3,5-тиадиазинан-4-она (2) с выходами
биологическую активность этих соединений.
80 и 69% соответственно (схема 1).
Гетеро(N,S)циклические соединения применяются
в медицине в качестве ингибиторов синтеза хитина
Мы предположили, что замена газообразного
(«Бупрофезин»), фунгицидных препаратов («Да-
H2S на Na2S·9H2O позволит упростить способ
зомет»), инсектицидных [8], противомикробных,
получения целевых гетероциклов. В условиях
антиокислительных [9] и аналептических агентов
[(тио)мочевина:диамин:Na2S·9H2O:RbNO3
=
[10].
10:20:10:2, 40°С, EtOH:H2O = 1:1, 8 ч] реакция
В продолжение работ [4-7] по синтезу N,S-
проходит с образованием 1,3,5-тиадиазинан-4-тиона
гетероциклов с (тио)амидными фрагментами в
(1) и 1,3,5-тиадиазинан-4-она (2) с выходами 92 и
данной работе рассмотрены реакции каталитичес-
69% соответственно. Без катализатора выход целе-
кого циклотиометилирования диамидов и дигид-
вых продуктов не превышает 20%.
277
278
ХАЙРУЛЛИНА и др.
Схема 1.
H2S
O(S)
S(O)
[Rb]
HN NH
+
Me2N NMe2
H2N
NH2
_Me2NH
Na2S. 9H2O
S
_NaOH
1 (2)
Реакция тиокарбогидразида с диамином и H2S
значения характерные для бициклических структур
при соотношении тиокарбогидразид:диамин:H2S:
[11]. Длины C3-N1 связей в мостиковом N-CН2-N
[kat] = 10:40:20:2, 70°С, EtOH-CHCl3 = 2:1, 8 ч
фрагменте составляют 1.4655(18) Å, что согла-
проходит с образованием
7-тиа-1,2,4,5-тетрааза-
суется с известными в литературе данными для С-
бицикло[3.3.1]нонан-3-тиона (3) с выходом 70% в
N связей на N-CН2-N участках [12-14]. На участке
присутствии 20 мол % RbNO3 и 65% в случае
N-C-S длины связей C5-N1 больше, а C5-S2 -
SmCl3·6H2O. Карбогидразид вступает в реакцию с
меньше в сравнении с длинами аналогичных связей
образованием 1,2,4,5-тетраазинан-3-она (4) с выхо-
в 1,3,5-тиадиазинановых производных [12-14]. Сумма
дом 90% (схема 2). В качестве минорных про-
углов при атоме азота N1 составляет 331.18°, что
дуктов в обоих случаях образуются соединения,
свидетельствует о пирамидальной конформации,
содержащие метиленсульфидные звенья, малораст-
тогда как атом N2 имеет плоскую конформацию
воримые в органических растворителях.
(сумма углов при атоме азота равна 352.04°). Связь
С=S имеет значение 1.7177(18) Å. Кристаллическая
При соотношении (тио)карбогидразид:диамин:
структура соединения 3 стабилизируется за счёт C-
Na2S·9H2O:RbNO3 = 10:40:20:2 (40°С, растворитель
H···S водородных связей.
EtOH, 8 ч) циклотиометилирование тиокарбогидра-
зида приводит к образованию бицикла 3 с выходом
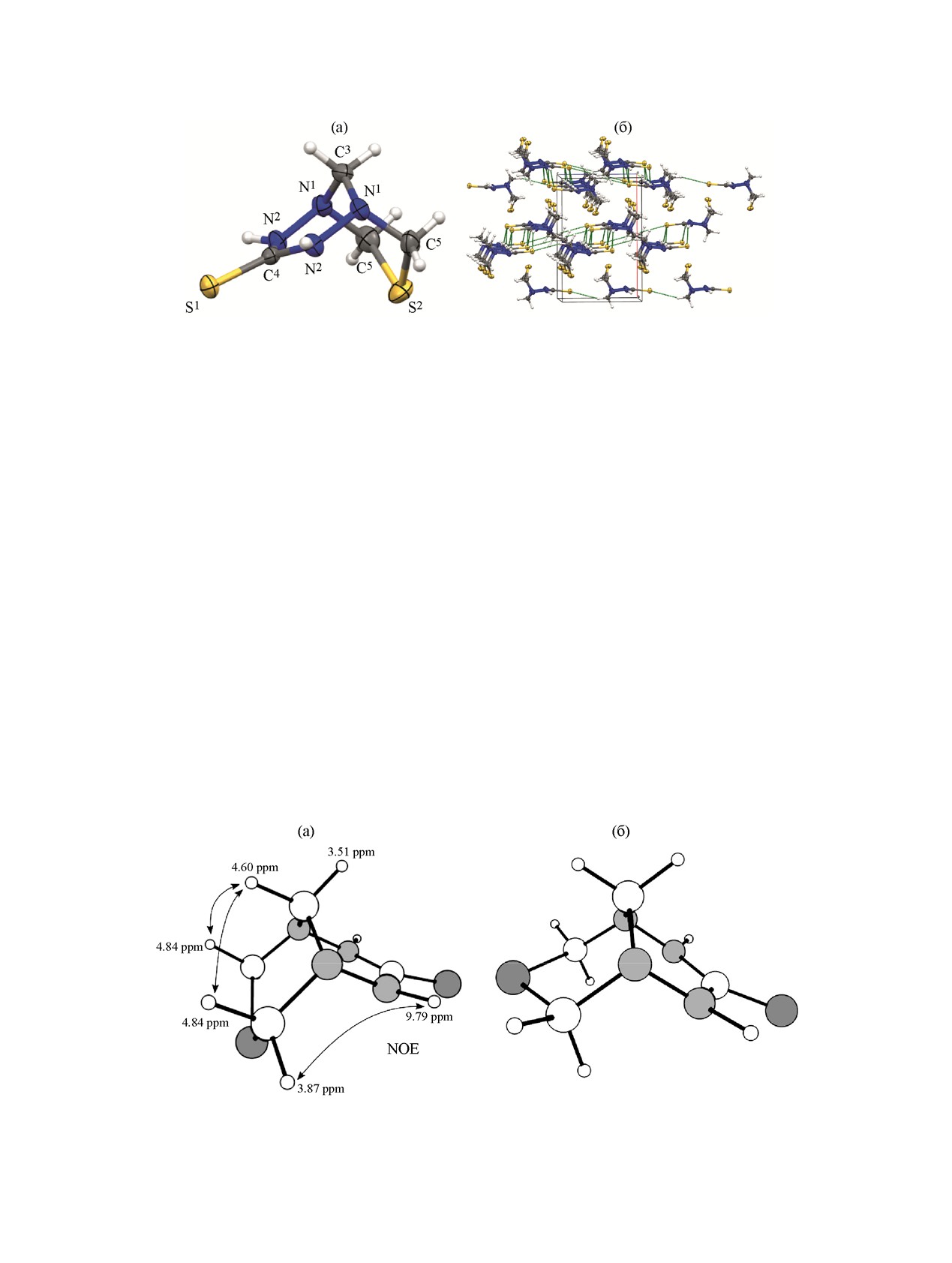
В растворе, по видимому, преобладает та же
85%, тогда как карбогидразид не вступает в
конформация бицикла, поскольку она соответст-
реакцию. Без катализатора реакция не проходит.
вует глобальному минимуму на поверхности
потенциальной энергии молекулы согласно полу-
Структуры соединений 1-4 подтверждены мето-
ченным расчетным данным (рис. 2а). Найденная
дами ЯМР, масс- и ИК спектрометрии. Для
стабильная конформация «софа-ванна» выше по
соединения 3 получены кристаллы из ДМСО-d6 и
энергии на
6.3 ккал/моль. Конформационная
проведено рентгеноструктурное исследование.
жесткость бицикла подтверждается наблюдаемой в
Бицикл 3 кристаллизуется в центросимметрич-
спектре ЯМР 1H значительной диастереотопностью
ной пространственной группе Pnma с Z
4, в
протонов метиленовых групп как мостикового N-
независимой части элементарной ячейки находится
CH2-N- (∆δ 1.8 м.д.), так и S-CH2-N- (∆δ 1.9 м.д.)
половина молекулы (Z' 0.5).
фрагментов. Стереохимические отнесения всех
7-Тиа-1,2,4,5-тетраазабицикло[3.3.1]нонан-3-
протонов выполнены по данным NOESY экспе-
тион (3) включает в себя 1,2,4,5-тетразинановый и
римента (рис.
2). Оказалось, что аксиальные
1,3,5-тиадиазинановый циклы, которые имеют кон-
протоны находятся в относительно более слабом
формацию
«софа» и
«кресло», соответственно
поле по сравнению с экваториальными в отличие
(рис. 1). Гидразиновые N1-N2 связи принимают
от шестичленных систем не бициклической струк-
Схема 2.
S
O
O(S)
HN NH
[kat]
Me2N
[kat]
HN
NH
H2N
NH2
+
+
H2S
N
N
_Me2NH
N
N
NMe2
_Me2NH
HN NH
H
H
S
4
3
[kat] = RbNO3, SmCl3 · 6H2O.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
КАТАЛИТИЧЕСКОЕ ЦИКЛОТИОМЕТИЛИРОВАНИЕ ДИАМИДОВ И ДИГИДРАЗИДОВ
279
Рис. 1. Структура молекулы и кристаллическая упаковка 7-тиа-1,2,4,5-тетраазабицикло[3.3.1]нонан-3-тиона 3 (тепловые
эллипсоиды представлены c 50% вероятностью).
туры, что свидетельствует о наличии стерео-
продуктам 1 (2) с выходом 75 и 70% соответст-
электронных эффектов в гетеробициклане.
венно, тогда как по направлению II реакция не
проходит (схема 3).
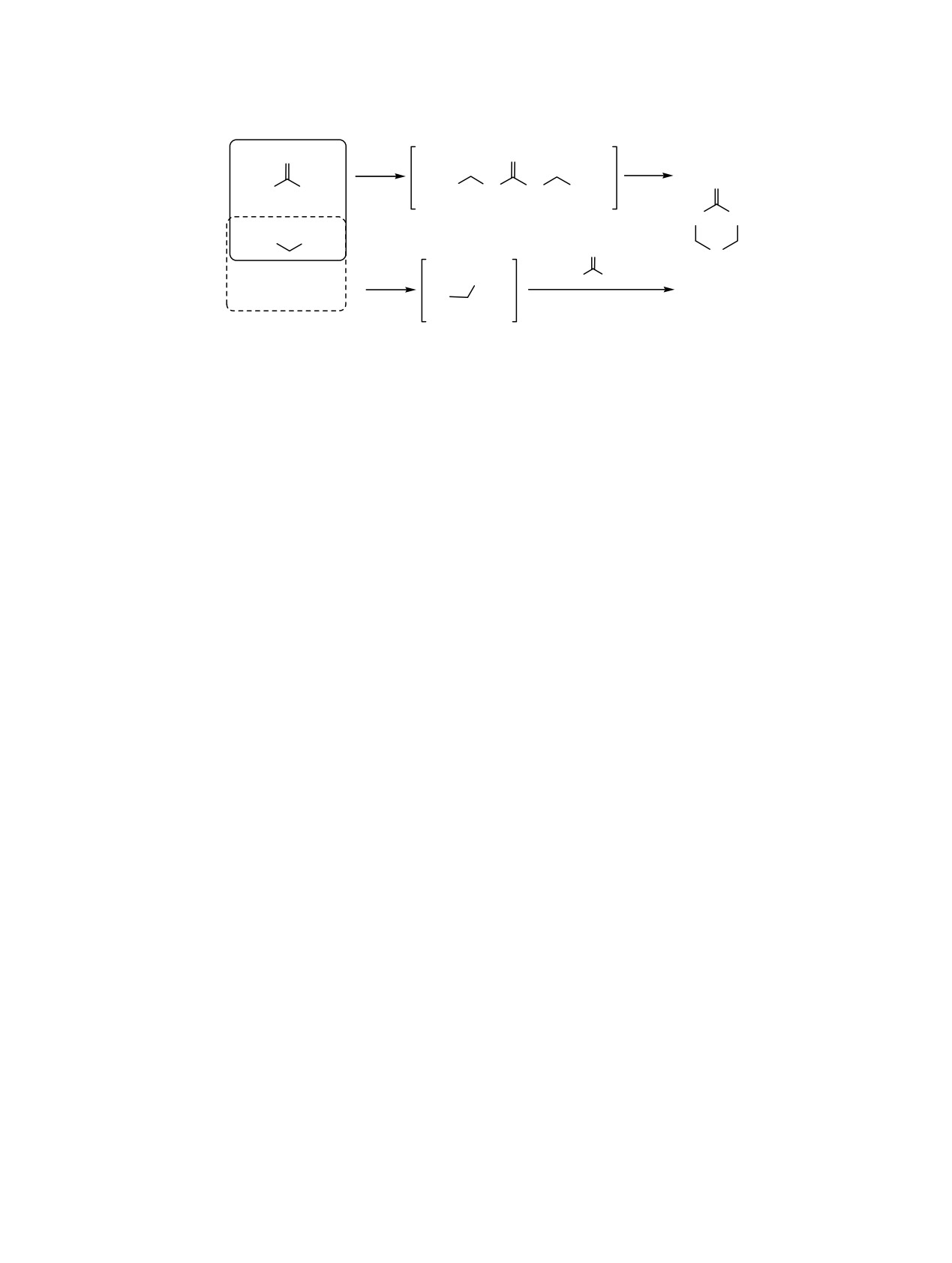
Мы предположили, что реакции циклотиоме-
тилирования (тио)мочевины с помощью H2S и
Вероятный механизм реакции циклотиомети-
диамина включает два возможных направления I и
лирования (тио)мочевины с помощью диамина и
II (схема 3). По направлению I в условиях катализа
H2S включает первоначальное образование 1,3-бис-
in situ формируется 1,3-бис(диметиламинометил)-
(диметиламинометил)(тио)мочевины [15], которые
(тио)мочевина 5 (6) [15], которая циклоаминоме-
координируются к иону центрального атома
тилирует H2S с образованием гетероциклов 1 (2).
катализатора
[16], последующее нуклеофильное
Направление II включает аминометилирование H2S
присоединение меркаптогруппы сероводорода к
с помощью диамина с получение (диметиламино)-
образовавшемуся карбокатиону приводит к фор-
метантиола
7, его реакция с (тио)мочевиной
мированию соответствующих связей S-C-N целе-
приводит к целевым продуктам 1 (2).
вых азот- и серасодержащих гетероциклов [2, 17].
Для проверки этого предположения мы провели
Таким образом, реакция каталитического цикло-
реакции предварительно полученных производных
тиометилирования диамидов и дигидразидов (тио)-
мочевины 5 (6) [15] с H2S, а также полученного in
угольной кислоты с помощью бис(диметиламино)-
situ 1,3-аминосульфида 7 с (тио)мочевиной в усло-
метана и H2S или Na2S·9H2O является эффек-
виях катализа. Экспериментально установили, что
тивным способом получения N,S-гетероциклов с
реакции по направлению I приводят к целевым
(тио)амидными фрагментами.
Рис. 2. Оптимизированные структуры конформеров 7-тиа-1,2,4,5-тетраазабицикло[3.3.1]нонан-3-тиона 3 и данные NOESY
эксперимента.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
280
ХАЙРУЛЛИНА и др.
Схема 3.
O(S)
O(S)
[M]
H2S
I
O(S)
H2N NH2
Me2N
N
N
NMe2
H
H
+
HN
NH
5 (6)
Me2N NMe2
O(S)
S
+
[M]
NMe2
H2N NH2
1 (2)
II
H2S
HS
7
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
водой и сушили, 3 и 4 экстрагировали хлоро-
формом, очищали колоночной хроматографией на
Одномерные (1Н, 13С), гомо- (COSY, NOESY) и
SiO2.
гетеро- (HSQC, HMBC) ядерные эксперименты
Исходные 1,3-бис[(диметиламино)метил]тиомо-
ЯМР проводили на спектрометре Bruker Avance
чевина (5) и 1,3-бис[(диметиламино)метил]моче-
400 (100.62 МГц для 13С и 400.13 МГц для 1Н) по
вина (6) были получены по методике, приведенной
стандартным методикам фирмы Bruker, раство-
в [15].
ритель - ДМСО-d6. Время перемешивания для экспе-
риментов NOESY составило 0.3 с. Масс спектры
Реакция
1,3-бис[(диметиламино)метил]тио-
соединений получены на приборе MALDI TOF/
мочевины (5) и 1,3-бис[(диметиламино)метил]-
TOF AUTOFLEX III фирмы Bruker. Пробоподго-
мочевины (6) с сероводородом. в. Аналогично
товка по методику
«сухая капля», в качестве
методу б в [7].
матрицы использовали синаповую кислоту. Затем
1,3,5-Тиадиазинан-4-тион (1). Выход 0.107 г
пробу с мишени переводили в газовую фазу с
(80%, метод a), 0.123 г (92%, метод б), 0.100 г
помощью лазерных импульсов (200 импульсов с
(75%, метод в), белый порошок, т.пл. 177-180°С
частотой 100 Гц). В качестве источника лазерного
(т.пл. 178-180°С, [6]).
излучения применяли твёрдотельный УФ лазер с
длиной волны излучения 355 нм. ИК спектры
1,3,5-Тиадиазинан-4-он
(2). Выход
0.081 г
снимали на спектрометре Bruker Vertex 70 v в
(69%, метод a), 0.083 г (69%, метод б), 0.083 г
суспензии в вазелиновом масле. Температуры
(70%, метод в), белый порошок, т.пл. 217-219°С
плавления определяли на приборе РНМК 80/2617.
(т.пл. 215-218°С, [6]).
Контроль реакции осуществляли методом ТСХ на
пластинах Sorbfil (ПТСХ-АФ-В), проявляли
7-Тиа-1,2,4,5-тетраазабицикло[3.3.1]нонан-3-
парами I2. Для колоночной хроматографии исполь-
тион (3). Выход 0.123 г (70%, метод a), 0.150 г
зовали силикагель КСК (100-200 мкм).
(85%, метод б), кристаллы кремового цвета, т.пл.
240-242°С. ИК спектр, ν, см-1: 3452, 3190, 2923-
Циклотиометилирование диамидов и дигидра-
2854, 1633, 1462, 1377, 1261, 1206, 1079, 994, 734-
зидов угольной кислоты с помощью диамина и
620. Спектр ЯМР 1Н, δ, м.д.: 3.51 и 4.60 д (2Н СH2,
H2S·или Na2S·9H2O (общая методика). В стеклян-
2J 13.0 Гц), 3.87 и 4.84 д (4Н, N-СH2-S, 2J 13.0 Гц),
ный реактор, снабженный магнитной мешалкой,
9.79 уш.с (2Н, НN). Спектр ЯМР 13C, δ, м.д.: 58.13
адаптером для ввода газа загружали диамин
(N-СH2-S), 66.43 (СH2), 177.84 (С=S). MALDI TOF,
(2.5 ммоль), диамид или гидразид угольной кисло-
m/z: 176.994 [М + H]+, 216.952 [М + Na + H2O]+.
ты (1 ммоль), EtOH (5 мл) и RbNO3 (0.2 ммоль) и
перемешивают в течение 1 часа при комнатной
Рентгеноструктурное исследование монокрис-
температуре
(~20°С). Затем барботированием
талла 3 проведено при комнатной температуре на
насыщали реакционную массу сероводородом при
автоматическом четырех кружном дифрактометре
постоянном перемешивании в течение 1 ч (метод а)
Agilent Xcalibur (Eos, Gemini) (графитовый моно-
или добавляли 20 ммоль Na2S·9H2O (метод б) и
хроматор, λMoKα излучение, ω-сканирование,
перемешивали 4 ч при температуре 60°С. Соеди-
2θмакс 62°) [18]. Кристаллы ромбические, прост-
нения 1, 2 отфильтровывали, промывали горячей
ранственная группа Pnma, a 12.4675(12), b 7.4080(7),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
КАТАЛИТИЧЕСКОЕ ЦИКЛОТИОМЕТИЛИРОВАНИЕ ДИАМИДОВ И ДИГИДРАЗИДОВ
281
c 8.0805(6) Å, α 90°, β 90°, с 90°, V = 746.30(11) Å3,
№ 2019-05-595-000-058 и Федерального агентства
C4H8N4S2, Z 4, Dрасч 1.569gcm-3, μ 0.640 cm-1. Всего
по науке и инновациям (грант Президента РФ
было собрано 2023 отражений, из которых 901
№ НШ-5240.2018.3).
являются независимыми (R-фактор усреднения
КОНФЛИКТ ИНТЕРЕСОВ
0.0315). Атомы водорода локализованы из раз-
ностного Фурье-синтеза и уточнены в изотропном
Авторы заявляют об отсутствии конфликта
приближении. Структура расшифрована прямым
интересов.
методом и уточнена методом наименьших квад-
ратов в полноматричном анизотропном прибли-
СПИСОК ЛИТЕРАТУРЫ
жении с использованием программ SHELXS и
1. Дронов В.И., Никитин Ю.Е. Усп. Хим. 1985, 54,
SHELXL [19, 20]. Окончательные значения фак-
941-955. [Dronov V.I., Nikitin Yu.E. Russ. Chem.
торов расходимости R1(F) 0.0315 и RW(F2) 0.0803,
Rev.
1985,
54,
554-561.] doi
10.1070/
GOF 1.114. Остаточная электронная плотность
RC1985v054n06ABEH003088
изразностного ряда Фурье после последнего цикла
2. Tramontini M., Angiolini L. Tetrahedron. 1990, 46,
уточнения
0.28 и
-0.37 е/Å3. Кристаллографи-
1791-1837. doi 10.1016/S0040-4020(01)89752-0
ческие данные структуры
3 депонированы в
3. Arend M., Westermann B., Risch N. Angew. Chem. Int.
Кембриджской базе кристаллоструктурных данных
Ed. 1998, 37, 1044-1070. doi 10.1002/(SICI)1521-3773
(19980504)37:8<1044::AID-ANIE1044>3.0.CO;2-E
Квантово-химические расчеты проводили с
4. Akhmetova V.R., Khabibullina G.R., Rakhimova E.B.,
использованием программы Gaussian
09W [21].
Vagapov R.V., Khairullina R.R., Niatshina Z.T.,
Murzakova N.N. Mol. Divers. 2010, 14, 463-471. doi
Оптимизацию геометрических параметров, реше-
10.1007/s11030-010-9248-3
ние колебательной задачи проводили на DFT-уров-
5. Ахметова В.Р., Хайруллина Р.Р., Тюмкина Т.В.,
не методом B3LYP/6-31(G(d,p)). Термодинамичес-
Нелюбина Ю.В., Смоляков А.Ф., Бушмаринов И.С.,
кие параметры и свободные энергии активации
Старикова З.А., Абдуллин М.Ф., Кунакова Р.В. Изв.
определяли при 298.15 К. Квантово-химические
АН. Сер. хим. 2010, 59, 416-424. [Akhmetova V.R.,
данные визуализировали с помощью программы
Khairullina R.R., Tyumkina T.V., Nelyubina Yu.V,
Chemcraft [22].
Smol’yakov A.F., Bushmarinov I.S., Starikova Z.A.,
Abdullin M.F., Kunakova R.V. Russ. Chem. Bull. 2010,
1,2,4,5-Тетраазинан-3-он
(4). Выход 0.092 г
59, 425-433.] doi 10.1007/s11172-010-0096-1
(90%, метод а), аморфный порошок, т.пл. 80-86°С.
6. Akhmetova V.R., Khairullina R.R., Bushmarinov I.S.,
ИК спектр, ν, см-1: 3328-3253, 2924-2854, 1651,
Tyumkina T.V., Janibin V.M. Arkivoc. 2011, viii, 149-
1537, 1462, 1367, 1176, 1022, 987, 745-734. Спектр
162. doi 10.3998/ark.5550190.0012.811
ЯМР 1Н, δ, м.д.: 4.30 уш.с (2Н, СH2), 4.74 и 7.95
7. Khairullina R.R., Geniyatova A.R., Tyumkina T.V.,
уш.с (4Н, НN). Спектр ЯМР 13C, δ, м.д.: 67.27 (СH2),
Karamzina D.S., Ibragimov A.G., Dzhemilev U.M.
162.85 (С=O). MALDI TOF, m/z: 140.053 [М + K -
Tetrahedron,
2017.
73,
7079-7084. doi
10.1016/
H]+, 159.073 [М + K + H2O]+.
j.tet.2017.10.068
(Диметиламино)метантиол (7) (in situ). Спектр
8. Maienfisch P., Huerlimann H., Rindlisbacher A.,
ЯМР 1Н (400.13 МГц, DMSO-d6): 2.25 уш.с (6Н, СH3),
Gsell L., Dettwiler H., Haettenschwiler J., Sieger E.,
Walti M. Pest. Manag. Sci. 2001, 57, 165-176. doi
4.04 уш.с (2Н, СH2). Спектр ЯМР 13C (100.62 МГц,
10.1002/1526-4998(200102)57:2<165::AID-
DMSO-d6): 42.51 (СH3), 65.96 (СH2).
PS289>3.0.CO;2-G
9. Siddiqui N.J., Barsagade A., Idrees M. Indo Am. J. P.
БЛАГОДАРНОСТИ
Sci. 2017, 4, 3655-3663. doi 10.5281/zenodo.1035798
Работа выполнена с использованием оборудо-
10. Bibik E.Yu., Saphonova A.A., Yeryomin A.V.,
вания Регионального центра коллективного поль-
Frolov K.A., Dotsenko V.V., Krivokolysko S.G. Res.
зования «Агидель».
Results Pharm. 2017, 3, 20-25. doi 10.18413/2313-
8971-2017-3-4-20-25
ФОНДОВАЯ ПОДДЕРЖКА
11. Neugebauer F.A., Krieger C., Siegel R., Kaftory M.
Chem. Ber.
1983,
116,
3461-3481. doi
10.1002/
Работа выполнена в рамках госзадания [№ AAAA-
cber.19831161019
A19-119022290010-9
(2019-2021)], а также при
12. Bushmarinov I.S., Fedyanin I.V., Lyssenko K.A.,
поддержке Минобрнауки России грант ФЦП
Lapteva V.L., Pisarev S.A., Palyulin V.A., Zefirov N.S.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
282
ХАЙРУЛЛИНА и др.
Antipin M.Yu. J. Phys. Chem. A. 2011, 115, 12738-
19. Sheldrick G.M. Acta Cryst. 2008, A64, 112-122. doi
12745. doi 10.1021/jp203730b
10.1107/S0108767307043930
13. Xotlanihua-Flores A., Montes-Tolentino P., Sanchez-
20. Sheldrick G.M. Acta Cryst.
2015, C71,
3-8. doi
Ruiz S.A., Suarez-Moreno G.V., Galvez-Ruiz J.C.,
10.1107/S2053229614024218
Contreras R., Flores-Parra A. J. Mol. Struct. 2016, 1106,
21. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
322-330. doi 10.1016/j.molstruc.2015.10.087
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
14. Akhmetova V.R., Nadyrgulova G.R., Niatshina Z.T.,
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
Khairullina R.R., Starikova Z.A., Borisova A.O.,
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
Antipin M.Yu., Kunakova R.V., Dzhemilev U.M.
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
Heterocycles. 2009, 78, 45-57. doi 10.3987/COM-08-
Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y.,
11432
Kitao O., Nakai H., Vreven T., Montgomery J.A., Jr.,
Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J.,
15. Хайруллина Р.Р., Гениятова А.Р., Ибрагимов А.Г.,
Brothers E., Kudin K.N., Staroverov V.N., Kobayashi R.,
Джемилев У.М. ЖОрХ.
2013,
49,
918-922.
Normand J., Raghavachari K., Rendell A., Burant J.C.,
[Khairullina R.R., Genijatova A.R., Ibragimov A.G.,
Iyengar S.S., Tomasi J., Cossi M., Rega N., Millam J.M.,
Dzhemilev U.M. Russ. J. Org. Chem. 2013, 49, 904-
Klene M., Knox J.E., Cross J.B., Bakken V., Adamo C.,
908.] doi 10.1134/S1070428013060171
Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O.,
16. Кукушкин Ю.Н. Реакционная способность коорди-
Austin A.J., Cammi R., Pomelli C., Ochterski J.W.,
национных соединений. Ленинград: Химия, 1987,
Martin R.L., Morokuma K., Zakrzewski V.G., Voth G.A.,
115.
Salvador P., Dannenberg J.J., Dapprich S., Daniels A.D.,
17. Kostyanovsky R.G., Voznesensky V.N., Kadorkina G.K.,
Farkas Ö., Foresman J.B., Ortiz J.V., Cioslowski J.,
El’natanov Yu.I. Org. Mass Spectrom. 1980, 15, 412-
Fox D.J. Gaussian 09, Revision D.01, Gaussian, Inc.,
418. doi 10.1002/oms.1210150804
Wallingford CT, 2009.
18. CrysAlis PRO, Agilent Technologies UK, Yarnton,
22. Zhurko G.A., Zhurko D.A. ChemCraft, version 1.6,
Oxfordshire, England, 2012.
2009.
Catalytic Cyclothiomethylation of Diamides and Dihydrazides
of (Thio)carbonic Acid Using Bis(dimethylamino)methane,
H2S, and Na2S·9H2O
R. R. Khairullina*, T. V. Tyumkina, Е. S. Meshcheryakova,
L. R. Yakupova, and А. G. Ibragimov
Institute of Petrochemistry and Catalysis, Russian Academy of Sciences,
450075, Russia, Republic of Bashkortostan, Ufa, pr. Oktyabrya141
*е-mail: reginessa@mail.ru
Received September 9, 2019; revised December 5, 2019; accepted December 5, 2019
An efficient method for the synthesis of N,S-heterocycles with (thio)amide fragments by the catalytic
cyclothiomethylation of diamides and dihydrazides(thio)carbonic acid with H2S or sodium sulfide
crystallohydrate and bis(dimethylamino)methane has been developed.
Keywords: cyclothiomethylation, thiourea, urea, thiocarbonohydrazide, carbonohydrazide, bis(dimethylamino)-
methane, hydrogen sulfide, sodium sulfide crystallohydrate, N,S-heterocycles, catalysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020