ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 2, с. 283-289
УДК 547.233; 547.79
СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ
НОВЫХ 4-МЕТОКСИФЕНИЛТЕТРАГИДРОПИРАН-
ЗАМЕЩЕННЫХ 1,3,4-ОКСАДИАЗОЛОВ
© 2020 г. A. A. Агекян*, Г. Г. Мкрян, Г. А. Паносян, А. С. Сафарян,
А. Г. Аракелян, Г. М. Степанян
Научно-технологический центр органической и фармацевтической химии НАН Республики Армения,
0014, Республика Армения, г. Ереван, пр. Азатутян 26
*е-mail: aaghekyan@mail.ru
Поступила в редакцию 12 сентября 2019 г.
После доработки 14 октября 2019 г.
Принята к публикации 02 декабря 2019 г.
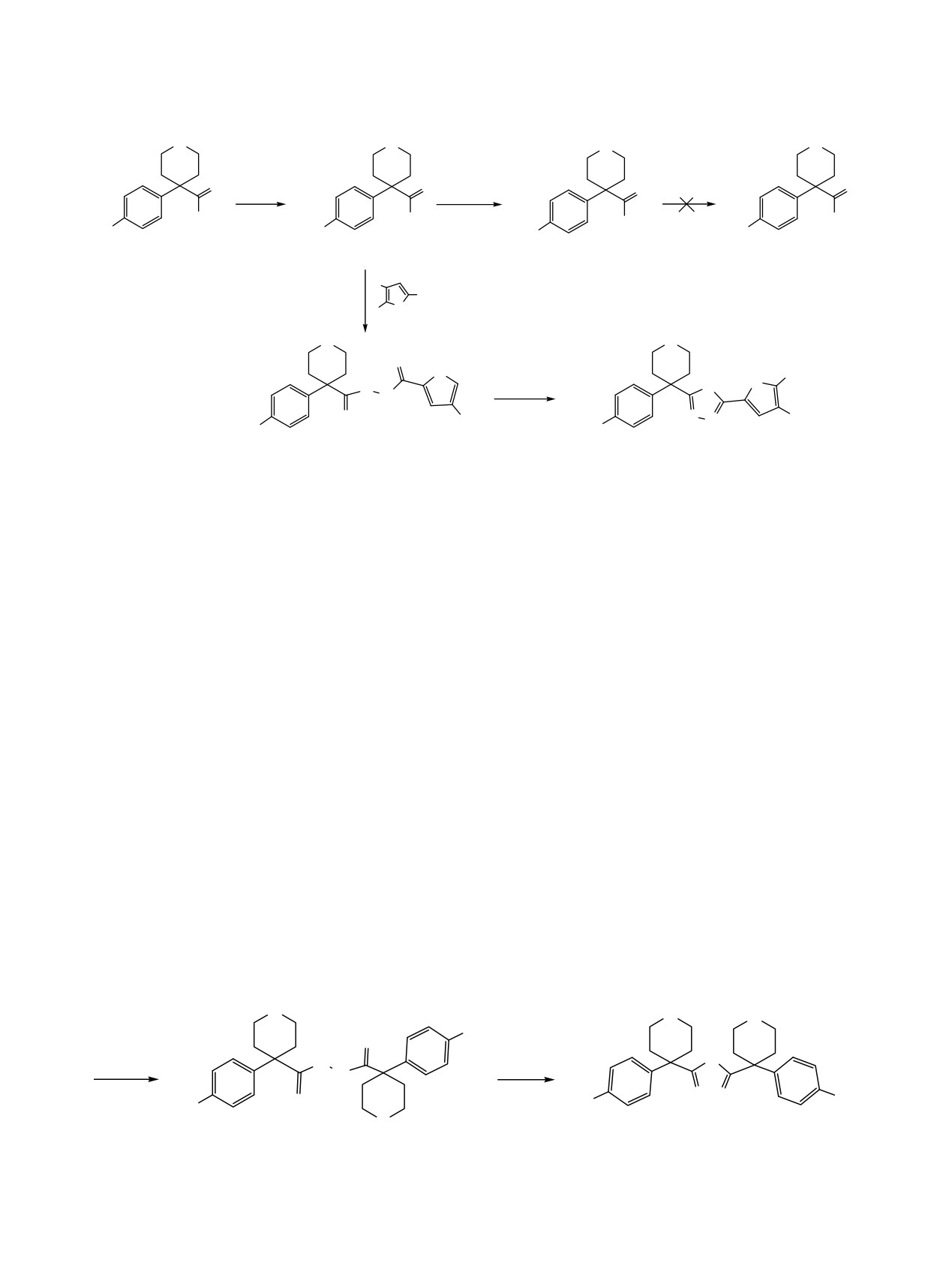
Конденсацией хлорангидрида 4-(4-метоксифенил)тетрагидро-2Н-пиранкарбоновой кислоты с гидразин
гидратом, а также гидразидами фуран- и 4,5-диметилфуранкарбоновых кислот получены дизамещенные
гидразиды, циклизацией которых выделены симметрично и несимметрично 2,5-дизамещенные 1,3,4-
оксадиазолы. Гидразид 4-[4-(4-метоксифенил)тетрагидро-2H-пиран-4-карбоксамидо]бензойной кислоты
действием ортоэфира муравьиной кислоты переведен в монозамещенный оксадиазол, а реакцией с
сероуглеродом - в 5-меркаптопроизводное, алкилированием которого получены S-замещенные произ-
водные.Изучены антибактериальные свойства синтезированных соединений.
Ключевые слова: фуран-2-карбоновая кислота, 4-(4-метоксифенил)тетрагидро-2Н-пиранкарбоновая кислота,
гидразин гидрат, 1,3,4-оксадиазол, 4-[4-(4-метоксифенил)тетрагидро-2H-пиран-4-карбоксамидо]бензойная
кислота.
DOI: 10.31857/S0514749220020172
Кольцо
1,3,4-оксадиaзола является важным
4-(4-метоксифенил)тетрагидро-2Н-пиранкарбоно-
структурным фрагментом многих биологически
вой и 4-[4-(4-метоксифенил)тетрагидро-2Н-пиран-
активных соединений, обладающих антибактериа-
4-карбоксамидо]бензойной кислот из соответст-
льными [1], противовоспалительными [2], противо-
вующих эфиров.
судорожными [3], противоoпухолевыми [4], анти-
В первом случае в качестве исходного соеди-
гипертензивными [5] и др. свойствами. Поэтому
интерес к подобным структурам остается в центре
нения использован нитрил
4-(4-метоксифенил)-
тетрагидро-2Н-пиранкарбоновой кислоты
[11].
внимания химиков-синтетиков [6, 7].
Исследования показали, что попытки получить
Соединения, содержащие арилтетрагидропира-
этиловый эфир указанной кислоты пропусканием
новый фрагмент, также обладают разнообразным
через спиртовый раствор соответствующего нитри-
спектром биологического действия: среди них
ла сухого хлористого водорода с последующим
обнаружены соединения, действующие на α- и β-
гидролизом образовавшегося иминоэфира, а также
адренорецепторы, а также проявляющие антимоно-
этанолизом самой кислоты в присутствии ката-
аминооксидазные, антибактериальные и антигиста-
лизатора (серная кислота) оказались безуспеш-
минные свойства [8-10].
ными. Из хлорангидрида 4-(4-метоксифенил)тетра-
Настоящая работа посвящена синтезу новых
гидро-2Н-пиранкарбоновой кислоты (1) реакцией с
соединений, в которых
1,3,4-оксадиазольное
этиловым спиртом в среде пиридина нами был
кольцо связано с арилтетрагидропирановым остат-
выделен с высоким выходом этиловый эфир 2.
ком как непосредственно, так и через амидо-
Однако получить гидразид соответствующей
бензольный фрагмент. Для решения поставленной
кислоты реакцией последнего как с гидразин
задачи необходимо было синтезировать гидразиды
гидратом, так и с 80% гидразином (в этаноле и
283
284
АГЕКЯН и др.
Схема 1.
O
O
O
O
O
O
O NH2NH
O
SOCl
2
C2H5OH
2
Py
OH
Cl
NHNH2
OC2H5
H3CO
H3CO
H3CO
H3CO
1
2
R
CONHNH2
O
R
3a, b
O
O
O
R
H
O R
O
N
POCl3
O
N
H
O
R
N N
R
H
H3CO
3CO
4a, b
5a, b
R = H (a), R = CH3 (b).
бутаноле) не удалось. Поэтому синтез оксади-
Для синтеза производных
1,3,4-оксадиазола,
азолов, в которых тетрагидропирановое кольцо
содержащих
4-(4-метоксифенил)-N-фенилтетра-
связано непосредственно с оксадиазольным циклом,
гидро-2Н-пиран-4-карбоксамидный остаток, в
осуществлен на основе гидразидов фуран- и 4,5-
качестве исходного соединения использован
диметилфуранкарбоновых кислот (3а, b), в свою
полученный нами ранее этиловый эфир 4-[4-(4-ме-
очередь полученных из их этиловых эфиров.
токсифенил)тетрагидро-2H-пиран-4-карбоксами-
Конденсацией хлорангидрида 1 с вышеуказанными
до]бензойной кислоты
(8)
[11]. Конденсацией
гидразидами выделены соответствующие дизаме-
последнего с гидразин гидратом выделен гидразид
щенные гидразиды
4а, b, циклизация которых
9, который реакцией с сероуглеродом переведен
хлорокисью фосфора приводит к целевым несим-
в 5-меркаптопроизводное 10. Полученный тиол
метричным 2,5-дизамещенным 1,3,4-оксадиазолам
10 использован в дальнейших синтезах, в част-
5а, b (схема 1).
ности, в реакциях алкилирования. Так, его кон-
денсацией с эфиром хлорметилфуранкарбоно-
С целью синтеза симметричного 2,5-дизаме-
вой кислоты получено соединение
11a, a
щенного oксадиазола, в котором тетрагидропирано-
реакцией с N-бензил-2-хлорацетамидом выделено
вые кольца непосредственно связаны с пятичлен-
соединение
11b. Реакцией же гидразида
9 с
ным гетроциклом, нами реакцией хлорангидрида 1
ортоэфиром муравьиной кислоты получен моно-
с гидразин гидратом получен дизамещенный гид-
замещенный
1,3,4-оксадиазол
12 с
4-(4-ме-
разид 6. Последний, подвергаясь внутримолекуляр-
токсифенил)-N-фенилтетрагидро-2Н-пиран-4-кар-
ной циклизации под действием хлорокиси фосфора,
боксамидным заместителем во втором положении
переходит в оксадиазол 7 с 83% выходом (схема 2).
(схема 3).
Схема 2.
O
O
O
OCH3
O
H
N
O
NH2NH2
POCl3
N
1
H
N N
OCH3
O
H3CO
H3CO
O
6
7
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ
285
Схема 3.
O
O
H
H
N
N
O
NH2NH
2
O
O
O
H3CO
OC2H5
H3CO
NHNH2
8
9
CS2
(C2H5O)3CH
O
O
H
H
N
N
O
O
SH
O
O
H3CO
N N
H3CO
N N
10
12
Cl
R
O
H
H
N
COOCH3 (a),
N
(b).
O SRR =
O
O
O
H
3CO
N N
11a, b
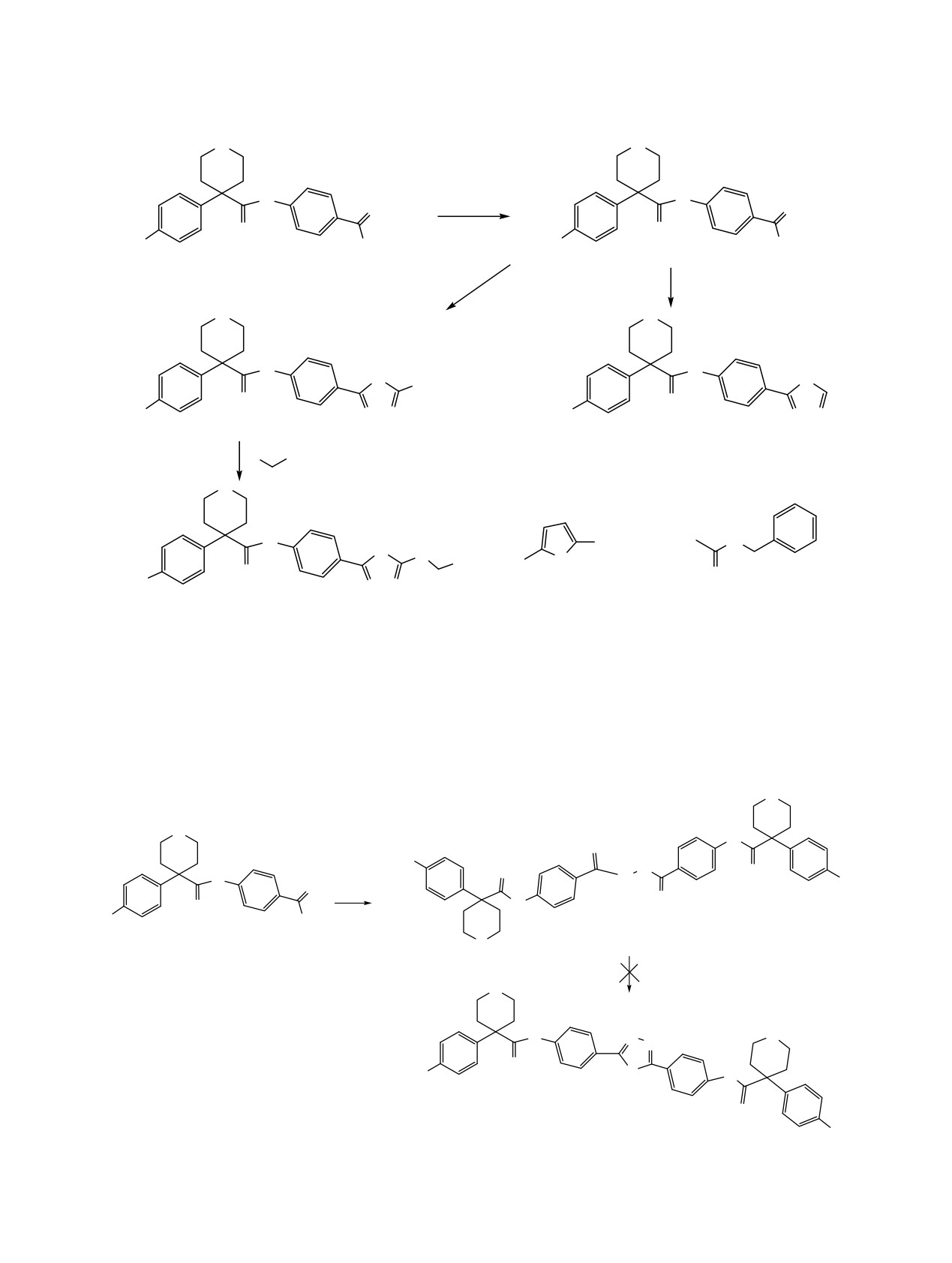
Попытка получить симметрично дизамещенный
гидро-2Н-пиран-4-карбоксамидо)бензойной кисло-
1,3,4-оксадиазол 15 с вышеприведенными замес-
ты 13 с гидразин гидратом, не увенчалась успехом,
тителями в положениях C2 и C5 из соответст-
так как в процессе циклизации в присутствии
вующего гидразида
14, полученного конденса-
хлорокиси фосфора происходит расщепление
цией хлорангидрида
4-(4-метоксифенил)тетра-
связей (схема 4).
Схема 4.
O
H
O
N
O
H3CO
H
H
O
N
O
N
N
OCH3
O
H O
O
N
H
H
COCl
3CO
13
O
14
POCl3
O
H
N
N
O
N
O
H
H3CO
O
N
O
15
OCH3
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
286
АГЕКЯН и др.
Строение и чистота всех синтезированных
ровали бензолом (2×30мл), промывали экстракт
соединений подтверждены физико-химическими
раствором соды, водой, сушили. Отгоняли раство-
методами и тонкослойной хроматографией.
ритель, остаток перекристаллизовывали из гексана.
Выход 1.8 г (70%), т.пл. 58-60°С, Rf 0.55 (бензол-
Антибактериальную активность полученных
эфир, 5:1). ИК спектр, ν, см-1: 1720 с (CO). Спектр
соединений изучали методом
«диффузии в
ЯМР 1Н, δ, м.д.: 1.18 т (3Н, СН3, J 7.1 Гц), 1.80-1.90
агаре» [13] при бактериальной нагрузке 20 млн
м (2Н) и 2.38-2.45 м (2Н, СН2), 3.42 д.д.д (2Н,
микробных тел на 1 мл среды. В опытах исполь-
ОСН2, J 11.8, 11.2, 2.2 Гц), 3.77 с (3Н, ОСН3), 3.77-
зовали грамположительные Staphylococcus aureus
3.84 м (2Н, ОСН2), 4.08 к (2Н, ОСН2СН3, J 7.1 Гц),
209 p, Bacilus subtilis и грамотрицательные палочки
6.79-6.84 м (2Н) и 7.19-7.25 м (2Н, С6Н4). Спектр
(Shigella flexneri
6858, E. coli
0-55). Растворы
ЯМР 13С, δ, м.д.: 13.6, 33.9; 47.0; 54.4; 59.8; 64.5;
соединений готовили в ДМСО в разведении 1:20.
113.3; 126.0; 134.0; 157.9; 172.8. Найдено, %: С
Исследования показали, что гидразид
4а и
68.34; Н 7.45. С15Н20О4. Вычислено, %: С 68.16; Н
меркаптооксадиазол
11 проявляют умеренную
7.63.
антибактериальную активность, подавляя рост всех
использованных микроорганизмов в зоне диамет-
[4-(4-Метоксифенил)тетрагидро-2Н-пиран]-
ром 15-16 мм. Остальные соединения обладают
N-(фуран-2-карбонил)-4-карбогидразид
(4a). К
слабой активностью (d 10-11 мм). Все соединения
раствору 0.5 г (4 ммоль) гидразида фуран-2-кар-
по активности существенно уступают контроль-
боновой кислоты (3а) и 0.4 г (4 ммоль) триэтил-
ному препарату фурадонину (d 23-26 мм) [14].
амина в 20 мл диоксана прибавляли раствор 1.0 г
(4 ммоль) хлорангидрида 1 в 10 мл диоксана и
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
кипятили 10 ч. Выливали реакционную смесь в
воду, отфильтровывали от взвесей и экстрагиро-
ИК спектры сняты на спектрометре Nicolet
вали 2 раза бензолом по 50 мл, сушили органи-
Avatar 330 FT-IR в вазелиновом масле, спектры
ческий слой сульфатом магния, отгоняли раство-
ЯМР 1Н - на Varian Mercury-300 в ДМСО-d6, рабо-
ритель, кристаллизовали эфиром и перекристалли-
чая частота 300 МГц, внутренний стандарт ТМС.
зовывали из толуола. Выход 0.8 г (59%), т.пл. 162-
Температуры плавления определены на микрона-
164°С, Rf 0.55 (бензол-ацетон, 2:1). ИК спектр, ν,
гревательном столике «Boёtius». ТСХ проведена на
см-1: 3308 с (NH), 1693 с и 1652 с (NCO). Спектр
пластинах Silufol UV-254, проявитель - пары йода.
ЯМР 1Н, δ, м.д.: 1.85 д.д.д (2Н, СН2, J 13.3, 11.0,
4.4 Гц), 2.57 уш.д (2Н, СН2, J 13.3 Гц), 3.64-3.80 м
4-(4-Mетоксифенил)тетрагидро-2Н-пиран-
[4Н, (СН2)2О], 3.78 с (3Н, ОСН3), 6.52 уш.с (1Н,
карбоновая кислота, этиловый эфир и хлор-
Нфур), 6.81-6.86 м (2Н, С6Н4), 7.16 уш.д (1Н, Нфур, J
ангидрид
4-[4-(4-метоксифенил)тетрагидро-2Н-
3.2 Гц), 7.32-7.37 м (2Н, С6Н4), 7.66 уш.с (1Н,
пиран-4-карбоксамидо]бензойной кислоты
Нфур), 9.52 уш.с (1Н, NН), 9.90 уш.с (1Н, NН).
получены по методике [11].
Найдено, %: С 62.59; Н 5.94; N 8.25. С18Н20N2О5.
Хлорангидрид
4-(4-метоксифенил)тетра-
Вычислено, %: С 62.78; Н 5.85; N 8.13.
гидро-2Н-пиран-4-карбоновой кислоты
(1).
[4-(4-Метоксифенил)тетрагидро-2Н-пиран]-
Смесь 14.2 г (0.06 моль) 4-(4-метоксифенил)тетра-
N-(4,5-диметилфуран-2-карбонил)-4-карбогид-
гидро-2Н-пиран-4-карбоновой кислоты и
9.0 г
разид (4b) получали аналогично из 1.0 г (4 ммоль)
(0.75 моль) хлористого тионила в 60 мл бензола
хлорангидрида 1 и 0.6 г (4 ммоль) гидразида 4,5-
кипятили 6 ч, отгоняли растворитель, добавляли
диметилфуран-2-карбоновой кислоты (3b). Выход
20 мл бензола, отгоняли бензол досуха и остаток
0.9 г (61%), т.пл. 168-170°С, Rf 0.52 (бензол-ацетон,
перегоняли в вакууме. Выход 12.3 г (80%), т.кип
2:1). ИК спектр, ν, см-1: 3310 с (NH), 1696 с и 1655
170-175°С при 2 мм рт.ст.
с (NCO). Спектр ЯМР 1Н, δ, м.д.: 1.84 д.д.д (2Н,
Этил 4-(4-метоксифенил)тетрагидро-2Н-пиран-
СН2, J 13.4, 10.6, 4.6 Гц), 1.99 с (3Н, СН3), 2.28 с
4-карбоксилат (2). К смеси 20 мл абс. этанола и
(3Н, СН3), 2.56 уш.д (2Н, СН2, J 13.4 Гц), 3.63-3.79
10 мл пиридина при охлаждении льдом прибавляли
м [4Н, (СН2)2О], 3.78 с (3Н, ОСН3), 6.81-6.86 м (2Н,
по каплям 2.5 г (0.01 моль) хлорангидрида 1 и
С6Н4), 6.90 уш.с (1Н, Нфур), 7.31-7.36 м (2Н, С6Н4),
оставляли на ночь при комнатной температуре.
9.47 уш.д (1Н, NН, J 1.5 Гц), 9.59 уш.с (1Н, NН).
Раствор выливали в ледяную воду и, охлаждая
Найдено, %: С 64.23; Н 6.70; N 7.67. С20Н24N2О5.
льдом и солью, подкисляли 10% HCl. Экстраги-
Вычислено, %: С 64.50; Н 6.50; N 7.52.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ
287
5-[4-(4-Метоксифенил)тетрагидро-2Н-пиран-
но, %: С 66.89; Н 6.72; N 5.81. С26Н32N2О6. Вычис-
4-ил]-2-(фуран-2-ил)-1,3,4-оксадиазол (5а). Раст-
лено, %: С 66.65; Н 6.88; N 5.98.
вор 0.7 г (2 ммоль) N,N'-диацилгидразина 4а и 6 мл
2,5-Бис[4-(4-метоксифенил)тетрагидро-2Н-
хлорокиси фосфора в 15 мл абс.толуола кипятили
пиран-4-ил]-1,3,4-оксадиазол
(7). Смесь
1.2 г
2 ч. По охлаждении смесь выливали в воду, экстра-
(2.6 ммоль) дигидразида 6 и 12 мл хлорокиси
гировали бензолом, органический слой промывали
фосфора в 20 мл толуола кипятили 2 ч. По охлаж-
водой, сушили сульфатом магния, отгоняли раство-
дении добавляли ледяную воду, образовавшиеся
ритель и остаток перекристаллизовывали из гексана.
кристаллы, нерастворимые ни в толуоле, ни в воде,
Выход 0.5 г (75%), т.пл. 90-91°С, Rf 0.52 (бензол-
отфильтровывали, промывали водой и перекрис-
ацетон, 5:1). Спектр ЯМР 1Н, δ, м.д.: 2.23 д.д.д (2Н,
таллизовывали из изопропилового спирта. Выход
СН2, J 13.7, 10.9, 4.2 Гц), 2.58-2.66 м (2Н, СН2),
0.96 г (83%), т.пл. 178-180°C, Rf 0.51 (бензол-
3.49-3.58 м (2Н, СН2О), 3.76 с (3Н, ОСН3), 3.84-
ацетон, 5:1). Спектр ЯМР 1Н, δ, м.д.: 2.14 уш.д.д.д
3.91 м (2Н, СН2О), 6.62 д.д (1Н, Нфур, J 3.5, 1.8 Гц),
(4Н, СН2, J 13.3, 11.4, 4.1 Гц), 2.44 уш.д (4Н, СН2, J
6.82-6.87 м (2Н, С6Н4), 7.13 д.д (1Н, Нфур, J 3.5,
13.3 Гц), 3.37 уш.т (4Н, ОСН2, J 11.4 Гц), 3.75 с
0.8 Гц), 7.22-7.27 м (2Н, С6Н4), 7.76 д.д (1Н, Нфур, J
(6Н, ОСН3), 3.81 уш.д.т (4Н, ОСН2, J 11.8, 4.0 Гц),
1.8, 0.8 Гц). Спектр ЯМР 13С, δ, м.д.: 34.5, 40.5,
6.75-6.80 м (4Н) и 7.03-7.08 м (4Н, С6Н4). Спектр
54.4, 63.7, 111.6, 113.4, 113.7, 126.2, 134.2, 138.7,
ЯМР 13С, δ, м.д.: 34.5, 40.8, 54.4, 63.7, 113.5, 125.9,
145.3, 156.8, 158.7, 167.7. Найдено, %: С 66.52; Н
134.7, 158.0, 168.6. Найдено, %: С 69.59; Н 6.60; N
5.43; N 8.44. С18Н18N2О4. Вычислено, %: С 66.25; Н
6.04. С26Н30N2О5. Вычислено, %: С 69.31; Н 6.71; N
5.56; N 8.58.
6.22.
2-(4,5-Диметилфуран-2-ил)-5-[4-(4-метокси-
фенил)тетрагидро-2Н-пиран-4-ил]-1,3,4-оксади-
N-[4-(Гидразинокарбонил)фенил]-4-(4-ме-
азол (5b) получали аналогично из 0.75 г (2 ммоль)
токсифенил)тетрагидро-2Н-пиран-4-карбокс-
N,N'-диацилгидразина 4b и 6 мл хлорокиси фосфора.
амид (9). Смесь 3.8 г (0.01 моль) амидоэфира 8 и
Выход
0.6 г
(84%), т.пл.
110-111°С, Rf
0.56
15 мл гидразин гидрата в 30 мл этилового спирта
(бензол-ацетон, 5:1). Спектр ЯМР 1Н, δ, м.д.: 2.01
кипятили
4 ч. По охлаждении образовавшиеся
уш.с (3Н, СН3), 2.21 д.д.д (2Н, СН2, J 13.8, 11.0,
кристаллы отфильтровывали, промывали водой,
перекристаллизовывали из спирта. Выход 2.8 г
4.3 Гц), 2.32 уш.с (3Н, СН3), 2.56-2.63 м (2Н, СН2),
3.52 д.д.д (2Н, ОСН2, J 11.9, 11.0, 2.0 Гц), 3.76 с
(77%), т.пл.
190-192°C, Rf
0.56 (метанол). ИК
(3Н, ОСН3), 3.83-3.91 м (2Н, СН2О), 6.81-6.86 м
спектр, ν, см-1: 3250-3300 с (NH, NH2), 1674 с и
1638 с (NCO). Спектр ЯМР 1Н, δ, м.д.: 1.89-2.01 м
(2Н, С6Н4), 6.90 уш.с (1Н, Нфур), 7.19-7.25 м (2Н,
С6Н4). Спектр ЯМР 13С, δ, м.д.: 9.1, 11.0, 34.5, 40.5,
(2Н) и 2.53-2.62 м (2Н, СН2), 3.52-3.62 м (2Н) и
54.4, 63.7, 113.7, 116.3, 116.6, 126.2, 134.4, 135.8,
3.72-3.81 м (2Н, ОСН2), 3.76 с (3Н, ОСН3), 4.17
уш.с (2Н, NН2), 6.82-6.87 м (2Н) и 7.29-7.35 м (2Н,
150.7, 156.9, 158.1, 167.2 Найдено, %: С 67.50; Н
6.41; N 8.03. С20Н22N2О4. Вычислено, %: С 67.78; Н
С6Н4О), 7.60-7.65 м (2Н) и 7.71-7.76 м (2Н, С6Н4N),
6.26; N 7.90.
9.05 с (1Н, NH), 9.48 уш.с (1Н, NН). Найдено, %: С
. Вычислено, %:
65.32; Н 6.14; N 11.23. С20Н23N3О4
N-[4-(4-Метоксифенил)тетрагидро-2Н-пиран-
С 65.03; Н 6.28; N 11.37.
4-карбонил]-[4-(4-метоксифенил)-тетрагидро-2Н-
пиран]-4-карбогидразид (6). Смесь 1.5 г (6 ммоль)
N-[4-(5-Меркапто-1,3,4-оксадиазол-2-ил)фе-
хлорангидрида 1 и 10 мл гидразин гидрата в 20 мл
нил]-4-(4-метоксифенил)тетрагидро-2Н-пиран-
спирта кипятили 2 ч. По охлаждении образовав-
4-карбоксамид (11). Смесь 1.5 г (4 ммоль) гидра-
шиеся кристаллы отфильтровывали, промывали
зида 9, 0.3 г (5 ммоль) едкого кали и 4 мл серо-
водой, сушили и перекристаллизовывали из изопро-
углерода в 5 мл абс. этанола нагревали 30 ч. Отго-
пилового спирта. Выход 1.2 г (85%), т.пл. 188-190°С,
няли растворитель, остаток растворяли в воде,
Rf 0.47 (бензол-ацетон, 2:1). ИК спектр, ν, см-1:
отфильтровывали, фильтрат подкисляли разб. HCl
3280 с (NH) и 1646 с (NCO). Спектр ЯМР 1Н, δ,
(1:1). Образовавшиеся кристаллы отфильтровыва-
м.д.: 1.74-1.87 м (4Н, СН2), 2.58 уш.д (4Н, СН2, J
ли и перекристаллизовывали из спирта. Выход
13.4 Гц), 3.67-3.78 м [8Н, (СН2)2О], 3.77 с (6Н,
1.1 г (66%), т.пл. 140-142°C, Rf 0.49 (бензол-
ОСН3), 6.80-6.85 м (4Н) и 7.31-7.36 м (4Н, С6Н4),
ацетон, 1:1). Спектр ЯМР 1Н, δ, м.д.: 1.90-2.01 м
9.24 с (2Н, NН). Спектр ЯМР 13С, δ, м.д.: 34,1, 46.4,
(2Н) и 2.53-2.62 м (2Н, СН2), 3.53-3.62 м (2Н) и
54.5, 64.3, 113.0, 126.7, 135.7, 157.7, 172.3. Найде-
3.72-3.81 м (2Н, ОСН2), 3.76 с (3Н, ОСН3), 6.82-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
288
АГЕКЯН и др.
6.87 м (2Н) и 7.29-7.35 м (2Н, С6Н4О), 7.75-7.85 м
Отгоняли растворитель, добавляли метиловый
(4Н, С6Н4N), 9.21 с (1Н, NН), 14.29 уш.с (1Н, SН).
спирт и отфильтровывали образовавшиеся крис-
Найдено, %: С 61.48; Н 5.38; N 10.35. С21Н21N3О4S.
таллы, перекристаллизовывали из спирта. Выход
Вычислено, %: С 61.30; Н 5.14; N 10.21.
0.8 г (70%), т.пл. 132-133°C, Rf 0.54 (бензол-ацетон,
1:1). Спектр ЯМР 1Н, δ, м.д.: 1.91-2.03 м (2Н) и
Метил
5-[(5-{4-[4-(4-метоксифенил)тетра-
2.53-2.63 м (2Н, СН2), 3.54-3.64 м (2Н) и 3.73-3.82
гидро-2Н-пиран-4-карбоксамидо]фенил}-1,3.4-
м (2Н, ОСН2), 3.77 с (3Н, ОСН3), 6.83-6.88 м (2Н) и
оксадиазол-2-илтио)метил]фуран-2-карбоксилат
7.30-7.36 м (2Н, С6Н4О), 7.82-7.93 м (4Н, С6Н4N),
(11a). К суспензии 0.5 г (1.2 ммоль) тиола 11 в
8.94 с (1Н, N=CH), 9.20 уш.с (1Н, NН). Найдено,%:
10 мл воды прибавляли 0.07 г (1.2 ммоль) едкого
С 66.71; Н 5.39; N 11.20. С21Н21N3О4. Вычислено,
кали. К раствору образовавшейся калиевой соли
%: С 66.48; Н 5.58; N 11.08.
прибавляли 0.21 г (1.2 ммоль) метилового эфира
хлорметилфуранкарбоновой кислоты и оставляли
N,N'-[Гидразиндикарбонилбис(4,1-фенилен)]-
на ночь при комнатной температуре. Образовав-
бис[4-(4-метоксифенил)тетрагидро-2Н-пиран-4-
шиеся кристаллы отфильтровывали, промывали
карбоксамид] (14). Смесь 0.5 г (1.2 ммоль) хлор-
водой, сушили и перекристаллизовывали из
ангидрида 13 и 5 мл гидразин гидрата в 10 мл
этанола. Выход 0.4 г (60%), т.пл. 130-132°C, Rf 0.55
спирта кипятили 4 ч. Образовавшиеся кристаллы
(бензол-ацетон, 2:1). Спектр ЯМР 1Н, δ, м.д.: 1.90-
отфильтровывали, промывали водой, эфиром и
2.02 м (2Н) и 2.53-2.63 м (2Н, СН2), 3.53-3.64 м
перекристаллизовывали из спирта. Выход 0.35 г
(2Н) и 3.74-3.82 м (2Н, ОСН2), 3.76 с (3Н, ОСН3),
(79%), т.пл. 256-258°C. Rf 0.53 (бензол-ацетон,
3.80 с (3Н, ОСН3), 4.62 с (2Н, SСН2), 6.59 д (1Н,
1:1). Спектр ЯМР 1Н, δ, м.д.: 1.91-2.02 м (4Н) и
Нфур, J 3.4 Гц), 6.82-6.87 м (2Н, С6Н4О), 7.08 д (1Н,
2.54-2.63 м (4Н, СН2), 3.53-3.63 м (4Н) и 3.73-3.82
Нфур, J 3.4 Гц), 7.30-7.35 м (2Н, С6Н4О), 7.83 с (4Н,
м (4Н, ОСН2), 3.77 с (6Н, ОСН3), 6.83-6.88 м (4Н) и
С6Н4N), 9.20 уш.с (1Н, NН). Найдено,%: С 61.37; Н
7.31-7.36 м (4Н, С6Н4О), 7.66-7.71 м (4Н) и 7.84-
4.78; N 7.52. С28Н27N3О7S. Вычислено, %: С 61.19;
7.89 м (4Н, С6Н4N), 9.13 уш.с (2Н, NН), 10.16 уш.с
Н 4.95; N 7.65.
(2Н, NН). Найдено, %: С 67.71; Н 5.69; N 7.81.
С40Н42N4О8. Вычислено, %: С 67.97; Н 5.99; N 7.93.
N-(4-{5-[2-(Бензиламино)-2-оксоэтилтио]-
1,3,4-оксадиазол-2-ил}фенил)-4-(4-метокси-
КОНФЛИКТ ИНТЕРЕСОВ
фенил)тетрагидро-2Н-пиран-4-карбоксамид
(11b). К 0.5 г (1.2 ммоль) тиола 11 в 10 мл абс.
Авторы заявляют об отсутствии конфликта
этанола прибавляли 0.07 г (1.2 ммоль) едкого кали
интересов.
в 3 мл абс.этанола. Нагревали 30 мин.при 30-40°С,
прибавляли 0.22 г (1.2 ммоль) N-бензил-2-хлор-
СПИСОК ЛИТЕРАТУРЫ
ацетамида и нагревали еще 4 ч при 45-50°С. Раст-
воритель отгоняли, к остатку прибавляли воду,
1. Sangshetti J.N., Chabukswar A.R., Shinde D.B. Bioorg.
образовавшийся осадок отфильтровывали, промы-
Med. Chem. Lett. 2011, 21, 444-448. doi 10.1016/
вали водой, ацетоном и перекристаллизовывали из
j.bmcl.2010.10.120
изопропилового спирта. Выход 0.4 г (59%), т.пл.
2. Husain A., Ahmad A., Alam M.M, Ajmal M., Ahuja P.
100-102°C, Rf 0.57 (бензол-ацетон, 2:1). Спектр
Eur. J. Med. Chem. 2009, 44, 3798-3804. doi 10.1016/
ЯМР 1Н, δ, м.д.: 1.89-2.02 м (2Н, СН2), 2.57 уш.д
j.ejmech.2009.04.009
(2Н, СН2, J 13.5 Гц), 3.52-3.63 м (2Н) и 3.73-3.81 м
3. Lankau H.-J., Unverferth K., Grunwald C., Hartenhauer H.,
(2Н, ОСН2), 3.76 с (3Н, ОСН3), 4.45 д (2Н, NСН2, J
Heinecke K., Bernoster K., Dost R., Egerland U.,
5.8 Гц), 4.64 с (2Н, SСН2), 6.83-6.88 м (2Н) и 7.29-
Rundfeldt C. Eur. J. Med .Chem. 2007, 42, 873-879.
doi 10.1016/j.ejmech.2006.12.022
7.34 м (2Н, С6Н4О), 7.25-7.30 м (5Н, С6Н5), 7.70-
7.75 м (4Н, С6Н4), 8.04 уш.т (1Н, NH, J 5.8 Гц), 9.20
4. Liu K., Lu X., Zhang H.J., Sun J., Zhu H.L. Eur. J.
Med. Chem.
2012,
47,
473-478. doi
10.1016/
с (1Н, NН). Найдено,%: С 64.24; Н 5.56; N 10.22.
j.ejmech.2011.11.015
С30Н30N4О5S. Вычислено, %: С 64.50; Н 5.41; N 10.03.
5. Bankar G.R., Nampurath G.K., Nayak P.G.,
N-[4-(1,3,4-Оксадиазол-2-ил)фенил]-4-(4-ме-
Bhattcharya S. Chem. Biol. Interact.
2010,
183,
токсифенил)-тетрагидро-2Н-пиран-4-карбокс-
327-331. doi 10.1016/j.cbi.2009.11.001
амид (12). Раствор 1.1 г (3 ммоль) гидразида 9 в 20 мл
6. Friggeri L., Hargrove T.Y., Wawrzak Z., Blobaum A.L.,
ортоэфира муравьиной кислоты кипятили 24 ч.
Rachakonda G., Lindsley C.W., Villalta F., Nes W.D.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ
289
Botta M., Guengerich F.P., Lepesheva G.I. J. Med.
10. Bernadelli P., Cronin A.M., Denis A., Denton S.M.,
Chem.
2018,
61,
5679-5691. doi
10.1021/
Jacobelli H., Kemp M.I., Lorthiois E., Rousseau F.,
acs.jmedchem.8b00641
Serradeil-Civit D., Vergne F. Пат. 15.3679 A1 (2005).
7. Vosátka R., Krátký М., Švarcová М., Janoušek J.,
Европ.
Stolaříková J., Madacki J., Huszár S., Mikušová K.,
11. Агекян А.А., Мкрян Г.Г. ЖОХ. 2015, 85, 760-764.
Korduláková J., Trejtnar F., Vinšová J. Eur. J.
[Aghekyan A.A., Mkryan G.G. Russ. J. Gen. Chem.
Med. Chem.
2018,
151,
824-835. doi
10.1016/
2015, 85, 1057-1062.] doi 10.1134/S1070363215050096
j.ejmech.2018.04.017
12. Амбарцумян Э.Н., Ворсканян А.С., Енгоян А.П.
8. Агекян А.А., Пирджанов Л.Ш, Маркарян Э.А. Хим.
Хим. ж. Арм. 2011, 64, 544-550.
ж. Арм. 2004, 57, 85-89.
13. Руководство по проведению доклинических иссле-
9. Агекян А.А., Мкрян Г.Г., Цатинян А.С., Норавян О.С.,
дований лекарственных средств. Ред. А.Н. Миронов.
Гаспарян Г.В. ЖОрХ. 2016, 52, 226-230. [Aghe-
М.: Гриф и Ко, 2012, 509-525.
kyan A.A., Mkryan G.G., Tsatinyan A.S., Noravyan O.S.,
Gasparyan G.V. Russ. J. Org. Chem. 2016, 52, 209-
14. Машковский М.Д. Лекарственные средства. М.:
213.] doi 10.1134/S1070428016020081
Новая волна, 2010, 850.
Synthesis and Antibacterial Activity of the New
Methoxyphenyltetrahydropyransubstituted
1,3,4-Oxadiazoles
А. А. Aghekyan*, G. G. Mkryan, H. A. Panosyan, A. S. Safaryan,
A. G. Arakelyan, and H. M. Stepanyan
The Scientific Technological Centre of Organic and Pharmaceutical Chemistry NAS RA,
0014, Republic of Armenia, Yerevan, ul. Azatutyana 26
*е-mail: aaghekyan@mail.ru
Received September 12, 2019; revised October 14, 2019; accepted December 2, 2019
By interaction of 4-(4-methoxyphenyl)tetrahydro-2H-pyran-4-carbonyl chloride with hydrazine hydrate, furan-2-
and
2,5-dimethylfuran-2carbohydrazides disubstituted hydrazides have been obtained. The latters were
transformed to the symmetric and non symmetric 2,5-disubstituted 1,3,4-oxadiazoles. By condensation of ethyl
4-[4-(4-methoxyphenyl)tetrahydro-2H-pyran-4-carboxamido]benzoate with hydrazine N-[4-(hydrazinecarbonyl)-
phenyl]-4-(4-methoxphenyl)tetrahydro-2H-pyran-4-carboxamide was obtained. The reaction of the latter with
ortho-formiate leads to monosubstituted 1,3,4-oxadiazole and with carbon disulphide - to 5-thiosubstituted
compound. By intereaction of above-mentioned 1,3,4-oxadiazole-5-thiol with substituted chlorides new S-
substituted oxadiazole derivatives have been obtained. The antibacterial activity of synthesized compounds was
investigated.
Keywords: furan-2-carboxylic acid, 4-(4-methoxyphenyl)tetrahydro-2H-pyran-4-carboxylic acid, hydrazine hydrate,
1,3,4-oxadiazole, 4-[4-(4-methoxyphenyl)tetrahydro2H-pyran-4-carboxamido]benzoic acid
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020