ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 2, с. 290-295
УДК 547-318 + 547-326 + 547-327
ПРОМОТИРУЕМЫЕ ПЕРВИЧНЫМИ АМИНАМИ
ДЕЦИКЛИЗАЦИОННЫЕ ПРЕВРАЩЕНИЯ
п-НИТРОБЕНЗИЛОВЫХ ЭФИРОВ КАРБАПЕНЕМОВ
© 2020 г. З. Р. Валиуллина*, А. М. Галеева, А. Н. Лобов, М. С. Мифтахов
ФГБУН «Уфимский Институт химии Уфимского федерального исследовательского центра РАН»,
450054, Россия, Республика Башкортостан, г. Уфа, пр. Октября 71
*e-mail: valiullina.zulya@mail.ru
Поступила в редакцию 07 октября 2019 г.
После доработки 17 января 2020 г.
Принята к публикации 20 января 2020 г.
Этиламин и этаноламин реагируют с
4-нитробензил-(4R,5S,6S)-3-[(2-фурилметил)тио]-6-[(1R)-1-
гидроксиэтил]-4-метил-7-оксо-1-азабицикло[3.2.0]гепт-2-ен-2-карбоксилатом, приводя к продуктам
дециклизации β-лактамного цикла с разрывом С7-N связи и одновременным переамидированием в
сложноэфирной части. В этом переходе анионоидной природы енамин-иминная перегруппировка с
последующим стереоселективным протонированием обеспечивают образование энантиомерно чистых
производных пирролидинов (2S,3R,4S)-N-этил-2-{(1S,2R)-1-[(этиламино)карбонил]-2-гидроксипропил}-
4-[(2-фурилметил)тио]-3-метил-3,4-дигидро-2H-пиррол-5-карбоксамида и (2S,3R,4S)-4-[(2-фурилметил)-
тио]-N-(2-гидроксиэтил)-2-((1S,2R)-2-гидрокси-{[(2-гидроксиэтил)амино]карбонил}пропил)-3-метил-3,4-
дигидро-2H-пиррол-5-карбоксамида.
Ключевые слова: синтез, карбапенем, этаноламин, этиламин, дециклизационные превращения, енамин-
иминная перегруппировка.
DOI: 10.31857/S0514749220020184
В ряду β-лактамных антибиотиков карбапенемы -
выступать присутствующие алкокси- и гидрокси-
признанные и широко используемые на практике
анионы, мы изучили реакцию модельного карба-
антибактериальные средства
[1]. Карбапенемы
пенема 3 [7] с водным EtNH2 и этаноламином,
получают путем химического синтеза [2]. Одна из
предполагая конкурентное с раскрытием лактама
«затратных» стадий в синтезе карбапенемов 1 - это
протекание реакции переамидирования в сложно-
стадия гидрогенолиза нитробензилового эфира 2 и
эфирной части с образованием вместо соединения 2
очистка кислоты 1. Выходы кислоты 1 на этой
соответствующих более стабильных этил- и этанол-
стадии, в основном, низкие и составляют ~20-30%
амидов, что может обеспечить более однозначные ре-
(схема 1) [3-6].
зультаты в последующих возможных превращениях.
Учитывая то, что при выделении и очистке кис-
Выдерживанием раствора 3 в ТГФ c 2 экв 70%
лоты
1 как возможные
«разрушители» могут
водного раствора EtNH2 при комнатной темпе-
Схема 1.
OH
OH
H H
H H
SR
H2, Pd/C
SR
N
MeOH
N
O
OPNB
O
COOH
O
2
1
PNB - п-нитробензил.
290
ПРОМОТИРУЕМЫЕ ПЕРВИЧНЫМИ АМИНАМИ ДЕЦИКЛИЗАЦИОННЫЕ ПРЕВРАЩЕНИЯ
291
Схема 2.
OH
H
HO
HO H
H H
HS
S
+
+
O
O
N
HN
O
O
C
O
COOPNB
NHEt
NHEt
NO2
NHEt
4 (48%)
5 (46%)
6 (47%)
EtNH2
ТГФ
OHH H
S
N
O
O
COOPNB
3
NH2CH2CH2OH
ТГФ
HO
HO
H H
H H
HS
S
+
+
6 (20%)
O
O
N
HN
O
O
NH
C
O
COOPNB
NH
HN
HO
HO
OH
7 (23%)
8 (65%)
ратуре в течение 12 ч были получены циклические
гичный путь распада принят и в случае образо-
имин 4, енамин 5 и п-нитробензиловый спирт 6.
вания соединения 7.
Аналогичная реакция эквимолярных количеств
Спектральные данные также подтверждают
карбапенема 3 и моноэтаноламина в ТГФ (20°С,
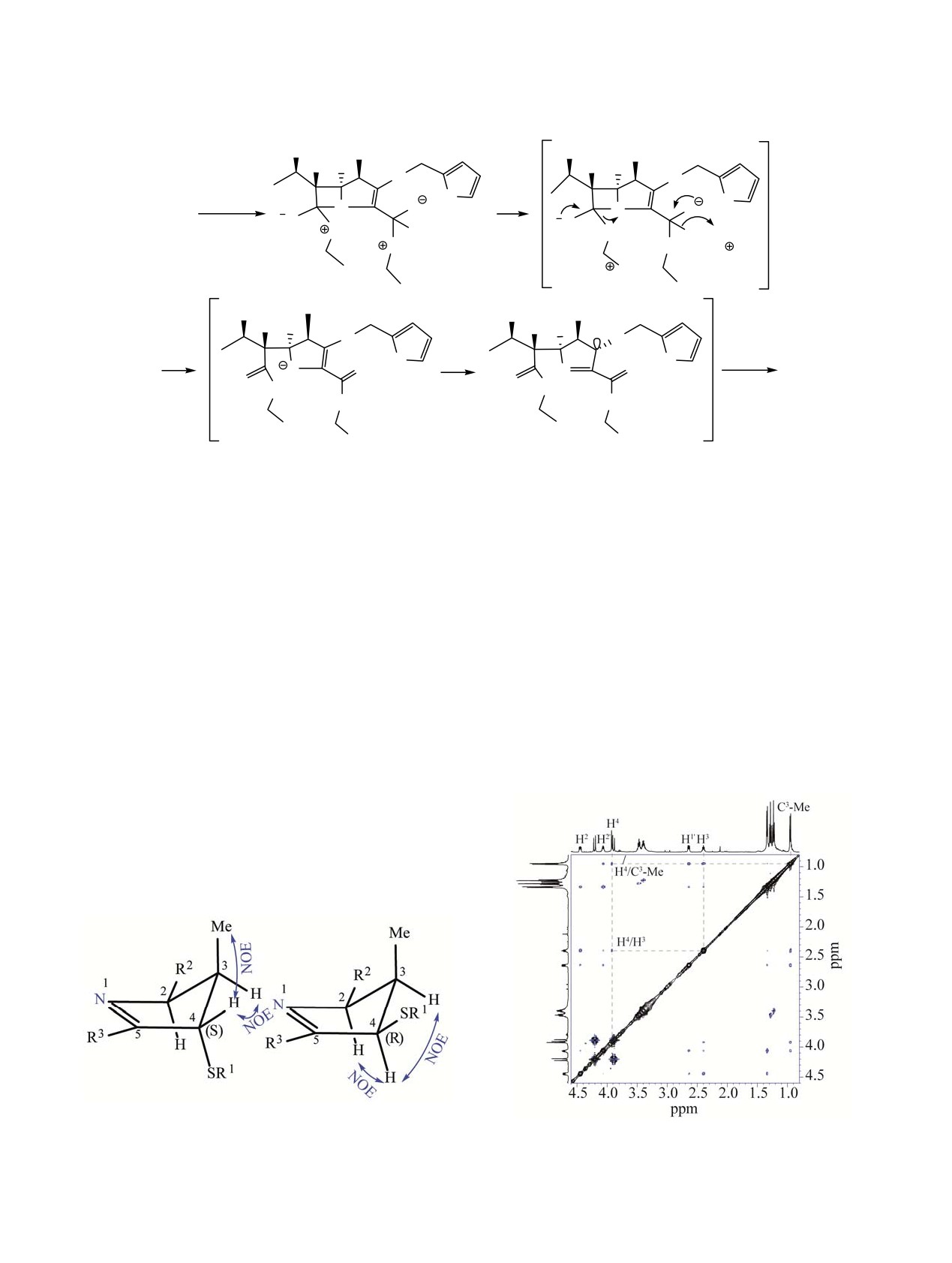
принятые отнесения в С4-центре. Оптимизация гео-
12 ч) протекала по сходной схеме, приводя к сое-
метрических параметров для имина 4 с (R)- и (S)-
динениям 7, 8 и 6 (схема 2).
конфигурацией вновь образующегося хирального
Как известно, раскрытие напряженного β-лак-
C4 центра в приближении B3LYP/6-311+G(d,p) по-
тамного кольца гидрокси- и амино-нуклеофилами
казала, что для 4(S)-диастереомера сближенными в
протекает через тетраэдрический интермедиат с
пространстве являются протоны Н4/H3 и Н4/C3-Ме,
последующим разрывом С7-N-связи
[8-10].
тогда как для 4(R)-диастереомера ожидаемы NOE-
Аналогичный вариант тетраэдрического интерме-
взаимодействия между H4/H2 и H4/H3 (рис. 1). В
диата должен реализовываться и в случае переами-
NOESY спектре соединения 4 (рис. 2) наблюдают-
дирования в активированной эфирной части карба-
ся NOE кросс-пики δH 3.92/2.40 м.д. и 3.92/0.95 м.д.,
пенема 3. Возможные пути образования имина 4
что согласно проведенным отнесениям соответст-
поясняет схема 3.
вует структуре с конфигурацией 4(S) центра. Кроме
того, установлено, что для
4(S)-диастереомера
Из схемы 3 видно, что образующийся после рас-
диэдральный угол H4-H3 близок к 90°, что находит
крытия лактамного цикла N-центрированный
отражение в спектре ЯМР 1H: сигнал H4 предс-
карбанион А перегруппировывается в заряженный
тавлен синглетом при δH 3.92 м.д., а в дублет-
циклический имин В, в котором неподеленная
квартетном сигнале H3 (δH 2.40 м.д., 3J3-2 5.7 Гц, 3J3-Ме
электронная пара пирамидального анионного
7.1 Гц) отсутствует расщепление на протоне H4.
центра направлена в β-область. Этим снимаются
стерические ограничения, ожидаемые при α-ориен-
На примере карбапенема 3 мы продемонст-
тации электронной пары, и в конце протони-
рировали 2 характеристичных направления распада
рование В EtNH+ приводит к имину 4. Анало-
карбапенемов при действии первичных аминов. На
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
292
ВАЛИУЛЛИНА и др.
Схема 3.
OH
OH
H H
H H
S
S
O
2 EtNH2
O
N
O
N
O
3
O
O
NH2
OPNB
NH
OPNB
NH
2
NH
EtNH3
EtNH3
OHH H
OHHH
S
S
_
+
O
O
EtNH3
N
O
O
4
N
O
NH
O NH
A
B
NH
NH
практике в опытах по выделению после гидро-
зации электрораспылением (ИЭР, ESI [electrospray
генолиза PNB-эфира 3 соответствующей кислоты 1
ionization]) были получены на ВЭЖХ-масс-
наблюдали образование смеси трудно идентифи-
спектрометре LCMS-2010EV (Shimadzu, Япония)
цируемых побочных соединений. Отметим, что
(шприцевой ввод, раствор образца в хлороформе/
соединения 4, 5 и 7, 8 представляют интерес как
ацетонитриле при расходе 0.1 мл/мин, элюент -
новые биологически активные структуры и
ацетонитрил-вода,
95:5) в режиме регистрации
потенциальные ингибиторы β-лактамаз [11].
положительных ионов при потенциале игольчатого
ионизирующего электрода
4.5 кВ. Температура
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
капилляра интерфейса
250°С, скорость потока
небулизирующего (распыляющего) газа (азот)
ИК спектры получены на спектрофотометре «IR
1.5 л/мин для ХИАД. Углы вращения измерены на
Prestige-21 Shimadzu» (Япония) в пленке или в
приборе
«Perkin-Elmer
341 M» (США). Эле-
вазелиновом масле. Спектры ЯМР
1Н и
13С
ментный анализ выполнен на CHNS-анализаторе
записаны на спектрометре
«Bruker AVANCE-
«Euro-EA
3000» (Италия). Ход реакции конт-
500» (Германия) [рабочие частоты 500.13 (1H) и
125.77 (13С) МГц] в CDCl3, (CD3)2CO. В спектре
ЯМР 13С за внутренний стандарт принято значение
сигналов CDCl3, (CD3)2CO (δС 77.00, 28.83 м.д.) в
спектре ЯМР 1H за внутренний стандарт принято
значение сигналов остаточных протонов в CDCl3,
(CD3)2CO (δН 7.27, 2.07 м.д.). Масс-спектры иони-
Рис. 1. Структуры 4(S)- и 4(R)-диастереомеров соеди-
нения 4.
Рис. 2. Спектр {1H, 1H} NOESY соединения 4 (4S).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
ПРОМОТИРУЕМЫЕ ПЕРВИЧНЫМИ АМИНАМИ ДЕЦИКЛИЗАЦИОННЫЕ ПРЕВРАЩЕНИЯ
293
ролировали методом ТСХ на пластинках
Енамин 5. Бесцветная маслообразная жидкость.
«Сорбфил» (Россия) с обнаружением веществ сма-
[α]
20 -44° (с 1.0, CH2Cl2). ИК спектр, ν, см-1: 3460,
чиванием пластинок раствором анисового альде-
3345, 2923, 1730, 1695, 1655, 1596, 1514, 1445, 1345,
гида и серной кислоты в этаноле с последующим
1225, 1115, 1045, 895. Спектр ЯМР 1Н (500 МГц,
нагреванием при 120-150°С. Продукты синтеза
ацетон-d6), δ, м.д.: 1.03 д (3H, CH3, J 6.8 Гц), 1.08
выделяли методом колоночной хроматографии на
т (3Н, CH3, J 7.2 Гц), 1.14 д (3Н, СH3, J 6.2 Гц),
силикагеле фирмы Macherey-Nayel (Германия) (30-
2.70 д.д (1Н, H1', J 10.2, 5.6 Гц), 3.12-3.32 м (3Н,
60 г адсорбента на 1 г вещества). Очистка раство-
H4, CH2N), 3.67 м (1Н, H5), 3.95 д (1Н, CH2S, J
рителей осуществлена по стандартным методикам
14.6 Гц), 3.97 м (1Н, H2'), 4.10 д (1Н, CH2S, J
[12].
14.6 Гц), 4.24 уш.с (1H, OH), 5.35 д (1Н, OCH2, J
13.7 Гц), 5.40 д (1Н, OCH2, J 13.7 Гц), 6.26 д
(2S,3R,4S)-N-Этил-2-{(1S,2R)-1-[(этиламино)-
(1Нфуран, J 2.9 Гц), 6.35 д.д (1Нфуран, J 2.9, 1.8 Гц),
карбонил]-2-гидроксипропил}-4-[(2-фурил-
7.20 уш.с (2Н, NH), 7.47 д (1Нфуран, J 0.8 Гц), 7.72
метил)тио]-3-метил-3,4-дигидро-2H-пиррол-5-
д (2Наром, J 8.7 Гц), 8.25 д (2Наром, J 8.7 Гц).
карбоксамид
(4)
и
4-нитробензил-(4R,5S)-5-
Спектр ЯМР 13С (125 МГц, ацетон-d6), δ, м.д.:
{(1R)-1-[(этиламино)карбонил]-2-метилпропил}-
11.10 (CH3), 14.29 (CH3), 19.78 (CH3), 28.36 (CH2S),
3-[(2-фурилметил)тио]-4-метил-4,5-дигидро-1Н-
33.57 (CH2N),
42.82 (C4),
53.40 (C1'),
61.19
пиррол-2-карбоксилат (5). К перемешиваемому
(C5), 64.67 (CH2O), 66.98 (C2'), 107.54 (CHфуран),
раствору 95 мг (0.21 ммоль) карбапенема 3 в 5 мл
110.52 (CHфуран),
123.44 (CHаром),
128.07 (C3),
ТГФ добавляли 37 мкл (0.46 ммоль) 70% водного
128.55 (СHаром),
134.94 (С2),
142.94 (CHфуран),
раствора EtNH2, массу перемешивали при комнат-
143.94 (Cаром),
147.66 (C-NO2),
151.75 (Cфуран),
ной температуре в течение 12 ч. Затем раств-
160.80 (СO2),
171.80 (CONH). Масс-спектр,
оритель упаривали, продукты очищали хроматог-
m/z (Iотн, %): 504 (100) [M + H]+. Найдено, %: C
рафированием на колонке с SiO2 (элюент CH2Cl2-
57.12; H 5.67; N 8.41; S 6.46. C24H29N3O7S. Вы-
CH3OH, 80:1→10:1). Выход 50 мг (48%) енамина 4,
числено, %: C 57.24; H 5.80; N 8.34; S 6.37.
38 мг (46%) имина 5 и 15 мг (47%) спирта 6.
(2S,3R,4S)-4-[(2-Фурилметил)тио]-N-(2-гид-
Имин 4. Светло-желтая маслообразная жид-
роксиэтил)-2-((1S,2R)-2-гидрокси-{[(2-гидрокси-
кость. [α]
20 -107° (с 1.0, CH2Cl2). ИК спектр, ν, см-1:
этил)амино]карбонил}пропил)-3-метил-3,4-ди-
3420, 3360, 2955, 1703, 1680, 1655, 1445, 1225,
гидро-2H-пиррол-5-карбоксамид (7) и 4-нитро-
1100, 1030. Спектр ЯМР 1Н (500 МГц, CDCl3), δ,
бензил-(4R,5S)-3-[(2-фурилметил)тио]-5-((2R)-2-
м.д.: 0.95 д (3H, C3-CH3, J 7.2 Гц), 1.23 т (3Н, CH3,
гидрокси-1-{[(2-гидроксиэтил)амино]карбонил}-
J 7.2 Гц), 1.28 т (3Н, СH3, J 7.3 Гц), 1.34 д (3Н, C2'-
пропил)-4-метил-4,5-дигидро-1H-пиррол-2-кар-
СH3, J 6.3 Гц), 2.40 д.к (1Н, H3, 3J3-2 5.7 Гц, 3J3-Ме
боксилат (8). Раствор 0.10 г (0.22 ммоль) карба-
7.1 Гц), 2.64 д.д (1Н, H1ʹ, 3J1'-2 9.8 Гц, 3J1'-2' 4.8 Гц),
пенема 3 и 0.14 мл (0.24 ммоль) этаноламина в 6 мл
3.30-3.50 м (4Н, CH2N), 3.89 д
(1Н, CH2S, 2J
безводного ТГФ перемешивали при комнатной
14.8 Гц), 3.92 с (1Н, H4), 4.05 д.к (1Н, H2ʹ, 3J2'-1'
температуре в течение 12 ч. После концентриро-
4.8 Гц, J2'-Ме 6.3 Гц), 4.20 д (1Н, CH2S, 2J 14.8 Гц),
вания реакционной смеси в вакууме остаток хро-
4.46 д.д
(1Н, H2, 3J2-1' 9.8, J2-3 5.7 Гц), 6.39 м
матографировали на колонке с SiO2 (CH2Cl2-
(2Нфуран), 6.58 т (1Н, NH, J 5.3 Гц), 7.10 т (1Н, NH, J
CH3OH, 80:1→10:1). Выход 74 мг (65%) енамина 8,
5.9 Гц), 7.45 с (1Нфуран). Спектр ЯМР 13С (125 МГц,
22 мг (23%) имина 7 и 6 мг (20%) спирта 6.
CDCl3), δ, м.д.: 14.61 (CH3), 11.64 (C3-CH3), 20.17
(C2'-CH3),
29.29 (CH2S),
34.22 (CH2N),
34.37
Имин 7. Бесцветная маслообразная жидкость.
(CH2N), 44.98 (C3), 51.63 (C1'), 55.01 (C4),
67.55
[α]
20 -105° (с 1.0, CH3OH). ИК спектр, ν, см-1: 3460,
(C2'), 71.29 (C2), 108.36 (CHфуран), 110.51 (CHфуран),
3350, 2985, 1700, 1675, 1655, 1439, 1221, 1110,
142.39 (CHфуран), 151.04 (Cфуран), 161.17 (С5-CONH),
1015. Спектр ЯМР 1Н (500 МГц, ацетон-d6), δ, м.д.:
170.43 (С5),
172.93 (СONH). Спектр ЯМР
15N
0.89 д (3H, CH3, J 7.2 Гц), 1.20 д (3Н, CH3, J 6.6 Гц),
(500 МГц, CDCl3), δ, м.д.: 114.45 (NH, С5-CONHEt),
2.50 д.к (1Н, H3, J 7.2, 5.5 Гц), 2.60 д.д (1Н, H1', J
124.59 (NH, С1''-CONHEt). Масс-спектр, m/z (Iотн,
9.7, 7.5 Гц), 3.30-3.70 м (8Н, 2CH2N, 2CH2OH), 3.84
%): 396 (100) [M + H]+. Найдено, %: C 57.59; H
с (1Н, Н4), 3.85 д (1Н, CH2S, J 14.7 Гц), 4.08 д.к (1Н,
7.52; N 10.48; S 8.25. C19H29N3O4S. Вычислено, %:
Н2', J 6.6, 7.5 Гц), 4.12 д (1Н, CH2S, J 14.7 Гц), 4.42
C 57.70; H 7.39; N 10.62; S 8.11.
д.д (1Н, Н2, J 9.7, 5.5 Гц), 6.35 с (2Нфуран), 7.35 уш.с
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
294
ВАЛИУЛЛИНА и др.
(1Н, NH), 7.45 с (1Нфуран), 8.00 уш.с (1Н, NH).
ФОНДОВАЯ ПОДДЕРЖКА
Спектр ЯМР 13С (125 МГц, ацетон-d6), δ, м.д.: 14.81
Работа выполнена при финансовой поддержке
(CH3), 21.07 (CH3), 28.44 (CH2S), 41.59 (CH2N),
Российского научного фонда (проект № 15-13-
41.94 (CH2N), 45.41 (C3), 53.31 (C1ʹ), 55.51 (C4),
00039-П).
60.66 и 60.83 (CH2OH), 67.70 (C2'), 73.50 (C2),
107.89 (CHфуран), 110.37 (CHфуран), 142.39 (CHфуран),
КОНФЛИКТ ИНТЕРЕСОВ
151.66 (Cфуран), 161.95 (CONH), 169.56 (C5), 173.57
(CONH). Масс-спектр, m/z (Iотн, %): 428 (100) [M +
Авторы заявляют об отсутствии конфликта
H]+. Найдено, %: C 53.47; H 6.72; N 9.69; S 7.62.
интересов.
C19H29N3O6S. Вычислено, %: C 53.38; H 6.84; N
9.83; S 7.50.
СПИСОК ЛИТЕРАТУРЫ
Енамин 8. Бесцветная маслообразная жидкость.
1. Papp-Wallace K.M., Endimiani A., Taracila M.A.,
[α]
20 -6о (с 1.0, CH2Cl2). ИК спектр, ν, см-1: 3455,
Bonomo R.A. Antimicrob. Agents Chemother. 2011,
3335, 2930, 1735, 1681, 1662, 1586, 1520, 1431, 1352,
55, 4943-4960. doi 10.1128/AAC.00296-11
1218, 1108, 1021, 887. Спектр ЯМР 1Н (500 МГц,
2. Kamath A., Ojima I. Tetrahedron. 2012, 68, 10640-
ацетон-d6), δ, м.д.: 1.05 д (3H, CH3, J 6.7 Гц), 1.16 д
10664. doi 10.1016/j.tet.2012.07.090
(3Н, C2'-CH3, J 6.3 Гц), 2.80 д.д (1Н, H1', J 9.8, 5.5 Гц),
3. Berks A.H. Tetrahedron.
1996,
52,
331-375. doi
3.24 д.к (1Н, H4, J 6.7, 7.9 Гц), 3.35 м (2Н, CH2N),
10.1016/0040-4020(95)00842-X
3.60 т (2Н, CH2OH, J 5.45 Гц), 3.67 д.д (1Н, H5, J
4. Kang Y.K., Shin K.J., Yoo K.H., Seo K.J., Hong C.Y.,
Lee C.-S., Park S.Y., Kim D.J., Park S.W. Bioorg. Med.
9.8, 7.9 Гц), 3.98 д (1Н, CH2S, J 14.6 Гц), 4.00 м (1Н,
Chem. Lett. 2000, 10, 95-99. doi 10.1016/S0960-894X
H2'), 4.12 д (1Н, CH2S, J 14.6 Гц), 5.34 д (1Н,
(99)00646-0
CH2OPh, J 13.8 Гц), 5.42 д (1Н, CH2OPh, J 13.8 Гц),
5. Sunagawa M., Matsumura H., Inoue T., Fukasawa M.,
6.28 д.д (1Нфуран, J 3.0, 0.9 Гц), 6.36 д.д (1Нфуран, J
Kato M. J. Antibiotics. 1990, 43, 519-532. doi 10.7164/
3.0, 1.8 Гц), 7.37 т (2Н, 2NH, J 5.7 Гц), 7.47 д.д.
antibiotics.43.519
(1Нфуран, J 1.8, 0.9 Гц), 7.74 д (2Наром, J 8.5 Гц), 8.25
6. Nagao Y., Iimori H., Nam K.H., Sano S., Shiro M. Chem.
д (2Наром, J 8.5 Гц). Спектр ЯМР 13С (125 МГц,
Pharm. Bull. 2001, 49, 1660-1661. doi 10.1248/cpb.49.1660
ацетон-d6), δ, м.д.: 11.96 (C4-CH3), 20.47 (C2'-CH3),
7. Валиуллина З.Р., Галеева А.М., Гималова Ф.А.,
29.84 (CH2S), 42.67 (CH2N), 43.62 (C4), 54.22 (C1'),
Селезнева Н.К., Хасанова Л.С., Мавзютов А.Р.,
61.83 (C5), 61.88 (CH2OH), 65.56 (OCH2Ph), 67.72
Мифтахов М.С. Биоорг. хим. 2019, 45, 412-418.
(C2'), 108.45 (CHфуран),
111.42 (CHфуран),
124.35
[Valiullina Z.R., Galeeva A.M., Gimalova F.A.,
(CHаром), 129.12 (C3), 129.44 (CHаром), 135.78 (C2),
Selezneva N.K., Khasanova L.S., Mavzyutov A.R.,
143.15 (CHфуран),
144.86 (Cаром),
148.56 (Cаром),
Miftakhov M.S. Russ. J. Bioorg. Chem. 2019, 45, 398-
152.65 (Cфуран),
161.67 (CО2),
173.46 (СONH).
404.] doi 10.1134/S0132342319040134
Масс-спектр, m/z (Iотн, %): 520 (100) [M + H]+.
8. Rao V.S., Fung-Tomc J.C., Desiderio J.V. J. Antibiotics.
Найдено, %: C 55.61; H 5.72; N 7.97; S 6.02.
1993, 46, 167-176. doi 10.7164/antibiotics.46.167
C24H29N3O8S. Вычислено, %: C 55.48; H 5.63; N
9. Hop C.A., Yu X., Xu X., Singh R., Wong B.K. J. Mass.
8.09; S 6.17.
Spectrom. 2001, 36, 575-579. doi 10.1002/jms.154
10. Rao V.S. Spectroscopy. 1991, 9, 93-96.
БЛАГОДАРНОСТИ
11. Liu X.-L., Xiang Y., Chen C., Yang K.-W. J. Antibiotics.
2019, 72, 118-121. doi 10.1038/s41429-018-0121-4
Анализы выполнены на оборудовании ЦКП
12. Гордон А., Форд Р. Спутник химика. М.: Мир, 1976.
«Химия» УфИХ РАН.
542.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
ПРОМОТИРУЕМЫЕ ПЕРВИЧНЫМИ АМИНАМИ ДЕЦИКЛИЗАЦИОННЫЕ ПРЕВРАЩЕНИЯ
295
Primary Amines Promoted Decyclization Transformations
of p-Nitrobenzyl Ethers of Carbapenems
Z. R. Valiullina*, А. М. Galeeva, А. N. Lobov, and М. S. Miftakhov
Ufa Institute of Chemistry UFRC RAS, 450054, Russia, Republic of Bashkortostan, Ufa, pr. Oktyabrya 71
*e-mail: valiullina.zulya@mail.ru
Received October 7, 2019; revised January 17, 2020; accepted January 20, 2020
Ethylamine and ethanolamine react with
4-nitrobenzyl
(4R,5S,6S)-3-[(2-furylmethyl)thio]-6-[(1R)-1-
hydroxyethyl]-4-methyl-7-oxo-1-azabicyclo[3.2.0]hept-2-en-2-carboxylate, leading to products of decylization
of the β-lactam cycle with cleavage of the C7-N bond and simultaneous amidation in the ester part. In this
transition of an anionoid nature, the enamine-imine rearrangement followed by stereoselective protonation
provides the formation of enantiomerically pure pyrrolidine derivatives (2S,3R,4S)-N-ethyl-2-{(1S,2R)-1-
[(ethylamino)carbonyl]-2-hydroxypropyl}-4-[(2-furylmethyl)thio]-3-methyl-3,4-dihydro-2H-pyrrole-5-carbox-
amide and
(2S,3R,4S)-4-[(2-furylmethyl)thio]-N-(2-hydroxyethyl)-2-[(1S,2R)-2-hydroxy-{[(2-hydroxyethyl)-
amino]carbonyl}propyl]-3-methyl-3,4-dihydro-2H-pyrrole-5-carboxamide.
Keywords: synthesis, carbapenem, ethanolamine, ethylamine, decyclization transformations, enamine-imine
rearrangement
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020