ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 2, с. 303-306
КРАТКИЕ СООБЩЕНИЯ
УДК 547.288.4 + 547.781
АЛКИЛЗАМЕЩЕННЫЕ
1,1'-ДИГИДРОКСИ-2,2'-БИСИМИДАЗОЛЫ:
РЕАКЦИИ С ИОДМЕТАНОМ И ТРИМЕТИЛФОСФИТОМ
© 2020 г. И. А. Оськина*, А. Я. Тихонов
ФГБУН «Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН»,
630090, Россия, г. Новосибирск, пр. Академика Лаврентьева 9
*е-mail: oi@nioch.nsc.ru
Поступила в редакцию 15 июля 2019 г.
После доработки 18 ноября 2019 г.
Принята к публикации 27 ноября 2019 г.
При алкилировании алкилзамещенных 1,1'-дигидрокси-2,2'-бисимидазолов иодметаном в эквимольном
соотношении образуются продукты алкилирования по атому азота имидазольного кольца, с трехкратным
избытком иодметана - продукты алкилирования как по атому азота имидазольного кольца, так и двум
гидроксигруппам. Реакция 1,1'-дигидрокси-2,2'-бисимидазолов с P(OMe)3 приводит к образованию
соответствующих 2,2'-бисимидазолов.
Ключевые слова: 1,1'-дигидрокси-2,2'-бисимидазолы, 2,2'-бисимидазолы, метилирование, восстановление.
DOI: 10.31857/S0514749220020214
2,2'-Бисимидазолы представляют интерес для
кислорода гидроксильной группы, как это можно
синтеза фоточувствительных макрогетероциклов
было ожидать [10], обусловлено, вероятно, большей
[1], новых краун-эфиров [2], люминесцентных [3] и
нуклеофильностью атома азота по сравнению с
биологически активных соединений [4], высоко-
атомом кислорода гидроксигруппы. Последнее
энергетических соединений
[5], при разработке
может быть связано с участием в этой реакции N-
методов синтеза органических проводников [6],
оксидной формы бисимидазола [9]. Нельзя иск-
диквартернизованных соединений [7].
лючить существование соединений 2a-c в N-оксид-
ной форме А или их таутомерное равновесие [8].
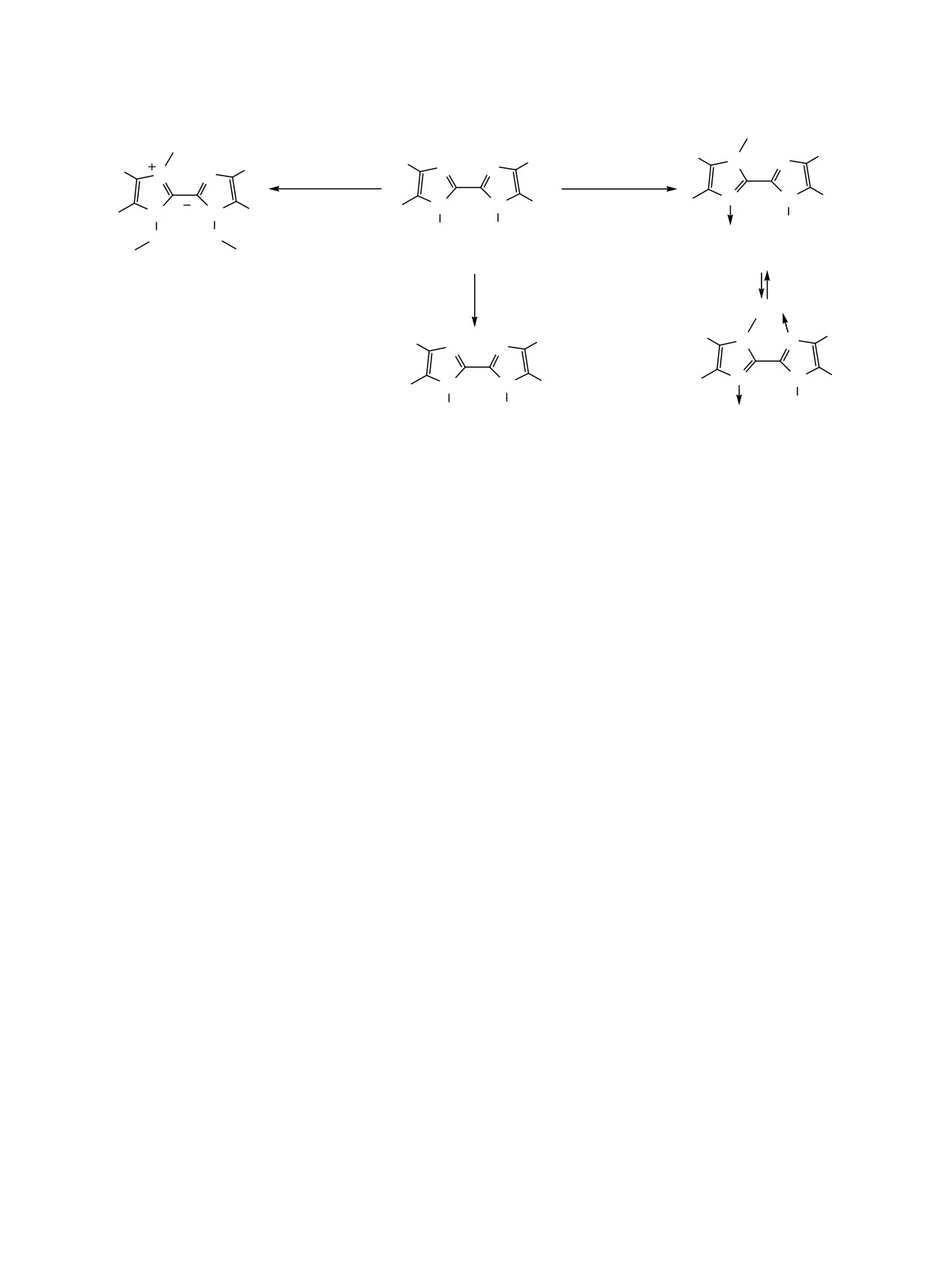
1,1'-Дигидрокси-2,2'-бисимидазолы, в отличие
от 2,2'-бисимидазолов, остаются мало изученными
При взаимодействии алкилзамещенных
1,1'-
[8, 9] и могут быть интересны как для синтеза
дигидрокси-2,2'-бисимидазолов 1a-c с избытком
производных
1,1'-дигидрокси-2,2'-бисимидазолов,
иодметана в диметилформамиде в присутствии
так и для синтеза 2,2'-бисимидазолов.
карбоната калия при комнатной температуре обра-
зуются
4,4',5,5'-алкилзамещенные
2,2'-бисимида-
Цель настоящей работы - изучение реакций
золий иодиды 3a-c с выходом 51-97% (схема 1).
алкилзамещенных
1,1'-дигидрокси-2,2'-бисимид-
азолов с иодметаном и P(OMe)3.
В этом случае, по-видимому, сначала проис-
ходит алкилирование по атому азота имидазо-
Алкилирование соединений 1a-c эквимольным
льного кольца, а затем алкилирование атомов
количеством иодметана приводит к образованию
кислорода гидроксильных групп.
продуктов алкилирования по атому азота имидазо-
льного кольца: 4,4',5,5'-алкилзамещенным 1-гид-
При восстановлении гидроксиимидазолов 1a-c
рокси-1'-метил-2,2'-бисимидазол 3-оксидам 2a-c с
триметилфосфитом (ср.
[11]) легко образуются
выходом 57-86% (схема 1). Протекание реакции по
соответствующие имидазолы 4a-c с выходом 56-
атому азота имидазольного кольца, а не по атому
98% (схема 1).
303
304
ОСЬКИНА, ТИХОНОВ
Схема 1.
R
R
R
R
N
N
R
R
N
N
N
N
MeI (3 экв)
MeI (1 экв)
K2CO3, ДМФА, rt
K2CO3, ДМФА, rt
R
N
N
R
R
N
N
R
R
N
I
N
R
OH
OH OH
O
O
O
3a-c
1a-c
2a-c
P(OMe)3, DMF
O
R
R
R
R
N
N
N
N
R
N
N
R
R
N
N
R
H
H
H
O
4a-c
A
R = R = Me (a); R + R = (CH2)4 (b); R + R = (CH2)5 (c).
Следует отметить, что в работе [12] бисимида-
13C, δ, м.д.: 132.53, 128.49, 124.08, 123.87, 122.95,
золы
4a и
4b получены реакцией глиоксаля,
122.75, 31.82, 13.45, 8.79, 7.42, 7.19. Масс-спектр,
аммиака и соответствующего дикетона с выхо-
m/z: 236.1268 [M]+. С11H17N4O2. М 236.1269.
дами, существенно более низкими (12 и 8%, соот-
1'-Гидрокси-1-метил-4,4',5,5',6,6',7,7'-окта-
ветственно), чем в настоящей работе.
гидро-1H,1'H-2,2'-дибензо[d]имидазол
3-оксид
Таким образом, при алкилировании алкилза-
(2b). Выход 0.15 г (70%), желтые кристаллы, т.пл.
мещенных 1,1'-дигидрокси-2,2'-бисимидазолов иод-
195°C (с разл.). ИК спектр, ν, см-1: 1630, 1563,
метаном первоначально алкилирование протекает
1441, 1382, 1345, 1319, 1220, 1126, 1099, 958, 947,
по атому азота, а не атому кислорода гидрокси-
902, 841, 808. Спектр ЯМР 1H, δ, м.д.: 1.79-1.83 м
группы. 1,1'-Дигидрокси-2,2'-бисимидазолы восс-
(6H, 3CH2), 1.83-1.89 м (2H, CH2), 2.50-2.58 м (2H,
танавливаются с образованием соответствующих
CH2), 2.58-2.73 м (6H, 3CH2), 3.85 с (3H, Me).
алкилзамещенных 2,2'-бисимидазолов с хорошими
Спектр ЯМР 13C, δ, м.д.: 135.42, 128.46, 126.26,
выходами.
126.21, 125.48, 124.37, 31.95, 24.52, 23.08, 22.12,
21.81, 21.40, 19.90, 19.58, 18.66. Масс-спектр, m/z:
Получение соединений
2a-c (общая мето-
288.1582 [M]+. С15H20N4O2. М 288.1581.
дика). К суспензии 3 ммоль К2СО3 в 3 мл сухого
ДМФА прибавляли 0.9 ммоль алкилзамещенного
1'-Гидрокси-1-метил-1,1',4,4',5,5',6,6',7,7',8,8'-
1,1'-дигидрокси-2,2'-бисимидазола
1а-с в
2 мл
додекагидро-2,2'-ди(циклогепта[d]имидазол)
3-
сухого ДМФА и 0.9 ммоль CH3I. Смесь переме-
оксид (2c). Выход 0.24 г (86%), желтые кристаллы,
шивали 72 ч при комнатной температуре, разбав-
т.пл. 175°C (с разл.). ИК спектр, ν, см-1: 1672, 1620,
ляли 3 мл воды, подкисляли 10%-ным HCl до нейт-
1553, 1443, 1362, 1331, 1256, 1211, 1086, 1072, 995,
ральной pH, экстрагировали CHCl3 (3×3 мл), экст-
962. Спектр ЯМР 1H, δ, м.д.: 1.68-1.79 м (12H,
ракт сушили MgSO4. Остаток после упаривания раст-
6CH2), 2.68-2.85 м (8H, 4CH2), 3.89 с (3H, CH3).
ворителя хроматографировали (пластины с SiO2,
Спектр ЯМР 13C, δ, м.д.: 139.06, 129.93, 129.34,
элюент CHCl3).
128.90, 127.27, 122.71, 32.11, 31.23, 30.57, 29.61,
27.55, 27.03, 26.44, 25.93, 24.31, 22.83, 22.10. Масс-
2-(1-Гидрокси-4,5-диметил-1H-имидазол-2-
спектр, m/z: 316.1897 [M]+. С17H24N4O2. М 316.1894.
ил)-1,4,5-триметил-1H-имидазол
3-оксид
(2a).
Выход 0.12 г (57%), желтые кристаллы, т.пл. 158°C
Получение соединений 3a-c (общая методика).
(с разл.). ИК спектр, ν, см-1: 1632, 1562, 1439, 1394,
К суспензии 3 ммоль К2СО3 в 3 мл сухого ДМФА
1350, 1294, 1254, 1230, 1194, 1121, 1034, 1007, 831.
прибавляли 0.9 ммоль алкилзамещенного 1,1'-ди-
Спектр ЯМР 1H, δ, м.д.: 2.17 с (3H, Me), 2.18 с (3H,
гидрокси-2,2'-бисимидазола 1а-c в 2 мл сухого
Me); 2.20 с (6H, 2Me), 3.86 с (3H, Me). Спектр ЯМР
ДМФА и 2.8 ммоль CH3I. Смесь перемешивали 72 ч
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
АЛКИЛЗАМЕЩЕННЫЕ 1,1'-ДИГИДРОКСИ-2,2'-БИСИМИДАЗОЛЫ
305
при комнатной температуре, разбавляли 3 мл воды,
ДМФА прибавляли 3 ммоль триметилфосфита, смесь
подкисляли
10%-ным HCl до нейтральной pH,
реагентов нагревали при 110°С в течение 14 ч.
экстрагировали CHCl3 (3×3 мл), экстракт сушили
После охлаждения реакционную смесь разбавляли
MgSO4. Остаток после упаривания растворителя хро-
5 мл Н2О, экстрагировали CHCl3 (3×3 мл), экстракт
матографировали (пластины с SiO2, элюент CHCl3).
сушили MgSO4. Остаток после упаривания раство-
рителя хроматографировали (пластины с SiO2,
1-Метокси-2-(1-метокси-4,5-диметил-1H-ими-
элюент CHCl3).
дазол-2-ил)-3,4,5-триметил-1H-имидазол-3-ий
иодид (3a). Выход 0.38 г (97%), желтые кристаллы,
4,4',5,5'-Тетраметил-1H,1'H-2,2'-бисимидазол
т.пл. 165°C (с разл.). ИК спектр, ν, см-1: 1641, 1591,
(4a). Выход 0.12 г (63%), белые кристаллы, т.пл.
1564, 1508, 1446, 1404, 1342, 1105, 955, 874. Спектр
(разл. без плавл.), (т.пл. > 337°C [12]). Спектр ЯМР
ЯМР 1H, δ, м.д.: 2.17 с (3H, CH3), 2.26 с (3H, Me),
1H, δ, м.д.: 2.10 с (6H, 2Me), 2.19 с (6H, 2Me). Масс-
2.40 с (3H, Me), 2.44 с (3H, Me), 3.83 с (3H, MeN),
спектр, m/z: 189.1134 [M - H]+. С10H13N4. М 189.1135.
4.12 с (3H, MeО), 4.16 с (3H, MeО). Спектр ЯМР
4,4',5,5',6,6',7,7'-Октагидро-1H,1'H-2,2'-ди-
13C, δ, м.д.: 134.53, 128.43, 127.86, 125.40, 124.79,
бензо[d]имидазол (4b). Выход 0.23 г (98%), белые
119.35, 70.46, 69.22, 34.82, 13.15, 10.42, 8.09, 7.63.
кристаллы, т.пл. 219°C (с разл.), (т.пл. > 342°C
Найдено, %: C 39.32; H 5.30; N 14.28; I 32.30.
[12]). ИК спектр, ν, см-1: 1645, 1572, 1443, 1356,
C13H21N4O2I. Вычислено, %: C 39.81; H 5.40; N
1313, 1277, 1244, 1213, 1111, 966, 860. Спектр ЯМР
14.28; I 32.35.
1H, δ, м.д.: 1.61-1.97 м (8H, 4CH2), 2.36-2.56 м (4H,
1,1'-Диметокси-3-метил-4,4',5,5',6,6',7,7'-окта-
2CH2), 2.56-2.77 м (4H, 2CH2). Спектр ЯМР 13C, δ,
гидро-1H,1'H-2,2'-дибензо[d]имидазол-3-ий
м.д.: 129.88, 126.43, 125.84, 22.48, 22.44, 21.83, 19.15.
иодид (3b). Выход 0.80 г (60%), желтые кристаллы,
Масс-спектр, m/z: 241.1450 [M - H]+. С14H17N4. М
т.пл. 156°C (с разл.). ИК спектр, ν, см-1: 1638, 1585,
241.1448.
1562, 1495, 1439, 1392, 1345, 1327, 1222, 1083, 958,
1,1',4,4',5,5',6,6',7,7',8,8'-Додекагидро-2,2'-ди-
941. Спектр ЯМР 1H, δ, м.д.: 1.82-1.92 м (4H,
(циклогепта[d]имидазол) (4c). выход 0.15 г (56%),
2CH2), 1.94-2.11 м (4H, 2CH2), 2.56-2.62 м (2H,
белые кристаллы, т.пл. (разл. без плавл.). ИК
CH2), 2.67-2.74 м (2H, CH2), 2.74-2.84 м (4Н,
спектр, ν, см-1: 1635, 1560, 1439, 1362, 1329, 1254,
2СН2), 3.84 с (3H, MeN), 4.23 с (3H, MeО), 4.24 с
1175, 1067, 960, 868. Спектр ЯМР 1H, δ, м.д.: 1.57-
(3H, MeО). Спектр ЯМР 13C, δ, м.д.: 137.24, 130.57,
1.68 м (4H, 2CH2), 1.68-1.76 м (4H, 2CH2), 1.76-
128.21, 127.59, 127.15, 120.19, 70.68, 68.90, 34.36,
1.86 м (4H, 2CH2), 2.50-2.64 м (4H, 2CH2), 2.71-
24.22, 22.63, 21.78, 20.97, 20.81, 20.58, 19.96, 19.38.
2.88 м (4H, 2CH2). Спектр ЯМР 13C, δ, м.д.: 133.32,
Масс-спектр, m/z:
302.1735
[M
- CH3I]+.
129.18, 124.75, 30.78, 28.03, 27.18, 26.78, 22.55.
С16H22N4O2. М 302.1737.
Масс-спектр, m/z:
270.1834
[M]+. С16H22N4. М
1,1'-Диметокси-3-метил-1,1',4,4',5,5',6,6',7,7',8,8'-
270.1839.
додекагидро-2,2'-ди(циклогепта[d]имидазол)-1-
ИК спектры зарегистрированы в таблетках KBr
ий иодид (3c). Выход 0.22 г (51%), желтые крис-
на приборе Bruker Vector-22. Спектры ЯМР 1Н и
таллы, т.пл. (разл. без плавл.). ИК спектр, ν, см-1:
13С зарегистрированы в растворе в CDCl3 на при-
1632, 1554, 1502, 1446, 1398, 1356, 1325, 1055, 991,
боре Bruker AV-400 (400 и 100 МГц), внутренний
953, 924. Спектр ЯМР 1H, δ, м.д.: 1.66-1.81 м (4H,
стандарт - остаточные сигналы CDCl3 (7.24 м.д.
2CH2), 1.81-1.99 м (8H, 4CH2), 2.65-2.80 м (4H,
для 1Н и 76.90 м.д. для 13С). Температуры плав-
2CH2), 2.82-3.05 м (4H, 2CH2), 3.83 с (3H, MeN),
ления измерены на приборе Mettler Toledo FD-900.
4.17 с (6H, MeO). Спектр ЯМР 13C, δ, м.д.: 140.88,
Элементный анализ выполнен на автоматическом
133.18, 130.54, 130.11, 127.53, 118.59, 71.19, 69.42,
CHNS-анализаторе Euro EA3000. Масс спектры
34.80, 30.74, 30.68, 28.67, 26.91, 26.65, 25.64, 25.51,
высокого разрешения (EI, 70 eV) зарегистрированы
25.31, 23.13, 22.82. Найдено, %: C 48.08; H 6.22; N
на приборе DFS Thermo Electron. Контроль за ходом
11.77; I 27.31. C19H29N4O2I. Вычислено, %: C 48.31;
реакций и индивидуальностью полученных соеди-
H 6.19; N 11.86; I 26.87.
нений осуществлялся с помощью ТСХ на пласти-
Получение соединений 4a-c (общая методика).
нах Sorbfil ПТСХ-АФ-А-УФ, элюент CHCl3. Алкил-
К раствору 1 ммоль алкилзамещенного 1,1'-ди-
замещенные
1,1'-дигидрокси-2,2'-бисимидазолы
гидрокси-2,2'-бисимидазола 1a-c в 2 мл сухого
1a-c были получены по методике [9].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
306
ОСЬКИНА, ТИХОНОВ
БЛАГОДАРНОСТИ
5. a Yin P.H.C., Shreeve J.M. Chem. Eur. J. 2016, 22,
2108-2113. doi 10.1002/chem.201504407 b Lewczuk R.,
Авторы выражают благодарность Химическому
Szala M., Rećko J., Klapötke T.M., Cudziło S. Chem.
сервисному центру коллективного пользования СО
Heterocycl. Compd. 2017, 53, 697-701. doi 10.1007/
РАН за проведение спектральных и аналитических
s10593-017-2111-z
измерений.
6. Murata T., Nakasuji K., Morita Y. Eur. J. Org. Chem.
2012, 4123-4129. doi 10.1002/ejoc.201200426
КОНФЛИКТ ИНЕРЕСОВ
7. Xiao J.-C., Shreeve J.M. J. Org. Chem. 2005, 70, 3072-
3078. doi 10.1021/jo0501083
Авторы заявляют об отсутствии конфликта
8. Никитина П.А., Перевалов В.П. ХГС. 2017, 53, 123-
интересов.
149. [Nikitina P.A., Perevalov V.P. Chem. Heterocycl.
Compd. 2017, 53, 123-149.] doi 10.1007/s10593-017-
СПИСОК ЛИТЕРАТУРЫ
2030-z
1. Nonell S., Borrell J.I., Borrós S., Colominas C., Rey O.,
9. Tikhonov A.Ya, Selivanov B.A., Gatilov Yu.V.
Rubio N., Sánchez-Garcí, D., Teixidó J. Eur. J. Org.
Tetrahedron Lett. 2015, 56, 159-161. doi 10.1016/
Chem. 2003, 1635-1640. doi 10.1002/ejoc.200200684
j.tetlet.2014.11.056
2. Llinás M.C., Farran J., Capparelli M.V., Anguera G.,
10. Никитина Г.В., Певзнер М.С. ХГС. 1993, 29, 147-
Sánchez-García D., Teixidó J., Borros S. Tetrahedron
175. [Nikitina G.V., Pevzner M.S. Chem. Heterocycl.
Lett. 2014, 55, 4667-4670. doi 10.1016/j.tetlet.2014.06.072
Compd. 1993, 29, 127-151.] doi 10.1007/BF00531655
3. Maślewski P., Kazimierczuk K., Hnatejko Z., Dołega A.
11. Николаенкова Е.Б., Оськина И.А., Тихонов А.Я.
Inorg. Chim. Acta. 2017, 459, 22-28. doi 10.1016/
ЖОрХ. 2017, 53, 1851-1853. [Nikolaenkova E.B.,
j.ica.2017.01.014
Os’kina I.A., Tikhonov A.Ya. Russ. J. Org. Chem.
4. Casas J.S., Castineiras A., Parajo Y., Sánchez A.,
2017, 53, 1887-1889]. doi 10.1134/S1070428017120193
Sánchez-González A., Sordo J. Polyhedron. 2005, 24,
12. Kuhn R., Blau W. Liebigs Ann. 1957, 605, 32-35. doi
1196-1202. doi 10.1016/j.poly.2005.04.008
10.1002/jlac.19576050106
Alkyl-Substituted 1,1'-Dihydroxy-2,2'-bisimidazoles:
Reactions with Iodmethane and Trimethyl Phosphite
I. A. Os’kina* and A. Ya. Tikhonov
Vorozhtsov Novosibirsk Institute of Organic Chemistry Of the Siberian Branch of Russian Academy of Science,
630090, Russia, Novosibirsk, Ak. Lavrentieva 9
*e-mail: oi@nioch.nsc.ru
Received July 15, 2019; revised, November 18, 2019; accepted November 27, 2019
The alkylation of alkyl substituted 1,1'-dihydroxy-2,2'-biimidazoles by using iodomethane in an equimolar
ratio gives alkylation products on the nitrogen atom of the imidazole ring, with a three-fold excess of
iodomethane - the alkylation products on both the nitrogen atom of the imidazole ring and two hydroxy groups.
The reaction of 1,1'-dihydroxy-2,2'-bisimidazoles with P(OMe)3 leads to the formation of the corresponding
2,2'-bisimidazoles.
Keywords: 1,1'-dihydroxy-2,2'-biimidazoles, 2,2'-biimidazoles, methylation, reduction
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020