ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 3, с. 373-378
УДК 547.841, 547.793
СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ
НОВЫХ ПРОИЗВОДНЫХ
ОКСАДИАЗОЛИЛБЕНЗОДИОКСАНА
© 2020 г. А. С. Авакян, С. О. Вартанян, А. Б. Саргсян, A. A. Агекян*, Г. А. Паносян,
Р. В. Пароникян, Г. М. Степанян, Р. Е. Мурадян
Научно-технологический центр органической и фармацевтической химии НАН Республики Армения,
Институт тонкой органической химии им. А.Л. Мнджояна, 0014, Республика Армения, г. Ереван, пр. Азатутян 26
*e-mail: avagal@mail.ru
Поступила в редакцию 12 сентября 2019 г.
После доработки 20 января 2020 г.
Принята к публикации 20 января 2020 г.
Реакцией 5-(1,4-бензодиоксан-2-ил)-1,3,4-оксадиазол-2-тиола с разнообразными амидами хлоруксусной
кислоты синтезирован ряд S-замещенных производных. Исследованы условия присоединения указанного
тиола по двойной связи нитрила, амида и этилового эфира акриловой кислоты. Изучена реакция
Манниха, в результате которой синтезированы соединения, содержащие у атома азота оксадиазольного
кольца пиперидинил- и морфолинилметильные фрагменты. Изучена антибактериальная активность
синтезированных соединений.
Ключевые слова: 1,3,4-оксадиазол, 5-(1,4-бензодиоксан-2-ил)-1,3,4-оксадиазол-2-тиол, амид хлоруксус-
ной кислоты, реакция Манниха, акриламид, акрилонитрил.
DOI: 10.31857/S0514749220030040
Соединения, содержащие 1,4-бензодиоксановое
На основе синтезированного ранее 5-(1,4-бензо-
ядро, как синтетического, так и природного
диоксан-2-ил)-1,3,4-оксадиазол-2-тиола
(1)
[9]
происхождения, такие как силибин А, выделенный
были получены S-арилалкилзамещенные производ-
из растения Silybum marianum, обладающий анти-
ные. В настоящей работе представлены разно-
гепатотоксической активностью, доксазосин, испо-
образные превращения тиола
1, в результате
льзуемый для лечения гипертензии, флупароксан
которых получены новые бигетероциклические
(антидепрессант), WB 4104, F 17807, пипероксан и
производные 1,4-бензодиоксана, представляющие
многие другие, представляют большой интерес с
интерес в плане изыскания новых биологически
точки зрения их разнообразной фармакологи-
активных веществ в этом ряду соединений.
ческой активности [1-3]. Среди бигетероцикли-
ческих производных 1,4-бензодиоксана, включаю-
В продолжение этих исследований и с целью
щих в структуру азот-, кислород- и серусодер-
сравнения биологических свойств нами пред-
жащие пятичленные кольца, выявлены адреноли-
принят синтез соединений, содержащих у атома
тики, антиоксиданты, гипогликемические, проти-
серы фармакофорный ариламидоалкильный фраг-
воопухолевые и другие лекарственные средства, а
мент. Целевые N-замещенные амидометилтио-
также вещества с выраженными антигипокси-
производные 2a-d получены с высокими выходами
ческими, противоожоговыми, антидотными и радио-
(65-70%) взаимодействием калиевой соли окса-
защитными свойствами
[4-7]. Оксадиазольное
диазолилтиола 1 с замещенными амидами хлор-
кольцо также является фармакофорным фрагмен-
уксусной кислоты, синтезированными реакцией
том и входит в структуру многих лекарственных
конденсации хлорангидрида хлоруксусной кисло-
препаратов, в частности, несапидила и тиодазосина
ты с различными первичными арил- и арилалкил-
(антигипертензивные средства), фурамизола (анти-
аминами. Следует отметить, что существенным
бактериальное средство), зиботентана (противо-
фактором в процессе этих синтезов является темпе-
опухолевый препарат) и др. [8].
ратура ведения реакции: так, в случае соединений
373
374
АВАКЯН и др.
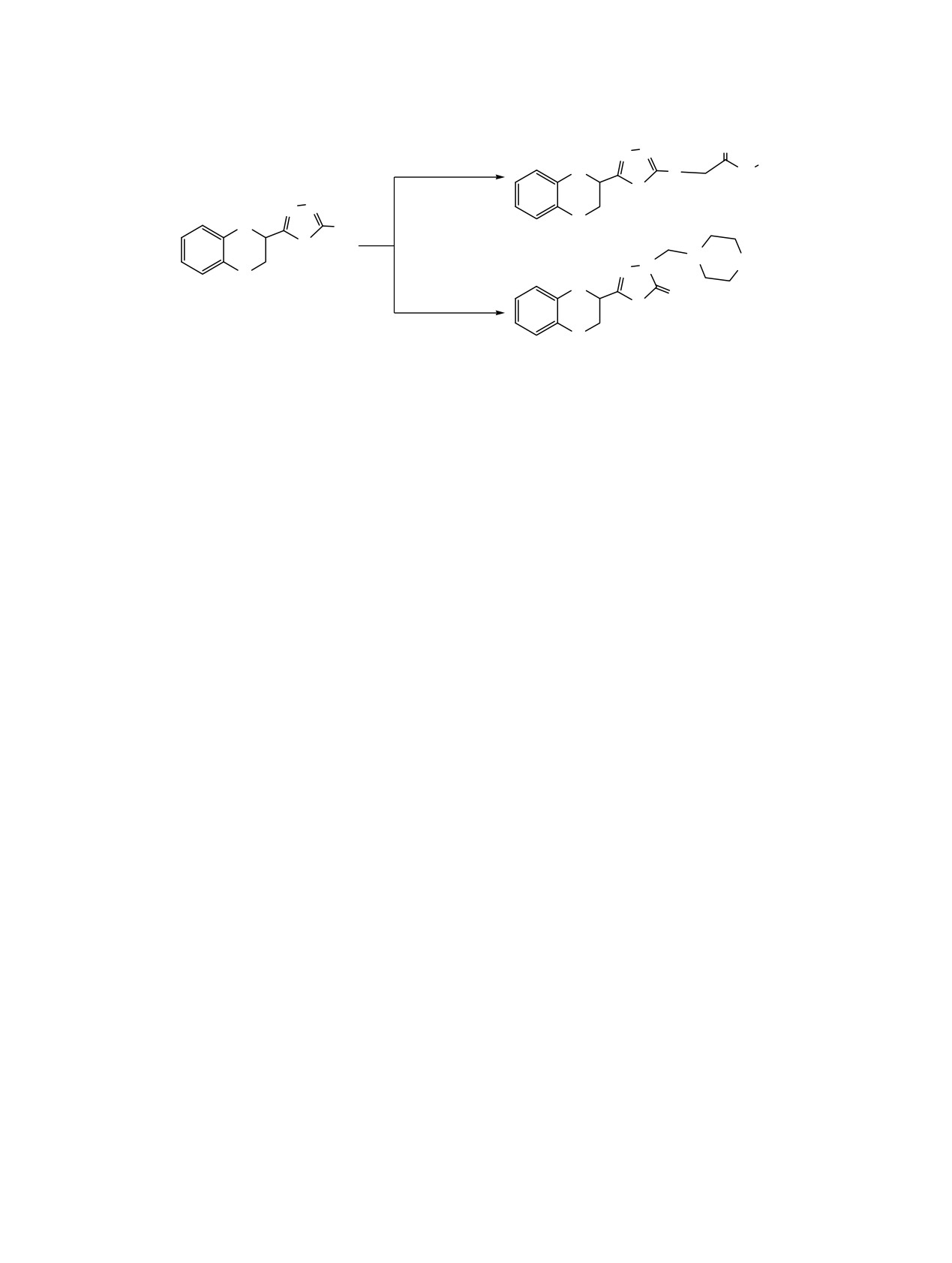
Схема 1.
O
N
N
ClCH2C(O)NHR
R
O
S
N
O
H
N
N
O
O
SH
2a-2d
O
N
N X
N
O
1
O
S
CH2O, AmH
O
O
3a, b
2, R = H (a), 2-CH3C6H4 (b), 2-CH3OC6H4 (c), CH2CH2C6H5 (d); 3, X = O (a), X = CH2 (b).
2a и d реакция проходила при температуре 21-22°С,
Исследованы антибактериальные свойства син-
тогда как соединения 2b и c удалось получить
тезированных соединений методом «диффузии в
лишь при более низких температурах (10-14°С).
агаре» [11] при бактериальной нагрузке 20 млн
микробных тел на 1 мл среды. В опытах испо-
Для синтеза соединений, содержащих фрагмен-
льзовали бактерии: грамположительные - стафило-
ты циклических аминов у атома азота оксадиа-
кокки (Staphylococcus aureus
209 p,1) и грам-
зольного цикла, исследованы оптимальные условия
отрицательные - палочки (Shigella flexneri 6858,
проведения реакции Манниха [10]. Показано, что
E. coli 0-55). Растворы соединений и контрольного
наибольший выход соединений 3a и b (66-68%)
препарата готовили в ДМСО в разведении 1:20.
достигается
12-часовым нагреванием спиртово-
водного раствора смеси тиола 1, параформа и
Показано, что все соединения, за исключением
морфо-лина (или пиперидина) (схема 1).
3a и b, проявляют слабую активность в отношении
стафилококков дизентерийной палочки, подавляя
Реакцией исходного оксадиазолилтиола
1 с
рост микробов в зоне диаметром 10-14 мм. Соеди-
нитрилом, этиловым эфиром и амидом акриловой
нения, содержащие аминный фрагмент
3a, b,
кислоты в присутствии триэтиламина синтезиро-
проявили высокую антибактериальную активность
ваны N-замещенные производные бензодиоксанил-
(d 25-45 мм) в отношении всех использованных
оксадиазолилтиона 4a-c, содержащие нитрильную,
штаммов, значительно превосходя препарат срав-
сложноэфирную и карбамидную группы. На основе
нения фурадонин (d 20-26 мм) [12]. Эти вещества
этилового эфира
5-(1,4-бензодиоксан-2-ил)-2-ти-
изучали также методом
«двукратных серийных
оксо-1,3,4-оксадиазол-3(2Н)-пропионовой кислоты
разведений» [11].
(4b) щелочным гидролизом получена кислота 5a, а
реакцией с гидразингидратом - соответствующий
Установлено, что по величине минимальной
гидразид 5b. Аминированием эфира 4b метил-
ингибирующей концентрации
(500 мкг/мл) они
амином выделен метиламид 5c. Однако использо-
существенно уступают препарату сравнения
вание в аналогичных условиях этиламина привело
фурадонину (39 мкг/мл).
к соединению 6, в котором, наряду с этилкарба-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
мидным фрагментом, присутствует =NC2H5 группа
в положении C2 оксадиазольного кольца. Подобное
ИК спектры сняты на спектрометре «Nicolet
замещение атома серы под действием довольно
Avatar 330 FT-IR» в вазелиновом масле, спектры
сильного основания (этиламина) доказано нали-
ЯМР 1Н и 13С - на «Varian Mercury-300» в ДМСО-
чием в ИК спектре, наряду с поглощением амид-
d6, внутренний стандарт - ТМС. Оба прибора из
ного карбонила (1640 см-1), поглощения в области
США Температуры плавления определены на мик-
1677 см-1 (С=N) и соответствующих сигналов в
ронагревательном столике «Boёtius» (Германия).
спектрах ЯМР 1Н и 13С (схема 2).
ТСХ проведена на пластинках «Silufol UV-254»,
Чистота и строение всех синтезированных
подвижная фаза бензол-ацетон, 4:1, проявитель -
веществ подтверждены физико-химическими
пары йода. Использованные реагенты соответст-
методами и тонкослойной хроматографией.
вуют стандарту «хч».
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 3 2020
СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ НОВЫХ ПРОИЗВОДНЫХ
375
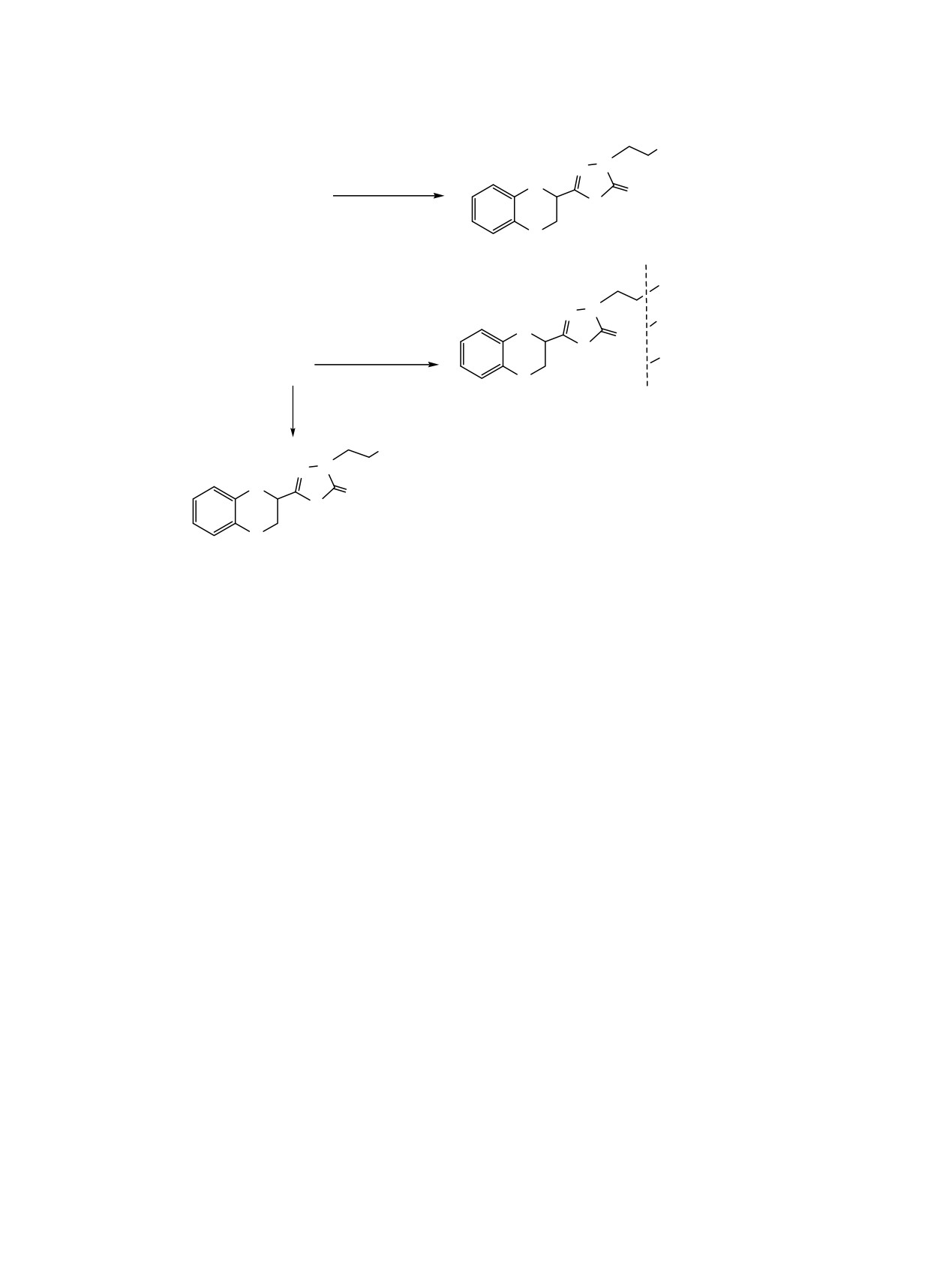
Схема 2.
R
N
N
CH2= CH-R
O
1
S
O
O
4a-c
COOH
(a)
N
N
CONHNH2
(b)
O
S
O
CONHCH3
(c)
4b
O
5
CONHC2H5
N
N
O
NC2H5
O
O
6
4, R = CN (a), COOC2H5 (b), CONH2 (c).
5-(1,4-Бензодиоксан-2-ил)-1,3,4-оксадиазол-2-
2-[5-(1,4-Бензодиоксан-2-ил)-1,3,4-окса-
тиол (1) получен по методике [9].
диазол-2-илтио]-N-o-толилацетамид (2b). Выход
0.43. ИК спектр, ν,
2.26 г (59%), т.пл. 129-130°С, Rf
N-Замещенные
2-[5-(1,4-бензодиоксан-2-ил)-
см-1: 3248 (NH-амидн.), 1675 (С=O), 1590, 1495
1,3,4-оксадиазол-2-илтио]ацетамиды 2a-c (общая
(аром.). Спектр ЯМР 1Н, δ, м.д.: 2.25 с (3Н, СН3),
методика). К 2.36 г (0.01 моль) тиола 1 в 30 мл
4.29 с (2Н, SCH2), 4.47 д.д (1Н, ОСН2, J 11.7, 6.2 Гц),
этанола прибавляли 0.56 г (0.01 моль) едкого кали
4.57 д.д (1Н, ОСН2, J 11.7, 2.7 Гц), 5.61 д.д (1Н,
в 20 мл этанола и через 25-30 мин медленно при-
OСH, J 6.2, 2.7 Гц), 6.81-6.92 м (4Н, С6Н4), 7.00-
бавляли 0.01 моль соответствующего N-замещен-
7.16 м (3Н, С6Н4Ме), 7.50 д (1Н, С6Н4Ме, J 7.8 Гц),
ного амида хлоруксусной кислоты. Выдерживали
9.53 уш.с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 17.6,
4-6 ч при 10-14°С (2b и 2c) и при 21-22°С (2a и
36.4, 63.9, 65.9, 116.8, 116.8, 121.3, 121.5, 124.0,
2d), отгоняли растворитель, остаток хорошо расти-
124.6, 125.4, 129.8, 130.7, 135.6, 141.5, 142.3, 162.3,
рали водой, сливали воду, кристаллизовали в
164.0, 164.7. Найдено, %: С 60.04; Н 4.76; N 11.15.
эфире, перекристаллизовывали из спирта.
С19Н17N3О4S. Вычислено, %: С 59.52; Н 4.47; N
10.96.
2-[5-(1,4-Бензодиоксан-2-ил)-1,3,4-оксадиазол-
2-илтио]ацетамид (2a). Выход 1.55 г (53%), т.пл.
2-[5-(1,4-Бензодиоксан-2-ил)-1,3,4-окса-
163-164°С, Rf 0.38. ИК спектр, ν, см-1: 3310, 3242
диазол-2-илтио]-N-(2-метоксифенил)ацетамид
(NH-амидн),
1653 (С=O),
1591,
1500 (аром.).
(2c). Выход 2.15 г (54%), т.пл 76-78°С, Rf 0.48. ИК
Спектр ЯМР 1Н, δ, м.д.: 4.01 с (2Н, SCH2), 4.46 д.д
спектр, ν, см-1: 3258 (NH-амидн.), 1673 (С=O),
(1Н, ОСН2, J 11.8, 6.2 Гц), 4.56 д.д (1Н, ОСН2, J
1598, 1489 (аром.). Спектр ЯМР 1Н, δ, м.д.: 3.86 с
11.8, 2.7 Гц), 5.59 д.д (1Н, OСH, J 6.2, 2.7 Гц), 6.81-
(3Н, ОСН3), 4.29 с (2Н, SCH2), 4.47 д.д (1Н, ОСН2, J
6.93 м (4Н, С6Н4), 7.10 уш.с (1Н, СОNH2), 7.57 уш.с
11.7, 6.1 Гц), 4.57 д.д (1Н, ОСН2, J 11.7, 2.7 Гц),
(1Н, СОNH2). Найдено, %: С 49.35; Н 3.89; N 14.59.
5.61 д.д (1Н, OСH, J 6.1, 2.7 Гц), 6.81-6.93 м (6Н),
С12Н11N3О4S. Вычислено, %: С 49.14; Н 3.78; N
6.98-7.04 м (1Наром), 8.07 д (1Наром, J 7.7 Гц), 9.45
14.33.
уш.с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 36.4, 55.2,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 3 2020
376
АВАКЯН и др.
63.9, 65.9, 110.2, 116.8, 120.0, 120.7, 121.3, 121.5,
(0.0032 моль) тиола 1 прибавляли 16 мл воды,
123.6, 127.1, 141.4, 142.2, 148.6, 162.4, 164.0, 164.6.
10 мл триэтиламина и 7 мл свежеперегнанного
Найдено, %: С 57.49; Н 4.61; N 10.87. С19Н17N3О5S.
акрилонитрила. Кипятили 6 ч, отгоняли раствори-
Вычислено, %: С 57.13; Н 4.29; N 10.52.
тель, к остатку прибавляли воду, растирали, 2-3 раза
сливали воду, кристаллизовали из смеси гексан-
2-[5-(1,4-Бензодиоксан-2-ил)-1,3,4-оксадиазол-
метанол и перекристаллизовывали из метанола.
2-илтио]-N-фенэтилацетамид (2d). Выход 2.3 г
Выход 0.4 г (40%), т.пл. 110-112°С, Rf 0.51. ИК
(57%), т.пл. 91-93°С, Rf 0.50. ИК спектр, ν, см-1:
спектр, ν, см-1: 2248 (СN), 1594, 1637 (аром.).
3264 (NH-амидн), 1669 (С=O), 1590, 1497 (аром.).
Спектр ЯМР 1Н, δ, м.д.: 2.99 т (2Н, СН2, J 6.6 Гц),
Спектр ЯМР 1Н, δ, м.д.: 2.73-2.78 м (2Н, СН2Ph),
4.32 т (2Н, NСН2, J 6.6 Гц), 4.46 д.д (1Н, ОСН2, J
3.32-3.39 м (2Н, NCH2), 3.99 с (2H, SCH2), 4.46 д.д
11.8, 5.3 Гц), 4.51 д.д (1Н, ОСН2, J 11.8, 2.9 Гц),
(1Н, ОСН2, J 11.8, 6.1 Гц), 4.56 д.д (1Н, ОСН2, J
5.58 д.д (1Н, OСH, J 5.3, 2.9 Гц), 6.83-6.96 м (4Н,
11.8, 2.7 Гц), 5.60 д.д (1Н, OСH, J 6.1, 2.7 Гц), 6.81-
С6Н4). Найдено, %: С 54.16; Н 4.12; N 14.83.
6.92 м (4Н, С6Н4), 7.11-7.27 м (5Н, С6Н5), 8.21 т
С13Н11N3О3S. Вычислено, %: С 53.97; Н 3.83; N
(1Н, NH, J 5.6 Гц). Найдено, %: С 60.75; Н 5.11; N
14.52.
10.84. С20Н19N3О4S. Вычислено, %: С 60.44; Н 4.82;
N 10.57.
3-]5-(1,4-Бензодиоксан-2-ил)-2-тиоксо-1,3,4-
оксадиазол-3(2Н)-ил]этилпропаноат (4b). Смесь
5-(1,4-Бензодиоксан-2-ил)-3-(морфолино-
0.7 г (0.003 моль) тиола 1, 7.0 мл триэтиламина,
метил)-1,3,4-оксадиазол-2(3Н)-тион (3a). К раст-
7.0 мл этилового эфира акриловой кислоты в 10 мл
вору 0.8 г (0.0032 моль) 5-(1,4-бензодиоксан-2-ил)-
этанола оставляли при комнатной температуре на
1,3,4-оксадиазол-2-тиола
(1) в
20 мл метанола
15-17 ч. Отгоняли досуха в вакууме, остаток раст-
прибавляли 0.3 г (0.0034 моль) морфолина, затем
воряли в 5 мл бензола и выливали в 30 мл гексана,
по каплям прибавляли 1.0 мл 30%-го раствора
сливали с образовавшегося масла эту смесь, добав-
формалина. Перемешивали при комнатной темпе-
ляли 15 мл гексана. Образовавшиеся кристаллы
ратуре 12 ч. Отгоняли растворитель, добавляли
отфильтровывали, сушили и перекристаллизовы-
50 мл воды и экстрагировали бензолом. Сушили
вали из гексана. Выход 0.6 г (62%), т.пл. 77-78°С,
сульфатом натрия, отгоняли бензол, к остатку
Rf 0.48. ИК спектр, ν, см-1: 1720 (С=O),
1600
прибавляли 30 мл эфира, образовавшиеся крис-
(аром.). Спектр ЯМР 1Н, δ, м.д.: 1.24 т (3Н, СН3, J
таллы отфильтровывали, промывали спиртом,
7.1 Гц), 2.81 т (2Н, СН2, J 7.1 Гц), 4.09 к (2Н,
сушили, перекристаллизовывали из спирта. Выход
ОСН2СН3, J 7.1 Гц), 4.26 т (2Н, NCH2, J 7.1 Гц),
0.7 г (67%), т.пл. 104-105°С, Rf 0.56. Спектр ЯМР
4.44 д.д (1Н, ОСН2, J 11.8, 5.3 Гц), 4.49 д.д (1Н,
1Н, δ, м.д.: 2.66-2.70 м [4Н, N(CH2)2], 3.54-3.58 м
ОСН2, J 11.8, 2.9 Гц), 5.53 д.д (1Н, OСH, J 5.3, 2.9 Гц),
[4Н, О(CH2)2], 4.47 д.д (1Н, ОСН2, J 11.8, 5.3 Гц),
6.82-6.94 м (4Н, С6Н4). Найдено, %: С 53.79; Н
4.52 д.д (1Н, ОСН2, J 11.8, 2.8 Гц), 4.91 c (2H, NCH2),
4.96; N 8.57. С15Н16N2О5S. Вычислено, %: С 53.56;
5.54 д.д (1Н, OСH, J 5.3, 2.8 Гц), 6.82-6.95 м (4Н,
Н 4.79; N 8.33.
С6Н4). Найдено, %: С 54.02; Н 4.94; N 12.81.
С15Н17N3О4S. Вычислено, %: С 53.72; Н 5.11; N
3-[5-(1,4-Бензодиоксан-2-ил)-2-тиоксо-1,3,4-
12.53.
оксадиазол-3(2Н)-ил]пропанамид
(4c). К раст-
вору 0.8 г (0.0032 моль) тиола 1 в 25 мл этанола
5-(1,4-Бензодиоксан-2-ил)-3-(пиперидин-1-ил-
прибавляли 8.0 г (0.011 моль) акриламида в 10 мл
метил)-1,3,4-оксадиазол-2(3Н)-тион
(3b). Полу-
воды и 16 мл триэтиламина. Оставляли при ком-
чен аналогично из тиола 1, пиперидина и форма-
натной температуре в течение 18-20 ч. Остаток
лина. Выход 0.7 г (68%), т.пл. 106-108°С, Rf 0.51.
тщательно растирали водой, сливали воду, прибав-
Спектр ЯМР 1Н, δ, м.д.: 1.31-1.39 м (2Н) и 1.47-
ляли эфир. Образовавшиеся кристаллы отфильтро-
1.55 м (4Н, 3СН2), 2.60-2.65 м [4Н, N(CH2)2], 4.47
вывали, сушили, перекристаллизовывали из эта-
д.д (1Н, ОСН2, J 11.8, 5.2 Гц), 4.51 д.д (1Н, ОСН2, J
нола. Выход 0.45 г (43%), т.пл. 140-141°С, Rf 0.43.
11.8, 2.9 Гц), 4.89 c (2H, NCH2), 5.53 д.д (1Н, OСH,
ИК спектр, ν, см-1: 3326, 3442 (NH2-амидн.), 1659
J 5.2, 2.9 Гц), 6.82-6.95 м (4Н, С6Н4). Найдено, %:
(С=O), 1608, 1493 (аром.). Спектр ЯМР 1Н, δ, м.д.:
С 57.88; Н 5.58; N 12.79. С16Н19N3О3S. Вычислено,
2.61 т (2Н, СН2, J 7.5 Гц), 4.21 т (2Н, NСН2, J 7.5 Гц),
%: С 57.64; Н 5.74; N 12.60.
4.44 д.д (1Н, ОСН2, J 11.8, 5.6 Гц), 4.51 д.д (1Н,
3-[5-(1,4-Бензодиоксан-2-ил)-2-тиоксо-1,3,4-
ОСН2, J 11.8, 2.8 Гц), 5.53 д.д (1Н, OСH, J 5.6, 2.8 Гц),
оксадиазол-3(2Н)-ил]пропионитрил (4a). К 0.8 г
6.64 уш.с (1Н, СОNH2), 6.82-6.95 м (4Н, С6Н4), 7.26
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 3 2020
СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ НОВЫХ ПРОИЗВОДНЫХ
377
уш.с (1Н, СОNH2). Спектр ЯМР 13С, δ, м.д.: 32.0,
ритель, к остатку прибавляли эфир, образовав-
45.0, 63.4, 65.9, 116.8, 116.9, 121.4, 121.6, 141.3,
шиеся кристаллы отфильтровывали, сушили, пере-
142.2, 156.5, 170.0, 175.6. Найдено, %: С 51.12; Н
кристаллизовывали из этанола. Выход 0.4 г (48%),
4.55; N 13.90. С13Н13N3О4S. Вычислено, %: С 50.81;
т.пл. 200-203°С, Rf 0.53. ИК спектр, ν, см-1: 3260
Н 4.26; N 13.67.
(NH-амидн.),
1675 (С=O),
1589,
1500 (аром.).
Спектр ЯМР 1Н, δ, м.д.: 2.57 т (2Н, СН2, J 7.7 Гц),
3-[5-(1,4-Бензодиоксан-2-ил)-2-тиоксо-1,3,4-
2.63 д (3Н, СН3, J 4.6 Гц), 4.32 т (2Н, NCH2, J 7.7 Гц),
оксадиазол-3(2Н)-ил]пропионовая кислота (5a).
4.44 д.д (1Н, ОСН2, J 11.7, 7.7 Гц), 4.60 д.д (1Н,
К 0.6 г (0.002 моль) 3-[5-(1,4-бензодиоксан-2-ил)-2-
ОСН2, J 11.7, 2.6 Гц), 5.49 д.д (1Н, OСH, J 7.7, 2.6 Гц),
тиоксо-1,3,4-оксадиазол-3(2Н)-ил]этилпропаноата
6.79-6.90 м (4Н, С6Н4), 7.62 к (1Н, NH, J 4.6 Гц).
(4b) прибавляли 5 мл 10%-го водного раствора
Спектр ЯМР 13С, δ, м.д.: 25.2, 33.2, 45.1, 63.5, 65.6,
едкого натра и нагревали 1 ч. Прибавляли бензол,
116.7, 116.8, 121.0, 121.5, 141.5,142.4, 145.6, 166.9,
встряхивали, отделяли водный слой, который под-
168.5. Найдено, %: С 52.46; Н 4.93; N 13.31.
кисляли разбавленным раствором HCl до рН 3.
С14Н15N3О4S. Вычислено, %: С 52.33; Н 4.70; N
Выделившиеся кристаллы отфильтровывали, про-
13.08.
мывали водой, сушили, перекристаллизовывали из
этанола. Выход 0.4 г (73%), т.пл. 145-146°С. ИК
3-[5-(1,4-Бензодиоксан-2-ил)-2-(этилимино)-
спектр, ν, см-1: 2800 - 3000 (ОН), 1706 (С=O), 1595,
1,3,4-оксадиазол-3(2Н)-ил]-N-этилпропанамид
1496 (аром.). Спектр ЯМР 1Н, δ, м.д.: 2.68 т (2Н,
(6). Получен аналогично из этилового эфира 4b и
СН2, J 7.2 Гц), 4.00-4.15 м (2Н, NCH2), 4.32 д.д (1Н,
этиламина. Смесь двух изомеров, 90:10. Выход 0.6 г
ОСН2, J 11.7, 5.8 Гц), 4.47 д.д (1Н, ОСН2, J 11.7,
(53%), т.пл. 115-117°С, Rf 0.52. ИК спектр, ν, см-1:
2.6 Гц), 5.36 д.д (1Н, OСH, J 5.8, 2.6 Гц), 6.81-6.90
3312 (NH-амидн.), 1677 (С=N), 1640 (C=O), 1596
м (4Н, С6Н4), 12.20 уш.с (1Н, СООН). Найдено, %:
(аром.). Спектр ЯМР 1Н, δ, м.д.: 1.07 т (3Н, СН3, J
С 50.88; Н 4.25; N 8.97. С13Н12N2О5S. Вычислено,
7.2 Гц), 1.42 т (3Н, СН3, J 7.1 Гц), 2.57 т (2Н, СН2, J
%: С 50.64; Н 3.92; N 9.09.
7.7 Гц), 3.11 к.д (2Н, NHСН2, J 7.2, 5.6 Гц), 4.13-
4.26 м (2Н, СН2CH2N), 4.26-4.36 м (2Н, СН2CH2N),
Гидразид
3-[5-(1,4-бензодиоксан-2-ил)-2-
4.44 д.д (1Н, ОСН2, J 11.6, 7.6 Гц), 4.63 д.д (1Н, ОСН2,
тиоксо-1,3,4-оксадиазол-3(2Н)-ил]пропионовой
J 11.6, 2.6 Гц), 5.47 д.д (1Н, OСH, J 7.6, 2.6 Гц),
кислоты (5b). К 0.6 г (0.002 моль) 3-(5-(1,4-бен-
6.78-6.90 м (4Н, С6Н4), 7.65 т (1Н, NH, J 5.6 Гц).
зодиоксан-2-ил)-2-тиоксо-1,3,4-оксадиазол-3(2Н)-
Спектр ЯМР 13С, δ, м.д.: 13.1, 14.4, 33.2, 33.3, 39.8,
ил)этилпропаноата (4b) прибавляли 5 мл 25%-го
45.0, 63.7, 65.4, 116.6, 116.8, 121.0, 121.6, 141.6,
гидразин гидрата и нагревали 1 ч. По охлаждении
142.4, 145.3, 166.2, 167.8. Найдено, %: С 59.13; Н
добавляли холодную воду, образовавшиеся крис-
6.71; N 16.38. С17Н22N4О4. Вычислено, %: С 58.95;
таллы отфильтровывали, промывали водой и эфиром,
Н 6.40; N 16.17.
сушили и перекристаллизовывали из смеси этанол-
эфир (1:5). Выход 0.5 г (87%), т.пл. 151-152°С, Rf
КОНФЛИКТ ИНТЕРЕСОВ
0.28. ИК спектр, ν, см-1: 3312, 3199, 3132 (NHNH2),
1650 (С=O), 1595 (аром.). Спектр ЯМР 1Н, δ, м.д.:
Авторы заявляют об отсутствии конфликта
2.55 т (2Н, СН2, J 7.5 Гц), 3.95 уш.с (2Н, NH2), 4.31
интересов.
т (2Н, NCH2, J 7.5 Гц), 4.41 д.д (1Н, ОСН2, J 11.5,
7.3 Гц), 4.52 д.д (1Н, ОСН2, J 11.5, 2.6 Гц), 5.47 д.д
(1Н, OСH, J 7.3, 2.6 Гц), 6.80-6.92 м (4Н, С6Н4),
СПИСОК ЛИТЕРАТУРЫ
8.96 уш.с (1Н, NH). Найдено, %: С 48.70; Н 4.61; N
17.58. С13Н14N4О4S. Вычислено, %: С 48.44; Н 4.38;
1. Achari B.М., Mandal S.B., Dutta P.K., Chowdhury Ch.
N 17.38.
Synlett.
2004,
14,
2449-2467. doi
10.1055/s-2004-
834816
3-[5-(1,4-Бензодиоксан-2-ил)-2-тиоксо-1,3,4-
2. Rouf A., Gupta P., Aga M.A., Kumar B., Chaubey A.,
оксадиазол-3(2Н)-ил]-N-метилпропанамид
(5c).
Parshad R., Taneja S.C. Tetrahedron:Asymmetry.
К раствору 0.8 г (0.0032 моль) эфира 4b в 25 мл
2012, 23, 1615-1623. doi 10.1016/j.tetasy.2012.10.018
этанола прибавляли
10 мл насыщенного спир-
3. Straniero V., Casiraghi A., Fumagalli L. Valoti E.
тового раствора метиламина. Оставляли при ком-
Chirality.
2018,
30,
943-950. doi
10.1002/
натной температуре на 20-23 ч. Отгоняли раство-
chir.22968
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 3 2020
378
АВАКЯН и др.
4. Khalilullah H., Khan S., Ahsan M., Ahmed B. Bull.
8. Verma G., Khan M.F., Akhtar W., Alam M.M.,
Korean Chem. Soc. 2012, 33, 575-582. doi 10.5012/
Shaquiquzzaman M. Int. J. Pharm. Chem. Analysis.
bkcs.2012.33.2.575
2017, 4, 37-42. doi 10.18231/2394-2797.2017.0010
5. Вартанян С.О., Авакян А.С., Саргсян А.Б.,
9. Авакян А.С., Вартанян С.О., Саркисян А.Б.,
Арутюнян С.А., Норавян О.С., Цатинян А.С. ЖОрХ.
Маркарян Э.А. Хим. ж. Арм. 2006, 59, 130-136.
2016, 52, 261-265. [Vartanyan S.O., Avakyan A.S.,
10. Roman G., Agache C., Manciulea I., Comaniţă E.,
Sargsyan A.B., Arutyunyan S.A., Noravyan O.S.,
Dumitrescu L. Rev. Roum. Chim. 2007, 52, 1103-1110.
Tsatinyan A.S. Russ. J. Org. Chem. 2016, 52, 244-248.]
doi 10.1002/chin.200901136
doi 10.1134/S107042801602
11. Руководство по проведению доклинических исследо-
6. Al-Omair M. A., Sayed A.R., Youssef M.M. Molecules.
ваний лекарственных средств. Ред. А.Н. Миронов.
2015, 20, 2591-2610. doi 10.3390/molecules20022591
М.: Медицина, 2012, 509.
7. Maddila S., Pagadala R., Jonnalagadda S.B. Lett.
Org. Chem.
2013,
10,
693-714. doi
10.2174/
12. Машковский М.Д. Лекарственные средства. М.:
157017861010131126115448
Новая волна, 2010, 850.
Synthesis and Antibacterial Properties of the New Derivatives
of Oxadiazolylbenzodioxanes
A. S. Avagyan, S. O. Vardanyan, A. B. Sargsyan, A. A. Aghekyan*, H. A. Panosyan,
R. V. Paronikyan, H. M. Stepanyan, and R. E. Muradyan
Scienctific Technological Centre of Organic and Pharmaceutical Chemistry NAS RA,
0014, Republic of Armenia, Yerevan, ul. Azatutiana 26
*e-mail: avagal@mail.ru
Received September 12, 2019; revised January 20, 2020; accepted January 20, 2020
By interaction of the 5-(1,4-benzodioxane-2-yl)-1,3,4-oxadiazol-2-thiole with different chloracetamides the S-
substituted derivatives have been synthesized. The condition of reaction of the above-mentioned thiole with
derivatives of acrylic acid (ethylate, amide and nitrile) were investigated. The Mannich reaction was also studied,
the compounds with aminomethyl fragments by nitrogen atome of the oxadiazole ring have been obtained. The
antibacterial properties of synthesized compounds have been investigated.
Keywords: 1,3,4-oxadiazole, 5-(1,4-benzodioxan-2-yl)-1,3,4-oxadiazol-2-thiol, chloracetamide, Mannich, acrylamide,
acrylonitrile
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 3 2020