ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 3, с. 384-388
УДК 547.859
СИНТЕЗ (7-АРИЛ-5-МЕТИЛ-
4,7-ДИГИДРОТЕТРАЗОЛО[1,5-a]ПИРИМИДИН-
6-ИЛ)(ФЕНИЛ)МЕТАНОНОВ
© 2020 г. В. Л. Гейнa, *, А. Н. Прудниковаa, А. А. Курбатоваa, М. В. Дмитриевb
a ФГБОУ ВО «Пермская государственная фармацевтическая академия»,
614990, Россия, г. Пермь, ул. Полевая 2
*e-mail: geinvl48@mail.ru
b ФГБОУ ВО «Пермский государственный национальный исследовательский университет»,
614990, Россия, г. Пермь, ул. Букирева 15
Поступила в редакцию 17 сентября 2019 г.
После доработки 16 января 2020 г.
Принята к публикации 17 января 2020 г.
Трехкомпонентная реакция 1-фенил-1,3-бутандиона с ароматическими альдегидами и 5-аминотетразола
моногидратом протекает при выдерживании смеси исходных реагентов в отсутствии растворителя и
катализатора при температуре 160-170°C в течение 15-20 мин с образованием (7-арил-5-метил-4,7-ди-
гидротетразоло[1,5-a]пиримидин-6-ил)(фенил)метанонов.
Ключевые слова: мультикомпонентные реакции, реакция Биджинелли, 1-фенил-1,3-бутандион, 5-амино-
тетразол, 4,7-дигидротетразоло[1,5-a]пиримидин.
DOI: 10.31857/S0514749220030064
Среди различных классов органических
мультикомпонентные реакции
[10]. Так, для
соединений пиримидин и его производные
синтеза замещенных 4,7-дигдидротетразоло[1,5-a]
представляют особый практический интерес в
пиримидинов широко используют трехкомпонент-
области синтеза биологически активных соедине-
ную реакцию Биджинелли, применяя в качестве
ний. Известно, что пиримидиновое кольцо входит
амино-компоненты 5-аминотетразол [11-15].
в состав таких важнейших для жизнедеятельности
В предыдущих работах, посвященных синтезу
организма соединений как азотистые основания и
производных
4,7-дигидротетразоло[1,5-a]пирими-
витамины. В структуре молекул лекарственных
дина методом сплавления исходных реагентов, в
средств пиримидиновый фрагмент встречается
качестве β-дикарбонильной компоненты использо-
относительно часто [1]. Согласно литературным
вались эфиры, амиды ароил(гетерил)пировиноград-
данным производные дигидропиримидин-2-она и
ной и ацетоуксусной кислот, а также метиловый
его N,S-аналоги обладают широким спектром
эфир циннамоилпировиноградной кислоты [16]. С
биологической активности [2]. За счет способности
целью дальнейшего расширения ряда соединений
образовывать в организме прочные фермент-
данного класса нами был использован в качестве β-
субстратные комплексы наиболее перспективными
дикарбонильного соединения
1-фенил-1,3-бутан-
являются триазоло- и тетразоло[1,5-a]пиримидины,
дион.
среди которых обнаружены вещества с противо-
опухолевой [3], противовирусной [4, 5], противо-
В результате проведенных исследований было
установлено, что при выдерживании смеси
1-
микробной [6], гипогликемической [7], жаропони-
фенил-1,3-бутандиона, ароматического альдегида и
жающей [8] и антиоксидантной [9] активностями.
5-аминотетразола моногидрата в эквимолярных коли-
Наиболее распространенным методом получе-
чествах в отсутствии растворителя и катализатора
ния сопряженных азотсодержащих гетероцикли-
при температуре 160-170°С в течение 15-20 мин
ческих соединений на данный момент являются
реакция протекает с образованием в качестве
384
СИНТЕЗ (7-АРИЛ-5-МЕТИЛ-4,7-ДИГИДРОТЕТРАЗОЛО[1,5-a]ПИРИМИДИН-...
385
Схема 1.
O
Ar
O O
O
H
N
N
H2N
N
+
+
N
Ar
H
N
N N
N
N
H
1
2al
3
4al
Ar = C6H5 (a), 4-(CH3)3CC6H4 (b), 3-CH3OC6H4 (c), 4-C2H5OC6H4 (d), 2,5-(CH3O)2C6H3 (e), 3,4-(CH3O)2C6H3 (f),
4-(CH3)2NC6H4 (g), 3-BrC6H4 (h), 4-BrC6H4 (i), 2-ClC6H4 (j), 4-ClC6H4 (k), 4-NO2C6H4 (l).
единственного продукта
(7-арил-5-метил-4,7-ди-
соответственно. Неплоский бензоильный замести-
гидротетразоло[1,5-а]пиримидин-6-ил)(фенил)ме-
тель вследствие пространственных затруднений,
танонов 4a-l (схема 1).
создаваемых метильной группой, развернут на
значительный угол относительно гетероцикли-
Синтезированные соединения 4a-l представляют
ческой системы. Бромфенильный заместитель
собой светло-жёлтые или белые кристаллические
находится в псевдоаксиальном положении. В
вещества, растворимые в хлороформе, ДМСО,
кристалле молекулы связаны в одномерные цепи,
ДМФА, при нагревании — в этаноле, уксусной
вытянутые вдоль оси a, за счет МВС N5-H5···O1
кислоте, нерастворимые в воде, гексане.
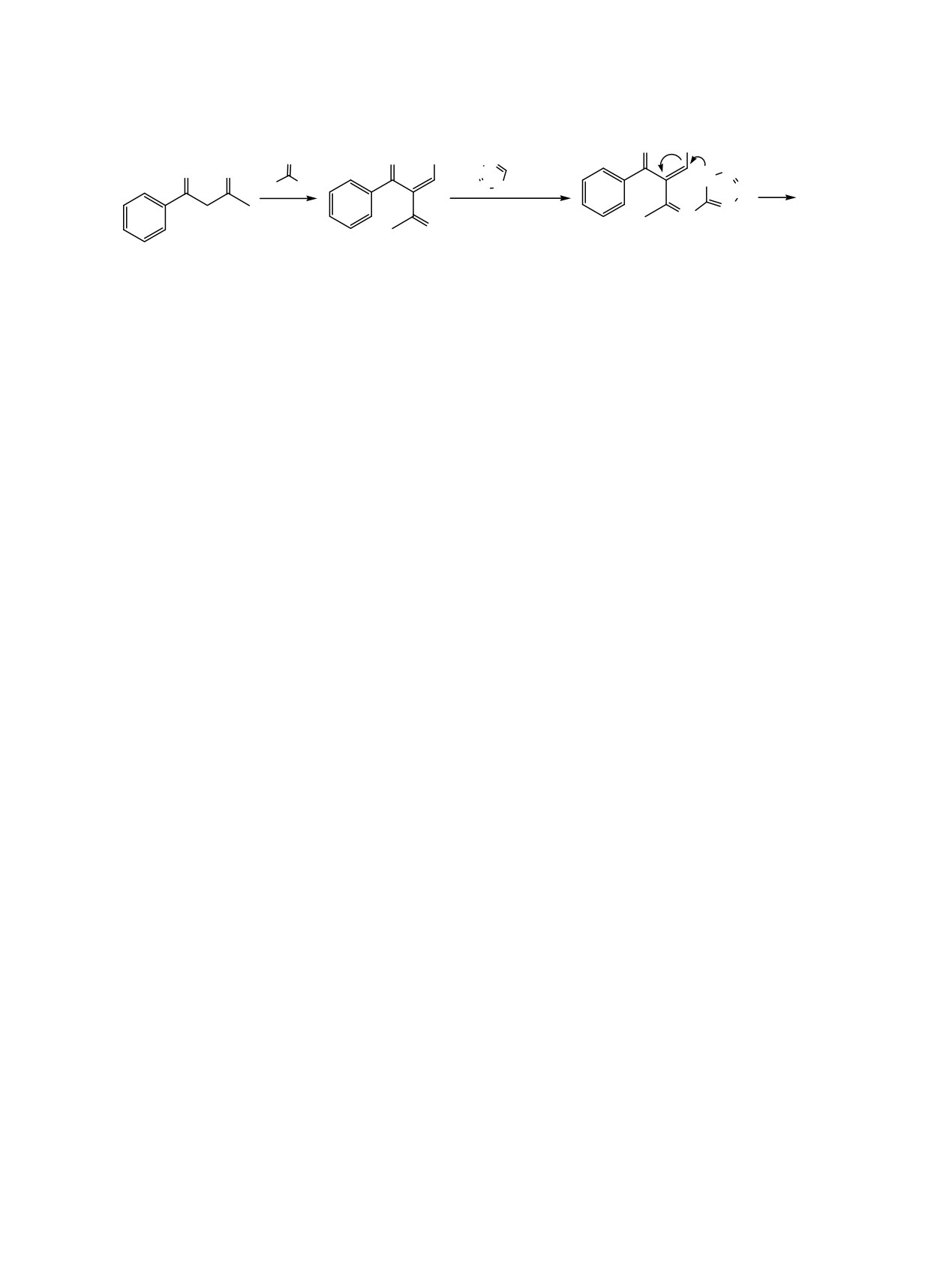
[1-x, y, z]; N5-H5 0.76(3), H5···O1 2.10(3), N5···O1
В ИК спектрах соединений 4a-l присутствуют
2.853(3) Å, угол N5H5O1 173(3)°.
характерные полосы поглощения валентных коле-
Результаты РСА зарегистрированы в Кемб-
баний сопряженной с двойной связью карбониль-
риджском центре кристаллографических данных
ной группы (С=О) при 1621-1675 см-1, а также NH
под номером CCDC 1952480 и могут быть запро-
связи при 3150-3230 см-1.
В спектрах ЯМР 1Н соединений 4a-l наблю-
cif.
даются характерные сигналы протонов метильной
Образование соединений 4a-l протекает, по-
группы в виде синглета при 1.87-1.89 м.д., синглет
видимому, по следующей схеме (схема 2).
протона в положении C7 гетероцикла при 6.64-
6.95 м.д., уширенный синглет протона NH группы
На первой стадии образуется непредельное
при 10.86-11.94 м.д. В спектре ЯМР 13С соедине-
соединение I1, которое затем атакуется 5-амино-
ния 4i присутствуют характерные сигналы атомов
углерода метильной группы в области 19.08 м.д.,
атома углерода в положении C7 при 59.45 м.д. и атома
углерода карбонильной группы при 193.94 м.д.
Характерным для масс-спектра соединения 4e
является наличие интенсивного пика молекуляр-
ного иона с m/z 378, а также пиков соответст-
вующих фрагментных ионов.
Для подтверждения структуры и установления
пространственного строения данного ряда веществ
был проведен рентгеноструктурный анализ моно-
кристалла соединения 4i, полученного методом
медленной кристаллизации из уксусной кислоты
(см. рисунок).
Соединение 4i кристаллизуется в центросиммет-
ричной пространственной группе моноклинной
сингонии. Пиримидиновый цикл принимает кон-
формацию искаженная ванна, атомы C1 и N5 отк-
Общий вид молекулы соединения 4i по данным РСА в
лоняются от плоскости N1C2C3C4 на 0.32 и 0.17 Å
тепловых эллипсоидах 50% вероятности.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 3 2020
386
ГЕЙН и др.
Схема 2.
O Ar
O
O Ar
N NH2
O O
N
N
HN
Ar
H
N
NH
N
4al
H2O
H2O
N N
O
I1
I2
тетразолом по карбонильной группе ацетильного
использована модель наездника. Окончательные
остатка с последующей циклизацией интермедиата
параметры уточнения: R1 0.0433, wR2 0.0905 [для
I2 в соединения 4a-l. Реакция протекает регио-
2863 отражений с I > 2σ(I)], R1 0.0661, wR2 0.1037
селективно вследствие того, что реакционная
(для всех 3818 независимых отражений), S 1.025.
способность карбонильной группы в положении C1
(5-Метил-7-фенил-4,7-дигидротетразоло[1,5-
1-фенил-1,3-бутандиона
1 понижена за счёт её
a]пиримидин-6-ил)(фенил)метанон
(4a). Смесь
сопряжения с фенильным заместителем.
1.62 г (0.01 моль) 1-фенил-1.3-бутандиона 1, 1 мл
(0.01 моль) бензальдегида 2a и 1.03 г (0.01 моль) 5-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
аминотетразола моногидрата 3 выдерживали при
температуре 160-170°С в течение 15 мин до прек-
ИК спектры сняты на ИК Фурье-спектрометре
ращения газовыделения и затвердевания реакцион-
ФСМ 1202 в вазелиновом масле. Спектры ЯМР 1Н,
ной смеси, смесь охлаждали, обрабатывали этано-
13С записаны на спектрометре Bruker Avance III HD
лом, выпавшие кристаллы отфильтровывали, пере-
400 с рабочей частотой 400 и 100 МГц соот-
кристаллизовывали из этанола. Выход 2.01 г (63%),
ветственно в ДМСО-d6, внутренний стандарт -
белые кристаллы, т.пл.
223-225°С (EtOH). ИК
ТМС. Масс-спектр соединения 4e зарегистрирован
спектр, ν, см-1: 3195 (NH), 1675 (С=О). Спектр
методом ультра-ВЭЖХ-МС на приборе Waters
ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.88 с (3H, CH3), 6.78 c
ACQUITY UPLC I-Class, колонка Acquity UPLC
(1H, CH), 7.25-8.36 м (10Наром) 11.09 уш.с (1H, NH).
BEH C18 1.7 мкм, масс-детектор Xevo TQD, иони-
Найдено, %: С 68.03; Н 4.66; N 22.01. C18H15N5O.
зация пробы проводилась электрораспылением в
Вычислено, %: С 68.13; Н 4.76; N 22.07. M 317.34.
режиме регистрации положительных ионов, темпе-
ратура источника 150°C, напряжение на капилляре
Соединения 4b-l получали аналогично.
3500-4000 В, напряжение на конусе
20-70 В.
{7-(4-трет-Бутилфенил)-5-метил-4,7-дигид-
Элементный анализ проведен на приборе Perkin
ротетразоло[1,5-a]пиримидин-6-ил}(фенил)-
Elmer 2400. Температура плавления измерена на
метанон
(4b). Выход 1.85 г (50%), кристаллы
приборе Melting Point M-565. Рентгеноструктур-
белого цвета, т.пл. 280-282°С (EtOH). ИК спектр,
ный анализ выполнен на монокристальном диф-
ν, см-1: 3150 (NH), 1621 (С=O). Спектр ЯМР 1Н
рактометре Xcalibur Ruby с ССD-детектором по
(ДМСО-d6), δ, м.д.: 1.21 c (9H, (CH3)3C), 1.87 с (3H,
стандартной методике (MoKα-излучение, 295(2) K,
CH3), 6.72 c (1H, CH), 7.17-7.54 м (9Hаром) 11.01
ω-сканирование с шагом 1°). Поглощение учтено
уш.с (1H, NH). Найдено, %: С 70.63; Н 6.02; N 4.15.
эмпирически с использованием алгоритма SCALE3
C22H23N5O. Вычислено, %: С 70.76; Н 6.21; N 4.28.
ABSPACK [17]. Сингония кристалла (C18H14BrN5O,
M 373.45.
M 396.25) моноклинная, пространственная группа
P21/c, a 7.2663(17), b 18.978(5), c 11.930(3) Å, β
[7-(3-Метоксифенил)-5-метил-4,7-дигидро-
92.42(2)°, V 1643.8(7) Å3, Z 4, dвыч 1.601 г/см3; μ
тетразоло[1,5-a]пиримидин-6-ил](фенил)мета-
2.518 мм-1. Структура расшифрована с помощью
нон (4c). Выход 2.25 г (65%), кристаллы белого
программы Superflip [18] и уточнена полномат-
цвета, т.пл. 230-232°С (EtOH). ИК спектр, ν, см-1:
ричным МНК по F2 в анизотропном приближении
3195 (NH), 1675 (С=С). Спектр ЯМР 1Н (ДМСО-d6),
для всех неводородных атомов с использованием
δ, м.д.: 1.87 с. (3H, CH3), 3.68 c (3H, CH3O), 6.72
программы SHELXL [19] с графическим интер-
c (1H, CH), 6.76-7.66 м (9Наром) 11.0 уш.с (1H,
фейсом OLEX2 [20]. Атом водорода группы NH
NH). Найдено,
%: С
65.51; Н
4.81; N
20.05.
уточнен независимо в изотропном приближении.
C19H17N5O2. Вычислено,
%: С 65.69; Н 4.93; N
При уточнении остальных атомов водорода
20.16. M 347.37.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 3 2020
СИНТЕЗ (7-АРИЛ-5-МЕТИЛ-4,7-ДИГИДРОТЕТРАЗОЛО[1,5-a]ПИРИМИДИН-...
387
[7-(4-Этоксифенил)-5-метил-4,7-дигидротет-
[7-(4-Бромфенил)-5-метил-4,7-дигидротет-
разоло[1,5-a]пиримидин-6-ил](фенил)метанон
разоло[1,5-a]пиримидин-6-ил](фенил)метанон
(4d). Выход 1.9 г (53%), кристаллы белого цвета,
(4i). Выход 1.95 г (49%), бесцветные кристаллы,
т.пл. 203-206°С (EtOH). ИК спектр, ν, см-1: 3194
т.пл. 198-200°С. ИК спектр, ν, см-1: 3230 (NH),
(NH), 1652 (С=O). Спектр ЯМР 1Н (ДМСО-d6), δ,
1629 (С=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
м.д.: 1.27 т (3Н, CH3CH2O, J 8.0 Гц ), 1.88 с. (3H,
1.87 с (3H, CH3), 6.79 c (1H, CH), 7.28-8.34 м
CH3), 3.96 к (2H, CH3CH2O, J 8.0 Гц), 6.72 c (1H,
(9Наром), 11.15 уш.с (1H, NH). Спектр ЯМР 13С
CH), 6.83-8.34 м (9Наром), 11.03 уш.с (1H, NH).
(ДМСО-d6), δ, м.д.: 19.08, 59.45, 106.74, 121.82,
Найдено, %: С 66.32; Н 5.19; N 19.15. C20H19N5O2.
128.03, 128.71, 129.7, 131.63, 132.2, 139.22, 139.97,
Вычислено, %: С 66.47; Н 5.30; N 19.38. M 361.40.
148.67, 193.94. Найдено, %: С 54.49; Н 3.44; N
17.61. C18H14BrN5O. Вычислено, %: С 54.56; Н 3.56;
[7-(2,5-Диметоксифенил)-5-метил-4,7-дигид-
N 17.67. M 396.25.
ротетразоло[1,5-a]пиримидин-6-ил](фенил)ме-
танон (4e). Выход 2.66 г (71%), кристаллы желтого
[7-(2-Хлорфенил)-5-метил-4,7-дигидротет-
цвета, т.пл. 242-244°С (EtOH). ИК спектр, ν, см-1:
разоло[1,5-a]пиримидин-6-ил](фенил)метанон
3195 (NH), 1626 (С=O). Спектр ЯМР 1Н (ДМСО-d6),
(4j). Выход 2.66 г (76%), кристаллы белого цвета,
δ, м.д.: 1.84 с (3H, CH3), 3.56 c и 3.61 с (6H, 2CH3O),
т.пл. 217-219°С (EtOH). ИК спектр, ν, см-1: 3190
6.62 д (1H, CH, J 3.2 Гц), 6.79-7.56 м (8Наром) 10.86
(NH), 1629 (С=O). Спектр ЯМР 1Н (ДМСО-d6), δ,
уш.с (1H, NH). Масс-спектр, m/z (Iотн, %): 378 (100)
м.д.: 1.88 с (3H, CH3), 7.15 c (1H, CH), 7.31-8.35 м
[M + H]+. Найдено, %: С 63.42; Н 5.95; N 18.43.
(9Наром), 11.17 уш.c (1H, NH). Найдено, %: С 61.42;
C20H19N5O3. Вычислено, %: С 63.65; Н 6.07; N
Н 3.91; N 19.89. C18H14ClN5O. Вычислено, %: С
18.56. M 377.39.
61.46; Н 4.01; N 19.91. M 351.78.
[7-(3,4-Диметоксифенил)-5-метил-4,7-дигид-
[7-(4-Хлорфенил)-5-метил-4,7-дигидротет-
ротетразоло[1,5-a]пиримидин-6-ил](фенил)мета-
разоло[1,5-a]пиримидин-6-ил](фенил)метанон
нон (4f). Выход 2.22 г (59%), кристаллы жёлтого
(4k). Выход 2.75 г (78%), кристаллы светло-жёл-
цвета, т.пл. 221-223°С (EtOH). ИК спектр, ν, см-1:
того цвета, т.пл. 225-227°С (EtOH). ИК спектр, ν,
3195 (NH), 1675 (С=O). Спектр ЯМР 1Н (ДМСО-
см-1: 3170 (NH),
1675 (С=O). Спектр ЯМР 1Н
d6), δ, м.д.: 1.89 с. (3H, CH3), 3.66 с и 3.69 с (6H,
(ДМСО-d6), δ, м.д.: 1.84 с (3H, CH3), 6.80 c (1H,
2CH3O), 6.68 c (1H, CH), 6.79-7.60 м (8Наром) 11.94
CH), 7.37-7.66 м (9Наром), 11.21 уш.с (1H, NH).
уш.c (1H, NH). Найдено, %: С 63.53; Н 5.94; N
Найдено, %: С 61.39; Н 3.93; N 19.89. C18H14ClN5O.
18.47. C20H19N5O3. Вычислено, %: С 63.65; Н 6.07;
Вычислено, %: С 61.46; Н 4.01; N 19.91. M 351.78.
N 18.56. M 377.39.
[7-(4-Нитрофенил)-5-метил-4,7-дигидротетра-
[7-(4-Диметиламинофенил)-5-метил-4,7-ди-
золо[1,5-a]пиримидин-6-ил](фенил)метанон (4l).
гидротетразоло[1,5-a]пиримидин-6-ил](фенил)-
Выход 2.49 г (69%), кристаллы белого цвета, т.пл.
метанон (4g). Выход 1.93 г (54%), кристаллы жёл-
185-187°С (EtOH). ИК спектр, ν, см-1: 3175 (NH),
того цвета, т.пл. 244-246°С. ИК спектр, ν, см-1:
1675 (С=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
3150 (NH), 1621 (С=O). Спектр ЯМР 1Н (ДМСО-
1.86 с (3H, CH3), 6.95 c (1H, CH), 7.44-8.16 м
d6), δ, м.д.: 1.89 с (3H, CH3), 2.84 с (6H, (CH3)2N),
(9Наром) 11.27 уш.с (1H, NH). Найдено, %: С 59.65;
6.64 c (1H, CH), 6.60-7.58 м (9Наром), 10.95 уш.с
Н 3.77; N 23.08. C18H14N6O3. Вычислено, %: С
(1H, NH). Найдено, %: С 66.58; Н 5.43; N 23.21.
59.67; Н 3.89; N 23.19. M 362.34.
C20H20N6O. Вычислено, %: С 66.65; Н 5.59; N 23.32.
M 360.41.
КОНФЛИКТ ИНТЕРЕСОВ
[7-(3-Бромфенил)-5-метил-4,7-дигидро-
Авторы заявляют об отсутствии конфликта
тетразоло[1,5-a]пиримидин-6-ил](фенил)мета-
интересов.
нон (4h). Выход 2.44 г (62%), кристаллы белого
цвета, т.пл. 234-235°С. ИК спектр, ν, см-1: 3170
СПИСОК ЛИТЕРАТУРЫ
(NH), 1675 (С=O). Спектр ЯМР 1Н (ДМСО-d6), δ,
м.д.: 1.87 с (3H, CH3), 6.79 c (1H, CH), 7.29-7.58 м
1. Taylor R.D., MacCoss M., Lawson A.D. J. Med. Chem.
(9Наром), 11.16 уш.с (1H, NH). Найдено, %: С 54.42;
2014, 57, 5845-5859. doi 10.1021/jm4017625
Н 3.48; N 17.53. C18H14BrN5O. Вычислено, %: С
2. Шкурко О.П., Толстикова Т.Г., Седова В.Ф. Усп.
54.56; Н 3.56; N 17.67. M 396.24.
хим. 2016, 85, 1056-1096. [Shkurko O.P, Tolstikova T.G.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 3 2020
388
ГЕЙН и др.
Sedova V.F. Russ. Chem. Rev. 2016, 85, 1056-1096.]
11. Murlykina M.V., Morozova A.D., Zviagin I.M.,
doi 10.1070/RCR4586
Sakhno Y.I., Desenko S.M., Chebanov V.A. Front.
3. Popova E.A., Protas A.V., Trifonov R.E. Anticancer
Chem. 2018, 6, 527-569. doi 10.3389/fchem.2018.00527
Agents Med. Chem.
2017,
17,
1856-1868. doi
12. Sakho Y.I., Desenko S.M., Shishkina S.V., Shishkin O.V.,
10.2174/1871520617666170327143148
Sysoyev D.O., Groth U., Kappe C.O., Chebanov V.A.
4. Русинов В.Л., Чарушин В.Н., Чупахин О.Н. Изв. АН.
Tetrahedron. 2008, 64, 11041-11049. doi 10.1016/
Сер. хим. 2018, 67, 573-599. [Rusinov V.L., Charu-
j.tet.2008.09.089
shin V.N., Chupakhin O.N. Russ. Chem. Bull. 2018, 67,
13. Maleki A., Ravaghi P., Aghaei M., Movahed H. Res.
573-599.] doi 10.1007/s11172-018-2113-8
Chem. Intermed. 2017, 43, 5485-5494. doi 10.1007/
5. Dougherty A.M., Guo H., Westby G., Liu Y., Simsek E.,
s11164-017-2941-4
Guo J.-T., Mehta A., Norton P., Gu B., Block T.,
14. Kour P., Singh V.P., Khajuria B., Singh T., Kumar A.
Cuconati A. Antimicrob. Agents Chemother. 2007, 51,
Tetrahedron Lett. 2017, 58, 4179-4185. doi 10.1016/
4427-4437. doi 10.1128/AAC.00541-07
j.tetlet.2017.09.052
6. Гейн В.Л., Мишунин В.В., Цыплякова Е.П.,
15. Dolzhenko A.V. Heterocycles. 2017, 94, 1819-1846.
Винокурова О.В., Вахрин М.И. Хим.-фарм. ж. 2009,
doi 10.3987/REV-17-867
43, 10-12. [Gein V.L., Mishunin V.V., Tsyplyakova E.P.,
16. Гейн В.Л., Замараева Т.М. ЖОХ. 2016, 86, 160-162.
Vinokurova O.V., Vakhrin M.I. Pharm. Chem. J. 2009,
[Gein V.L., Zamaraeva T.M. Russ. J. Gen. Chem. 2016,
43, 652-654.] doi 10.1007/s11094-010-0373-1
86, 196-198.] doi 10.1134/S1070363216010321
7. Гейн В.Л., Замараева Т.М., Мишунин В.В., Котегов В.П.
17. CrysAlisPro, Agilent Technologies, Version 1.171.37.33
ЖОХ. 2016, 86, 258-262. [Gein V.L., Zamaraeva T.M.,
(release 27-03-2014 CrysAlis171 .NET)
Mishunin V.V., Kotegov V.P. Russ. J. Gen. Chem.
2016, 86, 286-290.] doi 10.1134/S1070363216020134
18. Palatinus L., Chapuis G. J. Appl. Cryst. 2007, 40, 786-
8. Гейн В.Л., Панова О.С., Сыропятов Б.Я., Ковале-
790. doi 10.1107/S0021889807029238
ва М.Ю. Пат. 2413730. РФ.
19. Sheldrick G.M. ActaCryst. 2015, C71, 3-8. doi 10.1107/
9. Raju C., Madhaiyan K., Spridhar R., Ramakrishna S. RSC
S2053229614024218
Adv. 2012, 2, 11657-11663. doi 10.1039/C2RA21330C
20. Dolomanov O.V., Bourhis L.J., Gildea R.J, Howard J.A.K.,
10. Cioc R.C., Ruijter E., Orru R.V.A. Green. Chem. 2014,
Puschmann H. J. Appl. Cryst. 2009, 42, 339-341. doi
16, 2958-2975. doi 10.1039/C4GC00013G
10.1107/S0021889808042726
Synthesis of (7-Aryl-5-methyl-4,7-dihydrotetrazolo[1,5-a]-
pyrimidin-6-yl)(phenyl)methanones
V. L. Geina, *, A. N. Prudnikovaa, A. A. Kurbatovaa, and M. V. Dmitrievb
a Perm State Pharmaceutical Academy, 614990, Russia, Perm, ul. Polevaya 2
*e-mail: geinvl48@mail.ru
b Perm State University, 614990, Russia, Perm, ul. Bukireva 15
Received September 17, 2019; revised January 16, 2020; accepted January 17, 2020
Three-component reaction of
1-phenyl-1,3-butandione with aromatic aldehydes and
5-aminotetrazole
monohydrate proceeds in the absence of any solvent and catalyst at a temperature 160-170°C for 15-20 min
with the formation of (7-aryl-5-methyl-4,7-dihydrotetrazolo[1,5-a]pyrimidin-6-yl)(phenyl)methanones.
Keywords: multicomponent reactions, Biginelli reaction, 1-phenyl-1,3-butandione, 5-aminotetrazole, 4,7-
dihydrotetrazolo[1,5-a]pyrimidine
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 3 2020