ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 4, с. 501-513
УДК 547.812; 548.737; 547.814;1 547.825
СИНТЕЗ МАКРОЦИКЛИЧЕСКИХ ДЕПСИПЕПТИДОВ
НА ОСНОВЕ ПАССЕРИНИ - «СLICK» СТРАТЕГИИ
© 2020 г. И. В. Кутовая, В. Г. Ненайденко*
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова», химический факультет,
119991, Россия, г. Москва, Ленинские горы 1, стр. 3
*e-mail: nenajdenko@gmail.com
Поступила в редакцию 10 января 2020 г.
После доработки 10 февраля 2020 г.
Принята к публикации 12 февраля 2020 г.
Исследована комбинация реакций Пассерини - «click» как метод синтеза триазолсодержащих макро-
циклических депсипептидов. Показано, что ключевыми факторами, определяющими направление
макроциклизации, являются длина линейного депсипептида и наличие жестких фрагментов. Установ-
лено, что предложенная стратегия позволяет синтезировать мономерные (12-13-членные) и димерные
(24-28-членные) триазолсодержащие циклические депсипептиды с выходами до 97%.
Ключевые слова: реакция Пассерини, триазол, макроцикл, депсипептид, селективность.
DOI: 10.31857/S0514749220040011
Несмотря на бурное развитие органической
пептидам, в связи с чем фрагмент циклических
химии, поиск новых синтетических подходов к
депсипептидов является основой многих природ-
построению углерод-углеродных связей, несо-
ных антибиотиков [6], противогрибковых, проти-
мненно, остается актуальным [1]. Практическая
вовирусных антибактериальных и противовос-
важность химического превращения определяется
палительных препаратов
[7-9]. Синтетические
многими факторами, например, количеством обра-
аналоги стереокальпина А [10], вальгамицинов,
зовавшихся новых связей за одну стадию, затрата-
викеамида А [11], одоамида [12] и многих других
ми различных ресурсов (времени, труда, реаген-
природных циклических депсипептидов являют-
тов, растворителей и т.д.) и объемом отходов [2].
ся перспективными кандидатами для применения
Многокомпонентные реакции (МКР) позволяют
в медицинской практике. Отдельный интерес для
получать продукты с высокой молекулярной слож-
медицинской химии представляет высокая про-
ностью, а также минимизируют расходы. Именно
тивоопухолевая активность циклических деспси-
поэтому МКР являются очень эффективным ин-
пептидов [13].
струментом в органической химии. Особенно про-
Замыкание цикла при синтезе циклических
дуктивными многокомпонентными реакциями яв-
депсипептидов чаще всего проводится путем лак-
ляются реакции Уги [3] и Пассерини [4], которые
тонизации динейного прекурсора, при этом дан-
используют в качестве ключевых реагентов изо-
ная стадия зачастую сопровождается некоторыми
цианиды [5]. Данная работа посвящена изучению
сложностями, такими как невысокие выходы и
комбинации реакций Пассерини - «click» как ме-
образование сложной смеси продуктов при нали-
тода синтеза макроциклических депсипептидов.
чии в исходном соединении нескольких реакци-
Депсипептиды - это аналоги пептидов, в кото-
онных центров [14]. Мы решили повысить эффек-
рых одна или несколько амидных связей замеще-
тивность такого процесса и адаптировать приме-
ны сложноэфирными группами. Такие соединения
ненную ранее стратегию [15, 16] МКР - «click»
часто не уступают в биологической активности
[17] для синтеза циклических депсипептидов.
501
502
КУТОВАЯ, НЕНАЙДЕНКО
Схема 1.
R1
O
H
N
NC
R1
Реакция Пассерини
CuAAC
3
N
макроциклы
O
COOH
O
O
N
3
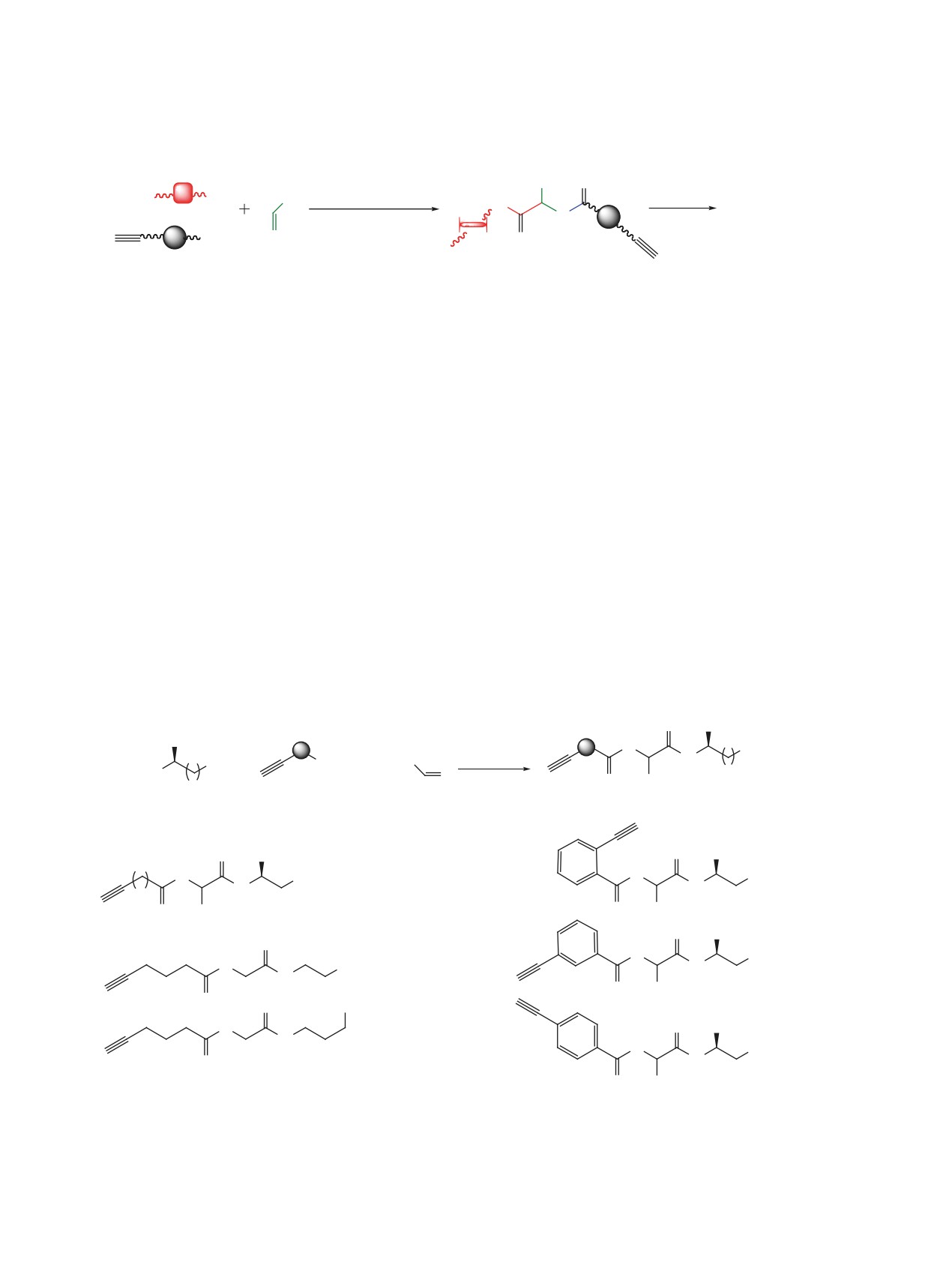
Предлагаемый нами метод включает образование
был синтезирован ряд линейных депсипептидов
линейного депсипептида при помощи реакции
3a-i с выходами до 98% (схема 2). Также было
Пассерини между азидоизоцианидом, альдегидом
проведено варьирование альдегидной и изоци-
и ацетилен-содержащей карбоновой кислотой и
анидной компоненты в реакции Пассерини, для
последующее медь-катализируемое ацетилен-а-
этого были осуществлены реакции (S)-(3-азидо-
зидное циклоприсоединение (схема 1).
2-изоцианопропил)бензола 1a с изомасляным аль-
дегидом и бензальдегидом. Для варьирования изо-
Литературные данные свидетельствуют, что
нитрильной компоненты были выбраны 1-азидо-
чаще всего реакция Пассерини проводится в мета-
2-изоцианоэтаном 1b и 1-азидо-3-изоцианопропан
ноле при комнатной температуре [18], модельные
1c [19], в результате чего целевые депсипептиды
эксперименты были проведены нами в этих ус-
были получены с выходами до 73%. К сожалению,
ловиях. Получив высокие результаты в реакциях
попытка ввести в реакцию ацетон не увенчалась
формальдегида с (S)-(3-азидо-2-изоцианопропил)-
успехом.
бензолом 1a, а также пентиновой 2a и гексиновой
2b кислотами (выходы 96 и 98% соответственно)
«Click»-макроциклизация полученных линей-
мы выбрали эти условия в качестве оптимальных.
ных депсипептидов 3a-i проводилась в каталити-
На основе гибкоцепных алифатических ацетилен-
ческой системе CuI/iPr2NEt/лутидин/MeCN при
содержащих кислот 2a, b, а также жестких орто-,
сильном разбавлении (0.5 mM), и привела к об-
мета-, и пара-этинилбензойных кислот
2c-e
разованию соответствующих макроциклических
Схема 2.
O
R2
R2
O
N3
R1
MeOH
N
N3
COOH
m
+
+
H
CN
O
m
O
R1
1a-c
2a-e
3-i
O
Bn
O Bn
3g, 86%
O
N
O
N3
3
n
N
N
H
H
O
R1
O
R1
O
Bn
3h, 88%
O
O
N3
O
N3
3e, 69%
N
N
H
H
O
R1
O
O
N3
O
3f, 62%
O Bn
3i, 89%
N
H
O
N3
O
N
H
O
R1
3a, n = 2, R1 = H (96%); 3b, n = 3, R1 = H (98%); 3c, n = 3, R1 = i-Pr (73%), dr 1:1;
3d, n = 3, R1 = Ph (45%), dr 1:1.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ МАКРОЦИКЛИЧЕСКИХ ДЕПСИПЕПТИДОВ
503
Таблица 1. Макроциклизация ацетилен-содержащих азидов 3a-c, 3g-i.
Bn
O
N N
Bn
O
H
CuI (2 экв), i-Pr2NEt,
O
N
N
R1
O
O
2,6- лутидин
O
N HN
O
N
+
Bn
R1
MeCN (0.5 мM),
O
R1
HN
N
R1
N
N
20°C, Ar
O
H
N3
O
Bn
N
N
O
мономер
O
димер
2a-c, 3g-i
4a-c, 4g-i
Кислотная компонента
Альдегид
Размер цикла, атомов
Продукт
Выход, %
H
12 + 24
Мономер+димер
4a
67
H
13
Мономер
4b
55
i-Pr, H
13
Мономер
4c
52
H
12 + 24
Мономер+димер
4g
66
H
26
Димер
4h
80
H
28
Димер
4i
45
пептидомиметиков 4a-c и 4g-i с выходами до 80%
цатичленного мономеров и двадцатичетырехчлен-
(табл. 1). В случае депсипептидов 3d-f реакция не
ного димера. Тенденция к образованию смеси
увенчалась успехом, что вероятно связано с низ-
мономера и димера (размер цикла 12 и 24 соот-
кой растворимостью образующихся макроциклов.
ветственно) наблюдается и для депсипептида 4g,
Циклические депсипептиды, полученные из гек-
полученного из орто-этинилбензойной кислоты
синовой кислоты 2c, представляли собой моно-
2c. Наличие жестких мета- и пара-фениленовых
мерные продукты 4b и 4c с размером цикла 13 ато-
фрагментов способствует образованию димерных
мов вне зависимости от природы используемого
альдегида, в то время как производное пентиновой
продуктов, в результате чего были выделены 26- и
кислоты 4a было выделено в виде смеси двенад-
28-членные депсипептиды 4h и 4i.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
504
КУТОВАЯ, НЕНАЙДЕНКО
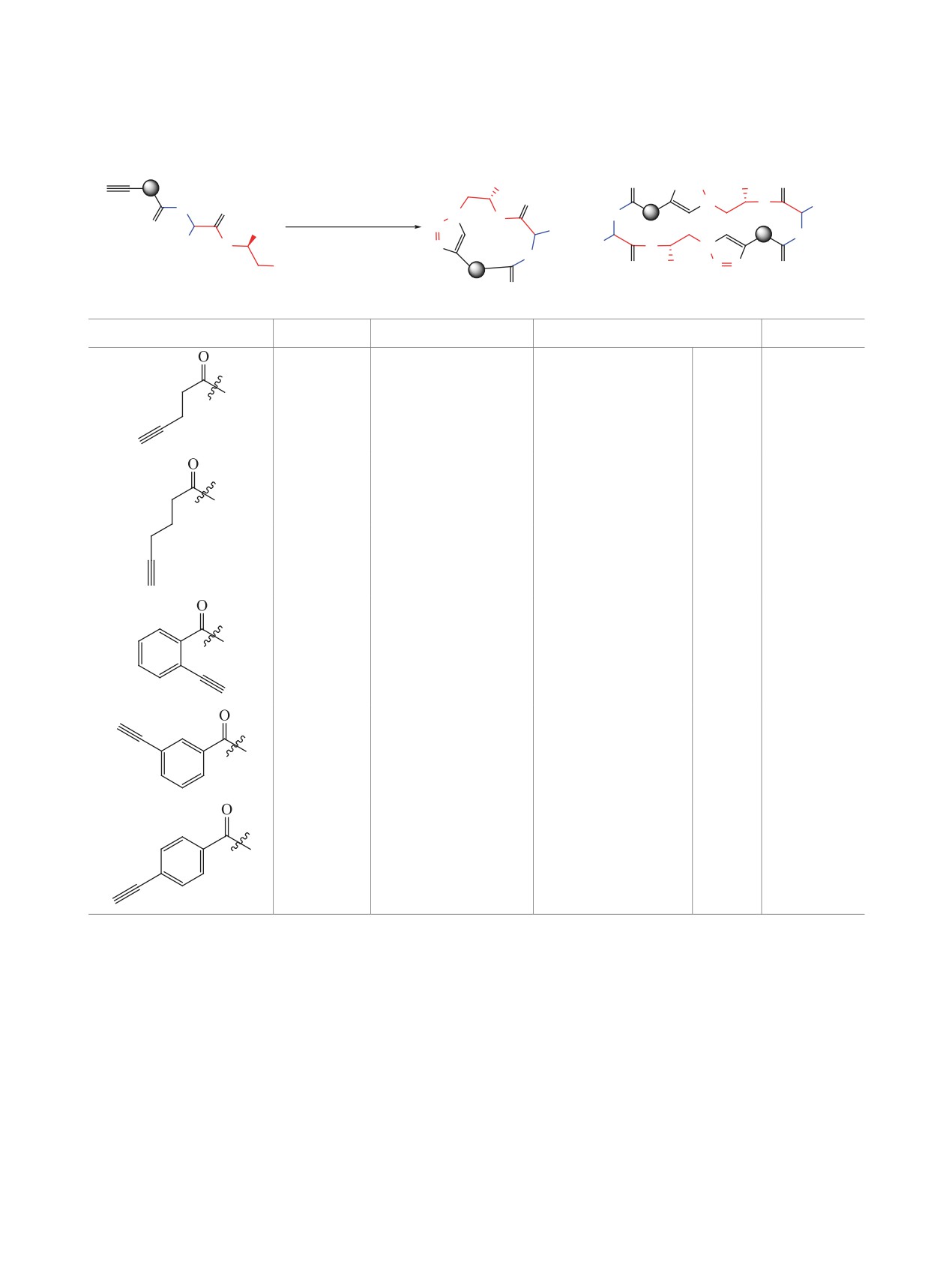
Схема 3.
O
Bn
Bn
O
N3
F3C
OH
MeOH
N3
N
+
COOH
+
CN
H
O
R1
OMe
1d
2a-e
3j-n
O
Bn
O Bn
O
N3
3j, n = 2 (95%)
3l (100%)
n
N
3k, n = 3 (87%)
O
N3
H
N
O
CF
3
H
O
CF3
O
Bn
O Bn
3n (32%)
3m (100%)
O
N3
O
N3
N
N
H
H
O
CF
O
CF3
3
Известно, что трифторметильная группа яв-
смеси мономера и димера с размерами циклов 13
ляется важным фармакофором [20], около 25%
и 26 атомов.
лекарств содержат в своей структуре фтор [21],
Таким образом, комбинация реакций Пассери-
кроме того, введение такого сильноакцепторного
ни - Click представляет собой эффективный ме-
заместителя может кардинально менять свойства
тод синтеза макроциклических депсипептидов.
химических соединений [22]. Учитывая это, мы ре-
Получена серия азид- и этинил-содержащих ли-
шили изучить получение трифторметилированных
нейных депсипептидов, в том числе фторирован-
производных и исследовать особенности макро-
ных, с выходами до 100%. Показано, что в целом
циклизации полученных депсипептидов (схема 3).
ход CuAAC схож с циклизацией продуктов реак-
Для этого на основе реакции Пассерини азидоизо-
ции Уги, и ключевыми факторами, определяющи-
цианида 1a с полуацеталем трифторуксусного аль-
ми направление макроциклизации, также являют-
дегида и ацетиленсодержащими кислотами 2a-e
ся расстояние между ацетиленовым и азидным
была синтезирована серия депсипептидов 3j-n
концами линейного депсипептида и наличие жест-
преимущественно с очень высокими выходами
ких фрагментов. Внедрение трифторметиленовой
(32-100%).
группы в линейный прекурсор мало влияет на
Полученные CF3-содержащие депсипептиды
CuAAC. Присутствие жестких мета- и пара-фе-
были помещены в условия CuAAC (каталитиче-
ниленовых фрагментов способствует образованию
ская система CuI/iPr2NEt/лутидин/MeCN, сильное
димерных 26- и 28-членных продуктов. В резуль-
разбавление 0.5 mM), в результате чего был выде-
тате работы мы установили, что предложенная
лен ряд циклических депсипептидов с высокими
Пассерини-«click» стратегия позволяет синтези-
выходами (51-97%, табл. 2). Макроциклизация
ровать мономерные (12-13-членные) и димерные
производного пентиновой кислоты 3j, а также эти-
(24-28-членные) триазолсодержащие депсипепти-
нилбензойных кислот 3l-n протекала аналогично
ды с выходами до 97%.
их нефторированным аналогам, при этом образо-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
вывались смеси мономеров и димеров для соеди-
нений 4j и 4l (размеры циклов 12 и 24), а также
Спектры ЯМР 1Н и 13С регистрировали на
димерные продукты 4m и 4n в случае мета- и
спектрометре Bruker AMX 400 (рабочая частота
пара-этинилбензойных кислот (размеры циклов
400 и 100 МГц соответственно), ЯМР 19F реги-
26 и 28 соответственно). Производное гексиновой
стрировали на спектрометре AGILENT 400-MR
кислоты 4k, напротив же, было выделено в виде
(рабочая частота 280 МГц) в CDCl3 или DMSO-d6.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ МАКРОЦИКЛИЧЕСКИХ ДЕПСИПЕПТИДОВ
505
Таблица 2. Макроциклизация ацетилен-содержащих азидов 3j-n.
Bn
O
N N
Bn
O
H
O
CuI (2 экв), i-Pr2NEt,
N
N
CF3
O
O
2,6- лутидин
N HN
O
N
O
Bn
CF3
+
MeCN (0.5 mM),
O
F3C
HN
20°C, Ar
N
F3C
N
N
O
H
N3
O Bn
N
N
O
мономер
O
димер
3j-n
4j-n
Кислотная компонента
Размер цикла, атомов
Продукт
Выход, %
12 + 24
Мономер + димер
4j
53
13 + 26
Мономер + димер
4k
51
12 + 24
Мономер + димер
4l
97
26
Димер
4m
61
28
Димер
4n
74
В качестве внутреннего стандарта использовали
Колоночная хроматография проводилась на сили-
ТМС. Спектры ИК снимали на спектрофотометре
кагеле фирмы Merck (63-200 mesh).
«UR-20» в тонком слое для жидкостей и вазелино-
Общая методика реакции Пассерини.
вом масле для твердых веществ и ThermoNicolet
Альдегид (1 ммоль), изоцианид (1 ммоль) и кисло-
(США) IR-10 в таблетке KBr. ТСХ анализ прово-
ту (1 ммоль) растворяли в MeOH (2 мл) после чего
дили на пластинах «Silufol UV-254», проявление
производили в растворе нингидрина, в лучах уль-
раствор выдерживали при комнатной температуре
трафиолетовой лампы или в растворе Ce(SO4)2
в течение 2-6 дней (контроль реакции по ТСХ).
с фосформолибденовой и серной кислотами.
После окончания реакции растворитель отгоняли
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
506
КУТОВАЯ, НЕНАЙДЕНКО
на роторном испарителе, и очищали продукты 3
Масс-спектр (ESI-MS), m/z: найдено 329.1611 [M +
при помощи колоночной хроматографии (элюент
H]+, C17H21N4O3+, вычислено 329.1608.
гексан-этилацетат, либо дихлорметан-метанол).
2-{[(S)-1-Азидо-3-фенилпропан-2-ил]ами-
(S)-2-[(1-Азидо-3-фенилпропан-2-ил)ами-
но}-2-оксо-1-фенилэтил гекс-5-иноат (3d). Выход
но]-2-оксоэтил пент-4-иноат (3a). Выход 0.301 г
0.182 (45%), коричневое масло (смесь диастере-
(96%), желтоватое масло, [α]D25 +0.8 (c 0.1, MeOH).
омеров 1:1), [α]D25 -3.0 (c 0.1, MeOH). ИК спектр
ИК спектр (KBr), ν, см-1: 3313 уш.с (NH), 2092
(KBr), ν, см-1: 3389 уш.с (NH), 2104 (N3, C≡C),
(N3, C≡C), 1761 (CO), 1674 (CO). Спектр ЯМР
1791 (CO), 1722 (CO). Спектр ЯМР 1H (400 MГц,
1H (400 MГц, CDCl3, 25°C), δ, м.д.: 2.01 т (1H, J
CDCl3, 25°C), δ, м.д.: 1.83-1.90 м (5H), 1.99-2.01 м
2.5 Гц), 2.45-2.60 м (4H), 2.78-2.88 м (2H), 3.28-
(4H), 2.25-2.31 м (3H), 2.50-2.62 м (8H), 2.81-2.93
3.47 м (2H), 4.27-4.32 м (1H), 4.47-4.56 м (2H),
м (3H), 3.35-3.50 м (3H), 4.30-4.40 м (1H), 6.07
6.55 уш.д (1H, J 8.3 Гц), 7.14-7.29 м (5H). Спектр
д (1H, J 15.8 Гц), 7.12-7.39 м (16H), 7.45-7.49 м
ЯМР 13C (100 MГц, CDCl3, 25°C), δ, м.д.: 13.9,
(2H), 8.08-8.12 м (2H). Спектр ЯМР 13C (100 MГц,
32.7, 37.2, 49.5, 52.4, 62.6, 69.4, 82.1, 126.6, 128.4,
CDCl3, 25°C), δ, м.д.: 17.6, 17.7, 23.2, 32.5, 32.6,
128.9, 136.3, 166.4, 169.9. Масс-спектр (ESI-MS),
37.2, 37.5, 48.7, 49.7, 52.6, 52.9, 69.2, 69.5, 75.2,
m/z: найдено 315.1449 [M + H]+, C16H19N4O3+, вы-
75.3, 82.9, 83.0, 126.8, 126.9, 127.3, 128.4, 128.6,
числено 315.1452.
128.7, 128.8, 128.9, 129.0, 129.1, 129.2, 129.3, 130.0,
(S)-2-[(1-Азидо-3-фенилпропан-2-ил)ами-
133.6, 135.0, 136.5, 161.3, 168.2, 171.1, 171.5. Масс-
но]-2-оксоэтил гекс-5-иноат (3b). Выход 0.32 г
спектр (ESI-MS), m/z: найдено 405.1921 [M + H]+,
(98%), желтоватое масло, [α]D25 +2.2 (c 0.1, MeOH).
C23H25N4O3+, вычислено 405.1922.
ИК спектр (KBr), ν, см-1: 3320 (NH), 2096 (N3,
2-[(2-Азидоэтил)амино]-2-оксоэтил гекс-5-и-
C≡C), 1760 (CO), 1673 (CO). Спектр ЯМР 1H
ноат (3e). Выход 0.165 г (69%), бесцветное мас-
(400 MГц, CDCl3, 25°C), δ, м.д.: 1.82-1.89 м (2H),
ло. ИК спектр (KBr), ν, см-1: 3301 уш.с (NH), 2089
2.01 т (1H, J 2.6 Гц), 2.27-2.31 м (2H), 2.55 т (2H,
(N3, C≡C), 1763 (CO), 1685 (CO). Спектр ЯМР 1H
J 7.4 Гц), 2.82-2.94 м (2H) 3.34-3.48 м (2H), 4.32-
(400 MГц, CDCl3, 25°C), δ, м.д.: 1.79-1.88 м (2H),
4.36 м (1H), 4.49-4.58 м (2H), 6.31 уш.д (1H, J
1.96-2.00 м (1H), 2.22-2.28 м (2H), 2.55 т (2H, J
8.2 Гц), 7.18-7.34 м (5H). Спектр ЯМР 13C (100 MГц,
7.3 Гц), 3.44-3.45 м (4H), 4.56 с (2H), 6.65 уш.с
CDCl3, 25°C), δ, м.д.: 17.5, 23.1, 32.2, 37.4, 49.4,
(1H). Спектр ЯМР 13C (100 MГц, CDCl3, 25°C),
52.5, 62.7, 69.5, 82.8, 126.9, 128.7, 129.1, 136.4,
δ, м.д.: 17.5, 23.1, 32.2, 38.4, 50.4, 62.6, 69.4, 82.8,
166.6, 171.3. Масс-спектр (ESI-MS), m/z: найде-
167.5, 171.5. Масс-спектр (ESI-MS), m/z: найде-
но 329.1600 [M + H]+, C17H21N4O3+, вычислено
но 239.1136 [M + H]+, C10H15N4O3+, вычислено
329.1608.
239.1139.
1-{[(S)-1-Азидо-3-фенилпропан-2-ил]ами-
2-[(3-Азидопропил)амино]-2-оксоэтил гекс-
но}-3-метил-1-оксобутан-2-ил гекс-5-иноат (3c).
5-иноат (3f). Выход 0.157 г (62%), бесцветное
Выход 0.24 г (73%), желтое масло (смесь диасте-
масло. ИК спектр (KBr), ν, см-1: 3261 уш.с (NH),
реомеров 1:1), [α]D25 -5.1 (c 0.1, MeOH). ИК спектр
2031 (N3, C≡C), 1786 (CO), 1704 (CO). Спектр
(KBr), ν, см-1: 3298 уш.с (NH), 2099 (N3, C≡C),
ЯМР 1H (400 MГц, CDCl3, 25°C), δ, м.д.: 1.73-1.86
1757 (CO), 1673 (CO). Спектр ЯМР 1H (400 MГц,
м (4H), 1.97-1.99 м (1H), 2.20-2.26 м (2H), 2.53 т
CDCl3, 25°C), δ, м.д.: 0.78-0.81 м (3H), 0.86-0.92
(2H, J 7.3 Гц), 3.32-3.36 м (4H), 4.52 с (2H), 6.63
м (7H), 1.17-1.26 м (3H), 1.81-1.90 м (4H), 1.97-
уш.с (1H). Спектр ЯМР 13C (100 MГц, CDCl3,
2.03 м (2H), 2.17-2.31 м (5H), 2.48-2.57 м (5H),
25°C), δ, м.д.: 17.4, 23.0, 28.3, 32.2, 36.7, 49.1, 62.6,
2.80-2.92 м (3H), 3.33-3.51 м (3H), 4.30-4.39 м
69.4, 82.8, 167.3, 171.5. Масс-спектр (ESI-MS), m/z:
(2H), 4.99-5.06 м (2H), 6.08-6.16 м (2H) 7.13-7.34
найдено 253.1296 [M + H]+, C11H17N4O3+, вычисле-
м (10H). Спектр ЯМР 13C (100 MГц, CDCl3, 25°C),
но 253.1295.
δ, м.д.: 16.4, 16.8, 17.6, 17.7, 18.5, 18.7, 23.2, 23.3,
30.3, 30.4, 32.4, 32.5, 37.4, 37.5, 49.3, 49.4, 52.8,
(S)-2-[(1-Азидо-3-фенилпропан-2-ил)ами-
52.9, 69.2, 69.5, 77.8, 82.8, 83.0, 126.8, 126.9, 128.7,
но]-2-оксоэтил
2-этинилбензоат
(3g). Выход
129.0, 129.1, 136.4, 136.5, 169.0, 169.1, 171.7, 177.6
0.312 г (86%), желтоватое масло (смесь нескольких
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ МАКРОЦИКЛИЧЕСКИХ ДЕПСИПЕПТИДОВ
507
ротамеров), [α]D25 +0.9 (c 0.1, MeOH). ИК спектр
MeOH). ИК спектр (KBr), ν, см-1: 3319 уш.с (NH),
(KBr), ν, см-1: 3149 уш.с (NH), 2090 (N3, C≡C),
2100 (N3, C≡C), 1758 (CO), 1677 (CO). Спектр
1770 (CO), 1678 (CO). Спектр ЯМР 1H (400 MГц,
ЯМР 1H (400 MГц, CDCl3, 25°C), δ, м.д.: 1.83-
CDCl3, 25°C), δ, м.д.: 2.65 с (1H), 2.86-3.05 м (2H),
1.92 м (2H), 1.99-2.04 м (1H), 2.27-2.31 м (2H),
3.40-3.56 м (2H), 4.37-4.44 м (1H) 4.74-4.88 м
2.59-2.66 м (2H), 2.83-2.99 м (2H), 3.34-3.52 м
(2H), 6.85-7.12 м (1H), 7.19-7.30 м (5H), 7.47-8.02
(2H), 4.30-4.37 м (1H), 5.52-5.62 м (1H), 6.46-
м (4H). Спектр ЯМР 13C (100 MГц, CDCl3, 25°C),
6.52 м (1H), 7.16-7.35 м (5H). Спектр ЯМР 13C
δ, м.д.: 37.4, 37.5, 49.8, 50.2, 52.7, 52.8, 63.6, 63.7,
(100 MГц, CDCl3, 25°C), δ, м.д.: 14.0, 32.6, 32.7,
сигнал -Cq≡ перекрывается с сигналами CDCl3,
37.1, 37.2, 50.3, 52.4, 52.5, 69.8, 70.0 к (J 32.3 Гц),
82.8, 82.9, 126.6, 126.9, 127.9, 128.5, 128.6, 128.7,
81.6, 81,7, 121.4 к (J 282.0 Гц), 126.9, 127.0, 128.7,
128.9, 129.1, 129.2, 129.7, 130.0, 130.8, 131.1, 131.5,
129.0,
129.1,
136.1
136.2,
161.1,
162.5,
168.8.
131.6, 132.4, 135.2, 136.5, 136.9, 138.9, 164.5, 164.6,
Спектр ЯМР 19F (375 МГц, CDCl3, 25°C), δ, м.д.:
166.7 166.9. Масс-спектр (ESI-MS), m/z: найде-
-72.4, -73.5. Масс-спектр (ESI-MS), m/z: найде-
но 363.1451 [M + H]+, C20H19N4O3+, вычислено
но 383.1325 [M + H]+, C17H18F3N4O3+, вычислено
363.1452.
383.1326.
(S)-2-[(1-Азидо-3-фенилпропан-2-ил)ами-
3-{[(S)-1-Азидо-3-фенилпропан-2-ил]амино}-
но]-2-оксоэтил
3-этинилбензоат
(3h). Выход
1,1,1-трифтор-3-оксопропан-2-ил гекс-5-иноат
0.319 г (88%), желтоватое масло, [α]D25 -1.7 (c 0.1,
(3k). Выход 0.345 г (87%), желтоватое масло (смесь
MeOH). ИК спектр (KBr), ν, см-1: 3310 уш.с (NH),
диастереомеров 1:1), [α]D25 -0.6 (c 0.1, MeOH).
2088 (N3, C≡C), 1756 (CO), 1666 (CO). Спектр ЯМР
ИК спектр (KBr), ν, см-1: 3304 уш.с (NH), 2101
1H (400 MГц, CDCl3, 25°C), δ, м.д.: 2.85-2.97 м
(N3, C≡C), 1748 (CO), 1656 (CO). Спектр ЯМР 1H
(2H), 3.20 с (1H), 3.40-3.52 м (2H), 4.36-4.41 м (1H),
(400 MГц, CDCl3, 25°C), δ, м.д.: 1.83-1.92 м (2H),
4.74-4.82 м (2H), 6.26 уш.д (1H, J 7.9 Гц), 7.18-7.30
1.99-2.04 м (1H), 2.27-2.31 м (2H), 2.59-2.66 м
м (5H), 7.46-7.50 м (1H), 7.74-8.01 м (2H), 8.15 с
(2H), 2.83-2.99 м (2H), 3.34-3.52 м (2H), 4.30-4.37
(1H). Спектр ЯМР 13C (100 MГц, CDCl3, 25°C), δ,
м (1H), 5.52-5.62 м (1H), 6.46-6.52 м (1H) 7.16-7.35
м.д.: 37.5, 49.5, 52.5, 63.5, 78.7, 82.1, 122.9, 127.0,
м (5H). Спектр ЯМР 13C (100 MГц, CDCl3, 25°C),
128.7, 128.8, 129.2, 133.3, 136.3, 137.0, 164.3, 166.6.
δ, м.д.: 17.3, 17.4, 22.8, 22.9, 31.8, 31.9, 37.0, 37.2,
Масс-спектр (ESI-MS), m/z: найдено 363.1450 [M +
50.1, 52.3, 52.4, 69.6 к (J 32.4 Гц), 69.7, 82.5, 121.5
H]+, C20H19N4O3+, вычислено 363.1452.
к (J 281.6 Гц), 126.9, 127.0, 128.7, 129.0, 129.1,
(S)-2-[(1-Азидо-3-фенилпропан-2-ил)ами-
136.0 136.1, 161.2, 170.0, 170.1. Спектр ЯМР 19F
но]-2-оксоэтил
4-этинилбензоат
(3i). Выход
(375 МГц, CDCl3, 25°C), δ, м.д.: -76.1, -76.5. Масс-
0.322 г (89%), желтоватое масло, [α]D25 -2.6 (c 0.1,
спектр (ESI-MS), m/z: найдено 397.1484 [M + H]+,
MeOH). ИК спектр (KBr), ν, см-1: 3316 уш.с (NH),
C18H20F3N4O3+, вычислено 397.1482.
2109 (N3, C≡C), 1777 (CO), 1681 (CO). Спектр
3-{[(S)-1-Азидо-3-фенилпропан-2-ил]амино}-
ЯМР 1H (400 MГц, CDCl3, 25°C), δ, м.д.: 2.82-2.96
1,1,1-трифтор-3-оксопропан-2-ил 2-этинилбен-
м (2H), 3.33-3.48 м (3H), 4.36-4.38 м (1H), 4.68-
зоат (3l). Выход 0.430 г (100%), желтоватое мас-
4.81 м (2H), 6.47 уш.д (1H, J 8.12 Гц), 7.16-7.27
ло (смесь диастереомеров 1:1), [α]D25 +0.3 (c 0.1,
м (5H), 7.57 д (2H, J 8.2 Гц), 7.96 д (2H, J 8.2 Гц).
MeOH). ИК спектр (KBr), ν, см-1: 3336 уш.с (NH),
Спектр ЯМР 13C (100 MГц, CDCl3, 25°C), δ, м.д.:
2126 (N3, C≡C), 1773 (CO), 1680 (CO). Спектр
37.2, 49.4, 52.4, 63.2, 80.8, 82.3, 126.8, 127.4, 128.6,
ЯМР 1H (400 MГц, CDCl3, 25°C), δ, м.д.: 2.70 с
128.7, 129.0, 129.4, 132.0, 136.2, 164.3, 166.5. Масс-
(1H), 2.91-3.03 м (2H), 3.39-3.60 м (2H), 4.35-4.42
спектр (ESI-MS), m/z: найдено 363.1446 [M + H]+,
м (1H), 5.73-5.82 м (1H), 6.45-6.53 м (1H), 7.09-
C20H19N4O3+, вычислено 363.1452.
7.36 м (5H), 7.48-7.79 м (2H), 8.04-8.19 м (2H).
3-{[(S)-1-Азидо-3-фенилпропан-2-ил]ами-
Спектр ЯМР 13C (100 MГц, CDCl3, 25°C), δ, м.д.:
но}-1,1,1-трифтор-3-оксопропан-2-илпент-4-и-
37.0, 37.1, 50.0, 50.4, 52.3, 52.7, 70.4 к (J 32.4 Гц),
ноат (3j). Выход 0.364 г (95%), желтоватое мас-
70.7 к (J 32.4 Гц), 82.2, 82.4, 83.4, 83.6, 121.4 к (J
ло (смесь диастереомеров 1:1), [α]D25 +8.5 (c 0.1,
246.7 Гц), 122.1, 122.6, 124.2 к (J 246.7 Гц), 126.9,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
508
КУТОВАЯ, НЕНАЙДЕНКО
127.0, 128.6, 128.7, 128.9, 129.0, 129.2, 130.5,
перемешивали в атмосфере аргона в течение двух
131.6, 131.7, 133.2, 133.3, 134.5, 135.4, 135.5,
дней при комнатной температуре. После этого рас-
136.0 136.1, 161.3, 162.7, 163.0. Спектр ЯМР 19F
творитель отгоняли, остаток растворяли в смеси
(375 МГц, CDCl3, 25°C), δ, м.д.: -68.6, -71.2. Масс-
дихлорметан-вода-этилендиамин (300:100:1 мл)
спектр (ESI-MS), m/z: найдено 431.1324 [M + H]+,
и оставляли перемешиваться еще на сутки. Затем
C21H18F3N4O3+, вычислено 431.1326.
в случае образования осадка его отфильтровыва-
ли и получали целевые продукты. Если осадка не
3-{[(S)-1-Азидо-3-фенилпропан-2-ил]ами-
было, органическую фазу отделяли, сушили над
но}-1,1,1-трифтор-3-оксопропан-2-ил 3-этинил-
Na2SO4, и упаривали на роторном испарителе.
бензоат (3m). Выход 0.430 г (100%), желтоватое
Продукт выделяли колоночной хроматографией
масло, смесь диастереомеров 1:1, [α]D25 +1.2 (c 0.1,
(элюент дихлорметан:метанол 30:1 или градиент
MeOH). ИК спектр (KBr), ν, см-1: 3319 уш.с (NH),
полярности дихлорметан - дихлорметан-MeOH,
2098 (N3, C≡C), 1788 (CO), 1669 (CO). Спектр
8:2), в некоторых случаях хроматографию повто-
ЯМР 1H (400 MГц, CDCl3, 25°C), δ, м.д.: 2.85-2.99
ряли дважды для дополнительной очистки. Если
м (2H), 3.23 с (1H), 3.35-3.55 м (2H), 4.33-4.38 м
вещество не растворялось ни в одном из элюентов,
(1H), 5.72-5.92 м (1H), 6.83-7.31 м (6H), 7.50-8.09
его промывали дихлорметаном и получали чистые
м (2H). Спектр ЯМР 13C (100 MГц, CDCl3, 25°C),
продукты.
δ, м.д.: 37.1, 37.2, 50.1, 52.2, 52.4, 70.5 к (J 32.4 Гц),
70.6 к (J 32.4 Гц), 79.0, 79.1, 81.8, 121.6 к (J
(3S)-3-Бензил-7-окса-1,4,12,13-тетрааза-
282.8 Гц), 123.1, 125.8, 126.9, 127.0, 127.6, 127.7,
бицикло[9.2.1]тетрадека-11(14),12-диен-5,8-
128.3, 128.7, 128.8, 128.9, 129.0, 129.1, 130.2,
дион и
(3S,16S)-3,16-Дибензил-7,20-диокса-
133.5, 133.6, 135.8 136.0, 137.6, 161.1, 162.9, 163.0.
1,4,12,13,14,17,25,26-октаазатрицикло-
Спектр ЯМР 19F (375 МГц, CDCl3, 25°C), δ, м.д.:
[22.2.1.111,14]октакоза-11(28),12,24(27),25-те-
-73.0, -73.6. Масс-спектр (ESI-MS), m/z: найде-
траен-5,8,18,21-тетраон
(4a). Выход
0.052 г
но 431.1324 [M + H]+, C21H18F3N4O3+, вычислено
(67%), белое твердое вещество, т.пл 178°C (разл.)
431.1326.
(смесь мономера и димера). ИК спектр (KBr), ν,
1-[(2-Азидо-1-Бензилэтил)карбамоил]-
см-1: 3251 уш.с (NH), 1745 (CO), 1682 (CO). Спектр
ЯМР 1H (400 MГц, CDCl3, 25°C), δ, м.д.: 2.45-3.09
2,2,2-трифторэтил 4-этинилбензоат (3n). Выход
0.138 г (32%), желтоватое масло (смесь диастерео-
м (11H), 3.40-3.66 м (2H), 4.22-4.90 м (10H),
меров). ИК спектр (KBr), ν, см-1: 3313 уш.с (NH),
7.16-7.49 м (11H), 8.20-9.14 м (2H). Спектр ЯМР
2090 (N3, C≡C), 1761 (CO), 1677 (CO). Спектр
13C (100 MГц, CDCl3, 25°C), δ, м.д.: 20.5 м, 29.6,
ЯМР 1H (400 MГц, CDCl3, 25°C), δ, м.д.: 2.82-2.98
32.3, 32.5, 33.9, 34.0, 36.8, 38.5 м, 49.0, 50.5, 50.7,
м (2H), 3.34-3.55 м (3H), 4.33-4.38 м (1H), 5.71-
52.2, 62.7 м, 121.2, 122.2, 124.1, 126.4, 126.6, 127.1,
5.79 м (1H), 6.33 уш.д.д (1H, J 8.25 Гц, J 23.9 Гц),
128.3, 128.4, 128.8, 129.2, 129.4, 137.4, 138.1, 144.1,
7.08-7.33 м (5H), 7.61-7.65 м (2H), 8.01-8.04 м
145.6, 168.1, 168.5, 171.7, 172.5. Масс-спектр (ESI-
(2H). Спектр ЯМР 13C (100 MГц, CDCl3, 25°C),
MS), m/z: найдено 315.1455 [M + H]+, C16H19N4O3+,
δ, м.д.: 37.1, 37.2, 50.0, 50.1, 52.3, 52.4, 70.5 к (J
вычислено 315.1452; найдено 629.2830 [M + H]+,
32.4 Гц), 81.3, 81.4, 82.3, 121.6 к (J 282.0 Гц), 127.0,
C32H37N8O6+, вычислено 629.2831.
127.2, 128.5, 128.7, 128.8, 129.0, 129.1, 129.9, 132.4,
(3S)-3-Бензил-7-окса-1,4,13,14-тетраазаби-
135.8, 136.0, 161.1, 163.0, 163.1. Спектр ЯМР 19F
цикло[10.2.1]пентадека-12(15),13-диен-5,8-ди-
(375 МГц, CDCl3, 25°C), δ, м.д.: -79.0, -82.4. Масс-
он (4b). Выход 0.045 г (55%), желтоватое масло.
спектр (ESI-MS), m/z: найдено 431.1326 [M + H]+,
ИК спектр (KBr), ν, см-1: 3263 уш.с (NH), 1728
C21H18F3N4O3+, вычислено 431.1326.
(CO),
1656 (CO). Спектр ЯМР 1H (400 MГц,
Общая методика макроциклизации. Продукт
CDCl3, 25°C), δ, м.д.: 1.57-2.24 м (4H), 2.31-2.45
реакции Пассерини (0.25 ммоль) растворяли в су-
м (2H), 2.84-3.15 м (3H), 4.32-4.55 м (4H), 5.63 д
хом ацетонитриле (500 мл), прибавляли 2,6-лути-
(1H, J 7.34 Гц), 7.17-7.36 м (6H). Спектр ЯМР 13C
дин (29 мл, 0.29 ммоль), этилдиизопропиламин
(100 MГц, CDCl3, 25°C), δ, м.д.: 23.0, 25.7, 29.7,
(40 мл, 0.42 ммоль) и CuI (48 мг, 0.25 ммоль) и
33.1, 37.6, 48.9, 65.0,
124.7, 127.0, 128.8, 129.4,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ МАКРОЦИКЛИЧЕСКИХ ДЕПСИПЕПТИДОВ
509
136.8, 145.1, 174.1, 175.7. Масс-спектр (ESI-MS),
ЯМР 13C (100 MГц, CDCl3, 25°C), δ, м.д.: 37.6
m/z: найдено 329.1612 [M + H]+, C17H21F3N4O3+,
м, 45.2, 48.6, 49.4, 52.8 м, 60.5, 62.7 м, 126.9 м,
вычислено 329.1608.
128.7 м, 128.9, 129.0, 129.1 м, 129.6, 129.7, 132.0,
132.3, 136.5 м, 160.8, 164.3, 164.4, 166.7. Масс-
(3S)-3-Бензил-6-изопропил-7-окса-1,4,13,
спектр (ESI-MS), m/z: найдено 725.2829 [M + H]+,
14-тетраазабицикло[10.2.1]пентадека-12(15),13-
C40H37N8O6+, вычислено 725.2831.
диен-5,8-дион (4c). Выход 0.048 г (52%), корич-
невое масло. ИК спектр (KBr), ν, см-1: 3330 уш.с
(14Z,104Z,8R,17R)-8,17-Дибензил-11H,101H-
(NH), 1761 (CO), 1639 (CO). Спектр ЯМР 1H
4,13-диокса-7,16-диаза-1(4,1),10(1,4)-дитри-
(400 MГц, CDCl3, 25°C), δ, м.д.: 0.35-0.96 м (4H),
азола-2,11(1,4)-дибензенациклооктадека-
1.09-1.33 м (2H), 1.60-2.96 м (7H), 3.04-3.40 м
фан-3,6,12,15-тетраон (4i). Выход 0.181 г (45%),
(1H), 4.11-4.98 м (5H), 5.01-5.96 м (1H), 6.96-
желтоватое твердое вещество, т.пл 248°C (разл.).
7.37 м (5H), 7.44-7.88 м (1H). Спектр ЯМР 13C
ИК спектр (KBr), ν, см-1: 3269 уш.с (NH), 1755 (CO),
(100 MГц, DMSO-d6, 25°C), δ, м.д.: 15.6, 16.0, 17.6,
1689 (CO). Спектр ЯМР 1H (400 MГц, DMSO-d6,
17.8, 18.0, 18.6, 23.6, 25.3, 25.7, 27.8, 29.6, 32.6 м,
25°C), δ, м.д.: 2.66-3.01 м (3H), 3.50-3.75 м (1H),
33.3, 37.7, 48.5, 49.8, 51.2, 124.0, 124.1, 126.9, 127.0,
4.41-4.68 м (4H), 7.21-7.35 м (6H), 7.76-8.07 м
128.6, 128.7, 129.1, 129.4, 136.1, 136.6, 144.0, 145.1,
(3H), 8.30-8.69 м (1H). Спектр ЯМР 13C (100 MГц,
168.0, 168.3, 168.8, 168.9, 173.4, 173.6, 175.0, 175.1.
DMSO-d6, 25°C), δ, м.д.: 37.2, 37.4, 49.6, 50.4, 50.9,
Масс-спектр (ESI-MS), m/z: найдено 371.2084 [M +
52.3, 52.6, 53.3, 124.9, 125.2, 126.4 м, 127.8, 128.4
H]+, C20H27N4O3+, вычислено 371.2078.
м, 129.1 м, 130.3 м, 135.4, 135.6, 138.1 м, 144.9,
164.9, 165.0, 166.6 м. Масс-спектр (ESI-MS), m/z:
(8S,Z)-8-Бензил-11H-4-окса-7-аза-1(4,1)-три-
найдено 725.2825 [M + H]+, C40H37N8O6+, вычисле-
азола-2(1,2)-бензенациклононафан-3,6-дион и
но 725.2831.
(14Z,104Z,8R,17R)-8,17-дибензил-11H,101H-4,13-
диокса-7,16-диаза-1(4,1),10(1,4)-дитриазола-
(3S)-3-Бензил-6-(трифторметил)-7-окса-
2,11(1,2)-дибензенациклооктадекафан-3,6,12,
1,4,12,13-тетраазабицикло[9.2.1]тетраде-
15-тетраон (4g). Выход 0.060 г (66%), желтое твер-
ка-11(14),12-диен-5,8-дион
и
(3S,16S)-3,16-
дое вещество, т.пл. 123°C (разл.) (смесь мономера и
дибензил-6,19-бис(трифторметил)-7,20-
димера). ИК спектр (KBr), ν, см-1: 3300 уш.с (NH),
диокса-1,4,12,13,14,17,25,26-октаазатрицик-
1736 (CO), 1655 (CO). Спектр ЯМР 1H (400 MГц,
ло[22.2.1.111,14]октакоза-11(28),12,24(27),25-те-
CDCl3, 25°C), δ, м.д.: 2.83-3.49 м (4H), 4.04-4.42 м
траен-5,8,18,21-тетраон (4j). Выход 0.05 г (53%),
(2H), 4.56-5.05 м (1H), 5.23-5.29 м (1H), 6.64-6.66 м
белое твердое вещество, т.пл 221°C (разл.) (смесь
(1H), 7.08-8.31 м (10H). Спектр ЯМР 13C (100 MГц,
мономера и димера, несколько ротамеров или
CDCl3, 25°C), δ, м.д.: 37.8, 49.5, 52.8, 62.2, 122.2,
диастереомеров). ИК спектр (KBr), ν, см-1: 3313
126.9, 128.2, 128.7, 128.8, 129.2, 129.3, 131.5, 131.9,
уш.с (NH), 1760 (CO), 1674 (CO). Спектр ЯМР
136.7, 146.2, 171.1, 171.8. Масс-спектр (ESI-MS),
1H (400 MГц, DMSO-d6, 25°C), δ, м.д.: 2.44-2.46
m/z: найдено 363.1455 [M + H]+, C20H19N4O3+, вы-
м (1H), 2.61-3.00 м (6H), 3.42-3.59 м (1H), 4.32-
числено 363.1452; найдено 725.2827 [M + H]+,
4.79 м (2H), 5.40-5.57 м (1H), 7.15-7.28 м (4H),
C40H37N8O6+, вычислено 725.2831.
7.48-7.74 м (1H), 8.32-8.65 м (1H). Спектр ЯМР
(14Z,104Z,8R,17R)-8,17-Дибензил-11H,101H-
13C (100 MГц, DMSO-d6, 25°C), δ, м.д.: 13.4, 13.5,
4,13-диокса-7,16-диаза-1(4,1),10(1,4)-дитри-
14.0, 20.0, 20.2, 22.1, 22.4, 22.8, 28.7, 29.0, 31.3,
азола-2,11(1,3)-дибензенациклооктадека-
32.2, 32.5, 36.9, 37.2 м, 37.8, 50.1, 50.2, 50.6, 51.5
фан-3,6,12,15-тетраон (4h). Выход 0.145 г (80%),
м, 53.1, 53.2, 67.3, 67.7, 69.5 м, 70.2, 70.5, 71.3,
белое твердое вещество, т.пл 239°C (разл.). ИК
71.9, 122.8, 123.2, 125.4, 126.3 м, 126.9, 128.2 м,
спектр (KBr), ν, см-1: 3305 уш.с (NH), 1734 (CO),
129.1 м, 137.6 м, 142.4, 143.3, 144.6 м, 165.0, 165.3,
1668 (CO). Спектр ЯМР 1H (400 MГц, DMSO-d6,
169.4, 169.5, 170.1, 170.2,
171.1. Спектр ЯМР
25°C), δ, м.д.: 2.84-3.02 м (3H), 3.24-3.52 м (2H),
19F (375 МГц, CDCl3, 25°C), δ, м.д.: -77.1, -77.9,
4.37-4.41 м (1H), 4.75-4.83 м (1H), 6.82-7.40 м
-78.3, -80.4, -83.6, -83.9. Масс-спектр (ESI-MS),
(8H), 7.55-7.62 м (1H), 7.96-8.05 м (1H). Спектр
m/z: найдено 383.1329 [M + H]+, C17H18F3N4O3+,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
510
КУТОВАЯ, НЕНАЙДЕНКО
вычислено 383.1326; найдено 765.2578 [M + H]+,
(14Z,104Z,8R,17R)-8,17-Дибензил-5,14-
C34H35F6N8O6+, вычислено 765.2578.
бис(трифторметил)-11H,101H-4,13-диокса-
7,16-диаза-1(4,1),10(1,4)-дитриазола-2,11(1,3)-
(3S)-3-Бензил-6-(трифторметил)-7-окса-
дибензенациклооктадекафан-3,6,12,15-тетраон
1,4,13,14-тетраазабицикло[10.2.1]пентадека-
(4m). Выход 0.131 г (61%), белое твердое веще-
12(15),13-диен-5,8-дион и
(3S,17S)-3,17-ди-
ство, т.пл. 198°C (разл.) (димер, смесь диастерео-
бензил-6,20-бис(трифторметил)-7,21-диокса-
меров и ротамеров). ИК спектр (KBr), ν, см-1: 3308
1,4,13,14,15,18,27,28-октаазатрицикло-
уш.с (NH), 1787 (CO), 1644 (CO). Спектр ЯМР
[24.2.1.112,15]триаконта-12(30),13,26(29),27-те-
1H (400 MГц, DMSO-d6, 25°C), δ, м.д.: 2.60-3.14
траен-5,8,19,22-тетраон
(4k). Выход
0.051 г
м (2H), 4.14-4.75 м (3H), 5.42-5.76 м (1H), 7.23-
(51%), белое твердое вещество, т.пл. 196°C (разл.)
8.04 м (8H), 8.33-8.89 м (3H). Спектр ЯМР 13C
(смесь мономера, димера, диастереомеров и рота-
(100 MГц, DMSO-d6, 25°C), δ, м.д.
36.4, 37.0,
меров). ИК спектр (KBr), ν, см-1: 3326 уш.с (NH),
37.6, 51.0, 51.4, 53.7, 71.4 к (J 29.1 Гц), 121.9 к
1787 (CO), 1623 (CO).Спектр ЯМР 1H (400 MГц,
(J 281.2 Гц), 124.2, 126.8, 127.5, 128.2 м, 128.6 м,
CDCl3, 25°C), δ, м.д.: 1.61-2.37 м (5H), 2.73-2.98
129.2 м, 130.0 м, 131.8, 137.3, 137.5, 144.7 м, 161.1
м (3H), 3.36-3.49 м (1H), 4.37-4.64 м (3H), 6.61-
м, 164.1, 164.3. Спектр ЯМР 19F (375 МГц, CDCl3,
6.72 м (1H), 7.22-7.53 м (7H). 13C ЯМР (100 MГц,
25°C), δ, м.д.: -77.5, -79.2, -81.4, -82.4. Масс-
DMSO-d6, 25°C), δ, м.д.: 23.5, 25.0, 33.0, 36.7,
спектр (ESI-MS), m/z: найдено 861.2576 [M + H]+,
36.8, 50.7, 51.7, 52.0, 123.7, 126.4, 128.2, 128.3,
C42H35F6N8O6+, вычислено 861.2578.
129.1, 129.3, 137.5, 144.3, 160.3, 171.1. Спектр
(14Z,104Z,8R,17R)-8,17-Дибензил-5,14-бис-
ЯМР 19F (375 МГц, CDCl3, 25°C), δ, м.д.: -73.8,
(трифторметил)-11H,101H-4,13-диокса-7,16-ди-
-73.9, -77.6, -79.3. Масс-спектр (ESI-MS), m/z:
аза-1(4,1),10(1,4)-дитриазола-2,11(1,4)-дибен-
найдено 397.1484 [M + H]+, C18H20F3N4O3+, вы-
зенациклооктадекафан-3,6,12,15-тетраон
(4n).
числено 397.1482; найдено 793.2884 [M + H]+,
Выход 0.159 г (74%), белое твердое вещество,
C36H39F6N8O6+, вычислено 793.2891.
т.пл. 240°C (разл.) (димер, смесь диастереомеров
(8S,Z)-8-Бензил-5-(трифторметил)-11H-4-
и ротамеров). ИК спектр (KBr), ν, см-1: 3301 уш.с
окса-7-аза-1(4,1)-триазола-2(1,2)-бензенацикло-
(NH), 1763 (CO), 1639 (CO). Спектр ЯМР 1H
нонафан-3,6-дион и
(14Z,104Z,8R,17R)-8,17-
(400 MГц, DMSO-d6, 25°C), δ, м.д.: 0.84-1.33 м
дибензил-5,14-бис(трифторметил)-11H,101H-
(2H), 2.80-3.16 м (2H), 4.41-4.79 м (2H), 5.72-
4,13-диокса-7,16-диаза-1(4,1),10(1,4)-дитри-
5.90 м (1H), 7.00-7.34 м (5H), 7.52-7.74 м (2H),
азола-2,11(1,2)-дибензенациклооктадека-
7.92-8.07 м (1H), 8.25-9.10 м (2H). Спектр ЯМР
фан-3,6,12,15-тетраон (4l). Выход 0.104 г (97%),
13C (100 MГц, DMSO-d6, 25°C), δ, м.д.: 24.0, 36.7,
желтоватое масло (смесь мономера, димера, диа-
36.9, 37.2, 50.5, 51.3, 51.6, 51.9, 121.4 к (J 279.9 Гц),
стереомеров и ротамеров). ИК спектр (KBr), ν, см-1:
124.7, 125.0, 126.3 м, 128.2, 128.3, 129.1, 129.3,
3352 уш.с (NH), 1749 (CO), 1683 (CO). Спектр ЯМР
130.4 м, 136.9 м, 144.4 м, 161.1, 161.4, 163.1, 163.6.
1H (400 MГц, DMSO-d6, 25°C), δ, м.д.: 1.23-1.78
Спектр ЯМР 19F (375 МГц, CDCl3, 25°C), δ, м.д.:
м (1H), 2.73-3.08 м (2H), 3.41-3.82 м (1H), 4.15-
-76.0, -76.2, -77.3, -78.1. Масс-спектр (ESI-MS),
4.95 м (2H), 6.84-7.87 м (9H), 7.97-8.89 м (1H).
m/z: найдено 861.2583 [M + H]+, C42H35F6N8O6+,
Спектр ЯМР 13C (100 MГц, CDCl3, 25°C), δ, м.д.:
вычислено 861.2578.
37.0, 37.1, 50.1, 50.3, 51.6, 53.2, 69.3 к (J 28.9 Гц),
ФОНДОВАЯ ПОДДЕРЖКА
123.7 к (J 280.6 Гц), 124.1 к (J 281.6 Гц), 126.2,
В.Г. Ненайденко выражает благодарность
126.5, 128.2, 128.3, 128.7, 129.0, 129.1, 132.2, 132.5,
Российскому фонду фундаментальных исследо-
137.3, 137.8, 137.9, 143.2, 158.8, 159.7, 165.2, 167.0.
ваний (грант
№ 18-53-34002) за финансовую
Спектр ЯМР 19F (375 МГц, CDCl3, 25°C), δ, м.д.:
поддержку.
-79.3, -79.6, -79.8, -80.2. Масс-спектр (ESI-MS),
КОНФЛИКТ ИНТЕРЕСОВ
m/z: найдено 431.1330 [M + H]+, C21H18F3N4O3+,
вычислено 431.1326; найдено 861.2574 [M + H]+,
Авторы заявляют об отсутствии конфликта
C42H35F6N8O6+, вычислено 861.2578.
интересов.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ МАКРОЦИКЛИЧЕСКИХ ДЕПСИПЕПТИДОВ
511
СПИСОК ЛИТЕРАТУРЫ
ков М.С., Николаев В.А., Родина Л.Л., Хлебни-
ков А.Ф., Белецкая И.П., Вацадзе С.З., Громов С.П.,
1. Антипин И.С., Казымова М.А., Кузнецов М.А., Ва-
Зык Н.В., Лебедев А.Т., Леменовский Д.А., Петро-
сильев А.В., Ищенко М.А., Кирюшкин А.А., Куз-
сян В.С., Ненайденко В.Г., Негребецкий В.В., Бау-
нецова Л.М., Макаренко С.В., Островский В.А.,
ков Ю.И., Шмиголь Т.А., Корлюков А.А., Тихоми-
Петров М.Л., Солод О.В., Тришин Ю.Г., Яков-
ров А.С., Щекотихин А.Е., Травень В.Ф., Воскре-
лев И.П., Ненайденко В.Г., Белоглазкина Е.К., Бе-
сенский Л.Г., Зубков Ф.И., Голубчиков О.А., Семей-
лецкая И.П., Устынюк Ю.А., Соловьев П.А., Ива-
кин А.С., Березин Д.Б., Стужин П.А., Филимо-
нов И.В., Малина Е.В., Сивова Н.В., Негребец-
нов В.Д., Краснокутская Е.А., Федоров А.Ю., Ню-
кий В.В., Бауков Ю.И., Пожарская Н.А., Тра-
чев А.В., Орлов В.Ю., Бегунов Р.С., Русаков А.И.,
вень В.Ф., Щекотихин А.Е., Варламов А.В., Бори-
Колобов А.В., Кофанов Е.Р., Федотова О.В., Его-
сова Т.Н., Лесина Ю.А., Краснокутская Е.А., Рого-
рова А.Ю., Чарушин В.Н., Чупахин О.Н., Климоч-
жников С.И., Шуров С.Н., Кустова Т.П., Клюев М.В.,
кин Ю.Н., Осянин В.А., Резников А.Н., Фисюк А.С.,
Хелевина О.Г., Стужин П.А., Федоров А.Ю.,
Сагитуллина Г.П., Аксенов А.В., Аксенов Н.А.,
Гущин А.В., Додонов В.А., Колобов А.В., Плах-
Грачев М.К., Масленникова В.И., Коротеев М.П.,
тинский В.В., Орлов В.Ю., Кривенько А.П., Фе-
Брель А.К., Лисина С.В., Медведева С.М., Ши-
дотова О.В., Пчелинцева Н.В., Чарушин В.Н.,
халиев Х.С., Субоч Г.А., Товбис М.С., Мироно-
Чупахин О.Н., Климочкин Ю.Н., Климочки-
вич Л.М., Иванов С.М., Курбатов С.В., Клец-
на А.Ю., Курятников В.Н., Малиновская Ю.А.,
кий М.Е., Буров О.Н., Кобраков К.И., Кузнецов Д.Н.
Левина А.С., Журавлев О.Е., Ворончихина Л.И.,
ЖОрХ. 2018, 54, 161-360. [Konovalov A.I., Anti-
Фисюк А.С., Аксенов А.В., Аксенов Н.А., Аксено-
pin I.S., Burilov V.A., Madzhidov T.I., Kurbangalie-
ва И.В. ЖОрХ. 2017, 53, 1257-1408. [Antipin I.S.,
va A.R., Nemtarev A.V., Solovieva S.E., Stoikov I.I.,
Kazymova M.A., Kuznetsov M.A., Vasilyev A.V.,
Mamedov V.A., Zakharova L.Ya., Gavrilova E.L., Sinya-
Ishchenko M.A., Kiryushkin A.A., Kuznetsova L.M.,
shin O.G., Balova I.A., Vasilyev A.V., Zenkevich I.G.,
Makarenko S.V., Ostrovskii V.A., Petrov M.L.,
Krasavin M.Yu., Kuznetsov M.A., Molchanov A.P.,
Solod O.V., Trishin Yu.G., Yakovlev I.P., Nenai-
Novikov M.S., Nikolaev V.A., Rodina L.L., Khlebni-
denko V.G., Beloglazkina E.K., Beletskaya I.P.,
Ustynyuk Yu.A., Solov’ev P.A., Ivanov I.V., Ma-
kov A.F., Beletskaya I.P., Vatsadze S.Z., Gromov S.P.,
Zyk N.V., Lebedev A.T., Lemenovskii D.A., Petro-
lina E.V., Sivova N.V., Negrebetskii V.V., Bau-
syan V.S., Nenaidenko V.G., Negrebetskii V.V., Bau-
kov Yu.I., Pozharskaya N.A., Traven’ V.F., Shcheko-
tikhin A.E., Varlamov A.V., Borisova T.N., Lesi-
kov Yu.I., Shmigol’ T.A., Korlyukov A.A., Tikhomi-
na Yu.A., Krasnokutskaya E.A., Rogozhnikov S.I.,
rov A.S., Shchekotikhin A.E., Traven’ V.F., Voskre-
Shurov S.N., Kustova T.P., Klyuev M.V., Khe-
senskii L.G., Zubkov F.I., Golubchikov O.A., Semei-
levina O.G., Stuzhin P.A., Fedorov A.Yu., Gu-
kin A.S., Berezin D.B., Stuzhin P.A., Filimonov V.D.,
shchin A.V., Dodonov V.A., Kolobov A.V., Plakh-
Krasnokutskaya E.A., Fedorov A.Yu., Nyuchev A.V.,
tinskii V.V., Orlov V.Yu., Kriven’ko A.P., Fedotova O.V.,
Orlov V.Yu., Begunov R.S., Rusakov A.I., Kolo-
Pchelintseva N.V., Charushin V.N., Chupakhin O.N.,
bov A.V., Kofanov E.R., Fedotova O.V., Egorova A.Yu.,
Klimochkin Yu.N., Klimochkina A.Yu., Kuryatni-
Charushin V.N., Chupakhin O.N., Klimochkin Yu.N.,
kov V.N., Malinovskaya Yu.A., Levina A.S.,
Osyanin V.A., Reznikov A.N., Fisyuk A.S., Sagitulli-
Zhuravlev O.E., Voronchikhina L.I., Fisyuk A.S., Akse-
na G.P., Aksenov A.V., Aksenov N.A., Grachev M.K.,
nov A.V., Aksenov N.A., Aksenova I.V. Russ.
Maslennikova V.I., Koroteev M.P., Brel’ A.K., Lisi-
J. Org. Chem. 2017, 53, 1275-1437.] doi 10.1134/
na S.V., Medvedeva S.M., Shikhaliev Kh.S., Su-
S1070428017090019
boch G.A., Tovbis M.S., Mironovich L.M., Iva-
nov S.M., Kurbatov S.V., Kletskii M.E., Burov O.N.,
2. Коновалов А.И., Антипин И.С., Бурилов В.А., Мад-
Kobrakov K.I., Kuznetsov D.N., Russ. J. Org. Chem.
жидов Т.И., Курбангалиева А.Р., Немтарев А.В.,
2018, 54, 157-371.] doi 10.1134/S107042801802001X
Соловьева С.Е., Стойков И.И., Мамедов В.А., За-
харова Л.Я., Гаврилова Е.Л., Синяшин О.Г., Ба-
3. Zhdanko A.G., Gulevich A.V., Nenajdenko V.G.
лова И.А., Васильев А.В., Зенкевич И.Г., Краса-
Tetrahedron. 2009, 65, 4692-4702. doi 10.1016/
вин М.Ю., Кузнецов М.А., Молчанов А.П., Нови-
j.tet.2009.04.030
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
512
КУТОВАЯ, НЕНАЙДЕНКО
4.
Gulevich A. V., Zhdanko A.G., Orru R.V.A., Nenajden-
19.
Nenajdenko V.G, Gulevich A.V., Sokolova N.V., Mi-
ko V.G. Chem. Rev. 2010, 110, 5235-5331. doi 10.1021/
ronov A.V., Balenkova E.S. Eur. J. Org. Chem. 2010,
cr900411f
1445-1449. doi 10.1002/ejoc.200901326
5.
Nenajdenko V.G., Isocyanide Chemistry: Applications
20.
Betageri R., Zhang Y., Zindell R.M., Kuzmich D.,
Kirrane T.M., Bentzien J., Cardozo M., Capolino A.J.,
in Synthesis and Material Science. Weinheim: Wiley-
Fadra T.N., Nelson R.M., Paw Z., Shih D.T., Shih C.K.,
VCH, 2012. doi 10.1002/9783527652532
Zuvela-Jelaska L., Nabozny G., Thomson D.S. Bioorg.
6.
Smolyar I.V., Yudin A.K., Nenajdenko V.G. Chem.
Med. Chem. Lett. 2005, 15, 4761-4769. doi 10.1016/j.
Rev. 2019, 119, 10032-10240. doi 10.1021/
bmcl.2005.07.025
acs.chemrev.8b00789
21.
Политанская Л.В., Селиванова Г.А., Пантелее-
7.
Kitagakia J., Shic G., Miyauchi S., Murakamia S., Yang Y.
ва Е.В., Третьяков Е.В., Платонов В.Е., Никуль-
Anti-Cancer Drug. 2015, 26, 259-271. doi 10.1097/
шин П.В., Виноградов А.С., Зонов Я.В., Карпов В.М.,
CAD.0000000000000183
Меженкова Т.В., Васильев А.В., Колдобский А.Б.,
Шилова О.С., Морозова С.М., Бургарт Я.В., Ще-
8.
Ballard C.E., Yu H., Wang B. Curr. Med. Chem. 2002,
гольков Е.В., Салоутин В.И., Соколов В.Б., Аксинен-
9, 471-498. doi 10.2174/0929867023371049
ко А.Ю., Ненайденко В.Г., Москалик М.Ю., Аста-
9.
Lemmens-Gruber R., Kamyar M.R., Dornetshuber R.
хова В.В., Шаинян Б.А., Таболин А.А., Иоффе С.Л.,
Curr. Med. Chem. 2009, 16, 1122-1137. doi 10.2174/
Музалевский В.М., Баленкова Е.С., Шастин А.В.,
092986709787581761
Тютюнов А.А., Бойко В.Э., Игумнов С.М., Диль-
10.
Seo C., Yim H.J., Lee H.K., Park S.M., Sohn J.-H., Oh H.
ман А.Д., Адонин Н.Ю., Бардин В.В., Масоуд С.М.,
Tetrahedron Lett. 2008, 49, 29-31. doi 10.1016/j.
Воробьева Д.В., Осипов С.Н., Носова Э.В., Ли-
tetlet.2007.11.022
пунова Г.Н., Чарушин В.Н., Прима Д.О., Мака-
ров А.Г., Зибарев А.В., Трофимов Б.А., Собени-
11.
Wang D., Song S., Tian Y., Xu Y., Miao Z., Zhang A. J.
на Л.Н., Беляева К.В., Сосновских В.Я., Обыден-
Nat. Prod. 2013, 76, 974-978. doi 10.1021/np4001027
нов Д.Л., Усачев С.А. Усп. хим. 2019, 88, 425-569.
12.
Kaneda M., Sueyoshi K., Teruya T. Ohno H., Fujii N.,
[Politanskaya, L.V., Selivanova, G.A., Panteleeva, E.V.,
Oishi S. Org. Biomol. Chem. 2016, 14, 9093-9104. doi
Tretyakov, E.V., Platonov, V.E., Nikul’shin, P.V., Vino-
10.1039/C6OB01583B
gradov, A.S., Zonov, Ya.V., Karpov, V.M., Mezhenko-
va, T.V., Vasilyev, A.V., Koldobskii, A.B., Shilova, O.S.,
13.
Takusagawa F. J. Antibiot. 1985, 38, 1596-1604. doi
Morozova, S.M., Burgart, Ya.V., Shchegolkov, E.V., Sa-
10.7164/antibiotics.38.1596
loutin, V.I., Sokolov, V.B., Aksinenko, A.Yu., Nenaj-
14.
Cochrane J.R., Yoon D.H., McErlean C.S.P., Jolliffe K.A.
denko, V.G., Moskalik, M.Yu., Astakhova, V.V.,
Beilstein J. Org. Chem. 2012, 8, 1344-1351. doi
Shainyan, B.A., Tabolin, A.A., Ioffe, S.L., Muzalevs-
10.3762/bjoc.8.154
kiy, V.M., Balenkova, E.S., Shastin, A.V., Tyutyu-
15.
Zakharova E.A., Kutovaya I.V., Shmatova O.I., Khrus-
nov, A.A., Boiko, V.E., Igumnov, S.M., Dilman, A.D.,
talev V.N., Nenajdenko V.G. Org. Biomol. Chem. 2019,
Adonin, N.Yu., Bardin, V.V., Masoud, S.M., Vorobye-
17, 3433-3445. doi 10.1039/C9OB00229D
va, D.V., Osipov, S.N., Nosova, E.V., Lipunova, G.N.,
Charushin, V.N., Prima, D.O., Makarov, A.G., Ziba-
16.
Kutovaya I.V., Zakharova E.A., Shmatova O.I.,
rev, A.V., Trofimov, B.A., Sobenina, L.N., Belyae-
Nenajdenko V.G. Eur. J. Org. Chem. 2019, 4855-4862.
va, K.V., Sosnovskikh, V.Ya., Obydennov, D.L.,
doi 10.1002/ejoc.201900780
Usachev, S.A., Russ. Chem. Rev., 2019, 88, 425-569.]
17.
Zakharova E.A., Shmatova O.I., Nenajdenko V.G. Russ.
doi 10.1070/RCR4871
Chem. Rev. 2018, 87, 619-635. doi 10.1070/RCR4788
22.
Gulevich A.V., Shpilevaya I.V., Nenajdenko V.G.
18.
Kazemizadeh A.R., Ramazani A. Curr. Org. Chem.
Eur. J. Org. Chem. 2009, 3801-3808. doi 10.1002/
2012, 16, 418-450. doi 10.2174/138527212799499868
ejoc.200900330
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ МАКРОЦИКЛИЧЕСКИХ ДЕПСИПЕПТИДОВ
513
Synthesis of Macrocyclic Depsipeptides Based on Passerini -
“Click” Strategy
I. V. Kutovaya and V. G. Nenajdenko*
Lomonosov Moscow State University, Department of Chemistry, 119991, Russia, Moscow, Leninskie gory 1, str. 3
*e-mail: nenajdenko@gmail.com
Received September 7, 2019; revised October 18, 2019; accepted December 2, 2019
The combination of Passerini - click reactions was investigated as a method for the synthesis of triazole-
containing macrocyclic depsipeptides. It has been shown that the key factors determining the direction of
macrocyclization are the length of the linear depsipeptide and the presence of hard fragments. It has been
established that the proposed strategy allows the synthesis of monomeric (12-13 membered) and dimeric (24-28
membered) triazole-containing cyclic depsipeptides with yields of up to 97%.
Keywords: Passerini reaction, triazole, macrocycle, depsipeptide, selectivity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020