ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 4, с. 568-575
УДК 547.567.5
СИНТЕЗ ПРОИЗВОДНЫХ 1,3-БЕНЗОКСАТИОЛ-2-ОНА
НА ОСНОВЕ N-(4-ОКСОЦИКЛОГЕКСА-2,5-ДИЕН-
1-ИЛИДЕН)МОЧЕВИН
© 2020 г. С. А. Коноваловаa, А. П. Авдеенкоa, *, В. В. Дьяконенкоb, С. В. Шишкинаb
a Донбасская государственная машиностроительная академия,
84313, Украина, г. Краматорск-13, ул. Академическая 72
b ГНУ НТК «Институт монокристаллов» НАН Украины, 61001, Украина, г. Харьков, пр. Науки 60
*е-mail: chimist@dgma.donetsk.ua
Поступила в редакцию 11 декабря 2019 г.
После доработки 13 февраля 2020 г.
Принята к публикации 18 февраля 2020 г.
Производные 1,3-бензоксатиол-2-она синтезированы в результате реакций N-(4-оксоциклогекса-2,5-ди-
ен-1-илиден)мочевин с роданидом калия и тиомочевиной. В большинстве случаев реакции с тиомоче-
виной в этаноле в присутствии соляной кислоты дают наибольшие выходы. Для N-(2,6-диметил-4-оксо-
циклогекса-2,5-диен-1-илиден)мочевины наибольший выход получен в реакции с роданидом калия. В
результате реакции N-(3,5-диметил-4-оксоциклогекса-2,5-диен-1-илиден)мочевины с роданидом калия
получен 3-гидрокси-2,4-диметил-6-(карбамоиламино)фенил тиоцианат, с тиомочевиной - 5-гидрокси-
4,6-диметил-2Н-1,3-бензоксатиол-2-он. В реакции N-(4-оксоциклогекса-2,5-диен-1-илиден)мочевин
с роданидом калия, фактором, определяющим направление реакции, является энергия интермедиата,
образующегося на первой стадии реакции.
Ключевые слова: 1,3-бензоксатиол-2-он, тиомочевина, N-(4-оксоциклогекса-2,5-диен-1-илиден)моче-
вина, роданид калия, биологическая активность.
DOI: 10.31857/S0514749220040084
Бензоксатиолоны и их производные являют-
данным работы [4] могут служить хорошей ос-
ся важными фармакофорами с разнообразной
новой для синтеза производных 1,3-бензоксати-
фармакологической активностью. В частности,
ол-2-она.
производные
1,3-бензоксатиол-2-она проявляют
Целью данной работы является получение но-
антиокислительную [1], противовирусную [2], ан-
вых производных 1,3-бензоксатиол-2-она на осно-
тибактериальную и противогрибковую активности
ве N-(4-оксоциклогекса-2,5-диен-1-илиден)моче-
[3]. Актуальным является получение новых произ-
вин и разработка наиболее оптимального метода
водных 1,3-бензоксатиол-2-она и разработка про-
их синтеза. Для достижения этой цели были иссле-
стых методов их синтеза.
дованы реакции мочевин 1-5 с роданидом калия
Ранее производные
1,3-бензоксатиол-2-она
и тиомочевиной в различных условиях. Реакцию
были получены в результате реакции различных
с роданидом калия проводили в ледяной уксусной
N-замещенных
4-иминоциклогекса-2,5-диен-1-
кислоте с соотношением реагентов 1:2 (метод а),
онов с роданидом калия [4], а также в результате
с тиомочевиной - в уксусной кислоте с соотноше-
взаимодействия производных циклогекса-2,5-ди-
нием реагентов 1:13 (метод б), в этаноле с соот-
ен-1,4-диона с тиомочевиной [1, 2, 5]. В работе [6]
ношением реагентов 1:6 (метод в) и 1:2 (метод г).
были синтезированы новые N-(4-оксоциклогекса-
В результате были выделены N-(2-оксо-2H-1,3-
2,5-диен-1-илиден)мочевины, которые согласно
бензоксатиол-5-ил)мочевины 6-11 (схема 1).
568
СИНТЕЗ ПРОИЗВОДНЫХ 1,3-БЕНЗОКСАТИОЛ-2-ОНА
569
Схема 1.
1
R1
R2
O
R
R2
O
а. KCNS;
H2N
H2N
б, в, г. (NH2)2CS
N
O
HN
O
S
O
R3
R3
1-5
6-11
1, 6, R1 = R2 = R3 = H; 2, 7, R2 = Me, R1 = R3 = H; 3, 8, R1 = H, R2 = R3 = Me;
4, 9, R2 = H, R1 = R3 = Me; 5, 10, R1 = Me, R2 = R3 = H; 11, R3 = Me, R1 = R2 = H.
Наибольший выход целевых продуктов полу-
женным структурам. В спектре ЯМР 1Н соедине-
чен при взаимодействии соединения 4 с родани-
ния 10 присутствуют два синглета протонов Н4 и
дом калия - 75% (метод а) и при взаимодействии
Н7 при 7.83 и 7.30 м.д., а в спектре соединения 11 -
соединения 3 с тиомочевиной - 85% (метод в).
два дублета с орто-константой спин-спинового
Следует отметить, что метод г оказался наиболее
взаимодействия протонов Н6 и Н7 с химически-
неудачным - в большинстве случаев образовыва-
ми сдвигами 7.69 и 7.25 м.д., соответственно. В
лись трудно анализируемые многокомпонентные
спектре ЯМР 13С соединения 8 присутствуют ха-
смеси. Только в случае мочевин 2 и 3 были выде-
рактерные для 1,3-бензоксатиол-2-онов сигналы
лены продукты 7 и 8 с выходом 10 и 15%, соответ-
атомов С3а (120.61 м.д.), С7a (141.55 м.д.) и группы
ственно.
С=О (168.36 м.д.) [4].
В результате
реакции
N-(2-метил-4-
В ИК спектрах соединений 6-11 присутствует
оксоциклогекса-2,5-диен-1-илиден)мочевины
(5)
интенсивная полоса поглощения в области 1760-
с роданидом калия (метод а) и тиомочевиной в
1750 см-1, соответствующая группе С=О 1,3-бен-
среде этанола (метод в) была выделена смесь изо-
зоксатиол-2-онов, в области 3340-3290 см-1, соот-
меров 10 и 11 с процентным соотношением 80:20.
ветствующая группам NH, NH2, и отсутствует по-
Соединение 11 выделить в индивидуальном виде
глощение в областях, характерных для групп ОН,
не удалось, оно было получено только в смеси с
SCN, NCS.
продуктом 10. Ранее подобное региоселективное
Согласно литературным данным направление
присоединение нуклеофила в хиноидное ядро на-
роданирования соединений, содержащих хинони-
блюдалось при гидрогалогенировании N-(2-метил-
миновое ядро, зависит от энергии НСМО исходно-
4-оксоциклогекса-2,5-диен-1-илиден)ацет(арил)-
го соединения [4, 8]. Для хинониминов с низким
амидов [7], однако, разделение изомеров представ-
значением энергии НСМО на первой стадии ре-
ляло определенные трудности. Изомер 10 с выхо-
акции происходит 1,4-присоединение роданид-а-
дом 50% был выделен в индивидуальном виде в
ниона атомом серы с образованием тиоцианата,
результате реакции мочевины 5 с тиомочевиной
затем в результате циклизации образуются 2-ими-
в уксусной кислоте (метод б). Таким образом, ре-
но-1,3-бензоксатиолы, последующий гидролиз
акция соединения 5 с тиомочевиной в уксусной
которых приводит к образованию N-замещенных
кислоте становится региоспецифичной - выделен
5-амино-1,3-бензоксатиол-2-онов [4, 8]. В случае
только один из возможных изомеров.
хинонмоноиминов с высоким значением НСМО
Строение соединений 6-11 доказано на основа-
на первом этапе протекает 1,4-присоединение ро-
нии данных элементного анализа, ЯМР 1Н, 13С и
данид-аниона атомом азота с образованием изо-
тиоцианата, последующая циклизация которого
ИК-спектроскопии. В спектрах ЯМР 1Н продуктов
приводит к образованию 5-амино-1,3-бензокса-
6-11 присутствуют характерные сигналы протонов
ядра и алкильных заместителей, уширенные син-
зол-2-тиона [8, 9].
глеты протонов группы NH2 и синглеты протонов
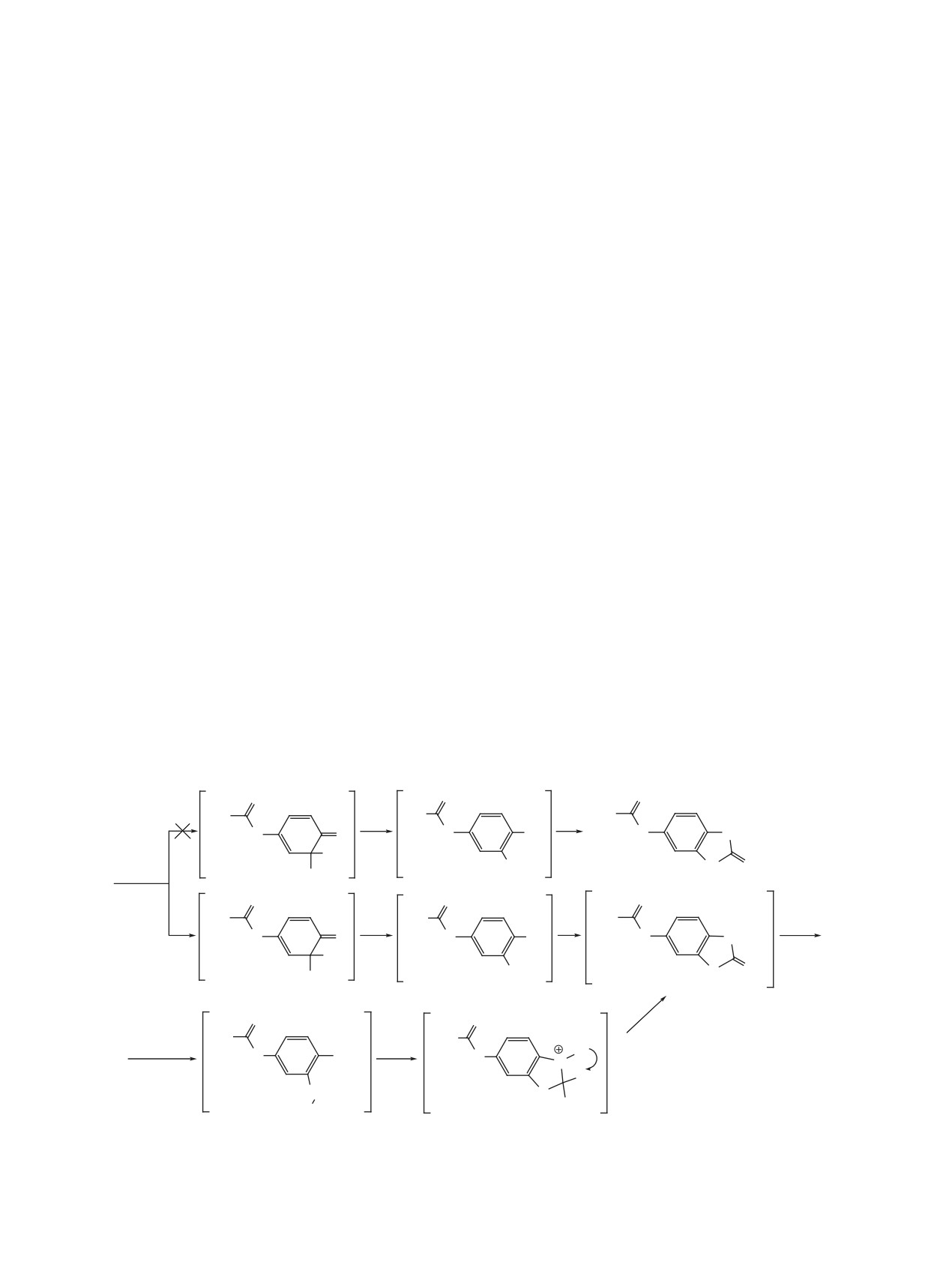
Согласно квантово-химическим расчетам
группы NH, полностью соответствующие предло-
энергия НСМО исходной мочевины
1 равна
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
570
КОНОВАЛОВА и др.
–363.62 кДж/моль, что близко к энергии НСМО
присоединению роданид-аниона атомом серы, на
N-(4-оксоциклогекса-2,5-диен-1-илиден)-3-фенил-
15.49 кДж/моль (схема 2). То есть присоедине-
проп-2-енамида
(-356.69 кДж/моль) и N-(4-
ние роданид-аниона атомом серы является более
оксоциклогекса-2,5-диен-1-илиден)-2-фенилаце-
выгодным, что полностью согласуется с экспе-
тамида (-366.60 кДж/моль) [8], для которых полу-
риментом - в результате роданирования мочевин
чены продукты, образующиеся через стадию при-
1-5 получены только продукты 6-11, образующи-
соединения роданид-аниона как атомом серы, так
еся через интермедиаты C→D→E. На основании
и атомом азота. На основании этого можно было
этого можно сделать вывод, что основным факто-
бы предположить, что при роданирование моче-
ром, определяющим направление роданирования
вин 1-5 могут быть выделены производные 5-ами-
N-(4-оксоциклогекса-2,5-диен-1-илиден)мочевин
но-1,3-бензоксатиол-2-она 6 и 5-амино-1,3-бензок-
1-5, является не энергия НСМО исходного соеди-
сазол-2-тиона 12 (схема 2), то есть присоединение
нения, а энергия образующегося в ходе реакции
интермедиата С.
роданид-аниона на первой стадии может протекать
как атомом серы, так и атомом азота, что противо-
На основании работ [10, 11] можно было пред-
речит эксперименту.
положить, что в результате реакции мочевин 1-5 с
тиомочевиной могут быть получены производные
В работе [8] также было высказано пред-
2-аминобензотиазола, образованию которых спо-
положение, что направление роданирования
собствует проведение реакции в этиловом спирте
N-замещенных
4-иминоциклогекса-2,5-диен-1-
в присутствии сильной кислоты [10] или избытка
онов определяется не только энергией НСМО, но
исходного бензохинонмоноимина [11], что не на-
и энергией переходных состояний, образующих-
шло экспериментального подтверждения - были
ся в результате присоединения роданид-аниона
выделены только производные
1,3-бензоксати-
к молекуле
4-иминоциклогекса-2,5-диен-1-она.
ол-2-она 6-11 (схемы 1, 2).
Согласно квантово-химическим расчетам, выпол-
ненным на примере мочевины 1, энергия пере-
Согласно литературным данным [5, 10, 11] пер-
ходного состояния А (-1021.423857 ат. ед.), соот-
вый этап реакции N-замещенных 4-иминоцикло-
ветствующего присоединению роданид-аниона
гекса-2,5-диен-1-онов с тиомочевиной включает
атомом азота, больше энергии переходного состо-
образование гидрохлорида F (схема 2). Затем ре-
яния C (-1021,429758 ат. ед.), соответствующего
акция может протекать по двум направлениям - с
Схема 2.
O
O
O
H2N
H2N
H2N
HN
O
HN
OH
HN
O
NCS
NCS
N
S
CNS
-
A
H
B
12
H
1
O
O
O
H2N
H2N
H2N
H2O
HN
O
HN
OH
HN
O
6
SCN
SCN
S
NH
H
C
D
E
O
O
-NH
3
H2N
H2N
CS(NH2)2
∆
H
1
HN
OH
HN
O
HCl
NH2
+
SC NH2
S
Cl-
NH2
H2N
F
G
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ ПРОИЗВОДНЫХ 1,3-БЕНЗОКСАТИОЛ-2-ОНА
571
образованием производных 2-аминобензотиазола
тверждается экспериментом - в результате реак-
и 1,3-бензоксатиол-2-она.
ции соединений 1-5 с тиомочевиной получены
только производные 1,3-бензоксатиол-2-она 6-11,
Производные 2-аминобензотиазола и 1,3-бен-
образующиеся, вероятно, через переходные состо-
зоксатиол-2-она ранее были получены для цикло-
яния 1→F→G→E→6 (схема 2).
гекса-2,5-диен-1,4-диона и его алкилзамещенных
аналогов [10, 11]. Для нафтален-1,4-диона и его
В результате реакции мочевины 13 с родани-
производных были выделены только производные
дом калия был получен продукт, который по спек-
2-аминобензотиазола, а для 2,5-дихлор-циклогек-
тральным характеристикам не соответствовал
са-2,5-диен-1,4-диона - только производные 1,3-
производным
5-амино-1,3-бензоксатиол-2-она,
бензоксатиол-2-она [11]. Наличие атомов хлора
5-амино-1,3-бензоксазол-2-тиона и 2-аминобензо-
в молекуле
2,5-дихлор-циклогекса-2,5-диен-1,4-
тиазола. В результате анализа данных элементного
диона значительно повышает его ОВП по срав-
анализа, спектров ЯМР 1Н, 13С и ИК было уста-
нению с незамещенным циклогекса-2,5-диен-1,4-
новлено, что в реакции мочевины 13 с роданидом
дионом, наличие алкильных заместителей - сни-
калия образуется тиоцианат 14, а с тиомочеви-
жает, а нафтален-1,4-дион и его производные име-
ной - 1,3-бензоксатиол-2-он 15 (схема 3).
ют значительно меньший ОВП, чем циклогекса-
В спектре ЯМР 1Н соединения 14 присутству-
2,5-диен-1,4-дионы [12]. Авторы работы [11] пред-
ет синглет протона Н5, два синглета протонов
положили, что образование производных 2-амино-
метильных групп 2-Ме и 4-Ме и уширенные син-
бензотиазола протекает через окислительно-вос-
глеты групп NH, OH, NH2. В спектре ЯМР 13С -
становительные процессы и данное направление
характерные сигналы атомов С3-ОН (149.89 м.д.),
протекания реакции становится возможным при
С=О (167.32 м.д.), SCN (118.01 м.д.) [4]. В ИК
снижении ОВП исходного соединения. Поэтому
спектре присутствует поглощение при 1654 см-1,
для нафтален-1,4-дионов, имеющих самый низкий
соответствующее фрагменту C6-NH, интенсив-
ОВП среди рассматриваемых соединений, в ре-
ная полоса поглощения при 2033 см-1, что со-
акции с тиомочевиной получены исключительно
ответствует группе SCN (2090-2020 см-1 [15]),
производные 2-аминобензотиазола [11].
3117 - группе ОН, 3330-3280 см-1 - группам NH,
NH2 [15, 16].
N-Замещенные
4-иминоциклогекса-2,5-диен-
1-оны имеют более высокий ОВП, чем нафта-
В спектре ЯМР 1Н соединения 15 присутствует
лен-1,4-дион и циклогекса-2,5-диен-1,4-дионы
синглет протона Н7 при 6.93 и два синглета про-
[13, 14], поэтому образование производных 2-ами-
тонов групп 4-Ме и 6-Ме при 2.24 и 2.29 м.д., со-
нобензотиазола в результате их реакции с тио-
ответственно. В спектре ЯМР 13С присутствуют
мочевиной является маловероятным, что и под-
характерные для 1,3-бензоксатиол-2-онов сигналы
Схема 3.
O
Me
H2N
HN
OH
O
Me
KCNS
NCS
Me
H2N
14
N
O
(NH2)2C=S
Me
Me
O
S
H2O
Me
O
O
O
13
OH
Me
Me
H
15
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
572
КОНОВАЛОВА и др.
атомов С3а (121.36 м.д.), С7a (141.53 м.д.) и группы
N-(4-оксоциклогекса-2,5-диен-1-илиден)мочевин.
С=О (169.45 м.д.) [4]. В ИК спектре присутству-
В большинстве случаев предпочтительными яв-
ет интенсивная полоса поглощения при 1757 см-1,
ляются реакции N-(4-оксоциклогекса-2,5-диен-
соответствующая группе С=О 1,3-бензоксатиол-2-
1-илиден)мочевин с тиомочевиной в этаноле с
онов, при 3590 см-1 - группе ОН, и отсутствует по-
соотношением реагентов 1:6 в присутствии со-
глощение в областях, характерных для групп NH,
ляной кислоты, дающие наибольшие выходы.
NH2, SCN, NCS.
Преимуществом данного метода является также
то, что он не требует дополнительной очистки про-
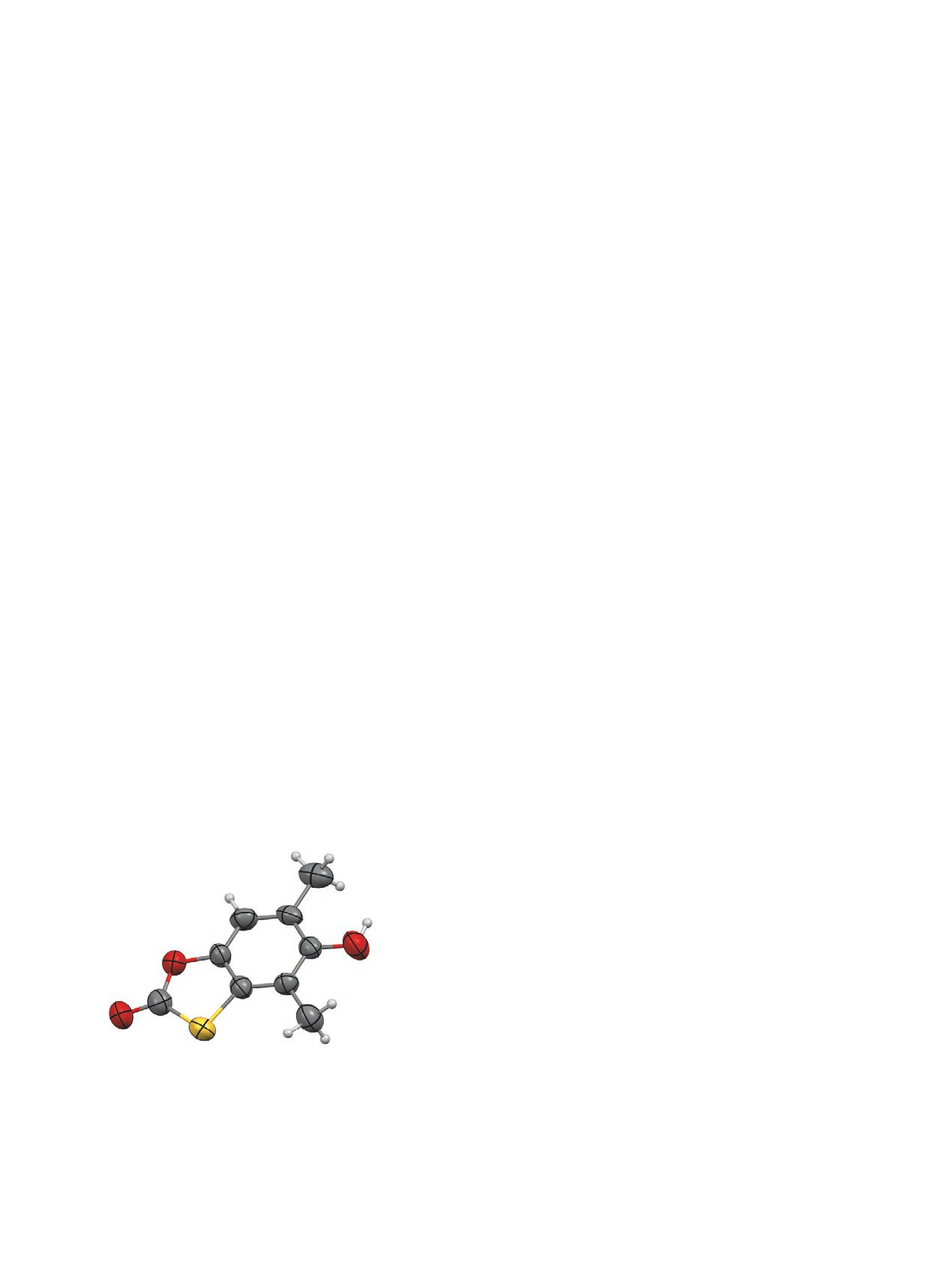
С целью подтверждения строения соединения
дуктов реакции перекристаллизацией. Для N-(2,6-
15 мы выполнили его РСА (см. рисунок).
диметил-4-оксоциклогекса-2,5-диен-1-илиден)мо-
Следует отметить, что ранее в реакциях
чевины наибольший выход дает реакция с родани-
N-замещенных
4-имино-2,6-диметилциклогек-
дом калия. В результате реакции N-(3,5-диметил-
са-2,5-диен-1-онов с роданидом калия были вы-
4-оксоциклогекса-2,5-диен-1-илиден)мочевины с
делены только восстановленные формы исходных
роданидом калия получен 3-гидрокси-2,4-диме-
4-иминоциклогекса-2,5-диен-1-онов
- соответ-
тил-6-(карбамоиламино)фенил тиоцианат, с тио-
ствующие N-замещенные 4-аминофенолы [4, 8].
мочевиной - 5-гидрокси-4,6-диметил-2Н-1,3-бен-
Продуктов присоединения роданид-аниона полу-
зоксатиол-2-он.
чено не было. На основании результатов данного
На основании квантово-химических расчетов
исследования можно предположить, что для моче-
показано, что в реакции N-(4-оксоциклогекса-2,5-
вины 13 в реакции с роданидом калия более вы-
диен-1-илиден)мочевин с роданидом калия, фак-
годным является присоединение роданид-аниона с
тором, определяющим направление реакции, яв-
образованием устойчивого продукта 14, а не вос-
ляется энергия интермедиата, образующегося на
становление до соответствующего 4-аминофено-
первой стадии реакции.
ла. В реакции с тиомочевиной вначале происходит
гидролиз исходного соединения 13 до соответству-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ющего 2,6-диметилциклогекса-2,5-диен-1,4-диона
Спектры ЯМР 1H и 13C измерены на приборе
H (схема 3), а затем - присоединение солянокис-
VXR-300 с рабочей частотой 300 МГц относитель-
лой тиомочевины к 1,4-диону H с образованием
но ТМС в ДМСО-d6. ИК спектры получены на
конечного продукта 15 через интермедиаты, ана-
спектрометре UR-20 в таблетках КBr.
логичные интермедиатам F, G, E (схема 2).
Анализ чистоты исходных соединений 1-5, 13
Таким образом, в результате данного иссле-
и продуктов реакции 6-11, 14, 15 проводили мето-
дования найдены оптимальные пути синтеза
дом ТСХ на пластинах Silufol UV-254. Для моче-
производных 1,3-бензоксатиол-2-она на основе
вин 1-5, 13 в качестве растворителя использова-
ли хлороформ, элюент - бензол-гексан, 10:1. Для
соединений 6-11, 14, 15 в качестве растворителя
C9
использовали ацетон, элюент - спирт-хлороформ,
C7
C6
1:10. Проявление УФ светом.
C7a
Квантово-химические расчеты выполнены с ис-
O1
пользованием пакета Firefly QC [17], который ча-
C4
C5
11
O
стично основан на исходном коде пакета GAMESS
8
C
(US) [18]. Оптимизации молекул мочевины 1 и ин-
C3a
термедиатов выполнены по всем геометрическим
C2
параметрам методом DFT (B3LYP) с использова-
O10
S3
нием базисного набора 6-31+G(d).
Молекулярное строение 5-гидрокси-4,6-диметил-2Н-
Рентгеноструктурное исследование соеди-
1,3-бензоксатиол-2-она (15) по данным РСА. Эллип-
соиды тепловых колебаний показаны с вероятностью
нения 15. Кристаллы соединения 15 моноклин-
50%.
ные,·C9H8O3S, при 293°С a 9.074(1), b 13.244(2),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ ПРОИЗВОДНЫХ 1,3-БЕНЗОКСАТИОЛ-2-ОНА
573
c 7.358(1) Å, β 96.14(1)°, V 879.1(2) Å3, Mr
ремешивали при комнатной температуре 30 мин,
196.21, Z 4, пространственная группа Р21/c, dвыч
затем в течение 4 ч при температуре 50-55°С, ох-
1.483 г/см3, μ(MoKα) 0.336 мм-1, F(000)
508.
лаждали до комнатной температуры и приливали к
Параметры элементарной ячейки и интенсив-
50 мл воды. Выпавший осадок отфильтровывали,
ности 5289 отражений (1548 независимых, Rint
промывали холодной водой и высушивали.
0.182) измерены на дифрактометре «Xcalibur-3»
в. К раствору 2 ммоль мочевины, растворен-
(MoKα излучение, ССD-детектор, графитовый мо-
ной в 20 мл этанола, приливали раствор 12 ммоль
нохроматор, ω-сканирование, 2θмакс 50°).
(0.91 г) тиомочевины в 20 мл этанола и 2 мл кон-
Структура расшифрована прямым методом по
центрированной соляной кислоты и перемешива-
комплексу программ SHELXTL [19]. Положения
ли при комнатной температуре 24 ч. Затем из рас-
атомов водорода выявлены из разностного син-
твора удаляли часть растворителя, а оставшийся
теза электронной плотности и уточнены по мо-
раствор оставляли на воздухе. Выпавший осадок
дели «наездника» с Uизо = nUэкв неводородного
отфильтровывали, промывали холодной водой и
атома, связанного с данным водородным (n = 1.5
высушивали.
для метильных и гидроксильной групп и n 1.2 для
г. К раствору 1 ммоль тиомочевины и 0.1 мл
остальных атомов водорода). Структура уточнена
концентрированной соляной кислоты в 2 мл эта-
по F2 полноматричным МНК в анизотропном при-
нола по каплям прибавляли раствор 2 ммоль мо-
ближении для неводородных атомов до wR2 0.141
чевины в 4 мл горячего этанола и перемешивали
по 1548 отражениям (R1 0.071 по 563 отражениям
при комнатной температуре 24 ч. Затем досуха
с F > 4σ(F), S 0.802). Координаты атомов, а также
удаляли растворитель при пониженном давлении.
полные таблицы длин связей и валентных углов
Кристаллический остаток обрабатывали горячим
депонированы в Кембриджский банк структурных
ацетонитрилом, отфильтровывали, промывали хо-
данных (e-mail: deposit@ccdc.cam.ac.uk) под номе-
лодным этанолом и высушивали.
ром CCDC 1966382.
N-(2-Оксо-2H-1,3-бензоксатиол-5-ил)мо-
N-(4-оксоциклогекса-2,5-диен-1-илиден)мо-
чевина (6). Выход 12 (а), 10 (б), 35% (в), т.пл.
чевины 1-5, 13 получены окислением соответ-
216-217°С. Спектр ЯМР 1Н, δ, м.д.: 5.94 уш.с (2H,
ствующих N-(4-гидроксифенил)мочевин оксидом
NH2), 7.30 д (1H, H7, J 9.0 Гц), 7.34 д (1H, H6, J
серебра в хлороформе по методике, описанной в
9.0 Гц), 7.89 с (1H, H4), 8.80 с (1H, NH). Найдено,
работе [6]. Характеристики хинониминов 1-5, 13
%: N 13.25; S 15,32. C8H6N2O3S. Вычислено, %: N
соответствуют литературным данным [6].
13.33; S 15.25.
Реакцию мочевин 1-5, 13 с роданидом калия
N-(7-Метил-2-оксо-2H-1,3-бензоксатиол-5-
проводили в ледяной уксусной кислоте с соот-
ил)мочевина (7). Выход 20 (а), 35 (б), 45 (в), 10%
ношением реагентов 1:2 (метод а), с тиомочеви-
(г), т.пл. 228-229°С. Спектр ЯМР 1Н, δ, м.д.: 2.29
ной - в уксусной кислоте с соотношением реа-
c (3H, 7-Me), 5.88 уш.с (2H, NH2), 7.15 уш.с (1H,
гентов 1:13 (метод б), в этаноле с соотношением
H6), 7.67 уш.с (1H, H4), 8.61 с (1H, NH). Найдено,
реагентов 1:6 (метод в) и 2:1 (метод г). а. К раство-
%: N 12.53; S 14.22. C9H8N2O3S. Вычислено, %: N
ру 2 ммоль мочевины в 20 мл ледяной уксусной
12.49; S 14.30.
кислоты прибавляли 4 ммоль (0.39 г) роданида ка-
N-(4,7-Диметил-2-оксо-2H-1,3-бензоксатиол-
лия, перемешивали и оставляли на 12-14 ч. После
5-ил)мочевина (8). Выход 45 (а), 65 (б), 85 (в), 15%
обесцвечивания в реакционную массу добавляли
(г), т.пл. 282-283°С. Спектр ЯМР 1Н, δ, м.д.: 2.13 c
воду до полного осаждения. Осадок отфильтровы-
(3H, 7-Me), 2.26 c (3H, 4-Me), 6.03 уш.с (2H, NH2),
вали, промывали теплой водой и перекристаллизо-
7.54 с (1H, H6), 7.88 с (1H, NH). Спектр ЯМР 13С, δ,
вывали из уксусной кислоты.
м.д.: 15.26 (7-Me), 16.38 (4-Ме), 118.93 (С7), 120.61
б. К раствору 2 ммоль мочевины в 40 мл ледя-
(С3а), 122.16 (С6), 123.02 (С5), 135.01 (С4), 141.55
ной уксусной кислоте, прибавляли при переме-
(С7a), 156.24 (С=Окарб), 168.36 (С2). Найдено, %:
шивании 26 ммоль (1.98 г) тиомочевины в 5 мл
N 11.84; S 13.38. C10H10N2O3S. Вычислено, %: N
концентрированной соляной кислоты. Раствор пе-
11.76; S 13.46.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
574
КОНОВАЛОВА и др.
N-(4,6-Диметил-2-оксо-2H-1,3-бензоксатиол-
2.
Шадуро О.И., Тимощук В.А., Повалишев В.Н.,
5-ил)мочевина (9). Выход 75 (а), 35 (б), 45% (в),
Андреева О.Т., Желобкович В.Е. Хим.-фарм. ж.
т.пл. 286-287°С. Спектр ЯМР 1Н, δ, м.д.: 2.16 c (3H,
1999, 33, 25-27. [Shadyro O.I., Timoshchuk V.A.,
4-Me), 2.22 c (3H, 6-Me), 5.79 уш.с (2H, NH2), 7.20
Polozov G.I., Povalishev V.N., Andreeva O.T.,
с (1H, H7), 7.71 с (1H, NH). Найдено, %: N 11.71;
Zhelobkovich V.E. Pharm. Chem. J.
1999,
33,
366-369.] doi 10.1007/BF02508708
S 13.51. C10H10N2O3S. Вычислено, %: N 11.76; S
13.46.
3.
Konieczny M. T., Konieczny W., Sabisz M., Skla-
danowski A., Wakieć R., Augustynowicz-Kopeć E.,
N-(6-Метил-2-оксо-2H-1,3-бензоксатиол-5-
Zwolska Z. Eur. J. Med. Chem. 2007, 42, 729-733. doi
ил)мочевина (10). Выход 20 (а), 50 (б), 60% (в),
10.1016/j.ejmech.2006.12.014
т.пл. 309-310°С. Спектр ЯМР 1Н, δ, м.д.: 2.24 c (3H,
4.
Авдеенко А.П., Пироженко В.В., Коновалова С.А.,
6-Me), 6.11 уш.с (2H, NH2), 7.30 с (1H, H7), 7.83 с
Романьков Д.А., Паламарчук Г.В., Шишкин О.В.
(1H, H4), 8.09 с (1H, NH). Найдено, %: N 12.40; S
ЖОрХ. 2009, 45, 419-426. [Avdeenko A.P., Pirozhen-
14.35. C9H8N2O3S. Вычислено, %: N 12.49; S 14.30.
ko V.V., Konovalova S.A., Roman’kov D.A., Pala-
N-(4-Метил-2-оксо-2H-1,3-бензоксатиол-5-
marchuk G.V., Shishkin O.V. Russ. J. Org. Chem.
ил)мочевина (11). Выход 5 (а), 0 (б), 15% (в).
2009, 45, 408-416.] doi 10.1134/S1070428009030105
Спектр ЯМР 1Н, δ, м.д.: 2.20 c (3H, 4-Me), 6.04
5.
Lau P.T.S., Kestner M. J. Org. Chem. 1968, 33,
уш.с (2H, NH2), 7.25 д (1H, H7, J 9.0 Гц), 7.69 д
4426-4431. doi 10.1021/jo01276a025
(1H, H6, J 9.0 Гц), 7.96 с (1H, NH).
6.
Коновалова С.А., Авдеенко А.П., Полищук М.В.,
3-Гидрокси-2,4-диметил-6-(карбамоил-
Лысенко Е.Н., Баумер В.Н., Омельченко И.В.,
Гончарова С.А. ЖОрХ.
2015,
51,
1772-1777.
амино)фенил тиоцианат (14). Выход 55% (а),
[Konovalova S.A., Avdeenko A.P., Polishchuk M.V.,
т.пл. 194-195°С. Спектр ЯМР 1Н, δ, м.д.: 2.25 c
Lysenko E.N., Baumer V.N., Omel’chenko I.V.,
(3H, 2-Me), 2.26 c (3H, 4-Me), 7.11 с (1H, H5), 8.68
Goncharova S.A. Russ. J. Org. Chem. 2015, 51, 1739-
уш.с (1H, NH), 9.44 уш.с (2H, NH2), 10.11 уш.с (1H,
1744.] doi 10.1134/S1070428015120131
ОH). Спектр ЯМР 13С, δ, м.д.: 14.86 (2-Me), 16.98
7.
Авдеенко А.П., Коновалова С.А., Лудченко О.Н.,
(4-Ме), 113.02 (С5), 118.01 (СSCN), 121.91 (С1),
Леденева О.П., Вакуленко А.В. ЖОрХ.
2011,
125.87 (С2), 130.82 (С4), 129.73 (С6), 149.89 (С3),
47,
223-237.
[Avdeenko A.P., Konovalova S.A.,
167.32 (С=Окарб). Найдено, %: N 17.90; S 13.39.
Ludchenko O.N., Ledeneva O.P., Vakulenko A.V.
C10H11N3O2S. Вычислено, %: N 17.71; S 13.51.
Russ. J. Org. Chem. 2011, 47, 214-229.] doi 10.1134/
5-Гидрокси-4,6-диметил-2Н-1,3-бензо-
S1070428011020102
ксатиол-2-он (15). Выход 30 (б), 35% (в), т.пл.
8.
Коновалова С.А., Авдеенко А.П., Васильева В.М.,
146-147°С. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 2.24
Гончарова С.А. ЖОрХ.
2014,
50,
1689-1693.
c (3H, 6-Me), 2.29 c (3H, 4-Me), 4.79 с (1H, OH),
[Konovalova S.A., Avdeenko A.P., Vasil’eva V.M.,
6.93 с (1H, H7). Спектр ЯМР 13С, δ, м.д.: 14.69 (4-
Goncharova S.A. Russ. J. Org. Chem. 2014, 50, 1677-
Me), 16.25 (6-Ме), 111.16 (С7), 117.73 (С4), 121.36
1682.] doi 10.1134/S1070428014110220
(С3a), 122.85 (С6), 141.53 (С7a), 149.21 (С5), 169.45
9.
Бурмистров К.С., Торопин Н.В., Бурмистров С.И.,
(С=О). Найдено, %: С 55.15; S 16.25. C9H8O3S.
Ничволода В.М. ЖОрХ. 1992, 28, 1900-1904.
Вычислено, %: С 55.09; S 16.34.
10.
ТретьяковаЕ.В.,ФлехтерО.Б.,ГалинФ.З.,ШульцЕ.Е.,
КОНФЛИКТ ИНТЕРЕСОВ
Толстиков Г.А. ЖОрХ.
2005,
41,
849-852.
[Tret’yakova E.V., Flekhter O.B., Galin F.Z.,
Авторы заявляют об отсутствии конфликта ин-
Shul’ts E.E., Tolstikov G.A. Russ. J. Org. Chem. 2005,
тересов.
41, 828-831.] doi 10.1007/s11178-005-0252-5
СПИСОК ЛИТЕРАТУРЫ
11.
Lau P.T.S., Gompf T.E. J. Org. Chem. 1970, 35, 4103-
4108. doi 10.1021/jo00837a003
1. Vellasco W.T., Gomes C.R.B., Vasconcelos T.R.A.
Mini-Rev. Org. Chem.
2011,
8,
103-109. doi
12.
Реутов О.А., Курц А.Л., Бутин К.П. Органи-
10.2174/157019311793979882
ческая химия. 3. М.: БИНОМ, 2004.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ ПРОИЗВОДНЫХ 1,3-БЕНЗОКСАТИОЛ-2-ОНА
575
13. Бурмистров К.С., Бурмистров С.И. Вопр. хим.
химтехнол. 1979, 120-122.
msu.su/gran/gamess/index.html
14. Бурмистров К.С., Торопин Н.В., Вакуленко А.В.,
18. Schmidt M.W., Baldridge K.K., Boatz J.A.,
Юрченко А.Г., Марков В.И. Вопр. хим. химтехнол.
2000, 30-33.
Elbert S.T., Gordon M.S., Jensen J.H., Koseki S.,
15. Гордон А., Форд Р. Спутник химика. М.: Мир.
Matsunaga N., Nguyen K.A., Su S., Windus T.L., Du-
1976, 200. [Gordon A.J., Ford R.A. The Chemist’s
Companion: A Handbook of Practical Data, Tech-
puis M., Montgomery J.A. J. Comput. Chem. 1993, 14,
niques, and References. New York: Wiley. 1973,
1347-1363. doi 10.1002/jcc.540141112
184.]
19. Sheldrick G.M. Acta Cryst. A.
2008,
64,
112-
16. Day E.W., Jr. PhD (Chem.) Dissertation. Iowa,
1963. doi 10.31274/rtd-180813-1456
122. doi 10.1107/S0108767307043930
Synthesis of 1,3-Benzoxatiol-2-one Derivatives Based
on N-(4-Oxocyclogex-2,5-dien-1-ylidene)ureas
S. A. Konovalovaa, A. P. Avdeenkoa, *, V. V. D’yakonenkob, and S. V. Shishkinab
a Donbass State Engineering Academy, 84313, Ukraine, Kramatorsk, ul. Akademichna 72
b Institute of Single Crystals, National Academy of Sciences of Ukraine, 61001, Ukraine, Kharkiv, pr. Nauki 60
*е-mail: chimist@dgma.donetsk.ua
Received December 11, 2019; revised February 13, 2020; accepted February 18, 2020
Derivatives of 1,3-benzoxathiol-2-one were synthesized in reactions of N-(4-oxocyclohexa-2,5-dien-1-
ylidene)ureas with potassium thiocyanate and thiourea. In the most cases, the reactions with thiourea in
ethanol in the presence of hydrochloric acid gave the highest yields. For N-(2,6-dimethyl-4-oxocyclohexa-
2,5-dien-1-ylidene)urea the highest yield was obtained in reaction with potassium thiocyanate. The reaction
of N-(3,5-dimethyl-4-oxocyclohexa-2,5-dien-1-ylidene)urea with potassium thiocyanate gave 3-hydroxy-2,4-
dimethyl-6-(carbamoylamino)phenyl thiocyanate, but in reaction with thiourea the 5-hydroxy-4,6-dimethyl-2H-
1,3-benzoxathiol-2-one was obtained. In reaction of N-(4-oxocyclohexa-2,5-diene-1-ylidene)urea with potassium
thiocyanate the energy of intermediate in the first stage defines the way of reaction.
Keywords: 1,3-benzoxathiol-2-one, thiourea, N-(4-oxocyclohexa-2,5-dien-1-ylidene)urea, potassium thio-
cyanate, bioactivity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020