ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 4, с. 584-590
УДК 547.26’118
3,28-ДИАЦЕТОКСИЛУП-20(29)-ЕН-30-ОВАЯ КИСЛОТА
И ЕЕ ω-БРОМАЛКИЛОВЫЕ ЭФИРЫ
© 2020 г. Д. В. Пономаревa, Л. Р. Григорьеваa, А. В. Немтаревa, b, *, О. В. Цепаеваa, b,
В. Ф. Мироновa, b, О. И. Гнездиловc, И. С. Антипинa, b
a ФГАОУ ВО «Казанский (Приволжский) федеральный университет»,
Химический институт им. А.М. Бутлерова, 420008, Россия, Республика Татарстан, г. Казань, ул. Кремлевская 18
b Институт органической и физической химии им. А.Е. Арбузова - обособленное структурное подразделение
ФГБУН «Федеральный исследовательский центр «Казанский научный центр РАН»,
420088, Россия, Республика Татарстан, г. Казань, ул. Арбузова 8
c Казанский физико-технический институт им. Е.К. Завойского - обособленное структурное подразделение
ФГБУН «Федеральный исследовательский центр «Казанский научный центр Российской академии наук»
420111, Россия, Республика Татарстан, г. Казань, ул. Лобачевского 2/31
*e-mail: a.nemtarev@mail.ru
Поступила в редакцию 07 ноября 2019 г.
После доработки 19 февраля 2020 г.
Принята к публикации 20 февраля 2020 г.
Разработан удобный способ получения 3β,28-диацетоксилуп-20(29)-ен-30-овой кислоты, основанный на
окислении 3β,28-диацилбетулина диоксидом селена в водном этаноле при нагревании с образованием
3β,28-диацетоксилуп-20(29)-ен-30-аля и его последующем окислении хлоритом натрия в трет-бути-
ловом спирте. Алкилированием кислоты дигалогеналканами при нагревании в среде ацетонитрила в
присутствии карбоната калия получены с высоким выходом ее галогеналкиловые эфиры.
Ключевые слова: лупановые тритерпеноиды, бетулин, аллильное окисление, галогеналкиловые эфиры,
акцептор Михаэля.
DOI: 10.31857/S0514749220040102
Природные соединения обладают большим
ванием физических методов исследования струк-
потенциалом для последующей химической мо-
туры веществ, методов биологического скрининга
дификации с целью получения новых биологиче-
и компьютерного моделирования, значительно
ски активных веществ, благодаря их полифунк-
способствовали развитию химии природных сое-
циональности. Последнее свойство предоставля-
динений и выявлению новых перспективных мо-
ет широкие возможности для конструирования
лекулярных скаффолдов для направленного дизай-
и последующего получения структурно разноо-
на веществ с практически полезными свойствами
бразных массивов синтетических производных
[9-11], среди которых выделяются производные
природных соединений, в которых природный
тритерпеноидов [12, 13]. Так, пентациклические
остов играет ключевую роль в процессе создания
тритерпеноиды лупанового ряда, содержащиеся
библиотек биологически активных молекул [1-7].
во многих растениях [14, 15], обладают рядом цен-
Например, среди соединений, перспективных для
ных биологических свойств [16, 17], что, наряду с
использования в противораковой терапии,
49%
присутствием в их молекулах различных функци-
имеют природное происхождение, или являются
ональных групп, удобных для дальнейшей хими-
различными синтетическими производными при-
ческой модификации, делает их привлекательной
родных структур [8]. Достижения последних не-
синтетической платформой для направленного
скольких десятилетий, связанные с совершенство-
конструирования лекарственных веществ
[18].
584
3,28-ДИАЦЕТОКСИЛУП-20(29)-ЕН-30-ОВАЯ КИСЛОТА И ЕЕ ω-БРОМАЛКИЛОВЫЕ ЭФИРЫ
585
Наиболее изученным и доступным представите-
ние в медицинской практике сравнительно недав-
лем этого класса соединений является бетулин,
но одобренных акриламидосодержащих средств
выделяемый из растительного сырья, в частности -
свидетельствует о целесообразности исследова-
из внешней части коры различных видов березы
ния систем, являющихся акцепторами Михаэля
(Betula sp.) [14].
[21]. Влияние α,β-ненасыщенного карбонильного
фрагмента на биологическую активность было ис-
В настоящей работе предложен удобный и эф-
следовано на примере производного бетулиновой
фективный способ получения 3,28-диацетокси-
кислоты - 3β-гидрокси-30-оксолуп-20(29)-ен-28-
луп-20(29)-ен-30-овой кислоты 3 и ее ω-галогенал-
овой кислоты, которое проявляет более высокий
киловых эфиров 4 на основе диацетата бетулина 1
уровень активности в ингибировании топоизоме-
(схема 1). Луп-20(29)-ен-30-овые кислоты инте-
разы I [22] по сравнению с немодифицированной
ресны присутствием в их структуре сопряженных
бетулиновой кислотой.
фрагментов с электроноакцепторными группами,
что придает им свойства акцепторов Михаэля,
Лупановые тритерпеноиды, являющиеся акцеп-
способных к ковалентному связыванию с биоми-
торами Михаэля, обнаружены в природе, напри-
шенями. Акцепторы Михаэля способны к ингиби-
мер, 3β,28-дигидроксилуп-20(29)-ен-30-аль выде-
рованию некоторых ферментов, за счет прочного
лен из Cyclolepis genistoides D. Don (Asteraceae),
связывания с ними [19, 20]. Несмотря на мощный
однако его содержание в данном сырье является
потенциал таких сопряженных фармакофорных
крайне низким [23]. В связи с этим экономически
фрагментов для разработки новых лекарственных
более целесообразными представляются методы
соединений, содержащие их структуры долгое вре-
направленной химической модификации, позво-
мя не использовались в виду предполагаемого от-
ляющие получать С-30-оксопроизводные пента-
сутствия селективности действия. Однако появле-
циклических тритерпеноидов.
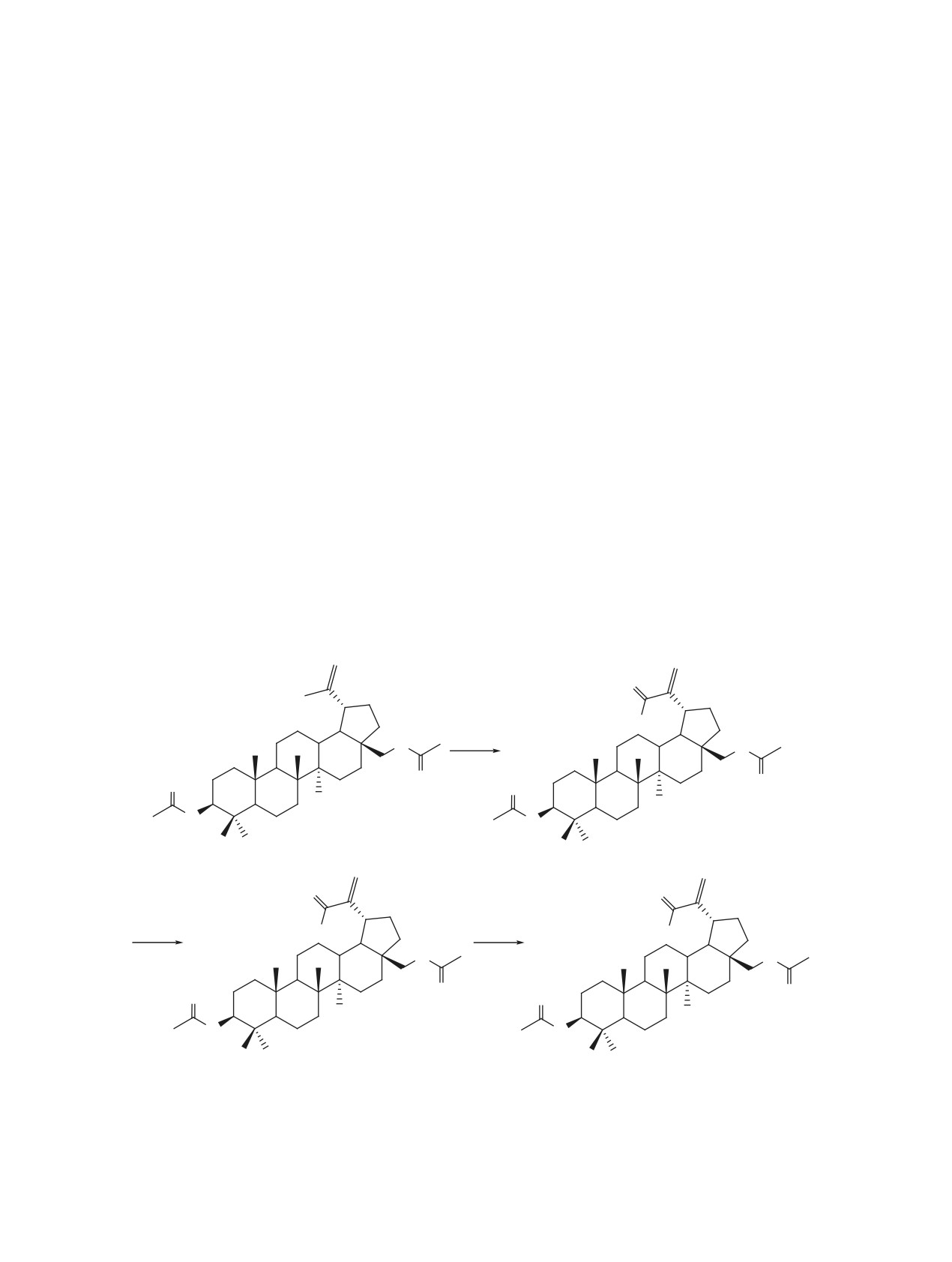
Схема 1.
29
20
O
30
19
21
30
12
22
H
13
17
11
18
a
25
26
O
O
1
14
28
16
28
2
9
O
O
10
8
O
15
O
3
3
4
727
5
O
O
6
23
24
1
2
O
O
30
30
b
HO
c
RO
O
O
28
28
O
O
O
O
3
3
O
O
3
4a, b
a, SeO2, EtOH, H2O, t; b, NaClO2, KH2PO4, 2-метилбутен-2, t-BuOH, H2O;
c, Br(CH2)3Br/Br(CH2)5Br, K2CO3, MeCN, t.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
586
ПОНОМАРЕВ и др.
Среди производных пентациклических тритер-
ряда, окисленных по положению С30. Полученные
пеноидов особого внимания заслуживают галоге-
эфиры диацетоксилуп-20(29)-ен-30-овой кислоты
налкиловые эфиры, которые хоть и не обладают
обладают значительным синтетическим потенци-
сами по себе выраженной биологической активно-
алом для проведения дальнейшей функционализа-
стью [24, 25], но являются ценными прекурсорами
ции тритерпеновой платформы.
в синтезе мультитаргетных агентов [26-33], что
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
подчеркивает актуальность разработки подходов
к данному классу функциональных производных.
Спектры ЯМР 1Н, 13С записаны при 25°С
на приборе Bruker Avance-400
[400.0
(1Н),
В данной работе описан способ получения ди-
100.6 (13С) МГц], в CDCl3 относительно сигналов
ацетоксилуп-20(29)-ен-30-овой кислоты (соедине-
остаточных протонов или ядер дейтерия раствори-
ние 3) посредством последовательного окисления
теля (1H и 13С). ИК спектры зарегистрированы на
диацилбетулина 1 диоксидом селена в водном эта-
приборе Bruker Tensor 27 для образцов в таблет-
ноле при нагревании с образованием лупеналя 2 с
ках KBr. Оптическое вращение измерено при 20°C
выходом 60%, окисление которого по Пиннику хло-
на автоматическом поляриметре Atago POL-1/2 с
ритом натрия дает кислоту 3 с выходом 98% (59%
внешним модулем Пельтье (концентрация указана
в пересчете на исходный диацетат 1) (схема 1).
в г/100 мл). Температуры плавления определены
ω-Галогеналкиловые эфиры 4 получены алкилиро-
на плавильном столике Boetius. Элементный ана-
ванием кислоты 3 α,ω-дибромалканами (на приме-
лиз соединений выполнен на элементном CHNS-O
ре 1,3-дибромпропана и 1,5-дибромпентана) при
высокотемпературном анализаторе EuroEA 3028-
кипячении в ацетонитриле в присутствии K2CO3.
HT-OM Eurovector S.p.A. Растворители очищали
Состав и строение полученных веществ под-
и высушивали по стандартным методикам.
тверждены комплексом физико-химических мето-
Диацетат бетулина 1 получали согласно литера-
дов исследования: одно- и двумерные эксперимен-
турной методике [36].
ты спектроскопии ЯМР (1H, 13С-{1H}, DEPT-135,
3β,28-Диацетоксилуп-20(29)-ен-30-аль
(2).
HSQC, HMBC), ИК спектроскопия, элементный
Смесь 1.0 г (1.9 ммоль) соединения 1 и 0.53 г
анализ. При рассмотрении спектров ЯМР 13С-{1H}
SeO2 (4.75 ммоль), 40 мл этилового спирта и 4 мл
соединений 2-4, зарегистрированных при 25°С,
воды перемешивали при 100°C в течение 6 ч.
обращает на себя внимание сильная уширенность
Полученный раствор отделяли декантацией от
и низкая интенсивность сигналов углеродов C12,
выпавшего элементного селена. Спирт отгоня-
C18, C20, C21 и C29, а сигнал углерода C19 настолько
ли в вакууме (15 мм рт.ст.), к остатку добавля-
уширен, что не обнаруживается в спектре. В дву-
ли этилацетат, промывали водой. Органический
мерных гетерокорреляционных (13С-1Н) спектрах
слой сушили безводным Na2SO4, после чего,
HSQC кросс-пики между H19 и C19 также не про-
упаривали досуха. Желтый остаток очищали ме-
являются. Данное явление объясняется наличием у
тодом колоночной хроматографии при исполь-
C30-оксопроизводных лупановых тритерпеноидов
зовании системы петролейный эфир-этилацетат
ротамеров за счет затрудненного вращения по свя-
(5:1). Выход 0.62 г (60%), т.пл. 139-141°C, [α]D20
зи С19-С20 [34, 35]. Как и в работе [26], положение
+10.2 (с 0.2, CHCl3). ИК спектр, ν, см-1: 2946,
сигнала C19 в спектрах ЯМР 13С удалось устано-
2873, 1737 (C=O), 1693 (CH=O), 1636 (=CH2),
вить по данным гетероядерных корреляций HSQC в
1458,
1391,
1366,
1245 (CH3CO),
1031,
979,
условиях регистрации спектров при 40°C. В указан-
943, 901 (=CH2), 753. Спектр ЯМР 1Н (CDCl3,
ных условиях в двумерном спектре HSQC альдеги-
40°C), δ, м.д.: 0.72-2.25 м (23H), 0.76 д (1H, H5,
да 2 наблюдается кросс-пик между H19 и C19, что
3JHH 9.4 Гц), 0.82 уш.с (9H, H23-25),
0.93
(3H,
позволило надежно установить область проявле-
H27), 1.01 с (3H, H26), 2.04 c [3H, CH3С(O)OC3],
ния резонанса углерода C19 (δС 36.9-37.1 м.д.), в
2.07 c [3H, CH3С(O)OC28], 2.80 д.д.д (1H, H19,
которой он налагается с резонансом углерода С10.
3JHH 11.7, 3JHH 4.3-4.5 Гц), 3.86 д (1H, HA28, 2JHH
Таким образом, в работе представлен удобный
11.0 Гц), 4.27 д (1H, HB28, 2JHH 11.0 Гц), 4.45 д.д
способ получения тритерпеноидов лупанового
(1H, H3, 3JHH 10.6, 3JHH 5.5 Гц), 5.93 c (1H, HА29),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
3,28-ДИАЦЕТОКСИЛУП-20(29)-ЕН-30-ОВАЯ КИСЛОТА И ЕЕ ω-БРОМАЛКИЛОВЫЕ ЭФИРЫ
587
6.28 с (1H, HB29), 9.50 с (1H, H30). Спектр ЯМР
Общая методика синтеза ω-галогеналкило-
13С-{1H} (CDCl3), δ, м.д.: 194.73 (С30),
171.48
вых эфиров 3β,28-диацетоксилуп-20(29)-ен-30-
[CH3С(O)OC28], 171.02 [CH3С(O)OC3], 156.46 уш.с
овой кислоты. К смеси 0.15 г (0.27 ммоль) со-
(С20), 133.45 уш.с (C29), 80.84 (С3), 62.38 (С28),
единения 3 и 0.75 г (0.54 ммоль) K2CO3 в 20 мл
55.32 (С5), 51.35 уш.с (С18), 50.04 (С9), 46.55 (С17),
ацетонитрила добавляли 0.54 ммоль 1,ω-дибро-
42.54 (С14), 40.79 (С8), 38.33 (С1), 37.76 (С4), 37.18
малкана и перемешивали при 85°C в течение 20 ч.
(С13), 36.99 (С10), 36.90-37.10 уш.с (С19, наложился
Контроль за прохождением реакции осуществляли
с сигналом С10), 34.46 (С22), 34.07 (C7), 31.98 уш.с
по ТСХ в системе петролейный эфир-этилацетат
(С21), 29.69 (С16), 27.93 (С23), 27.42 (С12), 26.94 (С15),
(4:1). Ацетонитрил удаляли в вакууме (15 мм рт.ст.),
23.64 (С2), 21.32 [CH3С(O)OC3], 21.04 [CH3С(O)
к остатку добавляли 50 мл воды и экстрагирова-
OC28], 20.77 (С11), 18.13 (С6), 16.49 (С24), 16.10
ли хлороформом (3×20 мл). Органический слой
(С25), 15.97 (С26), 14.57 (С27). Найдено, %: С 75.44;
промывали 10%-ным раствором NaCl, сушили над
Н 9.78. C34H52O5. Вычислено, %: С 75.52; Н 9.69.
Na2SO4, упаривали досуха в вакууме (15 мм рт.ст.).
Полученную смолооборазную массу светло-корич-
3β,28-Диацетоксилуп-20(29)-ен-30-овая кис-
невого цвета выдерживали в вакууме (15 мм рт.ст)
лота (3). 0.5 г (0.92 ммоль) соединения 2 раство-
при 120°C в течение 2 ч. Остаток очищали мето-
ряли в 25 мл трет-бутилового спирта. К раствору
дом колоночной хроматографии, элюент - петро-
приливали 25 мл 2-метилбутена-2, 25 мл раство-
лейный эфир-этилацетат (4:1).
ра 2.5 г (18.49 ммоль) KH2PO4 в воде и добавляли
(3-Бромпропил)-3β,28-диацетоксилуп-
0.34 г (3.7 ммоль) NaClO2. После 8 ч перемеши-
20(29)-ен-30-оат (4a). Выход 0.14 г (77%), т.пл.
вания трет-бутиловый спирт и 2-метилбутен-2
57-58°C, [α]D20 -4.1 (с 0.2, CHCl3). ИК спектр, ν,
удаляли в вакууме. К остатку добавляли 150 мл
см-1: 2946, 2872, 1736 (C=O), 1715 (COOH), 1624
раствора NH4Cl, экстрагировали этилацетатом
(=CH2), 1458, 1391, 1366, 1245 (CH3CO), 1147,
(3×50 мл). Органический слой промывали во-
1031, 979, 944, 900 (=CH2), 788, 760. Спектр ЯМР
дой, сушили Na2SO4, упаривали досуха в вакууме
(15 мм рт. ст). Выход 0.50 г (98%), т.пл. 233-235°C,
1Н (CDCl3), δ, м.д.: 0.73-2.19 м (23H), 0.76 д (1H,
H5, 3JHH 9.3 Гц), 0.83 уш.с (9H, H23-25), 0.93 (3H,
[α]D20 -3.2 (с 0.2, CHCl3). ИК спектр, ν, см-1: 3448
H27), 1.01 (3H, H26), 2.03 c [3H, CH3С(O)OC3], 2.07
(OH), 2947, 2874, 1737 (C=O), 1716 (COOH), 1625
c [3H, CH3С(O)OC28], 2.23 т.т (2H, С32H2, 3JHH
(=CH2), 1459, 1391, 1367, 1245 (CH3CO), 1031, 979,
6.3 Гц), 2.75 д.д.д (1H, H19, 3JHH 11.2, 3JHH 5.6 Гц),
945, 902 (=CH2), 750. Спектр ЯМР 1Н (CDCl3), δ,
3.47 т (2H, СH2Br, 3JHH 6.5 Гц), 3.84 д (1H, HA28,
м.д.: 0.73-2.26 м (23H), 0.77 д (1H, H5, 3JHH 9.7 Гц),
2JHH 11.0 Гц), 4.26 д (1H, HB28, 2JHH 11.0 Гц), 4.30
0.84 уш.с (9H, H23-25), 0.95 с (3H, H27), 1.03 с (3H,
уш.т (2H, OСH2, 3JHH 6.0 Гц), 4.45 д.д (1H, H3,
H26), 2.04 c [3H, CH3С(O)OC3], 2.08 c [3H, CH3С(O)
3JHH 10.4, 3JHH 5.8 Гц), 5.57 c (1H, HА29), 6.07 с
OC28], 2.78 д.д.д (1H, H19, 3JHH 11.3, 3JHH 5.5 Гц),
(1H, HB29). Спектр ЯМР 13С-{1H} (CDCl3), δ, м.д.:
3.86 д (1H, HA28, 2JHH 11.0 Гц), 4.27 д (1H, HB28, 2JHH
171.74
[CH3С(O)OC28],
171.18
[CH3С(O)OC3],
11.0 Гц), 4.46 д.д (1H, H3, 3JHH 10.2, 3JHH 5.6 Гц),
5.69 c (1H, HА29), 6.24 с (1H, HB29). Спектр ЯМР
167.21 (С30), 146.50 уш.с (С20), 123.60 уш.с (C29),
80.97 (С3), 62.69 (С28), 62.46 (OC31H2), 55.40 (С5),
13С-{1H} (CDCl3), δ, м.д.: 171.99 (С30),
171.76
51.16 уш.с (С18), 50.13 (С9), 46.50 (С17), 42.69 (С14),
[CH3С(O)OC28],
171.23
[CH3С(O)OC3],
146.14
40.90 (С8), 38.42 (С1), 37.86 (С4), 37.22 (С13), 37.10
уш.с (С20), 125.07 уш.с (C29), 80.96 (С3), 62.68
(С10), 34.35 (С22), 34.17 (C7), 32.27 уш.с (С21), 31.79
(С28), 55.31 (С5), 51.12 уш.с (С18), 50.06 (С9), 46.43
(C32H2), 29.84 (С16), 29.56 (С33H2Br), 28.02 (С23),
(С17), 42.61 (С14), 40.82 (С8), 38.34 (С1), 37.78 (С4),
27.39 (С12), 27.04 (С15), 23.75 (С2), 21.45 [CH3С(O)
37.19 (С13), 37.02 (С10), 34.23 (С22), 34.11 (C7),
32.32 уш.с (С21), 31.09 (С16), 29.75 (С12), 27.95
OC3],
21.18
[CH3С(O)OC28], 20.91 (С11),
18.23
(С6), 16.59 (С24), 16.21 (С25), 16.09 (С26), 14.73
(С23), 26.99 (С15), 23.67 (С2), 21.37 [CH3С(O)OC3],
(С27). Найдено, %: С 65.33; Н 8.35. C37H57BrO6.
21.10 [CH3С(O)OC28], 20.87 (С11), 18.15 (С6), 16.53
Вычислено, %: С 65.57; Н 8.48.
(С24), 16.15 (С25), 16.01 (С26), 14.67 (С27). Найдено,
%: С 73.59; Н 9.32. C34H52O6. Вычислено, %: С
(5-Бромпентил)-3β,28-диацетоксилуп-20(29)-
73.35; Н 9.41.
ен-30-оат (4b). Выход 0.14 г (73%), т.пл. 58-59°C,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
588
ПОНОМАРЕВ и др.
[α]D20 -5.1 (с 0.2, CHCl3). ИК спектр, ν, см-1: 2947,
2.
Huffman B., Shenvi R.A. J. Am. Chem. Soc. 2019, 141,
2871, 1736 (C=O), 1716 (COOH), 1623 (=CH2),
3332-3346. doi 10.1021/jacs.8b11297
1458, 1390, 1366, 1244 (CH3CO), 1147, 1105, 1031,
3.
Li J.S., Barber C.C., Zhang W. J. Ind. Microbiol.
978, 943, 900 (=CH2), 788, 761. Спектр ЯМР 1Н
Biotechnol. 2019, 46, 375-383. doi 10.1007/s10295-
(CDCl3), δ, м.д.: 0.73-2.25 м (29H), 0.77 д (1H, H5,
018-2086-5
3JHH 9.9 Гц), 0.83 уш.с (9H, H23-25), 0.94 (3H, H27),
4.
Liu M., Karuso P., Feng Y., Kellenberger E., Liu F.,
1.02 (3H, H26), 2.04 c [3H, CH3С(O)OC3], 2.07 c
Wang C., Quinn R.J. Med. Chem. Commun. 2019,
[3H, CH3С(O)OC28], 2.75 д.д.д (1H, H19, 3JHH 11.0,
10, 1667-1677. doi 10.1039/c9md00128j
3JHH 5.4 Гц), 3.42 т (2H, С35H2Br, 3JHH 6.8 Гц), 3.85
5.
Wright G.D. Microbial Biotechnol. 2019, 12, 55-57. doi
д (1H, HA28, 2JHH 11.0 Гц), 4.17 т (2H, OС31H2, 3JHH
10.1111/1751-7915.13351
6.5 Гц), 4.26 д (1H, HB28, 2JHH 11.0 Гц), 4.46 д.д
6.
Long M.J.C., Liu X., Aye Y. Curr. Opin. Chem. Biol.
(1H, H3, 3JHH 10.1, 3JHH 5.7 Гц), 5.55 c (1H, HА29),
2019, 51, 48-56. doi 10.1016/j.cbpa.2019.02.014
6.08 с (1H, HB29). Спектр ЯМР 13С-{1H} (CDCl3),
7.
Davison E.K., Brimble M.A. Curr. Opin. Chem. Biol.
δ, м.д.: 171.69 [CH3С(O)OC28], 171.12 [CH3С(O)
2019, 52, 1-8. doi 10.1016/j.cbpa.2018.12.007
OC3], 167.42 (С30), 146.69 уш.с (С20), 123.36 уш.с
8.
Newman D.J., Cragg G.M. J. Nat. Prod. 2016, 79, 629-
(C29), 80.93 (С3), 64.38 (OC31H2), 62.69 (С28), 55.39
661. doi 10.1021/acs.jnatprod.5b01055
(С5), 51.13 уш.с (С18), 50.13 (С9), 46.48 (С17), 42.67
9.
Lam K.S. Trends Microbiol. 2007, 15, 279-289.
(С14), 40.89 (С8), 38.42 (С1), 37.84 (С4), 37.22 (С13),
doi 10.1016/j.tim.2007.04.001
37.08 (С10), 34.33 (С22), 34.16 (C7), 33.60 (C35H2Br),
10.
Fu Y., Jiaoyang L., Win J., Yang M. J. Pharm.
32.33 (C34H2), 32.16 уш.с (С21), 29.83 (С16), 28.00
Biomed. Anal. 2019, 168, 189-200. doi 10.1016/
(С23), 27.92 (C32H2), 27.35 (С12), 27.04 (С15), 24.78
j.jpba.2019.02.027
(С33H2), 23.73 (С2),
21.43
[CH3С(O)OC3], 21.16
11.
Elkin M., Newhouse T.R. Chem. Soc. Rev. 2018,
[CH3С(O)OC28], 20.91 (С11), 18.213 (С6),
16.57
47, 7830-7844. doi 10.1039/c8cs00351c
(С24), 16.20 (С25), 16.07 (С26), 14.71 (С27). Найдено,
12.
Sousa J.L.C., Freire C.S.R., Silvestre A.J.D.,
%: С 66.21; Н 8.60. C39H61BrO6. Вычислено, %: С
Silva A.M.S. Molecules. 2019, 24, 355. doi 10.3390/
66.37; Н 8.71.
molecules24020355
БЛАГОДАРНОСТИ
13.
da Silva G.N.S., Primon-Barros M., Macedo A.J.,
Gnoatto S.C.B. Biomolecules. 2019, 9, 58. doi 10.3390/
Авторы выражают благодарность САЦ ЦКП
biom9020058
ФИЦ КазНЦ РАН.
14.
Hayek E.W., Jordis U., Moche W., Sauter F. Phyto-
ФОНДОВАЯ ПОДДЕРЖКА
chemistry. 1989, 28, 2229-2242. doi 10.1016/
S0031-9422(00)97961-5
Синтетическая часть работы выполнена при
15.
Толстиков Г.А., Флехтер О.Б., Шульц Э.Э., Бал-
финансовой поддержке Российского фонда фунда-
тина Л.А., Толстиков А.Г. Химия в интересах
ментальных исследований (грант № 19-33-90275),
устойчивого развития. 2005, 13, 1-30. [Tolsti-
спектральные исследования всех соединений про-
kov G.A., Flekhter O.B., Baltina L.A., Tolstikov A.G.
ведены за счет средств субсидий, выделенных
Chem. Sustainable Dev. 2005, 13, 1-29.]
Казанскому федеральному университету и ФИЦ
16.
Król S.K., Kielbus M., Rivero-Müller A., Stepulak A.
КазНЦ РАН для выполнения государственного за-
BioMed Res. Int. 2015, 2015, 1-12. doi 10.1155/
дания в сфере научной деятельности.
2015/584189
КОНФЛИКТ ИНТЕРЕСОВ
17.
Alakurtti S., Mäkelä T., Koskimies S., Yli-Kauha-
luoma J. Eur. J. Pharm. Sci. 2006, 29, 1-13.
Авторы заявляют об отсутствии конфликта ин-
doi 10.1016/j.ejps.2006.04.006
тересов.
18.
Salvador J.A.R., Moreira V.R., Goncalves B.M.F.,
СПИСОК ЛИТЕРАТУРЫ
Leal S.A., Jing Y. Nat. Prod. Rep. 2012, 29,
1463-1479. doi 10.1039/c2np20060k
1. Lorsbach B.A., Sparks T.C., Cicchillo R.M., Garizi N.V.,
Hahn D.R., Meyer K.G. Pest Manag Sci. 2019, 75,
19.
Santos M.M.M., Moreira R. Mini-Rev. Med. Chem.
2301-2309. doi 10.1002/ps.5350
2007, 7, 1040-1050. doi 10.2174/138955707782110105
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
3,28-ДИАЦЕТОКСИЛУП-20(29)-ЕН-30-ОВАЯ КИСЛОТА И ЕЕ ω-БРОМАЛКИЛОВЫЕ ЭФИРЫ
589
20.
Dinkova-Kostova A.T., Fahey J.W., Talalay P. Methods
29.
Цепаева О.В., Немтарев А.В., Григорьева Л.Р., Ми-
Enzymol. 2004, 382, 423-448. doi 10.1016/
ронов В.Ф., Абдуллин Т.И., Салихова Т.И., Хозяи-
S0076-6879(04)82023-8
нова С.А. Пат. 2665922 (2018), РФ. Б.И. 2019, № 25.
21.
Jackson P.A., Widen J.C., Harki D.A., Brum-
30.
Цепаева О.В., Немтарев А.В., Абдуллин Т.И.,
mond K.M. J. Med. Chem. 2017, 60, 839-885.
Кузнецова Е.В., Миронов В.Ф. ЖОХ. 2018,
doi 10.1021/acs.jmedchem.6b00788
88, 1576-1579. [Tsepaeva O.V., Nemtarev A.V.,
22.
Bar F.M.A., Khanfar M.A., Elnagar A.Y., Hui L.,
Abdullin T.I., Kuznetsova E.V., Mironov V.F. Russ.
Zaghoul A.M., Badria F.A., Sylvester P.W., Ahmad K.F.,
J. Gen. Chem. 2018, 88, 1944-1947.] doi 10.1134/
Raisch K.P., El Sayed K.A. J. Nat. Prod. 2009,
S1070363218090335
72, 1643-1650. doi 10.1021/np900312u
31.
Antipin I.S., Tsepaeva O.V., Nemtarev A.V., Grigo-
23.
De Heluani C.S., De Boggiato M.V., Catalán C.A.N.,
r’eva L.R., Ziganshina L.E., Cong H.H., Abdul-
Díaz J.G., Gédris T.E., Herz W. Phytochemistry. 1997,
lin T.I., Mironov V.F. Eur. J. Clin. Inv. 2018,
45, 801-805. doi 10.1016/S0031-9422(97)00021-6
48, 97. doi 10.1111/eci.12926
24.
Yang S., Liang N., Li H., Xue W., Hu D., Jin L.,
32.
Antipin I.S., Tsepaeva O.V., Nemtarev A.V., Abdul-
Zhao Q., Yang S. Chem. Cent. J. 2012, 6, 141. doi
10.1186/1752-153X-6-141
lin T.I., Grigor’eva L.R., Kuznetsova E.V., Akhma-
dishina R.A., Mironov V. F. Eur. J. Clin. Inv. 2018, 48,
25.
Цепаева О. В., Немтарев А. В., Григорьева Л.Р., Во-
97-98. doi 10.1111/eci.12926
лошина А.Д., Миронов В.Ф. ЖОрХ. 2015, 51, 1343-
1348. [Tsepaeva O.V., Nemtarev A.V., Grigor’eva L.R.,
33.
Antipin I.S., Ponomaryov D.V., Grigor’eva L.R., Sali-
Voloshina A.D., Mironov V.F. Russ. J. Org. Chem. 2015,
khova T.I., Ali R., Dang T., Tsepaeva O.V., Nemta-
51, 1318-1323.] doi 10.1134/S1070428015090195
rev A.V., Abdullin T.I., Mironov V.F. Eur. J. Clin. Inv.
26.
Spivak A.Y., Nedopekina D.A, Khalitova R.R.,
2019, 49, 61. doi 10.1111/eci.13108
Gubaidullin R.R., Odinokov V.N., Bel’skii Y.P.,
34.
Burns D., Reynolds W.F., Buchanan G., Reese P.B.,
Bel’skaya N.V., Khazanov V.A. Med. Chem. Res. 2017,
Enrizuez R.G. Magn. Reson. Chem. 2000, 38, 488-
26, 518-531. doi 10.1007/s00044-016-1771-z
493. doi 10.1002/1097-458X(200007)38:7<488::AID-
27.
Tsepaeva O.V., Nemtarev A.V., Abdullin T.I., Grigo-
MRC704>3.0.CO;2-G
r’eva L.R., Kuznetsova E.V., Akhmadishina R.A.,
35.
Mutai C., Abatis D., Vagias C., Moreau D., Roussakis C.,
Ziganshina L.E., Cong H.K., Mironov V.F. J. Nat. Prod.
Roussis V. Phytochemistry. 2004, 65, 1159-1164. doi
2017, 80, 2232-2239. doi 10.1021/acs.jnatprod.7b00105
10.1016/j.phytochem.2004.03.002
28.
Цепаева О.В., Немтарев А.В., Миронов В.Ф. ЖОрХ.
2017, 53, 614-615. [Tsepaeva O.V., Nemtarev A.V.,
36.
Pohjala L., Alakurtti S., Ahola T., Yli-Kauha-
Mironov V.F. Russ. J. Org. Chem. 2017, 53, 621-623.]
luoma J., Tammela P. J. Nat. Prod. 2009, 72, 1917-
doi 10.1134/S1070428017040212
1926. doi10.1021/np9003245
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
590
ПОНОМАРЕВ и др.
3,28-Diacetoxylup-20(29)-en-30-oic Acid
and its ω-Bromoalkyl Esters
D. V. Ponomaryova, L. R. Grigor’evaa, A. V. Nemtareva, b, *, O. V. Tsepaevaa, b,
V. F. Mironova, b, O. I. Gnezdilovc, and I. S. Antipina, b
a Alexander Butlerov Institute of chemistry, Kazan (Volga region) Federal university,
420008, Russia, Republic of Tatarstan, Kazan, ul. Kremlevskaya 18
b Arbuzov Institute of organic and physical chemistry, FRC Kazan Scientific Center of RAS,
420008, Russia, Republic of Tatarstan, Kazan, ul. Arbuzova 8
c Zavoisky Physical-Technical Institute, FRC Kazan Scientific Center of RAS,
420111, Russia, Republic of Tatarstan, Kazan, ul. Lobachevskogo 2/31
*e-mail: a.nemtarev@mail.ru
Received November 7, 2019; revised February 19, 2020; accepted February 20, 2020
A convenient method for the preparation of 3β,28-diacetoxylup-20(29)-en-30-oic acid has been developed. It is
based on the oxidation of 3β,28-diacylbetulin by selenium dioxide in an aqueous solution under heating with the
formation of 3β,28-diacetoxylup-20(29)-en-30-al and its subsequent oxidation by sodium chlorite in tert-butyl
alcohol. Haloalkyl esters have been obtained in high yield by the alkylation of the acid with dihaloalkanes upon
heating in acetonitrile in the presence of potassium carbonate.
Keywords: lupan-type triterpenes, betulin, allylic oxidation, haloalkyl esters, Michael acceptor
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020