ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 4, с. 619-627
УДК 547.77
СИНТЕЗ И МОДИФИКАЦИЯ
ГЕТЕРОКОНДЕНСИРОВАННЫХ ПИРАЗОЛОВ,
ПОЛУЧЕННЫХ ИЗ МЕТИЛ-1-(2-ОКСО-
2-ФЕНИЛЭТИЛ)-3-ФЕНИЛ-1H-ПИРАЗОЛ-
5-КАРБОКСИЛАТА
© 2020 г. А. О. Харанеко, Т. М. Пехтерева, О. И. Харанеко*
ГУ «Институт физико-органической химии и углехимии им. Л.М. Литвиненко»,
83114, Украина, г. Донецк, ул. Р. Люксембург 70
*e-mail: o_kharaneko@mail.ru
Поступила в редакцию 01 октября 2019 г.
После доработки 10 февраля 2020 г.
Принята к публикации 18 февраля 2020 г.
Предложен модифицированный метод синтеза 2,7-дифенил-5,8-дигидро-4H-пиразоло[5,1-d][1,2,5]-
триазепин-4-она, показана возможность трансформации этой системы в пиразоло[1,5-a]пиразиновую,
изучены реакции функционализации в положении С4 триазепинового цикла, а также аннелирования
тетразольного и триазольного циклов по грани C4-N5 семичленного кольца.
Ключевые слова: 5,8-дигидро-4H-пиразоло[5,1-d][1,2,5]триазепин-4-он, пиразоло[1,5-a]пиразин-4-ол,
пиразоло[1,5-a]пиразин-4(5H)-он, 5-аминопиразоло[1,5-a]пиразин-4(5H)-он, 5,8-дигидро-4H-пи-
разоло[5,1-d][1,2,5]триазепин-4-тион, 4-(метилтио)-8H-пиразоло[5,1-d][1,2,5]триазепин, 4-морфо-
лин-4ил-8H-пиразоло[5,1-d][1,2,5]триазепин, 4-гидразино-8H-пиразоло[5,1-d][1,2,5]триазепин,
7H-пиразоло[5,1-d][1,2,4]триазоло[4,3-b][1,2,5]триазепин, 7H-пиразоло[5,1-d]тетразоло[1,5-b][1,2,5]-
триазепин.
DOI: 10.31857/S051474922004014X
Производные
метил-1-(2-оксо-2-арилэтил)-
В продолжение наших исследований синтети-
1H-пиразол-5-карбоксилата формально можно
ческих возможностей производных метил-1-(2-
рассматривать как 1,5-дикарбонильные соедине-
оксо-2-фенилэтил)-1H-пиразол-5-карбоксилата и
с учетом способности 1,5-дикарбонильных сое-
ния. Это открывает широкие возможности моле-
динений к пиридиневой гетероциклизации пред-
кулярного дизайна и получения новых гетерокон-
ставляло интерес осуществить синтез структур с
денсированных соединений, представляющих ин-
пиразоло[1,5-a]пиразиновым каркасом. Такие сое-
терес для биологического скрининга. Например,
динения представляют несомненный интерес, так
были получены пиразоло[5,1-c][1,4]оксазины и
как среди них были найдены препараты против
пиразоло[5,1-d][1,2,5]триазепин-4-oны с ариль-
ВИЧ-1, для профилактики и лечения некоторых
ным, метильным и карбогидразидным заместите-
гематологических заболеваний, диабета [4, 5].
лями в положении 2 пиразолооксазинового и пи-
Цель настоящей работы - изучение реакций
разолотриазепинонового ядер [1-3]. Установлено,
метил-1-(2-оксо-2-фенилэтил)-3-фенил-1H-пира-
что
2,7-диарил-5,8-дигидро-4H-пиразоло[5,1-d]-
зол-5-карбоксилата (1) с N-нуклеофилами и моди-
[1,2,5]триазепин-4-оны ингибируют апоптоз эндо-
фикация структуры
2,7-дифенил-5,8-дигидро-
телиальных клеток [2].
4H-пиразоло[5,1-d][1,2,5]триазепин-4-она по се-
619
620
ХАРАНЕКО и др.
Схема 1.
Ph
Ph
Ph
O
O
O
Ph
1. NaOH
O
2. (Ac)2O
N2H4
NH
N N
OMe
N N
NH
N N
+
N
NH
N
N O
Ph
Ph HN NH2
Ph
O
Ph
1
HCONHMe
2
3 (~15%)
4 (~85%)
HCONH2
H3PO4
AcOH
140°C
Ph
Ph
Ph
OH
O
O
Ph
O
N
N N
N NN
+
N
Me
N N
Me
N NN
NH
2
Ph
Ph
Ph
Ph
5
6
7
8
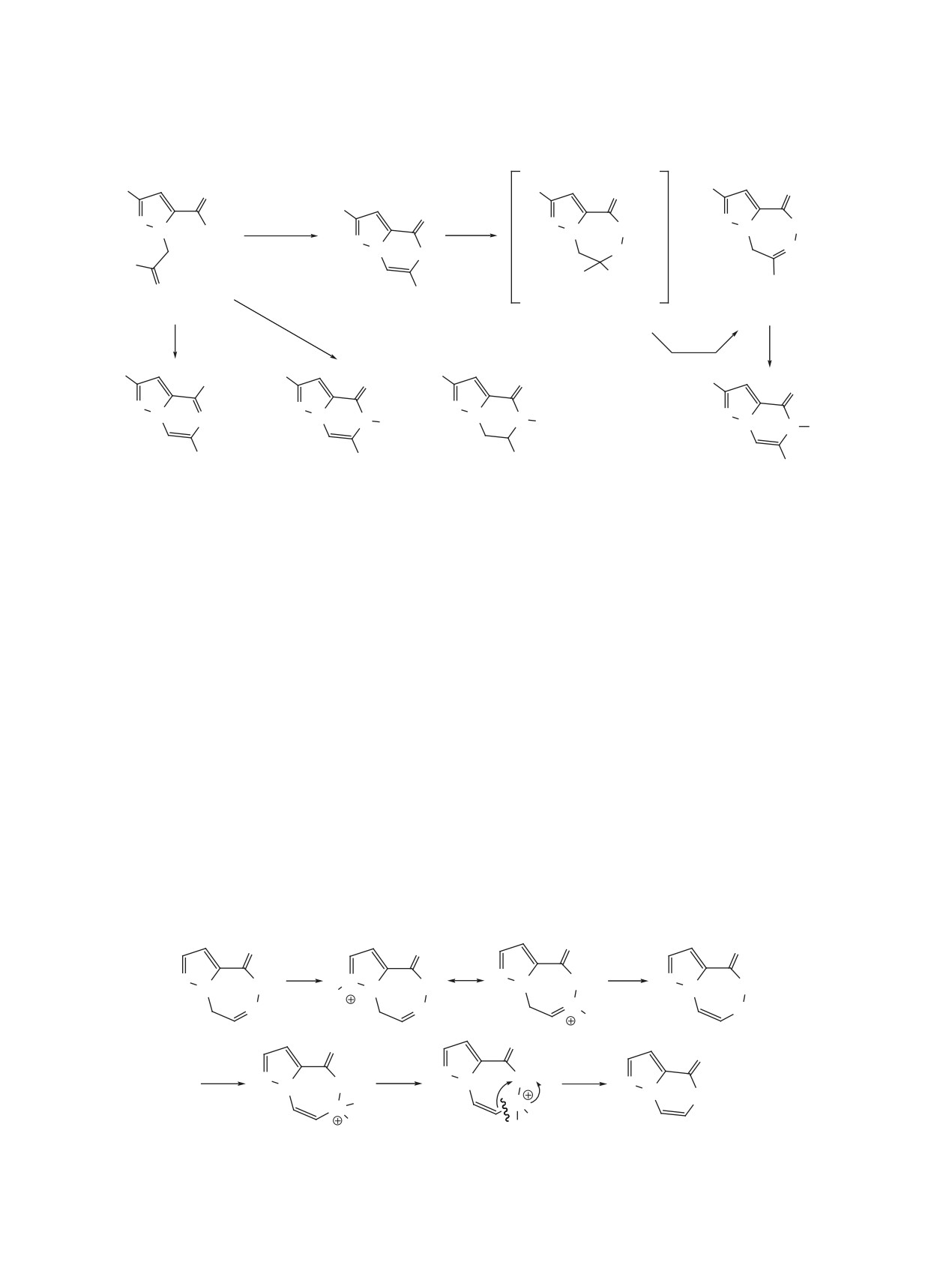
мичленному циклу, а именно по связи C4-C5 триа-
ного с образованием N-аминопроизводных
[6,
зепинового цикла.
7]. Однако показано [3], что 1,2,5-триазепиноно-
вый цикл, сочлененный с пиразольным, оказался
Впервые производные 2,7-дифенил-5,8-диги-
устойчивым при кипячении в соляной кислоте.
дро-4H-пиразоло[5,1-d][1,2,5]триазепин-4-она
Вместе с тем мы нашли, что при нагревании три-
4 были получены [1, 2] из 2,6-дифенил-4H-пи-
азепинона 4 в течение 1 ч при 140°С в 85% H3PO4
разоло[1,5-a][1,4]оксазин-4-онов под действием
происходит сужение триазепинонового цикла и
гидразина с выходом 68-82%. Мы нашли, что
образуется
5-амино-2,6-дифенилпиразоло[1,5-a]-
в этой системе, наряду с пиразолотриазепино-
пиразин-4(5H)-он (8). Эту реакцию можно рассма-
ном 4, также образуется 7-гидразино-2,7-дифе-
тривать как новый метод синтеза производных пи-
нил-5,6,7,8-тетрагидро-4H-пиразоло[5,1-d][1,2,5]-
триазепин-4-он (3), который при действии на него
разоло[1,5-a]пиразинов.
уксусной кислоты превращается в триазепинон
Приведен механизм сжатия триазепинонового
4. Это позволило нам модифицировать методику
цикла под действием следов кислоты, содержа-
синтеза [2] и получить целевой триазепинон 4 с
щихся в хлороформе, на примере 4-метил-2,5-ди-
выходом 96% (схема 1).
гидро-1H-пиролло[2,1-d][1,2,5]триазепин-1-она
Известно, что
1,2,5-триазепиноновый цикл,
[6]. По мнению авторов [6], на первой стадии про-
также, как и 1,2-диазепиноновый, под действием
исходит протонирование по карбонильному атому
соляной кислоты может сужаться до шестичлен-
кислорода триазепинонового цикла пирролотриа-
Схема 2.
O
O
O
O
+
+H
NH
N N
NH
NH
N N
N N
NH
-H+
N N
H
N
N
N
NH
H
O
O
O
+
+H
N
N N
NH
N
NH
N
-H+
N N NH
2
N
N H
H
HH
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ И МОДИФИКАЦИЯ ГЕТЕРОКОНДЕНСИРОВАННЫХ ПИРАЗОЛОВ
621
зепина, хотя можно предположить, что протониро-
щие триазепиноны. Это позволяет осуществить
вание скорее пойдёт по атому N3 триазепинонового
структурную модификацию семичленного цикла
цикла, т.к. наибольшая электронная плотность ло-
как по атому серы, так и по грани C4-N5 триазе-
кализована именно у этого атома азота. На схеме 2
пинового кольца, и расширить круг классов соеди-
представлен альтернативный механизм сжатия
нений, содержащих фрагмент пиразоло-1,2,5-три-
триазепинонового цикла для производных 5,8-ди-
азепина.
гидро-4H-пиразоло[5,1-d][1,2,5]триазепин-4-онов
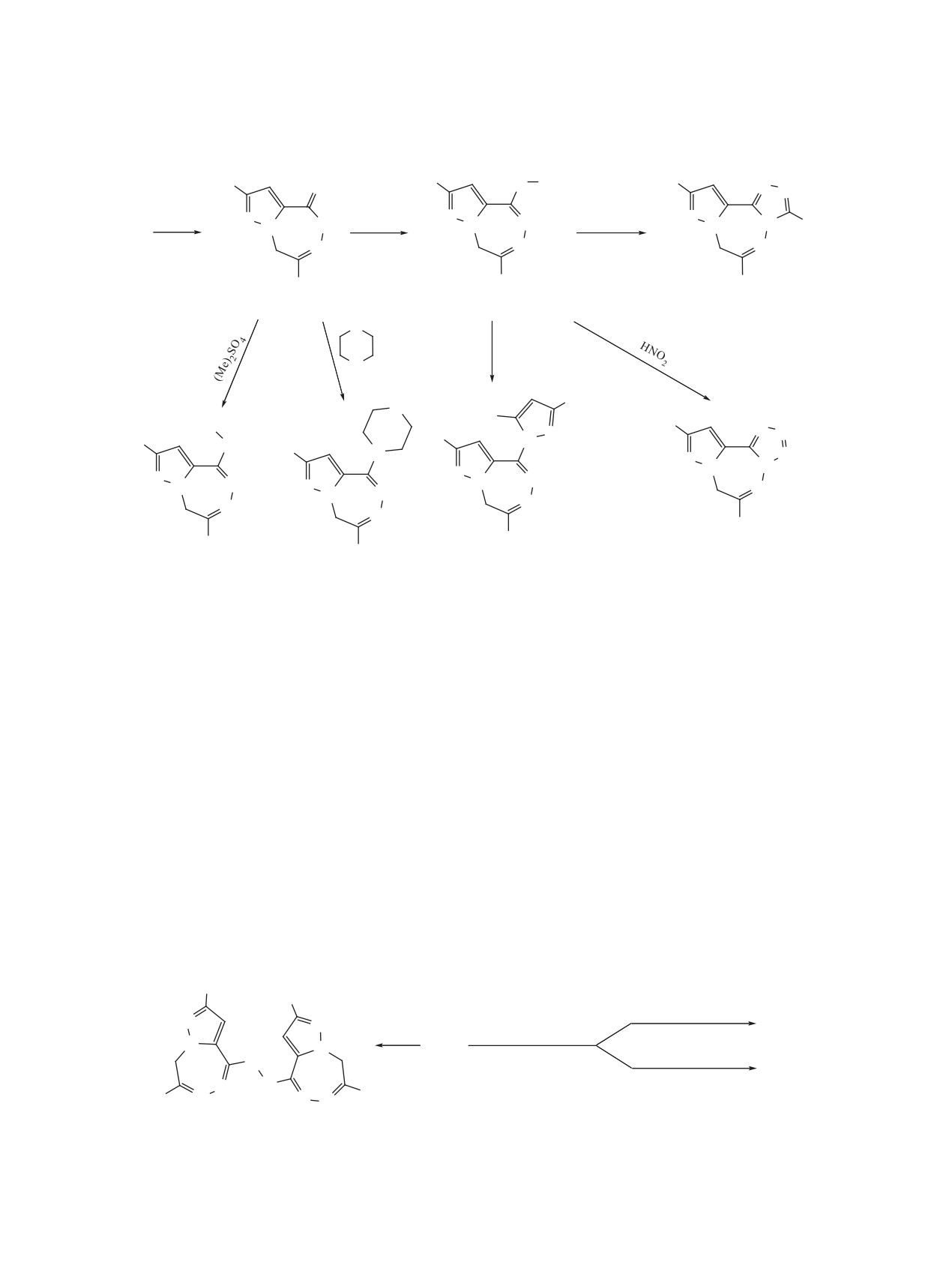
При действии реагента (Lawcon’s) Лауссона
в кислой среде.
(LR) на пиразолотриазепинон 4 с высоким выхо-
Считаем, что первоночальное протонирование
дом образуется 2,7-дифенил-5,8-дигидро-4H-пи-
атома азота пиразола объясняет большую устойчи-
разоло[5,1-d][1,2,5]триазепин-4-тион (9) (схема 4).
вость пиразолотриазепинона 4 в кислой среде по
При алкилировании триазепинтиона 9 диме-
сравнению с пиролло[2,1-d][1,2,5]триазепин-1-о-
тилсульфатом образуется
4-(метилтио)-2,7-ди-
ном и 2,5-дигидро-1H-2,3-бензодиазепин-1-онами
фенил-8H-пиразоло[5,1-d][1,2,5]триазепин
(10).
[7].
В спектре ЯМР 1H соединения 10 о-протоны фе-
Пиразоло[1,5-a]пиразины также могут быть
нильного заместителя, находящегося у триазепи-
получены непосредственно из пиразола 1. Так при
нонового ядра, проявляются двумя дублетами в
кипячении в течение 1 ч в формамиде пиразол 1
области 7.96 м.д с КССВ 6.8 Гц, что говорит об их
количественно циклизуется в 2,6-дифенилпиразо-
неэквивалентности. Протоны в пара- и мета-по-
ло[1,5-a]пиразин-4-ол (5) и при дальнейшем кипя-
ложениях этого же фенильного ядра проявляются
чении остаётся неизменным. Пиразол 1 в кипящем
узким мультиплетом в области 7.45-7.48 м.д.
N-метилформамиде в течение 1 ч дает смесь 5-ме-
Атом серы в пиразолотриазепинтионе 9 легко
тил-2,6-дифенилпиразоло[1,5-a]пиразин-4(5H)-
замещается на вторичный амин, например, морфо-
она (6) и 5-метил-2,6-дифенил-6,7-дигидропира-
золо[1,5-a]пиразин-4(5H)-она (7) в соотношении
лин, с образованием 4-морфолин-4-ил-2,7-дифе-
нил-8H-пиразоло[5,1-d][1,2,5]триазепина (11).
~72:28. Дальнейшее кипячение приводит к уве-
личению доли пиразинона 7, и по истечении
В реакции пиразолотриазепинтиона 9 с ги-
20 ч пропорция меняется на противоположную:
дразином образуется
4-гидразино-2,7-дифенил-
соотношение соединений 6:7 в смеси составляет
8H-пиразоло[5,1-d][1,2,5]триазепин (12), который
~30:70. По сути, это - реакция Лейкарта-Валлаха
в реакции с хлорангидридами уксусной и пара-ме-
(Leuckart-Wallach). По-видимому, сам процесс
токсибензойной кислот дает 3-триметил-6,10-ди-
восстановления пиразинона 6 в пиразинон 7 опре-
фенил-7H-пиразоло[5,1-d][1,2,4]триазоло[4,3-b]-
деляется скоростью дециклизации образовавшего-
[1,2,5]триазепин
(13a) и
3-(4-метоксифенил)-
ся пиразинона 6 с дальнейшим его восстановлени-
6,10-дифенил-7H-пиразоло[5,1-d][1,2,4]триазо-
ем и замыканием в пиразинон 7 (схема 3).
ло[4,3-b][1,2,5]триазепин
(13b) соответственно.
Известно
[8], что гетероконденсированные
С азотистой кислотой пиразолотриазепин 12 дает
1,2,5-триазепинтионы отличаются более высокой
6,10-дифенил-7H-пиразоло[5,1-d]тетразоло[1,5-
реакционной способностью, чем соответствую-
b][1,2,5]триазепин (14).
Схема 3.
Ph
O
Ph
Ph
O
Ph
O
Ph
O
O
N
N
-NH2Me
N
N
O
NH2Me
N
NHMe
N
N
NHMe
N
N
N
N
N
Me
Me
–NH2Me
Me
+NH2Me
Ph
Ph
Ph
Ph
Ph
O
NMe
NHMe
6
7
HCONHMe
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
622
ХАРАНЕКО и др.
Схема 4.
Ph
Ph
Ph
S
HN
NH2
N
N
LR
N2H4
N
RCOCl
N
N N
NH
N N
N N
R
4
N
N
N
Ph
Ph
Ph
9
12
13a, b
O
MeCOCH2COMe
N
H
Me
O
Me
Ph
Me
N
Ph
N
Ph
N N
S
Ph
N
N
N N
N
N N
N
N N
N
N
N
N N
N
N
N
Ph
Ph
Ph
Ph
10
11
15
14
R = Me (а), R = p-OMe-Ph (b).
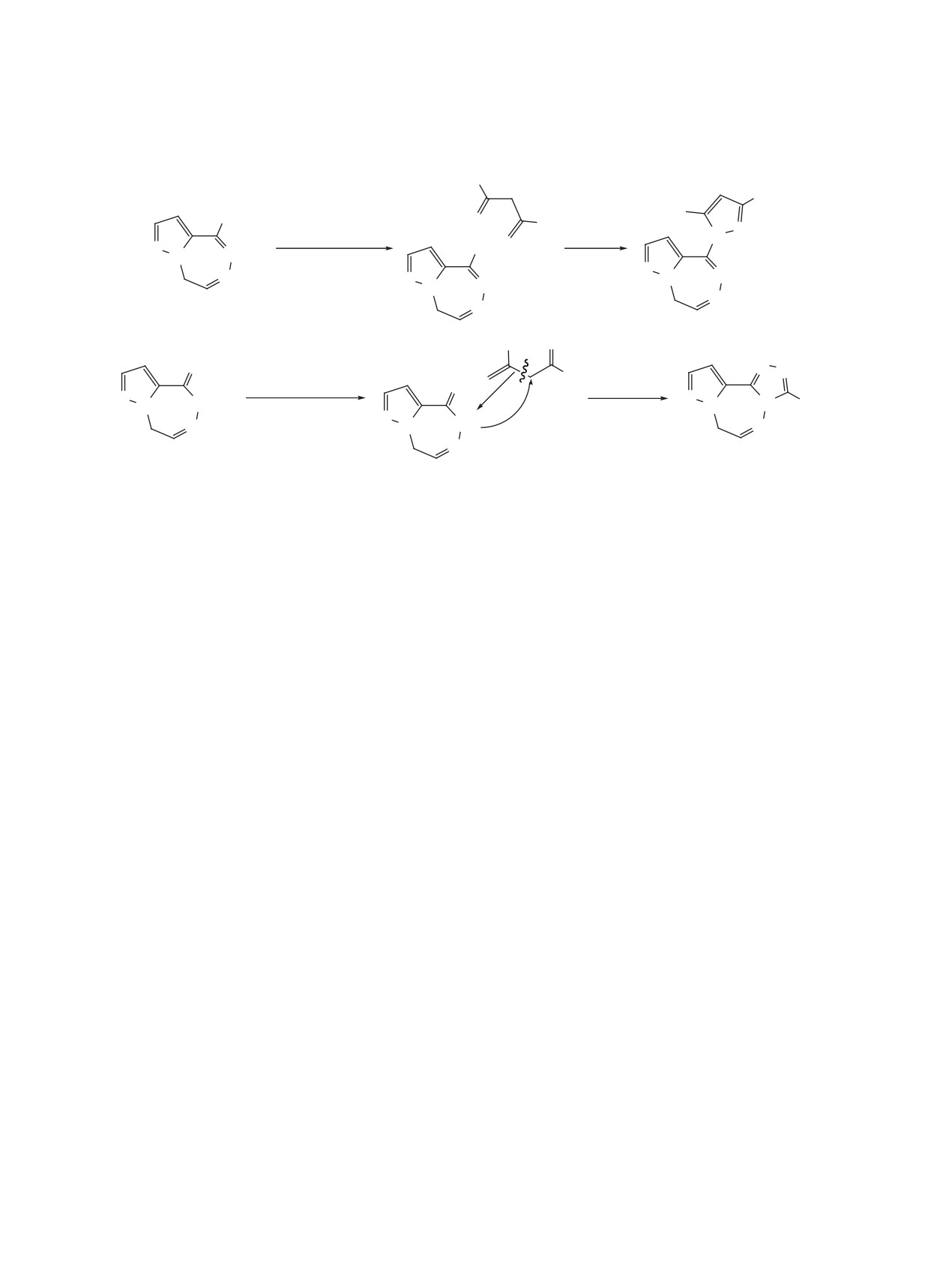
Пентан-2,4-дион с пиразолотриазепинонгидра-
(схема 6). Хотя пиразолотриазепин-гидразин 12
зином 12 в диоксане дает 4-(3,5-диметил-1H-пира-
не обладает высокой основностью, но конфигура-
зол-1-ил)-2,7-дифенил-8H-пиразоло[5,1-d][1,2,5]-
ция атомов азота в соединении 12, по-видимому,
триазепин (15) (схема 5). Применив в качестве рас-
благоприятствует такому расщеплению гидразона
творителя этилцеллозольв, мы неожиданно полу-
пентан-2,4-диона.
чили пиразолотриазолотриазепин 13a.
Пиразолотриазепинтион 9 (схема 5) реагирует с
По-нашему мнению, это можно объяснить су-
пиразолотриазепингидразином 12 с образованием
4,4'-гидразино-1,2-диилбис(2,7-дифенил-8H-пира-
ществованием различных форм гидразона пен-
золо[5,1-d][1,2,5]триазепина (16).
тан-2,4-диона 12 в полярном и неполярном рас-
творителе. По сути, в этилцеллозольве после
Этот факт необходимо принимать во внимание
образования гидразона происходит кетонное рас-
при синтезе пиразолотриазепин-гидразина 12 из
щепление гидразона пентан-2,4-диона с замыка-
пиразолотриазепинтиона 9 и использовать не ме-
нием триазольного цикла и выделением ацетона
нее чем 20-кратный избыток гидразингидрата.
Схема 5.
Ph
Ph
Этилцеллозольв
N
N
13a
9
MeCOCH2COMe
N
12
N
NH
15
Диоксан
N
N
Ph
N
H NNPh
16
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ И МОДИФИКАЦИЯ ГЕТЕРОКОНДЕНСИРОВАННЫХ ПИРАЗОЛОВ
623
Схема 6.
Me
Me
HN NH2
Me
O
Me
N
MeCOCH2COMe
N
HN N
N N
N
–H2O
N
N N
N
N N
N
N
N
В диоксане
Me
O
N NH2
N
N
Me
MeCOCH2COMe
N N
NH
N N
N Me
N N
–MeCOMe
N N
NH
N
N
N
В этилцеллозольве
Таким образом, в настоящей работе предло-
Спектр ЯМР 1H, δ, м.д.: 5.53 с (2H, CH2), 7.27 с
жена усовершенствованная методика синтеза пи-
(1H, CH), 7.28 т (1H, Ph, J 7.6 Гц), 7.37 т (2H, Ph,
разолотриазепинона 4, найдены условия сужения
J 7.2 Гц), 7.40-7.48 м (3H, Ph), 7.81 д (2H, Ph, J
триазепинонового цикла, сочлененного с пиразо-
7.2 Гц), 7.90 д (1H, Ph, J 6.8 Гц), 7.91 д (1H, Ph, J
льным, аминированием пиразолотриазепинтиона
6.8 Гц), 11.44 с (1H, NH). Спектр ЯМР 13C, δ, м.д.:
9 получены пиразолотриазепиногидразин 11 и пи-
48.6 (CH2), 106.6 (CH), 125.2 (2C), 126.6 (2C), 127.7,
разолотриазепин 12, осуществлено аннелирование
128.3 (2C), 128.5 (2C), 130.2, 132.0, 134.3, 137.1,
пиразолотриазепина по грани C4-N5 триазепина.
150.1, 154.4, 157.5 (CO). Найдено, %: C 71.50; H
4.70; N 18.52; O 5.28. C18H14N4O. Вычислено, %: C
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
71.51; H 4.67; N 18.53; O 5.29.
Спектры ЯМР 1Н и 13С записаны на приборе
2,6-Дифенилпиразоло[1,5-a]пиразин-4-ол (5).
BRUKER AVANCE II (Германия) (400 и 100 МГц,
Смесь 0.5 г (1.56 ммоль) и 3 мл формамида кипяти-
соответственно) в ДМСО-d6, внутренний стан-
ли 1 ч. Охлаждали и добавляли 8 мл воды. Осадок
дарт ТМС. ИК спектры записаны на приборе IR-75
отфильтровывали и промывали водой. Выход
(Германия) в таблетке из KBr. Температуры плав-
0.42 г (93%), мелкие бесцветные кристаллы, т.пл.
ления синтезированных соединений определены
242-243°С. Спектр ЯМР 1H, δ, м.д.: 7.33 т (1H, Ph,
на нагревательном приборе типа Boetius и не под-
вергались коррекции. В синтезах использовали
J 6.8 Гц), 7.38 с (1H, CH), 7.40-7.49 м (5H, Ph), 7.73
коммерческие реактивы марок «хч», «чда», а так-
д (2H, Ph, J 7.2 Гц), 7.91 с (1H, CH), 7.93 д (2H,
Ph, J 7.6 Гц), 11.55 с (1H, OH). Спектр ЯМР 13C, δ,
же фирмы Aldrich.
м.д.: 101.5 (CH), 107.9 (CH), 126.1 (2C), 126.7 (2C),
2,7-Дифенил-5,8-дигидро-4H-пиразоло-
128.5, 128.9 (2C), 129.0 (3C), 129.2, 129.3, 131.7,
[5,1-d][1,2,5]триазепин-4-он
(4). Смесь
3.35 г
132.5, 134.2, 152.2, 156.12. Найдено, %: C 75.29; H
(11.63 ммоль)
2,6-дифенил-4H-пиразоло[5,1-c]-
4.60; N 14.59; O 5.52. C18H13N3O. Вычислено, %: C
[1,4]оксазин-4-она (2) и 1.2 мл (24.0 ммоль) гидра-
75.25; H 4.56; N 14.62; O 5.57.
зингидрата кипятили 4 ч в 10 мл этилцеллозольва.
К горячей смеси добавляли 1.5 мл уксусной кисло-
5-Метил-2,6-дифенилпиразоло[1,5-a]пира-
ты и продолжали кипячение ещё 30 мин. После ох-
зин-4(5H)-он (6) и 5-метил-2,6-дифенил-6,7-диги-
лаждения к смеси добавляли при перемешивании
дропиразоло[1,5-a]пиразин-4(5H)-он (7). Смесь
80 мл воды. Выпавший осадок отфильтровывали
0.5 г (1.56 ммоль) и 3 мл N-метилформамида кипя-
и промывали водой. Выход 3.4 г (97%), бесцвет-
тили 20 ч. Охлаждали и добавляли 10 мл воды.
ные кристаллы, т.пл. 227-228°С (230-232°С [2]).
Выпавшую смолу отделяли декантированием и
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
624
ХАРАНЕКО и др.
добавляли к ней 1 мл метанола. Смесь нагрева-
132.54, 133.0, 133.7, 152.5, 154.7. Найдено, %: C
ли до кипения и растворения смолы и оставляли
71.52; H 4.69; N 18.54; O 5.25. C18H14N4O. Вы-
на ночь. Выпавшие кристаллы отфильтровывали
числено, %: C 71.51; H 4.67; N 18.53; O 5.29.
и промывали небольшим количеством метано-
2,7-Дифенил-5,8-дигидро-4H-пиразоло-
ла. Выход 0.19 г (40%), мелкие бесцветные кри-
[5,1-d][1,2,5]триазепин-4-тион (9). Смесь 3.0 г
сталлы, т.пл. 154-156°С. Спектр ЯМР 1H, δ, м.д.:
(9.97 ммоль) соединения 4 и 3 г (7.48 ммоль) реак-
3.02 с (3H, CH3), 4.52 д.д (1H, CH2, J 13.4, 1.2 Гц),
тива Лауссона кипятили 2 ч в 30 мл абсолютного
4.80 д.д (1H, CH2, J 13.4, 5.2 Гц), 5.15 к (1H, CH, J
толуола. Толуол полностью упаривали в вакууме
3.2 Гц), 7.14-7.20 м (3H, Ph, CH), 7.25 т (2H, Ph,
и добавляли 30 мл метанола. Смесь кипятили еще
J 6.8 Гц), 7.27-7.37 м (4H, Ph), 7.77 д (2H, Ph, J
2 ч и оставляли на ночь. Выпавший осадок от-
7.6 Гц). Спектр ЯМР 13C, δ, м.д.: 33.0 (CH3), 52.6
фильтровывали и промывали метанолом. Выход
(CH2), 60.7 (CH), 104.0, 125.5 (2C), 126.5 (2C),
1.9 г (60%), мелкие желтые кристаллы, т.пл. 159-
128.8 (2C), 129.0, 129.2 (2C), 129.8, 132.7, 135.6,
160°С. Спектр ЯМР 1H, δ, м.д.: 5.55 с (2H, CH2),
138.5, 151.0, 157.6. Найдено, %: C 75.26; H 5.68; N
7.25-7.42 м (4H, Ph), 7.45-7.53 м (3H, Ph, CH), 7.79
13.88; O 5.18. C19H17N3O. Вычислено, %: C 75.23;
д (2H, Ph, J 6.8 Гц), 7.97 д (2H, Ph, J 4.0 Гц), 13.13
H 5.65; N 13.85; O 5.27.
с (1H, NH). Спектр ЯМР 13C, δ, м.д.: 49.4 (CH2),
Из маточного раствора полностью удаляли ме-
110.5 (CH), 125.7 (2C), 127.7 (2C), 128.3, 128.8
танол в вакууме, добавляли 10 мл гептана и нагре-
(2C), 129.2 (2C), 131.6, 132.4, 133.8, 142.3, 150.8,
вали до кипения при перемешивании. Горячий геп-
158.8, 180.5. Найдено, %: C 67.92; H 4.45; N 17.57;
тановый раствор отделяли от нерастворившейся
S 10.06. C18H14N4S. Вычислено, %: C 67.90; H 4.43;
N 17.60; S 10.07.
смолы и оставляли на ночь. Выпавшие кристаллы
отфильтровывали и промывали гептаном. Выход
4-(Метилтио)-2,7-дифенил-8H-пиразо-
соединения 6 0.14 г (30%), мелкие бесцветные кри-
ло[5,1-d][1,2,5]триазепин (10). К интенсивно пе-
сталлы, т.пл. 106-108°С. Спектр ЯМР 1H, δ, м.д.:
ремешиваемой смеси 0.4 г (1.26 ммоль) соедине-
3.26 с (3H, CH3), 7.38-7.44 м (4H, Ph), 7.46-7.55 м
ния 9 и 0.1 г (2.52 ммоль) NaOH в 10 мл ацетона
(6H, Ph, CH), 7.93 д (2H, Ph, J 6.8 Гц). Спектр ЯМР
добавляли 0.19 мл (1.15 ммоль) диметилсульфата.
13C, δ, м.д.: 32.0 (CH3), 101.1, 109.3, 125.5 (2C),
Смесь перемешивали 1 ч при комнатной темпера-
127.9, 128.3 (2С), 128.4 (2C), 129.0, 129.2 (2C),
туре, добавляли 30 мл воды, выпавший осадок от-
131.4, 131.7, 131.8, 133.0, 151.7, 154.8. Найдено,
фильтровывали и промывали водой. Выход 0.41 г
%: C 75.78; H 5.05; N 13.97; O 5.50. C19H15N3O.
(98%), мелкие бледно-жёлтые игольчатые кристал-
Вычислено, %: C 75.73; H 5.02; N 13.94; O 5.31.
лы, т.пл. 168-169°С. Спектр ЯМР 1H, δ, м.д.: 2.64 с
(3H, CH3), 3.13 с (2H, CH2), 7.00 с (1H, CH), 7.28 т
5-Амино-2,6-дифенилпиразоло[1,5-a]пира-
(1H, Ph, J 7.2 Гц), 7.37 т (2H, Ph, J 7.6 Гц), 7.41-7.48
зин-4(5H)-он (8). Смесь 0.1 г (0.33 ммоль) пира-
м (3H, Ph), 7.79 д (2H, Ph, J 7.2 Гц), 7.91-8.00 м
золотриазепинона 4 и 0.5 мл 85% H3PO4 нагрева-
(2H, Ph). Спектр ЯМР 13C, δ, м.д.: 14.0 (CH3), 48.9
ли при перемешивании до 140°С до растворения
(CH2), 103.5 (CH), 125.8 (2C), 127.4 (2C), 128.2,
соединения 4. Выдерживали при этой температуре
128.8 (2C), 129.0 (2C), 130.8, 132.5, 134.7, 135.7,
1 ч. Раствор разбавляли 5 мл воды и 30% водным
147.3, 151.0, 152.9. Найдено, %: C 68.67; H 4.88; N
аммиаком до pH ~ 9. Выпавшее масло при расти-
16.86; S 9.59. C19H16N4S. Вычислено, %: C 68.65;
рании закристаллизовывалось. Осадок отфильтро-
H 4.85; N 16.85; S 9.65.
вывали и после высушивания перекристаллизо-
вывали из толуола. Выход 0.096 г (96%), мелкие
4-Морфолин-4-ил-2,7-дифенил-8H-пиразо-
бесцветные кристаллы, т.пл. 138-139°С. Спектр
ло[5,1-d][1,2,5]триазепин
(11). Смесь
0.12 г
ЯМР 1H, δ, м.д.: 5.43 с (2H, NH2), 7.34 т (1H, Ph, J
(0.32 ммоль) соединения 9 и 0.5 мл морфолина
6.8 Гц), 7.38-7.52 м (6H, Ph, CH), 7.57 с (1H, CH),
кипятили 1 ч. После охлаждения добавляли 1 мл
7.62 т (2H, Ph, J 3.6 Гц), 7.93 д (2H, Ph, J 7.2 Гц).
воды. Выпавшее масло при растирании закри-
Спектр ЯМР 13C, δ, м.д.: 101.6, 109.3, 126.2 (3C),
сталлизовывалось. Кристаллы отфильтровывали
128.1 (2C), 128.6, 128.9 (2C), 130.3 (2C), 132.2,
и промывали водой. Выход 0.13 г (93%), мелкие
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ И МОДИФИКАЦИЯ ГЕТЕРОКОНДЕНСИРОВАННЫХ ПИРАЗОЛОВ
625
желтые кристаллы, т.пл. 185-187°С. Спектр ЯМР
нения 13a 0.056 г (43%), мелкие бесцветные кри-
1H, δ, м.д.: 3.49-3.56 м (4H, 2CH2), 3.64-3.73 м
сталлы, т.пл. 194-195°С. Спектр ЯМР 1H, δ, м.д.:
(2H, CH2), 3.76-3.84 м (2H, CH2), 4.84 д (1H, CH2, J
2.69 с (3H, CH3), 5.76 с (2H, CH2), 7.30 т (1H, Ph, J
14.4 Гц), 5.64 д (1H, CH2, J 14.4 Гц), 6.91 с (1H, CH),
7.2 Гц), 7.31-7.45 м (3H, 3H, Ph, CH), 7.50-7.62 м
7.27 т (2H, Ph, J 7.2 Гц), 7.34 т (2H, Ph, J 7.6 Гц),
(3H, Ph), 7.84 д (2H, Ph, J 7.6 Гц), 8.13 д (2H, Ph,
7.39-7.46 м (3H, Ph), 7.78 д (2H, Ph, J 7.2 Гц), 7.89
J 7.2 Гц). Спектр ЯМР 13C, δ, м.д.: 9.9 (CH3), 48.6
д (2H, Ph, J 8.0 Гц). Спектр ЯМР 13C, δ, м.д.: 47.5
(CH2), 103.9 (CH), 125.3 (2C), 127.9, 128.0 (2C),
(2CH2), 47.8 (CH2), 65.9 (2CH2), 103.1 (CH), 125.3
128.3 (2C), 128.8 (2C), 130.3, 131.8, 132.2, 133.0,
(2C), 126.4 (2C), 127.6, 128.2 (2C), 128.3 (2C), 129.6,
140.6, 151.4, 151.7, 161.3. Найдено, %: C 58.10; H
131.2, 132.3, 135.0, 145.6, 150.3, 153.4. Найдено, %:
4.41; Cl 17.13; N 20.36. C20H16N6·2HCl. Вычислено,
C 71.15; H 5.73; N 18.82; O 4.30. C22H21N5O. Вы-
%: C 58.12; H 4.39; Cl 17.16; N 20.33.
числено, %: C 71.14; H 5.70; N 18.85; O 4.31.
Выход соединения 13b 0.062 г (39%), мелкие
4-Гидразино-2,7-дифенил-8H-пиразо-
бесцветные кристаллы, т.пл. 205-206°С. Спектр
ло[5,1-d][1,2,5]триазепин
(12). Смесь
1.15 г
ЯМР 1H, δ, м.д.: 3.88 с (3H, CH3), 5.81 с (2H, CH2),
(3.63 ммоль) соединения 9 и 3.63 мл (72.55 ммоль)
7.07 д (2H, Ph, J 8.8 Гц), 7.30 т (1H, Ph, J 7.6 Гц),
гидразингидрата кипятили при перемешивании в
7.32-7.42 м (3H, Ph, CH), 7.51-7.62 м (3H, Ph), 7.86
19 мл этилцеллозольва. Смесь охлаждали, добав-
д (2H, Ph, J 7.6 Гц), 7.97 д (2H, Ph, J 8.8 Гц), 8.08
ляли 80 мл воды и 3 г NaCl. Выпавший осадок от-
д (2H, Ph, J 6.8 Гц). Спектр ЯМР 13C, δ, м.д.: 48.4
фильтровывали и промывали водой. Выход 1.03 г
(CH2), 55.0 (CH3), 103.4 (CH), 113.7, 117.9, 125.3
(90%), мелкие желтоватые игольчатые кристаллы,
(2C), 127.7, 127.8 (2C), 128.3 (2C), 128.8 (2C),
т.пл. 110-111°С. Спектр ЯМР 1H, δ, м.д.: 5.40 с (2H,
130.3 (2C), 131.0 (2C), 131.8, 132.0, 133.3, 141.5,
CH2), 5.67 уш.с (2H, NH2), 6.78 с (1H, CH), 7.21 т
151.2, 152.8, 160.5, 160.9. Найдено, %: C 61.80; H
(1H, Ph, J 7.2 Гц), 7.31 т (2H, Ph, J 7.6 Гц), 7.34-
4.43; Cl 14.01; N 16.67; O 3.09. C26H20N6O·2HCl.
7.41 м (3H, Ph, CH), 7.72 д (2H, Ph, J 7.6 Гц), 7.81 д
Вычислено, %: C 61.79; H 4.39; Cl 14.03; N 16.63;
(2H, Ph, J 6.8 Гц), 9.28 уш.с (1H, NH). Спектр ЯМР
O 3.17.
13C, δ, м.д.: 47.6 (CH2), 101.9 (CH), 125.1 (2C),
3-Метил-6,10-дифенил-7H-пиразоло[5,1-d]-
126.0 (2C), 127.2, 128.1, 128.4, 129.4, 132.6, 134.7,
[1,2,4]триазоло[4,3-b][1,2,5]триазепин (13a) (аль-
135.2, 137.9, 149.3, 154.8. Найдено, %: C 68.37; H
тернативный метод). Смесь 0.1 г (0.316 ммоль)
5.14; N 26.49. C18H16N6. Вычислено, %: C 68.34; H
соединения
12 и
0.06 мл
(0.60 ммоль) пен-
5.10; N 26.56.
тан-2,4-диона кипятили 1 ч в 0.4 мл этилцеллозо-
3-Метил-6,10-дифенил-7H-пиразоло[5,1-
льва. Растворитель отогоняли в вакууме, к остатку
d][1,2,4]триазоло[4,3-b][1,2,5]триазепин диги-
добавляли 0.1 мл метанола и нагревали до кипе-
дрохлорид (13a) и 3-(4-метоксифенил)-6,10-ди-
ния. При растирании маслянистого остатка начи-
фенил-7H-пиразоло[5,1-d][1,2,4]триазоло[4,3-
налась кристаллизация. Выпавшие кристаллы от-
b][1,2,5]триазепин дигидрохлорид (13b) (общая
фильтровывали и промывали метанолом. Выход
методика). К раствору 0.1 г (0.316 ммоль) соеди-
0.053 г (49%), мелкие бесцветные кристаллы, т.пл.
нения 12 в 0.2 мл абсолютного диоксана добавля-
176-178°С. Спектр ЯМР 1H, δ, м.д.: 2.59 с (3H,
ли 0.05 мл (0.633 ммоль) ацетилхлорида (a) или
CH3), 5.68 с (2H, CH2), 7.25-7.35 м (2H, Ph, CH),
0.11 мл (0.633 ммоль) 4-метоксибензоилхлорида
7.39 т (2H, Ph, J 7.2 Гц), 7.53-7.62 м (3H, Ph), 7.85
д (2H, Ph, J 7.2 Гц), 8.11 д (2H, Ph, J 6.8 Гц). Спектр
(b). Смесь кипятили 5 мин, насыщали раствор га-
ЯМР 13C, δ, м.д.: 10.1 (CH3), 48.4 (CH2), 103.0
зообразным HCl и продолжали кипячение в тече-
ние еще 2 ч. К раствору добавляли 10 мл диэтило-
(CH), 125.3 (2C), 127.8 (3C), 128.3 (2C), 128.8 (2C),
вого эфира и оставляли на 1 ч. Выпавшую смолу
131.4, 131.8, 132.0, 133.4, 140.7, 151.1, 151.6, 159.4.
Найдено, %: C 70.59; H 4.73; N 24.68. C20H16N6.
отделяли деканттацией и добавляли к ней 0.3 мл
Вычислено, %: C 70.57; H 4.74; N 24.69.
пропанола-2. При нагревании и растирании масло
растворялось, и начинали выпадать бесцветные
6,10-Дифенил-7H-пиразоло[5,1-d]тетразоло-
мелкие кристаллы. Через 1 ч осадок отфильтро-
[1,5-b][1,2,5]триазепин (14). К раствору 0.1 г
вывали и промывали пропанолом-2. Выход соеди-
(0.316 ммоль) соединения 12 в 1 мл уксусной кис-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
626
ХАРАНЕКО и др.
лоты в один приём добавляли 0.03 г (0.32 ммоль)
жёлтые кристаллы, т.пл. 88-92°С. Спектр ЯМР
NaNO2 и перемешивали 1 ч при комнатной темпе-
1H, δ, м.д.: 5.56 с (4H, 2CH2), 7.25-7.39 м (8H, Ph,
ратуре. Осадок отфильтровывали, промывали не-
2CH), 7.48-7.55 м (6H, Ph), 7.79 д (4H, Ph, J 7.2 Гц),
большим количеством уксусной кислоты и водой.
7.98 д (4H, Ph, J 5.6 Гц), 13.12 с (2H, 2NH). Спектр
Выход 0.059 г (57%), мелкие бесцветные кристал-
ЯМР 13C, δ, м.д.: 49.4 (2CH2), 110.5 (2CH), 125.7
лы, т.пл. 206-207°С. Спектр ЯМР 1H, δ, м.д.: 5.83
(4C), 127.7 (4C), 128.3 (2C), 128.8 (4C), 129.2 (4C),
с (2H, CH2), 7.30 т (1H, Ph, J 7.2 Гц), 7.38 т (2H,
131.6 (2C). 132.4 (2C), 142.3 (2C), 150.8 (2C), 158.9
Ph, J 7.6 Гц), 7.51-7.61 м (3H, Ph, CH), 7.64 т (1H,
(2C), 180,5 (2C). Найдено, %: C 72.02; H 4.75; N
Ph, J 7.2 Гц), 7.85 д (2H, Ph, J 7.2 Гц), 8.16 д (2H,
23.23. C38H28N10. Вычислено, %: C 71.98; H 4.70;
Ph, J 7.2 Гц). Спектр ЯМР 13C, δ, м.д.: 49.5 (CH2),
N 23.32.
105.5 (CH), 125.9 (2C), 128.6, 128.9, 129.0 (4C),
129.5 (2C), 132.0, 133.0, 133.3, 141.7, 152.5, 162.0.
КОНФЛИКТ ИНТЕРЕСОВ
Найдено, %: C 66.07; H 4.03; N 29.90. C18H13N7.
Авторы заявляют об отсутствии конфликта ин-
Вычислено, %: C 66.05; H 4.00; N 29.95.
тересов.
4-(3,5-Диметил-1H-пиразол-1-ил)-2,7-дифе-
СПИСОК ЛИТЕРАТУРЫ
нил-8H-пиразоло[5,1-d][1,2,5]триазепин
(15).
Смесь 0.05 г (0.158 ммоль) соединения 12 и
1.
Zheng L.-W., Zhao B.-X., Liu Y.-R. J. Heterocycl.
0.025 мл (0.25 ммоль) пентан-2,4-диона в 0.25 мл
Chem. 2012, 49, 691-695. doi 10.1002/jhet.833
диоксана кипятили 4 ч. Смесь разбавляли 0.5 мл
2.
Zheng L.-W., Xuan H.-Z., Liu Y.-R., Zhao B.-X.,
воды, жёлтую смолу отделяли декантацией. К смо-
Liu J.-T., Miao J.-Y. Helvetica Chim. Acta. 2012, 95,
ле добавляли 0.25 мл метанола и растворяли при
134-143. doi 10.1002/hlca.201100249
нагревании. Из раствора при охлаждении выпадал
3.
Харанеко А.О., Харанеко О.И. ЖОрХ. 2018, 54,
осадок. Осадок отфильтровывали и промывали
738-742. [Kharaneko A.O., Kharaneko O.I. Russ.
метанолом. Выход 0.031 г (52%), мелкие бесцвет-
J. Org. Chem. 2018, 54, 742-746.] doi 10.1134/
ные кристаллы, т.пл. 170-172°С. Спектр ЯМР 1H,
S1070428018050111
δ, м.д.: 2.20 с (3H, CH3), 2.70 с (3H, CH3), 4.94 уш.с
4.
Zheng L.-W., Shao J.-H., Zhao B.-X., Miao J.-Y.
(1H, CH2), 5.93 уш.с (1H, CH2), 6.12 с (1H, CH),
Bioorg. Med. Chem. Lett. 2011, 21, 3909-3913. doi
6.89 с (1H, CH), 7.28 т (1H, Ph, J 7.2 Гц), 7.37 т (2H,
10.1016/j.bmcl.2011.05.035
Ph, J 7.6 Гц), 7.47-7.50 м (3H, Ph), 7.78 д (2H, Ph,
5.
Заремба О.В., Горобец Н.Ю., Коваленко С.С.,
J 7.6 Гц), 7.95-8.12 м (2H, Ph). Спектр ЯМР 13C, δ,
Друшлак О.Г., Гревцов О.Ю., Ловаленко С.М. ХГС.
м.д.: 13.4 (CH3), 13.6 (CH3), 48.8 (CH2), 105.6 (CH),
2013, 49, 980-986. [Zaremba O.V., Gorobets N.Yu.,
109.2 (CH), 125.3 (2C), 127.1 (2C), 127.6, 128.3
Kovalenko S.S., Drushlyak O.G., Grevtsov O.Yu.,
(2C), 128.5 (2C), 128.8, 130.5, 132.2, 133.7, 139.2,
Kovalenko S.M. Chem. Heterocycl. Compd. 2013, 49,
142.2, 149.7, 150.3, 153.2. Найдено, %: C 72.65; H
915-921.] doi 10.1007/s10593-013-1326-x
5.27; N 22.08. C23H20N6. Вычислено, %: C 72.61; H
6.
Menges N., Sari O., Abdullayev Y., Erdem S.S.,
5.30; N 22.09.
Balci M. J. Org. Chem. 2013, 78, 5184-5195. doi
4,4'-Гидразин-1,2-диилбис(2,7-дифенил-8H-
10.1021/jo4001228
пиразоло[5,1-d][1,2,5]триазепин)
(16).
Смесь
7.
Харанеко О.И., Попов В.Ю., Богза С.Л. ХГС. 2013,
0.05 г
(0.16 ммоль) соединения
9 и
0.06 г
49, 343-350. [Kharaneko O.I., Popov V.Y., Bogza S.L.
(0.19 ммоль) соединения 12 кипятили 4 ч в
Chem. Heterocycl. Compd. 2013, 49, 317-324.] doi
0.2 мл этилцеллозольва. Смесь охлаждали и по-
10.1007/s10593-013-1249-6
степенно при растирании выпадающего осадка
8.
Харанеко А.О. ЖОрХ. 2017, 53, 727-734. [Kharane-
разбавляли 2 мл воды. Осадок отфильтровывали
ko A.O. Russ. J. Org. Chem. 2017, 53, 738-745.] doi
и промывали водой. Выход 0.091 г (96%), мелкие
10.1134/S1070428017050153
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
СИНТЕЗ И МОДИФИКАЦИЯ ГЕТЕРОКОНДЕНСИРОВАННЫХ ПИРАЗОЛОВ
627
Synthesis and Modification of Heterocondensed Pyrazoles
Obtained from Methyl-1-(2-oxo-2-phenylethyl)-3-phenyl-
1H-pyrazole-5-carboxylate
A. O. Kharaneko, T. M. Pekhtereva and O. I. Kharaneko*
Litvinenko Institute of Physical Organic and Coal Chemistry, 83114, Ukraine, Donetsk, ul. R. Luxemburg 70
*e-mail: o_kharaneko@mail.ru
Received October 1, 2019; revised February 10, 2020; accepted February 18, 2020
A modified method for the synthesis of 2,7-diphenyl-5,8-dihydro-4H-pyrazolo[5,1-d][1,2,5]-triazepin-4-one
is proposed, the possibility of transforming this system into pyrazolo[1,5-a]pyrazine system is shown, the
functionalization reactions of the triazepine ring in C4, as well as the annulation of the tetrazole and triazole
rings along the C4-N5 side of seven-membered cycle, are studied.
Keywords: 5,8-dihydro-4H-pyrazolo[5,1-d][1,2,5]triazepin-4-one, pyrazolo[1,5-a]pyrazin-4-ol, pyrazolo[1,5-a]-
pyrazin-4(5H)-one, 5-aminopyrazolo[1,5-a]pyrazin-4(5H)-one, 5,8-dihydro-4H-pyrazolo[5,1-d][1,2,5]triaze-
pin-4-thion, 4-(methylthio)-8H-pyrazolo[5,1-d][1,2,5]triazepine, 4-morpholin-4-yl-8H-pyrazolo[5,1-d][1,2,5]-
triazepine, 4-hydrazino-8H-pyrazolo[ 5,1-d][1,2,5]triazepine, 7H-pyrazolo[5,1-d][1,2,4]triazolo[4,3-b][1,2,5]-
triazepine, 7H-pyrazolo[5,1-d]tetrazolo[1,5-b][1,2,5]triazepine
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020