ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 4, с. 636-640
КРАТКИЕ СООБЩЕНИЯ
УДК 547.022 + 661.7
ПРОДУКТЫ КОНДЕНСАЦИИ АЛЬДЕГИДОВ И
ФЕНИЛТИАЗОЛИДИНА, ПОЛУЧЕННОГО
НА ОСНОВЕ ДИБРОМЭТИЛБЕНЗОЛА
© 2020 г. Г. Ш. Дурускари*, А. Р. Аскерова, Х. Н. Алыева, С. А. Мусаева, А. М. Магеррамов
Бакинский государственный университет, 1148, Республика Азербайджан, г. Баку, ул. З. Халилова 23
*e-mail: rayten507@mail.ru
Поступила в редакцию 04 сентября 2019 г.
После доработки 14 февраля 2020 г.
Принята к публикации 16 февраля 2020 г.
Впервые синтезирован 3-амино-5-фенилтиазолидин-2-иминий-бромид на основе дибромэтилбензола.
Далее путем его взаимодействия с различными альдегидами в качестве продуктов конденсации были
получены соответствующие Шиффовы основания. Структуры полученных соединений подтверждены
методами 1Н и 13С ЯМР спектроскопий.
Ключевые слова: дибромэтилбензол, тиосемикарбазид, Шиффовы основания.
DOI: 10.31857/S0514749220040175
Соединения, содержащие тиазолидиновый
производных , проявляющих широкий спектр био-
фрагмент, имеют большое значение, в силу прояв-
логической активности [5]. Учитывая вышеска-
ления ими различными видами физиологической,
занное, интерес, который вызвала данная область
а также антиокислительной активности [1-4]. В
органического синтеза является вполне объясни-
качестве примера, можно показать препарат пио-
мым. В качестве исходного реагента из доступных
глитазон, который стимулирует выработку лейко-
веществ был получен 3-амино-5-фенил-тиазоли-
цитов во время лейкопении, а также пенициллин,
дин-2-иминий-бромид (1) (схема 2).
бензилпенницилин, ампициллин, оксациллин,
Предполагаемый механизм протекания реак-
амоксициллин являются известными β-лактамны-
ции представлен на схеме 3.
ми антибиотиками, содержащими тиазолидиновое
кольцо (схема 1).
Известно, что тиосемикарбазид в щелочной
В литературе достаточно подробно описаны ис-
среде находится в различных таутомерных фор-
следования в области синтеза различных функци-
мах. Предполагается, что реакция с дибромэтил-
онально-замещенных 2-иминотиазолидинов и их
бензолом и таутомерной формой гидрохлорида ти-
Схема 1.
O
O
COOH
H
O
O
N
N
N
HN
CH3
N
O
R
H
S CH3
S
S
H
Тиазолидин
Пиоглитазон
Пенициллин
636
ПРОДУКТЫ КОНДЕНСАЦИИ АЛЬДЕГИДОВ И ФЕНИЛТИАЗОЛИДИНА
637
Схема 2.
NH2
S
Br
EtOH, пиперидин
N
+
NH2 HClкипячение, 7 ч
Br
NH2Br
Ph
NH2
N
H
S
Ph
1
осемикарбазида может протекать как за счет элек-
ной с азотом проявляется в области 4.16 м.д. в
тронов азота, так и атома серы. Однако, вследствие
виде квартета, а сигнал второго протона в области
возможного участия электронов атомов азота NH-
4.45 м.д. в виде триплета. Кроме того, в спектре
и NH2-групп в сопряжении с C=S связью, нукле-
также наблюдаются сигналы протонов аромати-
офильная способность азота уменьшается и веро-
ческого кольца в области 7.32-7.50 м.д. (мульти-
ятнее всего реакция завершается формированием
плет), протонов NH2-группы в области 9.12 м.д.
гетероцикла за счет замыкания цикла из-за атаки
(синглет) и протона NH= группы в области
электронной пары атома серы к фрагменту CHBr.
9.78 м.д. (синглет).
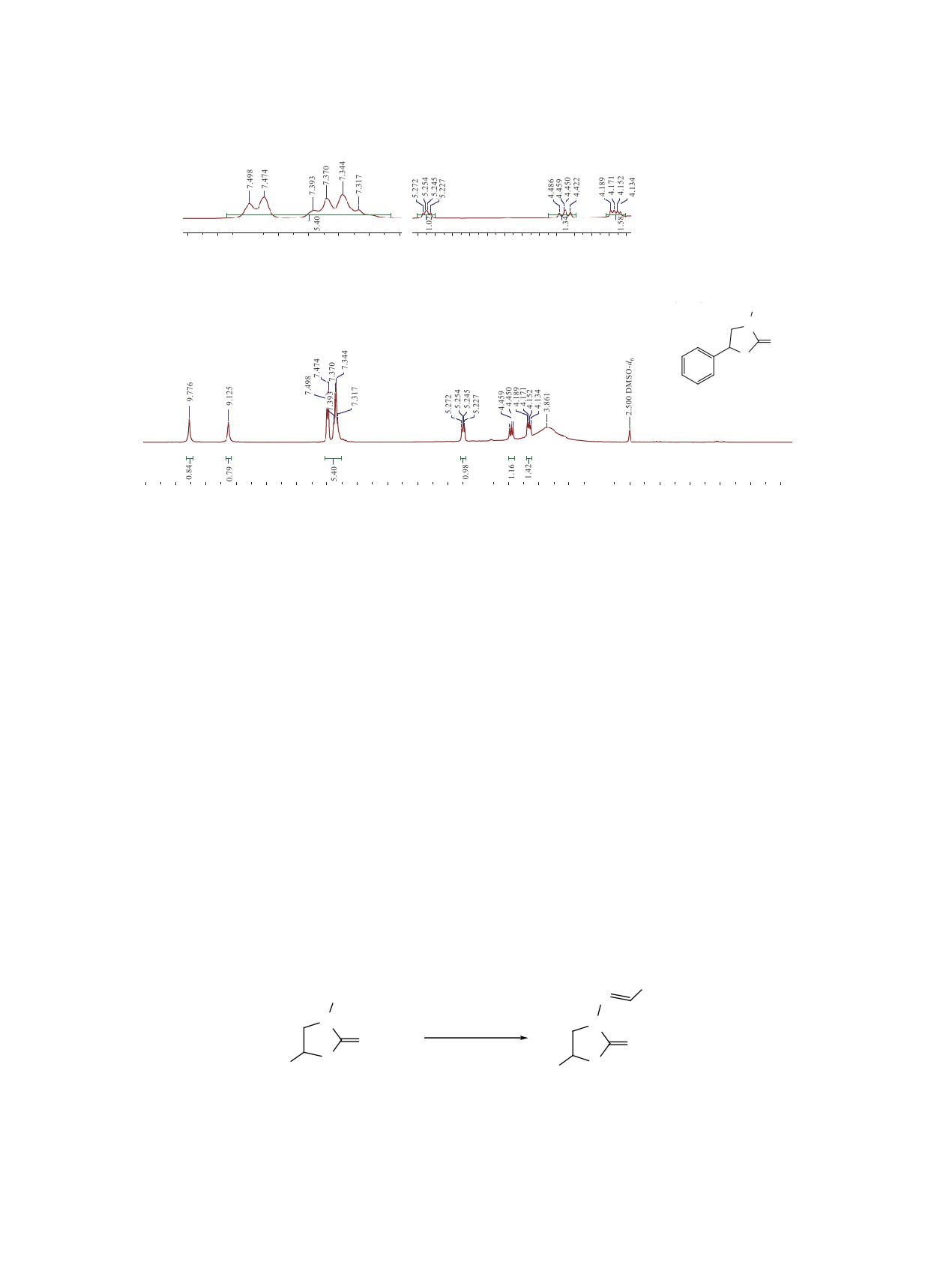
В спектре ЯМР 1Н соединения 1 наблюдается
Следующим этапом работ было осуществление
расщепление сигнала неэквивалентных протонов
синтеза соответствующих Шиффовых оснований,
CH2-фрагмента под действием сигнала прото-
являющихся продуктами конденсации
2-ими-
на соседней СН-группы (см. рисунок). По этой
но-5-фенилтиазолидин-3-амина с различными
причине, один из протонов СH2 группы, связан-
альдгидами в мягких условиях [6, 7] (схема 4).
Схема 3.
b
Br
Br
HN NH2
NH2
HN NH2
N
+
C
HS NH
S
NH2
HS
NH2
a
Br:
S
-
(a)
-Br
(b)
NH
-HBr
NH
–HBr
–
NH2
Br
H2N
H
Br:
S
NH2
BrHNNH2
N
BrHN:
NH
N+ NH2
NH
+
HN:
S
S
NH
S NH
S
NH
NH
2
-
H
–Br
-
-
(c)
-Br
Br
S
1
NH
S
–HBr
(d)
N
NH
+
NH2
-
–HBr
N: H Br
NH2
1c
NH2
S
NH
S
N
NH
:NH
N
H
1d
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
638
ДУРУСКАРИ и др.
7.60
7.50
7.40
7.30
5.3
5.1
4.9
4.7
4.5
4.3
4.1
f1, м.д.
f1, м.д.
NH2
6
Br-
N
14
1
5
+
8
2
NH2
7
4
13
9
S
3
10
12
11
10.0
9.0
8.0
7.0
6.0
5.0
4.0
3.0
2.0
1.0
0.0
f1, м.д.
Рис. 1. Спектр ЯМР 1Н соединения 1.
Впервые разработан эффективный метод син-
4.45 т (1H, CH2, 3JHH 8.4 Гц), 5.25 т (1H, CH-Ar,
теза
3-амино-5-фенилтиазолидин-2-иминий-бро-
3JHH 5.4 Гц), 7.32-7.50 м (5Hаром), 9.12 с (2H,
мида с помощью доступных реагентов. В резуль-
NH2), 9.78 с (1H, NH=). Спектр ЯМР 13C (75 MHz,
тате дальнейшего взаимодействия этого вещества
DMSO-d6), δ, м.д.: 44.42, 62.06, 127.59, 128.76,
с различными альдегидами получены соответству-
129.17, 138.85, 168.53. Масс-спектр (ESI), m/z:
ющие Шиффовы основания.
194.28 [C9H12N3S]+ и 79.88 [Br-]. Найдено, %: С
39.40; Н 4.25; N 15.30. C9N3SH12Br. Вычислено, %:
3-Амино-5-фенилтиазолидин-2-иминий бро-
С 39.42; Н 4.38; N 15.33.
мид (1). В этаноле растворяли 0.6 г (2.2 ммоль)
2-имино-5-фенилтиазолидин-3-амина (1) и к по-
5-Фенил-3-[(4-трифторметил)бензилиден]-
лученной смеси добавлялии 0.3 г (2.3 ммоль) ги-
амино-тиазолидин-2-иминиум бромид
(2). К
дрохлорида тиосемикарбазида. После добавления
0.4 г
(0.001 моль)
3-имино-5-фенилтиазоли-
2-3 капель пиперидина реакционнyю смесь пере-
дин-2-иминий-бромида (1) добавляли этиловый
мешивали при кипячении в тeчение 7 ч. Выпавшие
спирт, а зaтем 0.25 г (0.001 моль) 4-трифторбен-
белые кристаллы отфильтровывают и перекри-
зальдегида. Сммесь перемешивали при кипении в
сталлизовывали из этилового спирта. Выход 0.42 г
течение 2 ч. Полученые белые кристаллы отфиль-
(68%), т.пл. 194-196°С. Спектр ЯМР 1H (300 МГц,
тровывали и промывали ацeтоном. Выход 0.4 г
DMSO-d6), δ, м.д.: 4.16 к (1H, CH2, 3JHH 5.4 Гц),
(73%), т.пл. 230-232°С. Спектр ЯМР 1H (300 МГц,
Схема 4.
Ar
NH2
N
N
ArCHO, EtOH
N
+
-
+
–
NH2Br
NH2Br
кипячение, 2 ч
S
Ph
S
Ph
1
2-7
Ar = 4-CF3-C6H4 (2), 4-N-(CH3)2-C6H4 (3), 5-OH-2-Br-C6H3 (4), 3-OH-C10H6 (5),
4-OCH3-C6H4 (6), 4-NO2-C6H4 (7).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
ПРОДУКТЫ КОНДЕНСАЦИИ АЛЬДЕГИДОВ И ФЕНИЛТИАЗОЛИДИНА
639
DMSO-d6), δ, м.д.: 4.58 к (1H, CH2, 3JHH 6.6 Гц),
128.45,
128.50,
129.00,
129.11,
129.35,
129.54,
4.89 т (1H, CH2, 3JHH 8.4 Гц), 5.60 т (1Hаром, 3JHH
131.66, 135.09, 137.72, 150.55, 158.84, 167.37.
7.5 Гц), 7.39-8.29 м (9Hаром), 8.51 с (1H, CH), 10.51
Найдено, %: С 56.01; Н 4.00; N 9.78. C20N3SОH18Br.
с (1H, NH). Спектр ЯМР 13C (75 МГц, DMSO-d6),
Вычислено, %: С 56.07; Н 4.20; N 9.81.
δ, м.д.: 45.45, 56.03, 125.74, 125.80, 127.86, 128.95,
5-Фенил-3-[2-(п-метокси)-винил]тиазоли-
129.15, 129.22, 130.72, 131.14, 136.85, 137.50,
дин-2-имин (6). Методика синтеза аналогична
149.54, 168.62. Масс-спектр (ESI), m/z:
350.38
методике синтеза для соединения (2). Выход 0.3 г
[C17H15F3N3S]+ и 79.88 [Br-]. Найдено, %: С 47.40;
(83%), белые кристаллы, т.пл. 235-237°С. Спектр
Н 3.45; N 9.75. C17N3SF3H15Br. Вычислено, %: С
ЯМР 1H (300 МГц, DMSO-d6), δ, м.д.: 3.81 с (3H,
47.44; Н 3.49; N 9.77.
CH3O), 4.54 к (1H, CH2, 3JHH 6.9 Гц), 4.86 т (1H,
4-{[(2-Имино-5-феилтиазолидин-3-ил)ими-
CH2, 3JHH 9.0 Гц), 5.58 т (1Hаром, 3JHH 6.9 Гц), 7.03-
но]метил}-N,N-диметиланилин
(3). Методика
8.03 м (9Hаром), 10.56 с (1H, NH). Спектр ЯМР 13C
синтеза аналогична методике синтеза для соеди-
(75 МГц, DMSO-d6), δ, м.д.: 45.78, 55.98, 56.37,
нения (2). Выход 0.34 г (57.6%), белые кристал-
114.81,
125.86,
128.21,
129.31,
129.55,
131.02,
лы, т.пл. 246-248°С. Спектр ЯМР 1H (300 МГц,
138.02, 151.29, 162.42, 167.55. Найдено, %: С
56.01; Н 4.00; N 9.78. C20N3SОH18Br. Вычислено,
DMSO-d6), δ, м.д.: 2.99 с (6H, 2NCH3), 4.52 т (1H,
CH2, 3JHH 6.9 Гц), 4.83 т (1H, CH2, 3JHH 9.0 Гц),
%: С 56.07; Н 4.20; N 9.81.
5.55 т (1H, CH, 3JHH 7.5 Гц), 6.73-7.86 м (9Hаром),
4-[(п-Нитробензилиден)винил]нафталин-
8.24 с (1H, CH), 10.37 с (1H, NH). Спектр ЯМР 13C
2-ол (7). Методика синтеза аналогична методике
(75 МГц, DMSO-d6), δ, м.д.: 40.19, 45.67, 56.39,
синтеза для соединения (2). Выход 0.5 г (85%), бе-
111.92,
120.14,
128.20,
129.28,
129.55,
130.75,
лые кристаллы, т.пл. 273-275°С. Спектр ЯМР 1H
138.12, 151.93, 152.81, 166.37. Найдено, %: С
(300 МГц, DMSO-d6), δ, м.д.: 4.58 т (1H, CH2, 3JHH
53.00; Н 5.15; N 13.79. C18N4SH21Br. Вычислено,
8.4 Гц), 4.91 т (1H, CH2, 3JHH 9.0 Гц), 5.63 т (1H,
%: С 53.33; Н 5.19; N 13.83.
CH, 3JHH 7.0 Гц), 7.36-8.31 м (9Hаром), 8.56 с (1H,
CH), 10.60 с (1H, NH). Спектр ЯМР 13C (75 МГц,
2-Бром-5-{[(2-имино-5-фенилтиазолидин-
DMSO-d6), δ, м.д.: 45.93, 56.51, 124.39, 128.29,
3-ил)имино]метил}фенол (4). Методика синте-
129.38,
129.57,
130.04,
137.85,
139.43,
149.11,
за аналогична методике синтеза для соединения
149.20, 169.23. Найдено, %: С 3.88; Н 3.65; N 13.72.
(2). Выход 0.5 г (74%), белые кристаллы, т.пл.
C16N4SО2H15Br. Вычислено, %: С 3.93; Н 3.69; N
250-252°С. Спектр ЯМР 1H (300 МГц, DMSO-d6),
13.76.
δ, м.д.: 4.53 т (1H, CH2, 3JHH 6.9 Гц), 4.89 т (1H,
CH2, 3JHH 9.3 Гц), 5.56 т (1Hаром, 3JHH 7.5 Гц), 6.98-
Все реагенты закуплены от фирм MERCK и
8.42 м (8Hаром). 8.26 с (1H, CH), 10.52 с (1H, NH).
FLUKA и использовались без дальнейшей очист-
Спектр ЯМР 13C (75 МГц, DMSO-d6), δ, м.д.: 45.97,
ки. Спектры ЯМР 1Н и 13С регистрировали на
55.83, 111.69, 119.21, 121.55, 128.29, 129.30, 129.49,
спектрометре Bruker Avance 300 МГц (на часто-
135.78, 137.76, 145.21, 157.28, 168.23. Найдено,
тах 300 и 75 МГц соответственно). Температуры
%: С 41.98; Н 3.25; N 9.15. C16N3SОH15Br2. Вы-
плавления измеряли на аппарате Stuart 30. А ход
числено, %: С 42.01; Н 3.28; N 9.19.
реакции контролировали методом тонкослойной
хроматографии (ТСХ) на аллюминиевых пластин-
4-[2-(2-Имино-5-фенилтиазолидин-3-ил)ви-
ках с силикагелем 60 F254.
нил]нафталин-2-ол (5). Методика синтеза анало-
гична методике синтеза для соединения (2). Выход
КОНФЛИКТ ИНТЕРЕСОВ
0.44 г (71%), белые кристаллы, т.пл. 232-234°С.
Авторы заявляют об отсутствии конфликта ин-
Спектр ЯМР 1H (300 МГц, DMSO-d6), δ, м.д.: 4.68
тересов.
т (1H, CH2, 3JHH 8.4 Гц), 5.06 т (1H, CH2, 3JHH
9.6 Гц), 5.59 т (1Hаром, 3JHH 7.5 Гц), 7.34-8.92 м
СПИСОК ЛИТЕРАТУРЫ
(11Hаром), 8.87 с (1H, CH), 10.60 с (1H, OH), 10.80
1. Bayram F., Sipahi H., Acar E., Ulugöl K., Buran K.,
с (1H, NH). Спектр ЯМР 13C (75 МГц, DMSO-d6),
Akgün H. Eur. J. Med. Chem. 2016, 114, 337-344. doi
δ, м.д.: 45.71, 56.67, 109.85, 118.67, 124.24, 125.23,
10.1021/jm00371a006
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020
640
ДУРУСКАРИ и др.
2. Jain V., Vora D., Rama C. Bioorg. Med. Chem. 2013,
5. D’hooghe M., De Kimpe N. Tetrahedron. 2006, 62,
21, 1599-1608. doi 10.1016/j.bmc.2013.01.029
513-535. doi 10.1016/j.tet.2005.09.028
6. Akkurt M., Duruskari G., Toze F.A.A., Khalilov A.,
3. Katayama H., Morisue S. Tetrahedron. 2017, 73, 3541-
Huseynova A. Acta Cryst. E. 2018, 74, 1168-1172. doi
3546. doi 10.1016/j.tet.2017.05.041
10.1107/S2056989018010496
4. Veale E., O’Brien J., McCabe T., Gunnlaugsson T.
7. Akkurt M., Maharramov A., Duruskari G., Toze F.A.A.,
Tetrahedron. 2008, 64, 6794-6800. doi 10.1016/j.
Khalilov A. Acta Cryst. E. 2018, 74, 1290-1294. doi
tet.2008.04.097
10.1107/S2056989018011155
Products of Condensation of Aldehydes and Phenylthiazolidine
on the Base of Dibromethylbenzene
G. Sh. Duruskari*, A. R. Asgarova, Kh. N. Aliyeva, S. A. Musayeva, and A. M. Maharramov
Baku State University, 1148, Republic of Azerbaijan, Baku, ul. Z. Khalilova 23
*e-mail: rayten507@mail.ru
Received September 4, 2019; revised February 14, 2020; accepted February 16, 2020
At first time 3-amino-5-phenylthiazolidine-2-iminium bromide was synthesized on the base of dibromo-
methylbenzene and by the carrying out the interactions of the obtained crystals with various aldehydes the
corresponding Shiff bases have been obtained. Structures of synthesized compounds confirmed by 1H and 13C
NMR spectroscopy.
Keywords: dibromoethylbenzene, thisemicarbazide, Shiff bases
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 4 2020