ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 5, с. 672-678
УДК 547.239
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ
МОЧЕВИН И ИХ ИЗОСТЕРИЧЕСКИХ АНАЛОГОВ,
СОДЕРЖАЩИХ ПОЛИЦИКЛИЧЕСКИЕ ФРАГМЕНТЫ: I.
СИНТЕЗ 1-(АДАМАНТАН-1-ИЛ)-3-(ФТОР,
ХЛОРФЕНИЛ) МОЧЕВИН
© 2020 г. В. В. Бурмистровa, b, Д. В. Даниловb, В. С. Дьяченкоa, b,
Е. В. Рассказоваb, Г. М. Бутовa, b, *
a ФГБОУ ВО «Волжский политехнический институт» (филиал) ВолгГТУ,
404121, Россия, Волгоградская обл., г. Волжский, ул. Энгельса 42а
*e-mail: butov@volpi.ru
b ФГБОУ ВО «Волгоградский государственный технический университет»,
400006, Россия, г. Волгоград, ул. Дегтярева 2
Поступила в редакцию 10 января 2020 г.
После доработки 12 февраля 2020 г.
Принята к публикации 13 февраля 2020 г.
Синтезирована серия 1,3-дизамещенных мочевин с фенильным фрагментом, содержащим атомы фтора
и(или) хлора в различных положениях ароматического кольца с выходами 33-80%. Впервые синтези-
рован 1-изоцианатоадамантан по реакции (адамантан-1-ил)карбоновой кислоты с дифенилфосфорил
азидом (DPPA) с выходом 85%.
Ключевые слова: адамантан, изоцианат, мочевина, фтор, растворимая эпокисдгидролаза, sEH.
DOI: 10.31857/S051474922005002X
В последние годы растворимая эпоксидгидро-
яния таких изменений на свойства ингибиторов
лаза (sEH) человека стала перспективной мише-
необходимо создание базовой серии 1-(адаман-
нью для лечения воспалительных процессов [1].
тан-1-ил)-3-R-дизамещенных мочевин, где R - га-
Ингибирование sEH высокоселективными инги-
логенсодержащая ароматическая группа.
биторами позволяет сохранять высокую концен-
Мочевины, содержащие
2-фторфенильный
трацию метаболитов арахидоновой кислоты, что
фрагмент ранее уже показали повышенную ак-
может положительно сказаться при лечении забо-
тивность при ингибировании sEH человека по
леваний почек и гипертонической болезни [2, 3].
сравнению с не фторированным аналогом [9].
Адамантилсодержащие 1,3-дизамещенные моче-
1-(Адамантан-1-ил)-3-(4-фторфенил)
мочевина
вины [4] и их структурные аналоги [5] системати-
исследовалась в качестве антимикробного агента
чески исследуются в качестве ингибиторов sEH.
Однако, известные соединения характеризуются
против ряда грамм-положительных и грамм-от-
низкой растворимостью в воде и быстрым метабо-
рицательных бактерий [10]. Однако, кроме этого,
лизмом.
сведений по синтезу и свойствам 1-(адамантан-1-
Структурная модификация адамантильной ча-
ил)-3-(фтор-, хлорфенил) мочевин не проводилось.
сти молекулы является перспективным направле-
В этой связи представляет интерес оценка влияния
нием для устранения существующих недостатков
положения галогенов в ароматическом кольце на
ингибиторов sEH [6-8]. Однако для изучения вли-
ингибирующую активность мочевин.
672
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН И ИХ ИЗОСТЕРИЧЕСКИХ АНАЛОГОВ
673
замещенных анилинов 3b-j (схема 2). Подбор га-
Схема 1.
логенанилинов проводился таким образом, чтобы
получить зависимость активности мочевин от по-
ложения атомов F и (или) Cl и от количества ато-
мов галогенов.
Реакцию проводили в безводном диэтило-
Синтез данных мочевин проводили по реакции
вом эфире при комнатной температуре в течение
1-изоцианатоадамантана с различными галогена-
12 ч. Образующуюся в качестве побочного про-
нилинами. Ранее нами для получения 1-адаман-
дукта симметричную диадамантил мочевину
5
тилсодержащих изоцианатов использовался one
(~5%) отделяли перекристаллизацией из этанола.
pot синтез по реакции Курциуса из соответствую-
Свойства синтезированных 1,3-дизамещенных мо-
щих адамантанкарбоновых кислот, тионилхлорида
чевин представлены в таблице.
и азида натрия [11-13]. В данной работе впервые
Структуру полученных соединений подтвер-
получен 1-изоцианатоадамантан (2) из (адаман-
ждали методом ЯМР-спектроскопии 1H, 13C и 19F,
тан-1-ил)карбоновой кислоты (1), дифенилфосфо-
а также масс-спектрометрией. В спектрах ЯМР 1H
рил азида (DPPA) и триэтиламина, взятых в экви-
присутствует два характерных сигнала протонов
молярных количествах, с выходом 85% (схема 1).
NH мочевинной группы. Сигнал в области 5.79-
Данный метод также основан на перегруппи-
6.50 соответствуют протону ближней к адаман-
ровке Курциуса. В сравнении данного метода с
тильному фрагменту NH-группы, а сигнал в обла-
описанными нами ранее можно выделить следую-
сти 7.60-8.49 - протону NH-группы, связанной с
щие его достоинства: сокращение числа стадий за
ароматическим кольцом.
счет прямого замещения карбоксильной группы в
соединении 1 на ацилазидную группу и ее после-
Рассчитанный коэффициент липофильности
дующую перегруппировку в изоцианатную груп-
LogP для полученных соединений находится в пре-
пу; уменьшение числа реагентов; снижение чис-
делах 4.49-5.14 и практически не зависит от поло-
ла операций выделения избытка реагентов, что в
жения атомов галогенов в ароматическом кольце
конечном итоге приводит к уменьшению времени
(2-F 4.49, 3-F 4.51, 4-F 4.53). Также коэффициент
синтеза до 1 ч. Однако на стадии экстракции про-
липофильности не изменяется при введении вто-
дукта 2 требуется использование дополнительного
рого атома фтора (2,4-F 4.62, 2,6-F 4.60, 3,4-F 4.62).
безводного растворителя, например диэтилового
В то же время, замена атома фтора на хлор уве-
эфира.
личивает коэффициент липофильности примерно
Для синтеза 1,3-дизамещенных мочевин 4a-j
на 0.5, что, вероятно может привести к снижению
из изоцианата 2 были выбраны 10 фтор и хлор
растворимости хлорсодержащих мочевин в воде
Схема 2.
R2
R1
R3
2
R
H2N
R4
R5
R1
R3
O
O
3a-j
O
C
+
N
N
N
R4
N
N
H
H
H
H
R5
2
4a-j
5
R2 = F, R1 = R3 = R4 = R5 = H (4a); R3 = F, R1 = R2 = R4 = R5 = H (4b); R2 = Cl, R1 = R3 = R4 = R5 = H (4c);
R1 = R3 = F, R2 = R4 = R5 = H (4d); R1 = R5 = F, R2 = R3 = R4 = H (4e); R2 = R3 = F, R1 = R4 = R5 = H (4f);
R1 = Cl, R3 = F, R2 = R4 = R5 = H (4g); R1 = F, R3 = Cl, R2 = R4 = R5 = H (4h); R1 = F, R4 = Cl, R2 = R3 = R5 =H (4i);
R2 = Cl, R3 = F, R1 = R4 = R5 = H (4j).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020
674
БУРМИСТРОВ и др.
Коэффициенты липофильности, температуры плавления и выходы синтезированных соединений 4a-j и их аналогов.
№
Структура
Mr
LogPa
tпл, °C
Выход, %
288
4.49
199-200 [9]
85
4a
288
4.51
149-150
46
4b
288
4.53
199-200
40
4c
304
5.02
160-161
73
4d
306
4.62
216-217
37
4e
306
4.60
147-148
40
4f
306
4.62
224-225
80
4g
322
5.14
219-220
35
4h
322
5.14
231-232
50
4i
322
5.14
154-155
35
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН И ИХ ИЗОСТЕРИЧЕСКИХ АНАЛОГОВ
675
Таблица. (продолжение).
№
Структура
Mr
LogPa
tпл, °C
Выход, %
4j
322
5.14
214-215
50
Температура плавления мочевин, содержащих
Строение полученных соединений подтвер-
два атома галогена в ароматическом кольце, на-
ждали с помощью ЯМР 1Н, 13C и 19F спектроско-
оборот, зависит от расположения заместителей
пии, хромато-масс-спектрометрии и элементного
и не зависит от природы атомов галогенов. Если
анализа. Масс-спектры регистрировали на хро-
в положении C4 присутствует заместитель (4-F
мато-масс-спектрометре «Agilent GC 5975/MSD
или 4-Cl), то температура плавления составляет
7820». Капиллярная кварцевая колонка HP-5MS
~230°C, в противном случае температура плавле-
(длина 30 м, диаметр 0.25 мм, толщина слоя
ния снижается до 149-155°C. Пониженная темпе-
0.5 мкм), газ-носитель - гелий. Программируемый
ратура плавления мочевин является положитель-
нагрев колонки от 80 до 280°С, температура ис-
ным свойством ингибиторов. В целом введение
парителя 250°С. Спектры ЯМР 1H, 13C и 19F для
атомов галогена в ароматическое кольцо способ-
соединений 4b-i зарегистрированы на спектро-
ствует снижению температур плавления ингибито-
метре «Bruker DRX500» (500 МГц) в растворите-
ров на 50-100°C по сравнению с незамещенными
ле DMSO-d6. Спектры ЯМР 1H и 13C для соеди-
аналогами [6, 9].
нений 4a и 4j зарегистрированы на спектроме-
тре Jeol JNM-ECX400 (400 МГц) в растворителе
Таким образом, в мягких условиях получена
серия 1-(адамантан-1-ил)-3-R-дизамещенных мо-
DMSO-d6. Химические сдвиги 1H приведены от-
носительно SiMe4. Элементный анализ выполнен
чевин, где R - галогенсодержащая ароматическая
на приборе «Perkin-Elmer Series II 2400».
группа. Полученные соединения будут исследова-
ны в качестве ингибиторов растворимой эпоксид-
1-Изоцианатоадамантан (2). К смеси 10 г
гидролазы человека. Данная серия мочевин будет
(55.5 ммоль) адамантан-1-карбоновой кислоты
использована как эталон для оценки влияния из-
(1) и 5.65 г (55.5 ммоль) триэтиламина в 100 мл
менений вносимых в адамантильный фрагмент, а
безводного толуола прикапывали в течение 30 мин
также оценки влияния позиционной изомерии ато-
12 мл (15.3 г, 55.5 ммоль) дифенилфосфорил азида
мов галогенов на ингибирующую активность.
при комнатной температуре. Затем реакционную
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
смесь нагревали до кипения и выдерживали еще
30 мин до полного прекращения выделения азота.
Исходные 3-хлоранилин (99%, CAS 108-42-9),
Толуол упаривали, продукт из реакционной массы
3-хлор-4-фторанилин (98%, CAS 367-21-5), триэ-
извлекали безводным диэтиловым эфиром. Выход
тиламин (BioUltra ≥99.5%, CAS 121-44-8), ДМФА
8.35 г (85%) т.пл. 144-145°С. (лит. 144-145°С [14]).
(Anhydrous 99.8%, CAS 68-12-2) производства
Масс-спектр, m/z (Iотн, %): 177 (10) [М]+, 135 (100)
фирмы «Sigma-Aldrich»; 4-фторанилин (99%, CAS
[Ad]+.
371-40-4), 2,4-дифторанилин (99%, CAS 367-25-9),
2,6-дифторанилин (98%, CAS 5509-65-9), 3,4-диф-
1-(Адамантан-1-ил)-3-(3-фторфенил) моче-
торанилин (98+%, CAS 3863-11-4), 2-хлор-4-фто-
вина (4a). К 0.2 г (1.13 ммоль) 1-изоцианатоада-
ранилин (97%, CAS 2106-02-7), 4-хлор-2-фторани-
мантана (2) в 5 мл безводного диэтилового эфира
лин (98%, CAS 57946-56-2), 5-хлор-2-фторанилин
прибавляли 0.13 г (1.17 ммоль) 3-фторанилина
(97%, CAS 2106-05-0) производства фирмы «Alfa
(3а) и 0.2 мл триэтиламина. Реакционную смесь
Aesar»; 3-фторанилин (98%, CAS 372-19-0) произ-
выдерживали при комнатной температуре в тече-
водства фирмы «abcr» использовали без очистки.
ние 12 ч. После добавления 5 мл 1н HCl, смесь
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020
676
БУРМИСТРОВ и др.
перемешивали в течение 1 ч. Выпавший белый
Выход 0.129 г (37%), т.пл. 216-217°C. Спектр ЯМР
осадок отфильтровывали и промывали водой.
1Н (DMSO-d6), δ, м.д.: 1.60 т (6H, Ad, J 3.1 Гц),
Продукт очищали перекристаллизацией из этано-
1.85 д (6H, Ad, J 3.1 Гц), 2.04 c (3H, Ad), 6.37 с (1H,
ла. Выход 0.15 г (46%), т.пл. 149-150°C. Спектр
NH-Ad), 6.90-6.97 м (1H, 3-Hаром), 7.19-7.22 м
ЯМР 1Н (DMSO-d6), δ, м.д.: 1.56-1.99 м (15H,
(1H, 5-Hаром), 8.05-8.07 м (1H, 6-Hаром), 8.08 с (1H,
Ad), 5.89 с (1H, NH-Ad), 6.59-6.63 м (1Hаром),
NH). Спектр ЯМР 19F (DMSO-d6), δ, м.д.: -126.43
6.87 д (1H, 6-Hаром, J 7.3 Гц), 7.16 к (1H, 5-Hаром, J
(4-F), -120.20 (2-F). Масс-спектр, m/z (Iотн, %): 306
7.8 Гц), 7.38 д (1H, 2-Hаром, J 12.1 Гц), 8.43 с (1H,
(2.7) [М]+, 151 (6.0) [Ad-NH2]+, 135 (29.4) [Ad]+,
NH). Спектр ЯМР 13C (DMSO-d6), δ, м.д.: 29.62 c
129 (100) [C6H3F2NH2]+. Найдено, %: С 66.66; Н
(3C, Ad), 35.55 c (3C, Ad), 44.99 c (3C, Ad), 56.25
6.55; N 9.12; F 12.44. C17H20F2N2О. Вычислено, %:
c (Adчетв), 107.45 д (2-Cаром, J 21.0 Гц), 113.48 с
С 66.65; Н 6.58; N 9.14; F 12.40. М 306.36.
(6-Cаром), 122.84 с (5-Cаром), 130.55 д (1-Cаром, J
1-(Адамантан-1-ил)-3-(2,6-дифторфенил) мо-
9.5 Гц), 143.12 с (4-Cаром), 154.20 с (C=O), 161.79
чевина (4e). Получена аналогично соединению
с (3-Cаром). Масс-спектр, m/z (Iотн, %): 288 (3.0)
4a из 0.2 г соединения 2 и 0.145 г соединения 3e.
[М]+, 151 (15.5) [Ad-NH2]+, 135 (19.0) [Ad]+, 111
Выход 0.137 г (40%), т.пл. 147-148°C. Спектр ЯМР
(100) [C6H4FNH2]+. Найдено, %: С 70.79; Н 7.37; N
1Н (DMSO-d6), δ, м.д.: 1.60 т (6H, Ad, J 3.1 Гц),
9.70; F 6.63. C17H21FN2О. Вычислено, %: С 70.81;
1.85 д (6H, Ad, J 3.1 Гц), 2.04 c (3H, Ad), 6.02 с
Н 7.34; N 9.71; F 6.59. М 288.37.
(1H, NH-Ad), 7.02-7.05 м (2H, 3,5-Hаром), 7.18-
1-(Адамантан-1-ил)-3-(4-фторфенил) моче-
7.22 м (1H, 4-Hаром), 7.60 с (1H, NH). Спектр ЯМР
вина (4b). Получена аналогично соединению 4a
19F (DMSO-d6), δ, м.д.: -119.08 (2F, 2,6-F). Масс-
из 0.2 г соединения 2 и 0.125 г соединения 3b.
спектр, m/z (Iотн, %): 306 (0.5) [М]+, 151 (6.0) [Ad-
Выход 0.128 г (40%), т.пл. 199-200°C. Спектр ЯМР
NH2]+, 135 (53.15) [Ad]+, 129 (100) [C6H3F2NH2]+.
1Н (DMSO-d6), δ, м.д.: 1.58-2.02 м (15H, Ad), 5.79
Найдено, %: С 66.68; Н 6.54; N 9.10; F 12.43.
с (1H, NH-Ad), 7.01 т (2H, 3,5-Hаром, J 8.8 Гц), 7.33
C17H20F2N2О. Вычислено, %: С 66.65; Н 6.58; N
к (2H, 2,6-Hаром, J 5.0 Гц), 8.23 с (1H, NH). Спектр
9.14; F 12.40. М 306.36.
ЯМР 19F (DMSO-d6), δ, м.д.: -122.94. Масс-спектр,
1-(Адамантан-1-ил)-3-(3,4-дифторфенил) мо-
m/z (Iотн, %): 288 (1.6) [М]+, 151 (17.5) [Ad-NH2]+,
чевина (4f). Получена аналогично соединению
135 (17.7) [Ad]+, 111 (100) [C6H4FNH2]+. Найдено,
4a из 0.2 г соединения 2 и 0.145 г соединения 3f.
%: С 70.85; Н 7.38; N 9.67; F 6.57. C17H21FN2О.
Выход 0.276 г (80%), т.пл. 224-225°C. Спектр ЯМР
Вычислено, %: С 70.81; Н 7.34; N 9.71; F 6.59. М
1Н (DMSO-d6), δ, м.д.: 1.63 т (6H, Ad, J 2.8 Гц),
288.37.
1.92 д (6H, Ad, J 2.8 Гц), 2.02 с (3H, Ad), 5.93 с
1-(Адамантан-1-ил)-3-(3-хлорфенил) моче-
(1H, NH-Ad), 6.90-6.94 м (1H, 6-Hаром), 7.24 к (1H,
вина (4c). Получена аналогично соединению 4a
5-Hаром, J 9.2 Гц), 7.61 д.д.д (1H, 2-Hаром, J1 2.6, J2
из 0.5 г соединения 2 и 0.37 г соединения 3c в
7.5, J3 13.8 Гц), 8.49 с (1H, NH). Спектр ЯМР 13C
8 мл ДМФА и 0.5 мл Et3N. Выход 0.63 г (73%),
(DMSO-d6), δ, м.д.: 28.84 c (3C, Ad), 35.96 c (3C, Ad),
т.пл. 160-161°C. Спектр ЯМР 1Н (DMSO-d6), δ,
41.52 c (3C, Ad), 49.90 c (Adчетв), 105.97 д (2-Cаром,
м.д.: 1.61-1.94 м (12H, Ad), 2.02 c (3H, Ad), 5.93 с
J 22.6 Гц), 113.10 к (6-Cаром, J 3.8 Гц), 117.07 д
(1H, NH-Ad), 6.88-6.92 м (1H, 4-Hаром), 7.21 т (1H,
(5-Cаром, J 17.6 Гц), 137.78 д (1-Саром, J 8.8 Гц),
5-Hаром, J 8.0 Гц), 7.65 т (1H,, 6-Hаром J 2.0 Гц), 7.65
143.65 д (4-Cаром, J 237.6 Гц), 149.03 д (3-Cаром, J
с (1H, 2-Hаром), 8.45 с (1H, NH). Масс-спектр, m/z
242.7 Гц), 153.68 с (C=O). Спектр ЯМР 19F (DMSO-
(Iотн, %): 304 (1.2) [М]+, 135 (15.4) [Ad]+, 127 (100)
d6), δ, м.д.: -148.63 (4-F), -137.78 (3-F). Масс-
[C6H4ClNH2]+. Найдено, %: С 67.00; Н 6.96; N
спектр, m/z (Iотн, %): 306 (4.3) [М]+, 135 (35.8) [Ad]+,
9.15. C17H21ClN2О. Вычислено, %: С 66.99; Н 6.94;
129 (100) [C6H3F2NH2]+. Найдено, %: С 66.69; Н
N 9.19. М=304.82.
6.59; N 9.15; F 12.38. C17H20F2N2О. Вычислено, %:
С 66.65; Н 6.58; N 9.14; F 12.40. М 306.36.
1-(Адамантан-1-ил)-3-(2,4-дифторфенил) мо-
чевина (4d). Получена аналогично соединению
1-(Адамантан-1-ил)-3-(2-хлор-4-фторфенил)
4a из 0.2 г соединения 2 и 0.145 г соединения 3d.
мочевина (4g). Получена аналогично соедине-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН И ИХ ИЗОСТЕРИЧЕСКИХ АНАЛОГОВ
677
нию 4a из 0.2 г соединения 2 и 0.163 г соединения
(1H, NH-Ad), 7.02-7.06 м (1H, 5-Hаром), 7.18 т (1H,
3g. Выход 0.126 г (35%), т.пл. 219-220°C. Спектр
6-Hаром, J 9.1 Гц), 7.72 д.д (1H, 2-Hаром, J1 6.9, J2
ЯМР 1Н (DMSO-d6), δ, м.д.: 1.60 т (6H, Ad, J
2.5 Гц), 8.40 с (1H, NH). Спектр ЯМР 13C (DMSO-
3.1 Гц), 1.85 д (6H, Ad, J 3.1 Гц), 2.04 c (3H, Ad),
d6), δ, м.д.: 29.62 c (3C, Ad), 35.55 c (3C, Ad), 44.99
6.74 с (1H, NH-Ad), 7.07-7.12 м (1H, 5-Hаром), 7.36
c (3C, Ad), 50.49 c (Adчетв), 117.26 д (5-Cаром, J
д.д (1H, 6-Hаром, J1 8.5, J2 3.0 Гц), 7.86 с (1H, NH),
21.9 Гц), 117.82 д (3-Cаром, J 6.7 Гц), 118.88 с
8.10 д.д (1H, 3-Hаром, J1 9.3, J2 6.0 Гц). Спектр ЯМР
(6-Cаром), 119.50 д (2-Саром, J 17.1 Гц), 122.85 с
19F (DMSO-d6), δ, м.д.: -120.67. Масс-спектр, m/z
(1-Cаром), 138.46 с (4-Cаром), 154.23 с (C=O). Масс-
(Iотн, %): 322 (1.0) [М]+, 151 (25.7) [Ad-NH2]+, 145
спектр, m/z (Iотн, %): 322 (1.8) [М]+, 151 (60.5)
(100) [C6H3ClFNH2]+, 135 (30.9) [Ad]+. Найдено,
[Ad-NH2]+, 145 (100) [C6H3ClFNH2]+, 135 (50.6)
%: С 63.29; Н 6.28; N 8.65; F 5.86. C17H20ClFN2О.
[Ad]+. Найдено, %: С 63.20; Н 6.22; N 8.66; F 5.91.
Вычислено, %: С 63.25; Н 6.25; N 8.68; F 5.89. М
C17H20ClFN2О. Вычислено, %: С 63.25; Н 6.25; N
322.81.
8.68; F 5.89. М 322.81.
1-(Адамантан-1-ил)-3-(4-хлор-2-фторфенил)
ФОНДОВАЯ ПОДДЕРЖКА
мочевина (4h). Получена аналогично соединению
Работа выполнена при финансовой поддерж-
4a из 0.2 г соединения 2 и 0.163 г соединения 3h.
ке Российского научного фонда (грант № 19-73-
Выход 0.183 г (50%), т.пл. 231-232°C. Спектр ЯМР
10002).
1Н (DMSO-d6), δ, м.д.: 1.58-1.65 м (6H, Ad), 1.85
д (6H, Ad, J 2.6 Гц), 2.03 c (3H, Ad), 6.50 с (1H,
КОНФЛИКТ ИНТЕРЕСОВ
NH-Ad), 7.12 д (1H, 5-Hаром, J 9.0 Гц), 7.35 д.д (1H,
Авторы заявляют об отсутствие конфликта ин-
6-Hаром, J1 11.3, J2 2.4 Гц), 8.16 т (1H, 3-Hаром, J
тересов.
9.0 Гц), 8.23 д (1H, NH, J 2.4 Гц). Спектр ЯМР 19F
(DMSO-d6), δ, м.д.: -127.97 (1F). Масс-спектр, m/z
СПИСОК ЛИТЕРАТУРЫ
(Iотн, %): 322 (2.2) [М]+, 151 (8.2) [Ad-NH2]+, 145
1. Schmelzer K.R., Kubala L., Newman J.W., Kim I.H.,
(100) [C6H3ClFNH2]+, 135 (26.7) [Ad]+. Найдено,
Eiserich J.P., Hammock B.D. Proc. Natl. Acad.
%: С 63.24; Н 6.24; N 8.69; F 5.90. C17H20ClFN2О.
Sci. U.S.A.
2005,
102,
9772-9777. doi
10.1073/
Вычислено, %: С 63.25; Н 6.25; N 8.68; F 5.89. М
pnas.0503279102
322.81.
2. Fleming I., Rueben A., Popp R., Fisslthaler B.,
Schrodt S., Sander A., Haendeler J., Falck J.R.,
1-(Адамантан-1-ил)-3-(5-хлор-2-фторфенил)
Morisseau C., Hammock B.D., Busse R. Arterioscler.
мочевина (4i). Получена аналогично соединению
Thromb Vasc. Biol. 2007, 27, 2612-2618. doi 10.1161/
4a из 0.2 г соединения 2 и 0.163 г соединения 3i.
ATVBAHA.107.152074
Выход 0.126 г (35%), т.пл. 154-155°C. Спектр ЯМР
3. Imig J.D. Expert Opin. Drug Metab. Toxicol. 2008, 4,
1Н (DMSO-d6), δ, м.д.: 1.61 т (6H, Ad, J 3.1 Гц), 1.85
165-174. doi 10.1517/17425255.4.2.165
д (6H, Ad, J 2.9 Гц), 2.04 c (3H, Ad), 6.55 с (1H, NH-
4. Hwang S.H., Wecksler A.T., Zhang G., Morisseau C.,
Ad), 7.17-7.22 м (2H, 3,4-Hаром), 8.22-8.28 м (1H,
Nguyen L.V., Fu S.H., Hammock B.D. Bioorg. Med.
6-Hаром), 8.32 д (1H, NH, J 2.4 Гц). Спектр ЯМР 19F
Chem. Lett.
2013,
23,
3732-3737. doi
10.1016/
(DMSO-d6), δ, м.д.: -133.11 (1F). Масс-спектр, m/z
j.bmcl.2013.05.011
(Iотн, %): 322 (1.5) [М]+, 151 (62.9) [Ad-NH2]+, 145
5. Codony S., Valverde E., Leiva R., Brea J., Loza M.I.,
(100) [C6H3ClFNH2]+, 135 (57.2) [Ad]+. Найдено,
Morisseau C., Hammock B.D., Vázquez S. Bioorg. Med.
%: С 63.22; Н 6.26; N 8.72; F 5.92. C17H20ClFN2О.
Chem. 2019, 27, 1-9. doi 10.1016/j.bmc.2019.115078
Вычислено, %: С 63.25; Н 6.25; N 8.68; F 5.89. М
6. Burmistrov V., Morisseau C., Harris T.R., Butov G.,
322.81.
Hammock B.D. Bioorg. Chem. 2018, 76, 510-527. doi
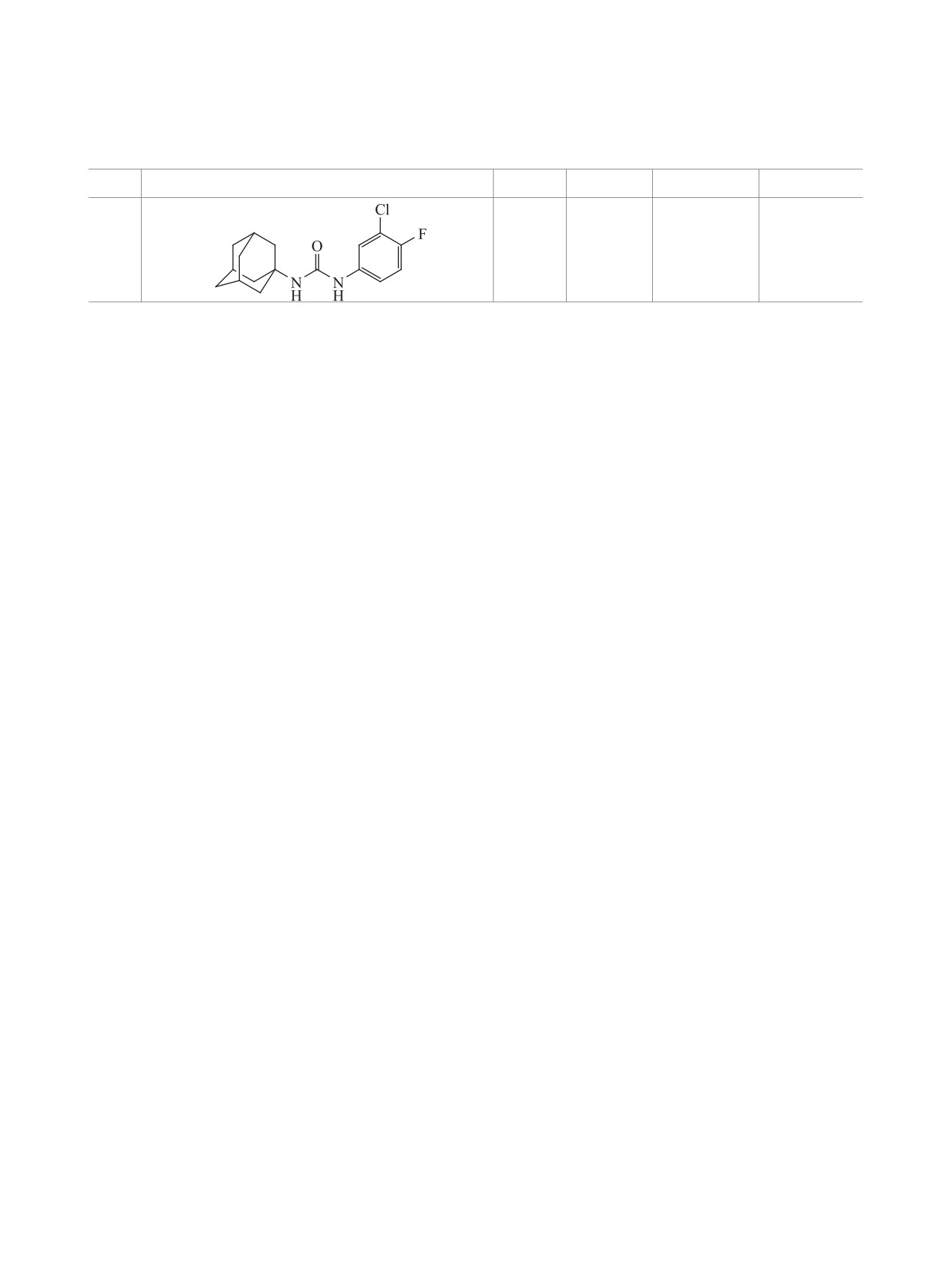
1-(Адамантан-1-ил)-3-(3-хлор-4-фторфенил)
10.1016/j.bioorg.2017.12.024
мочевина (4j). Получена аналогично соединению
7. Бутов Г.М., Бурмистров В.В., Данилов Д.В. Изв.
4a из 0.2 г соединения 2 и 0.17 г соединения 3j.
АН Сер. хим. 2017, 66, 1876-1880. [Butov G.M.,
Выход 0.184 г (50%), т.пл. 214-215°C. Спектр ЯМР
Burmistrov V.V., Danilov D.V. Russ. Chem. Bull. 2017,
1Н (DMSO-d6), δ, м.д.: 1.56-1.99 м (15H, Ad), 5.87 с
66, 1876-1880.] doi 10.1007/s11172-017-1961-y
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020
678
БУРМИСТРОВ и др.
8. Burmistrov V., Morisseau C., Pitushkin D., Karlov D.,
11. Бутов Г.М., Бурмистров В.В., Питушкин Д.А.
Fayzullin R.R., Butov G.M., Hammock B.D. Bioorg.
ЖОрХ. 2017, 53, 667-671. [Butov G.M., Burmist-
Med. Chem. Lett. 2018, 28, 2302-2313. doi 10.1016/
rov V.V., Pitushkin D.A. Russ. J. Org. Chem. 2017, 53,
j.bmcl.2018.05.024
673-678.] doi 10.1134/S1070428017050050
9. Burmistrov V., Morisseau C., D’yachenko V.,
12. Бурмистров В.В., Першин В.В., Бутов Г.М. Изв.
Rybakov V.B., Butov G.M., Hammock B.D. J.
ВолгГТУ. 2012, 5, 62-66.
Fluor. Chem.
2019,
220,
48-53. doi
10.1016/
13. Бурмистров В.В., Бутов Г.М. Изв. ВолгГТУ. 2013,
j.jfluchem.2019.02.005
19, 25-29.
10. Patil M., Noonikara-Poyil A., Joshi S.D., Patil S.A.,
Patil S.A., Bugarin A. Antibiotics. 2019, 8, 1-178. doi
14. Stetter H., Wullf C. Chem. Ber. 1962, 95, 2302-2304.
10.3390/antibiotics8040178
doi 10.1002/cber.19620950932
Synthesis and Properties of 1,3-Disubstituted Ureas
and its Isosteric Analogs Containing Polycyclic Fragments: I.
Synthesis of 1-(Adamantan-1-yl)-3-(fluoro, chlorophenyl) ureas
V. V. Burmistrova, b, D. V. Danilovb, V. S. D’yachenkoa, b, E. V. Rasskazovab, and G. M. Butova, b, *
a Volzhsky polytechnic institute (branch) VSTU, 404121, Russia, Volzhsky, ul. Engelsa 42a
*e-mail: butov@volpi.ru
b Volgograd state technical university, 400006, Russia, Volgograd, ul. Degtyareva 2
Received January 10, 2020; revised February 12, 2020; accepted February 13, 2020
Series of 1,3-disubstituted ureas with phenyl fragment containing fluorine and(or) chlorine atoms in various
positions of aromatic ring were synthesized with 33-80% yield. For the first time 1-isocyanatoadamantane was
prepared through the reaction of diphenylphosporyl azide with (adamantan-1-yl)carboxylic acid with 85% yield.
Keywords: adamantane, isocyanate, urea, fluorine, soluble epoxide hydrolase, sEH
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020