ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 5, с. 685-692
УДК 547.512:547.598
СИНТЕЗ И ПРЕВРАЩЕНИЯ АДДУКТА
1-ФЕНИЛТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА
С 2-БРОМЭТАНСУЛЬФОБРОМИДОМ
© 2020 г. С. Г. Кострюков*, Ю. Ю. Мастерова
ФГБОУ ВО «Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва»,
430005, Россия, Республика Мордовия, г. Саранск, ул. Большевистская 68
*e-mail: kostryukov_sg@mail.ru
Поступила в редакцию 05 декабря 2019 г.
После доработки 13 февраля 2020 г.
Принята к публикации 19 февраля 2020 г.
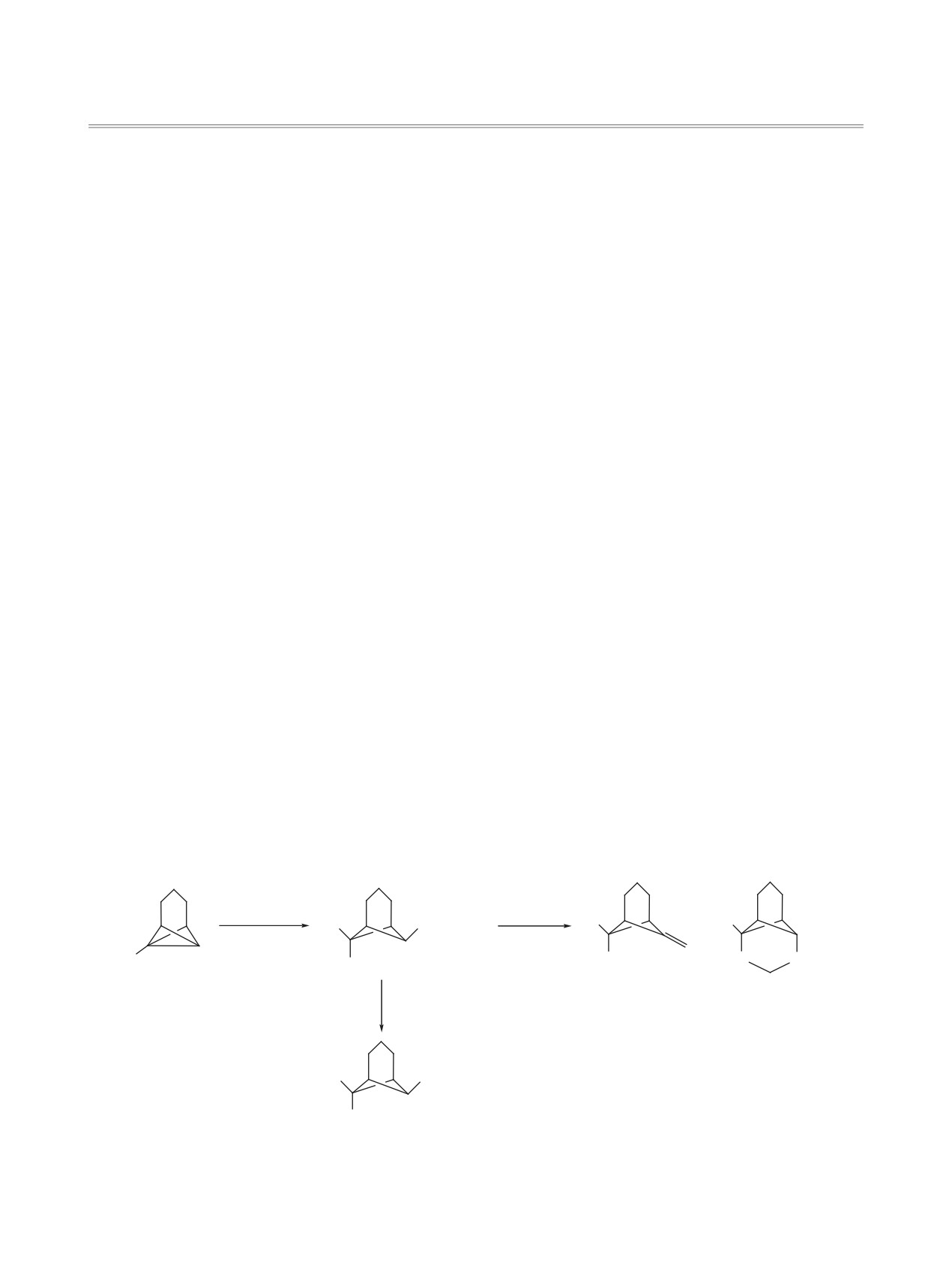
Присоединение 2-бромэтансульфобромида происходит по центральной связи С1-С7 1-фенилтри-
цикло[4.1.0.02,7]гептана с высокой анти-стереоселективностью с образованием аддуктов состава 1:1
норпинановой структуры. Исследовано действие некоторых оснований и нуклеофилов на продукт
анти-присоединения, при этом обнаружено, что в зависимости от условий наблюдается сольволиз,
1,2-дегидробромирование и, при избытке нуклеофила, последующее присоединение по двойной связи
винилсульфонильного фрагмента.
Ключевые слова: 2-бромэтансульфобромид, 1-фенилтрицикло[4.1.0.02,7]гептан, радикальное присое-
динение, бицикло[3.1.1]гептан, сольволиз, дегидробромирование.
DOI: 10.31857/S0514749220050043
α-Бромметансульфобромид присоединяется по
образом бромметансульфобромид реагирует и с
двойной связи алкенов с образованием α,β'-ди-
1-фенилтрицикло[4.1.0.02,7]гептаном
(1), анти-
бромсульфонов, способных при действии основа-
стереоселективно присоединяясь по связи С1-С7 с
ний подвергаться процессам дегидробромирова-
образованием в качестве единственного продукта
ния и десульфонирования, приводящим к образо-
экзо,син-изомера бицикло[3.1.1]гептановой (нор-
ванию сопряженных диенов [1-4]. Аналогичным
пинановой) структуры (схема 1) [5, 6].
Схема 1.
4
3
3
5
2
4
BrCH2SO2Br
2
6
1
5
Ph
Ph
Ph
SO2CH2BrNaOH
+
1
7
6
7
Ph
OH
O
SO2
Br
1
MeONa
MeOH
Ph
SO2CH2Br
OMe
685
686
КОСТРЮКОВ, МАСТЕРОВА
Схема 2.
Na2SO3
PBr5
Br CH
CH2
Br
Br CH2
CH
SO3Na
Br CH2
CH2
SO2Br
2
2
2
При обработке полученного аддукта метила-
присоединения реагента по связи С1-С7 трицикло-
том натрия происходит нуклеофильное замеще-
гептана 1 - соединений 3, 4 бицикло[3.1.1]гепта-
ние атома брома в положении 6 норпинанового
новой структуры в виде смеси 2 диастереомеров
остова молекулы. Под действием NaOH в водном
с преобладанием экзо,син-изомера 3 (схема
3).
диоксане протекает реакция Рамберга-Беклунда,
Соотношение изомеров 3 и 4 по данным спектра
которая приводит к производному 6-метиленби-
ЯМР 1Н реакционной смеси составило 95:5.
цикло[3.1.1]гептана, а также образуется про-
Продукт анти-присоединения 3 получен в ин-
дукт необычной гетероциклизации - 3-окса-2-
дивидуальном состоянии кристаллизацией, а про-
фенил-5-тиатрицикло[4.4.0.02,7]декан-S,S-диоксид
дукт син-присоединения 4 охарактеризован в реак-
(схема 1) [5, 6]. Таким образом, не вызывает сомне-
ционной смеси.
ний высокий синтетический потенциал галогенза-
мещенных бромангидридов алкансульфокислот
Строение, в том числе и конфигурацию суль-
как эффективных реагентов для введения галоге-
фонов 3, 4 определяли с помощью ЯМР 1Н и 13С
налкилсульфонильной группы с последующей её
спектроскопии. Так, бицикло[3.1.1]гептановая
трансформацией.
структура соединений 3, 4 подтверждается на-
личием в спектрах ЯМР 13С 5 пиков для 7 ато-
С целью расширения ассортимента галогенал-
мов углерода норпинанового остова c ожидае-
кансульфогалогенидов нами был синтезирован
мыми интенсивностью и химическими сдвига-
2-бромэтансульфобромид (2) и исследована его
ми. Отнесение конфигурации заместителей при
реакция с трициклогептаном 1.
проводили на основании анализа
атомах С6 и С7
Синтез соединения 2 (схема 2) осуществлен по
положения и мультиплетности сигналов атомов
методу, предложенному для получения иодметан-
Н7 в спектрах ЯМР 1Н с учётом известных струк-
сульфобромида и заключающемуся в обработке
турно-спектральных корреляций [8, 9]. Так, трип-
натриевой соли иодметансульфокислоты броми-
летный сигнал атома Н7 в соединениях 3, 4 ука-
дом фосфора(V) [4]. 2-Бромэтансульфонат натрия
зывает на анти-направленность этого протона по
получали реакцией избытка 1,2-дибромэтана с
отношению к триметиленовому мостику. Различие
сульфитом натрия [7].
в химических сдвигах атома Н7 для экзо,син- и
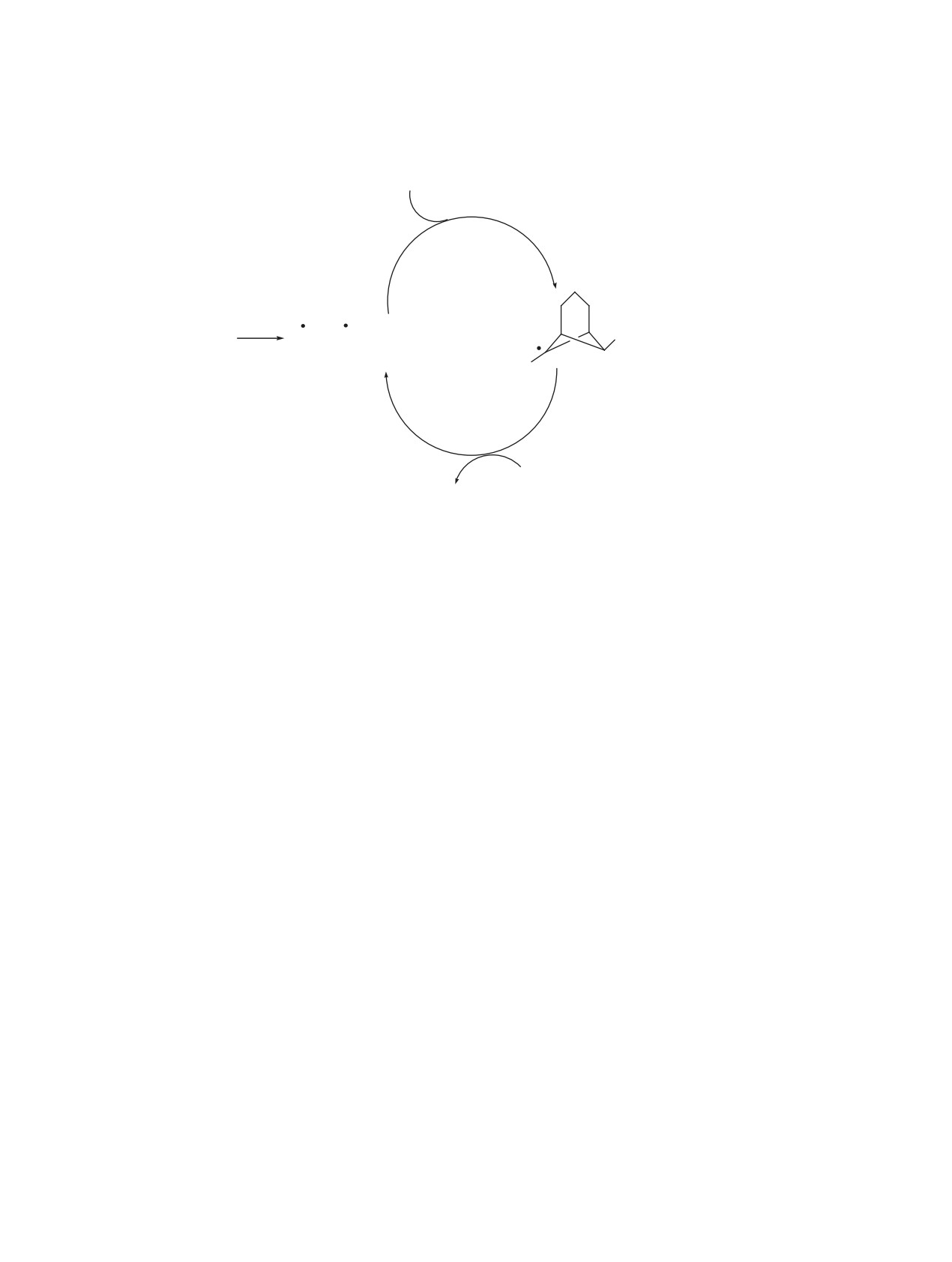
Реакцию трицикло[4.1.0.02,7]гептана 1 с суль-
эндо,син-изомеров составляет 1.1 м.д., при этом
фобромидом 2 проводили при простом смешении
в случае эндо,син-изомера 4 триплетный сигнал
реагентов в абсолютном CH2Cl2 при 0°С c добав-
атома Н7 находится в более сильном поле вслед-
лением безводного карбоната натрия, с последую-
ствие экранирующего влияния противостоящего
щим выдерживанием реакционной смеси на рассе-
бензольного кольца в положении 6. эндо-Ориента-
янном солнечном свете при комнатной температу-
ция фенильного заместителя в экзо,син-изомере 3
ре в течение 12 ч. При этом наблюдалось образова-
следует из наличия в спектре ЯМР 1Н сильнополь-
ние с высоким препаративным выходом продуктов
ного однопротонного сигнала атома эндо-Н3 (δ
Схема 3.
4
3
3
5
2
4
BrCH2CH2SO2Br (2)
2
6
Ph
1
5
SO
Br
Br
SO2CH2CH2Br
2CH2CH2
+
1
СH2Cl2
7
6
7
Ph
Ph
Br
1
3
4
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020
СИНТЕЗ И ПРЕВР
АЩЕНИЯ АДДУКТА 1-ФЕНИЛТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА
687
Схема 4.
1
hν
2
Br +
SO2CH2CH2Br
SO2CH2CH2Br
A
Ph
2
3, 4
0.60-0.90 м.д.), попадающего под экранирующее
которые были осуществлены на примере экзо,-
влияние бензольного кольца [6]. Наличие сульфо-
син-стереоизомера 3 (схема 5).
группы подтверждается интенсивными характе-
Нами было установлено, что соединение 3 под-
ристическими полосами в ИК спектрах в области
вергается гидролизу по бензильному атому бро-
~1130 и ~1330 см-1 [10].
ма при нагревании в водном ТГФ в присутствии
Таким образом, можно констатировать, что
NaНCO3. При этом гидролиз происходит с полным
присоединение 2-бромэтансульфобромида к три-
сохранением конфигурации и приводит к получе-
циклогептану 1, подобно присоединению бромме-
нию спирта 5. Также легко протекает и метанолиз
тансульфобромида [5] и арилсульфогалогенидов
сульфона 3 до метоксипроизводного 6. При дей-
[11, 12], осуществляется исключительно по цен-
ствии на соединения 5 и 6 триэтиламина наблюда-
тральной связи С1-С7. На основании аргументов,
ется 1,2-дегидробромирование, в результате кото-
обсуждаемых в работах [7-9, 11], для рассматри-
рого образуются соответствующие винилсульфо-
ваемой реакции следует принять радикальный ме-
ны 7 и 8.
ханизм (схема 4). При этом, как и в других слу-
Интересно отметить, что при кипячении ди-
чаях [7-9], реакция инициируется эндо-стерео-
бромида 3 в водно-диоксановом растворе NaOH
направленной атакой сульфонильного радикала.
наблюдали образование дигидроксипроизводного
Такая атака для 1-фенилтрицикло[4.1.0.02,7]геп-
9, а при обработке трёхкратным избытком мети-
тана (1) происходит региоспецифично по стери-
лата натрия при кипячении в метаноле в качестве
чески более доступному незамещенному атому
единственного продукта был получен сульфон 10.
С7. Последующая стадия переноса атома брома на
Также было показано, что двухатомный спирт 9
бицикло[3.1.1]гептильный интермедиат осущест-
образуется и при обработке водно-диоксановым
вляется преимущественно в экзо-положение из-за
раствором NaOH винилсульфона 7, в то время как
стерических затруднений для эндо-направленной
диметоксипроизводное 10 может быть получено
атаки на радикальный интермедиат А, создавае-
из винилсульфона 8 при действии на последний
мых триметиленовым мостиком.
метилата натрия в условиях кипячения в метано-
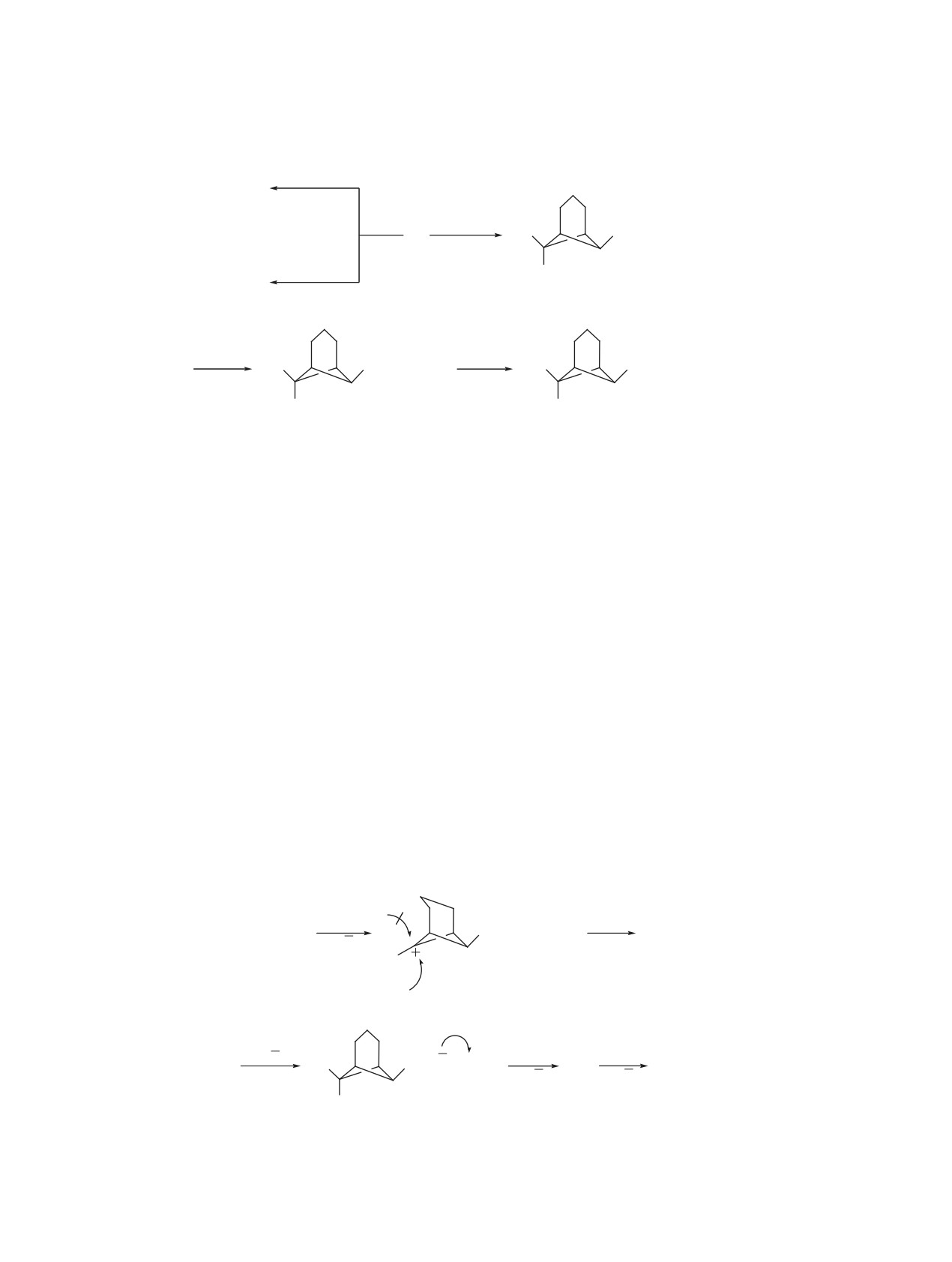
2-Бромэтилсульфонильный фрагмент в сульфо-
ле. Реализованные превращения аддукта 3 при
нах 3, 4 позволяет проводить при действии нукле-
действии оснований-нуклеофилов представлены
офилов и оснований различные трансформации,
на схеме 5.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020
688
КОСТРЮКОВ, МАСТЕРОВА
Схема 5.
NaOH
9
H2O
NuH
3
Ph
SO2CH2CH2Br
NaHCO3
MeONa
Nu
10
MeOН
5, 6
Et3N
NuNa
Ph
SO2CH=CH2
Ph
SO2CH2CH2Nu
NuH
Nu
Nu
7, 8
9, 10
Nu = OH (5, 7, 9), OMe (6, 8, 10).
Все сульфоны 5-10 получены в индивидуаль-
сульфонильном фрагменте на гидрокси- и меток-
ном состоянии и охарактеризованы ЯМР 1Н, 13С
сигруппы наблюдается значительное уменьшение
и ИК спектрами, а также данными элементного
вицинальных констант спин-спинового взаимо-
анализа. Отметим, что в спектрах ЯМР 1Н соеди-
действия 3JHH с 8.0 до 4.5 Гц, обусловленное боль-
нений 5-10 наблюдается сильнопольный однопро-
шей электроотрицательностью кислорода по срав-
тонный сигнал эндо-Н3, подтверждающий эндо-
нению с бромом [10].
ориентацию фенильного заместителя. Таким обра-
Предполагаем, что замещение бензильного ато-
зом, гидролиз и метанолиз аддукта 3 происходят с
ма брома в дибромиде 3 протекает через образова-
сохранением конфигурации реакционного центра.
ние карбкатиона B (схема 6), в котором имеются
Аналогично данным спектра ЯМР 1Н дибромида 3
обусловленные триметиленовым мостиком сте-
в спектрах ЯМР 1Н сульфонов 5-10 присутствуют
рические препятствия для подхода нуклеофила с
триплетные сигналы атомов Н7 с ожидаемыми хи-
эндо-направления.
мическими сдвигами. Наличие двойной связи в ви-
нилсульфонах 7, 8 подтверждается присутствием
Образование соединений 9 и 10 в реакциях ад-
в спектрах ЯМР 1Н характерных мультиплетных
дукта 3 с гидроксидом и метилатом натрия соот-
сигналов в области ~6.5-7.6 м.д. Примечательно,
ветственно можно объяснить как результат после-
что при замещении атома брома в 2-бромэтил-
довательно протекающих реакций нуклеофильно-
Схема 6.
NuH
3
SO2CH2CH2Br
5, 6
_Br
_
+
H
Ph
B
NuH
Nu
NuH
Ph
SO2CHCH2Br
_
7, 8
9, 10
NuH
_ Br
Nu
Nu
Nu = OH (5, 7, 9), OMe (6, 8, 10).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020
СИНТЕЗ И ПРЕВР
АЩЕНИЯ АДДУКТА 1-ФЕНИЛТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА
689
го замещения атома брома в положении C6 1,2-де-
более 1 мм рт.ст.), собирая фракцию при 80-90°С,
гидробромирования в 2-бромэтилсульфонильном
которую перегоняли повторно. Выход 17 г (67.5%),
фрагменте и нуклеофильного присоединения по
т.кип. 88-89°С (0.5 мм рт.ст.). ИК спектр, ν, см-1:
двойной связи образовавшегося винилсульфона.
2950 сл, 1364 с (асимм. SO2), 1153 о.с (симм. SO2).
Легкость протекания нуклеофильного присоеди-
Спектр ЯМР 1Н, δ, м.д.: 3.75 т (2H, J 8.0 Гц), 4.18
нения подтверждают реакции винилсульфонов 7 и
т (2H, J 7.9 Гц). Спектр ЯМР 13С, δ, м.д.: 21.7 (С2),
8 с гидроксидом и метилатом натрия, приводящие
48.7 (С1). Найдено, %: C 9.59; H 1.58. C2H4Br2O2S.
к соединениям 9 и 10 соответственно.
Вычислено, %: C 9.54; H 1.60.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реакция трициклогептана 1 с 2-бромэтан-
сульфобромидом (2). К раствору 1.73 г (10 ммоль)
Спектры ЯМР 1Н и 13С растворов соединений
трициклогептана 1 в 15 мл абсолютного CH2Cl2,
в CDCl3 записаны на спектрометре JEOL JNM-
содержащего 0.2 г безводного Na2CO3 и охлажден-
ECX400 (JEOL Ltd., Япония) (400 и 100 MГц со-
ного до 0°С, добавляли 2.52 г (10 ммоль) соедине-
ответственно). В качестве реперных точек при об-
ния 2. Реакционную смесь выдерживали в течение
работке спектров использованы сигналы остаточ-
1 ч при 0°С, а затем при комнатной температуре в
ных протонов (δ 7.26 м.д.) и углеродных атомов
течение 11 ч. Затем растворитель удаляли в вакуу-
(δ 77.16 м.д.) дейтерохлороформа. ИК спектры
ме, остаток анализировали методами ТСХ и ЯМР
получены в таблетках KBr на Фурье-спектрометре
1Н и 13С. Основной продукт 3 выделяли кристал-
ИнфраЛЮМ ФТ-02 (ООО «Люмэкс», Россия).
лизацией.
Элементные анализы выполнены на СHNS-
анализаторе Vario MICRO (Elementar, Германия).
6-экзо-Бром-7-син-(2-бромэтилсульфо-
Условия аналитической ТСХ: адсорбент - Silufol
нил)-6-эндо-фенилбицикло[3.1.1]гептан
(3).
UV-245, элюент - лёгкий петролейный эфир-ди-
Выход 3.15 г (74.6%), т.пл. 135-136°С (CH2Cl2-
этиловый эфир, 1:1, проявление в иодной камере
гексан). ИК спектр, ν, см-1: 2951 ср, 1489 ср, 1454
или УФ-светом. Температуру плавления соедине-
cр, 1331 с (асимм. SO2), 1280 с, 1207 ср, 1134 о.с
ний определяли в запаянных стеклянных капил-
(симм. SO2), 1111 с, 1060 ср, 744 с, 648 ср. Спектр
лярах с использованием анализатора точки плав-
ЯМР 1Н, δ, м.д.: 0.60-0.90 м (1Н, эндо-Н3), 1.45-
ления МР-50 (Mettler-Toledo, Швейцария).
1.59 м (1Н, экзо-Н3), 2.08-2.26 м (2Н, эндо-Н2,4),
В работе использовали коммерчески доступные
2.48-2.58 м (2Н, экзо-Н2,4), 3.55 т (2Н, CH2Br, J
реагенты: триэтиламин (≥ 99%), 1,2-дибромэтан
8.0 Гц), 3.65 уш.с (2Н, Н1,5), 3.74 т (2Н, CH2SO2,
(98%) и PBr5 (95%) производства «Sigma-Aldrich».
J 8.0 Гц), 4.63 т (1Н, анти-Н7, J 5.8 Гц), 7.28-7.43
Растворители предварительно очищали перегон-
м (5Наром). Спектр ЯМР 13С, δ, м.д.: 12.4 (С3), 20.6
кой.
(CH2Br), 23.5 (С2,4), 51.6 (С1,5), 57.2 (CH2SO2), 58.4
(С7), 70.2 (С6), 125.2 (СHаром), 128.2 (2СHаром),
1-Фенилтрицикло[4.1.0.02,7]гептан
(1)
[13] и
128.8 (2СHаром), 140.1 (Саром). Найдено, %: C 42.69;
2-бромэтансульфонат натрия [7] получены по ме-
H 4.31. C15H18Br2O2S. Вычислено, %: C 42.68; H
тодикам, представленным в литературе.
4.30.
2-Бромэтансульфобромид (2). В круглодон-
6-эндо-Бром-7-син-(2-бромэтилсульфонил)-
ную колбу ёмкостью 500 мл, снабжённую обрат-
6-экзо-фенилбицикло[3.1.1]гептан (4). Фрагмент
ным холодильником, помещали 21.1 г (0.1 моль)
спектра ЯМР 1Н, δ, м.д.: 3.12 уш.д (2Н, Н1,5),
2-бромэтансульфоната натрия, 51.7 г (0.12 моль)
3.43 т (2Н, CH2Br, J 8.0 Гц), 3.54 т (1Н, анти-
PBr5 и 150 мл абсолютного CH2Cl2. Реакционную
Н7, J 5.7 Гц),3.63 т (2Н, CH2SO2, J 8.0 Гц). Фраг-
смесь кипятили в течение 6 ч, после чего при на-
мент спектра ЯМР 13С, δ, м.д.: 12.8 (С3), 20.5
ружном охлаждении до 0°С в реакционную смесь
(CH2Br), 24.2 (С2,4),49.8 (С1,5), 57.1 (С7),
57.2
вносили примерно 250 г толченого льда. После
(CH2SO2), 68.9 (С6).
плавления льда отделяли органическую фазу, су-
шили CaCl2, растворитель удаляли в вакууме (10-
Гидролиз бициклогептана 3. В 20 мл смеси
20 мм рт.ст.), продукт перегоняли в вакууме (не
ТГФ-Н2О (2:1) растворяли 422 мг (1 ммоль) сое-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020
690
КОСТРЮКОВ, МАСТЕРОВА
динения 3, добавляли 200 мг NaHCO3 и кипятили
%: C 51.44; H 5.65. C16H21BrO3S. Вычислено, %: C
в течение 30 мин. Затем растворитель удаляли в
51.48; H 5.67.
вакууме, продукт извлекали CH2Cl2 (3×5 мл), орга-
Дегидробромирование соединений 5 и 6. К
нические вытяжки сушили MgSO4. Растворитель
раствору 1 ммоль одного из соединений 5 или 6
отгоняли на роторном испарителе и получали
в 10 мл абсолютного бензола добавляли 0.14 мл
твёрдый продукт 5, который очищали кристалли-
(1 ммоль) триэтиламина в 2 мл бензола. Реак-
зацией.
ционную смесь перемешивали в течение 1 ч при
7-син-(2-Бромэтилсульфонил)-6-экзо-гид-
0°С, выпавший осадок бромида триэтиламмония
рокси-6-эндо-фенилбицикло[3.1.1]гептан
(5).
отфильтровывали и промывали 10 мл бензола.
Выход 215 мг (59.9%), т.пл. 128-129°С (CH2Cl2-
Объединённый бензольный раствор промывали
гексан). ИК спектр, ν, см-1: 3441 ср, 2944 ср, 1643
водой (2×5 мл), сушили MgSO4. Растворитель от-
ср, 1454 cр, 1280 с (асимм. SO2), 1238 ср, 1207 ср,
гоняли на роторном испарителе и получали твёр-
1114 о.с (симм. SO2), 1084 с, 702 с, 648 ср. Спектр
дый продукт 7 или 8, который очищали кристал-
ЯМР 1Н, δ, м.д.: 0.65-0.89 м (1Н, эндо-Н3), 1.45-
лизацией.
1.59 м (1Н, экзо-Н3), 1.85-2.10 м (2Н, эндо-Н2,4),
7-син-Винилсульфонил-6-экзо-гидрок-
2.25 уш.с (1Н, ОН), 2.38-2.55 м (2Н, экзо-Н2,4),
си-6-эндо-фенилбицикло[3.1.1]гептан (7). Выход
3.45 уш.с (2Н, Н1,5), 3.56 т (2Н, CH2Br, J 8.0 Гц),
208 мг (57.9 %), т.пл. 101-102°С (CH2Cl2-гексан).
3.73 т (2Н, CH2SO2, J 8.0 Гц), 4.36 т (1Н, анти-Н7, J
ИК спектр, ν, см-1: 3443 ср, 2945 ср, 1652 ср, 1644
5.8 Гц), 7.25-7.42 (5Наром). Спектр ЯМР 13С, δ, м.д.:
ср, 1451 cр, 1330 с (асимм. SO2), 1278 с, 1240 ср,
13.1 (С3), 20.6 (CH2Br), 23.1 (С2,4), 47.6 (С1,5), 51.2
1209 ср, 1120 о.с (симм. SO2), 1084 с, 710 с, 651
(CH2SO2), 57.3 (С7), 81.8 (С6), 126.1 (СHаром), 128.4
ср. Спектр ЯМР 1Н, δ, м.д.: 0.64-0.88 м (1Н, эндо-
(2СHаром), 128.8 (2СHаром), 139.1 (Саром). Найдено,
Н3), 1.44-1.57 м (1Н, экзо-Н3), 1.85-2.10 м (2Н, эндо-
%: C 50.19; H 5.35. C15H19BrO3S. Вычислено, %: C
Н2,4), 2.24 уш.с (1Н, ОН), 2.33-2.51 м (2Н, экзо-
50.15; H 5.33.
Н2,4), 3.40 уш.с (2Н, Н1,5), 4.39 т (1Н, анти-Н7, J
Метанолиз бициклогептана 3. В 20 мл сухого
5.8 Гц), 6.56 д.д (1H, СН2=, J 10.7, 1.8 Гц), 7.11 д.д
метанола растворяли 422 мг (1 ммоль) соединения
(1H, СН2=, J 17.1, 1.8 Гц), 7.21-7.53 м (5Наром),
3, добавляли 200 мг NaHCO3 и кипятили в тече-
7.61 д.д (1H, SO2СН=, J 17.1, 10.7 Гц). Спектр
ние 30 мин. Затем растворитель удаляли в вакууме,
ЯМР 13С, δ, м.д.: 13.0 (С3), 23.2 (С2,4), 47.5 (С1,5),
продукт извлекали CH2Cl2 (3×5 мл), органические
57.2 (С7), 81.7 (С6), 126.3 (СHаром), 128.5 (2СHаром),
вытяжки сушили MgSO4. Растворитель отгоняли
128.7 (2СHаром), 131.2 (CH2=), 136.7 (Саром), 139.2
на роторном испарителе и получали твёрдый про-
(=CHSO2). Найдено, %: C 64.69; H 6.54. C15H18O3S.
дукт 6, который очищали кристаллизацией.
Вычислено, %: C 64.72; H 6.52.
7-син-(2-Бромэтилсульфонил)-6-экзо-меток-
7-син-Винилсульфонил-6-экзо-метокси-6-
си-6-эндо-фенилбицикло[3.1.1]гептан (6). Выход
эндо-фенилбицикло[3.1.1]гептан
(8).
Выход
224 мг (60.2%), т.пл. 116-117°С (CH2Cl2-гексан).
228 мг (61.3%), т.пл. 109-110°С (CH2Cl2-гексан).
ИК спектр, ν, см-1: 2949 ср, 2860 ср, 1642 ср, 1453
ИК спектр, ν, см-1: 2948 ср, 2881 ср, 1651 ср, 1643
cр, 1335 с (асимм. SO2), 1278 с, 1207 ср, 1123 о.с
ср, 1458 cр, 1335 с (асимм. SO2), 1277 с, 1219
(симм. SO2), 1095 с, 730 с, 650 ср. Спектр ЯМР 1Н,
ср, 1123 о.с (симм. SO2), 1093 с, 1051 ср, 730 с,
δ, м.д.: 0.62-0.89 м (1Н, эндо-Н3), 1.39-1.57 м (1Н,
650 ср. Спектр ЯМР 1Н, δ, м.д.: 0.63-0.90 м (1Н,
экзо-Н3), 1.85-2.06 м (2Н, эндо-Н2,4), 2.95 с (3Н,
эндо-Н3), 1.38-1.56 м (1Н, экзо-Н3), 1.84-2.03 м
CH3), 2.40-2.62 м (2Н, экзо-Н2,4), 3.55 т (2Н, CH2Br,
(2Н, эндо-Н2,4), 2.40-2.62 м (2Н, экзо-Н2,4), 2.94 с
J 8.0 Гц), 3.67 т (2Н, CH2SO2, J 8.0 Гц), 3.38 уш.с
(3Н, CH3), 3.42 уш.с (2Н, Н1,5), 4.35 т (1Н, анти-Н7,
(2Н, Н1,5), 4.33 т (1Н, анти-Н7, J 5.8 Гц), 7.15-7.40
J 5.8 Гц), 6.56 д.д (1H, СН2=, J 10.7, 1.8 Гц), 7.07
м (5Наром). Спектр ЯМР 13С, δ, м.д.: 13.9 (С3), 20.5
д.д (1H, СН2=, J 17.1, 1.8 Гц), 7.20-7.50 м (5Наром),
(CH2Br), 23.2 (С2,4), 46.1 (С1,5), 51.2 (CH2SO2), 50.8
7.60 д.д (1H, SO2СН=, J 17.1, 10.7 Гц). Спектр ЯМР
(СН3О), 57.6 (С7), 80.2 (С6), 126.8 (СHаром), 128.5
13С, δ, м.д.: 13.8 (С3), 22.9 (С2,4), 48.2 (С1,5), 50.7
(2СHаром), 128.6 (2СHаром), 136.7 (Саром). Найдено,
(СН3О), 56.9 (С7), 81.5 (С6), 126.4 (СHаром), 128.5
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020
СИНТЕЗ И ПРЕВР
АЩЕНИЯ АДДУКТА 1-ФЕНИЛТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА
691
(2СHаром),
128.7
(2СHаром), 131.2 (CH2=), 136.7
1084 с, 702 с. Спектр ЯМР 1Н, δ, м.д.: 0.66-0.93 м
(Саром), 139.1 (=CHSO2). Найдено, %: C 66.70; H
(1Н, эндо-Н3), 1.44-1.56 м (1Н, экзо-Н3), 1.91-2.12
6.85. C16H20O3S. Вычислено, %: C 65.73; H 6.89.
м (2Н, эндо-Н2,4), 2.47-2.63 м (2Н, экзо-Н2,4), 2.94
с (3Н, CH3), 3.08 с (3Н, CH3), 3.16 т (2Н, CH2SO2,
Реакция бициклогептана 3 с NaOH. К раство-
J 4.5 Гц), 3.31 уш. с (2Н, Н1,5), 4.01 т (2Н, CH2О,
ру 420 мг (1 ммоль) соединения 3 в 7 мл диокса-
J 4.5 Гц), 4.30 т (1Н, анти-Н7, J 5.8 Гц), 7.22-7.52
на добавляли 3 мл 1 M водного раствора NaOH.
м (5Наром). Спектр ЯМР 13С, δ, м.д.: 12.9 (С3), 23.2
Реакционную смесь кипятили при перемешивании
(С2,4), 47.0 (С1,5), 50.2 (СН3О), 51.7 (СН3О), 52.5
магнитной мешалкой в течение 2 ч, охлаждали,
(CH2SO2), 56.8 (С7), 60.1 (СН2О), 83.5 (С6), 126.3
продукт извлекали эфиром (3×5 мл). Эфирные вы-
(СHаром), 128.5 (2СHаром), 128.6 (2СHаром), 139.0
тяжки промывали водой (2×5 мл), сушили MgSO4.
(Саром). Найдено, %: C 62.97; H 7.47. C17H24O4S.
Растворитель отгоняли на роторном испарителе и
Вычислено, %: C 62.94; H 7.46.
получали твёрдый продукт 9, который очищали
кристаллизацией.
Реакция винилсульфона 7 с NaOH. К раство-
ру 139 мг (0.5 ммоль) соединения 3 в 5 мл диок-
6-экзо-Гидрокси-7-син-(2-гидроксиэтилсуль-
сана добавляли 1 мл 1 M водного раствора NaOH.
фонил)-6-эндо-фенилбицикло[3.1.1]гептан
(9).
Реакционную смесь кипятили при перемешивании
Выход 165 мг (55.6%), т.пл. 111-112°С (CH2Cl2-
магнитной мешалкой в течение 2 ч, охлаждали,
гексан). ИК спектр, ν, см-1: 3480 с, 3443 ср, 2943
продукт извлекали эфиром (3×5 мл). Эфирные вы-
ср, 1644 ср, 1454 cр, 1280 с (асимм. SO2), 1238 ср,
тяжки промывали водой (2×3 мл), сушили MgSO4.
1115 о.с (симм. SO2), 1084 с, 702 с. Спектр ЯМР
Растворитель отгоняли на роторном испарителе и
1Н, δ, м.д.: 0.66-0.92 м (1Н, эндо-Н3), 1.45-1.58
получали твёрдый продукт 9, который очищали
м (1Н, экзо-Н3), 1.90-2.10 м (2Н, эндо-Н2,4), 2.31
кристаллизацией.
уш.с (1Н, ОН), 2.46-2.61 м (2Н, экзо-Н2,4), 3.17 т
6-экзо-Гидрокси-7-син-(2-гидроксиэтилсуль-
(2Н, CH2SO2, J 4.5 Гц), 3.25уш.с (2Н, Н1,5), 3.42
фонил)-6-эндо-фенилбицикло[3.1.1]гептан
(9).
уш.с (1Н, ОН), 4.05 т (2Н, CH2О, J 4.5 Гц), 4.36
Выход 82 мг (55.3%).
т (1Н, анти-Н7, J 5.8 Гц), 7.22-7.52 м (5Наром).
Спектр ЯМР 13С, δ, м.д.: 13.1 (С3), 23.3 (С2,4),
Реакция винилсульфона 7 с MeONa. К рас-
47.5 (С1,5), 52.4 (CH2SO2), 56.7 (С7), 60.7 (СН2О),
твору 139 мг (0.5 ммоль) соединения 3 в 5 мл аб-
84.6 (С6), 126.3 (СHаром), 128.5 (2СHаром), 128.7
солютного метанола добавляли 1 мл 1 M раствора
(2СHаром), 138.8 (Саром). Найдено, %: C 60.75; H
метилата натрия в метаноле. Реакционную смесь
6.81. C15H20O4S. Вычислено, %: C 60.79; H 6.80.
кипятили при перемешивании магнитной мешал-
кой в течение 2 ч, затем метанол удаляли в вакуу-
Реакция бициклогептана 3 с MeONa. К рас-
ме, остаток растворяли в 10 мл CH2Cl2 и промыва-
твору 420 мг (1 ммоль) соединения 3 в 10 мл аб-
ли водой (2×3 мл), сушили MgSO4. Растворитель
солютного метанола добавляли 3 мл 1 M раствора
отгоняли на роторном испарителе и получали кри-
метилата натрия в метаноле. Реакционную смесь
сталлический продукт 10, который очищали кри-
кипятили при перемешивании магнитной мешал-
сталлизацией.
кой в течение 2 ч, затем метанол удаляли в вакуу-
ме, остаток растворяли в 15 мл CH2Cl2 и промыва-
6-экзо-Метокси-7-син-(2-метоксиэтилсуль-
ли водой (2×5 мл), сушили MgSO4. Растворитель
фонил)-6-эндо-фенилбицикло[3.1.1]гептан (10).
отгоняли на роторном испарителе и получали
Выход 96 мг (59.2%).
твёрдый продукт 10, который очищали кристалли-
КОНФЛИКТ ИНТЕРЕСОВ
зацией.
Авторы заявляют об отсутствии конфликта ин-
6-экзо-Метокси-7-син-(2-метоксиэтилсуль-
тересов.
фонил)-6-эндо-фенилбицикло[3.1.1]гептан (10).
СПИСОК ЛИТЕРАТУРЫ
Выход 191 мг (58.9%), т.пл. 148-149°С (CH2Cl2-
гексан). ИК спектр, ν, см-1: 2945 с, 1645 ср, 1450 cр,
1. Block E., Aslam M. J. Am. Chem. Soc. 1983, 105,
1286 с (асимм. SO2), 1236 ср, 1119 о.с (симм. SO2),
6164-6165. doi 10.1021/ja00357a040
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020
692
КОСТРЮКОВ, МАСТЕРОВА
2. Block E., Aslam M., Eswarakrishnan V., Wall A. J. Am.
9. Васин В.А., Кострюков С.Г., Разин В.В., Зефи-
Chem. Soc. 1983, 105, 6165-6167. doi 10.1021/
ров Н.С. ЖОрХ. 1994, 30, 680-685. [Vasin V.A.,
ja00357a041
Kostryukov S.G., Razin V.V., Zefirov N.S. Zh. Org.
3. Block E., Eswarakrishnan V., Gebreyes K. Tetrahedron
Khim. 1994, 30, 680-685.]
Lett.
1984,
25,
5469-5472. doi
10.1016/s0040-
10. Сильверстейн Р., Вебстер Ф., Кимл Д. Спектрофо-
4039(01)81601-4
тометрическая идентификация органических сое-
4. Block E., Aslam M., Eswarakrishnan V., Gebreyes K.,
динений. М.: БИНОМ. Лаборатория знаний, 2012,
Hutchinson J., Iyer R., Laffitte J.A., Wall A. J. Am.
557.
[Silverstein R.M., Webster F.X., Kiemle D.J.
Chem. Soc. 1986, 108, 4568-4580. doi 10.1021/
Spectrometric Identification of Organic Compounds.
ja00275a051
7th Ed. N.-Y.: J. Wiley & Sons Inc., 2005.]
5. Vasin V.A., Romanova E.V., Kostryukov S.G.,
11. Васин В.А., Кострюков С.Г., Разин В.В., Болуше-
Razin V.V. Mendeleev Commun. 1998, 8, 122-125.
ва И.Ю., Зефиров Н.С. ЖОрХ. 1994, 30, 1351-1359.
doi 10.1070/MC1998v008n03ABEH000913
[Vasin V.A., Kostryukov S.G., Razin V.V., Bolushe-
6. Васин В.А., Романова Э.В., Кострюков С.Г., Ра-
va I.Yu., Zefirov N.S. Zh. Org. Khim. 1994, 30, 1351-
зин В.В. ЖОрХ. 1999, 35, 1189-1195. [Vasin V.A.,
1359.]
Romanova E.V., Kostryukov S.G., Razin V.V. Russ. J.
12. Васин В.А., Кострюков С.Г., Разин В.В. ЖОрХ.
Org. Chem. 1999, 35, 1161-1167.]
1996,
32,
59-64.
[Vasin V.A., Kostryukov S.G.,
7. Синт. орг. преп. 1949, 2, 124.
Razin V.V. Russ. J. Org. Chem. 1996, 32, 49-54.]
8. Васин В.А., Болушева И.Ю., Черняева Л.А., Сур-
13. Разин В.В., Задонская Н.Ю., Шамурзаев Х.Т.
мина Л.С. ЖОрХ. 1990, 26, 1509-1515. [Vasin V.A.,
ЖОрХ. 1991, 27, 1253-1260. [Razin V.V., Zadons-
Bolusheva I.Yu., Chernyaeva L.A., Surmina L.S. Zh.
kaya N.Yu., Shamurzaev K.T. Zh. Org. Khim. 1991, 27,
Org. Khim. 1990, 26, 1509-1515.]
1253-1260.]
Synthesis and Transformations of the Adduct
of 1-Phenyltricyclo[4.1.0.02,7]heptane
with 2-Bromoethanesulfonyl Bromide
S. G. Kostryukov* and Yu. Yu. Masterova
National Research Ogarev Mordovia State University,
430005, Russia, Republic of Mordovia, Saransk, ul. Bolshevistskaya 68
*e-mail: kostryukov_sg@mail.ru
Received December 5, 2019; revised February 13, 2020; accepted February 19, 2020
The addition of 2-bromoethanesulfonyl bromide to the central C1-C7 bond of 1-phenyltricyclo[4.1.0.02,7]-
heptane proceeds highly anti-stereoselectively with the formation of 1: 1 adducts with norpinic structure. The
action of certain bases and nucleophiles on the product of anti-addition was studied. It was found that the adduct
undergoes solvolysis, 1,2-dehydrobromination, and subsequent addition of an excess of the nucleophile to the
double bond of the vinylsulfonyl moiety depending on the reaction conditions.
Keywords: 2-bromoethanesulfonyl bromide, 1-phenyltricyclo[4.1.0.02,7]heptane, radical addition, bicyclo[3.1.1]-
heptane, solvolysis, dehydrobromination
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 5 2020