ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 6, с. 829-858
ОБЗОРНАЯ СТАТЬЯ
УДК 547.442.3
2-АЦИЛЦИКЛОАЛКАНОНЫ
В ОРГАНИЧЕСКОМ СИНТЕЗЕ
© 2020 г. В. Д. Дяченкоa, *, С. М. Сукачa, А. С. Морковникb
a Луганский национальный университет им. Тараса Шевченко, 91011, Украина, г. Луганск, ул. Оборонная 2
*е-mail: dyachvd@mail.ru
b Научно-исследовательский институт физической и органической химии
ФГАОУ ВО «Южного федерального университета»,
344090, Россия, г. Ростов-на-Дону, пр. Стачки 194/2
Поступила в редакцию 07 января 2020 г.
После доработки 21 января 2020 г.
Принята к публикации 26 января 2020 г.
Систематизированы литературные данные по использованию 2-ацилциклоалканонов в органическом
синтезе. Материал классифицирован по типу образования продуктов реакции.
Ключевые слова: 2-ацилциклоалканоны, енамины, азотсодержащие гетероциклы, пиран, фуран, 1,4-ди-
азепин, спироциклизации.
DOI: 10.31857/S0514749220060014
СОДЕРЖАНИЕ
Введение………………………………………………………………………………………………………..830
1. Реакции, 2-ацилциклоалканонов, не относящиеся к гетероциклизациям…………………………....830
1.1. Реакции по мезо-положению 1,3-дикарбонильной системы…………………….………………...830
1.2. Реакции с электрофильной атакой, затрагивающей О-атом экзоциклической или эндоциклической
карбонильной групп……………………….…………….……………………………………………834
1.3. Превращение в енамины…………………………………………………………………………
835
2. Реакции, приводящие к замыканию азотсодержащих гетероциклов…………………..………………837
2.1. Получение производных индола, индолина и индолона…………….………..…………………837
2.2. Получение пиразолов и оксазолов………………………………………………………………….838
2.3. Формирование пиридинового цикла посредством циклизаций с участием аминов, иминов и
метиленактивных тиоамидов………………………………..………………………………………842
2.4. Формирование пиримидинового цикла…………………………………………………………….845
2.5. Формирование пиранового и фуранового кольца……………………………..……………………846
2.6. Формирование 1,4-диазепинового цикла……………………………………….…………………847
2.7. Спироциклизации………………………………………………………………….…………………848
3. Прямая внутримолекулярная циклизация 1,3-дикарбонильных соединений………….………………848
4. Реакции, ведущие к образованию в циклическом фрагменте непредельных связей или к его аромати-
зации…………………………………………………………………….……………………………………849
5. Реакции с раскрытием цикла или изменением его размерности………………………………………850
Выводы……………………………………………………………………………...………………………..852
829
830
ДЯЧЕНКО и др.
ВВЕДЕНИЕ
1) Присоединение по активированной кратной
связи реагента.
2-Ацилциклоалканоны, как простые, так и
функционализированные, благодаря наличию в
2) С-Алкилирование.
них, по крайней мере, двух реакционноспособных
3) Галогенирование.
центров обладают высокой химической активно-
стью. При наличии дополнительной функциональ-
4) Другие реакции.
ной группы во всех реакциях этих соединений, за
К реакциям первого типа относится, например,
исключением внутримолекулярной циклизации
присоединение 2-этокси(метокси)карбонилцикло-
и дегидратации, участвует именно 1,3-дикарбо-
гексанона 1 к бут-3-ен-2-ону 2, являющееся прев-
нильный фрагмент. Как и ациклические 1,3-ди-
ращением Михаэлевского типа, которое протека-
карбонильные соединения 2-ацилциклоалканоны
ет весьма легко, уже при комнатной температуре
в реакциях с различными бинуклеофильными
[2-7], либо при умеренном нагревании [6] в подхо-
реагентами часто демонстрируют выраженную
дящем растворителе, или без него. Интересно, что
склонность к реакциям гетероциклизации, что де-
для этой реакции вместо обычных оснований час-
лает их весьма перспективными синтонами в хи-
то используют более сложные катализаторы, та-
мии различных гетероциклов. Эти и другие свой-
кие как соединения палладия (II) [8], иттербия (III)
ства 2-ацилциклоалканонов, собственно, и будут
[9-11], (III) [12], циркония [13], лантана [14], же-
рассмотрены нами ниже. Данная работа выполне-
леза (III) [15-17], меди (II) [18], серебра [19], неко-
на с учетом отсутствия современных обзоров по
торые полимерные соединения [20, 21]. Наиболее
химии этих дикетонов и их производных. Отчасти,
эффективными из них в этой реакции, являются
причем, лишь косвенно, проблема, впрочем, была
соединения иттербия (III), обеспечивающие прак-
затронута в работе [1]. Настоящий обзор включа-
тически количественное (до 99%) образование
ет в основном литературу, опубликованную после
трикарбонильных соединений 3. Показано, что
2000 года.
аналогично реагируют и производные дикетонов
1. РЕАКЦИИ 2-АЦИЛЦИКЛОАЛКАНОНОВ, НЕ
1, дополнительно замещенные по циклогексаново-
ОТНОСЯЩИЕСЯ К ГЕТЕРОЦИКЛИЗАЦИЯМ
му циклу [22] (схема 1).
1.1. РЕАКЦИИ ПО МЕЗО-ПОЛОЖЕНИЮ
Эффективными непредельными реагентами
1,3-ДИКАРБОНИЛЬНОЙ СИСТЕМЫ
для 2-ацилциклоалканонов могут служить и нит-
роолефины, что было показано в работе [23] на
Эти реакции, обычно протекающие, как можно
примере энантио- и диастереоселективной реак-
полагать, через образование енолят-аниона, яви-
ции метил 2-оксоциклопентанкарбоксилата 6 с ни-
лись предметом многочисленных исследований,
тростиролом 7, приводящей к нитропроизводному
что в значительной мере связано с ценностью их
8 (схема 2).
продуктов как исходных соединений для проведе-
ния дальнейших гетероциклизаций. Данные пре-
Другим показательным примером реакций при-
вращения по результату могут быть подразделены
соединения по кратным связям непредельных ре-
на следующие типы:
агентов является показанная на нижеприведенной
Схема 1.
O
O
O
O
O
Cat
R
+
R
O
1
2
3
R = OMe, OEt.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
831
Схема 2.
O
O
O Ph
NO2
NO2
OMe + Ph
CO2Me
4
5
6, 94%
схеме реакция метил 2-оксоиндан-1-карбоксилата
По-разному протекает реакция замещенных
7 с малеинимидами 8, с помощью которой были
2,4-диацетил-5-гидрокси-5-метилциклогексано-
получены сукцинимиды 9. Отметим, что в этом
нов 18 с фармальдегидом и аминами. Так, при на-
случае реакция проводилась в режиме катализа
гревании реагентов в присутствии K2CO3 образу-
природными основаниями - хинином или хиниди-
ется производное 19, а при кипячении - бицикл 20,
ном [24] (схема 3).
проявляющий анальгетические свойства. Такой же
результат дает и реакция, проводимая при микро-
Не меняется ход реакции и при использовании
волновом облучении [29] (схема 6).
альдиминов [25], а также алкинов [26, 27]. Такой
При структурной модификации дикарбониль-
подход был использован для синтеза из 1,3-дике-
ных соединений за счет подобного типа реак-
тона 10 соединений 11 и 12, для которого в каче-
ций с введением подходящих заместителей воз-
стве реагентов были использованы соединения 13
можна дальнейшая гетероциклизация аддуктов.
и 14 соответственно (схема 4).
Примером может служить внутримолекулярная
Аналогичные превращения, как было показа-
циклизация продукта присоединения 2-(этокси-
но на примере 2-бензоилциклогексанона 15 могут
карбонил)циклопентанона 4 к 2-бромпропеноату
идти и с азодикарбоксилатами 16. В этом случае
21 в присутствии диэтиламино(триметил)силана,
катализатором служит комплекс Сu2+ и образуется
метил 2-бром-3-[1-(этоксикарбонил)-2-оксоцикло-
гидразиновый аддукт 17 [28] (схема 5).
пентил]пропаноата 22, катализируемая 1,8-диазо-
Схема 3.
R
O
COOMe
N
O
O
+
N R
O
COOMe
O
O
7
8
9, 45-95%
R = H, Ph, t-Bu, Bn.
Схема 4.
Boc
N
Boc
O
O
O
O
NH
O
Ph
D
Ph
Et
13
14
O
R
Ph
MeO2C
D
Ph
11, 86%
10
12, 81%
R = Me, Et.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
832
ДЯЧЕНКО и др.
Схема 5.
O O
O
O
RO2C
N
Ph
Ph
+
N
NCO2R
CO2R
NHCO2R
15
16
17, 54-87%
R = Bn, Et.
Схема 6.
R2
H
O
O
N
N
R1
O
O
O
O
HCHO, H2N R2
HCHO,
H2N R1
K2CO3, reflux
D/K2CO3
HO
HO
HO
O
X
O
X
O
X
20, 60-90%
18
19, 60-90%
R1 = первичный амин; R2 = C3H7, C6H7; X = H, Cl, OCH3, NO2, CH3.
бицикло[5.4.0]ундек-7-еном и приводящая к об-
щем растворителе в основной среде, необходимой
разованию производного циклопента[b]фурана 23
для предварительного генерирования из субстра-
[30]. Аналогичная реакция протекает с цикличе-
тов С-анионов, приводит к С-алкилированию (бен-
скими аналогами соединений 21 [31] и с бицикли-
зилированию) по α-углеродному атому 1,3-дикар-
ческим 1,3-дикарбонильными соединениями типа
бонильной системы с образованием продуктов 28
4 [32] (схема 7).
[35-54] (схема 9).
Под действием определенных факторов воз-
Введение аллильного фрагмента в молекулу
можна внутримолекулярная свободнорадикальная
2-оксоциклогексанкарбоксилата 1 возможно при
циклизация замещенных
2-ацилциклогексано-
взаимодействии его с аллилацетатом 29. Реакция,
нов 24 в положение 2 с образованием бицикли-
приводящая к образованию аллилпроизводного
ческого продукта 25. Данная реакция использу-
30, протекает в толуоле и требует присутствия
ется в синтезе noncytotoxic against L1210 murine
палладиевого катализатора [55] (схема 10).
leukemia [33]. Дальнейшее окисление приводит к
Те же методы используются для введения ал-
(±)-Yezo’otogirin C 26, обладающего противоопу-
кильных, аллильных и бензильных заместителей в
холевой активностью [34] (схема 8).
α-положение циклических 1,3-дикетонов по отно-
Взаимодействие 1,3-дикетонов типа 1 с гало-
шению к циклической карбонильной группе при
геналканами и бензилгалогенидами 27 в подходя-
иной чем в соединениях 1 размерности карбоцик-
Схема 7.
O
O
COOMe
COOMe
Br
COOMe
COOMe
OMe +
COOMe
Br
O
O
4
21
22
23, 86%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
833
Схема 8.
R1
O
R1
R1
O
O
O
COR2
R2
O
R2
24
25
26, 92%
R1 = Ph, Me; R2 = OMe, i-Pr, s-Bu.
Схема 9.
O O
O O
Base
R1
+
R1
R2
Hal
R2
1
27
28, 82-100%
R1 = OEt, Me; R2 = Ar, винил, Н, I, Br; Hal = Cl, Br, I.
ла [56], а также циклических 1,3-дикетонов, кон-
азоний-4-фтор-1-хлорометилбицикло[2,2,2]ок-
денсированных с бензольным ядром [57].
тан бис(тетрафторборат)] или AccufluorTM NFSi
(N-фторобензосульфонимид), реагирующих в от-
По тому же самому наиболее реакционно-
сутствие растворителя [67, 68].
способному положению рассматриваемых ди-
карбонильных соединений 1 может быть про-
Рассматриваемые дикарбонильные соединения
ведено и галогенирование. Эффективными ре-
могут подвергаться не только гетеролитической,
но и свободнорадикальной по своему механизму
агентами для такого галогенирования являются
гетероциклизации под действием в качестве источ-
N-галогенсукцинимиды 31. Реакция заканчивает-
ника радикалов систем, содержащих подходящий
ся образованием хлор-, бром- и иодпроизводных
по строению фенол и окислитель. Примером мо-
α-ацилциклогексанонов 32 [58-66]. Наибольший
жет служить циклизация этил-2-оксоциклогек-
выход характерен для бром- (98%) и хлорпроиз-
санкарбоксилата 1 с β-нафтолом 33 в присутствии
водных (95%), наименьший - для иодпроизводных
хлорида железа (III) в подходящем растворителе
(72%) [58] (схема 11).
или без него при нагревании до 70°С, продуктом
Для введения атома фтора требуется исполь-
которой с выходом 35-97% (в зависимости от ус-
зование таких специфических фторирующих
ловий) является тетрациклическое производное с
агентов, как SelectfluorTM F-TEDA-BF4 [1,4-ди-
фурановым циклом 34 [69] (схема 12).
Схема 10.
O O
O O
O
Et
Et
+
O
1
29
30, 86%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
834
ДЯЧЕНКО и др.
Схема 11.
при действии арилбороновых кислот 38 дает био-
Hlg
логически активные С-арилпроизводные 39, явля-
ющиеся ингибиторами транспортеров дофамина
O N
O
O O
O O
человека (hDAT) [71] (схема 13).
31
Образование О-замещенных производных, но в
R
R
более сложном варианте, характерно и для реак-
Hlg
ции этилового эфира циклогексанон-2-карбоновой
1
32
кислоты 1 с триметилхлорсиланом 40. При нор-
мальных условиях в бензоле при катализе триэти-
R = OEt, Me; Hlg = Cl, Br, I.
ламином реакция идет по циклической CO-группе
1.2. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНОЙ АТАКОЙ,
так, что образуeтся О-триметилсилилпроизводное
ЗАТРАГИВАЮЩЕЙ О-АТОМ
41. В тетрагидрофуране же при 40°С атакуются
ЭКЗОЦИКЛИЧЕСКОЙ ИЛИ
оба карбонильных кислорода и получается смесь
ЭНДОЦИКЛИЧЕСКОЙ КАРБОНИЛЬНОЙ
изомерных продуктов бис-О-триметилсилилиро-
ГРУПП
вания 42 и 43, различающихся положением двух
сопряженных С=С связей, в соотношении 4:1 с об-
Для 2-ацилциклогексанонов в принципе воз-
щим выходом 93% [72] (схема 14).
можны реакции с электрофильной атакой по лю-
бой из двух имеющихся карбонильных групп, хотя
По-иному протекает реакция 2-ацетилцикло-
в целом они менее характерны, чем протекающие
пентанондикетона 44 с трифенилфосфаном 45, ре-
по атому α-углерода.
зультатом которой является замена экзоцикличе-
ской ОН-группы енольной формы на атом хлора и
Реакции по циклической CO-группе протека-
образование смеси (E)- и (Z)-β-хлоровинилкетонов
ют в разных условиях. Так, например, реакция
46 и 47 с общим выходом 72-78% [73] (схема 15).
2-ацилциклогексанона
35 с трифторметансуль-
фоангидридом 36 протекает в диэтиловом эфире
При нагревании дикетона 48 в присутствии со-
в присутствии гидрида натрия в атмосфере азота
единений рутения (ІІ) возможно восстановление
при температуре 0°С [70]. По всей вероятности,
одной или обеих кетогрупп до образования спир-
реакция начинается с электрофильной атаки либо
тов 49 и 50 соответственно. Реакция является сте-
непосредственно дикарбонильного соединения,
реоселективной и протекает с высокими выходами
либо его енольной формы. Продукт реакции 37
продуктов - около 99% [74] (схема 16).
Схема 12.
O O
O
FeCl3
HO
OEt
+
HO
CO2Et
1
33
34, 35-97%
Схема 13.
O
O
O
Tf2O
ArB(OH)2
36
38
O
OTf
Ar
35
37
39
Tf = CF3SO3.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
835
Схема 14.
Me3SiO
Me3SiO
Me3SiCl, 40°C
40
O
O
OSiMe3
+
OSiMe
3
OEt
42
43
Me3SiCl, 20°C
40
Me3SiO
O
1
41, 89%
Схема 15.
O O
O
O Cl
+
PPh3·CHCl3
Cl
+
44
45
46
47
Перекисное окисление
2-ацетилциклопента-
ет способностью к последующей гетероциклиза-
нона 44 приводит к образованию промежуточных
ции под действием соответствующих реагентов
продуктов 51 и 52 и заканчивается формированием
с образованием нового азотистого гетероцикла.
бицикличесой системы гексагидро-3-метилцикло-
Чаще всего первичной атаке подвергается
пента[с][1,2]диоксол-3,6а-диола 53 [75] (схема 17).
циклическая кетогруппа, которая может происхо-
1.3. ПРЕВРАЩЕНИЕ В ЕНАМИНЫ
дить в самых различных условиях. Одним из приме-
ров реакций с такой атакой может служить взаимо-
Наиболее распространенной и изученной реак-
цией 2-ацилциклоалканонов с одной экзоцикличе-
действие этилового эфира циклогексанон-2-карбо-
ской группой является взаимодействие с аминами,
новой кислоты 1 с газообразным аммиаком при его
при котором атаке может подвергаться любая из
пропускании через реакционную смесь при 50°С,
двух карбонильных групп. Обычно продукт пер-
которое дает енамин 54. Он с успехом может быть
воначального аминирования кетогруппы облада-
использован для дальнейшей циклизации в гидри-
Схема 16.
O O
O OH
HCO2H/Et3N, Ru (II)
CF3
CF3
PhCl, 40°C
R1
R1
48
49
OH OH
HCO2H/Et3N, Ru (II)
PhCl, 60°C
CF3
1
R
50
R = H, 5-Br, 6-OH, 7-OH, 7-NHAc.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
836
ДЯЧЕНКО и др.
Схема 17.
OOH
O
OH
O O
O
O OH
O
H2O
HO
HO
2
+
OOH
-H2O2
44
51
52
53, 67%
Схема 18.
OH
O
O
O
OAlk
OEt
NH2-R
OEt
O
NH
N O
R
R
1
54, 94%
55
R = H, аллил, CH(i-Pr)C(O)NEt2, CН(Ph)Me.
рованный хинолин 55 [76]. Вместо аммиака может
Микроволновое облучение значительно ускоря-
быть применен ацетат аммония в метиловом спир-
ет реакцию, что дает возможность проведения
те при комнатной температуре [77]. Аналогично
синтеза без катализатора [84]. Установлено, что
аммиаку реагируют и замещенные амины в ус-
образующиеся таким путем енамины 58, прояв-
ловиях кислотного катализа при нагревании в
ляют ингибирующий эффект в отношении бакте-
подходящем растворителе
[78-80] (схема
18).
риофага кишечной группы Т4 [85] и антимикроб-
Реакции замещенных
2-ацетилциклогексано-
ный эффект в отношении St. aureus и E. coli [82]
нов 56 с ароматическими аминами 57а протекают
(схема 19).
несколько труднее - при кипячении реагентов в
бензоле [81], толуоле [82] в условиях кислотного
Продуктом подобной реакции может являться и
катализа (СН3СООН), с тиосемикарбазидом 57b -
соответствующий имин 59, полученный при взаи-
при кипячении реагентов в этиловом спирте [83].
модействии реагентов 56 и 60 [86] (схема 20).
Схема 19.
O
Ar
O
O
Ar
O
2
H2N R
1
R1
R1
R1
R
57a, b
R2
HO
O
HO
N
H
56
58, 30-94%
R1 = Me, OEt, OMe; R2 = Ar (57a), NHCSNH2 (57b).
Схема 20.
O Ar O
O Ar O
H
+
N
H
H2N
S
N
O
O
O
N
S
OH
OH
O
O
56
60
59, 50-90%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
837
Схема 21.
2. РЕАКЦИИ, ПРИВОДЯЩИЕ К ЗАМЫКАНИЮ
АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛОВ
O
N R
2.1. ПОЛУЧЕНИЕ ПРОИЗВОДНЫХ ИНДОЛА,
H2N R
63
ИНДОЛИНА И ИНДОЛОНА
X
X
Превращения циклических
1,3-дикарбониль-
( )n
O
( )
O
n
ных реагентов в соединения индольного ряда чаще
62
61, 45-83%
всего включают начальную реакцию с амином, вы-
деление образующегося енамина и дальнейшую
X = NH, O; R = OH, NHPh, Ar; n = 0, 1.
циклизацию последнего.
В литературе имеются, однако, и сообщения, из
Например, для синтеза гексагидроиндола 67
которых следует, что подобные реакции могут про-
раствор кетоэфира 68 в СНСl3 обрабатывают ами-
текать по другому пути - посредством отщепления
ном 69 при 70°С и получают енамин 70, который
кислорода боковой ацильной группы и образова-
затем циклизуют с малеиновым ангидридом 71
ния иминов 61. Это характерно для некарбоцикли-
[92]. Циклизация, по-видимому, включает началь-
ческих 1,3-дикетонов 62, в цикле которых присут-
ное ацилирование аминогруппы и последующее
ствует атом азота или кислорода. Взаимодействие
присоединение С-нуклеофильного реакционного
с аминами 63 протекает как при нагревании, так и
центра по двойной связи раскрытого структурного
при комнатной температуре [87-89]. Циклические
фрагмента ангидрида (схема 23).
амины реагируют с образованием смеси продук-
В подобные реакции могут вступать и вторич-
тов, в том числе образующихся в результате рас-
ные амины. Катализатором является K2PtCl4, а ми-
крытия гетерокольца [90] (схема 21).
кроволновое облучение сокращает время реакции
с 24-72 ч до 1.3-1.5 ч [93].
В то же время, взаимодействие 1,3-дикарбо-
нильного соединения 64 с замещенным о-фени-
Интересная реакция протекает между β-кето-
лендиамином 65 протекает без участия карбониль-
кислотами 72 и азидостиреном 73 в присутствии
ных групп и заканчивается замыканием гидриро-
трехвалентного марганца в качестве катализатора,
ванного имидазольного цикла так, что образуется
приводящая к образованию конденсированных
бензимидазолин 66 [91] (схема 22).
4,5,6,7-тетрагидроиндолов 74 [94] (схема 24).
Схема 22.
O
O
NH2
H
H2N
N
+
O
R
NH2
N
R
H
HO
O
64
65
66, 29-64%
R = H, Me, NO2, COOH, COPh, 3,4-(NH2)2C6H3.
Схема 23.
O
O
R2
O
O
O
O O
R2
H2N R2
NH O
N
OH
69
71
OR1
OR1
COR1
( )
n
( )
n
(
)n
68
70
67, 43-87%
R1 = Me, Et; R2 = Ar, Het; n = 0, 1, 2.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
838
ДЯЧЕНКО и др.
Схема 24.
O
O
Mn (III)
HO
+
–N2
(
)n
N
N
H
(
)n
N
N
72
73
74, 51-83%
n = 1, 2, 3.
2.2. ПОЛУЧЕНИЕ ПИРАЗОЛОВ И ОКСАЗОЛОВ
генеза, индуцированного RANKL [104]. Следует
отметить, что такое течение реакции характерно и
Будучи 1,3-дикарбонильными соединениями,
для 1,3-дикарбонильных соединений, содержащих
структуры типа 75 легко претерпевают пиразоль-
большее количество циклов [105, 106]. На основе
ную циклизацию под действием гидразингидрата
полученных конденсированных систем с циклом
76. При этом образуются замещенные 4,5,6,7-тет-
пиразола синтезированы соединения с противо-
рагидроиндазолы 77 [95-101]. На их основе син-
опухолевой и антиметастатической активностью
тезированы соединения, обладающие свойствами
[107] (схема 26).
ингибиторов дипептидилпептидазы IV [102], а
Реакция 3-Ar-2,4-R-5-гидрокси-5-метилцикло-
также никотиновой кислоты [103] (схема 25).
гексанонов 56 с гидразингидратом 76 в этиловом
Трициклические производные
1,3-дикетонов
спирте протекает в зависимости от температурно-
78 также вступают в реакцию с гидразином 79
го режима. При 0°С образуются гидразоны 81, а
при кипячении в этиловом спирте в кислой сре-
при 60-80°С - тетрагидроиндазолы 82 [108-111].
де, в результате чего формируется гидрированное
Продуктом реакции β-циклокетолов 56 с 1-(пи-
производное нафтаиндазола 80. Его аналоги об-
ридин-2-ил)гидразином при кипячении в толуоле
ладают ингибирующим эффектом остеокласто-
в присутствии уксусной кислоты так же является
Схема 25.
O O
N NH
R3
NH2NH2·H2O
R3
R1
76
R1
( )n
R2
( )n
R2
75
77, 27-100%
R1 = Ar, OEt, CF3; R2 = Me, Et; R3 = i-Pr, Ме; n = 0, 1, 2.
Схема 26.
O
O
O
H2N NH2
79
R1
R1
HN
O
N
78
80, 64-83%
R = H, COOEt.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
839
Схема 27.
O
Ar
OH
t°
R
NH
N
OH
H2N-NH2·H2O
76
82, 47-88%
O
Ar O
Et
Et
N NH2
O
Ar O
OH
81, 41-60%
R
R
O
Ar
O
R
OH
56
R
O
N
OH
NH2OH
83
84, 30-60%
O Ar O
R
R
N OH
OH
85, 61-82%
R = OEt (a), Me (b), NMe (c), NAr (d), (Ме)2СНО (e), t-BuO (f).
замещенный тетрагидроиндазол [112]. Достаточно
вом облучении независимо от карбонилсодержа-
гладкое протекание реакции с образованием гид-
щего заместителя образуется продукт циклизации
рированных индазолов объясняется их высокой
с изоксазольным циклом 84 [115]. С 2,4-диэтокси-
термодинамической устойчивостью и простран-
карбонилциклогексаноном 56а реакция, впрочем,
останавливается на стадии образования оксимов
ственным расположением карбонильных групп,
85 [116-119]. Соединения 84 являются умеренны-
благоприятствующих пиразольной циклизации
ми по силе ингибиторами бактериофага кишечной
[113]. В пользу этого свидетельствует тот факт, что
группы Т4 [120, 121] (схема 27).
3-Ar-2,4-R-5-гидрокси-5-метилциклогексанон
56
с объемными заместителями, такими как t-Bu, в
Подобным же образом реагируют с гидразин-
реакции с гидразингидратом образует лишь соот-
гидратом аналогичные циклогексеноны, которые
ветствующий гидразон 81 даже при кипячении ре-
образуются вследствие дегидратации в условиях
акционной смеси [114]. Использование менее ну-
кислотного катализа исходных производных ци-
клогексанонов 56 [122].
клеофильного гидроксиламина 83 независимо от
температуры реакции позволяет получить продукт
Наряду с образованием пиразольного или ок-
гетероциклизации 84 только при использовании
сазольного кольца продукта 86 может также про-
β-циклокетолов 56b, содержащих ацетильную, но
текать и процесс отщепления молекулы воды от
не сложноэфирную группу. Хотя при микроволно-
замещенного циклогексанонового цикла соедине-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
840
ДЯЧЕНКО и др.
Схема 28.
Ph
R
Ph
R
N
N
N N
a) NH2NH2·H2O (7
6)
b) NH2OH·HCl (88)
MeOC
MeOC
O
X
O
N
OH
87
86a, b, 71-73%
R = H, 2-OH, 4-Cl, 4-Br; X = N (a), O (b).
ния 87 в результате взаимодействия соответствен-
пы, обеспечивающей возможность альтернатив-
но с гидразингидратом 76 или с гидроксиламином
ного варианта циклизации, приводящего к смеси
88 в метаноле при кипячении в течение 7 ч [123]
веществ 95-97 [126] (схема 30).
(схема 28).
Если реакции β-циклокетолов с гидразином или
Участие в реакции с гидроксиламином частично
фенилгидразином практически всегда заканчива-
замещенных 1,3-дикарбонильных соединений 89
ются образованием индазола [127, 128], кроме вза-
сопровождается частичным О-деметилированием
имодействия на холоду [120], то с дизамещенным
и заканчивается образованием смеси гидрирован-
или (гет)арилгидразином возможно образование
ных бензизоксазолов 90 и 91 [124]. В то же время с
одного из изомеров индазола [129-131], а также их
незамещенным β-циклокетолом 92 реакция проте-
смеси [132], енаминов [130, 133, 134], или смеси
кает как чистая циклизация с образованием лишь
индазола и енамина [135]. Первой в реакцию мо-
одного продукта 93 [125] (схема 29).
жет вступать как карбонильная группа циклогек-
сана, так и ацетильный фрагмент [130, 132, 133,
Другой пример неселективной и более слож-
135].
ной по своему механизму циклизации 1,3-дикар-
бонильных соединений, являющихся предметом
Так, при взаимодействии реагентов 98 и 99 в
настоящего обзора, протекающей в условиях
зависимости от условий реакции могут быть вы-
микроволнового облучения реагентов, приведен
делены два изомера индазола 100 или 101, а также
ниже. Здесь енаминный фрагмент реагента 94 по
енамины 102, в результате внутримолекулярной
существу играет роль криптокарбонильной груп-
циклизации преобразованые в гидрированные ин-
Схема29
O O
Ph
Ph
NH2OH, EtOH, 25°C
Ph
+
N
O
O
N
OMe
HON
MeO
89
90, 10%
91, 34%
O O
N
NH2OH, BF3·OEt2
O
R
( )n
R
( )n
HO
92
93, 48-89%
R = CF2CF2H, C4F9, CF3, C3F7, (CF2)4H, C6F13; n = 0, 1.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
841
Схема 30.
дазолы 101, или смесь продуктов 101 и 102 [130,
получают енамин, который может быть выделен и
135]. Следует заметить, что в структуре реагентов
подвергнут дальнейшей циклизации [134].
содержатся атомы фтора [130, 132, 135] (схема 31).
Иногда рассматриваемая реакция приводит к
В подобных реакция с гидразином индазол об-
двум изомерным гидрированным индазолам с раз-
разуется легко и промежуточный продукт обычно
ным выходом. При этом соотношение изомерных
не выделяют. При наличии в структуре монозаме-
продуктов таково, что позволяет заключить о пред-
щенного гидразина затрудняющих циклизацию
почтительности начальной N-нуклеофильной ата-
объемных заместителей и более мягких условий
ки по циклической СО-группе дикарбонильного
реакции (комнатная температура или слабое наг-
соединения, и, соответственно, меньшей реакци-
ревание, отсутствие катализатора) вначале часто
онной способности экзоциклической карбониль-
Схема 31.
R2
R2
NH
O O
O HN
N N
H2NHN
R2
99
R1
R1
R1
R4
O
O
O
R3
98
102
101, 76-88%
DMSO
X
X
X
O O
H2NHN
HN
R1
N N
NH O
OMe
R1
R1
O
O
100, 67-75%
N
R1 = Me, Et, Ph, фур-2-ил, cyclo-C3H5; R2 =
X
,
, COOEt;
N
R3, R4 = Me, Me; H, H; фур-2-ил, H; X = 4-F, 1,2,3,4,5-(F)5, 3,5-(CНF2)2.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
842
ДЯЧЕНКО и др.
Схема 32.
C6H5-NH-NH2
CF3
CF3
1c
+
Pyrrolidine, THF
N
N
N N
C6H5
C6H5
3c
5a
1:1
R-NH-NH2
F
RF
R
RF
+
CH3OH, reflux
N N
N N
O O
R
R
1d, f
3d, e
5b, c
ной группы. Вероятно, влияние на ход начальной
с образованием производного акридина 105, на ос-
стадии реакции оказывают стерические факторы.
нове которого получены ингибиторы геликазы ви-
руса геппатита С NS3 [136], а также ингибиторы
Интересно, что присутствие в арильной груп-
ацетилхолинэстеразы (hAChE) и бутирилхолин-
пе реагента атома фтора значительно повышает
эстеразы человека (hBChE) [137]. В других услови-
селективность пиразольной циклизации в такой
ях с помощью такого рода реакций получают про-
степени, что реакция в этом случае позволяет
дукты 106 и их производные, обладающие анти-
получить только один из двух возможных гидри-
малярийной активностью [138] (схема 33).
рованных индазолов. Если вместо основания ис-
пользовать соль ArNHNH2·HCl, реакция может
Сложноэфирная группа не всегда, однако, при-
протекать с повышенной региоселективностью.
нимает участие в реакции. Так, этил 2-оксоцикло-
С удлинением цепи заместителей в 1,3-дикетоне
гексанкарбоксилат 1 взаимодействует с произво-
направление реакции определяется стерическими
дными 4-аминопиридин-3-карбальдегида 107 при
факторами. Изменение жесткости концевой NH2-
кипячении в этаноле в присутствии гидроксида
группы также влияет на соотношение двух путей
калия таким образом, что на стадии циклизации
циклизации [132] (схема 32).
вместо сложноэфирной участвует формильная
группа. Это приводит к образованию производных
2.3. ФОРМИРОВАНИЕ ПИРИДИНОВОГО
тетрагидробензо[b][1,6]нафтиридина
108
[139,
ЦИКЛА ПОСРЕДСТВОМ ЦИКЛИЗАЦИЙ
140] (схема 34).
С УЧАСТИЕМ АМИНОВ, ИМИНОВ
И МЕТИЛЕНАКТИВНЫХ ТИОАМИДОВ
Также с сохранением сложноэфирной группы
протекает и циклизация кетоэфира 1 пропарги-
Рассматриваемые дикарбонильные соединения
ламином 109 в метаноле, в которой на стадии за-
по отношению к ариламинам способны проявлять
мыкания пиридинового цикла участвует тройная
особую реакционную способность, поскольку в
углерод-углеродная связь. В результате продуктом
этом случае первичные продукты реакции кети-
реакции оказывается производное гексагидрохи-
минной структуры благодаря возможности даль-
нолина 110. Наилучшие выходы соединения 110
нейшей электрофильной атаки со стороны второй
получены при температуре реакции 40°С в при-
карбонильной группы могут подвергаться даль-
сутствии каталитических количеств NaAuCl4 [141]
нейшей циклизации с замыканием пиридинового
(схема 35).
цикла. Иногда процесс проводят без выделения
промежуточного кетамина. Показательным при-
Конденсация 2-ацетил-4-ацетоксициклогексан-
мером может служить реакция анилинов 103 с
1,3-диона 111 с 3,4-дигидроизохинолином 112 при
2-этоксикарбонилциклогексаноном 104 (X = CH2)
кипячении или при комнатной температуре при-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
843
Схема 33.
OH
R2
Ph2O
(PhMe)
R1
N
R2
EtO2C
X
105, 65%
+
O
R1
NH2
O
AcOH,
R2
X
103
104
C6H6, Ph2O
R1
N
H
106, 39-84%
R1 = OEt, OMe, Cl, Br, H, Me, OC6H4Cl-п; R2 = H, Cl, OMe, O-i-Pr; X = CH2, CF2, N(Me), S.
Схема 34.
EtO
O
O
O
NH2
O
EtOH/KOH
N
OEt
+
H
N
N
1
107
108, 82-83%
R1
R2
;
; R1 = Cl, Br; R2 =H, OCH3.
N
N
Ph
водит к образованию тетрациклического продукта
ем изомерной смеси изохинолина 115 и хинолина
113 [142] (схема 36).
116 [143].
Интересным и многообещающим реагентом
Это предопределяется возможностью двух ва-
для пиридиновых циклизаций 1,3-дикарбониль-
риантов первоначальной нуклеофильной атаки
ных соединений с одной экзоциклической карбо-
С-аниона реагента 114, обусловленной биэлектро-
нильной группой являются метиленактивные тио-
фильным характером субстрата 35 (схема 37).
амиды, классическим примером которых является
Аналогичная реакция
2-(2-тиенил)-1-цикло-
цианотиоацетамид 114. Показано, что в этиловом
спирте в присутствии основания (триэтиламина
гексанона 117 в присутствии триэтиламина (60°С)
или морфолина) 2-ацетилциклогексанон 35 (n = 1)
приводит к образованию только одного изомерного
взаимодействует с этим тиоамидом с образовани-
продукта - 1-(2-тиенил)-4-циано-5,6,7,8-тетрагид-
Схема 35.
O O
CO2Et
MeOH, t°
+
EtO
H2N
N
1
109
110, 91%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
844
ДЯЧЕНКО и др.
Схема 36.
O O
O
O
OAc
R
OAc
N
+
R
R
N
O
R
111
112
113, 88-93%
R = H, OMe.
Схема 37.
CN
O
CN
( )n
S
( )n
NH2
EtOH, B
( )n
+
NC
+
NH
N
S
S
H
O
35
114
115, 49-88%
116, 3-42%
n = 0, 1.
роизохинолин-3-тиона 118. Это можно объяснить
С использованием [2-13С]-цианоацетамида 123
влиянием стерических факторов (аксиальным рас-
был подтвержден механизм образования изохино-
положением карбонильной группы в положении 1
линового 124 и хинолинового 125 изомерных про-
в исходном циклогексаноне), снижением реакци-
дуктов, включающий первичную нуклеофильную
атаку С-аниона реагента по двум СО-группам и
онной способности экзоциклической СО-группы,
образование в качестве конкурирующих интерме-
стабильностью промежуточного соединения 119 и
диатов структур 126 и 127. Соотношение продук-
образованием выгодной структуры с длинной це-
тов реакции зависит от заместителя в пара-поло-
почкой сопряженных связей [144] (схема 38).
жении арильного кольца исходного 2-ароилцикло-
В аналогичных условиях, но не только при наг-
гексанона 120, причем, во всех случаях основным
ревании, а и при комнатной температуре, и тоже
продуктом реакции является изохинолин
124.
селективно, протекает реакция 2-ароилциклогек-
Электроноакцепторные заместители в арильной
группе увеличивают количество хинолина 125 до
санонов 120 с цианоацетамидом 121, продуктами
максимально зафиксированного выхода 29% [146]
которой являются производные 5,6,7,8-тетрагид-
(схема 40).
ро-3-гидроксиизохинолин-4-карбонитрила
122,
которые были использованы для синтеза ингиби-
Взаимодействие 1,3-дикетона 35 с двумя моля-
торов EPHA4-киназы [145] (схема 39).
ми малононитрила 128 в этиловом спирте в при-
Схема 38.
CN
CN
O O
S
SH
NH2
NC
+
NH2
N
S
O
S
S
S
117
114
119
118, 85%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
845
Схема 39.
OH
O O
NC
NH2
Et3N
N
NC
Ar
+
O
Ar
120
121
122, 76-88%
сутствии пиперидина приводит к смеси продук-
циклических амидинов [152], приводящих к обра-
тов 129 и 130 с суммарным выходом до 88% [147]
зованию пиримидинсодержащих структур 134 и
(схема 41).
135, приведены ниже (схема 42).
2.4. ФОРМИРОВАНИЕ ПИРИМИДИНОВОГО
Аналогичным образом реагируют и карбо-
ЦИКЛА
циклические 1,3-дикетоны. Так, 2-этоксикарбо-
нилциклогексанон 1, взаимодействуя с замещен-
Формирование пиримидинового цикла воз-
ным пиразолом 136 в присутствии уксусной кис-
можно посредством реакций 1,3-дикарбонильных
лоты при кипячении, образует пиразоло[5,1-b]хи-
соединений с амидинами 131 или соединениями
назолин 137 - аналог ингибитора вируса гепатита
типа 132, имеющими амидиновый (гуанидино-
С [153] (схема 43).
вый) фрагмент, включенный в состав гетероцикла.
Примеры таких реакций с участием в качестве суб-
Взаимодействие замещенных гидроксицикло-
стратов соединений 133 для обычных [148-151] и
гексанонов 56 с 3-амино-1,2,4-триазолом 138 мо-
Схема 40.
O
OH
NC
NC
13
NH
2
C
N
O
R
R
124, 57-83%
126
O O
H
2
13
TEA
C NH
2
+
DMSO-d6
NC
80°C
O
R
120
123
O
OH
CN
H
13
2N
CN
N C
O
R
R
125, 3-29%
127
R = NO2, CN, COOMe, Cl, F, H, Me, OMe, OCHMe2.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
846
ДЯЧЕНКО и др.
Схема 41.
R
O
O
CN
CN
EtOH, piperidine
NC CN
+
2
+
R
NH2
R
N O
H
CN
35
128
129
130
R = Me, Et.
Схема 42.
R3
O
HN
NH
R4
X
H2N
N
R4
131
R2
R3
O
134, 31-87%
R1
X
O
R2
O
R5
R5
X
N
2
R
133
X
Y
N
X
R6
Z
R6 Y
132
Z
N
135, 37-62%
X = C, N; R1 = H, OEt; R2 = H, Alk, Ar; R3 = OН; 2H; R4 = Het;
R5 = нет, Me, SMe; R6 = Me, H; Х = O, C, N; Y = C, N; Z = C, S, N.
жет приводить к разным продуктам в зависимости
ную стадию кислотного расщепления β-дикарбо-
от заместителя у карбонильной группы. При про-
нильной системы и тем самым циклогексанового
чих равных условиях (нагревание до 120-140°С
цикла. Примером служит катализируемое хлори-
без растворителя) если заместителем является
дом иттербия взаимодействие 2-этоксикарбонил-
OEt, то образуется с выходом 72-93% триазоло-
циклогексанона 1 с 1,8-нафтилендиамином 141,
хиназолин 139 с гидроксогруппой в положении 5
приводящее к образованию перимидина 142 [155]
и этиловый спирт. В случае, когда заместитель -
(схема 45).
метильная группа, образуется с низким выходом
2.5. ФОРМИРОВАНИЕ ПИРАНОВОГО
25% триазолохиназолин 140 с метильной группой
И ФУРАНОВОГО КОЛЬЦА
в положении 5 и вода [154] (схема 44).
Возможность формирования пиранового коль-
Иногда к формированию ядра пиримидина при-
ца иллюстрируется примером пирановой циклиза-
водят и реакции, очевидно, включающие началь-
ции соединения 143 под действием уксусного ан-
Схема 43.
O
O
HN
N
N
H+
N
OEt
+
H2N
N
Ph
O
H
Ph
1
136
137, 76%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
847
Схема 44.
O
Ar OH
N
EtO
N
R1 = OEt
HO
O Ar
O
N N
N N
139
R1
R1
+
H2N
N
O
Ar
HO
H
O
N
56
138
R1 = Me
N
HO
N N
140
Ar = Ph, 4-OMeC6H4, 3-NO2C6H4.
Схема 45.
O
H
EtO
N
YbCl3
OEt
+
O
N
O
NH2
NH2
1
141
142, 50%
гидрида 144 в присутствии пиперидина при кипя-
тивного соединения 148 (кигамицина С) из дике-
чении реакционной смеси, приводящей к образо-
тона 149. Процесс начинается с его арилирования
ванию
2-оксо-4-фенилпирано[2,3-b]хиноксалина
фенилбороновой кислотой 150 [164] (схема 48).
145 [156] (схема 46).
β-Кетоэфир 151 с замещенным пропаргильным
По совершенно иному механизму способны
фрагментом в присутствии комплексного соедине-
подвергаться пирановой циклизации более прос-
ния палладия [Pd2(дибензилиденацетон)3·CHCl3]
претерпевает сложную циклизацию с замыканием
тые карбоциклические 1,3-дикарбонильные сое-
динения, для которых циклизующими реагентами
фуранового цикла и превращением в 3-метил-2-фе-
нилтетрагидробензофуран 152 [165] (схема 49).
выступают фенолы. Для примера укажем на реак-
цию, приводяющую к α-пираноновой структуре
2.6. ФОРМИРОВАНИЕ 1,4-ДИАЗЕПИНОВОГО
146, в которой фенолы 147 реагируют с соедине-
ЦИКЛА
ниями 1 [157-162]. Данная реакция требует, впро-
Этот цикл может быть сформирован в рас-
чем, микроволнового облучения [163] (схема 47).
сматриваемых
1,3-дикарбонильных соединени-
Особый случай пирановой циклизации имеет
ях под действием таких циклизующих агентов,
место в качестве стадии синтеза биологически ак-
как 1,2-диамины, что было продемонстрировано
Схема 46.
Ph
Ph
(MeCO)2O
N
144
N
O
N
O
N O O
H
143
145, 73%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
848
ДЯЧЕНКО и др.
Схема 47.
R2
R2
O
1
R
O O
1
R
OH
+
OEt
( )n
O
R3
R3
( )
n
147
1
146, 60-94%
R1, R2, R3 = OH, H, H; -(CH)4-, H; OH, H, OH; n = 0, 1.
Схема 48.
O O Br
B(OH)2
O
+
O
Br
149
150
148, 78%
1,3-дикарбонильными соединениями 156 образует
Схема 49.
спиросоединения 157 [167-175] (схема 51).
Взаимодействие трикарбонильного произво-
дного циклогексанона 56 с этиленгликолем 155
протекает региоселективно. И в этом случае атаке
подвергается лишь эндоциклическая СО-группа
субстрата, что приводит к образованию спиро-
соединений 158. Реакция реализуется в бензоле в
опять-таки на примере 3-бензоилхиноксалин-2-
присутствии уксусной кислоты при соотношении
она 143. Показано, что это соединение при цикли-
реагентов 1:2 соответственно [176] (схема 52).
зации о-фенилендиамином 153 в уксусной кислоте,
3. ПРЯМАЯ ВНУТРИМОЛЕКУЛЯРНАЯ
реагирует обеими своими аминогруппами, прев-
ЦИКЛИЗАЦИЯ 1,3-ДИКАРБОНИЛЬНЫХ
ращаясь в хиноксалино[2,3-b]бензо-1,5-диазепин
СОЕДИНЕНИЙ
154 [166] (схема 50).
Такие реакции возможны при наличии в 1,3-ди-
2.7. СПИРОЦИКЛИЗАЦИИ
карбонильных соединениях дополнительных,
Этиленгликоль 155 при кипячении в бензо-
удобно расположенных нуклеофильных реакцион-
ле или толуоле в условиях кислотного катализа с
ных центров, обладающих достаточной реакцион-
Схема 50.
Ph
Ph
N
H2N
N
N
O
CH3COOH
+
N
O
H2N
N N
R
R
143
153
154, 97%
R = H, Alk.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
849
Схема 51.
O
O
O
O
O
+
H
OH
+
R1
HO
R1
R2
R2
( )n
( )n
155
156
157, 75-90%
R1 = Me, OMe, OEt; R2 = H, Me, аллил; n = 0, 1.
Схема 52.
O
Ph
O
O
Ph
O
H+
R
R
OH
R
R
+
HO
O
O
OH
OH O
56
155
158, 63-66%
R = CH3, OEt.
ной способностью в отношении той или иной из
4. РЕАКЦИИ, ВЕДУЩИЕ К ОБРАЗОВАНИЮ
двух присутствующих карбонильных групп [177,
В ЦИКЛИЧЕСКОМ ФРАГМЕНТЕ
178]. Примером может служить циклизация ами-
НЕПРЕДЕЛЬНЫХ СВЯЗЕЙ
дов 159, протекающая под действием серной кис-
ИЛИ К ЕГО АРОМАТИЗАЦИИ
лоты и приводящая к образованию гетероцикли-
Производные циклогексанона 164 в кислой
ческих систем 160 - исходных соединений для
среде могут подвергаться дегидратации, резуль-
синтеза ингибиторов поли(ADP-рибозо)полиме-
татом которой является образование непредель-
разы-1 (PARP-1) [179] (схема 53).
ного 1,3-дикарбонильного соединения 165 [181]
(схема 55).
Возможна дегидрационная циклизация про-
изводного хинолина 161 в бензо[b]акридин 162.
Под действием окислителей может осущест-
Реакция протекает в присутствии BBr3 163 в
вляться полная ароматизация циклогексанового
дихлорметане при нагревании в атмосфере арго-
кольца. Так, при воздействии на 2,4-диацетил-5-гид-
на и, вероятно, включает предварительную акти-
рокси-5-метил-3-фенилциклогексанон 56 иодом в
вацию бензоильной группы как электрофила [180]
подходящем растворителе при кипячении получа-
(схема 54).
ют соединение 166 [182] (схема 56).
Схема 53.
O
R
O
O
NH
H2SO4
N
H
R
159
160, 53%
R = OMe, COOEt.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
850
ДЯЧЕНКО и др.
Схема 54.
O
O
O
Ph
F
BBr3, CH2Cl2
F
Ph
163
-H2O
F
N
CH2Ph
F
N
Pr
Pr
161
162, 90%
Схема 55.
R1
O
R1
O
H+
OEt
OEt
R2
O
O
HO
R2
164
165, 36-80%
R1, R2 = Ph, Ar, Het.
В зависимости от условий реакции на основе
Схема 56.
соединения 171 получают три разных продукта:
при кипячении в бензоле в присутствии пара-то-
луолсульфокислоты образуется производное де-
O
O
O
O
гидратированного циклогексанона 172; реакция,
протекающая в метиловом спирте в присутствии
метилата натрия, приводит к ароматизации цикло-
O
OH
гексанового фрагмента 173; при микроволновом
OH
облучении в ДМСО в присутствии хлорида натрия
56
166, 20-55%
получают смесь замещенного изобензофурана 174
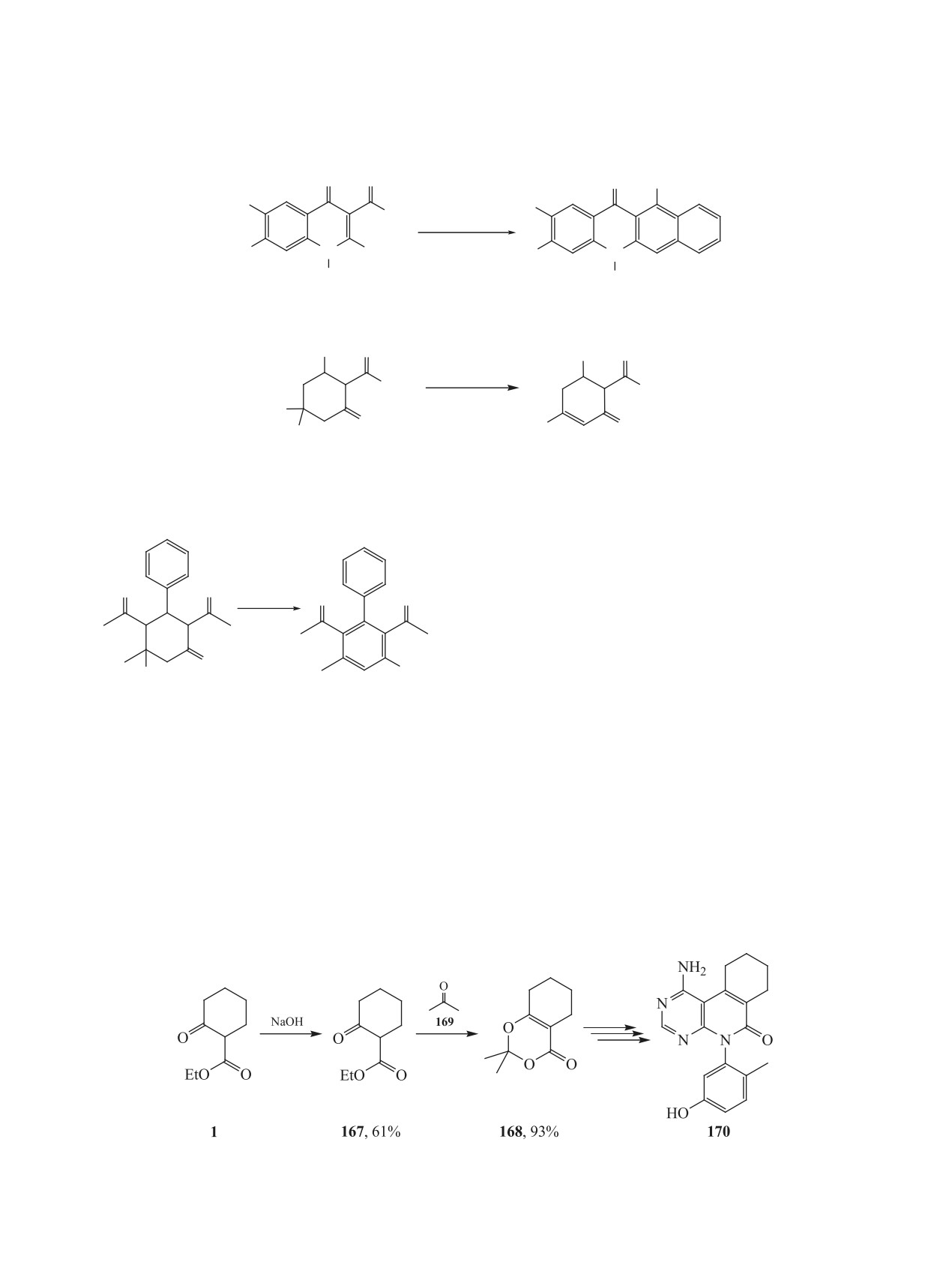
Омылением этил 2-оксоциклогексанкарбокси-
и образующегося в первом случае продукта 172
лата 1 в присутствии гидроксида натрия получают
[184] (схема 58).
кислоту 167, енольная форма которой легко об-
5. РЕАКЦИИ С РАСКРЫТИЕМ ЦИКЛА
разует циклический кеталь 168 с ацетоном 169 в
ИЛИ ИЗМЕНЕНИЕМ ЕГО РАЗМЕРНОСТИ
присутствии уксусного ангидрида и серной кисло-
ты. Соединение 168 является удобным исходным
При обработке 2-ацетилциклогексанона 35 во-
соединением для синтеза пиримидоизохинолина
дой при нагревании в присутствии соединения ин-
170
- ингибитора EphB4 тирозинкиназы [183]
дия в качестве катализатора происходит образова-
(схема 57).
ние 7-оксооктановой кислоты 175 [185] (схема 59).
Схема 57.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
851
Схема 58.
O
O
OH
H3COOC
NaOMe,
p-TSA
MeOH
O
OH
Ph
O
Ph
Ph
Ph
Ph
Ph
O
172, 96%
171
173, 91%
DMSO,
NaCl
OH
O
172, 23%
+ O
Ph
Ph
174, 53%
Схема 59.
O
O
In(OTf)3
O
O
+ H2O
OH
35
175, 85%
Схема 60.
N
O
NH2
O
YbCl3, EtOH
+
N
R
H
R
NH2
( )n
(
)n
OEt
OEt
176
65
177, 52-86%
R = H, Me, NO2; n = 1, 2.
Схема 61.
O
O O
[ReBr(CO)5],
Ph
PhCH2CN
OEt
+ Ph
O
(
)n
( )n
OEt
1
179
178, 78-97%
n = 0, 1
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
852
ДЯЧЕНКО и др.
Под действием катализатора YbCl3
при кипя-
7.
Mori Y., Kakumoto K., Manabe K., Kobayashi S.
чении в EtOH или при комнатной температуре
Tetrahedron Lett. 2000, 41, 3107-3111. doi 10.1016/
S0040-4039(00)00319-1
циклические 1,3-дикарбонильные соединения 176
8.
Drabina P., Broz B., Sedlak M., Padelkova Z. J. Orga-
взаимодействуют с ортофенилендиамином 65 с об-
nomet. Chem. 2011, 696, 971-981. doi 10.1016/
разованием бензимидазолов 177 [155] (схема 60).
j.jorganchem.2010.10.031
Известна реакция эфиров кетокислот 1 с расши-
9.
Ding R., Katebzadeh K., Roman L., Berquist K.-E.,
рением карбоцикла путем включения в него двух
Lindström U.M. J. Org. Chem. 2006, 71, 352-355. doi
атомов углерода и образованием производных ци-
10.1021/jo051540n
клогептенона или циклооктенона 178, в которой
10.
Aplander K., Ding R., Lindström U., Wennerberg J.,
источником этих атомов служит фенилацетилен
Schultz S. Angew. Chem., Int. Ed. 2007, 46, 4543-
179, а катализатором - комплексное соединение
4546. doi 10.1002/anie.200700560
рения [26] (схема 61).
11.
Aplander K., Ding R., Krasavin M., Lindstrom U.,
Marcus U., Wennerberg J. Eur. J. Org. Chem. 2009,
ВЫВОДЫ
810-821. doi 10.1002/ejoc.200800922
Химия
2-ацилциклоалканонов стремительно
12.
Yadav J.S., Geetha V., Reddy B.V.S. Synth. Commun.
развивается благодаря высокой реакционной спо-
2002, 32, 3519-3524. doi 10.1081/SCC-120014790
собности этого класса органических соединений.
13.
Smitha G., Patnaik S., Reddy C.S. Synthesis. 2005,
Они являются базовыми для получения многих
711-713. doi 10.1055/s-2005-861837
природных и синтетических практически важных
14.
Mori K., Oshiba M., Hara T., Mizugaki T., Ebitani K.,
веществ. Преимущественно эти структуры явля-
Kaneda K. Tetrahedron Lett. 2005, 46, 4283-4286. doi
ются исходным материалом для получения О,N-
10.1016/j.tetlet.2005.04.099
содержащих гетероциклов. В то же время реакции
15.
Shimizu K., Miyagi M., Kan-no T., Kodama T.,
по карбоциклическому фрагменту молекул 2-ацил-
Kitayama Y. Tetrahedron Lett. 2003, 44, 7421-7424.
циклоалканонов малоизучены, что открывает воз-
doi 10.1016/j.tetlet.2003.08.048
можности развития новых направлений химии
16.
Shimizu K., Miyagi M., Kan-no T., Kitayama Y. J. Catal.
этого перспективного класса функционализиро-
2005, 229, 470-479. doi 10.1016/j.jcat.2004.11.030
ванных карбоциклов.
17.
Vasiloiu M., Gaertner P., Bica K. Sci. Chin. Chem.
2012, 55, 1614-1619. doi 10.1007/s11426-012-4657-z
КОНФЛИКТ ИНТЕРЕСОВ
18.
Yadav J.S., Reddy B.V.S., Baishya G., Venkat N.A.
Авторы заявляют об отсутствии конфликта ин-
Chem. Lett. 2005, 34, 102-103. doi 10.1246/cl.2005.102
тересов.
19.
Yao X., Li C.-J. J. Org. Chem. 2005, 70, 5752-5755.
doi 10.1021/jo050570n
СПИСОК ЛИТЕРАТУРЫ
20.
Shibatomi K., Nakahashi T., Uozumi Y. Synlett. 2000,
1. Шокова Э.А., Ким Д.К., Ковалев В.В. ЖОрХ. 2015,
1643-1645. doi 10.1055/s-2000-7951
51, 773-847. [Shokova E.A., Kim J.K., Kovalev V.V.
21.
Bensa D., Constantieux Th., Rodriguez J. Synthesis.
Russ. J. Org. Chem. 2015, 51, 755-830.] doi 10.1134/
2004, 923-927. doi 10.1055/s-2004-815996
S1070428015060019
22.
Ge H.M., Zhang L.-D., Tan R.X., Yao Z.-J. J. Am.
2. Bensa D., Brunel J.-M., Buono G., Rodriguez J. Synlett.
Chem. Soc. 2012, 134, 12323-12325. doi 10.1021/
2001, 715-717. doi 10.1055/s-2001-13369
ja305261h
3. Villano R., Scettri A. Synthesis. 2005, 757-760. doi
23.
Li H., Wang Y., Tang L., Wu F., Liu X., Guo C.,
10.1055/s-2005-861810
Foxman B.M., Deng L. Angew. Chem., Int. Ed. 2005,
4. Reddy Ch.R.V., Verkade J.G. J. Org. Chem. 2007, 72,
44, 105-108. doi 10.1002/anie.200461923
3093-3096. doi 10.1021/jo062505z
24.
Bartoli G., Bosco M., Carlone A., Cavalli A., Loca-
5. Basle O., Porсel S., Ladeira S., Bouhadir G., Bouris-
telli M., Mazzanti A., Ricci P., Sambri L., Melchior-
sou D. Chem. Commun. 2012, 48, 4495-4497. doi
re P. Angew. Chem., Int. Ed. 2006, 45, 4966-4970. doi
10.1039/C2CC30399J
10.1002/anie.200600370
6. Tateiwa J.,HosomiA.Eur.J.Org.Chem.2001,1445-1448.
25.
Yamaoka Y., Miyabe H., Yasui Y., Takemoto Y.
doi
10.1002/1099-0690(200104)2001:8<1445::AID-
Synthesis.
2007,
2571-2575. doi
10.1055/s-2007-
EJOC1445>3.0.CO;2-Q
983795
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
853
26.
Horino Y. Angew. Chem., Int. Ed. 2007, 46, 2144-2146.
45.
Kusama H., Watanabe E., Ishida K., Iwasawa N.
doi 10.1002/anie.200605228
Chem. Asian J. 2011, 6, 2273-2277. doi 10.1002/
asia.201100460
27.
Xi Y., Wang D., Ye X., Akhmedov N.G., Petersen J.L.,
Shi X. Org. Lett. 2014, 16, 306-309. doi 10.1021/
46.
Iwai T., Okochi H., Ito H., Sawamura M. Angew.
ol403337u
Chem., Int. Ed. 2013, 52, 4239-4242. doi 10.1002/
anie.201300265
28.
Marigo M., Kumaragurubaran N., Jørgensen K.A.
Synthesis. 2005, 957-960. doi 10.1055/s-2005-861796
47.
Hierold J., Lupton D.W. Org. Lett. 2012, 14, 3412-
3415. doi 10.1021/ol301386k
29.
Rajveer Ch., Stephenrathinaraj B., Sudharshini S.,
Kumaraswamy D., Shreshta B., Choudhury P.K. Res. J.
48.
Reddy C., Babu S.A., Aslam N.A., Rajkumar V.
Pharm., Biol. Chem. Sci. 2010, 1, 99-104.
Eur. J. Org. Chem. 2013, 2362-2380. doi 10.1002/
ejoc.201201382
30.
Hagiwara H., Sato K., Nishino D., Hoshi T., Suzuki T.,
Ando M. J. Chem. Soc., Perkin Trans. 1. 2001, 2946-
49.
Hierold J., Hsia T., Lupton D.W. Org. Biomol. Chem.
2957. doi 10.1039/B107180G
2011, 9, 783-792. doi 10.1039/C0OB00632G
31.
Mekonnen A., Carlson R. Synthesis. 2006, 10, 1657-
50.
Chung S.H., Cho M.S., Choi J.Y., Kwon D.W.,
1663. doi 10.1055/s-2006-926459
Kim Y.H. Synlett. 2001, 1266-1268. doi 10.1055/
s-2001-16064
32.
Duan Y.-A., Cui L.-Q., Zuo L.-H., Zhang C. Chem.
Eur. J.
2015,
21,
13052-13057. doi
10.1002/
51.
Nishikawa K., Ando T., Maeda K., Morita T.,
chem.201502450
Yoshimi Y. Org. Lett. 2013, 15, 636-638. doi 10.1021/
ol303460u
33.
He S., Yang W., Zhu L., Du G., Lee C.-S. Org. Lett.
2014, 16, 496-499. doi 10.1021/ol403374h
52.
Penning M., Christoffers J. Eur. J. Org. Chem. 2013, 2,
389-400. doi 10.1002/ejoc.201201158
34.
Yang W., Cao J., Zhang M., Lan R., Zhu L., Du G.,
He S., Lee C.-S. J. Org. Chem. 2015, 80, 836-846. doi
53.
Bhar S., Chaudhyri S.K., Sahu S.G., Panja C.
10.1021/jo502267g
Tetrahedron.
2001,
57,
9011-9016. doi
10.1016/
S0040-4020(01)00896-1
35.
Anxionnat B., Robert B., George P., Ricci G.,
Perrin M.-A., Gomez Pardo D., Cossy J. J. Org. Chem.
54.
Kraus G.A., Nguyen T.H., Jeon I. Tetrahedron Lett.
2012, 77, 6087-6099. doi 10.1021/jo300887u
2003,
44,
659-661.
doi
10.1016/S0040-
4039(02)02693-X
36.
Casey M., Donnelly J.A., Ryan J.C., Ushioda S. Arkivoc.
2003, 7, 310-327. doi 10.3998/ark.5550190.0004.726
55.
Trost B.M., Fandrick D.R. Aldrich. Acta. 2007, 40,
59-72.
37.
Schmidt V.A., Alexanian E.J. J. Am. Chem. Soc. 2011,
133, 11402-11405. doi 10.1021/ja204255e
56.
Ooi T., Maruoka K. Aldrich. Acta. 2007, 40, 77-86.
38.
Fraga C.A.M., Teixeira L.H.P., Menezes C.M.S.,
57.
Ooi T., Maruoka K. Angew. Chem., Int. Ed. 2007, 46,
Sant’Anna C.M.R., Ramos M.C.K.V., Neto F.R.A.,
4222-4266. doi 10.1002/anie.200601737
Barreiro E.J. Tetrahedron. 2004, 60, 2745-2755. doi
58.
Pravst I., Zupan M., Stavber S. Tetrahedron. 2008, 64,
10.1016/j.tet.2004.01.079
5191-5199. doi 10.1016/j.tet.2008.03.048
39.
Ivkovic A., Matovic R., Saicic R.N. Org. Lett. 2004, 6,
59.
Mellegaard-Waetzig S.R., Wang C., Tunge J.A.
1221-1224. doi 10.1021/ol049875z
Tetrahedron.
2006,
62,
7191-7198. doi
10.1016/
40.
Punirun T., Peewasan K., Kuhakarn C., Soorukram D.,
j.tet.2005.12.072
Tuchinda P., Reutrakul V., Kongsaeree P., Prabpai S.,
60.
Sreedhar B., Reddy P.S., Madhavi M. Synth. Commun.
Pohmakotr M. Org. Lett. 2012, 14, 1820-1823. doi
2007,37,4149-4156.doi/10.1080/00397910701574908
10.1021/ol3004194
61.
Meshram H.M., Reddy P.N., Vishnu P., Sadashiv K.,
41.
Taber D.F., Guo P. J. Org. Chem. 2008, 73, 9479-9481.
Yadav J.S. Tetrahedron Lett. 2006, 47, 991-995. doi
doi 10.1021/jo8017704
10.1016/j.tetlet.2005.11.141
42.
Ito H., Ohmiya H., Sawamura M. Org. Lett. 2010, 12,
62.
Mei Y., Bentley P.A., Du J. Tetrahedron Lett. 2008, 49,
4380-4383. doi 10.1021/ol101860j
3802-3804. doi 10.1016/j.tetlet.2008.03.154
43.
Lamarque С., Beaufils F., Dénès F., Schenk K.,
63.
Etayo P., Badorrey R., Díaz-de-Villegas M.D.,
Renaud P. Adv. Synth. Catal. 2011, 353, 1353-1358.
Gálvez J.A. Adv. Synth. Catal. 2010, 352, 3329-3338.
doi 10.1002/adsc.201000852
doi 10.1002/adsc.201000594
44.
Miura T., Shimada M., Murakami M. Angew. Chem.
64.
Fang L.-Z., Shen J.-M., Li Q.-H., Yan F.-L. Asian
2005, 117, 7770-7772. doi 10.1002/anie.200502650
J. Chem. 2011, 23, 3425-3427.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
854
ДЯЧЕНКО и др.
65.
Fang L.-Z., Li Q.-H., Liu J.-P., Yan F.-L. Asian J. Chem.
Voronina E.V., Kriven’ko A.P. Pharm. Chem. J. 2002,
2011, 23, 2919-2921.
36, 131-134.] doi 10.1023/A:1019678210738
66.
Bartoli G., Bosco M., Carlone A., Locatelli M.,
83.
Поплевина Н.В., Кривенько А.Г., Щелочкова О.А.,
Melchiorre P., Sambri L. Angew. Chem., Int. Ed. 2005,
Голиков А.Г., Солодовников С.Ф. ЖОрХ. 2009, 45,
44, 6219-6222. doi 10.1002/anie.200502134
1796-1799. [Poplevina N.V., Kriven’ko A.P., Shche-
67.
Stavber G., Zupana M., Stavber S. Tetrahedron Lett.
lochkova O.A., Golikov A.G., Solodovnikov S.F.
2007, 48, 2671-2673. doi 10.1016/j.tetlet.2007.02.077
Russ. J. Org. Chem. 2009, 45, 1790-1794.] doi 10.1134/
68.
Burger C.C., Barron B.R., Tunge J.A. Synlett. 2006,
S1070428009120070
2824-2826. doi 10.1055/s-2006-950265
84.
Щелочкова О.А., Сорокин В.В., Кривенько А.П.
69.
Parnes R., Kshirsagar U.A., Werbeloff A. Org. Lett.
Бутлеровские сообщения. 2003, 4, 20-21. roi jbc-
2012, 14, 3324-3327. doi 10.1021/ol301297k
01/3-1-1-20
70.
Petersen M.D., Boye S.V., Nielsen E.H., Willumsen J.,
85.
Сорокин В.В., Кривенько А.П., Виноградова Н.А.,
Sinning S., Wiborg O., Bols M. Bioorg. Med. Chem.
Плотников О.П. Хим.-фарм. ж. 2001, 35, 24-26.
2007, 15, 4159-4174. doi 10.1016/j.bmc.2007.03.069
[Sorokin V.V., Kriven’ko A.P., Vinogradova N.A.,
71.
Christensen H.S., Boye S.V., Thinggaard J., Sinning S.,
Plotnikov O.P. Pharm. Chem. J. 2001, 35, 488-490.]
Wiborg O., Schiøtt B., Bols M. Bioorg. Med. Chem.
doi 10.1023/A:1014090608261
2007, 15, 5262-5274. doi 10.1016/j.bmc.2007.05.015
86.
Гейн В.Л.,ПрусаковаА.С.,НосоваН.В., ВахринМ.И.,
72.
Langer P., Schneider T. Synlett. 2000, 497-500. doi
Воронина Е.В., Кривенько А.П. Хим.-фарм. ж.
10.1055/s-2000-6570
2010, 44, 25-27. [Gein V.L., Prusakova A.S., Noso-
73.
Popov S.A., Tkachev A.V. Synth. Сommun. 2001, 31,
va N.V., Vakhrin M.I., Voronina E.V., Kriven’ko A.P.
233-243. doi 10.1081/SCC-100000204
Pharm. Chem. J. 2010, 44, 427-429.] doi 10.1007/
s11094-010-0483-9
74.
Cotman A.E., Cahard D., Mohar B. Angew. Chem., Int.
Ed. 2016, 55, 5294-5298. doi 10.1002/anie.201600812
87.
Yoo K.H., Choi E.B., Lee H.K., Yeon G.H., Yang H.C.,
75.
Novikov V.L., Shestak O.P. Russ. Chem. Bull. 2013, 62,
Pac C.S. Synthesis. 2006, 1599-1612. doi 10.1055/
2171-2190. doi 10.1007/s11172-013-0316-6
s-2006-926463
76.
Украинец И.В., Колесник Е.В., Сидоренко Л.В.,
88.
Becker W.A, Eller G.A., Holzer W. Synthesis. 2005,
Горохова О.В., Туров А.В. ХГС. 2006, 874-886.
2583-2589. doi 10.1055/s-2005-872078
[Ukrainets I.V., Kolesnik E.V., Sidorenko L.V.,
89.
Tapia R.A., López C., Morello A. Synthesis. 2005,
Gorokhova O.V., Turov A.V. Chem. Heterocycl.
903-906. doi 10.1055/s-2005-861802
Compd. 2006, 42, 765-775.] doi 10.1007/s10593-006-
90.
Kotljarov A., Iaroshenko V.O., Volochnyuk D.M.
0159-2
Synthesis.
2009,
3869-3879. doi
10.1055/s-0029-
77.
Ohashi T., Oguro Y., Tanaka T., Shiokawa Z., Tanaka Y.,
1216995
Shibata S., Sato Y., Yamakawa H., Hattori H., Yamamo-
91.
Тонких Н., Страков А., Петрова М., Чернышев В.В.,
to Y., Kondo S., Miyamoto M., Nishihara M., Ishimu-
Щенк Г. ХГС. 2002, 822-827. [Tonkikh N., Strakov A.,
ra Y., Tojo H., Bara A., Sasaki S. Bioorg. Med. Chem.
Petrova M., Chernyshev V.V., Schenk H. Chem.
2012, 20, 5507-5517. doi 10.1016/j.bmc.2012.07.034
Heterocycl. Compd.
2002,
38,
724-729.] doi
78.
Украинец И.В., Березнякова Н.Л., Горохова О.В., Ту-
10.1023/A:1019929622048
ров А.В., Шишкина С.В. ХГС. 2007, 43, 1180-1187.
92.
Cui J., Chai D.I., Miller C., Hao J., Thomas C., Wang J.,
[Ukrainets I.V., Bereznyakova N.L., O.V., Turov A.V.,
Scheidt K.A., Kozmin S.A. J. Org. Chem. 2012, 77,
Shishkina S.V. Chem. Heterocycl. Compd. 2007, 43,
7435-7438. doi 10.1021/jo301061r
1001-1007.] doi 10.1007/s10593-007-0156-0
79.
Dahmen S., Bräse S. Synthesis. 2001, 1431-1449. doi
93.
Liu X-Y. Che C-M. Angew. Chem., Int. Ed. 2009, 48,
10.1055/s-2001-16080
2367-2371. doi 10.1002/anie.200805383
80.
Schinnerl M., Murray J.K., Langenhan J.M.,
94.
Ng E.P.J., Wang Y.-F., Chiba S. Synlett. 2011, 783-786.
Gellman S.H. Eur. J. Org. Chem. 2003, 721-726. doi
doi 10.1055/s-0030-1259920
10.1002/ejoc.200390112
95.
DeAngelis A., Wang D-H., Buchwald S.L. Angew.
81.
Рамазанов А.К., Сорокин В.В., Кривенько А.П.
Chem., Int. Ed. 2013, 52, 3434-3437. doi 10.1002/
Бутлеровские сообщения. 2002, 2, 79-82. roi jbc-
anie.201208544
01/2-2-6-79
96.
Hang C., Li Q., Zhu Y., Katayama H. Synth.
82.
Гейн В.Л., Гейн Н.В., Воронина Э.В., Кривенько А.П.
Commun.
2011,
41,
3318-3324. doi
10.1080/
Хим.-фарм. ж. 2002, 36, 23-26. [Gein V.L., Gein N.V.,
00397911.2010.517892
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
855
97.
Zhu Y.-M., Qin L.-N., Liu R., Ji S-J., Katayama H.
112.
Amirthaganesan S., Aridoss G., Park Y.H., Kim J.S.,
Tetrahedron Lett. 2007, 48, 6262-6266. doi 10.1016/
Son S.M., Jeong Y.T. Heterocycles. 2008, 75, 537-
j.tetlet.2007.07.033
554. doi 10.3987/COM-07-11231
98.
Ermolenko M.S., Guillou S., Janin Y.L. Tetrahedron.
113.
Левандовская Е.Б. Автореф. дис. … канд. фарм.
2013, 69, 257-263. doi 10.1016/j.tet.2012.10.034
наук. Пермь. 2008.
114.
Гейн В.Л., Гейн Н.В., Потемкин К.Д., Кривень-
99.
Kashima C. Heterocycles. 2003, 60, 959-987. doi
ко А.П. ЖОХ. 2004, 74, 1687-1691. [Gein V.L.,
10.3987/REV-02-560
Gein N.V., Potemkin K.D., Kriven’ko A.P. Russ.
100.
Kashima C., Miwa Y., Shibata S., Nakazono H. J.
J. Gen. Chem. 2004, 74, 1564-1568.] doi 10.1007/
Heterocycl. Chem. 2002, 39, 1235-1240. doi 10.1002/
s11176-005-0056-x
jhet.5570390618
115.
Rajanarendar E., Rao E.K., Karunakar D. Indian
101.
Kashima C., Shibata S., Yokoyama H., Nishio T. J.
J. Chem., Sect B. 2006, 45, 805-807.
Heterocycl. Chem. 2003, 40, 773-782. doi 10.1002/
116.
Григорьева Э.А., Сорокин В.В., Кривенько А.П.
jhet.5570400505
Бутлеровские сообщения. 2002, 3, 26-28. roi jbc-
102.
Wu D., Jin F., Lu W., Zhu J., Li C., Wang W., Tang Y.,
01/2-3-11-26
Jiang H., Huang J., Liu G., Li J. Chem. Biol. Drug
117.
Гейн В.Л., Носова Н.В., Потемкин К.Д., Алиев З.Г.,
Des.
2012,
79,
897-906. doi
10.1111/j.1747-
Кривенько А.П. ЖОрХ.
2005,
41,
1039-1044.
0285.2012.01365.x
[Gein V.L., Nosova N.V., Potemkin K.D., Aliev Z.G.,
Kriven’ko A.P. Russ. J. Org. Chem. 2005, 41, 1016-
103.
Van Herk T., Brussee J., van den Nieuwen-
1022.] doi 10.1007/s11178-005-0287-7
dijk A.M.C.H., van der Klein P.A.M., Izerman A.P.,
118.
Рамазанов А.К., Сорокин В.В., Кривенько А.П.
Stannek C., Burmeister A., Lorenzen A. J. Med.
Бутлеровские сообщения. 2002, 6, 81-82. roi jbc-
Chem. 2003, 46, 3945-3951. doi 10.1021/jm030888c
01/or12
104.
Wei G., Wu Y., He X.-L., Liu T., Luo J., Qiu W.-W.
119.
Amirthaganesan S., Mohan R.T.S., Murugavel K.,
Eur. J. Med. Chem. 2017, 131, 48-67. doi 10.1016/
Muthukumaran G., Pandiarajan K. Indian J. Chem.
j.ejmech.2017.03.008
Sect. B. 2007, 46B, 1004-1004.
105.
Li H., Zou H., Gao L., Liu T., Yang F., Li J-Ya., Li J.,
120.
Смирнова Н.О., Плотников О.П., Виноградова Н.А.,
Qiu W.-W., Tang J. Heterocycles. 2012, 85, 1117-
Сорокин В.В., Кривенько А.П. Хим.-фарм. ж.
1139. doi 10.3987/COM-12-12445
1995, 29, 44-45. [Smirnova N.O., Plotnikov O.P.,
106.
Sun L., Li B., Su X., Chen G., Li Y., Yu L., Li L.,
Vinogradova N.A., Sorokin V.V., Kriven’ko A.P.
Wei W. J. Med. Chem. 2017, 60, 6638-6648. doi
Pharm. Chem. J. 1995, 29, 49-50.] doi 10.1007/
10.1021/acs.jmedchem.7b00592
BF02219464
121.
Maharramov A.M., Ismiev A.I., Rashidov B.A. Acta
107.
Gao C., Dai F-J., Cui H-W., Peng S.-H., He Y.,
Crystallogr., Sect. E. 2010, 66, o3030-o3030. doi
Wang X., Yi Z.-F., Qiu W.-W. Chem. Biol. Drug Des.
10.1107/S1600536810043667
2014, 84, 223-233. doi 10.1111/cbdd.12308
122.
Субботин В.Е., Субботин В.В., Кривенько А.П.
108.
Вафина Г.Ф., Галин Ф.З., Хакимова Т.В., Юну-
Хим. хим. технол. 2008, 51, 112-115.
сов М.С. ЖОрХ. 2000, 36, 1709-1717 [Vafina G.F.,
123.
Hote B.S., Lokhande P.D. Synth. Commun. 2014, 44,
Galin F.Z., Khakimova T.V., Yunusov M.S. Russ.
1492-1500. doi 10.1080/00397911.2013.862724
J. Org. Chem. 2000, 36, 1709-1717].
124.
Абеле Э., Абеле Р., Лукевиц Э. ХГС. 2007, 43,
109.
Сорокин В.В., Григорьев А.В., Рамазанов А.К.,
483-493. [Abele E., Abele R., Lukevics E. Chem.
Кривенько А.П. ХГС. 1999, 35, 757-759. [Soro-
Heterocycl. Compd. 2007, 43, 387-407.] doi 10.1007/
kin V.V., Grigor’ev A.V., Ramazanov A.K., Kri-
s10593-007-0057-2
ven’ko A.P. Chem. Heterocycl. Compd. 1999, 35,
125.
Sevenard D.V., Khomutov O.G., Pashkevich K.I.,
671-673.] doi 10.1007/BF02251624
Lork E., Röschenthaler G.-V. Helv. Chim.
110.
Potekhin K.A., Askerov R.K., Hajiyeva K.E., Gadiro-
Acta.
2002,
85,
1960-1972. doi
10.1002/1522-
va N.A., Nazarov S.I. Acta Crystallogr., Sect. E. 2013,
2675 ( 2 0 0 2 0 7 ) 8 5 : 7 < 1 9 6 0 : : A I D -
69, o243-o243. doi 10.1107/S1600536813000937
HLCA1960>3.0.CO;2-6
111.
Maharramov A.M., Ismiev A.I., Rashidov B.A,
126.
Hwang B.H., Choi E.B., Lee H.K., Yang H.C.,
Aliyev I.V. Acta Crystallogr., Sect. E. 2011, 67,
Chung B.Y., Pak C.S. Synthesis. 2008, 22, 3569-3578.
o1127-o1127. doi 10.1107/S1600536811013195
doi 10.1055/s-0028-1083197
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
856
ДЯЧЕНКО и др.
127.
Flores A.F.C., Martins M.A.P., Rosa A., Flores D.C.,
140.
Shelar D.P., Rote R.V., Patil S.R., Jachak M.N.
Zanatta N., Bonacorsso H.G. Synth. Commun. 2002,
Luminescence. 2012, 27, 398-413. doi 10.1002/
32, 1585-1594. doi 10.1081/SCC-120004150
bio.1364
128.
Kashima C., Tsykamoto Y., Miva Y., Higashide K. J.
141.
Faňanás F.J., Arto T., Mendoza A., Rodríguez F. Org.
Heterocycl. Chem. 2001, 38, 601-606. doi 10.1002/
Lett. 2011, 13, 4184-4187. doi 10.1021/ol201655u
jhet.5570380308
142.
Гулякевич О.В., Зайцев В.Г., Михальчук А.Л.
ХГС. 2000, 36, 1092-1098. [Gulyakevich O.V., Zai-
129.
Osborne R., Clarke N., Glossop P., Kenyon A., Liu H.,
tsev V.G., Mikhal’chuk A.L. Chem. Heterocycl.
Patel S., Summerhill S., Jones L.H. J. Med. Chem.
Compd. 2000, 36, 956-962.] doi 10.1007/BF02256981
2011, 54, 6998-7002. doi 10.1021/jm2007535
143.
Kaiho T., San-nohe K., Kajiya S., Suzuki T., Otsuka K.,
130.
Стракова И., Страков А., Петрова М. ХГС. 2002,
Ita T., Kamiya J., Maruyama M. J. Med. Chem. 1989,
38, 494-498. [Strakova I., Strakovs A., Petrova M.
32, 351-357. doi 10.1021/jm00122a012
Chem. Heterocycl. Compd. 2002, 38, 429-433.] doi
144.
Лозинский М.О., Чернега А.Н., Шелякин В.В.
10.1023/A:1016079221645
ЖОрХ. 2002,
38,
1718-1722.
[Lozinskii M.O.,
131.
Gopalakrishnan M., Thanusu J., Kanagarajan V. ХГС.
Chernega A.N., Shelyakin V.V. Russ. J. Org. Chem.
2008, 44, 1183-1188. [Gopalakrishnan M., Thanusu J.,
2002, 38, 1661-1665.] doi 10.1023/A:1022522420258
Kanagarajan V. Chem. Heterocycl. Compd. 2008, 44,
145.
Van Linden O.P.J., Farenc C., Zoutman W.H.,
950-955.] doi 10.1007/s10593-008-0137-y
Hameetmann L., Wijtmans M., Leurs R., Tensen C.P.,
132.
Sevenard D.V., Khomutov O.G., Kodess M.I.,
Siegal G., de Esch I.J.P. Eur. J. Med.Chem. 2012, 47,
Pashkevich K.I., Loop I., Lork E., Röschenthaler G.-V.
493-500. doi 10.1016/j.ejmech.2011.11.020
Can. J. Chem. 2001, 79, 183-194. doi 10.1139/v01-
146.
Van Linden O.P.J., Wijtmans M., Roumen L.,
003
Rotteveel L., Leurs R., de Esch I.J.P. J. Org. Chem.
133.
Илалдинов И.З., Фаткулина Д.А., Кадыров Р.
2012, 77, 7355-7363. doi 10.1021/jo301138w
ЖОрХ. 2011, 47, 933-934. [Ilaldinov I.Z., Fatkuli-
147.
Shestopalov A.M., Shestopalov A.A., Rodinovs-
na D.A., Kadyrov R. Russ. J. Org. Chem. 2011, 47,
kaya L.A. Synthesis. 2008, 1-25. doi 10.1055/s-2007-
952-953.] doi 10.1134/S1070428011060224
990942
134.
Vaickelioniene R., Mickevicius V., Mikulskiene G.
148.
Кузнецов А.Ю., Чапышев С.В. ХГС. 2007, 43,
ХГС.
2004,
40,
895-904.
[Vaickelioniene R.,
1556-1560.
[Kuznetsov A.Yu., Chapyshev S.V.
Mickevicius V., Mikulskiene G. Chem. Heterocycl.
Chem. Heterocycl. Compd. 2007, 43, 1320-1324.] doi
Compd.
2004,
40,
767-775.] doi
10.1023/
10.1007/s10593-007-0200-0
B:COHC.0000040773.29086.36
149.
Кузнецов А.Ю., Нам Н.Л., Чапышев С.В. ХГС.
2007, 43, 762-767. [Kuznetsov A.Yu., Nam N.L.,
135.
Хлебникова Т.С., Исакова В.Г., Лахвич Ф.А., Кур-
Chapyshev S.V. Chem. Heterocycl. Compd. 2007, 43,
ман П.В. ХГС. 2008, 44, 393-400. [Khlebnicova T.S.,
640-645.] doi 10.1007/s10593-007-0100-3
Isacova V.G., Lakhvich F.A., Kurman P.V. Chem.
150.
Кузнецов А.Ю., Чапышев С.В. ХГС. 2007, 43,
Heterocycl. Compd. 2008, 44, 301-308.] doi 10.1007/
1374-1380.
[Kuznetsov A.Yu., Chapyshev S.V.
s10593-008-0044-2
Chem. Heterocycl. Compd. 2007, 43, 1167-1173.] doi
136.
Gemma S., Butini S., Campiani G., Brindisi M.,
10.1007/s10593-007-0179-6
Zanoli S., Romano M.P., Tripaldi P., Savini L., Fiori-
151.
Тонких Н.Н., Страков А.Я., Петрова М.В. ХГС.
ni I., Borrelli G., Novellino E., Maga G. Bioorg.
2000, 30, 212-215. [Tonkikh N.N., Strakov A.Ya.,
Med. Chem. Lett. 2011, 21, 2776-2779. doi 10.1016/
Petrova M.V Chem. Heterocycl. Compd. 2000, 30,
j.bmcl.2010.09.002
174-177.] doi 10.1007/BF02283547
137.
Spilovska K., Korabecny J., Kral J., Horova A.,
152.
Воскресенский Л.Г., Борисова Т.Н., Овчаров М.В.,
Musilek K., Soukup O., Drtinova L., Gazova Z.,
Куликова Л.Н., Сорокина Е.А., Борисов Р.С., Вар-
Siposova K., Kuca K. Molecules. 2013, 18, 2397-
ламов А.В. ХГС.
2008,
44,
1861-1870.
2418. doi 10.3390/molecules18022397
[Voskressensky L.G., Borisova T.N., Ovcharov
138.
Cross R.M., Maignan J.R., Mutka T.S., Luong L.,
M.V., Kulilova L.N., Sorokina E.A., Borisov R.S.,
Sargent J., Kyle D.E., Manetsch R. J. Med. Chem.
Varlamov A.V. Chem. Heterocycl. Compd. 2008, 44,
2011, 54, 4399-4426. doi 10.1021/jm200015a
1510-1519.] doi 10.1007/s10593-009-0217-7
139.
Patil S.R., Shelar D.P., Rote R.V., Jachak M.N.
153.
Hwang J.Y., Windisch M.P., Jo S. Kim K., Kong S.,
J. Fluorescence. 2011, 21, 2037-2052. doi 10.1007/
Kim H.C., Kim S., Kim H., Lee M.E., Kim Y.,
s10895-011-0915-2
Choi J., Park D.-S., Park E., Kwon J., Nam J., Ahn S.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
2-АЦИЛЦИКЛОАЛКАНОНЫ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
857
Cechetto J., Kim J., Liuzzi M., No Z., Lee J. Bioorg.
169.
Hayashi Y., Shoji M., Kishida S. Tetrahedron Lett.
Med. Chem. Lett. 2012, 22, 7297-7301. doi 10.1016/
2005, 46, 681-685. doi 10.1016/j.tetlet.2004.11.119
j.bmcl.2012.10.123
170.
Muthusamy S., Krishnamurthi J., Suresh E. Chem.
154.
Поплевина Н.В., Кузнецова А.А., Кривенько А.П.
Commun. 2007, 861-863. doi 10.1039/B613008A
ХГС.
2010,
46,
1420-1422.
[Poplevina N.V.,
171.
Shcherbakova I., Huang G., Geoffroy O. J., Nair S.K.,
Kuznetsova A.A., Kriven’ko A.P. Chem. Heterocycl.
Swierczek K., Balandrin M.F., Fox J., Heaton W.L.,
Compd. 2010, 46, 1148-1150.] doi 10.1007/s10593-
Conklin R.L. Bioorg. Med. Chem. Lett. 2005, 15,
010-0644-5
2537-2540. doi 10.1016/j.bmcl.2005.03.054
155.
Cai L., Ji X., Yao Z., Xu F., Shen Qi. Chin. J. Chem.
172.
Aburel P.S., Romming C., Ma K., Undheim K.
2011, 29, 1880-1886.
J. Chem. Soc., Perkin Trans. 1. 2001, 1458-1472. doi
156.
Мамедов В.А., Калинин А.А., Губайдуллин А.Т.,
10.1039/B101462P
Литвинов И.А., Левин Я.А. ХГС. 2003, 39, 101-
173.
Hassner A., Bandi C.R., Panchgalle S. Synlett. 2012,
105. [Mamedov V.A., Kalinin A.A., Gubaidullin A.T.,
23, 2773-2776. doi 10.1055/s-0032-1317529
Litvinov I.A., Levin Ya.A. Chem. Heterocycl. Compd.
2003, 39, 96-100.] doi 10.1023/A:1023028927007
174.
Watson F.C., Kilburn J.D. Tetrahedron Lett. 2000, 41,
10341-10345. doi 10.1016/S0040-4039(00)01859-1
157.
Nazeruddin G.M., Pandharpatte M.S., Mulani K.B.
C. R. Chim.
2012,
15,
91-95. doi
10.1016/
175.
Huang F., Browne C.E., Wu W.-M., Juhász A., Ji F.,
j.crci.2011.10.005
Bodor N. Pharm. Res. 2003, 20, 1681-1689. doi
158.
Kumar B.S., Reddy Y.T., Reddy P.N., Kumar P.S.,
10.1023/a:1026160023030
Rajitha B. J. Heterocycl. Chem. 2006, 43, 477-479.
176.
Kriven’ko A.P., Kozlova E.A., Grigor’ev A.V.,
doi 10.1002/jhet.5570430233
Sorokin V.V. Molecules.
2003,
251-255. doi
159.
Smitha G., Reddy C.S. Synth. Сommun. 2004, 34,
10.3390/80200251
3997-4003. doi 10.1081/SCC-200034821
177.
Kier M.J., Leon R.M., O’Rourke N.F., Rhein-
160.
Singh P.R., Singh D.U., Samant S.D. Synlett. 2004,
gold A.L., Micalizio G.C. J. Am. Chem. Soc. 2017,
1909-1912. doi 10.1055/s-2004-830858
139, 12374-12377. doi 10.1021/jacs.7b06286
161.
Rahmatpour A., Mohammadian S. C. R. Chim. 2013,
178.
Qin X.-Y., Chen B.-Y., Fu J.-J., Shan L., Lei X.-G.,
16, 271-278. doi 10.1016/j.crci.2013.01.006
Zhang W.-D. Eur. J. Med. Chem. 2015, 102, 256. doi
162.
Kumar B.S., Kumar P.S., Srinivasulu N., Rajitha B.,
10.1016/j.ejmech.2015.07.051
Reddy Y.T., Reddy P.N., Udupi R.H. ХГC. 2006, 42,
179.
Park C.-H., Chun K., Choi J.-H., Ji W.-K., Kim H.Y.,
197-200. [Kumar B.S., Kumar P.S., Srinivasulu N.,
Kim S.H., Han G., Kim M.-H. Bull. Korean
Rajitha B., Reddy Y.T., Reddy P.N., Udupi R.H.
Chem. Soc. 2011, 32, 1650-1656. doi 10.5012/
Chem. Heterocycl. Compd. 2006, 42, 172-175.] doi
bkcs.2011.32.5.1650
10.1007/s10593-006-0066-6
180.
Valès M., Lokshin V., Pèpe G., Samat A., Guglielmet-
163.
Katkevičs M., Kontijevskis A., Mutule I., Sūna E.
ti R. Synthesis. 2001, 2419-2426. doi 10.1055/
ХГС. 2007, 43, 200-208. [Katkevičs M., Kontijevs-
s-2001-18719
kis A., Mutule I., Sūna E. Chem. Heterocycl. Compd.
181.
Усова Е.Б., Лысенко Л.И., Крапивин Г.Д., Куль-
2007, 43, 151-159.] doi 10.1007/s10593-007-0025-x
невич В.Г. ХГС. 1996, 32, 639-647. [Usova E.B.,
164.
Turner P.A., Griffin E.M., Whatmore J.L., Shipman M.
Lysenko L.I., Krapivin G.D., Kul’nevich V.G. Chem.
Org. Lett.
2011,
13,
1056-1059. doi
10.1021/
Heterocycl. Compd. 1996, 32, 548-554.] doi 10.1007/
ol103103n
BF01164783
165.
Yoshida M., Ohno S., Shishido K. Chem. Eur. J. 2012,
182.
Sharma A., Pandey J., Tripathi R.P. Tetrahedron Lett.
18, 1604-1607. doi 10.1002/chem.201103246
2009, 50, 1812-1816. doi 10.1016/j.tetlet.2009.02.001
166.
Калинин А.А., Исайкина О.Г., Мамедов В.А. ХГС.
183.
Zhao H., Dong J., Lafleur K., Nevado C., Caflisch A.
2007, 43, 1539-1606. [Kalinin A.A., Isaikina O.G.,
ACS Med. Chem. Lett. 2012, 3, 834-838. doi 10.1021/
Mamedov V.A. Chem. Heterocycl. Compd. 2007, 43,
ml3001984
1307-1314.] doi 10.1007/s10593-007-0198-3
167.
Nakatani K., Izawa T., Isoe S. J. Org. Chem. 1994, 59,
184.
Rao H.S.P., Senthilkumar S.P. J. Org. Chem. 2004,
5961-5969. doi 10.1021/jo00099a027
69, 2591-2594. doi 10.1021/jo0353839
168.
Basarab G.S., Jordan D.B., Gehret T.C., Schwartz R.S.
185.
Kawata А., Takata K., Kuninobu Y., Takai K. Angew.
Bioorg. Med. Chem.
2002,
10,
4143-4154. doi
Chem., Int. Ed. 2007, 46, 7793-7795. doi 10.1002/
10.1016/S0968-0896(02)00272-9
anie.200702798
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
858
ДЯЧЕНКО и др.
2-Acylcycloalkanes in Organic Synthesis
V. D. Dyachenkoa, *, S. M. Sukacha, and A. S. Morkovnikb
a Taras Shevchenko Lugansk National University, 91011, Ukraine, Lugansk, ul. Oboronnaya 2
*e-mail: dyachvd@mail.ru
b Research Institute of Physical and Organic Chemistry SFU, 344090, Russia, Rostov-on-Don, pr. Stachki 194/2
Received January 7, 2020; revised January 21, 2020; accepted January 26, 2020
The literature data on the use of 2 acylcycloalkanones in organic synthesis are systematized. The material is
classified according to the type of formation of the reaction products.
Keywords: 2-acylcycloalkanones, enamines, nitrogen-containing heterocycles, pyran, furan, 1,4-diazepine,
spirocyclization
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020