ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 6, с. 909-919
УДК 547.512:547.598
О РЕАКЦИИ ТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА
И 1-МЕТИЛТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА
С 2-БРОМЭТАНСУЛЬФОБРОМИДОМ
© 2020 г. С. Г. Кострюков*, Ю. Ю. Мастерова
ФГБОУ ВО «Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва»,
430005, Россия, Республика Мордовия, г. Саранск, ул. Большевистская 68
*e-mail: kostryukov_sg@mail.ru
Поступила в редакцию 14 ноября 2019 г.
После доработки 25 ноября 2019 г.
Принята к публикации 07 декабря 2019 г.
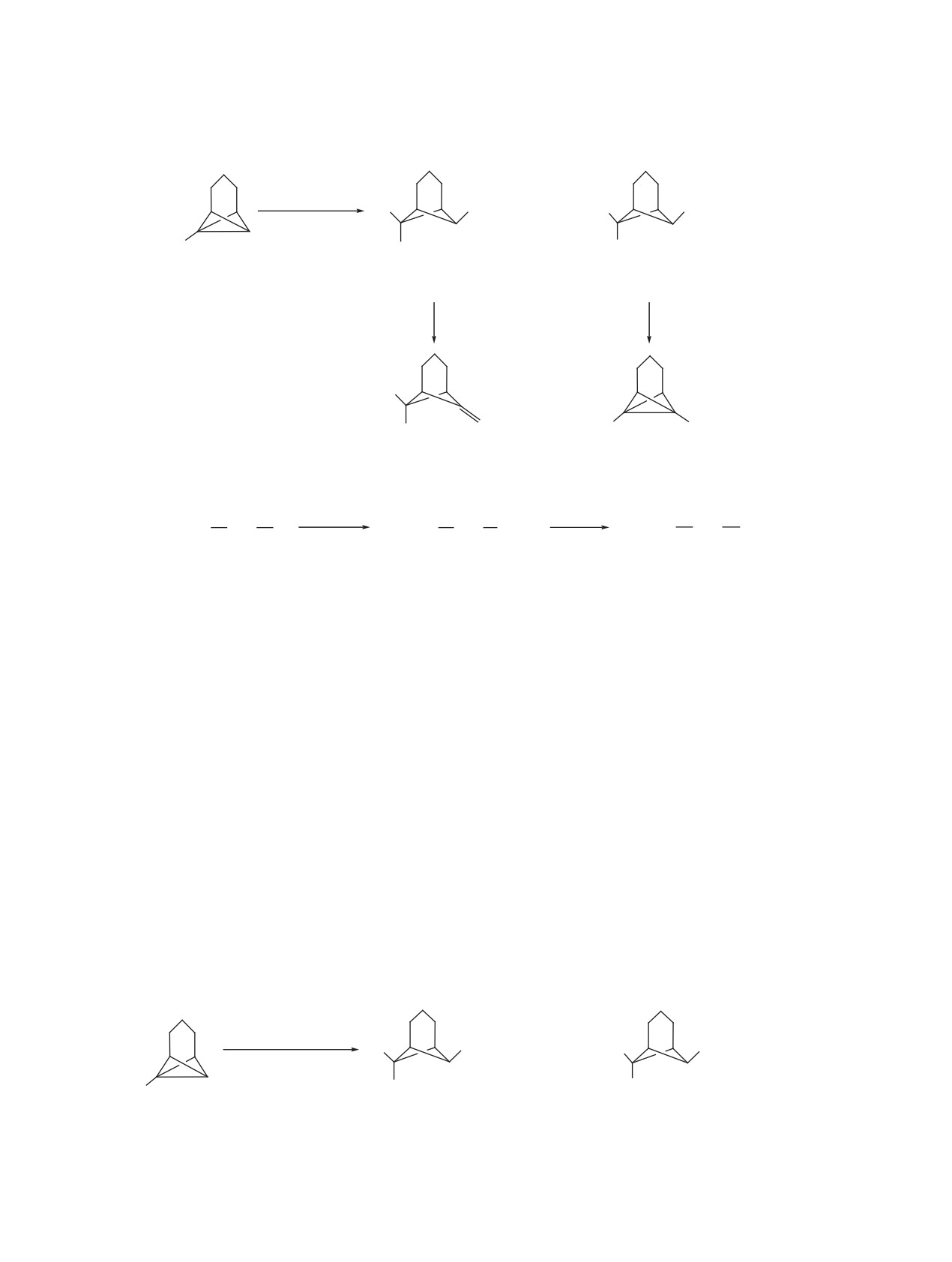
2-Бромэтансульфобромид реагирует с трицикло[4.1.0.02,7]гептаном и 1-метилтрицикло[4.1.0.02,7]геп-
таном по радикальному механизму с образованием продуктов как анти-, так и син-присоединения по
центральной бициклобутановой связи С1-С7 норпинановой структуры. При действии триэтиламина
на полученные аддукты осуществляется 1,2-дегидробромирование, приводящее к винилсульфонам
бицикло[3.1.1]гептанового ряда. При обработке продуктов анти- и син-присоединения метилатом на-
трия наблюдается 1,2- и 1,3-дегидробромирование и нуклеофильное присоединение в зависимости от
мольного соотношения реагентов и структуры исходных субстратов.
Ключевые слова: 2-бромэтансульфобромид, трицикло[4.1.0.02,7]гептан, радикальное присоединение,
бицикло[3.1.1]гептан, дегидробромирование.
DOI: 10.31857/S0514749220060087
Известно [1-4], что α-бромметансульфобромид
1-(бромметилсульфонил)трицикло[4.1.0.02,7]геп-
способен присоединяться по двойной связи алке-
таны (схема 1) [5].
нов с образованием α,β'-дибромсульфонов, кото-
Таким образом, не вызывает сомнений высокий
рые при действии оснований претерпевают про-
синтетический потенциал галогензамещенных
цессы дегидробромирования и десульфонирова-
бромангидридов алкансульфокислот как эффек-
ния, приводящие к образованию сопряженных ди-
тивных реагентов для введения галогеналкилсуль-
енов. Подобным образом бромметансульфобромид
фонильной группы с последующей её трансфор-
реагирует и с соединениями трицикло[4.1.0.02,7]-
мацией.
гептанового ряда 1a, b [5], при этом образуются
С целью расширения ассортимента галогенал-
продукты анти- и син-присоединения бицик-
кансульфогалогенидов нами был синтезирован
ло[3.1.1]гептановой (норпинановой) структуры с
2-бромэтансульфобромид 2 и исследованы его ре-
эндо(син)-ориентацией бромметилсульфонильной
акции с трициклогептанами 1a, b. Следует отме-
группы. Продукты анти-присоединения под дей-
тить, что соединение 2 не описано в литературе.
ствием оснований, например, NaOH в водном ди-
Для его синтеза (схема 2) мы применили метод,
оксане, вступают в реакцию Рамберга-Беклунда, в
предложенный для получения иодметансульфобро-
результате которой образуются производные 6-ме-
мида, заключающийся в обработке натриевой соли
тиленбицикло[3.1.1]гептана. Продукты син-при-
сульфокислоты PBr5 [4]. 2-Бромэтансульфонат на-
соединения при обработке основаниями испыты-
трия получали реакцией избытка 1,2-дибромэтана
вают 1,3-дегидробромирование и превращаются в
с сульфитом натрия [6].
909
910
КОСТРЮКОВ, МАСТЕРОВА
Схема 1.
BrCH2SO2Br
R
SO2CH2Br
Br
SO2CH2Br
+
R
R
Br
1a, b
экзо,син-
эндо,син-
(анти-присоединение)
(син-присоединение)
NaOH
NaOH
R
R
SO2CH2Br
Br
R = H (a), Me (b).
Схема 2.
Na2SO3
PBr5
Br CH
2
CH2
Br
Br CH2
CH2
SO3Na
Br CH2
CH2
SO2Br
2
Реакции трицикло[4.1.0.02,7]гептанов 1a, b с
Реакционные смеси были разделены на инди-
сульфобромидом 2 проводили при простом смеше-
видуальные компоненты с помощью колоночной
нии реагентов в абсолютном CH2Cl2 при 0°С c до-
хроматографии на Al2O3. Строение, в том числе
и конфигурацию, сульфонов 3, 4 определяли с
бавлением безводного карбоната натрия, с после-
помощью ЯМР 1Н и 13С спектроскопии. Так, би-
дующим выдерживанием реакционных смесей на
цикло[3.1.1]гептановая структура соединений 3,
рассеянном солнечном свете при комнатной тем-
4 подтверждается наличием в спектрах ЯМР 13С
пературе до 10 ч, контролируя исчезновение реа-
пяти пиков, соответствующих семи атомам угле-
гента 2 по ТСХ. В каждом случае наблюдали об-
рода остова молекул c ожидаемыми различиями в
разование с высокими препаративными выходами
интенсивностях и химических сдвигах. Отнесение
продуктов присоединения реагента по связи С1-С7
конфигурации заместителей проводили на основа-
трициклогептанов 1a, b - соединений бицик-
нии анализа положения и мультиплетности сигна-
ло[3.1.1]гептановой структуры в виде смеси двух
лов атомов Н6 и Н7 в спектрах ЯМР 1Н с учётом
диастереомеров 3, 4 с преобладанием продукта
известных структурно-спектральных корреляций
анти-присоединения 3a, b (схема 3). Соотношение
в ряду норпинанов [7-9]. Так, триплетный сигнал
изомеров 3a и 4a по данным ЯМР 1Н спектров ре-
атома Н6 в соединениях 3a, 4a и атома Н7 в соеди-
акционных смесей составило 65:35, а изомеров 3b
нениях 3b, 4b указывает на анти-направленность
и 4b - 85:15.
этого протона по отношению к триметиленовому
Схема 3.
4
BrCH2CH2SO2Br
3
5
2
R
SO2CH2CH2Br
SO2CH2CH2Br
2
6
+
Br
СH2Cl
2
1
7
Br
R
R
1a, b
3a, b
4a, b
R = H (a), Me (b).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
О РЕАКЦИИ ТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА И 1-МЕТИЛТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА
911
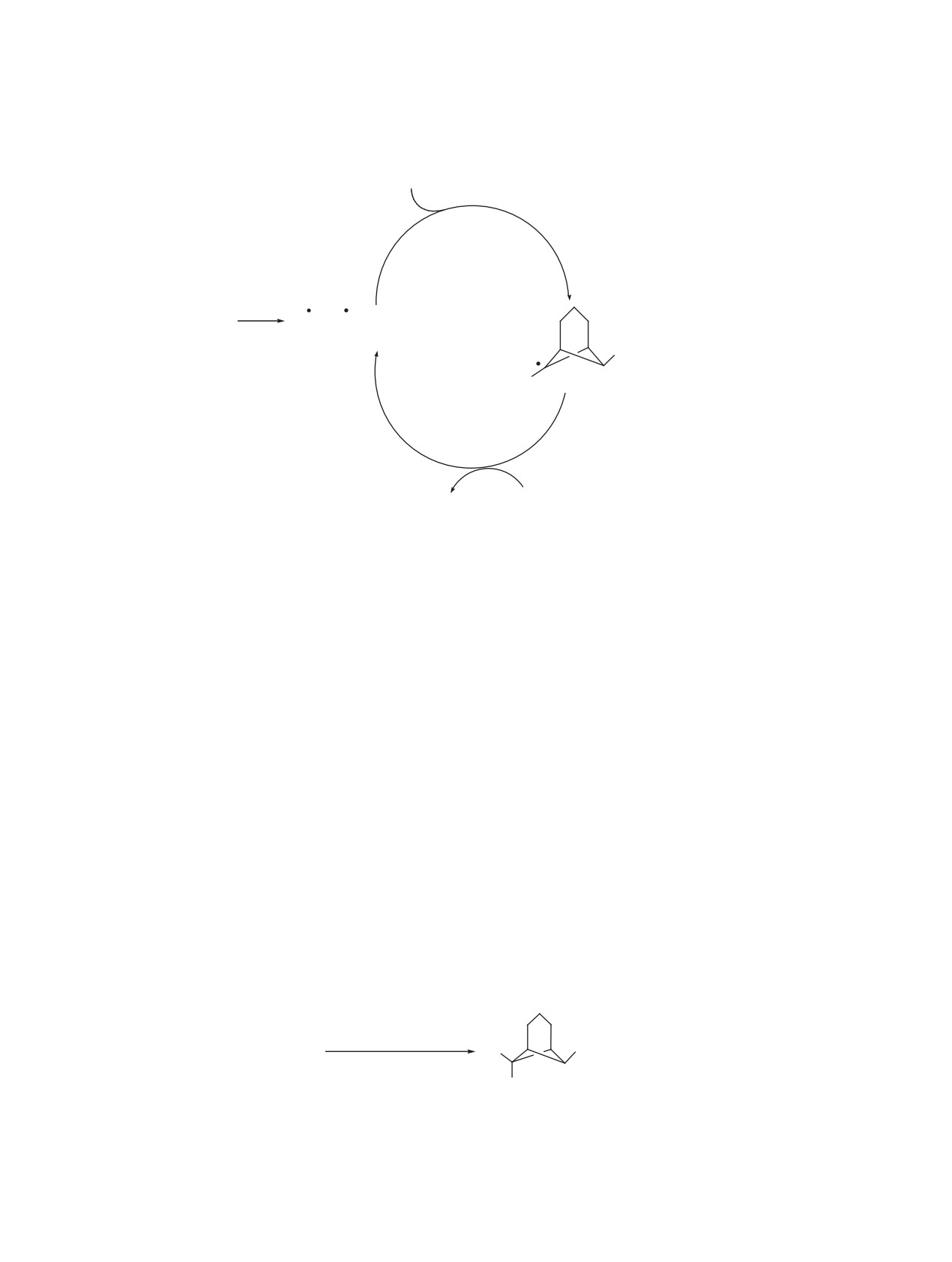
Схема 4.
1
hν
2
Br +
SO2CH2CH2Br
SO2CH2CH2Br
A
R
2
3, 4
мостику. Аналогичным образом эндо-ориентация
ному незамещенному атому С7. Последующая
атома Н7 в соединении 3a определяется по син-
стадия переноса атома брома на бицикло[3.1.1]-
глетному сигналу в спектре ЯМР 1Н. Наличие
гептильный интермедиат осуществляется преиму-
сульфо-группы подтверждается интенсивными
щественно в экзо-положение.
характеристическими полосами в ИК спектрах в
Как видно из приведенных выше данных о
областях ~1130 и ~1330 см-1 [10].
составе реакционных смесей, доля продукта
анти-присоединения возрастает при увеличении
Таким образом, можно констатировать, что
стерического объёма заместителя R в трицикло-
присоединение 2-бромэтансульфобромида к три-
гептановом субстрате.
циклогептанам 1a, b, подобно присоединению
бромметансульфобромида [5], арилсульфогалоге-
2-Бромэтилсульфонильный фрагмент в сульфо-
нидов [7, 9, 11] и ряда других сульфопроизводных
нах 3, 4 позволяет проводить различные трансфор-
[8], осуществляется исключительно по централь-
мации при действии нуклеофилов и оснований.
ной связи С1-С7. На основании аргументов, об-
Нами было установлено, что продукты анти-при-
суждаемых в работах [7-9], для рассматриваемых
соединения 3а, b в реакции с эквимольным ко-
личеством триэтиламина в бензоле или метилата
реакций следует принять радикальный механизм
(схема 4). При этом, как и в других случаях [5],
натрия в метаноле при 0°С легко превращаются в
результате 1,2-дегидробромированияв винилсуль-
реакция инициируется эндо-стереонаправленной
фоны 5a, b (схема 5).
атакой сульфонильного радикала. Такая атака для
1-метилтрицикло[4.1.0.02,7]гептана 1b происходит
Аналогичное превращение происходит и при
региоспецифично по стерически более доступ-
обработке продуктов син-присоединения 4a, b
Схема 5.
Et3N (1 экв), С6Н6
R
SO2CH=CH2
3a, b
или
MeONa (1 экв), МеОН
Br
5a, b
R = H (a), Me (b).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
912
КОСТРЮКОВ, МАСТЕРОВА
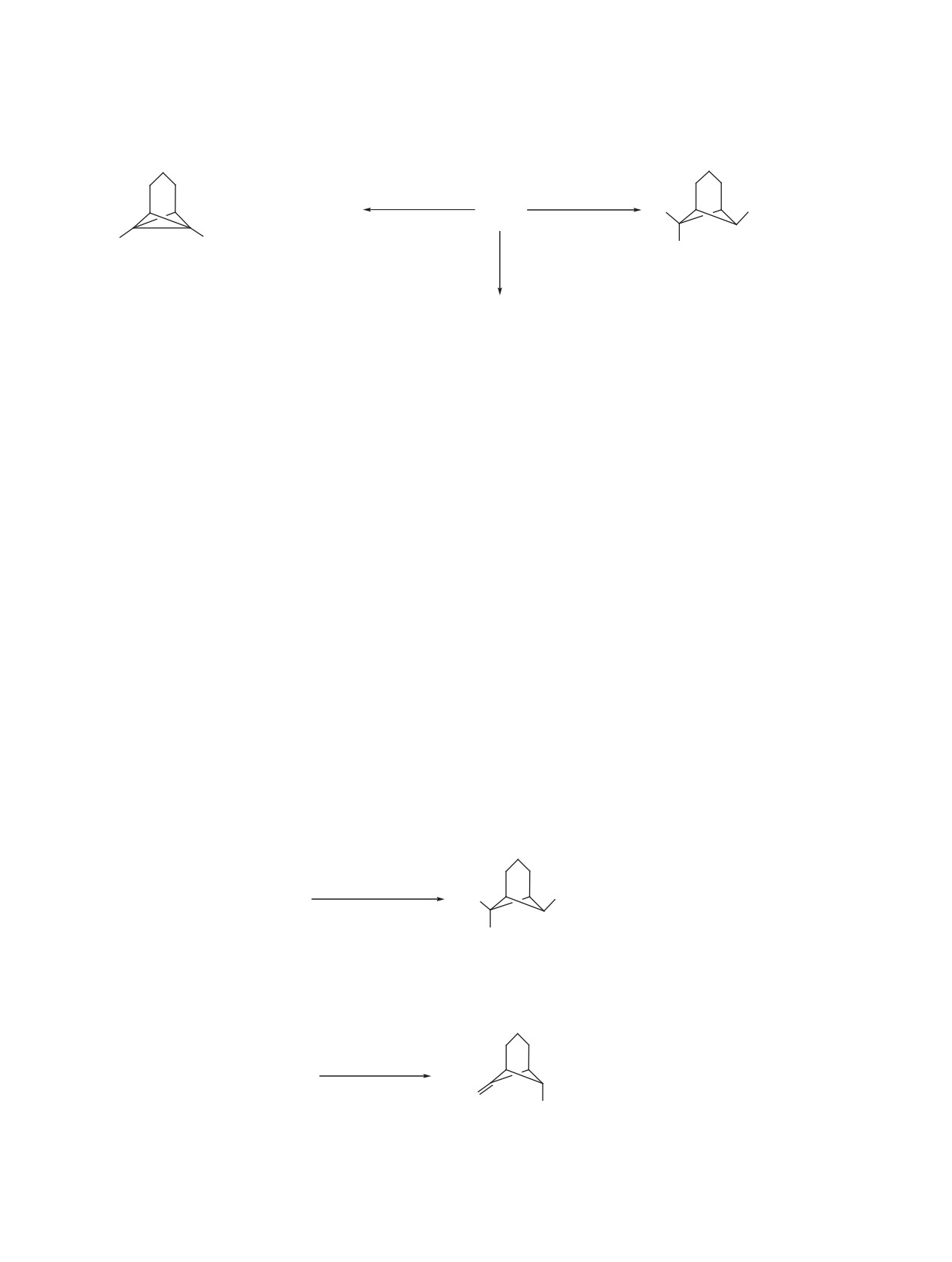
Схема 6.
MeONa (1 экв)
Et3N (1 экв)
+
6a, b
4a, b
Br
SO2CH=CH2
МеОН
С6Н6
R
SO2CH=CH2
MeONa (2 экв)
R
7a, b
МеОН
6a, b
7a, b
R = H (a), Me (b).
триэтиламином. Однако в реакции с метилатом
зование метоксипроизводного 8a в качестве един-
натрия (1 экв.) при 0°С наряду с винилсульфона-
ственного продукта, однако, при нагревании суль-
ми 6а, b также образуются сульфонилзамещённые
фона 3b с тремя эквивалентами метилата натрия в
трициклогептаны 7a, b (схема 6). Соотношение
запаянной ампуле при 90°С был получен норпи-
продуктов рекции 6a и 7a по данным ЯМР 1Н
нан 9 (схема 8), экзо-ориентация сульфонильной
спектров реакционных смесей составило 2.5:1,
группы в котором подтверждается наличием син-
а соединений 6b и 7b - 2.3:1. В то же время, при
глетного сигнала эндо-ориентированного атома
использовании 2-х кратного количества метилата
H6 в спектре ЯМР 1Н. Наблюдаемое превращение
натрия в тех же условиях были получены только
является результатом
1,2-дегидробромирования
трициклогептаны 7a, b (схема 6).
промежуточно образующегося соединения 8b с
последующей эпимеризацией при атоме углерода,
При действии двух эквивалентов метилата на-
несущем сульфонильную группу. Данный резуль-
трия на норпинаны 3a, b при кипячении в мета-
ноле наблюдалось образование соединений 8a, b
тат не является неожиданным, так как ранее была
(схема 7) с сохранением экзо(анти)-ориентиро-
показана термодинамическая предпочтительность
ванного атома брома, что явилось результатом по-
экзо(анти)-ориентации сульфонильной группы в
следовательно протекающих реакций 1,2-дегидро-
6,7-дизамещенных бицикло[3.1.1]гептанах [12].
бромирования и нуклеофильного присоединения
При действии на норпинаны 4а, b трёх эквива-
метоксид-иона к С=С связи винилсульфонильного
лентов метилата натрия наблюдали образование
фрагмента.
сульфонилзамещённых трициклогептанов 10а, b
При обработке сульфона 3a 3-х и 4-х кратным
(схема 9), которые являются продуктами нукле-
избытком метилата натрия также наблюдали обра-
офильного присоединения метоксид-иона по
Схема 7.
MeONa (2 экв)
R
SO2CH2CH2OMe
3a, b
MeOH, 60°C
Br
8a, b
R = H (a), Me (b).
Схема 8.
MeONa (3 экв)
3b
MeOH, 90°C
H2С
SO2CH2CH2OMe
9
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
О РЕАКЦИИ ТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА И 1-МЕТИЛТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА
913
Схема 9.
MeONa (3 экв)
4a, b
МеОН
R
SO2CH2CH2OMe
10a, b
R = H (a), Me (b).
двойной связи винилсульфонильного фрагмента
лельно протекающих реакций 1,2- и 1,3-элимини-
промежуточно образующихся трициклогептанов
рования и дальнейшего нуклеофильного присое-
7a, b.
динения по двойной связи винилсульфонильного
фрагмента и бициклобутановой связи С1-С7. Экзо-
Большая чувствительность двойной связи к ну-
ориентация сульфонильной группы в норпинане
клеофильной атаке по сравнению с бициклобута-
11 подтверждается наличием синглетного сигнала
новой C1-C7 связью подтверждается квантово-хи-
в спектре ЯМР 1Н, соответствующего эндо-ориен-
мическими расчётами. Так, для трициклогептана
тированному атому H6.
7а была проведена полная оптимизация молеку-
лярной геометрии без каких-либо ограничений
Все сульфоны 5-11 получены в индивидуаль-
по симметрии с учетом влияния растворителя
ном состоянии и охарактеризованы ЯМР 1Н, 13С
CH3OH в рамках модели поляризованного конти-
и ИК спектрами, а также данными элементного
нуума РСМ [13]. Данные для учета растворителя
анализа.
(диэлектрическая проницаемость, радиус молеку-
лы) взяты из источника [14]. Для подтверждения
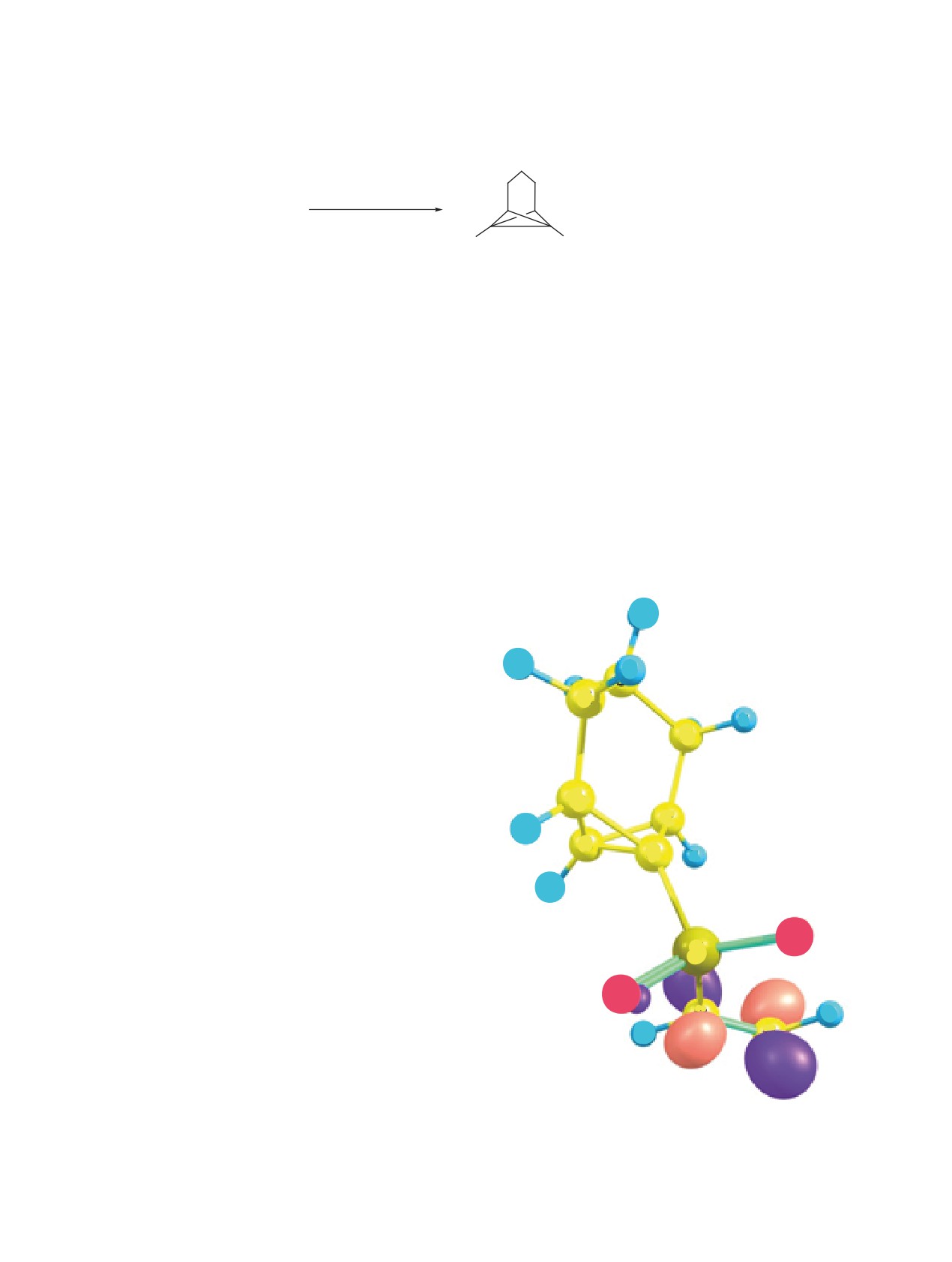
H
достижения истинного минимума в ходе оптими-
зации геометрии рассчитаны частоты нормальных
H
колебаний; отсутствие мнимых частот в колеба-
H
тельном спектре оптимизированной структуры
C
означает, что полученная структура отвечает
H
минимуму на полной поверхности потенциальной
C
энергии. Данные по распределению электронной
плотности для граничных орбиталей трицикло-
гептана 7а были получены методом функционала
C
плотности (DFT) при использовании гибридного
C
H
функционала B3LYP [13] и стандартного базис-
C
C
H
ного набора 6-311G [15] из пакета прикладных
программ Firefly [16]. Как показано на рисунке,
H
НВМО, на которую направлена нуклеофильная
атака, локализована на винильсульфонильном
фрагменте (см. рисунок).
O
S
Соединение 10b оказывается устойчивым к
дальнейшей обработке метилатом натрия, веро-
O
ятно, вследствие стерического экранирования ме-
C
H
C
тильным заместителем реакционного центра для
H
нуклеофильной атаки по атому C7. При нагрева-
нии же соединения 4a в запаянной ампуле до 90°С
с четырьмя эквивалентами метилата натрия было
получено диметоксипроизводное 11 (схема 10),
Локализация низшей вакантной молекулярной орби-
что явилось результатом последовательно и парал-
тали (НВМО) в соединении 7а.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
914
КОСТРЮКОВ, МАСТЕРОВА
Схема 10.
MeONa (4 экв)
MeO
4a
МеОН
SO2CH2CH2OMe
11
Таким образом, 2-бромэтансульфобромид явля-
ным холодильником, помещали 21.1 г (0.1 моль)
ется удобным реагентом для получения диастере-
2-бромэтансульфоната натрия, 51.7 г (0.12 моль)
омерных 2-бромэтилсульфонов бицикло[3.1.1]геп-
PBr5 и 150 мл абсолютного CH2Cl2. Реакционную
танового ряда, которые легко трансформируются
смесь кипятили в течение 6 ч, после чего при на-
в винилсульфонильные производные, вступающие
ружном охлаждении до 0°С в реакционную смесь
в реакции нуклеофильного присоединения. Кроме
внесли примерно 250 г толченого льда. После
того, в случае продуктов син-присоединения в ре-
плавления льда отделяли органическую фазу,
зультате 1,3-дегидробромирования могут быть по-
сушили CaCl2, растворитель удаляли в вакууме
лучены
1-(винилсульфонил)трицикло[4.1.0.02,7]-
(10-20 мм рт.ст.), продукт перегоняли в вакууме
гептаны, для которых, помимо нуклеофильного
(не более 1 мм рт.ст.), собирая фракцию при 80-
присоединения по связи С=С, возможно присое-
90°С, которую перегоняли повторно. Выход 17 г
динение и по С1-С7 бициклобутановой связи.
(67.5%), т.кип. 88-89°С (0.5 мм рт.ст.). ИК спектр,
ν, см-1: 2950 сл, 1364 с (асимм. SO2), 1153 о.с
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(симм. SO2). Спектр ЯМР 1Н, δ, м.д.: 3.75 т (2H,
Спектры ЯМР 1Н и 13С растворов соединений
J 8.0 Гц), 4.18 т (2H, J 7.9 Гц). Спектр ЯМР 13С,
в CDCl3 записаны на спектрометре JEOL JNM-
δ, м.д.: 21.7 (С2), 48.7 (С1). Найдено, %: C 9.59; H
ECX400 (400 и 100 MГц соответственно). В ка-
1.58. C2H4Br2O2S. Вычислено, %: C 9.54; H 1.60.
честве реперных точек при обработке спектров
Реакция трициклогептанов 1a, b с 2-бром-
использованы сигналы остаточных протонов (δ
этансульфобромидом (2) (общая методика). К
7.26 м.д.) и углеродных атомов (δ 77.16 м.д.) дей-
раствору 10 ммоль одного из трициклогептанов
терохлороформа. ИК спектры получены в таблет-
1a, b в 15 мл абсолютного CH2Cl2, содержаще-
ках KBr на Фурье-спектрометре ИнфраЛЮМ ФТ-
го 0.5 г безводного Na2CO3 и охлажденного до
02. Элементные анализы выполнены на СHNS-
0°С, добавляли 2.52 г (10 ммоль) соединения 2.
анализаторе Vario MICRO. Условия аналитической
Реакционную смесь выдерживали в течение 1 ч
ТСХ: адсорбент - Silufol UV-245, элюент - лёг-
при 0°С, а затем при комнатной температуре, кон-
кий петролейный эфир-диэтиловый эфир, 1:1,
тролируя исчезновение сульфобромида по ТСХ.
проявление в иодной камере или УФ светом. Для
По завершении реакции растворитель удаляли в
колоночной хроматографии использовали оксид
вакууме, остаток анализировали методами ТСХ и
алюминия (II степень активности), элюент - лёг-
ЯМР 1Н. Основные продукты выделяли колоноч-
кий петролейный эфир-диэтиловый эфир, 2-3:1.
ной хроматографией на Al2O3 и кристаллизацией.
Температуры плавления соединений определяли в
запаянных стеклянных капиллярах с использова-
7-анти-Бром-6-эндо-(2-бромэтилсульфо-
нием анализатора точки плавления МР-50.
нил)бицикло[3.1.1]гептан
(3a). Выход
1.64 г
(47.5%), т.пл.
112-113°С (CH2Cl2-гексан). ИК
Трицикло[4.1.0.02,7]гептан (1a) [17], 1-метил-
спектр, ν, см-1: 2955 ср, 1454 ср, 1308 с (асимм.
трицикло[4.1.0.02,7]гептан (1b) [18] и 2-бромэтан-
SO2), 1290 с, 1137 о.с (симм. SO2), 1025 ср, 745
сульфонат натрия [6] получены по литературным
с, 690 с. Спектр ЯМР 1Н, δ, м.д.: 1.71-1.80 м (1Н,
данным. Чистота трициклогептанов 1a, b по дан-
эндо-Н3), 1.84-1.94 м (1Н, экзо-Н3), 1.99-2.11 м
ным ГЖХ (40-80°С) составляла 97-98%.
(2Н, эндо-Н2,4), 2.49-2.57 м (2Н, экзо-Н2,4), 3.08
2-Бромэтансульфобромид (2). В круглодон-
уш.д (2Н, Н1,5), 3.45 т (2Н, CH2Br, J 8.0 Гц), 3.65
ную колбу ёмкостью 500 мл, снабжённую обрат-
т (2Н, CH2SO2, J 7.9 Гц), 4.10 с (1Н, син-Н7), 4.27
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
О РЕАКЦИИ ТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА И 1-МЕТИЛТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА
915
т (1Н, экзо-Н6, J 5.8 Гц). Спектр ЯМР 13С, δ, м.д.:
%: C 33.39; H 4.51. C10H16Br2O2S. Вычислено, %:
13.4 (С3), 20.6 (CH2Br), 25.0 (С2,4), 48.7 (С1,5),
C 33.35; H 4.48.
51.2 (С7), 57.0 (CH2SO2), 57.9 (С6). Найдено, %:
Реакции бициклогептанов 3а, b, 4a, b три-
C 31.23; H 4.06. C9H14Br2O2S. Вычислено, %: C
этиламином (общая методика). К раствору
31.24; H 4.08.
0.5 ммоль одного из соединений 3а, b, 4a, b в 5 мл
7-син-Бром-6-эндо-(2-бромэтилсульфонил)-
абсолютного бензола добавляли
0.069 мл
бицикло[3.1.1]гептан (4a). Выход 1.03 г (29.7%),
(0.5 ммоль) триэтиламина в 2 мл бензола. Реак-
т.пл. 99-100°С (CH2Cl2-гексан). ИК спектр, ν,
ционную смесь перемешивали в течение 1 ч при
см-1: 2951 ср, 1450 ср, 1304 с (асимм. SO2), 1288 с,
0°С, выпавший осадок бромида триэтиламмо-
1134 о.с (симм. SO2), 1030 ср, 740 с, 686 с. Спектр
ния отфильтровывали, промывали 10 мл бензола.
ЯМР 1Н, δ, м.д.: 1.75-1.84 м (2Н, Н3), 1.98-2.08 м
Бензольный раствор промывали водой (2×5 мл),
(2Н, эндо-Н2,4), 2.35-2.44 м (2Н, экзо-Н2,4), 3.00
сушили MgSO4. Растворитель отгоняли на ро-
уш.д (2Н, Н1,5), 3.39 т (2Н, CH2Br, J 7.8 Гц), 3.40
торном испарителе и получали кристаллический
т (1Н, анти-Н7, J 5.7 Гц), 3.68 т (2Н, CH2SO2, J
продукт, который анализировали методом ЯМР 1Н
8.0 Гц), 4.41 т (1Н, экзо-Н6, J 5.8 Гц). Спектр
и 13С спектроскопии и затем очищали кристалли-
ЯМР 13С, δ, м.д.: 12.5 (С3), 20.7 (CH2Br), 21.6 (С2,4),
зацией.
45.2 (С1,5), 48.6 (С7), 56.8 (С6), 57.2 (CH2SO2).
7-анти-Бром-6-эндо-(винилсульфонил)би-
Найдено, %: C 31.29; H 4.11. C9H14Br2O2S. Вы-
цикло[3.1.1]гептан (5a). Выход 91 мг (68.6%),
числено, %: C 31.24; H 4.08.
т.пл. 98-99°С (CH2Cl2-гексан). ИК спектр, ν, см-1:
6-экзо-Бром-7-син-(2-бромэтилсульфо-
3091 ср, 2950 ср, 1648 ср (C=C), 1451 ср, 1311 с
нил)-6-эндо-метилбицикло[3.1.1]гептан
(3b).
(асимм. SO2), 1291 с, 1142 о.с (симм. SO2), 1041 ср,
Выход 2.54 г (70.5%), т.пл. 126-127°С (CH2Cl2-
746 с, 695 с. Спектр ЯМР 1Н, δ, м.д.: 1.75-1.80 м
гексан). ИК спектр, ν, см-1: 2963 ср, 1456 ср, 1308
(1Н, эндо-Н3), 1.86-1.97 м (1Н, экзо-Н3), 2.00-2.15
с (асимм. SO2), 1290 с, 1129 о.с (симм. SO2), 1027
м (2Н, эндо-Н2,4), 2.53-2.64 м (2Н, экзо-Н2,4), 3.16
ср, 743 с, 681 с. Спектр ЯМР 1Н, δ, м.д.: 1.45-1.55
уш.д (2Н, Н1,5), 4.11 c (1Н, син-Н7, J 5.7 Гц), 4.47 т
м (1Н, эндо-Н3), 1.57-1.69 м (1Н, экзо-Н3), 1.92 с
(1Н, экзо-Н6, J 5.8 Гц), 6.57 д.д (1H, СН2=, J 10.7,
(3Н, СН3), 1.94-2.17 м (2Н, эндо-Н2,4), 2.28-2.50
1.8 Гц), 7.08 д.д (1H, СН2=, J 17.1, 1.8 Гц), 7.60 д.д
м (2Н, экзо-Н2,4), 3.09 уш.д (2Н, Н1,5), 3.44 т (2Н,
(1H, SO2СН=, J 17.1, 10.7 Гц). Спектр ЯМР 13С,
CH2Br, J 7.9 Гц), 3.61 т (2Н, CH2SO2, J 7.9 Гц), 4.59
δ, м.д.: 13.5 (С3), 25.1 (С2,4), 49.3 (С1,5), 51.8 (С7),
т (1Н, анти-Н7, J 5.7 Гц). Спектр ЯМР 13С, δ, м.д.:
58.1 (С6), 130.5 (CH2=), 137.2 (=CHSO2). Найдено,
12.3 (С3), 20.6 (CH2Br), 23.8 (С2,4), 23.8 (СН3), 53.4
%: C 40.71; H 4.90. C9H13BrO2S. Вычислено, %: C
(С1,5), 57.1 (CH2SO2), 57.8 (С7), 68.1 (С6). Найдено,
40.77; H 4.94.
%: C 33.39; H 4.51. C10H16Br2O2S. Вычислено, %:
7-син-Бром-6-эндо-(винилсульфонил)бицик-
C 33.35; H 4.48.
ло[3.1.1]гептан (6a). Выход 86 мг (65.0%), т.пл.
6-эндо-Бром-7-син-(2-бромэтилсульфонил)-
81-82°С (CH2Cl2-гексан). ИК спектр, ν, см-1:
6-экзо-метилбицикло[3.1.1]гептан
(4b). Выход
3090 ср, 2949 ср, 1647 ср (C=C), 1448 ср, 1310 с
0.29 г (8.0%), т.пл. 95-96°С (CH2Cl2-гексан). ИК
(асимм.SO2), 1295 с, 1139 о.с (симм.SO2), 1031 ср,
спектр, ν, см-1: 2961 ср, 1450 ср, 1304 с (асимм.
745 с, 690 с. Спектр ЯМР 1Н, δ, м.д.: 1.55-1.74 м
SO2), 1288 с, 1134 о.с (симм. SO2), 1030 ср, 740
(2Н, Н3), 1.78-1.98 м (2Н, эндо-Н2,4), 2.15-2.34 м
с, 686 с. Спектр ЯМР 1Н, δ, м.д.: 1.72-1.83 м (1Н,
(2Н, экзо-Н2,4), 2.93 уш.д (2Н, Н1,5), 3.40 т (1Н,
эндо-Н3), 1.87-1.96 м (1Н, экзо-Н3), 2.12 с (3Н,
анти-Н7, J 5.7 Гц), 4.56 т (1Н, экзо-Н6, J 5.8 Гц),
СН3), 2.10-2.27 м (2Н, эндо-Н2,4), 2.38-2.58 м (2Н,
6.56 д.д (1H, СН2=, J 10.7, 1.8 Гц), 7.06 д.д (1H,
экзо-Н2,4), 2.90 уш.д (2Н, Н1,5), 3.40 т (2Н, CH2Br,
СН2=, J 17.1, 1.8 Гц), 7.65 д.д (1H, SO2СН=, J 17.1,
J 8.0 Гц), 3.59 т (2Н, CH2SO2, J 7.9 Гц), 3.85 т (1Н,
10.7 Гц). Спектр ЯМР 13С, δ, м.д.: 12.5 (С3), 20.7
анти-Н7, J 5.7 Гц). Спектр ЯМР 13С, δ, м.д.: 12.7
(С2,4), 44.8 (С1,5), 47.2 (С7), 55.4 (С6), 130.5 (CH2=),
(С3), 20.5 (CH2Br), 25.2 (С2,4), 29.0 (СН3), 51.2
137.1 (=CHSO2). Найдено, %: C 40.71; H 4.90.
(С1,5), 54.4 (С7), 57.2 (CH2SO2), 66.3 (С6). Найдено,
C9H13BrO2S. Вычислено, %: C 40.77; H 4.94.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
916
КОСТРЮКОВ, МАСТЕРОВА
6-экзо-Бром-7-син-винилсульфонил-6-
тодика). К раствору 0.5 ммоль одного из соедине-
эндо-метилбицикло[3.1.1]гептан
(5b). Выход
ний 3a, b в 10 мл абсолютного метанола добавляли
94 мг (67.4%), т.пл. 74-75°С (CH2Cl2-гексан). ИК
2 мл 0.5 M раствора метилата натрия в метаноле.
спектр, ν, см-1: 3092 ср, 2959 ср, 1644 ср (C=C),
Реакционную смесь кипятили при перемешивании
1452 ср, 1314 с (асимм. SO2), 1289 с, 1140 о.с
в течение 1 ч, после чего метанол удаляли в вакуу-
(симм. SO2), 1037 ср, 745 с, 680 с. Спектр ЯМР
ме, остаток растворяли в 15 мл CH2Cl2 и промыва-
1Н, δ, м.д.: 1.65-1.75 м (1Н, эндо-Н3), 1.80-1.90
ли водой (2×5 мл), сушили MgSO4. Растворитель
м (1Н, экзо-Н3), 2.13 с (3Н, СН3), 2.01-2.21 м
отгоняли на роторном испарителе и получали кри-
(2Н, эндо-Н2,4), 2.30-2.49 м (2Н, экзо-Н2,4), 2.91
сталлический продукт, который анализировали
уш.д (2Н, Н1,5), 4.31 т (1Н, анти-Н7, J 5.7 Гц),
методом ЯМР 1Н и 13С спектроскопии и затем очи-
6.61 д.д (1H, СН2=, J 10.7, 1.8 Гц), 7.10 д.д (1H,
щали кристаллизацией.
СН2=, J 17.1, 1.8 Гц), 7.63 д.д (1H, SO2СН=, J 17.1,
7-анти-Бром-6-эндо-(2-метоксиэтилсульфо-
10.7 Гц). Спектр ЯМР 13С, δ, м.д.: 13.7 (С3), 25.2
нил)бицикло[3.1.1]гептан
(8a). Выход
96 мг
(С2,4), 29.5 (СН3), 51.9 (С1,5), 54.3 (С7), 65.3 (С6),
(64.6%), т.пл. 68-69°С (CH2Cl2-гексан). ИК спектр,
129.9 (CH2=),
138.0
(=CHSO2). Найдено, %: C
ν, см-1: 2950 ср, 2858 ср, 1450 cр, 1335 с (асимм.
43.06; H 4.47. C10H15BrO2S. Вычислено, %: C
SO2), 1261 ср, 1215 ср, 1133 о.с (симм. SO2), 1109
43.02; H 5.42.
с, 1091 с, 1048 ср, 749 с, 660 ср. Спектр ЯМР 1Н,
6-эндо-Бром-7-син-винилсульфонил-6-
δ, м.д.: 1.70-1.80 м (1Н, эндо-Н3), 1.83-1.94 м (1Н,
экзо-метилбицикло[3.1.1]гептан
(6b). Выход
экзо-Н3), 2.00-2.08 м (2Н, эндо-Н2,4), 2.52-2.59
94 мг (67.4%), т.пл. 74-75°С (CH2Cl2-гексан). ИК
м (2Н, экзо-Н2,4), 2.98 уш.с (2Н, Н1,5), 3.38c (3H,
спектр, ν, см-1: 3089 ср, 2956 ср, 1646 ср (C=C),
CH3O), 3.16 т (2Н, CH2SO2, J 5.4 Гц), 3.80 т (2Н,
1453 ср, 1310 с (асимм.SO2), 1290 с, 1135 о.с
CH2О, J 5.1 Гц), 4.09 с (1Н, син-Н7), 4.38 т (1Н,
(симм.SO2), 1040 ср, 740 с, 686 с. Спектр ЯМР
экзо-Н6, J 5.7 Гц). Спектр ЯМР 13С, δ, м.д.: 13.9
1Н, δ, м.д.: 1.70-1.80 м (1Н, эндо-Н3), 1.83-1.94
(С3), 23.7 (С2,4), 41.2 (С1,5), 51.3 (CH2SO2), 57.9
м (1Н, экзо-Н3), 2.10 с (3Н, СН3), 2.08-2.24 м
(С7), 58.8 (CH3О), 59.6 (СН2О), 63.2 (С6). Найдено,
(2Н, эндо-Н2,4), 2.34-2.54 м (2Н, экзо-Н2,4), 2.86
%: C 40.43; H 5.76. C10H17BrO3S. Вычислено, %: C
уш.д (2Н, Н1,5), 3.92 т (1Н, анти-Н7, J 5.7 Гц),
40.41; H 5.77.
6.57 д.д (1H, СН2=, J 10.7, 1.8 Гц), 7.08 д.д (1H,
СН2=, J 17.1, 1.8 Гц), 7.60 д.д (1H, SO2СН=, J 17.1,
6-экзо-Бром-6-эндо-метил-7-син-(2-метокси-
10.7 Гц). Спектр ЯМР 13С, δ, м.д.: 12.8 (С3), 25.2
этилсульфонил)бицикло[3.1.1]гептан (8b). Вы-
(С2,4), 29.3 (СН3), 51.4 (С1,5), 54.3 (С7), 66.5 (С6),
ход 121 мг (78.0%), т.пл. 139-140°С (CH2Cl2-
130.8 (CH2=),
138.9
(=CHSO2). Найдено, %: C
гексан). ИК спектр, ν, см-1: 2950 ср, 1453 cр, 1330
43.06; H 4.47. C10H15BrO2S. Вычислено, %: C
с (асимм. SO2), 1267 ср, 1210 ср, 1139 о.с (симм.
43.02; H 5.42.
SO2), 1110 с, 1093 с, 1059 ср, 745 с, 659 ср. Спектр
ЯМР 1Н, δ, м.д.: 1.34-1.49 м (1Н, эндо-Н3), 1.53-
Реакции бициклогептанов 3а, b, 4a, b с экви-
1.64 м (1Н, экзо-Н3), 1.92 с (3Н, СН3), 1.93-2.15
мольным количеством метилата натрия (общая
м (2Н, эндо-Н2,4), 2.24-2.43 м (2Н, экзо-Н2,4), 3.06
методика). К раствору 0.5 ммоль одного из соеди-
уш.с (2Н, Н1,5), 3.21 c (3H, CH3O), 3.56 т (2Н,
нений 3а, b, 4a, b в 10 мл абсолютного метанола
CH2SО2, J 4.8 Гц), 3.75 т (2Н, CH2O, J 4.9 Гц), 4.56
добавляли 1 мл 0.5 M раствора метилата натрия
т (1Н, анти-Н7, J 5.8 Гц). Спектр ЯМР 13С, δ, м.д.:
в метаноле. Реакционную смесь перемешивали в
12.2 (С3), 22.8 (С2,4), 23.8 (СН3), 52.3 (С1,5), 57.2
течение 1 ч при 0°С, метанол удаляли в вакууме,
(CH3О), 57.3 (CH2SO2), 58.0 (С7), 65.5 (CH2О), 67.8
остаток растворяли в 15 мл CH2Cl2 и промывали
(С6). Найдено, %: C 42.49; H 6.17. C11H19BrO3S.
водой (2×5 мл), сушили MgSO4. Растворитель от-
Вычислено, %: C 42.45; H 6.15.
гоняли на роторном испарителе и получали кри-
сталлический продукт, который анализировали
Реакции бициклогептанов 4а, b с 2-х крат-
методом ЯМР 1Н и 13С спектроскопии.
ным количеством метилата натрия (общая ме-
Реакция бициклогептанов 3a, b с 2-х крат-
тодика). К раствору 0.5 ммоль одного из соедине-
ным количеством метилата натрия (общая ме-
ний 4а, b в 10 мл абсолютного метанола добавляли
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
О РЕАКЦИИ ТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА И 1-МЕТИЛТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА
917
2 мл 0.5 M раствора метилата натрия в метаноле.
гоняли на роторном испарителе и получали кри-
Реакционную смесь перемешивали в течение
сталлический продукт, который анализировали
1 ч при 0°С, метанол удаляли в вакууме, остаток
методом ЯМР 1Н и 13С спектроскопии и затем очи-
растворяли в 15 мл CH2Cl2 и промывали водой
щали кристаллизацией.
(2×5 мл), сушили MgSO4. Растворитель отгоняли
7-анти-Бром-6-эндо-(2-метоксиэтилсульфо-
на роторном испарителе и получали кристалли-
нил)бицикло[3.1.1]гептан (8a). Выход 180 мг
ческий продукт, который анализировали методом
(60.5%).
ЯМР 1Н и 13С спектроскопии и затем очищали
кристаллизацией.
7-Метилен-6-экзо-(2-метоксиэтилсульфо-
нил)бицикло[3.1.1]гептан
(9). Выход
145 мг
1-(Винилсульфонил)трицикло[4.1.0.02,7]-
(63.0%), т.пл. 94-95°С (эфир-гексан). ИК спектр,
гептан (7a). Выход 66 мг (72.0%), т.пл. 55-56°С
ν, см-1: 3095 ср, 2950 ср, 1660 ср, 1451 cр, 1332
(эфир-гексан). ИК спектр, ν, см-1: 3090 сл, 2950
с (асимм. SO2), 1266 ср, 1211 ср, 1133 о.с (симм.
ср, 1642 ср (C=C), 1485 ср, 1450 cр, 1331 с (асимм.
SO2), 1117 с, 1090 с, 1059 ср, 890 ср, 749 с, 661
SO2), 1210 ср, 1140 о.с (симм. SO2), 1120 ср, 755 с,
ср. Спектр ЯМР 1Н, δ, м.д.: 1.37-1.44 м (1Н, эн-
661 ср. Спектр ЯМР 1Н, δ, м.д.: 1.21-1.48 м (2Н,
до-Н3), 1.50-1.60 м (1Н, экзо-Н3), 1.91-2.12 м
Н4), 1.50-1.64 м (4Н, Н3,5), 2.78 т (1Н, Н7, J 3.0 Гц),
(2Н, эндо-Н2,4), 2.19-2.34 м (2Н, экзо-Н2,4), 3.01
3.29 уш.с (2Н, Н2,6), 6.49 д.д (1H, СН2=, J 10.7,
уш.с (2Н, Н1,5), 3.24 c (3H, CH3O), 3.56 с (1Н,
1.8 Гц), 7.01 д.д (1H, СН2=, J 17.1, 1.8 Гц), 7.61 д.д
эндо-Н6), 3.61 т (2Н, CH2SO2, J 4.9 Гц), 3.78 т (2Н,
(1H, SO2СН=, J 17.1, 10.7 Гц). Спектр ЯМР 13С, δ,
CH2О, J 5.0 Гц), 5.09 с (2Н, СН2=). Спектр ЯМР
м.д.: 19.6 (С3,5), 20.1 (С4), 21.8 (С7), 30.4 (С1), 49.0
13С, δ, м.д.: 12.5 (С3), 23.1 (С2,4), 53.0 (С1,5), 58.5
(С2,6), 130.3 (CH2=), 136.8 (=CHSO2). Найдено, %:
(CH2SO2), 58.1 (С6), 59.4 (СН3О), 65.5 (CH2О),
C 58.70; H 6.54. C9H12O2S. Вычислено, %: C 58.67;
115.6 (СН2=), 130.1 (С7). Найдено, %: C 57.34; H
H 6.56.
S. Вычислено, %: C 57.36; H 7.88.
7.81. C11H18O3
1-Винилсульфонил-7-метилтрицикло-
Реакция бициклогептанов 4a, b с 3-х крат-
[4.1.0.02,7]гептан (7b). Выход
70 мг
(70.8%),
ным количеством метилата натрия (общая ме-
т.пл. 49-50°С (эфир-гексан). ИК спектр, ν, см-1:
тодика). К раствору 0.5 ммоль одного из соедине-
3093 сл, 2950 ср, 1643 ср (C=C), 1487 ср, 1454
ний 4а, b в 10 мл абсолютного метанола добавляли
cр, 1334 с (асимм. SO2), 1215 ср, 1143 о.с (симм.
3 мл 0.5 M раствора метилата натрия в метаноле.
SO2), 1122 ср, 760 с, 665 ср. Спектр ЯМР 1Н, δ,
Реакционную смесь перемешивали в течение
м.д.: 1.20-1.46 м (2Н, Н4), 1.47-1.60 м (4Н, Н3,5),
5 ч при кипячении, после чего метанол удаляли
1.91 c (3H, CH3), 3.09 уш.с (2Н, Н2,6), 6.48 д.д (1H,
СН2=, J 10.7, 1.8 Гц), 6.91 д.д (1H, СН2=, J 17.1,
в вакууме, остаток растворяли в 15 мл CH2Cl2
и промывали водой (2×5 мл), сушили MgSO4.
1.8 Гц), 7.59 д.д (1H, SO2СН=, J 17.1, 10.7 Гц).
Спектр ЯМР 13С, δ, м.д.: 12.1 (CH3), 19.8 (С3,5),
Растворитель отгоняли на роторном испарителе и
20.1 (С4), 27.5 (С7), 30.5 (С1), 49.4 (С2,6), 130.3
получали кристаллический продукт, который ана-
(CH2=), 136.7 (=CHSO2). Найдено, %: C 60.60; H
лизировали методом ЯМР 1Н и 13С спектроскопии
7.14. C10H14O2S. Вычислено, %: C 60.58; H 7.12.
и затем очищали кристаллизацией.
Реакция бициклогептанов 3a, b с 3-х крат-
1-(2-Метоксиэтилсульфонил)трицикло-
ным количеством метилата натрия (общая ме-
[4.1.0.02,7]гептан (10a). Выход 81 мг (74.9%), т.пл.
тодика). К раствору 1 ммоль одного из соедине-
48-49°С (эфир-гексан). ИК спектр, ν, см-1: 3095
ний 3a, b в 10 мл абсолютного метанола добавляли
сл, 2856 ср, 1451 cр, 1332 с (асимм. SO2), 1212
6 мл 0.5 M раствора метилата натрия в метаноле.
ср, 1142 о.с (симм. SO2), 1120 ср, 1091 с, 1058 ср,
Реакционную смесь запаивали в ампулу и нагрева-
890 ср, 665 ср. Спектр ЯМР 1Н, δ, м.д.: 1.32-1.51
ли при 90°С в течение 2 ч. После окончания нагре-
м (2Н, Н4), 1.65-1.76 м (4Н, Н3,5), 2.21 т (1Н, Н7,
ва ампулу вскрывали, метанол удаляли в вакууме,
J 3.0 Гц), 3.20 c (3H, CH3O), 3.27 уш.с (2Н, Н2,6),
остаток растворяли в 20 мл CH2Cl2 и промывали
3.65 т (2Н, CH2SO2, J 5.1 Гц), 3.88 т (2Н, CH2О, J
водой (2×5 мл), сушили MgSO4. Растворитель от-
5.0 Гц). Спектр ЯМР 13С, δ, м.д.: 20.1 (С3,5), 21.1
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
918
КОСТРЮКОВ, МАСТЕРОВА
(С4), 22.3 (С7), 44.4 (С1), 47.5 (С2,6), 53.3 (CH2SO2),
1Н, δ, м.д.: 1.50-1.62 м (1Н, эндо-Н3), 1.65-1.76 м
58.8 (CH3О), 59.7 (СН2О). Найдено, %: C 55.59; H
(1Н, экзо-Н3), 1.80-1.90 м (2Н, эндо-Н2,4), 2.03-
7.44. C10H16O3S. Вычислено, %: C 55.53; H 7.46.
2.14 м (2Н, экзо-Н2,4), 3.07 уш.с (2Н, Н1,5), 3.28 c
(3H, CH3O), 3.20 т (2Н, CH2О, J 5.1 Гц), 3.79 т (2Н,
7-Метил-1-(2-метоксиэтилсульфонил)-
CH2SO2, J 5.1 Гц), 3.36 с (3Н, СН3O), 3.35 с (1Н,
трицикло[4.1.0.02,7]гептан (10b). Выход 79 мг
эндо-Н6), 4.32 т (1Н, анти-Н7, J 5.8 Гц). Спектр
(68.7%), т.пл. 52-53°С (эфир-гексан). ИК спектр,
ЯМР 13С, δ, м.д.: 14.3 (С3), 23.0 (С2,4), 40.8 (С1,5),
ν, см-1: 3098 сл, 2859 ср, 1460 cр, 1335 с (асимм.
53.3 (CH2SO2), 55.8 (CH3О), 66.0 (С6), 58.8 (CH3О),
SO2), 1210 ср, 1146 о.с (симм. SO2), 1121 ср, 1091
59.6 (СН2О), 73.2 (С7). Найдено, %: C 53.22; H 8.11.
с, 1058 ср, 890 ср, 665 ср. Спектр ЯМР 1Н, δ, м.д.:
C11H20O4S. Вычислено, %: C 53.20; H 8.12.
1.34-1.50 м (2Н, Н4), 1.55 c (3H, CH3), 1.67-1.75 м
(4Н, Н3,5), 3.22 c (3H, CH3O), 3.24 уш.с (2Н, Н2,6),
КОНФЛИКТ ИНТЕРЕСОВ
3.71 т (2Н, CH2О, J 5.2 Гц), 3.58 т (2Н, CH2SO2, J
Авторы заявляют об отсутствии конфликта ин-
5.1 Гц). Спектр ЯМР 13С, δ, м.д.: 20.3 (С3,5), 21.0
тересов.
(С4), 21.9 (CH3), 27.5 (С7), 44.8 (С1), 47.5 (С2,6),
52.7 (CH2SO2), 58.2 (CH3О), 59.8 (СН2О). Найдено,
СПИСОК ЛИТЕРАТУРЫ
%: C 57.39; H 7.85. C11H18O3S. Вычислено, %: C
1.
Block E., Aslam M. J. Am. Chem. Soc. 1983, 105,
57.36; H 7.88.
6164-6165. doi 10.1021/ja00357a040
Реакция бициклогептанов 3а, b, 4a, b с 4-х
2.
Block E., Aslam M., Eswarakrishnan V., Wall A.
J. Am. Chem. Soc. 1983, 105, 6165-6167. doi 10.1021/
кратным количеством метилата натрия (общая
ja00357a041
методика). К раствору 0.5 ммоль одного из соеди-
нений 3а, b, 4a, b в 10 мл абсолютного метанола
3.
Block E., Eswarakrishnan V., Gebreyes K. Tetrahed-
ron Lett. 1984, 25, 5469-5472. doi 10.1016/s0040-
добавляли 4 мл 0.5 M раствора метилата натрия в
4039(01)81601-4
метаноле. Реакционную смесь нагревали в запаян-
ной ампуле при 90°С в течение 10 ч, после чего ам-
4.
Block E., Aslam M., Eswarakrishnan V., Gebreyes K.,
Hutchinson J., Iyer R., Laffitte J.A., Wall A. J. Am.
пулу вскрывали, метанол удаляли в вакууме, оста-
Chem. Soc. 1986, 108, 4568-4580. doi 10.1021/
ток растворяли в 15 мл CH2Cl2 и промывали водой
ja00275a051
(2×5 мл), сушили MgSO4. Растворитель отгоняли
5.
Васин В.А., Кострюков С.Г., Романова Э.В., Болу-
на роторном испарителе и получали кристалли-
шева И.Ю., Разин В.В. ЖОрХ. 1996, 32, 1701-1708.
ческий продукт, который анализировали методом
6.
Синт. орг. преп. 1949, 2, 124.
ЯМР 1Н и 13С спектроскопии и затем очищали
кристаллизацией.
7.
Васин В.А., Болушева И.Ю., Черняева Л.А., Сурми-
на Л.С., Зефиров Н.С. ЖОрХ. 1990, 26, 1509-1515.
7-анти-Бром-6-эндо-(2-метоксиэтилсульфо-
8.
Васин В.А., Кострюков С.Г., Разин В.В., Зефи-
нил)бицикло[3.1.1]гептан
(8a). Выход
91 мг
ров Н.С. ЖОрХ. 1994, 30, 680-685.
(61.3%).
9.
Васин В.А., Кострюков С.Г., Разин В.В., Болуше-
6-Метилен-7-анти-(2-метоксиэтилсуль-
ва И.Ю., Зефиров Н.С. ЖОрХ. 1994, 30, 1351-1359.
фонил)бицикло[3.1.1]гептан (9). Выход 81 мг
10.
Сильверстейн Р., Вебстер Ф., Кимл Д. Спектрофо-
(70.4%).
тометрическая идентификация органических сое-
динений. М.: БИНОМ. Лаборатория знаний, 2012,
7-Метил-1-(2-метоксиэтилсульфонил)три-
557.
[Silverstein R.M., Webster F.X., Kiemle D.J.
цикло[4.1.0.02,7]гептан
(10b). Выход
75 мг
Spectrometric Identification of Organic Compounds.
(65.2%).
7th Ed. N.-Y.: J. Wiley & Sons Inc., 2005, 512.]
7-син-Метокси-6-экзо-(2-метоксиэтилсуль-
11.
Васин В.А., Кострюков С.Г., Разин В.В. ЖОрХ.
фонил)бицикло[3.1.1]гептан (11). Выход 81 мг
1996, 32, 59-64.
(65.3%), т.пл. 48-49°С (эфир-гексан). ИК спектр,
12.
Васин В.А., Болушева И.Ю., Кострюков С.Г., Ра-
ν, см-1: 3095 ср, 2950 ср, 1450 cр, 1330 с (асимм.
зин В.В. ЖОрХ. 1993, 29, 1349-1357.
SO2), 1262 ср, 1204 ср, 1130 о.с (симм. SO2), 1115 с,
13.
Stephens P.J., Devlin F.J., Chablowski C.F., Frisch M.J.
1095 с, 1060 ср, 883 ср, 744 с, 657 ср. Спектр ЯМР
J. Phys. Chem. 1994, 98, 11623-11627.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
О РЕАКЦИИ ТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА И 1-МЕТИЛТРИЦИКЛО[4.1.0.02,7]ГЕПТАНА
919
17. Gassman P.G., Richmond G.D. J. Am. Chem. Soc.
15. Ditchfield R., Hehre W.J., Pople J.A. J. Chem. Phys.
1970, 92, 2090-2096. doi 10.1021/ja00710a049
1971, 54, 724-728. doi 10.1063/1.1674902
18. Closs G.L., Closs L.E. J. Amer. Chem. Soc. 1963, 85,
msu.su/gran/firefly/index.html.
2022-2023. doi 10.1021/ja00896a032
About Reaction of Tricyclo[4.1.0.02,7]heptane
and 1-Methyltricyclo[4.1.0.02,7]heptane
with 2-Bromoethanesulfonyl Bromide
S. G. Kostryukov* and Yu. Yu. Masterova
National Research Mordovia State University, 430005, Russia, Republic of Mordovia, Saransk, ul. Bolshevistskaya 68
*e-mail: kostryukov_sg@mail.ru
Received November 14, 2019; revised November 25, 2019; accepted December 7, 2019
2-Bromoethanesulfonyl bromide reacts with tricyclo[4.1.0.02,7]heptane and 1-methyltricyclo[4.1.0.02,7]-
heptane by a radical mechanism affording the products with norpinic structure as a result of both anti- and
syn-addition to the central C1-C7 bicyclobutane bond. The obtained adducts under treatment with triethylamine
undergo 1,2-dehydrobromination leading to the vinyl sulfones of the bicyclo[3.1.1]heptane row. When treated
with sodium methylate, the products of anti- and syn-addition undergo 1,2- and 1,3-dehydrobromination and
nucleophilic addition depending on the molar ratio of the reactants and the structure of the starting substrates.
Keywords: 2-bromoethanesulfonyl bromide, tricyclo[4.1.0.02,7]heptane, radical addition, bicyclo[3.1.1]heptane,
dehydrobromination
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020