ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 6, с. 920-926
УДК 547.821.2
НОВЫЙ ОДНОРЕАКТОРНЫЙ МЕТОД ПОЛУЧЕНИЯ
N,N-ДИМЕТИЛАМИНОПИРИДИНОВ ЧЕРЕЗ
ДИАЗОТИРОВАНИЕ АМИНОПИРИДИНОВ
В ДИМЕТИЛФОРМАМИДЕ В ПРИСУТСТВИИ
ТРИФТОРМЕТАНСУЛЬФОКИСЛОТЫ
© 2020 г. А. Н. Санжиев, М. И. Потапова, Е. А. Краснокутская*, В. Д. Филимонов
ФГАОУ ВО «Национальный исследовательский Томский политехнический университет»,
Россия, 634050, г. Томск, пр. Ленина 30
*e-mail: eak@tpu.ru
Поступила в редакцию 26 января 2020 г.
После доработки 01 февраля 2020 г.
Принята к публикации 07 февраля 2020 г.
Аминопиридины диазотируются в присутствии трифторметансульфокислоты с образованием не солей
диазония, а соответствующих эфиров трифторметансульфокислоты. Пиридилтрифторметансульфонаты
при нагревании в диметилформамиде способны замещать трифлатную группу с образованием N,N-ди-
метиламинопиридинов. Замещение ускоряется под действием микроволнового облучения. Предлагает-
ся однореакторный метод получения 2- и 4-N,N-диметиламинопиридинов из коммерчески доступных
аминопиридиов. Метод обеспечивает хорошие выходы целевых продуктов и является альтернативой
существующим методам синтеза N,N-диметилпиридин-4-амина (DMAP) - катализатора, широко ис-
пользуемого в органическом синтезе.
Ключевые слова: аминопиридины, диазотирование, пиридилтрифлаты, N,N-диметиламинопиридины.
DOI: 10.31857/S0514749220060099
N,N-Диметиламинопиридины широко исполь-
казано только на примере 2-аминопиридина. В
зуются в синтезе биологически активных соеди-
настоящее время наиболее приемлемым методом
нений пиридинового ряда [1-4], а также представ-
получения N,N-диметиламинопиридинов является
ляют самостоятельный интерес. Особую важность
аминирование 2- и 4-галоидпиридинов диметила-
представляет N,N-диметилпиридин-4-амин, из-
мином [10-14], выходы целевых продуктов при
этом составляют 83-91%. Аминирование 3-иод- и
вестный по аббревиатуре DMAP, являющийся ка-
3-бромпиридина удается провести только в при-
тализатором многих органических реакций [5-7].
сутствии иодида меди [14]. В ряде работ [15-18]
Несмотря на практическую важность N,N-
в качестве источника N,N-диметильного синтона
диметиламинопиридинов, методы их получения
используется диметилформамид. Так, показано,
ограничены. Так алкилирование под действием
что 2- и 4-галоидпиридины и хинолины в раство-
иодистого метила, диметилсульфата или мета-
ре ДМФА в присутствии оснований или кислот в
нола в присутствии кислот Льюиса приводит к
условиях микроволнового облучения [17] или при
смеси моно- и диалкилированных производных.
длительном нагревании [18] могут превращаться в
Успешное использование систем на основе фор-
соответствующие N,N-диметиламинопроизводные
мальдегида [8] или муравьиной кислоты [9] по-
с хорошими выходами.
920
НОВЫЙ ОДНОРЕАКТОРНЫЙ МЕТОД ПОЛУЧЕНИЯ N,N-ДИМЕТИЛАМИНОПИРИДИНОВ
921
Ранее в нашей лаборатории показано, что ами-
этом реакция протекает быстрее, чем с использо-
нопиридины и аминохинолины в присутствии
ванием хлор- и бромпиридинов. Так, например,
сульфокислот (п-толуолсульфокислоты, трифтор-
4-хлорпиридин при кипячении в ДМФА превра-
метансульфокислоты) диазотируются с образо-
щается в соответствующий N,N-диметиламин 2а в
ванием соответствующих гетероарилтозилатов и
течение 34 ч с выходом 69% [18], в то время как 4-
трифлатов [19, 20]. Обнаруженная особенность
пиридилтрифлат 1а за 5 ч с выходом 89% (табл. 1).
поведения указанных аминогетероциклов позво-
Ранее мы показали, что ДМФА может быть
лила разработать удобный метод получения пи-
успешно использован в качестве растворителя для
ридил- и хинолилтозилатов и трифлатов - важных
диазотирования 2-аминопиридина под действием
полупродуктов органического синтеза. Известно,
NaNO2 и TfOH. Однако при этом образуются проч-
что трифтометансульфонатная группа является хо-
ные комплексы ДМФА с получающимся 2-пири-
рошо уходящей группой [21], однако ее замещение
дилтрифлатом 1a, что затрудняет препаративное
в пиридинах на диметиламиногруппу неизвестно.
выделение последнего [20].
Цель настоящей работы состояла в исследовании
В данной работе мы нашли, что диазотирова-
реакционной способности пиридилтрифторметан-
ние в ДМФА ряда 2- и 4-аминопиридинов 3a-i
сульфонатов в реакции с диметилформамидом для
действием NaNO2 и TfOH протекает с полной кон-
получения N,N-диметиламинопиридинов.
версией субстратов при 20°С. Дальнейшее нагре-
Мы впервые показали, что 2- и 4-пиридил-
вание получающихся реакционных масс без выде-
трифлаты 1a-e при кипячении в ДМФА превраща-
ления промежуточных пиридилтрифлатов ведет к
ются в N,N-диметилзамещенные аминопиридины
образованию N,N-диметиламинопиридинов 2a-i.
2a-e с хорошими выходами (метод a, табл. 1). При
Далее мы нашли, что использование микровол-
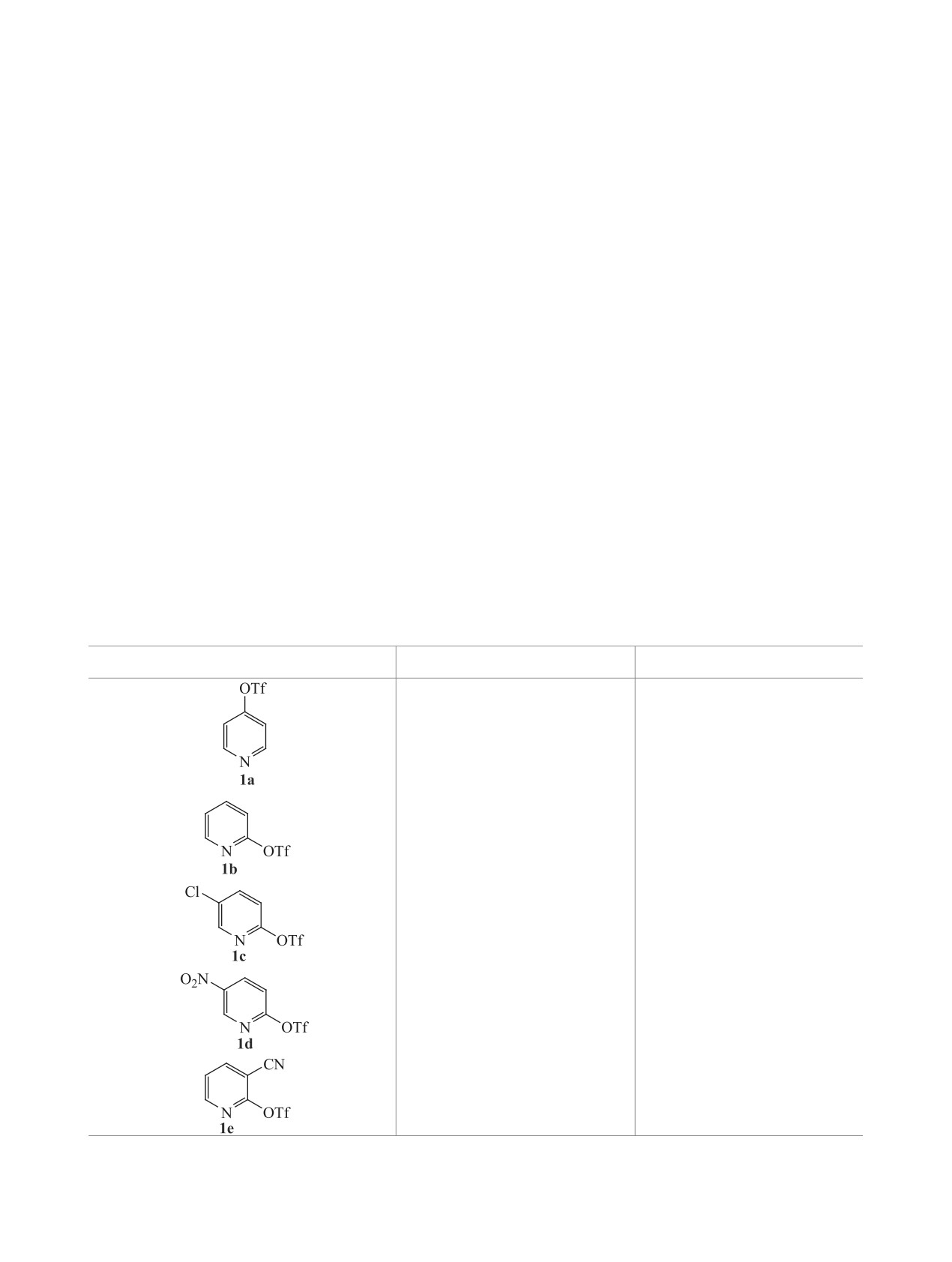
Таблица 1. Получение N,N-диметилпиридин-4-аминов 2а-е из пиридилтрифторметан сульфонатов 1а-е в ДМФА
при 160°С (метод a).
Субстрат
Время, ч (лит.)
Выход 2a-e, %
5 (34 [18])
89
5.5 (29 [26])
90
5 (24 [27])
90
6 (24 [18])
58
5 (22 [18])
90
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
922
САНЖИЕВ и др.
Схема 1.
R
R
R
CH3
NaNO2, TfOH
160°C (MWI)
NH2
OTf
ДМФА, 2-6 ч
ДМФА
N
N
N
N
CH3
3a-i
1a-i
2a-i
R = H, 4-N(CH3)2 (a); R = H, 2-N(CH3)2 (b); R = 5-Cl, 2-N(CH3)2 (c); R = 5-Br, 2-N(CH3)2 (d);
R = 5-NO2, 2-N(CH3)2 (e); R = 3-CN, 2-N(CH3)2 (f); R = 3,5-Br, 2-N(CH3)2 (g);
R = 4-CH3, 2-N(CH3)2 (h); R = 6-CH3, 2-N(CH3)2 (i).
нового облучения на стадии превращения пири-
диметиламинопиридины получали при длитель-
дилтрифлатов 1a-i в N,N-диметиламинопиридины
ном нагревании хлорпиридинов в ДМФА.
2a-i под действием ДМФА значительно снижает
Таким образом, впервые показано, что триф-
время реакции (метод b), (схема 1, табл. 2).
торметансульфонатная группа в положениях C2
Так, например, превращение 2-пиридилтрифла-
и C4 пиридинового кольца может легко заме-
та 1b без микроволнового облучения (метод a),
щаться на диметиламиногруппу при нагрева-
проходит за 5.5 ч (табл. 1), в условиях микроволно-
нии в ДМФА с образованием соответствующих
вого облучения (метод b) эта реакция проходит в
N,N-диметиламинопиридинов. При этом реакция
течение 0.83 ч (схема 1, табл. 2). Выходы целевых
протекает быстрее, чем с использованием гало-
N,N-диметиламинопиридинов 2a-i по методам a,
генпиридинов в качестве исходных субстратов.
b, как правило, превышают таковые, полученные
Обнаруженное свойство позволило разработать
при использовании галогенпиридинов в качестве
однореакторный метод получения 2- и 4-N,N-
исходных продуктов [17, 18]. На примере N,N-
диметиламинопиридинов через дизотирование
диметилпиридин-4-амина (DMAP) 2a показано,
2- и 4-аминопиридинов в ДМФА в присутствии
что выход продукта не снижается с увеличенны-
трифторметансульфокислоты при комнатной
ми количествами исходного субстрата (10 ммоль,
температуре с последующим быстрым нагре-
табл. 2).
ванием в условиях микроволнового облучения
реакционных масс без выделения промежуточ-
Разработанный
однореакторный
метод
ных пиридилтрифлатов. Предлагаемый метод
превращения аминопиридинов до N,N-диметил-
обеспечивает хорошие выходы целевых N,N-
аминопиридинов через промежуточное образова-
диметиламинопиридинов и является альтернати-
ние пиридилтрифлатов позволяет успешно полу-
вой существующим методам синтеза DMAP - ка-
чать 2- и 4-N,N-диметилпиридины, как с донор-
тализатора, широко используемого в органическом
ными, так и акцепторными заместителями в ядре
синтезе.
(табл. 2). Однако замещение NH2-группы в 3-ами-
нопиридине на N,N-диметильный радикал не про-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
исходит. В этом случае образующийся в результате
Хромато-масс-спектры регистрировали на га-
диазотирования пиридин-3-ил трифторметансуль-
зовом хроматографе Agilent Technologies 7890A
фонат остается неизменным даже после 10 ч наг-
GC System с масс-селективным детектором Agilent
ревания в ДМФА. Известно, что и у 3-галогенпи-
5975C (70 эВ) газ-носитель - гелий, спектры ЯМР
ридинов не удается осуществить замещение гало-
1Н, 13С записывали на спектрометре Bruker AC-
гена на диметиламиногруппу действием ДМФА в
400 (400 МГц), внутренний стандарт - ТМС, рас-
отсутствие катализаторов [15-18, 22].
творитель указан в тексте. Температура плавле-
Химизм описанных превращений пиридил-
ния определялась на приборе MP50 Melting Point
трифлатов 1a-i в ДМФА до соответствующих
System Mettler Toledo. Оборудование для прове-
N,N-диметиламинопиридинов 2a-i нами специ-
дения органического синтеза - микроволновый
ально не изучался, однако он укладывается в
реактор СЕМ на базе модуля Discover labmate, с
схему, предложенную в работе [18], где N,N-
частотой излучения 2455 МГц.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
НОВЫЙ ОДНОРЕАКТОРНЫЙ МЕТОД ПОЛУЧЕНИЯ N,N-ДИМЕТИЛАМИНОПИРИДИНОВ
923
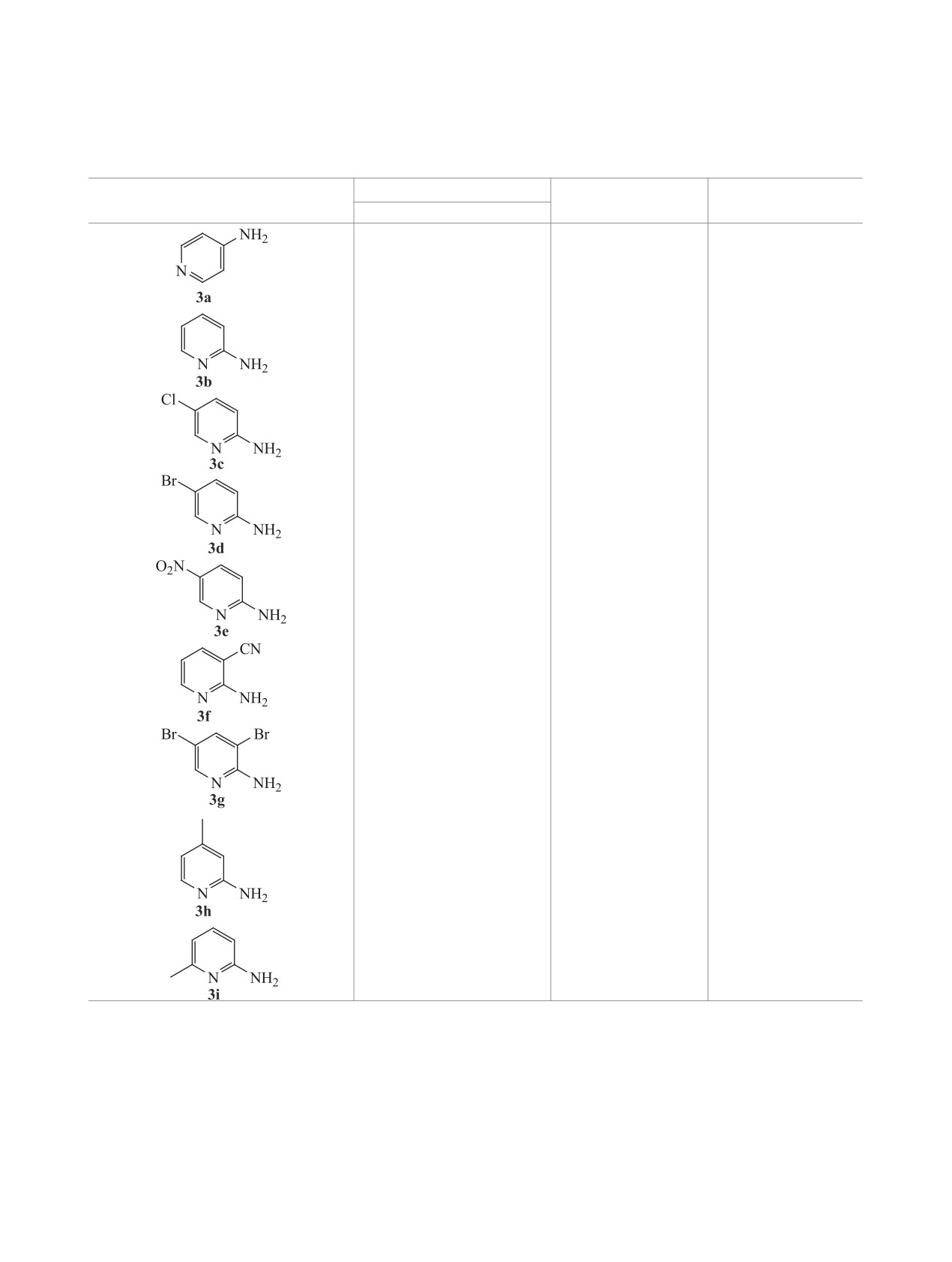
Таблица 2. Синтез N,N-диметиламинопиридинов 2a-i через диазотирование аминопиридинов 3a-i в ДМФА в
присутствии TfOH с последующим нагревом в условиях микроволнового облучения (метод b).
Время, чa
Субстрат
Продукт
Выход, % (лит.)
стадия 2
0.83
2a
92b (69 [18])
0.83
2b
90 (92 [26])
3.3
2c
91 (85 [27])
3
2d
87 (82 [28])
0.83
2e
98 (76 [18])
0.83
2f
94 (73 [18])
2
2g
78 (77 [29])
0.83
2h
92 (80 [13])
1.6
2i
81 (63 [30])
a Диазотирование аминопиридинов 3а-i (стадия 1) проводилась в течение 3 ч.
b Выход приведен для загрузки 10 ммол 4-аминопиридина.
Контроль за ходом реакции и чистотой полу-
Препаративное разделение продуктов осущест-
ченных продуктов вели методом ТСХ на пластин-
вляли с помощью флеш-хроматографии на колон-
ках Merck, silica gel 60, F254. Детектирование пятен
ках 15×1 см, сорбент Silica gel (40/60 μ), элюент
проводили УФ-светом при длине волны 254 нм.
указан в тексте. Аминопиридины 3a-i являются
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
924
САНЖИЕВ и др.
коммерческими препаратами компании Aldrich,
6.97 д (2Н, H3,5, J 8.0), 8.20 д (2Н, H2,6, J 8.0).
пиридилтрифторметан-сульфонаты 1a-e получали
Спектр ЯМР 13C (400 МГц, CDCl3), δ, м.д.: 36.56
по методу [20].
[N(CH3)2], 107.01 (C3,5), 139.27 (C2,6), 162.65 (C4).
Общая методика синтеза N,N-диметил-
N,N-диметилпиридин-2-амин
(2b). Выход
аминопиридинов 2a-e из пиридилтрифлатов
0.219 г (90%), светло-желтое масло (т.кип. 196°C
1a-e в ДМФА при 160°C. a. Раствор пиридил-
[32]). Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д.
трифторметансульфоната 1a-e (2 ммоль) в 0.5 мл
(J, Гц): 2.99 с [6H, N(CH3)2], 6.41-6.46 м (2H,
диметилформамида выдерживают при постоянном
H3,5), 7.33-7.37 м (1H, H4), 8.075 д (1Н, H6, J 4.0).
перемешивании и температуре 160°С в течение
Спектр ЯМР 13C (400 МГц, CDCl3), δ, м.д.: 38.14
времени, указанном в табл. 1. Контроль за ходом
[N(CH3)2], 105.91 (C3), 111.42 (C5), 137.17 (C4),
реакции ведут методом ТСХ (элюент этилацетат-
147.72 (C6), 159.26 (C2).
гексан, 1:3, Rf 0.2-0.3) и ГХ-МС. Далее реакцион-
5-Хлор-N,N-диметилпиридин-2-амин
(2c).
ную массу выливают в 40 мл воды, нейтрализуют
Выход 0.284 г (91%), желтое масло (т.пл. 26-27°С
водным раствором Na2CO3 (25%, 4 мл) и экстра-
[31]). Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д. (J,
гируют (50×3 мл) этилацетатом. Органический
Гц): 3.08 с [6H, N(CH3)2], 6.46 д (1Н, H3, J 8.0), 7.4
слой промывают 40 мл холодной воды, отделяют,
д (1Н, H4, J 8.0), 8.10 с (1Н, H6). Спектр ЯМР 13C
высушивают над Na2SO4. Растворитель отгоняют.
(400 МГц, CDCl3), δ, м.д.: 38.33 [N(CH3)2], 106.63
Очистку проводят флэш-хроматографией, элюент
(C3), 118.54 (C5), 136.93 (C4), 145.87 (C6), 157.53
хлористый метилен (CH2Cl2).
(C2).
Общая методика синтеза N,N-диметил-
5-Бром-N,N-диметилпиридин-2-амин
(2d).
аминопиридинов
2а-i через диазотирование
Выход 0.349 г (87%), желтые кристаллы, т.пл.
аминопиридинов 3а-i в ДМФА в присутствии
40-41°C (т.пл. 39-41°C [12, 13]). Спектр ЯМР 1Н
TfOH с последующим нагревом в условиях
(400 МГц, CDCl3), δ, м.д. (J, Гц): 3.04 с [6H,
микроволнового облучения. b. К охлажденно-
N(CH3)2], 6.38 д (1H, H3, J 9.0), 7.47 д.д (1H, H4,
му до 5°С раствору трифторметансульфокислоты
J 9.0, 2.5), 8.15 д (1H, H6, J 2.3). Спектр ЯМР 13C
(6 ммоль, 0.54 мл) в диметилформамиде (0.5 мл)
(400 МГц, CDCl3), δ, м.д.: 38.2 [N(CH3)2], 106.0
добавляют в течение 10 минут при постоянном
(С5), 107.3 (С3), 139.3 (С4), 148.3 (C6), 157.8 (C2).
перемешивании предварительно растертую смесь
аминопиридина (2 ммоль) и NaNO2 (5 ммоль,
5-Нитро-N,N-диметилпиридин-2-амин
(2e).
0.35 г). Далее реакцию продолжают при комнатной
Выход 0.328 г (98%), желтые кристаллы, т.пл.
температуре в течение 3 ч. Контроль за ходом ре-
156-157°C (т.пл. 155-157°C [18]). Спектр ЯМР 1Н
акции осуществляют методом ТСХ (элюент этил-
(400 МГц, CDCl3), δ, м.д. (J, Гц): 3.26 с [6Н,
ацетат-гексан, 3:1, Rf 0.68-0.72) и ГХ-МС. Затем к
N(CH3)2], 6.49 д (1Н, H3, J 8.0), 8.22 д (1Н, H4, J
соответствующему пиридилтрифлату, полученно-
12.0), 9.07 с (1Н, H6). Спектр ЯМР 13C (400 МГц,
му in situ, добавляют ДМФА (0.5 мл) и выдержи-
CDCl3), δ, м.д.: 38.55 [N(CH3)2], 104.33 (C3), 132.76
вают при постоянном перемешивании в условиях
(C4), 134.60 (C5), 146.33 (C6), 160.63 (C2).
микроволнового облучения при давлении 3 Бар и
3-Карбонитрил-N,N-диметилпиридин-2-
мощности 50 Вт. В течение времени указанном в
амин (2f). Выход 0.278 г (94%) темно-желтое мас-
табл. 2.
ло, (т.кип. 265°C [23]). Спектр ЯМР 1Н (400 МГц,
Контроль за ходом реакции ведут методом
CDCl3), δ, м.д. (J, Гц): 3.22 с [6Н, N(CH3)2], 6.55
ТСХ (элюент этилацетат-гексан, 1:3, Rf 0.2-0.3) и
д.д (1Н, H5, J 8.0, 4.0), 7.65 д.д (1Н, H4, J 8.0,
ГХ-МС. Выделение целевых продуктов 2а-i про-
4.0), 8.22 д.д (1H, H6, J 4.0, 4.0). Спектр ЯМР 13C
водили по методике, описанной выше.
(400 МГц, CDCl3), δ, м.д.: 40.37 [N(CH3)2], 91.09
(C3), 111.99 (C5), 119.17 (CN), 144.56 (C4), 151.72
N,N-диметипиридин-4-амин
(2а).
Выход
(C6), 159.33 (C2).
0.224 г (92%), белые кристаллы, т.пл. 108-110°С
(109-111°C
[18]). Спектр ЯМР 1Н (400 МГц,
3,5-Дибром-N,N-диметилпиридин-2-амин
DMSO-d6), δ, м.д. (J, Гц): 2.89 с [6H, N(CH3)2],
(2g). Выход 0.436 (78%), желтые кристаллы, т.пл.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
НОВЫЙ ОДНОРЕАКТОРНЫЙ МЕТОД ПОЛУЧЕНИЯ N,N-ДИМЕТИЛАМИНОПИРИДИНОВ
925
42-43°C (т.пл. 41-43°C [24]). Спектр ЯМР 1Н
5.
Hassner A., Hart A.P., Pigza J.A. Encycl. Reagents Org.
(400 МГц, CDCl3), δ, м.д. (J, Гц): 2.97 с [6Н,
Synth. 2016, 1-6. doi 10.1002/047084289X.rd310.
pub2
N(CH3)2], 7.86 д (1Н, H4, J 2.4), 8.19 д (1Н, H6, J
2.4). Спектр ЯМР 13C (400 МГц, CDCl3), δ, м.д.:
6.
Kalayanov G., Jaksa S., Scarcia T., Kobe J. Synthesis.
41.93 [N(CH3)2], 110.55 (C5), 110.68 (C3), 144.10
2004, 2026-2034. doi 10.1055/s-2004-829174
(C4), 146.64 (C6), 158.98 (C2).
7.
Nishibayashi R., Kurahashi T. Synlett. 2014, 25, 1287-
1290. doi 10.1055/s-0033-1341240
4-Метил-N,N-диметилпиридин-2-амин
(2h).
8.
Jiang X., Wang Ch., Wei Y., Xue D. Chem. Eur. J. 2014,
Выход 0.251 (92%), светло-желтое масло (т.кип.
20, 58-63. doi 10.1002/chem.201303802
225°C [3]). Спектр ЯМР 1Н (400 МГц, CDCl3), δ,
9.
Fu M.-Ch., Shang R., Cheng W.-M., Fu Y. Angew.
м.д. (J, Гц): 2.24 с (3H, CH3), 3.05 с [6H, N(CH3)2],
Chem., Int. Ed. 2015, 54, 9042-9046. doi 10.1002/
6.31 с (1H, H3), 6.38 д (1H, H5, J 4.8), 8.03 д (1H, H6,
anie.201503879
J 5.2). Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.:
10.
Lundgren R.J., Sappong-Kumankumah A., Stradiot-
21.5 (CH3), 38.2 [N(CH3)2], 106.3 (C3), 113.2 (C5),
to M. Chem. Eur. J. 2010, 16, 1983-1991. doi 0.1002/
147.6 (C6), 148.0 (C4), 159.8 (C2).
chem.200902316
6-Метил-N,N-диметилпиридин-2-амин
(2i).
11.
Cross J.B., Zhang J., Yang Q., Mesleh M.F.,
Выход 0.222 г (81%), светло-желтое масло (т.пл.
Romero J.A.C., Wang B., Bevan D., Poutsiaka K.M.,
198-200°C
[25]). Спектр ЯМР
1Н (500 МГц,
Epie F., Moy T., Daniel A., Shotwell J., Chamberlain B.,
CDCl3), δ, м.д. (J, Гц): 2.41 с (3H, СН3), 3.07 с
Carter N., Andersen O., Barker J., Ryan M. D.,
[6H, N(CH3)2], 6.32 д (1H, H3, J 8.3), 6.41 д (1H,
Metcalf C.A., Silverman J., Nguyen K., Lippa B.,
H5, J 7.5), 7.34 д.д (1H, H4, J 8.3, 7.5). Спектр ЯМР
Dolle R.E. ACS Med. Chem. Lett. 2016, 7, 374-378.
13C (125 МГц, CDCl3), δ, м.д.: 24.6 (СН3), 37.9
doi 10.1021/acsmedchemlett.5b00368
[N(CH3)2], 102.4 (С3), 110.6 (С5), 137.3 (С4), 156.5
12.
Matulenko M.A., Paight E.S., Frey R.R., Gomtsyan A.,
(С6), 159.1 (С2).
DiDomenico S., Jiang M., Lee C.-H., Stewart A.O.,
Yu H., Kohlhaas K.L., Alexander K.M., McGaraugh-
ФОНДОВАЯ ПОДДЕРЖКА
ty S., Mikusa J., Marsh K.C., Muchmore S.W.,
Работа выполнена в рамках государственного
Jakob C.L., Kowaluk E.A., Jarvis M.F., Bhagwat S.S.
задания Министерства науки и высшего образо-
Bioorg. Med. Chem. 2007, 15, 1586-1605. doi10.1016/
j.bmc.2006.12.029
вания Российской Федерации (Наука № FSWW-
2020-0011).
13.
Su W.-G., Deng W., Ji J. Пат. 2014/121200. США.
14.
Wang D., Kuang D., Zhang F., Yang Ch., Zhu X.
КОНФЛИКТ ИНТЕРЕСОВ
Adv. Synth. Cat. 2015, 357, 714-718. doi 10.1002/
Авторы заявляют об отсутствии конфликта ин-
adsc.201400785
тересов.
15.
Garcia J., Sorrentino J., Diller E.J., Chapman1 D.,
Woydziak, Z.R. Synth. Comm. 2016, 46, 475-481. doi
СПИСОК ЛИТЕРАТУРЫ
10.1080/00397911.2016.1147051
1. Bhunia A., Roy T., Pachfule P., Rajamohanan P.R.,
16.
Agarwal A., Chauhan Prem M.S. Synth. Comm. 2004,
Biju A.T. Angew. Chem., Int. Ed. 2013, 52, 10040-
34, 2925-2930. doi 10.1081/SCC-200026634
10043. doi 10.1002/anie.201304278
17.
Petersen T.P., Larsen A.F., Ritzén A., Ulven T. J. Org.
2. Desai L.V., Hull Kami L., Sanford M.S. J. Am. Chem.
Chem. 2013, 78, 4190-4195. doi 10.1021/jo400390t
Soc. 2004, 126, 9542-9543. doi 10.1021/ja046831c
18.
Kodimuthali A., Mungara A., Prasunamba P-L., Pal M.
3. Chen C., Wilcoxen K.M., Huang C.Q., Xie Y.-F.,
J. Braz. Chem. Soc. 2010, 21, 1439-1445. doi 10.1590/
McCarthy J.R., Webb T.R., Zhu Y.-F., Saunders J.,
S0103-50532010000800005
Liu X.-J., Chen T.-K., Bozigian H., Grigoriadis D.E.
J. Med. Chem. 2004, 47, 4787-4798. doi 10.1021/
19.
Krasnokutskaya E.A., Kassanova A.Z., Estaeva M.T.,
jm040058e
Filimonov V.D. Tetrahedron Lett. 2014, 55, 3771-
3773. doi 1016/j.tetlet.2014.05.052
4. Held K., Künzel H., Ising M., Schmid D.A.,
Zobel A., Murck H., Holsboer F., Steiger A. J. Psy-
20.
Kassanova A.Z., Krasnokutskaya E.A., Beisembai P.S.,
chiatr. Res. 2004, 38, 129-136. doi 10.1016/S0022-
Filimonov V.D. Synthesis. 2016, 48, 256-262. doi
3956(03)00076-1
10.1055/s-0035-1560392
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
926
САНЖИЕВ и др.
21. Kassanova A.Z., Krasnokutskaya E.A., Filimonov V.D.
27. Yang C., Zhang F., Deng G.J., Gong H. J. Org. Chem.
Russ. Chem. Bull. 2016, 65, 2559-2567. doi 10.1007/
2019, 84, 181-190. doi 10.1021/acs.joc.8b02588
s11172-016-1619-1
28. Yao W., Li R., Han D. Пат. 108689923. Кит.
22. Chen W.-X, Shao L.-X. J. Org. Chem. 2012, 77, 9236-
29. Paudler W.W., Jovanovic M.V. J. Org. Chem. 1983, 48,
9239. doi 10.1021/jo301811n
1064-1069. doi 10.1021/jo00155a027
23. Samadi A., Silva D., Chioua M., do Carmo Carreiras M.,
30. Mita T., Michigami K., Sato Y. Chem. Asian J. 2013, 8,
Marco-Contelles J. Synth. Commun. 2011, 41, 2859-
2970-2973. doi 10.1002/asia.201300930
2869. doi 10.1080/00397911.2010.515360
31. El-Anani A., Jones P.E., Katritzky A.R. J. Chem.
24. Hilton S., Naud S., Caldwell J.J., Boxall K., Burns S.,
Soc. B. 1971, 2363-2365. doi 10.1039/J29710002363
Anderson V.E., Antoni L., Allen C.E., Pearl L.H.,
Oliver A.W., Wynne Aherne G., Garrett M.D., Collins I.
32. Пожарский А.Ф., Звездина Э.А., Кашпаров И.С.,
Bioorg. Med. Chem. 2010, 18, 707-718. doi 10.1016/
Андрейчиков Ю.П., Марьяновский В.М., Си-
j.bmc.2009.11.058
монов А.М. ХГС. 1971, 7, 1230-1237. [Pozhars-
25. Feist K., Awe W., Kuklinski M. Arch. Pharm. 1936,
kii A.F., Zvezdina É.A., Kashparov I.S., Andreichi-
274, 418-425. doi 10.1002/ardp.19362740706
kov Yu.P., Mar’yanovskii V.M., Simonov A.M. Chem.
26. Cho Y.H., Park J.C. Tetrahedron Lett. 1997, 38, 8331-
Heterocycl. Compd. 1971, 7, 1156-1971.] doi 10.1007/
8334. doi 10.1016/S0040-4039(97)10255-6
BF00510027
A New One-Reactor Method for Producing
N,N-Dimethylaminopyridines through Diazotization
of Aminopyridines in Dimethylformamide in the Presence
of Trifluoromethanesulfonic Acid
A. N. Sanzhiev, M. I. Potapova, E. A. Krasnokutskaya*, and V. D. Filimonov
National Research Tomsk Polytechnic University, Russia, 634050, Tomsk, pr. Lenina 30
*e-mail: eak@tpu.ru
Received January 26, 2020; revised February 1, 2020; accepted February 7, 2020
Aminopyridines are diazotized in the presence of trifluoromethanesulfonic acid to form not diazonium salts,
but the corresponding trifluoromethanesulfonic acid esters. Pyridyl trifluoromethanesulfonates, when heated in
dimethylformamide, are able to replace the triflate group with the formation of N,N-dimethylaminopyridines.
Substitution is accelerated by microwave irradiation. A one-reactor method is proposed for producing 2- and
4-N,N-dimethylaminopyridines from commercially available aminopyridides. The method provides good yields
of the target products and is an alternative to existing methods for the synthesis of N,N-dimethylpyridin-4-amine
(DMAP), a catalyst widely used in organic synthesis.
Keywords: aminopyridines, diazotization, pyridyl triflates, N,N-dimethylaminopyridines
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020