ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 6, с. 933-940
УДК 547.466.1
РЕАКЦИОННАЯ СПОСОБНОСТЬ TYR-PRO
В БЕНЗОИЛИРОВАНИИ
В СРЕДЕ ВОДНОГО 1,4-ДИОКСАНА
© 2020 г. Т. П. Кустоваa, *, И. И. Локтеваa, Л. Б. Кочетоваa, Д. С. Хачатрянb
a ФГБОУ ВО «Ивановский государственный университет», 1530250, Россия, г. Иваново, ул. Ермака 39
*e-mail: kustova_t@mail.ru
b ФГУП «Институт химических реактивов и особо чистых химических веществ Национального
исследовательского центра «Курчатовский институт»,
107076, Россия, г. Москва, Богородский вал 3
Поступила в редакцию 09 января 2020 г.
После доработки 07 февраля 2020 г.
Принята к публикации 11 февраля 2020 г.
На основе экспериментального изучения кинетики взаимодействия дипептида L-Tyr-L-Pro с активиро-
ванными нитрогруппой фенилбензоатами в растворителе вода (40 масс %) - 1,4-диоксан в температурном
интервале 298-313 K установлен диапазон изменения констант скорости k298 0.035-0.564 л·моль-1·с-1
и активационные барьеры реакций 39-51 кДж·моль-1. Методом DFT/B3LYP/cc-pVTZ выполнено ком-
пьютерное моделирование дипептида в нейтральной и анионной формах. NBO-анализ распределения
электронной плотности в этих формах дипептида показал, что в рассматриваемой реакции из двух воз-
можных нуклефильных центров - азота первичной аминогруппы и кислорода фенольного гидроксила -
предпочтительным является первый.
Ключевые слова: дипептид, тирозилпролин, бензоилирование, кинетика, 1,4-диоксан, 2,4 - и 2,6-ди-
нитрофенилбензоаты, пикрилбензоат.
DOI: 10.31857/S0514749220060117
Имеющиеся на сегодняшний день систематиче-
жащих 30 семействам, выявил высокую частоту
ские данные о реакционной способности дипепти-
встречаемости дипептидного фрагмента Tyr-Pro,
дов в реакциях ацильного переноса исчерпывает-
авторами также было экспериментально установ-
ся кинетическими данными реакций глицилгли-
лено, что этот дипептид является минимальной
цина и аланилаланина с рядом сложных эфиров
из известных последовательностей аминокислот,
и результатами исследования кинетики реакций
проявляющих анальгетическую активность при
дипептидов с бензоилхлоридом и сульфонилхло-
раздражении термо-, механо- и хеморецепторов
ридами в водном 1,4-диоксане, полученными в
боли у крыс. Показано, что аналоги Tyr-Pro, полу-
наших работах [1-4]. Вместе с тем, в литера-
ченные путем его модификации по карбоксильной
туре последних лет довольно много внимания
группе пролина Tyr-Pro-Х, где Х = NH2, OCH3,
уделяется биологической активности как самих
OC2H5, обладают более сильной активностью в
природных олигопептидов, так и полученных на
выполненных тестах. Получение функциональных
их основе функциональных производных, а так-
производных этого дипептида по α-аминогруп-
же метаболизму этих соединений. Выполненный
пе тирозина сдерживается отсутствием данных о
в работах [5, 6] анализ аминокислотных последо-
реакционной способности этого нуклеофильного
вательностей 130 опиоидных пептидов, принадле-
центра.
933
934
КУСТОВА и др.
Схема 1.
O
H
H2N
C C
N
CH2
C
_
O
+
C
O
O
(NO2)n
O
OH
O
H
H
C
N
C C
N
O
CH2
C
_
O
+ HO
(1)
O
(NO2)n
OH
_
_
_
C O
+
2OH
C O +
O
(2)
(NO2)n
(NO2)n
O
O
n = 2, 3.
Целью настоящей работы является комплекс-
учитывался только щелочной гидролиз эфира
ное исследование реакционной способности двух
[уравнение (2)].
нуклеофильных центров Tyr-Pro - азота первич-
Кинетику реакций изучали спектрофотометри-
ной аминогруппы и кислорода фенольного гидрок-
ческим методом (λ 400 нм) при большом избыт-
сила - на основе квантово-химических расчетов
ке дипептида (в 102 раз) по сравнению с ацили-
структурных, энергетических и электронных ха-
рующим агентом. За скоростью взаимодействия
рактеристик дипептида в нейтральной и анионной
следили по изменению концентрации продуктов
формах, а также на основе изучения кинетики его
реакции - нитрозамещенных фенолят-ионов. В
N-ацилирования.
условиях эксперимента скорость изменения кон-
Кинетика реакции L-Tyr-L-Pro с 2,4- и 2,6-ди-
центрации ацилирующего агента (сац) описывает-
нитрофениловыми эфирами (ДНФБ) и 2,4,6-три-
ся уравнением (3):
нитрофениловым эфиром (ТНФБ) бензойной кис-
dc
ац
–
= [ kг + (kα)с0]cац = kнcац,
(3)
лоты исследована в растворителе вода - 1,4-диоксан
dτ
в интервале температур 298-313 K (схема 1). Как
где α - доля концентрации реакционноспособной
было показано ранее [2], в условиях кинетических
(анионной) формы Tyr-Pro от общей концентра-
опытов при рН 8.5-9 в реакциях со сложными
ции дипептида в растворе c0; k (л·моль-1·с-1) -
эфирами единственной реакционноспособной
константа скорости ацилирования реакционно-
формой α-аминокислот и дипептидов являются
способной формы; kг (с-1) - константа скорости
их анионы. В водно-органической среде парал-
гидролиза ацилирующего агента; kн (с-1) - наблю-
лельно с реакциями N-ацилирования может про-
даемая константа скорости:
текать гидролиз сложных эфиров. В ряде наших
kн = kг + (kα)c0
(4)
работ [2-4] показано, что фенилбензоаты в воде не
гидролизуются, в связи с чем при расчете констант
Для создания определенной концентрации
скорости, кроме целевой реакции [уравнение (1)]
анионов дипептида в раствор добавляли щелочь
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
РЕАКЦИОННАЯ СПОСОБНОСТЬ TYR-PRO В БЕНЗОИЛИРОВАНИИ
935
(КОН) в таком количестве, чтобы часть реагента
оставалась в нереакционноспособной в ацилиро-
вании цвиттерионной форме. Концентрация ани-
онной формы Tyr-Pro равнялась концентрации до-
бавленной щелочи (с = сКOH), а его доля в растворе
α и наблюдаемая константа скорости kн определя-
лись выражениями (5) и (6):
α = cKOH/c0 = c/c0
(5)
kн = kг + kc
(6)
Кинетические исследования, проведенные ра-
нее [2-4], показали, что при отношении концен-
траций нереакционноспособной, цвиттерионной
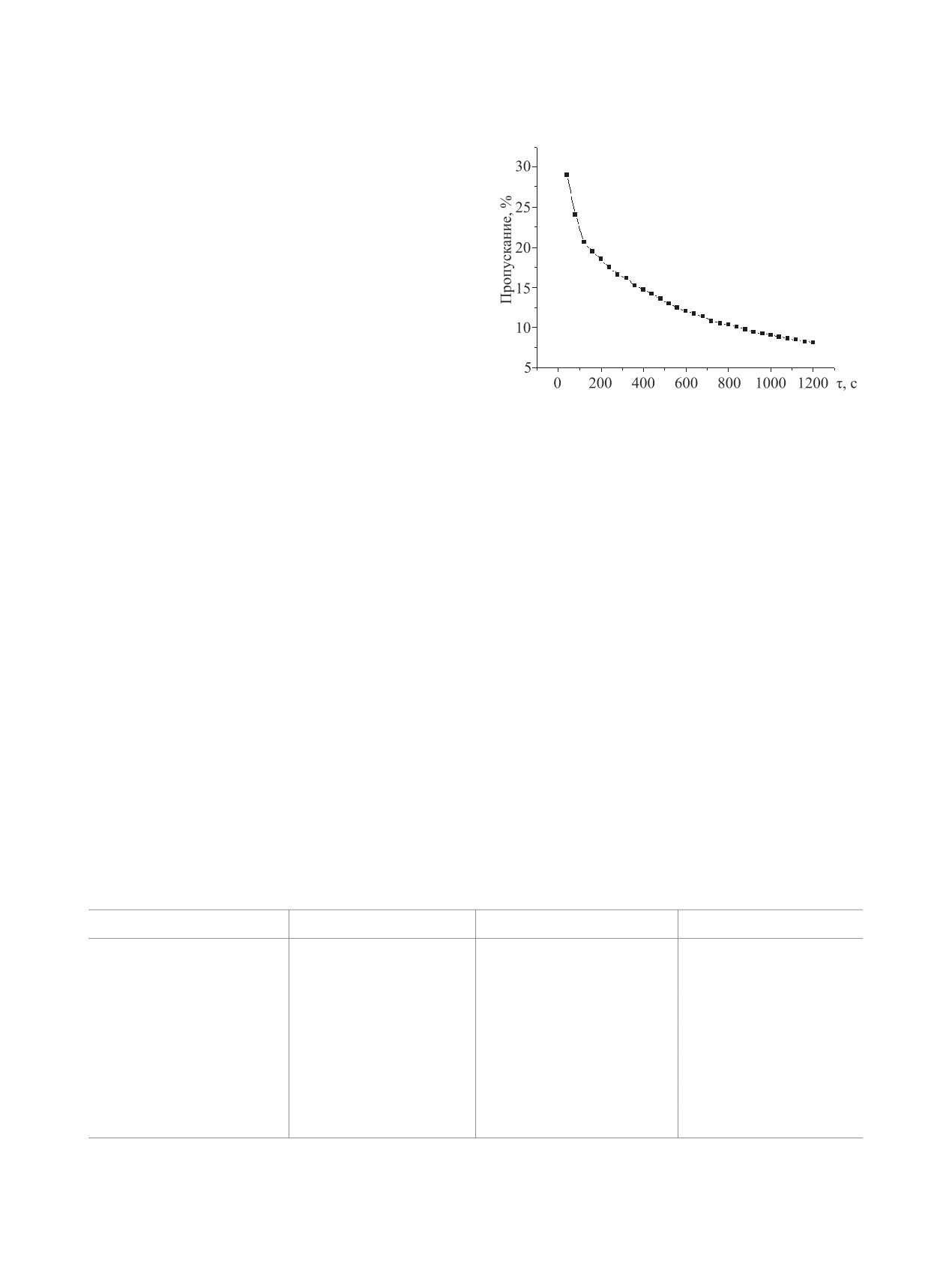
Рис. 1. Зависимость пропускания рабочего раствора от
времени для реакции Tyr-Pro с 2,4-ДНФБ в раствори-
(с±) и реакционноспособной, анионной (с) форм
теле вода (40 масс %) - 1,4-диоксан; 313 K.
α-аминокислоты (или дипептида) с±/c > 4, скоро-
стью щелочного гидролиза эфира можно пренеб-
Характер зависимости пропускания рабочего
речь по сравнению со скоростью N-ацилирования.
раствора от времени дает основание полагать, что
В таком случае константу скорости реакции (1)
в системе отсутствуют каталитические и автоката-
можно рассчитать по уравнению:
литические процессы и что атаке ацилирующего
kн
k =
(7)
агента подвергается единственный нуклеофиль-
с
ный центр - первичная аминогруппа тирозина.
Для того, чтобы проверить, протекает ли гидро-
Как будет показано ниже, именно она проявляет
лиз в условиях эксперимента, был проведен кине-
более ярко выраженные электронодонорные свой-
тический опыт (реакция L-пролина с 4-нитрофе-
ства по сравнению с другим возможным нуклео-
нилбензоатом), который повторяли несколько раз
филом - фенольным гидроксилом.
в растворителе одного и того же состава при одной
температуре, изменяя только начальную концен-
Экспериментально определенные кинетиче-
трацию аминокислоты. Постоянство величин k в
ские характеристики реакции (1) сведены в табл. 2.
изученном диапазоне температур (табл. 1) свиде-
Как видно из данных табл. 2, значения констант
тельствует о несущественном вкладе гидролиза
скорости реакции Tyr-Pro с эфирами увеличивает-
эфиров в общую скорость реакции.
ся в ряду: 2,6-ДНФБ < 2,4-ДНФБ < 2,4,6-ТНФБ.
На рис. 1 представлена одна из эксперимен-
Такая же последовательность реакционной спо-
тально полученных кинетических кривых реакции
собности эфиров, связанная с усилением их элек-
бензоилирования Tyr-Pro.
трофильности, наблюдалась ранее в реакциях с
Таблица 1. Значения kн и k реакции L-пролина с 4-нитрофенилбензоатом при разных концентрациях анионов аминокис-
лоты с; Х1 - мольная доля воды в 1,4-диоксане; 298 K.
Х1,
с, моль·л-1
k, л·моль-1·с-1
kн×102, с-1
0.0169
1.87 ± 0.06
1.10 ± 0.04
0.00846
0.93 ± 0.01
1.10 ± 0.02
0.765
0.00564
0.64 ± 0.01
1.13 ± 0.02
0.00423
0.493 ± 0.007
1.16 ± 0.02
0.0196
5.0 ± 0.6
2.6 ± 0.3
0.951
0.00980
2.46 ± 0.07
2.51 ± 0.07
0.00653
1.67 ± 0.06
2.56 ± 0.09
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
936
КУСТОВА и др.
Таблица 2. Кинетические характеристики реакции (1) в растворителе вода (40 масс %) - 1,4-диоксан.
Т, K
с, моль·л-1
kн×104, с-1
k×102, л·моль-1·с-1
ΔH≠298, кДж·моль-1
-ΔS≠298, Дж·моль-1·K-1
2,4-ДНФБ
298
4.19 ± 0.17
4.79 ± 0.19
303
5.21 ± 0.16
5.94 ± 0.18
0.00876
37 ± 2
145 ± 7
308
6.49 ± 0.43
7.40 ± 0.49
313
9.43 ± 0.57
10.8 ± 0.65
2,6-ДНФБ
298
0.00876
3.02 ± 0.22
3.45 ± 0.25
-
-
2,4,6-ТНФБ
298
25.3 ± 0.3
28.9 ± 0.3
303
0.00876
37.3 ± 0.5
42.6 ± 0.6
49 ± 2
91 ± 6
308
54.8 ± 0.5
56.4 ± 0.1
Gly-Gly и Ala-Ala [2, 4]. Следует отметить также
Анализируя данные табл. 3, видно, что при пе-
близкие величины активационных параметров в
реходе от Gly к Gly-Gly величина pK уменьшается
случае реакции с 2,4-ДНФБ рассматриваемого
на 1.55, а величина константы скорости ацилиро-
вания - в 3.6 раза. Согласно данным [7] дипептид
нами дипептида Tyr-Pro (табл. 2) и аналогичной
Tyr-Pro демонстрирует низкую основность в во-
реакции с Gly (ΔH≠298 = 31 кДж·моль-1, ΔS≠298 =
дных растворах [pK(Tyr-Pro) 7.81, для сравнения
-134 Дж·моль-1·K-1) [4].
pK(Tyr) 9.11], что, по всей видимости, является
Сопоставление кинетических характеристик
причиной снижения на порядок величины k ре-
бензоилирования α-аминокислот и дипептидов в
акции бензоилирования Tyr-Pro (табл. 2) по срав-
водном 1,4-диоксане (табл. 3) указывает на опре-
нению с Gly-Gly. При наращивании пептидной
деляющее влияние основности участвующих в
цепи до семи аминокислотных фрагментов: Tyr-
ацилировании аминогрупп на скорость реакции.
Pro-Phe-Pro-Gly-Pro-Ile и Tyr-Pro-Phe-Val-Glu-
Таблица 3. Константы скорости N-ацилирования α-аминокислот и дипептидов в растворителе вода (40 масс %) -
1,4-диоксан, 298 K.
Амин
рKa
Эфир
kb, л·моль-1·с-1
Амин
рKa
Эфир
kb, л·моль-1·с-1
2,4-ДНФБ
2.12
2,4-ДНФБ
11.1
2,5-ДНФБ
0.42
2,5-ДНФБ
7.9
Gly
9.78
L-Pro
10.64
2,6-ДНФБ
0.30
2,6-ДНФБ
3.0
2,4,6-ТНФБ
11.2
2,4,6-ТНФБ
36.5
2,4-ДНФБ
0.54
L-Asn
8.80
2,4,6-ТНФБ
0.75
2,5-ДНФБ
0.09
DL-Ser
9.15
2,4,6-ТНФБ
1.67
DL-Val
9.72
2,6-ДНФБ
0.06
Gly-Gly
8.23
2,4,6-ТНФБ
3.1
2,4,6-ТНФБ
5.2
L-Ala-L-Ala
8.14
2,4-ДНФБ
0.35c
a Величина рK, характеризующая протонирование первичной аминогруппы в воде, взята из базы данных [7].
b Ошибки в определении константы скорости не превышают 5%.
c Величина k приведена для растворителя вода (60 масс %) - 1,4-диоксан.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
РЕАКЦИОННАЯ СПОСОБНОСТЬ TYR-PRO В БЕНЗОИЛИРОВАНИИ
937
N2
N3
C
7
C10
O4
9
C
11
O1
C8
C
C7
C3
C12
C14
C6
C9
O3
C5
C14
O2
C2
O1
C13
C8
O2
C2
O4
N1
C10
C13
N1
O3
C11
C1
C12
C1
C4
C5
C3
C4
∆E = 0 ккал/моль (конформер 1)
∆E = 0.64 ккал/моль (конформер 2)
N2
O2
C3
C7
O1
C8
C6
N1
C2
O3
C1
C11
C9
C10
C4
C13
C5
C14
C12
O4
∆E = 2.96 ккал/моль (конформер 3)
Рис. 2. Строение конформеров молекулы Tyr-Pro и их относительная энергия. Все конформеры имеют внутримолекуляр-
ную водородную связь в карбоксильной группе.
Pro-Ile величины pK уменьшаются незначительно
частот не обнаружено. Для депротонированной
и составляют 7.31 и 7.34 соответственно [7]. Для
(по карбоксильной группе пролина) формы ди-
прогнозирования констант скорости реакций геп-
пептида заряд принимали равным -1, а мульти-
тапептидов с 2,4,6-ТНФБ была использована ли-
плетность 1.
нейная корреляция между lgk реакций аминокис-
На основании выполненных квантово-хими-
лот и дипептидов с 2,4,6-ТНФБ (табл. 3) и значе-
ческих расчетов среди возможных конформеров
ниями pK их аминогрупп. Экстраполяция данной
нейтральной формы Tyr-Pro были выбраны 3 наи-
зависимости дает для этих соединений величину k
более устойчивые структуры, изображенные на
на уровне 0.080-0.084 л·моль-1·c-1.
рис. 2.
В связи с наличием в молекуле Tyr-Pro двух
На рис. 3 представлена геометрическая струк-
пригодных для атаки электрофильной группой
тура депротонированной формы дипептида.
(бензоилом) нуклеофильных центров - первичной
аминогруппы тирозина и его фенольного гидрок-
Из данных рис. 2 и 3 видно, что геометриче-
сила - представляло интерес на основе компьютер-
ское строение дипептида (конформер 1) претер-
ного моделирования рассматриваемой молекулы
певает значительные изменения при переходе от
выяснить, электронодонорные свойства какой из
нейтральной к анионной форме. Существенно
этих функциональных групп выражены сильнее.
увеличивается торсионный угол N1-C5-C6-C7 и
Методом DFT/B3LYP/cc-pVTZ с использова-
расстояние между циклическими фрагментами
нием программы Gaussian 03 [8] проведено ком-
молекулы. Торсионный угол N1-C5-C6-N2, на-
пьютерное моделирование исследуемого объекта
против, уменьшается за счёт образования внутри-
(дипептида) в нейтральной и анионной формах.
молекулярной водородной связи между кислоро-
При расчетах выполняли полную оптимизацию ге-
дом депротонированной карбоксильной группы
ометрических параметров обеих форм дипептида.
и водородом первичной аминогруппы, связь N-H
Соответствие оптимизированной геометрии ми-
при этом удлиняется (от 1.015 до 1.021 А), что об-
нимуму на поверхности потенциальной энергии
легчает её разрыв в ходе реакции ацилирования.
проверяли расчетом частот колебаний, мнимых
Также происходит изменение направления и ве-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
938
КУСТОВА и др.
гибридизации) с более высокой энергией по срав-
9
C
нению с LP2-орбиталью кислорода. При перехо-
O3
N2
C11
C14
O4
де от нейтральной к анионной форме дипептида
C7C8
O2
энергия орбитали LP(N2) повышается и ее элек-
C6
C13
2
C
тронодонорные свойства усиливаются.
C5
C10
C12
Таким образом, NBO-анализ распределения
C1
N1
O1
электронной плотности в анионной форме ди-
C3
C4
пептида показал, что в рассматриваемой реакции
из двух возможных нуклефильных центров - азота
первичной аминогруппы и кислорода фенольного
Рис. 3. Геометрическое строение анионной формы
Tyr-Pro с изображением неподеленных пар LP(N2) и
гидроксила - предпочтительным является первый.
LP2(O2) на нуклеофильных центрах.
Результаты выполненных квантово-химических
расчетов и полученные кинетические данные ре-
личины дипольного момента при переходе от ней-
акции (1) открывают возможности модификации
тральной (μ 4.38 D) к анионной форме дипептида
дипептида Tyr-Pro по α-аминогруппе тирозина.
(μ 11.23 D).
Дипептид L-Tyr-L-Pro в форме гидрохлорида
С целью сопоставления электронных харак-
был синтезирован в ФГУП «Институт химиче-
теристик двух возможных нуклеофильных цен-
ских реактивов и особо чистых химических ве-
тров - азота первичной аминогруппы (N2) и кис-
ществ Национального исследовательского центра
лорода (O2) фенольного гидроксила - выполнен
«Курчатовский институт»» (содержание основно-
NBO-анализ [9, 10] распределения электронной
го вещества составляло 99.95%). 2,4-, 2,6-дини-
плотности в двух формах дипептида. Результаты
трофениловые и 2,4,6-тринитрофениловый эфиры
NBO-анализа указывают на то, что атом кислоро-
бензойной кислоты получали ацилированием со-
да фенильного фрагмента имеет 2 неподеленные
ответствующих нитропроизводных фенола бензо-
пары: LP1(sp1,2-гибридизации) с низкой энер-
илхлоридом. Все реактивы и растворитель были
гией и LP2(рπ) (рис. 3) с более высокой энергией
очищены до полного соответствия их физических
(табл. 4), однако, LP2-орбиталь кислорода вовлече-
параметров (температура плавления/кипения и
на в сильное сопряжение с π-системой ароматиче-
показатель преломления) литературным данным.
ского кольца LP2 → π*(C12-C13) (табл. 4), за счёт
1,4-Диоксан квалификации «хч» в течение семи
чего её электронодонорные свойства снижаются.
дней выдерживали над гидроксидом калия, затем
Атом N2 имеет одну неподеленную пару LP(sp3,6-
осуществляли его перегонку при атмосферном
Таблица 4. Электронные характеристики двух возможных нуклеофильных центров в нейтральной и анионной
формах дипептида Tyr-Pro.
Нейтральная форма
Анионная форма
Электронные характеристики
N2
O2
N2
O2
Величина заряда, а.е.з.
-0.826
-0.629
-0.849
-0.782
-16.55 (LP1)
-14.54 (LP1)
Энергия неподеленных пар, эВ
-8.51
-5.15
-8.68 (LP2)
-6.52 (LP2)
Заселенность
1.98 (LP1)
1.98 (LP1)
1.95
1.94
LP-орбиталей
1.88 (LP2)
1.89 (LP2)
Взаимодействующие орбитали
LP →
LP1 →
LP2 →
LP →
LP1 →
LP2 →
(донор → акцептор)
σ*(C5-C6)
σ*(C12-C13)
π*(C12-C13)
σ*(C5-C6)
σ*(C12-C13)
π*(C12-C13)
Энергия донорно-акцепторного
8.45
6.70
25.23
9.44
7.13
27.88
взаимодействия, ккал/моль
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
РЕАКЦИОННАЯ СПОСОБНОСТЬ TYR-PRO В БЕНЗОИЛИРОВАНИИ
939
давлении в присутствии металлического натрия
lazkina E.K., Beletskaya I.P., Ustynyuk Yu.A.,
с целью удаления органических перекисей. Для
Solov’ev P.A., Ivanov I.V., Malina E.V., Sivova N.V.,
приготовления бинарного растворителя использо-
Negrebetskii V.V., Baukov Yu.I., Pozharskaya N.A.,
вали деионизованную воду, полученную на деио-
Traven’ V.F., Shchekotikhin A.E., Varlamov A.V.,
низаторе воды «ДВ-1». Рабочий раствор дипепти-
Borisova T.N., Lesina Yu.A., Krasnokutskaya E.A.,
да с КОН в бинарном растворителе и рабочий
Rogozhnikov S.I., Shurov S.N., Kustova T.P.,
раствор эфира в 1,4-диоксане готовили по точной
Klyuev M.V., Khelevina O.G., Stuzhin P.A., Fedo-
rov A.Yu., Gushchin A.V., Dodonov V.A., Kolo-
навеске и термостатировали в течение 30 мин до
начала опыта. Начальные концентрации реаген-
bov A.V., Plakhtinskii V.V., Orlov V.Yu., Kri-
тов составляли 10-2 и 10-4 моль/л соответствен-
ven’ko A.P., Fedotova O.V., Pchelintseva N.V.,
Charushin V.N., Chupakhin O.N., Klimochkin Yu.N.,
но. Изменение пропускания раствора в ходе реак-
Klimochkina A.Yu., Kuryatnikov V.N., Malinovs-
ции фиксировали с помощью спектрофотометра
kaya Yu.A., Levina A.S., Zhuravlev O.E., Voronchikhi-
СФ-56, снабженного термостатируемой ячейкой
na L.I., Fisyuk A.S., Aksenov A.V., Aksenov N.A.,
для кювет.
Aksenova I.V. Russ. J. Org. Chem. 2017, 53, 1275-
БЛАГОДАРНОСТИ
1437.] doi 10.1134/S1070428017090019
Авторы выражают благодарность профессору
2.
Курицын Л.В., Кустова Т.П., Садовников А.И., Ка-
Гиричевой Н.И. за помощь в выполнении и обсуж-
линина Н.В., Клюев М.В. Кинетика реакций ациль-
дении результатов квантово-химических расчетов.
ного переноса. Ред. Л.В. Курицын. Иваново: изд-во
КОНФЛИКТ ИНТЕРЕСОВ
Иван. гос. ун-та, 2006.
Авторы заявляют об отсутствии конфликта ин-
3.
Курицын Л.В., Кочетова Л.Б., Калинина Н.В., Ку-
стова Т.П. ЖОХ. 2012, 82, 1814-1819. [Kuritsyn L.V.,
тересов.
Kochetova L.B., Kalinina N.V., Kustova T.P. Russ.
СПИСОК ЛИТЕРАТУРЫ
J. Gen. Chem. 2012, 82, 1805-1809.] doi 10.1134/
1. Антипин И.С., Казымова М.А., Кузнецов М.А., Ва-
S1070363212110114
сильев А.В., Ищенко М.А., Кирюшкин А.А., Куз-
4.
Кочетова Л.Б., Калинина Н.В., Грабчилева Ю.Э.,
нецова Л.М., Макаренко С.В., Островский В.А.,
Симонова К.А., Кустова Т.П. Бутлеровские сообще-
Петров М.Л., Солод О.В., Тришин Ю.Г., Яков-
ния. 2015, 43, 1-11. roi. jbc-01/15-43-7-1
лев И.П., Ненайденко В.Г., Белоглазкина Е.К.,
5.
Гузеватых Л.С., Воронина Т.А., Емельянова Т.Г.,
Белецкая И.П., Устынюк Ю.А., Соловьев П.А.,
Андреева Л.А., Алфеева Л.Ю., Середенин С.Б., Мя-
Иванов И.В., Малина Е.В., Сивова Н.В., Негре-
соедов Н.Ф. Изв. РАН. Сер. биол. 2008, 35, 61-67.
бецкий В.В., Бауков Ю.И., Пожарская Н.А., Тра-
[Guzevatykh L.S., Voronina T.A., Emelyanova T.G.,
вень В.Ф., Щекотихин А.Е., Варламов А.В., Борисо-
Seredenin S.B., Andreeva L.A., Alfeeva L.Yu.,
ва Т.Н., Лесина Ю.А., Краснокутская Е.А., Рогожни-
Myasoedov N.F. Biology Bull. 2008, 35, 50-55.] doi
ков С.И., Шуров С.Н., Кустова Т.П., Клюев М.В.,
10.1134/S1062359008010081
Хелевина О.Г., Стужин П.А., Федоров А.Ю., Гу-
6.
Гузеватых Л.С. Биоорг. хим., 2008, 34, 591-609.
щин А.В., Додонов В.А., Колобов А.В., Плахтин-
[Guzevatykh L.S. Russ. J. Bioorg. Chem. 2008, 34,
ский В.В., Орлов В.Ю., Кривенько А.П., Федото-
526-543.] doi 10.1134/S1068162008050026
ва О.В., Пчелинцева Н.В., Чарушин В.Н., Чупа-
7.
The IUPAC Stability Constants Database (SC-
хин О.Н., Климочкин Ю.Н., Климочкина А.Ю., Ку-
Database)©, software version 5.86, data version 4.83.
рятников В.Н., Малиновская Ю.А., Левина А.С.,
Журавлев О.Е., Ворончихина Л.И., Фисюк А.С.,
8.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Аксенов А.В., Аксенов Н.А., Аксенова И.В. ЖОрХ.
Robb M.A., Cheeseman J.R., Montgomery J.A. Jr.,
2017, 53, 1257-1408. [Antipin I.S., Kazymova M.A.,
Vreven T., Kudin K.N., Burant J.C., Millam J.M.,
Kuznetsov M.A., Vasilyev A.V., Ishchenko M.A.,
Iyengar S.S., Tomasi J., Barone V., Mennucci B.,
Kiryushkin A.A., Kuznetsova L.M., Makarenko S.V.,
Cossi M., Scalmani G., Rega N., Petersson G.A.,
Ostrovskii V.A., Petrov M.L., Solod O.V., Tri-
Nakatsuji H., Hada M., Ehara M., Toyota K., Fukuda R.,
shin Yu.G., Yakovlev I.P., Nenaidenko V.G., Belog-
Hasegawa J., Ishida M., Nakajima T., Honda Y.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020
940
КУСТОВА и др.
Kitao O., Nakai H., Klene, Li X., Knox J.E.,
Martin R.L., Fox D.J., Keith T., Al-Laham M.A.,
Hratchian H.P., Cross J.B., Adamo C., Jaramillo J.,
PengC.Y.,NanayakkaraA.,ChallacombeM.,GillP.M.W.,
Gomperts R., Stratmann R.E., Yazyev O., Austin A.J.,
Johnson B., Chen W., Wong M.W., Gonzalez C.,
Cammi R., Pomelli C., Ochterski J.W., Ayala P.Y.,
Pople J.A. Gaussian 03, Revision B 04, Gaussian Inc,
Morokuma K., Voth G.A., Salvador P., Dannen-
Pittsburgh, PA, 2003.
berg J.J., Zakrzewski V.G., Dapprich S., Daniels A.D.,
9. Glendening E.D., Reed A.E., Carpenter J.E.,
Strain M.C., Farkas O., Malick D.K., Rabuck A.D.,
Weinhold F. NBO 3.1, QCPE Bull., 10, 58, 1990.
Raghavachari K., Foresman J.B., Ortiz J.V., Cui Q.,
10. Weinhold F., Landis C.R. Valency and Bonding. A
Baboul A.G., Clifford S., Cioslowski J., Stefanov B.B.,
Natural Bond Orbital Donor-Acceptor Perspective.
Liu G., Liashenko A., Piskorz P., Komaromi I.,
Cambridge: Cambridge University Press, 2005.
Tyr-Pro Reactivity in Benzoylation
in the Medium of Aqueous 1,4-Dioxane
T. P. Kustovaa, *, I. I. Loktevaa, L. B. Kochetovaa, and D. S. Khachatryanb
a Ivanovo State University, 1530250, Russia, Ivanovo, ul. Ermaka 39
*e-mail: kustova_t@mail.ru
b Institute of Chemical Reagents and Highly Pure Chemical Substances, National Research Center «Kurchatov Institute»»,
107076, Russia, Moscow, Bogorodskii val 3
Received January 9, 2020; revised February 7, 2020; accepted February 11, 2020
On a base of experimental study of the kinetics of L-Tyr-L-Pro dipeptide interaction with activated by nitro
group phenyl benzoates in the solvent water (40 wt %)-1,4-dioxane in the temperature interval 298-313 K, a
diapason of rate constants variation k298 = 0.035-0.564 L·mol-1·s-1 and the reactions activation barriers 37-
49 kJ·mole-1 are established. A computer simulation of neutral and anionic forms of the dipeptide is carried
out at DFT/B3LYP/cc-pVTZ level. NBO-analysis of the electronic density distribution in these forms of the
dipeptide has shown that in the reaction under study, of the two possible nucleophylic centers - nitrogen of the
primary amine group and oxygen of phenol hydroxyl - the former is most preferable.
Keywords: dipeptide, tyrosylproline, benzoylation, kinetics, 1,4-dioxane, 2,4- and 2,6-dinitro phenyl benzoates,
picril benzoate
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 6 2020