ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 993-1003
УДК 547.576; 547.814.1; 548.737
СИНТЕЗ И СВОЙСТВА 3-ЗАМЕЩЕННЫХ
2Н-ХРОМЕН-2-ОНОВ
© 2020 г. И. В. Дяченкоa, В. Д. Дяченкоa, П. В. Дороватовскийb,
В. Н. Хрусталевc, d, В. Г. Ненайденкоe, *
a Луганский национальный университет им. Тараса Шевченко, 91011, Украина, г. Луганск, ул. Оборонная 2
b Национальный исследовательский центр «Курчатовский институт»,
123182, Россия, г. Москва, ул. Академика Курчатова 1
c ФГАОУ ВО «Российский университет дружбы народов», 117198, Россия, г. Москва, ул. Миклухо-Маклая 6
d ФГБУН «Институт органической химии им. Н.Д. Зелинского», 119991, Россия, г. Москва, Ленинский пр. 47
e ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
119991, Россия, г. Москва, Ленинские горы 1
*e-mail: nenajdenko@gmail.com
Поступила в редакцию 05 апреля 2020 г.
После доработки 07 апреля 2020 г.
Принята к публикации 10 апреля 2020 г.
Конденсацией салицилового альдегида с СН-кислотами - п-метоксиацетоацетанилидом, этил 3-ами-
но-3-тиоксопропаноатом, 3-амино-N-арил-3-тиоксопропанамидами и этил 2-тиазол-2- и -4-илацетатами
синтезированы 3-замещенные хромен-2-оны и изучены их некоторые свойства. Строение 3-[4'-(4''-хлор-
фенил)тиазол-2'-ил]-2Н-хромен-2-она, 2-оксо-2Н-хромен-3-карбоксамида и 2-имино-N-(2-метоксифе-
нил)-2Н-хромен-3-карбоксамида изучено методом РСА.
Ключевые слова: п-метоксиацетоацетанилид, 3-амино-3-тиоксопропаноат, 3-амино-N-арил-3-тиоксо-
пропанамид, этил 2-тиазол-2-илацетат, 2Н-хромен-2-он (кумарин), рентгеноструктурный анализ.
DOI: 10.31857/S0514749220070010
Производные 2Н-хромен-2-она (кумарина) об-
дит к образованию 2-гидрокси-2-метил-N-(4-ме-
ладают различными видами биологической актив-
токсифенил)-2Н-хромен-3-карбоксамида 4. Веро-
ности, среди которых отметим фунгицидную [1],
ятным интермедиатом в данной конденсации яв-
антимикробную [2, 3] и противоопухолевую [4].
ляется алкен Кнёвенагеля А, который внутримо-
Они используются в качестве полупродуктов при
лекулярно хемоселективно циклоконденсируется
получении красителей с высокой флуоресценцией
в конечную структуру 4.
[5], антикоагулянтов [6], активаторов каспаз и ин-
Взаимодействие салицилаля 1 с СН-кислотой
дукторов апоптоза [7], а также ингибиторов аце-
3 в однотипных указанным выше условиях за-
тилхолинэстеразы [8].
канчивается образованием N-арил-2-имино-2Н-
В продолжение исследований по химии
хромен-3-карбоксамидов
5a, b. По-видимому,
2Н-хромен-2-онов [9-11] нами изучены конден-
после образования алкена Кнёвенагеля В реали-
сации салицилового альдегида 1 с СН-кислота-
зуется внутримолекулярная гетероциклизация с
ми - п-метоксиацетоацетанилидом 2 и 3-амино-
элиминированием сероводорода, результатом ко-
N-арил-3-тиоксопропанамидами 3, протекающие в
торой является формирование гетероциклической
этаноле при 20°С в присутствии Et3N. Установлено,
конденсированной системы 5. Обработка соедине-
что введение в эту реакцию СН-кислоты 2 приво-
ния 5а водным раствором КОН приводит к образо-
993
994
ДЯЧЕНКО и др.
Схема 1.
OMe
OMe
O
N
H
CHO
Me
O
O
2
NH
–H2O
OH
O
1
OH Me
A
O
MeO
N
OMe
H
O
O
R
H2N
S
N
N
3a, b
H
Me
8
O NH
O
OH
Me
8
4
I
8 Me/KOH
7
O
O
O
NH
R
H2O/KOH
N
N
-H2S
H
H
NH
R
Me
2
O NH
O O
OH S
B
5a, b
6
3, 5, R = Me (a), MeO (b).
ванию 2-оксо-N-(о-толил)-2Н-хромен-3-карбокса-
(среднеквадратичное отклонение атомов от сред-
мида 6 как результат гидролиза иминогруппы до
ней плоскости равно 0.040 Å), что определяется
карбонильной.
наличием как обширной системы сопряженных
связей, так и достаточно прочной внутримолеку-
Алкилирование иминохромена 5b нонилиоди-
лярной водородной связи N-H∙∙∙N (рис. 1, табл. 1).
дом 7 в ДМФА при 20°С в щелочной среде проте-
Метоксигруппа копланарна фенильному заме-
кает региоселективно по атому N амидного фраг-
стителю [торсионный угол C12-C11-O3-C16 равен
мента с образованием 2-имино-N-(2-метоксифе-
-2.28(17)°], а метоксифенильный заместитель раз-
нил)-N-нонил-2Н-хромен-3-карбоксамида 8, о чем
вернут относительно плоскости основного фраг-
свидетельствует его спектр ЯМР 1Н - исчезает
мента на угол 18.31(5)°. Наблюдаемая геометрия
сигнал именно протона группы CONH (эксперим.
молекулы 5b стабилизируется также внутримо-
часть) (схема 1).
лекулярной водородной связью N-H∙∙∙O (рис. 1,
Для однозначного выяснения направления рас-
табл. 1).
смотренной выше конденсации и установления
В кристалле молекулы 5b образуют стопки
строения ее продуктов 2-имино-N-(2-метоксифе-
вдоль кристаллографической оси b. Молекулы в
нил)-2Н-хромен-3-карбоксамид 5b изучен мето-
стопках расположены под углом ~53° по отноше-
дом РСА.
нию к плоскости (010) (рис. 2). Короткие контакты
Основной 2-имино-2Н-хромен-3-карбоксамид-
в кристаллической структуре соединения 5b от-
ный фрагмент молекулы 5b практически плоский
сутствуют.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И СВОЙСТВА 3-ЗАМЕЩЕННЫХ 2Н-ХРОМЕН-2-ОНОВ
995
O2
C14
C15
C13
C5
C9
C6
C10
C4A
C4C3
N2
C12
a
C11
C7
c
8A
2
0
C
C
C8
N1
O3
O1
C16
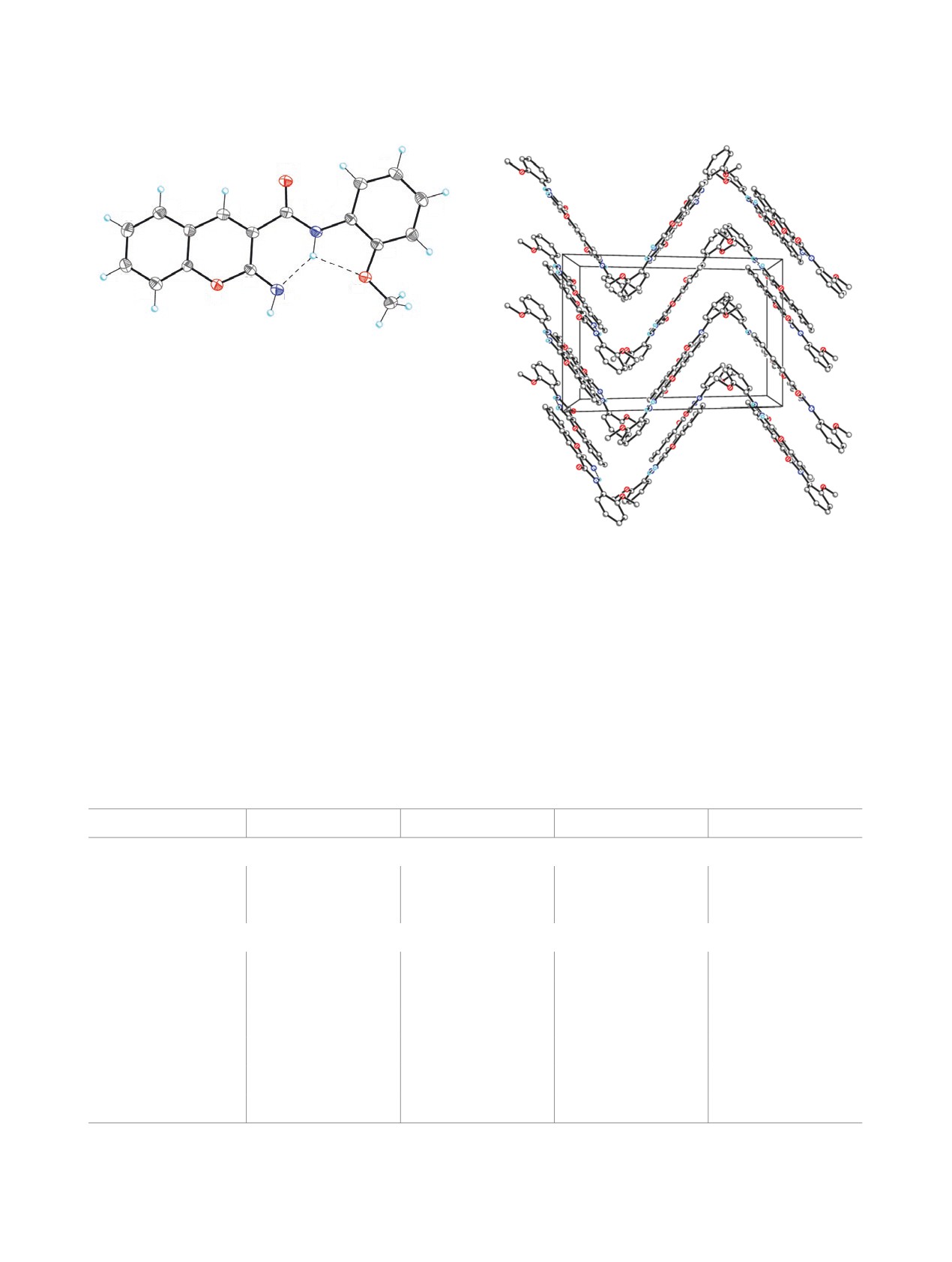
Рис.
1. Молекулярная структура соединения
5b.
Атомы представлены 50%-эллипсоидами анизотроп-
ных смещений. Штриховой линией показана внутри-
молекулярная водородная связь.
b
Введение в конденсацию с салицилалем 1 этил
3-амино-3-тиоксопропаноата 9 в этаноле при 20°С
в присутствии водного раствора КОН приводит к
образованию
2-оксо-2Н-хромен-3-карбоксамида
10. Вероятно, реакция протекает через стадию об-
разования алкена Кнёвенагеля С, хемоселективно
Рис. 2. Кристаллическая структура соединения 5b.
циклизующегося в конечную структуру 10. При
этом осуществляется гидролиз тиоамидной груп-
Соединение 10 кристаллизуется в моноклинной
пы до амидной. Отметим, что использование в
сингонии, пространственной группе P21/n, с тремя
этой конденсации в качестве катализатора морфо-
кристаллографически независимыми молекула-
лина вместо КОН приводит к образованию 2-ок-
ми в элементарной ячейке, имеющими подобное
со-2Н-хромен-3-карботиоамида [9] (схема 2).
строение. Все кристаллографически независимые
Для выяснения направления данной конден-
молекулы соединения 10 практически плоские
сации и однозначного установления строения ее
(среднеквадратичные отклонения атомов от сред-
продукта
2-оксо-2Н-хромен-3-карбоксамид
10
них плоскостей равны 0.034, 0.042 и 0.040 Å), что
изучен методом РСА.
определяется наличием как обширной системы
Таблица 1. Водородные связи в структурах 5b и 10 (Å и град).
D-H∙∙∙A
d(D-H), Å
d(H∙∙∙A), Å
d(D∙∙∙A), Å
Угол (DHA), град
Соединение 5b
N2-H2∙∙∙O3
0.938(15)
2.253(14)
2.6404(14)
103.9(10)
N2-H2∙∙∙N1
0.938(15)
1.915(15)
2.7097(15)
141.1(12)
Соеднение 10
N1-H1A∙∙∙O6
0.88
2.03
2.908(8)
173.6
N1-H1B∙∙∙O2
0.88
1.98
2.697(8)
137.2
N2-H2A∙∙∙O3
0.88
1.97
2.852(9)
175.8
N2-H2B∙∙∙O5
0.88
2.11
2.783(8)
133.1
N3-H3B∙∙∙O8
0.88
2.03
2.729(9)
135.0
N3-H3A∙∙∙O9 a
0.88
2.02
2.898(8)
173.6
а Кристаллографические операции для генерации симметрически эквивалентных атомов: -x+1, -y+1, -z+2.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
996
ДЯЧЕНКО и др.
Схема 2.
S
S
NH2
NH2
O OEt
9
OEt
1
OH O
S
C
N
S
N
R
O OEt
N
–EtOH, H2O
11
O OEt
-H2S
12a-c
S
S
O
R
N
N
NH2
N
O O
O O
O O
13
14a-c
10
12, 14, R = n-Bu (a), 4-ClC6H4 (b), cyclopropyl (c).
сопряженных связей, так и достаточно прочной
отличие от вышеописанного, является центросим-
внутримолекулярной водородной связи N-H∙∙∙O
метричным (рис. 4, табл. 1).
(рис. 3, табл. 1).
В кристалле, водородно-связанные димеры об-
разуют стопки вдоль кристаллографической оси c.
Две из трех кристаллографически независимых
Димеры в стопках расположены параллельно пло-
молекул соединения 10 образуют водородно-свя-
скостям (0 1 2) и (0 ¯ 2) (рис. 4).
занный димер посредством межмолекулярных во-
дородных связей N-H∙∙∙O (рис. 4, табл. 1). Третья
Применение в качестве СН-кислотной компо-
молекула также образует аналогичный водород-
ненты этил 2-[4-бутил(4-хлорфенил, циклопро-
но-связанный димер посредством межмолекуляр-
пил)тиазол-2-ил]ацетатов
12а-с в конденсации
ных водородных связей N-H∙∙∙O, но с симметри-
с салициловым альдегидом 1, реализующейся в
чески эквивалентной молекулой, т.е., этот димер, в
этаноле при 20°С в присутствии KОН, принципи-
O3
C5
C4
C9
a
c
C6
C4A
C3
0
N1
C7
C8A
C2
b
C8
O2
O1
Рис. 3. Молекулярная структура соединения 10 (пока-
зана одна из трех кристаллографически независимых
молекул). Атомы представлены 50%-эллипсоидами
Рис. 4. Кристаллическая структура соединения 10.
анизотропных смещений. Штриховой линией показа-
Штриховыми линиями показаны внутри- и межмоле-
на внутримолекулярная водородная связь.
кулярные водородные связи.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И СВОЙСТВА 3-ЗАМЕЩЕННЫХ 2Н-ХРОМЕН-2-ОНОВ
997
Cl1
C14
C15
C13
C16
a
c
C12
C17
0
C10
N1
C5
C4
C9
C11
b
C6
C4A
C3
S1
C2
C7
C8A
C8
O1
O2
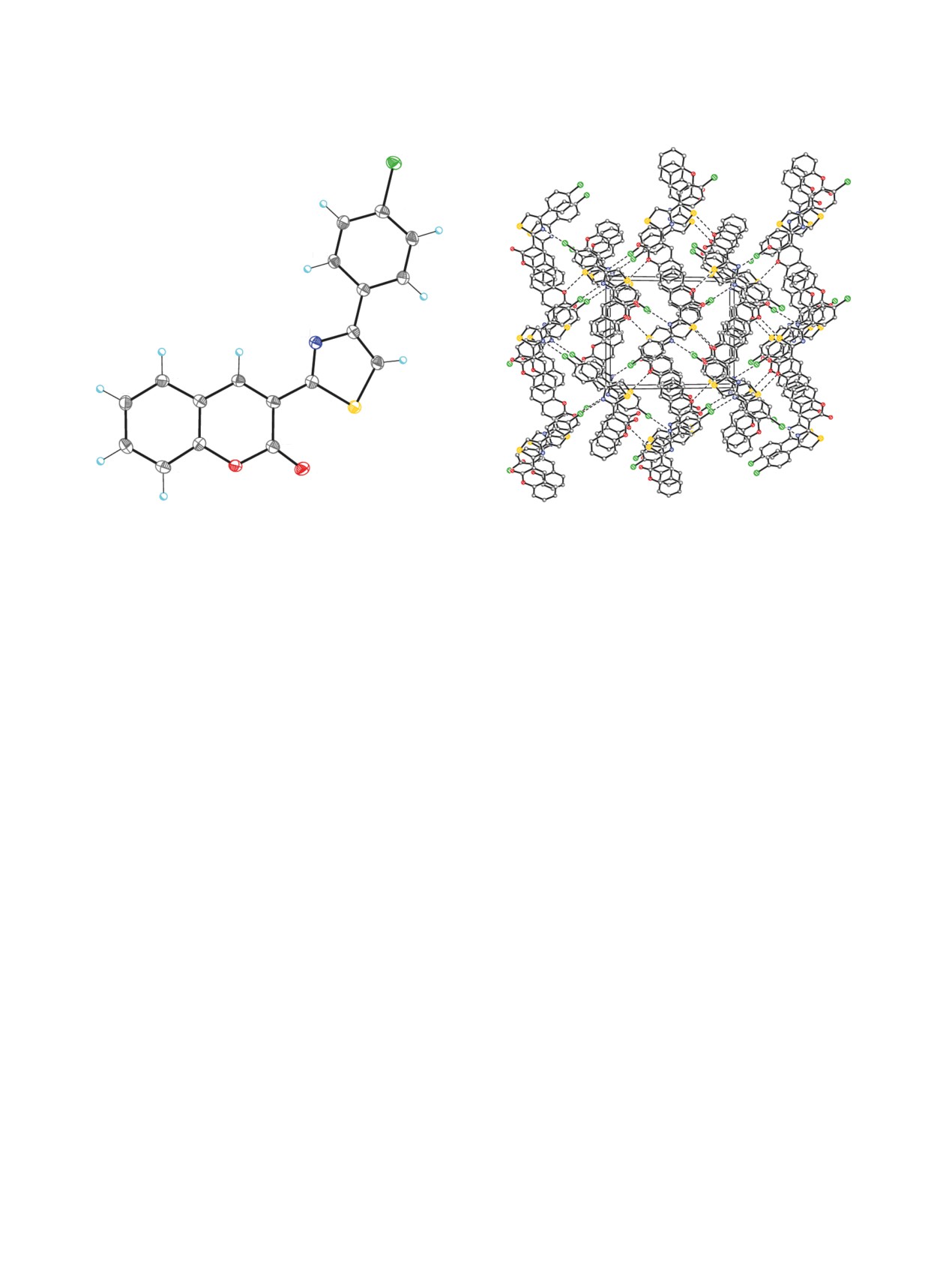
Рис. 5. Молекулярная структура соединения 14b.
Рис. 6. Кристаллическая структура соединения 14b.
Атомы представлены 50%-эллипсоидами анизотроп-
Штриховыми линиями показаны невалентные межмо-
ных смещений.
лекулярные взаимодействия Cl∙∙∙N и S∙∙∙O.
ально не изменяет направление реакции - полу-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
чаются 3-тиазолилзамещенные 2Н-хромен-2-оны
Параметры элементарных ячеек и интенсив-
13 и 14a-c соответственно - удобные исходные
ности отражений для 5b, 10 и 14b измерены на
реагенты для создания ансамблей циклов [12, 13]
синхротронной станции «БЕЛОК» Национального
(схема 2).
исследовательского центра
«Курчатовский ин-
Для однозначного установления строения про-
ститут», используя двухкоординатный детектор
дуктов данной конденсации 3-[4'-(4''-хлорфенил)-
Rayonix SX165 CCD (T 100 K, λ 0.96990 Å, φ-ска-
тиазол-2'-ил]-2Н-хромен-2-он 14b изучен методом
нирование с шагом 1.0°). Обработка эксперимен-
РСА.
тальных данных проведена с помощью программы
iMOSFLM, входящей в комплекс программ CCP4
Основной фрагмент молекулы 14b - 2Н-хромен-
[14]. Для полученных данных проведен учет по-
2-он практически плоский (среднеквадратичное
глощения рентгеновского излучения по програм-
отклонение атомов от средней плоскости равно
ме Scala [15]. Основные кристаллоструктурные
0.042 Å) (рис. 5). По-видимому, вследствие стери-
данные и параметры уточнения представлены в
ческих эффектов, тиазольный и хлорфенильный
табл. 2. Структуры определены прямыми мето-
заместители развернуты относительно плоскости
дами и уточнены полноматричным методом наи-
основного фрагмента на углы 10.10(9) и 8.34(8)°,
меньших квадратов по F2 в анизотропном прибли-
соответственно. Интересно отметить, что указан-
жении для неводородных атомов. Атомы водорода
ные заместители развернуты относительно этой
амино- и имино-групп в соединении 5b выявлены
плоскости в разные стороны.
объективно в разностных Фурье-синтезах и уточ-
В кристалле, молекулы 14b образуют стопки
нены изотропно с фиксированными параметрами
вдоль кристаллографической оси a. Молекулы
смещения [Uизо(H) = 1.2Uэкв(N)]. Атомы водорода
различных стопок связаны друг с другом посред-
амино-групп в соединении 10 выявлены объек-
ством слабых межмолекулярных невалентных вза-
тивно в разностных Фурье-синтезах и включены
имодействий Cl1∙∙∙N1 [-x, ½+y, ½-z] [3.2747(17) Å]
в уточнение с фиксированными позиционными
и S1∙∙∙O1 [1-x, ½+y, 1½-z] [3.2842(14) Å] в трехмер-
параметрами (модель «наездника») и изотропны-
ный каркас (рис. 6).
ми параметрами смещения [Uизо(H) = 1.2Uэкв(N)].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
998
ДЯЧЕНКО и др.
Таблица 2. Кристаллоструктурные данные для соединений 5b, 10 и 14b.
Соединение
5b
10
14b
Элементный состав
C17H14N2O3
C10H7NO3
C18H10ClNO2S
Молекулярная масса
294.30
189.17
339.78
Размеры монокристалла, мм
0.15×0.15×0.15
0.10×0.15×0.25
0.10×0.10×0.30
Сингония
Моноклинная
Моноклинная
Моноклинная
Пространственная группа
C2/c
P21/n
P21/c
a, Å
14.680(3)
12.700(3)
8.3300(17)
b, Å
11.455(2)
14.290(3)
12.384(3)
c, Å
17.415(4)
14.330(3)
14.622(3)
β, град
107.86(3)
105.43(3)
102.12(3)
V, Å3
2787.4(11)
2506.9(10)
1474.8(6)
Z
8
12
4
dc, г·см-3
1.403
1.504
1.530
F(000)
1232
1176
696
μ, мм-1
0.206
0.242
0.965
2θмакс, град
76.84
66.00
76.92
Количество измеренных отражений
23895
8182
22410
Количество независимых отражений (Rint)
2917 (0.062)
3543 (0.114)
3006 (0.092)
Количество отражений с I > 2σ(I)
2511
805
2524
Количество уточняемых параметров
207
176
209
R1; wR2 [для отражений с I > 2σ(I)]
0.046; 0.123
0.075; 0.153
0.044; 0.055
R1; wR2 (все измеренные отражения)
0.053; 0.129
0.243; 0.256
0.108; 0.116
GOF по F2
1.075
0.747
1.049
Коэффициент экстинкции
0.0045(4)
0.0007(1)
0.0111(11)
Tмин; Tмакс
0.960; 0.960
0.930; 0.970
0.740; 0.900
Положения остальных атомов водорода во всех со-
в Кембриджском Банке Структурных Данных, но-
единениях рассчитаны геометрически и включены
мера депонирования - CCDC 1877233 (5b), CCDC
в уточнение с фиксированными позиционными па-
1877234 (10) и CCDC 1877235 (14b).
раметрами (модель «наездника») и изотропными
ИK спектры получали на приборе ИКС-40 в
параметрами смещения [Uизо(H) = 1.5Uэкв(C) для
вазелиновом масле. Спектры ЯМР 1H и 13C ре-
CH3-групп и Uизо(H) = 1.2Uэкв(C) для остальных
гистрировали на спектрофотометре Varian VXR-
групп]. Все расчеты проведены с использовани-
400 (399.97 и 100 МГц соответственно) в рас-
ем комплекса программ SHELXTL [16]. Таблицы
творах DMSO-d6, внутренний стандарт - TMC.
координат атомов, длин связей, валентных и тор-
Масс-спектры получали на масс-спектрометре
сионных углов и анизотропных параметров сме-
высокого разрешения Orbitrap Elite (для соедине-
щения для соединений 5b, 10 и 14b депонированы
ний 5b, 6, 14b). Образцы для HRMS растворяли в
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И СВОЙСТВА 3-ЗАМЕЩЕННЫХ 2Н-ХРОМЕН-2-ОНОВ
999
1 мл DMSO, разбавляли в 100 раз 1%-ной HCOOH
при 20°С перемешивали 5 ч и оставляли на 2 сут.
в CH3CN, вводили шприцевым насосом со ско-
Образовавшийся осадок отфильтровывали, про-
ростью 40 мкл/мин в источник ионизации элек-
мывали этанолом и гексаном. Выход 2.1 г (77%),
трораспылением. Потоки газов источника были
желтый ватообразный продукт, т.пл. 202-204°С
отключены, напряжение на игле составляло
(BuOH). ИК спектр, ν, см-1: 3300 (NH),
1668
3.5 кВ, температура капилляра
275°С. Масс-
(СОNH). Спектр ЯМР 1Н, δ, м.д.: 2.34 c (3Н, Ме),
спектры регистрировали в режимах положи-
7.02 т (1Наром, J 6.9 Гц), 7.11-7.30 м (4Наром), 7.57
тельных и отрицательных ионов в орбитальной
т (1Наром, J 7.4 Гц), 7.78 д (1Наром, J 7.1 Гц), 8.24
ловушке с разрешением 480000. Внутренние ка-
д (1Наром, J 7.7 Гц), 8.58 с (1Н, С4Н=), 9.13 уш.с
либранты - ион 2DMSO + Н+ (m/z 157.03515) в по-
(1Н, =NH), 12.53 уш.с (1Н, СОNH). Масс-спектр,
ложительных ионах и додецилсульфат-анион (m/z
m/z (Iотн, %): 279.0 (100) [M + 1]+. Найдено, %: C
265.14789) в отрицательных ионах. Для остальных
73.25; H 4.93; N 9.91. C17H14N2О2. Вычислено, %:
соединений масс-спектры снимали на спектроме-
C 73.37; H 5.07; N 10.07. М 278.3.
тре Agilent 1100 Series с селективным детектором
2-Имино-N-(2-метоксифенил)-2Н-хромен-
Agilent LS/MSDLS (образцы вводили в матрице
3-карбоксамид (5b) получали аналогично сое-
CH3COOH, ионизация ЭУ, 70 эВ). Элементный
динению 5а при использовании 2.3 г (10 ммоль)
анализ осуществляли на приборе Perkin Elmer
3-амино-N-(2-метоксифенил)-3-тиоксопропанами-
CHN-analyser. Температуры плавления определя-
да 3b. Выход 2.4 г (82%), желтые кристаллы, т.пл.
ли на блоке Кофлера. Ход реакции и чистоту по-
161-163°С (BuOH). ИК спектр, ν, см-1: 3330 (NH),
лученных соединений контролировали методом
1662 (СОNH). Спектр ЯМР 1Н, δ, м.д.: 3.84 c (3Н,
ТСХ на пластинках Silufol UV-254 в системе аце-
МеО), 6.91 т (1Наром, J 7.2 Гц), 7.01-7.12 м (2Наром),
тон-гексан (3:5), проявление парами йода и УФ-
7.19-7.28 м (2Наром), 7.54 т (1Наром, J 7.2 Гц), 7.76
облучением.
д (1Наром, J 7.6 Гц), 8.42 д (1Наром, J 7.2 Гц), 8.52
2-Гидрокси-2-метил-N-(2-метоксифенил)-
уш.с (1Н, =NH), 9.13 с (1Н, С4Н=), 12.79 уш.с (1Н,
2Н-хромен-3-карбоксамид
(4). Смесь
1.1 мл
СОNH). Спектр ЯМР 13С, δ, м.д.: 56.4, 111.5, 115.4,
(10 ммоль) салицилаля 1, 2.1 г (10 ммоль) п-ме-
119.0, 120.4, 120.9, 121.1, 124.5, 124.6, 128.3, 130.5,
токсиацетоацетанилида 2 и 0.1 мл Et3N в 50 мл
133.6, 142.0, 149.4, 154.0, 155.7, 160.0. Найдено
этанола при 20°С перемешивали 4 ч и оставляли
295.1078 [M + Н]+. C17H14NО3. Вычислено (М + Н)
на 3 сут. Образовавшийся осадок отфильтровыва-
295.1004.
ли и промывали этанолом и гексаном. Выход 2.1 г
2-Оксо-N-(о-толил)-2Н-хромен-3-кар-
(68%), желтые трубчатообразные кристаллы, т.пл.
боксамид (6). К перемешиваемому раствору 2.8 г
131-132°С (EtOH). ИК спектр, ν, см-1: 3010-3435
(10 ммоль) хромена 5а в 25 мл ДМФА при 20°С
(ОН, NH), 1658 (СОNH). Спектр ЯМР 1Н, δ, м.д.:
прибавляли 5.6 мл (10 ммоль) 10%-ного водного
1.79 c (3Н, Ме), 3.75 с (3H, МеО), 6.95-7.01 м (4Н,
раствора КОН, перемешивали 4 ч и оставляли на
Наром и С4Н), 7.18-7.24 м (2Н, Наром и ОН), 7.30 т
2 сут. Затем реакционную смесь разбавляли рав-
(1Наром, J 6.5 Гц), 7.37 д (1Наром, J 7.5 Гц), 7.61 д
ным объемом воды и отфильтровывали образовав-
(2Наром, J 7.2 Гц), 9.94 уш.с (1Н, NH). Спектр ЯМР
шийся осадок. Промывали последовательно водой,
13С, δ, м.д.: 26.4, 26.9, 55.2, 97.6, 113.9 (2С), 119.4,
этанолом и гексаном. Выход 2.1 г (75%), желтый
121.1, 121.4 (2С), 128.1, 128.4, 131.9, 132.2, 152.3,
ватообразный продукт, т.пл. 215-216°С (BuOH).
155.7, 164.0, 195.8. Масс-спектр, m/z (Iотн, %):
ИК спектр, ν, см-1: 3300 (NH), 1713 (С=О), 1658
310.0 (100) [M - 1]+. Найдено, %: C 69.31; H 5.35;
(СОNH). Спектр ЯМР 1Н, δ, м.д.: 2.32 c (3Н, Ме),
N 4.40. C18H17NО4. Вычислено, %: C 69.44; H 5.50;
7.07 т (1Наром, J 7.4 Гц), 7.21 т (1Наром, J 8.0 Гц),
N 4.50. М 311.3.
7.25 д (1Наром, J 7.6 Гц), 7.46 т (1Наром, J 7.6 Гц),
2-Имино-N-(о-толил)-2Н-хромен-3-кар-
7.51 д (1Наром, J 8.3 Гц), 7.75 т (1Наром, J 8.3 Гц),
боксамид (5а). Смесь 1.1 мл (10 ммоль) салици-
7.99 д (1Наром, J 7.8 Гц), 8.08 д (1Наром, J 8.0 Гц),
лаля 1, 2.1 г (10 ммоль) 3-амино-N-(о-толил)-3-ти-
8.98 с (1Н, С4Н=), 10.53 уш.с (1Н, NH). Спектр
оксопропанамида 3а и 0.1 мл Et3N в 70 мл этанола
ЯМР 13С, δ, м.д.: 17.9, 110.0, 116.6, 119.0, 119.6,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1000
ДЯЧЕНКО и др.
122.1, 125.1, 125.7, 126.8, 128.9, 130.8, 134.8, 136.6,
ветствующей СН-кислоты
11,
12а-с,
5.6 мл
148.6, 154.4, 159.8, 161.6. Найдено 280.0988 [M +
(10 ммоль) 10%-ного водного раствора КОН, пе-
Н]+. C17H13NО3. Вычислено (М + Н) 280.0895.
ремешивали 5 ч и оставляли на сут. Затем реакци-
онную смесь разбавляли равным объемом воды и
2-Имино-N-(2-метоксифенил)-N-нонил-
отфильтровывали образовавшийся осадок, промы-
2Н-хромен-3-карбоксамид
(8). Смесь
3.0 г
вали водой, этанолом и гексаном.
(10 ммоль) хромена 5b, 5.6 мл (10 ммоль) 10%-ного
водного раствора КОН и 1.2 мл (10 ммоль) нони-
3-[2'-(Пиридин-3''-ил)тиазол-4'-ил]-2Н-хро-
лиодида 7 в 30 мл ДМФА при 20°С перемешива-
мен-2-он (13). Выход 2.5 г (80%), светло-желтый
ли 5 ч и оставляли на сут, после чего разбавляли
порошок, при УФ-облучении флуоресцирует, т.пл.
равным объемом воды и отфильтровывали образо-
172-174°С (BuOH). ИК спектр, ν, см-1: 1712 (С=О).
вавшийся осадок. Промывали водой, этанолом и
Спектр ЯМР 1Н, δ, м.д.: 7.40 т (1Наром, J 8.0 Гц),
гексаном. Выход 3.0 г (71%), ярко-желтый мелко-
7.46 д (1Наром, J 8.4 Гц), 7.56-7.62 м (1Наром), 7.66
кристаллический порошок, т.пл. 98-99°С (EtOH).
т (1Наром, J 8.0 Гц), 7.93 д (1Наром, J 8.4 Гц), 8.37-
ИК спектр, ν, см-1: 3300 (NH), 1665 (С=О). Спектр
8.43 м (1Наром), 8.52 с (1Н, H2Py), 8.71 д (1Н, H6Py, J
ЯМР 1Н, δ, м.д.: 0.81 т (3Н, Ме, J 6.8 Гц), 1.13-1.52
4.9 Гц), 9.00 с (1Н, H5тиазола), 9.28 с (1Н, Н4кумарина).
м (12Н, 6СН2), 1.73-1.82 м (2Н, СН2), 3.89 с (3Н,
Спектр ЯМР 13С, δ, м.д.: 116.0, 119.2, 120.1, 121.0,
МеО), 4.06 т (2Н, NСН2, J 6.4 Гц), 6.92 т (1Наром,
124.3, 125.0, 128.7, 129.2, 132.3, 134.0, 140.3, 147.3,
J 7.6 Гц), 6.95-7.19 м (4Наром), 7.51 т (1Наром, J
148.5, 151.3, 152.7, 159.0, 163.8. Масс-спектр, m/z
7.6 Гц), 8.03-8.06 м (1Наром), 8.14 д (1Наром, J
(Iотн, %): 307.0 (100) [M + 1]+. Найдено, %: C 66.51;
8.0 Гц), 8.66 с (1Н, С4Н), 8.94 уш.с (1Н, NH). Масс-
H 3.18; N 8.96. C17H10N2О2S. Вычислено, %: C
спектр, m/z (Iотн, %): 421.2 (100) [M + 1]+. Найдено,
66.65; H 3.29; N 9.14. М 306.4.
%: C 74.11; H 7.55; N 6.50. C26H32N2О3. Вычислено,
3-(4'-Бутилтиазол-2'-ил)-2Н-хромен-2-он
%: C 74.26; H 7.67; N 6.66. М 420.6.
(14а). Выход 2.3 г (80%), желтые пластинчатые
2-Оксо-2Н-хромен-3-карбоксамид (10). Смесь
кристаллы, при УФ-облучении флуоресцируют,
1.1 мл (10 ммоль) салицилаля 1, 1.5 г (10 ммоль)
т.пл. 112-114°С (АсOH). ИК спектр, ν, см-1: 1715
этил-3-амино-3-тиоксопропаноата
9 и
5.6 мл
(С=О). Спектр ЯМР 1Н, δ, м.д.: 0.90 т (3Н, Ме, J
(10 ммоль) 10%-ного водного раствора КОН в
7.4 Гц), 1.16-1.48 м (2Н, СН2), 1.62-1.71 м (2Н,
25 мл ДМФА при 20°С перемешивали 5 ч и остав-
СН2), 2.76 т (2Н, СН2, J 7.4 Гц), 7.40 т (1Наром,
ляли на 2 сут, после чего разбавляли равным объ-
J 7.8 Гц), 7.45 с (1Н, Н5тиазола), 7.48 д (1Наром, J
емом воды и отфильтровывали образовавшийся
8.0 Гц), 7.65 т (1Наром, J 8.0 Гц), 7.99 д (1Наром, J
осадок. Промывали водой, этанолом и гексаном.
7.8 Гц), 8.91 с (1Н, Н4кумарина). Спектр ЯМР 13С, δ,
Выход 1.3 г (68%), желтые иглообразные кристал-
м.д.: 14.0, 22.1, 30.6, 31.0, 116.4, 117.4, 119.3, 119.7,
лы, при УФ-облучении флуоресцируют, т.пл. 268-
125.5, 130.2, 133.0, 139.3, 153.0, 157.5, 157.7, 160.4.
270°С (АсOH). ИК спектр, ν, см-1: 3389, 3149, 3056
Масс-спектр, m/z (Iотн, %): 286.0 (100) [M + 1]+.
(NH2), 1716 (С=О), 1678 (СОNH2). Спектр ЯМР
Найдено, %: C 67.22; H 5.20; N 4.85. C16H15NО2S.
1Н, δ, м.д.: 7.38 т (1Наром, J 7.4 Гц), 7.44 д (1Наром,
Вычислено, %: C 67.34; H 5.30; N 4.91. М 285.4.
J 8.4 Гц), 7.63-7.75 м (2Н, Наром и NH2), 7.91 д
(1Наром, J 7.8 Гц), 7.98 уш.с (1Н, NH2), 8.81 с (1Н,
3-[4'-(4''-Хлорфенил)тиазол-2'-ил]-2Н-хро-
С4Н). Спектр ЯМР 13С, δ, м.д.: 116.5, 118.9, 119.9,
мен-2-он (14b). Выход 2.7 г (78%), т.пл. 208-
125.5, 130.6, 134.4, 148.1, 154.5, 160.7, 162.9. Масс-
210°С (BuOH) (208-212°С [9]). Спектр ЯМР 13С,
спектр, m/z (Iотн, %): 190.1 (100) [M + 1]+. Найдено,
δ, м.д.: 116.7, 118.6, 119.4, 119.8, 125.7, 128.3 (2С),
%: C 63.32; H 3.64; N 7.35. C10H7NО3. Вычислено,
129.3 (2С), 130.3, 133.1, 133.3, 133.5, 140.2, 153.4,
%: C 63.49; H 3.73; N 7.40. М 189.2.
153.6, 159.1, 159.8. Найдено 340.0197 [M + Н]+.
C18H10ClNО2S. Вычислено (М + Н) 340.0121.
3-Тиазолилзамещенные
2Н-хромен-2-оны
13, 14а-с (общая методика). К перемешивае-
3-(4'-Циклопропилтиазол-2'-ил)-2Н-хромен-
мому раствору 1.1 мл (10 ммоль) салицилаля 1 в
2-он (14с). Выход 1.9 г (70%), желтые кристал-
30 мл ДМФА при 20°С прибавляли 10 ммоль соот-
лы, т.пл. 168-170°С (АсOH). ИК спектр, ν, см-1:
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И СВОЙСТВА 3-ЗАМЕЩЕННЫХ 2Н-ХРОМЕН-2-ОНОВ
1001
1712 (С=О). Спектр ЯМР 1Н, δ, м.д.: 0.81-1.02 м
9. Дяченко В.Д., Пугач Ю.Ю. ЖОХ. 2012, 82, 844-849.
(4Н, 2СН2), 2.18-2.24 м (1Н, СНциклопропана), 7.43
[Dyachenko V.D., Pugach Yu.Yu. Russ. J. Gen. Chem.
т (1Наром, J 7.4 Гц), 7.45 с (1Н, Н5тиазола), 7.47 д
2012, 82, 921-926.] doi 10.1134/s1070363212050209
(1Наром, J 7.4 Гц), 7.68 т (1Наром, J 8.4 Гц), 7.98 д
10. Дяченко В.Д., Чернега А.Н., Дяченко С.В. ЖОХ.
(1Наром, J 7.8 Гц), 8.88 с (1Н, Н4кумарина). Спектр
2012, 82, 634-638. [Dyachenko V.D., Chernega A.N.,
ЯМР 13С, δ, м.д.: 8.4 (2С), 12.0, 115.3, 116.2, 119.0,
Dyachenko S.V. Russ. J. Gen. Chem. 2012, 82, 720-
119.5, 125.2, 129.8, 132.8, 138.8, 152.9, 157.6,
724.] doi 10.1134/s1070363212040184
158.8, 159.3. Масс-спектр, m/z (Iотн, %): 270.2 (100)
11. Дяченко В.Д., Пугач Ю.Ю. ЖОХ. 2013, 83, 845-848.
[M + 1]+. Найдено, %: C 66.59; H 3.97; N 5.06.
[Dyachenko V.D., Pugach Yu.Yu. Russ. J. Gen. Chem.
C15H11NО2S. Вычислено, %: C 66.70; H 4.12; N
2013, 42, 979-982.] doi 10.1134/s1070428019020131
5.20. М 269.3.
12. Антипин И.С., Казымова М.А., Кузнецов М.А., Ва-
ФОНДОВАЯ ПОДДЕРЖКА
сильев А.В., Ищенко М.А., Кирюшкин А.А., Кузне-
Работа выполнена при финансовой поддержке
цова Л.М., Макаренко С.В., Островский В.А., Пе-
Программы повышения конкурентоспособности
тров М.Л., Солод О.В., Тришин Ю.Г., Яковлев И.П.,
РУДН «5-100». Рентгеновские измерения были
Ненайденко В.Г., Белоглазкина Е.К., Белецкая И.П.,
проведены на оборудовании уникальной научной
Устынюк Ю.А., Соловьев П.А., Иванов И.В., Ма-
установки Курчатовский источник синхротронного
лина Е.В., Сивова Н.В., Негребецкий В.В., Бау-
излучения,
финансируемой Министерством
ков Ю.И., Пожарская Н.А., Травень В.Ф., Щеко-
образования и науки РФ (идентификатор проекта
тихин А.Е., Варламов А.В., Борисова Т.Н., Леси-
RFMEFI61917X0007).
на Ю.А., Краснокутская Е.А., Рогожников С.И., Шу-
ров С.Н., Кустова Т.П., Клюев М.В., Хелевина О.Г.,
КОНФЛИКТ ИНТЕРЕСОВ
Стужин П.А., Федоров А.Ю., Гущин А.В., Додо-
Авторы заявляют об отсутствии конфликта ин-
нов В.А., Колобов А.В., Плахтинский В.В.,
тересов.
Орлов В.Ю., Кривенько А.П., Федотова О.В., Пче-
СПИСОК ЛИТЕРАТУРЫ
линцева Н.В., Чарушин В.Н., Чупахин О.Н., Кли-
мочкин Ю.Н., Климочкина А.Ю., Курятников В.Н.,
1. Guogiang L., Jianguang L., Minghua X., Jin R. Заявка
Малиновская Ю.А., Левина А.С., Журавлев О.Е.,
1638878 (2006). ЕПВ. РЖХим. 2007. 07.24-19О.91П.
Ворончихина Л.И., Фисюк А.С., Аксенов А.В.,
2. Ухов С.В., Коньшин М.Е., Одегова Т.Ф. Хим.-
Аксенов Н.А., Аксенова И.В. ЖОрХ. 2017, 53,
фарм. ж. 2001, 35, 17-18. [Ukhov S.V., Kon’shin M.E.,
1257-1408. [Antipin I.S., Kazymova M.A., Kuznet-
Odegova T.F. Pharm. Chem. J. 2001, 35, 364-365.]
sov M.A., Vasilyev A.V., Ishchenko M.A., Kiryush-
doi 10.1023/A:1012747018793
kin A.A., Kuznetsova L.M., Makarenko S.V., Ostrovs-
3. Abdelhamid A.O., Al-Atoom A.A. Phosph., Sulfur,
kii V.A., Petrov M.L., Solod O.V., Trishin Yu.G.,
Silicon Relat. Elem.
2005,
180,
1629-1646. doi
Yakovlev I.P., Nenaidenko V.G., Beloglazkina E.K.,
10.1080/104265090885048
Beletskaya I.P., Ustynyuk Yu.A., Solov’ev P.A.,
4. Трковник М., Ивезич З., Полак Л. Заявка 97111207/
Ivanov I.V., Malina E.V., Sivova N.V., Negrebets-
04 (1999). Россия. РЖХим. 2000. 00.02-19О.178П.
kii V.V., Baukov Yu.I., Pozharskaya N.A., Traven’ V.F.,
5. Luo X., Song J., Cheng L., Huang D. Sci. in China (B).
Shchekotikhin A.E., Varlamov A.V., Borisova T.N.,
Lesina Yu.A., Krasnokutskaya E.A., Rogozhnikov S.I.,
5-532
Shurov S.N., Kustova T.P., Klyuev M.V., Khelevi-
6. Carter D.C. Пат. 7179838 (2007). США. РЖХим.
na O.G., Stuzhin P.A., Fedorov A.Yu., Gushchin A.V.,
2007. 07.24-19О.92П.
Dodonov V.A., Kolobov A.V., Plakhtinskii V.V.,
7. Cai S.X., Zhang H., Kemnitzer W.E., Jiang S.,
Orlov V.Yu., Kriven’ko A.P., Fedotova O.V., Pche-
Drewe J., Storer R. Пат. 6900325 (2005). США.
lintseva N.V., Charushin V.N., Chupakhin O.N.,
РЖХим. 2006. 06.06-19О.133П.
Klimochkin Yu.N., Klimochkina A.Yu., Kuryatni-
8. Brühlmann C., Ooms F., Carrupt P.-A., Testa B.,
kov V.N., Malinovskaya Yu.A., Levina A.S., Zhurav-
Catto M., Leonetti F., Altomare C., Carotti A. J. Med.
lev O.E., Voronchikhina L.I., Fisyuk A.S., Akse-
Chem. 2001, 44, 3195-3198. doi 10.1021/jm010894d
nov A.V., Aksenov N.A., Aksenova I.V. Russ. J. Org.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1002
ДЯЧЕНКО и др.
Chem.
2017,
53,
1275-1437.] doi
10.1134/
shin O.G., Balova I.A., Vasilyev A.V., Zenkevich I.G.,
S1070428017090019
Krasavin M.Yu., Kuznetsov M.A., Molchanov A.P.,
13. Коновалов А.И., Антипин И.С., Бурилов В.А., Мад-
Novikov M.S., Nikolaev V.A., Rodina L.L., Khlebni-
жидов Т.И., Курбангалиева А.Р., Немтарев А.В., Со-
kov A.F., Beletskaya I.P., Vatsadze S.Z., Gromov S.P.,
ловьева С.Е., Стойков И.И., Мамедов В.А., Захаро-
Zyk N.V., Lebedev A.T., Lemenovskii D.A., Petro-
ва Л.Я., Гаврилова Е.Л., Синяшин О.Г., Балова И.А.,
syan V.S., Nenaidenko V.G., Negrebetskii V.V., Bau-
Васильев А.В., Зенкевич И.Г., Красавин М.Ю.,
kov Yu.I., Shmigol’ T.A., Korlyukov A.A., Tikhomi-
Кузнецов М.А., Молчанов А.П., Новиков М.С., Ни-
rov A.S., Shchekotikhin A.E., Traven’ V.F., Voskre-
колаев В.А., Родина Л.Л., Хлебников А.Ф., Белец-
senskii L.G., Zubkov F.I., Golubchikov O.A., Semei-
кая И.П., Вацадзе С.З., Громов С.П., Зык Н.В.,
kin A.S., Berezin D.B., Stuzhin P.A., Filimonov V.D.,
Лебедев А.Т., Леменовский Д.А., Петросян В.С.,
Krasnokutskaya E.A., Fedorov A.Yu., Nyuchev A.V.,
Ненайденко В.Г., Негребецкий В.В., Бауков Ю.И.,
Orlov V.Yu., Begunov R.S., Rusakov A.I., Kolo-
Шмиголь Т.А., Корлюков А.А., Тихомиров А.С.,
bov A.V., Kofanov E.R., Fedotova O.V., Egorova A.Yu.,
Щекотихин А.Е., Травень В.Ф., Воскресенский Л.Г.,
Charushin V.N., Chupakhin O.N., Klimochkin Yu.N.,
Зубков Ф.И., Голубчиков О.А., Семейкин А.С.,
Osyanin V.A., Reznikov A.N., Fisyuk A.S., Sagitulli-
Березин Д.Б., Стужин П.А., Филимонов В.Д.,
na G.P., Aksenov A.V., Aksenov N.A., Grachev M.K.,
Краснокутская Е.А., Федоров А.Ю., Нючев А.В.,
Maslennikova V.I., Koroteev M.P., Brel’ A.K., Lisi-
Орлов В.Ю., Бегунов Р.С., Русаков А.И., Коло-
na S.V., Medvedeva S.M., Shikhaliev Kh.S., Su-
бов А.В., Кофанов Е.Р., Федотова О.В., Егоро-
boch G.A., Tovbis M.S., Mironovich L.M., Iva-
ва А.Ю., Чарушин В.Н., Чупахин О.Н., Климоч-
кин Ю.Н., Осянин В.А., Резников А.Н., Фисюк А.С.,
nov S.M., Kurbatov S.V., Kletskii M.E., Burov O.N.,
Сагитуллина Г.П., Аксенов А.В., Аксенов Н.А.,
Kobrakov K.I., Kuznetsov D.N. Russ. J. Org. Chem.
Грачев М.К., Масленникова В.И., Коротеев М.П.,
2018, 54, 157-371.] doi 10.1134/S107042801802001X
Брель А.К., Лисина С.В., Медведева С.М., Шихали-
14. Battye T.G., Kontogiannis L., Johnson O., Powell H.R.,
ев Х.С., Субоч Г.А., Товбис М.С., Миронович Л.М.,
Leslie A.G.W. Acta Crystallogr. Sect. D. 2011, 67, 271-
Иванов С.М., Курбатов С.В., Клецкий М.Е., Бу-
281. doi 10.1107/S0907444910048675
ров О.Н., Кобраков К.И., Кузнецов Д.Н. ЖОрХ.
15. Evans P. Acta Crystallogr., Sect. D. 2006, 62, 72-82.
2018, 54, 161-360. [Konovalov A.I., Antipin I.S.,
doi 10.1107/S0907444905036693
Burilov V.A., Madzhidov T.I., Kurbangalieva A.R.,
Nemtarev A.V., Solovieva S.E., Stoikov I.I., Mame-
16. Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
dov V.A., Zakharova L.Ya., Gavrilova E.L., Sinya-
3-8. doi 10.1107/S2053273314026370
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И СВОЙСТВА 3-ЗАМЕЩЕННЫХ 2Н-ХРОМЕН-2-ОНОВ
1003
Synthesis and Properties of 3-Substituted 2H-Chromen-2-ones
I. V. Dyachenkoa, V. D. Dyachenkoa, P. V. Dorovatovskyb,
V. N. Khrustalevc, d, and V. G. Nenajdenkoe, *
a Lugansk National University named after Taras Shevchenko, 91011, Ukraine, Lugansk, ul. Oboronnaya 2
b National Research Center “Kurchatov Institute”, 123182, Russia, Moscow, pl. Akad. Kurchatova 1
c Peoples’ Friendship University of Russia, 117198, Russia, Moscow, ul. Miklukho-Maclaya 6
d Institute of Organic Chemistry named after N.D. Zelinsky RAS, 119991, Russia, Moscow, Leninskii pr. 47
e Lomonosov Moscow State University, 119991, Russia, Moscow, Leninskie gory 1
*e-mail: nenajdenko@gmail.com
Received April 5, 2020; revised April 7, 2020; accepted April 10, 2020
Condensation of salicylic aldehyde with CH acids - p-methoxyacetoacetanilide, ethyl 3-amino-3-thioxopropa-
noate, 3-amino-N-aryl-3-thioxopropanamides and ethyl 2-thiazol-2- and -4-yl acetates synthesized 3-substituted
chromene -2-ones and their certain properties are studied. The structure of 3-[4'-(4''-chlorophenyl)thiazol-2'-yl]-
2H-chromen-2-one, 2-oxo-2H-chromene-3-carboxamide and 2-imino-N-(2-methoxyphenyl)-2H-chromene-3-
carboxamide was studied by X-ray diffraction.
Keywords: p-methoxyacetoacetanilide, 3-amino-3-thioxopropanoate, 3-amino-N-aryl-3-thioxopropanamide,
ethyl 2-thiazol-2-yl acetate, 2H-chromen-2-one (coumarin), X-ray diffraction analysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020