ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1004-1013
УДК 547.239
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ
МОЧЕВИН И ИХ ИЗОСТЕРИЧЕСКИХ АНАЛОГОВ,
СОДЕРЖАЩИХ ПОЛИЦИКЛИЧЕСКИЕ ФРАГМЕНТЫ:
III.1 СИНТЕЗ И СВОЙСТВА 1-[2-(АДАМАНТАН-1-ИЛ)-
ЭТИЛ]-3-R-МОЧЕВИН
© 2020 г. Д. В. Даниловa, В. В. Бурмистровa, b, Г. М. Бутовa, b, *
a ФГБОУ ВО «Волгоградский государственный технический университет» Волг ГТУ,
400005, Россия, г. Волгоград, пр. Ленина 28
b ФГБОУ ВО «Волжский политехнический институт» (филиал) Волг ГТУ,
404121, Россия, Волгоградская обл., г. Волжский, ул. Энгельса 42а
*e-mail: butov@post.volpi.ru
Поступила в редакцию 04 марта 2020 г.
После доработки 18 марта 2020 г.
Принята к публикации 26 марта 2020 г.
Разработаны методы получения адамантилсодержащих 1,3-дизамещенных мочевин, содержащих этиле-
новый мостик между адамантильным фрагментом и мочевинной группой, на основе 2-(адамантан-1-ил)-
этилизоцианата (или амина) с выходами 29-88%. Впервые для синтеза 2-(адамантан-1-ил)этилизоци-
аната использован N,N'-карбонилдиимидазол. Синтез изоцианата протекал через стадию образования
устойчивого N-[2-(адамантан-1-ил)этил]-1H-имидазол-1-карбоксамида, который в дальнейшем может
быть использован как прекурсор для получения симметричных или несимметричных мочевин.
Ключевые слова: адамантан, изоцианат, N,N'-карбонилдиимидазол, мочевина, галогенсодержащие
анилины, растворимая эпоксидгидролаза.
DOI: 10.31857/S0514749220070022
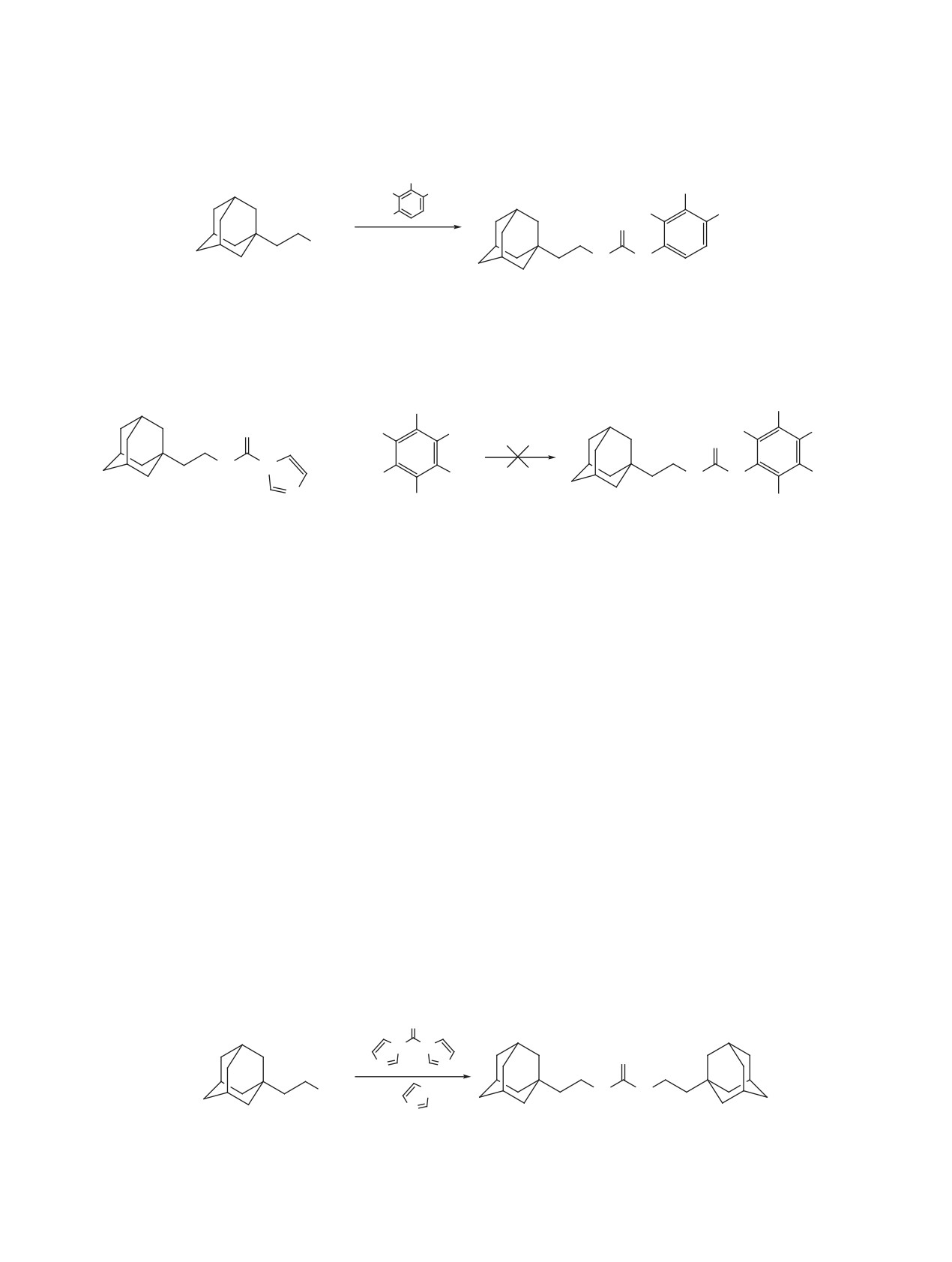
В продолжение работ по синтезу ингибиторов
на их водорастворимость [5-7]. Дальнейшее уве-
растворимой эпоксидгидролазы (sEH) - фермента
личение мостика с метиленового до этиленового
играющего важную роль в арахидоновом каска-
также приводит к увеличения ингибирующей ак-
де [2-4], превращающий эпоксижирные кислоты
тивности соответствующих тиомочевин до 2.5 раз
(продукты метаболизма арахидоновой кислоты
[8].
под действие цитохромов Р450) в вицинальные
Ранее синтез ингибиторов с этиленовым мости-
диолы, проведена целенаправленная модификация
ком осуществляли на основе 2-(адамантан-1-ил)-
липофильной части молекул ингибиторов. Ранее
этиламина и алифатических (ароматических)
нами было показано, что введение метиленового
изоцианатов, что существенно снижало возмож-
мостика между адамантильным фрагментом и уре-
ности получения широкого спектра ингибиторов
идной (или тиоуреидной) группой липофильной
из-за малого количества известных изоцианатов,
части ингибитора, существенно повышает их инги-
по сравнению с существующими аминами анало-
бирующую активность в отношении растворимой
гичного строения. В этой связи целесообразным
эпоксидгидролазы, а также положительно влияет
является разработка методов синтеза 2-(адаман-
1 Сообщение II см. [1].
тан-1-ил)этилизоцианата (3) - как прекурсора для
1004
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : III.
1005
Схема 1.
S(O)Cl2
NaN3
OH
Cl
NCO
O
O
1
2
3
получения различных 1,3-дизамещенных моче-
время. Кроме того, карбоксамид 5 способен сам
вин, сведения о котором в литературе отсутствуют.
вступать в реакцию с различными аминами, с об-
разованием 1,3-дизамещенных мочевин, что по-
Для синтеза 2-(адамантан-1-ил)этилизоцианата
зволяет сразу осуществить их one-pot синтез из
(3) нами использовано два подхода. Первый под-
адамантиламина 4. В этой связи нами осуществле-
ход был основан на one-pot синтезe по реакции
ны синтезы ингибиторов, как на основе изоциана-
Курциуса из (адамантан-1-ил)пропионовой кис-
та 3, так и карбоксамида 5.
лоты (1) [9-11], по выше приведенной схеме [12]
(схема 1).
Следует отметить также, что сведения о синтезе
и свойствах адамантилсодержащих 1H-имидазол-
Выход изоцианата (3) составил 85%. Сущес-
1-карбоксамидах крайне малочисленны. Описаны
твенным недостатком этого метода получения яв-
синтез и свойства N-(адамантан-2-ил)- [13] и N-
ляется труднодоступность (адамантан-1-ил)про-
[(адамантан-1-ил)метил]- [14] 1H-имидазол-1-кар-
пионовой кислоты и применение взрывоопасного
боксамидов. Сведения о синтезе N-[2-(адамантан-
азида натрия.
1-ил)этил]-1H-имидазол-1-карбоксамида в литера-
Второй подход заключался во взаимодей-
туре отсутствуют.
ствии 2-(адамантан-1-ил)-этиламина (4) с N,N'-
Изоцианат 3 использован для синтеза трудно-
карбонилдиимидазолом в ТГФ при комнатной тем-
доступных 1,3-дизамещенных мочевин 6a-e, по
пературе с образованием N-[2-(адамантан-1-ил)-
реакциям предсавленным на схеме 3.
этил]-1H-имидазол-1-карбоксамида (5) (схема 2).
Последующие нагревание карбоксамида (5) при
В качестве исходных аминов использовались
температуре 110°C в вакууме приводит к образо-
адамантилсодержащие амины с различными мо-
ванию изоцианата (3).
стиками Х, 2-адамантиламин и транс-4-(цикло-
гексилокси)бензойная кислота. Синтез осущест-
Второй способ синтеза изоцианата 3 обла-
вляли в безводном диэтиловом эфире в течение
дает рядом преимуществ. Во-первых, это возмож-
12 ч при комнатной температуре. Выходы состави-
ность осуществления one-pot синтеза изоциа-
ли 29-88%.
ната 3 из более доступного 2-(адамантан-1-ил)-
этиламина 4. Во-вторых, реакция протекает в
Для оценки влияния этиленового мостика на
более мягких условиях, чем one-pot синтез изо-
ингибирующую активность были синтезирова-
цианата 3 по реакции Курциуса. В-третьих, про-
ны мочевины, содержащие атомы фтора (хлора) в
межуточный карбоксамид 5 легко выделяется и
бензольном кольце по реакции изоцианата 3 с га-
является более устойчивым, чем хлорангидрид 2
логенсодержащими анилинами (схема 4), которая
и изоцианат 3, и может храниться длительное
не увенчалась успехом, или по реакции 2-(адаман-
Схема 2.
O
N N
O
N
N
∆
N N
HN
HN
NH2
H
NCO
N
N
N
4
5
3
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1006
ДАНИЛОВ и др.
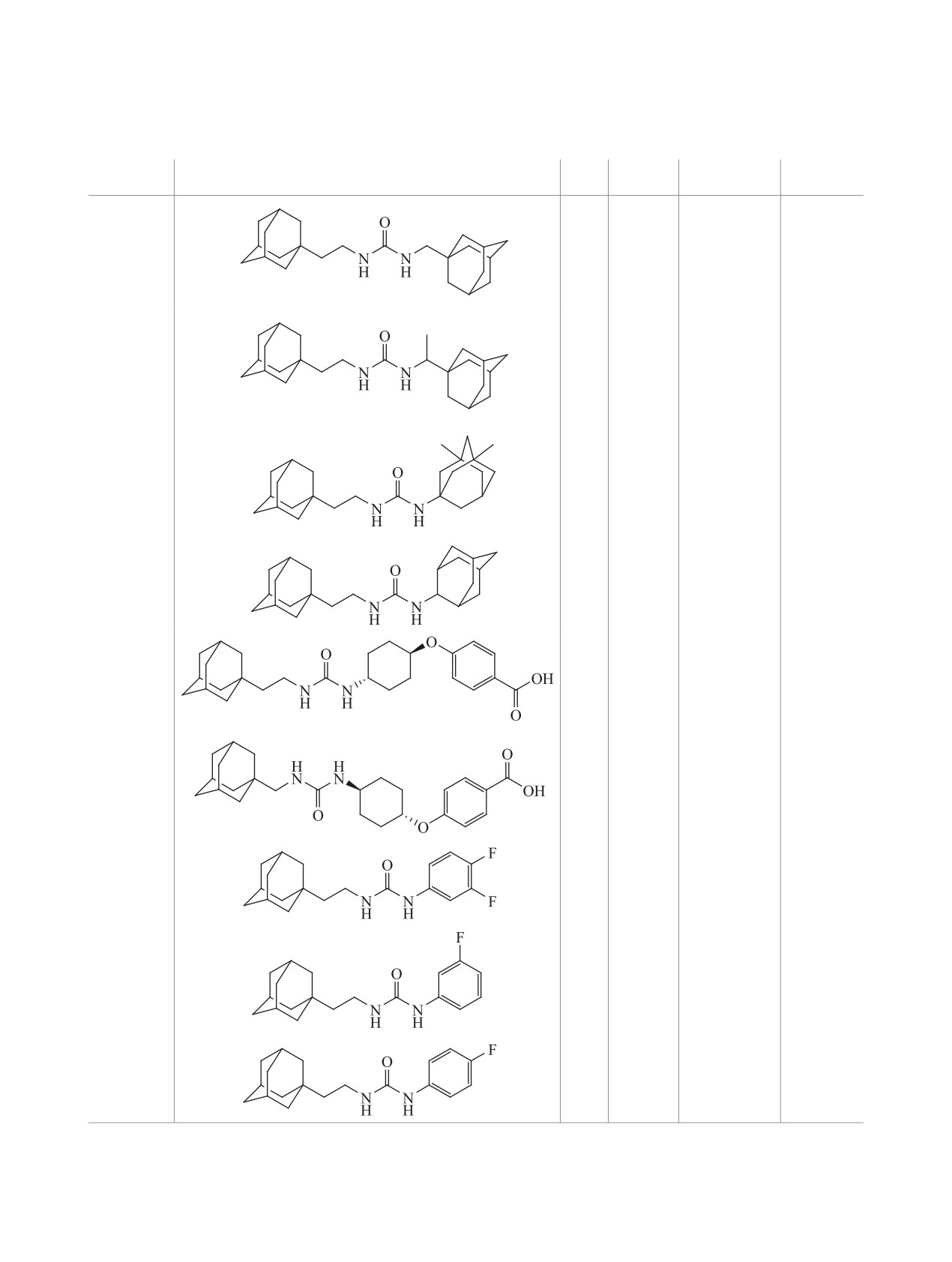
Схема 3.
R
NH2
X
O
R
R
X
N
N
NCO
H
H
R
3
6a-c
6, R = H, X = CH2 (a); X = CH(CH3) (b); R = CH3, X = «-» (c).
NH2
O
NCO
N
N
H
H
2
6d
O
O
OH
H2N
O
O
OH
N
N
NCO
H
H
O
2
6e
тан-1-ил)-этиламина 4 с ароматическими изоциа-
ходился в орто-положении к аминогруппе, то в
натами (схема 5, мочевины 6k-n), которые явля-
продуктах реакции обнаруживалась только симме-
ются структурными аналогами ингибиторов, не
тричная диадамантил мочевина (7). Такое протека-
содержащих такой мостик и опубликованных в
ние реакции, по-видимому, объясняется электро-
ноакцепторными свойствами фтора (хлора), при-
работах [1, 15].
водящие к значительному снижению реакционной
Синтез осуществляли в безводном диэтиловом
способности галогенсодержащих анилинов.
эфире в течение 12 ч при комнатной температуре.
Однако, при проведении реакции N,N'-
Выходы соединений 6j-m составили 70-84%.
карбонилдиимидазола с двухкратным избытком
Попытка получения несимметричных мочевин
адамантилсодержащего амина 4 в тетрагидрофу-
из карбоксамида 5 и фторированных анилинов в
ране в течение 4 ч при температуре кипения рас-
аналогичных условиях не увенчалась успехом
творителя была получена симметричная мочеви-
(схема 6).
ны 7 с выходом 42% (схема 7).
Выходы ингибиторов по данной реакции не
По-видимому, получение симметричных моче-
превышали 10%, а в случае, если атом фтора на-
вин также происходит через стадию образования
Схема 4.
R2
R1
R3
R2
H2N
R4
R1
R3
R5
O
O
+
NCO
N
N
R4
N
N
H
H
H
H
R5
2
6f-i
7
R1 = F, R2 = R3 = R4 = R5 = H (6f, 0%); R1 = R3 = F, R2 = R4 = R5 = H (6g, 0%);
R1 = R5 = F, R2 = R3 = R4 = H (6h, 0%); R3 = R4 = F, R1 = R2 = R5 = H (6i, 10%).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : III.
1007
Схема 5.
R2
R1
R3
R2
R1
R3
OCN
O
NH2
N
N
H
H
4
6j -m
R2 = F, R1 = R3 = H (6j, 84%); R3 = F, R1 = R2 = H (6k, 83%);
R1 = Cl, R2 = R3 = H (6l, 70%); R2 = Cl, R1 = R3 = H (6m, 70%).
Схема 6.
R2
R2
O
R1
R3
R1
R3
O
+
N N
4
H
H2N
R
N
N
R4
H
H
N
R5
R5
5
6f -m
6, R1 = F, R2 = R3 = R4 = R5 = H (f); R1 = R3 = F, R2 = R4 = R5 = H (g); R1 = R5 = F, R2 = R3 = R4 = H (h);
R3 = R4 = F, R1 = R2 = R5 = H (i); R2 = F, R1 = R3 = H (j); R3 = F, R1 = R2 = H (k);
R1 = Cl, R2 = R3 = H (l); R2 = Cl, R1 = R3 = H (m).
соответствующего промежуточного N-адамантил-
Рассчитанный коэффициент липофильности
1H-имидазол-1-карбоксамида.
LogP для полученных соединений находится в
пределах 4.79-7.56 что в среднем на 0.28 единиц
Структуру полученных соединений подтвер-
выше, чем для аналогичных соединений, полу-
ждали методом ЯМР-спектроскопии 1H, 13C и 19F,
ченных на основе незамещенного 1-изоцианато-
а также масс-спектрометрией. В спектрах ЯМР
адамантана [1] и 0.15 единиц выше, чем для со-
1H присутствует два характерных сигнала про-
единений, полученных на основе 1-изоцианато-
тонов NH мочевинной группы. Сигнал в области
метиладамантана [6]. По-видимому, этиленовый
5.50-6.07 м.д. соответствуют протону ближней к
мостик является предельным при котором адаман-
адамантильному фрагменту NH-группы, а сигнал
тилсодержащие мочевины соответствуют правилу
в области 7.92-8.62 м.д. - протону NH-группы,
Липински [16] в контексте коэффициента липо-
связанной с ароматическим кольцом.
фильности.
В спектрах ЯМР 19F атомы фтора в положении
Температура плавления мочевин, содержащих
3 характеризуются сигналом в области -112.51 м.д.
этиленовый мостик между адамантильным фраг-
(6j), а в положении 4 в области -122.80 м.д. (6k).
ментом и мочевинной группой, в большинстве
Некоторые свойства мочевин представлены в
случаев на ~20°C ниже, чем у аналогичных сое-
таблице.
динений, полученных на основе незамещенного
Схема 7.
O
N N
O
N
N
2
NH
N
N
NH2
-2
N
H
H
4
7
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1008
ДАНИЛОВ и др.
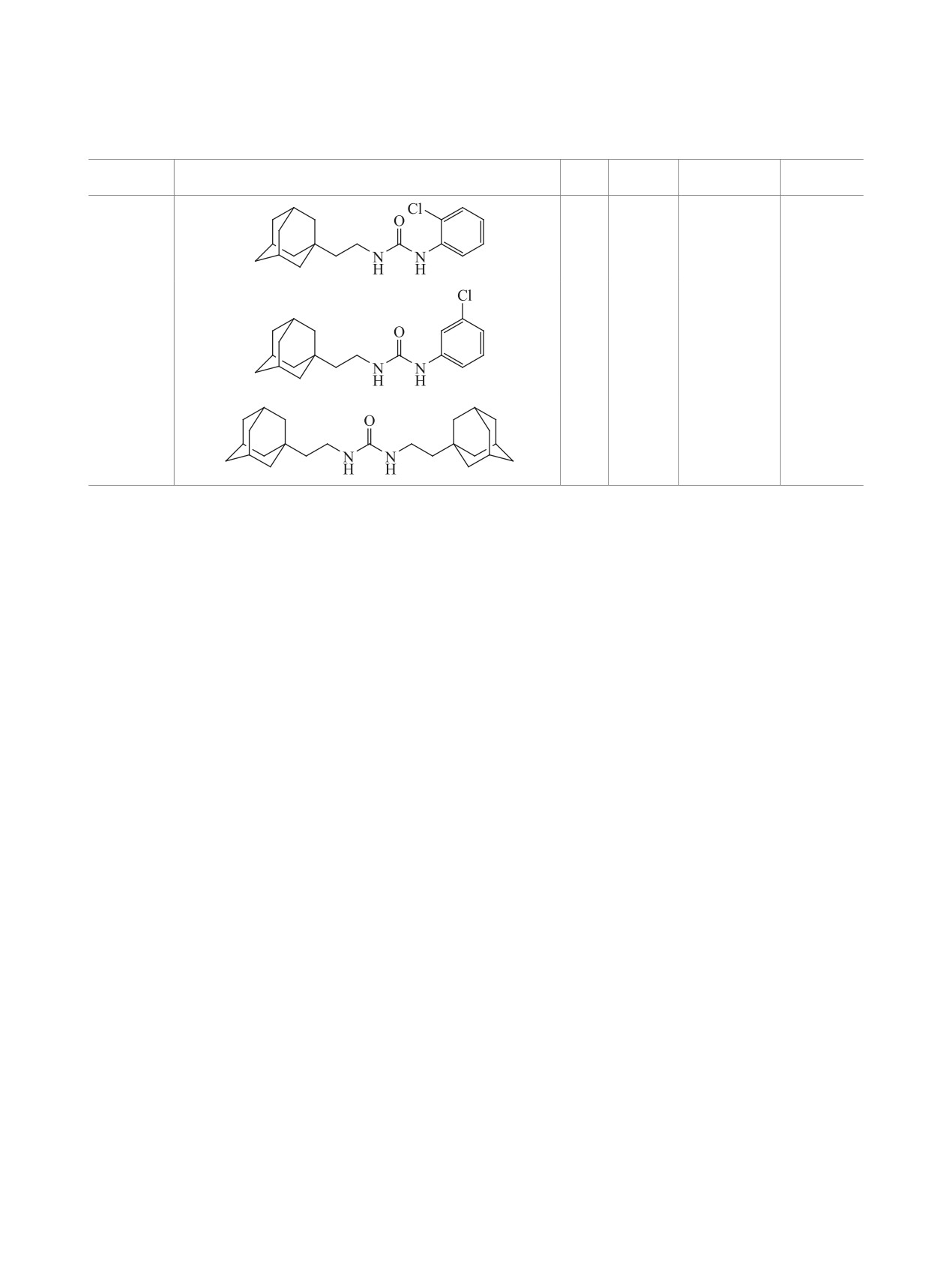
Коэффициенты липофильности, температуры плавления и выходы синтезированных соединений 6a-j и их аналогов.
№
Структура
Mr
LogPa
tпл, °C
Выход, %
6a
370
5.89
121-122
62
6b
384
6.22
138-139
29
6c
384
6.00
90-91
34
6d
356
5.73
95-96
73
6e
440
5.47
214-215
88
426
5.20
241-243 [6]
94 [6]
6i
334
4.91
154-155
10
6j
316
4.79
164-165
70
6k
316
4.82
180-181
70
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : III.
1009
Таблица. (продолжение).
№
Структура
Mr
LogPa
tпл, °C
Выход, %
6l
332
5.28
195-196
84
6m
332
5.31
128-129
83
7
384
6.16
232-233
42
1-изоцианатоадамантана. Пониженная температу-
3-фторфенилизоцианат
(97+%, CAS
404-71-7),
ра плавления мочевин является положительным
4-фторфенилизоцианат (98+%, CAS 1195-45-5),
свойством ингибиторов, упрощающим процесс
2-хлорфенилизоцианат
(98%, CAS
3320-83-0),
приготовления лекарственных форм.
1,1'-карбонилдиимидазол
(97%, CAS
530-62-1)
производства фирмы «Alfa Aesar» использовали
Таким образом, разработаны методы получения
без очистки. (Адамантан-1-ил)пропионовая кис-
адамантилсодержащих 1,3-дизамещенных моче-
лота (1) [9], 2-(адамантан-1-ил)-этиламин (4) [17],
вин, содержащих этиленовый мостик между ада-
3,5-диметил-1-адамантиламин [18] и транс-4-(ци-
мантильным фрагментом и мочевинной группой.
клогексилокси)бензойной кислота [19] получены
Предлагаемые методы характеризуются доступ-
по известным методикам.
ностью исходных реагентов, простотой синтеза,
Строение полученных соединений подтвер-
выделения и очистки соединений. Предложен аль-
ждали с помощью ЯМР 1Н, 13C и 19F спектро-
тернативный
2-(адамантан-1-ил)этилизоцианату
скопии, хромато-масс-спектрометрии и элемент-
3 реагент - N-[2-(адамантан-1-ил)этил]-1H-ими-
ного анализа. Масс-спектры регистрировали на
дазол-1-карбоксамид для синтеза 1,3-дизамещен-
хромато-масс-спектрометре
«Agilent GC
5975/
ных мочевин, более удобный в использовании.
MSD 7820». Капиллярная кварцевая колонка HP-
Коэффициент липофильности синтезированных
5MS (длина 30 м, диаметр 0.25 мм, толщина слоя
соединений в среднем на 0.28 единиц меньше,
0.5 мкм), газ-носитель - гелий. Программируемый
чем у их аналогов с незамещенным адамантаном.
нагрев колонки от 80 до 280°С, температура испа-
Полученные соединения будут исследованы в ка-
рителя 250°С. Спектры ЯМР 1H зарегистрирова-
честве ингибиторов растворимой эпоксидгидрола-
ны на спектрометре «Bruker DRX500» (500 МГц)
зы человека.
в растворителе DMSO-d6, химические сдвиги 1H
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
приведены относительно SiMe4. Элементный ана-
лиз выполнен на приборе «Perkin-Elmer Series II
Исходные 3-хлорфенилизоцианат (99%, CAS
2400».
2909-38-8), триэтиламин (BioUltra ≥ 99.5%, CAS
121-44-8), 1-(адамантан-1-ил)этиламин (99%, CAS
2-(Адамантан-1-ил)этилизоцианат (3). а. Пер-
1501-84-4), адамант-1-илметиламин (98%, CAS
вая стадия. К 1.25 г (6.0 ммоль) адамантилпро-
17768-41-1) и
2-аминоадамантан
(99%, CAS
пионовой кислоты (1) прибавляли 1.05 г (0.7 мл,
10523-68-9) производства фирмы «Sigma-Aldrich»;
8.8 ммоль) хлористого тионила и выдерживали
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1010
ДАНИЛОВ и др.
реакционную смесь при температуре его кипения
рекристаллизацией из этанола. Выход 0.28 г (62%),
в течение 1.5 ч. Избыток хлористого тионила от-
т.пл. 121-123°C. Спектр ЯМР 1Н (DMSO-d6), δ,
гоняли и остаток вакуумировали на водоструйном
м.д.: 2.01-1.53 м (32H, Ad и Ad-CH2), 3.08 с (2H,
насосе. Полученный хлорангидрид растворяли в
CH2), 3.38 т (2H, CH2, J 8.0 Гц), 5.82 с (2H, 2NH).
безводном толуоле.
Масс-спектр, m/z (Iотн, %): 370 (6.4) [М]+,
135
(100) [Ad]+. Найдено, %: С 77.78; Н 10.37; N 7.53.
Вторая стадия. Полученный раствор хлоран-
C24H38N2О. Вычислено, %: С 77.79; Н 10.34; N
гидрида адамантисодержащей кислоты прикапы-
7.56. М 370.57.
вали в течение 1 ч к суспензии 0.65 г (10 ммоль)
азида натрия (соотношение 1:2) в 50 мл безвод-
1-[2-(Адамантан-1-ил)этил]-3-[1-(адаман-
ного толуола. Затем реакционную смесь выдер-
тан-1-ил)этил] мочевина (6b). Получена анало-
живали в течение 1 ч при температуре кипения
гично соединению 6a из 0.2 г 2-(адамантан-1-ил)-
толуола до полного прекращения выделения азо-
этилизоцианата (3) и 0.174 г 1-(адамантан-1-ил)-
та. Реакционную смесь фильтровали через слой
этиламина. Выход 0.108 г (29%), т.пл. 138-139°C.
хлорида натрия, отгоняли растворитель. Продукт
Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 0.87 д (3H,
перегоняли в вакууме. Выход по двум стадиям
CH3, J 6.8 Гц), 1.11-1.16 м (2H, Ad-CH2), 1.44-1.68
1.05 г (85%). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.25-
м (24H, 2Ad), 1.90 уш.с (6H, 2Ad), 2.94-3.00 м (2H,
1.29 м (2H, Ad-CH2), 1.50 д (6H, Ad, J 2.5 Гц), 1.66
Ad-CH2CH2), 3.25-3.30 м (1H, Ad-CH), 5.50 д (1H,
д.д (6Н, Ad, J1 11.9, J2 42.4 Гц), 1.94 с (3H, Ad),
CH2-NH), 5.56 уш.с (1H, CH-NH). Масс-спектр,
3.13-3.18 м (2H, Ad-CH2CH2). Масс-спектр, m/z
m/z (Iотн, %): 384 (7.8) [М]+, 249 (24.3) [M - Ad]+,
(Iотн, %): 205 (56.2) [М]+, 162 (6.2) [М - HNCO]+,
135 (100) [Ad]+. Найдено, %: С 78.05; Н 10.50; N
148 (5.0) [М - CH3NCO]+, 135 (100).
7.24. C25H40N2О. Вычислено, %: С 78.07; Н 10.48;
N 7.28. М 384.31.
б. К смеси 5 г (27.9 ммоль) 2-(адамант-1-ил)-
этиламина (4) в 50 мл безводного толуола прибав-
1-[2-(Aдамантан-1-ил)этил]-3-(3,5-диметила-
ляли 4.5 г (27.9 ммоль) 1,1-карбонилдиимидазола
дамантан-1-ил) мочевина (6c). Получена анало-
и выдерживали при температуре кипения раство-
гично соединению 6a из 0.2 г 2-(адамантан-1-ил)-
рителя 1 ч. Толуол упаривали, выпадший имидазол
этилизоцианата (3) и 0.175 г 3,5-диметил-1-ада-
отфильтровывали. При вакуумной перегонке про-
мантиламина. Выход 0.128 г (34%), т.пл. 90-91°C.
межуточного карбоксамида 5 получали изоцианат
Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 1.11-1.16 м (2H,
3 с выходом 4.56 г (80%). Спектр ЯМР 1Н (CDCl3),
Ad-CH2), 1.38 с (6H, 2CH3), 1.45-1.68 м (24H, 2Ad),
δ, м.д.: 1.25-1.29 м (2H, Ad-CH2), 1.50 д (6H, Ad,
1.91 уш.с (6H, 2Ad), 2.95-3.00 м (2H, CH2-NH),
J 2.5 Гц), 1.66 д.д (6Н, Ad, J1 11.9, J2 42.4 Гц),
5.55 уш.с (1H, CH2-NH), 5.68 уш.с (1H, C-NH).
1.94 с (3H, Ad), 3.13-3.18 м (2H, Ad-CH2CH2).
Масс-спектр, m/z (Iотн, %): 384 (1.3) [М]+, 164 (7.6)
Масс-спектр, m/z (Iотн, %): 205 (56.2) [М]+, 162
[(CH3)2Ad]+, 135 (100) [Ad]+. Найдено, %: С 78.10;
(6.2)
[М - HNCO]+, 148 (5.0) [М - CH3NCO]+,
Н 10.45; N 7.31. C25H40N2О. Вычислено, %: С
135 (100). Найдено, %: С 76.11; Н 9.45; N 6.80.
78.07; Н 10.48; N 7.28. М 384.31.
C13H19NО. Вычислено, %: С 76.06; Н 9.33; N 6.82.
1-[2-(Адамантан-1-ил)этил]-3-(адамантан-2-
М 205.29.
ил) мочевина (6d). Получена аналогично соедине-
1-[2-(Адамантан-1-ил)этил]-3-[(адамантан-
нию 6a из 0.2 г 2-(адамантан-1-ил)этилизоцианата
1-ил)метил] мочевина (6a). К 0.25 г (1.2 ммоль)
(3) и 0.148 г 2-аминоадамантана. Выход 0.255 г
2-(адамантан-1-ил)этилизоцианата (3) в 6 мл без-
(73%), т.пл. 95-96°C. Спектр ЯМР 1Н (DMSO-d6),
водного диэтилового эфира прибавляли
0.2 г
δ, м.д.: 1.12-1.17 м (2H, Ad-CH2), 1.44-1.85 м
(1.2 ммоль) адамантан-1-илметиламина и 0.2 мл
(24H, Ad), 1.91 с (3H, Ad), 2.00-2.05 (2H, CH2 цик-
триэтиламина. Реакционную смесь выдерживали
логексан), 2.94-3.00 м (2H, CH2-NH), 3.05-3.10 м
при комнатной температуре в течение 12 ч. После
(2H, Ad), 3.64 c (1H, CH-NH), 5.55 уш.с (1H, CH2-
добавления 6 мл 1N HCl, смесь перемешивали в
NH), 5.99 д (1H, CH-NH, J 7.9 Гц). Масс-спектр,
течение 1 ч. Выпавший белый осадок отфильтро-
m/z (Iотн, %): 356 (20.9) [М]+, 206 (68.5) [Ad-
вывали и промывали водой. Продукт очищали пе-
CH2CH2NH-C=O]+, 135 (100) [Ad]+. Найдено, %:
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : III.
1011
С 77.52; Н 10.15; N 7.90. C23H36N2О. Вычислено,
6.67 т.д (1H, 4-Hаром, J1 2.5, J2 8.4 Гц), 7.00 д.д (1H,
%: С 77.48; Н 10.18; N 7.86. М 356.55.
2-Hаром, J1 1.5, J2 8.0 Гц), 7.19-7.24 м (1H, 3-Hаром),
7.45 д.т (1H, 6-Hаром, J1 2.3, J2 12.3 Гц), 8.62 с (1H,
4-[(4-{3-[2-(Адамантан-1-ил)этил]уреидо}-
NH-Ph). Спектр ЯМР 13C (DMSO-d6), δ, м.д.: 27.98
циклогексил)окси] бензойная кислота
(6e).
c (3C, Ad), 31.45 c (Ad-CH2), 34.01 c (CH2-NH),
Получена аналогично соединению 6a из 0.1 г
36.57 c (3C, Ad), 41.88 c (3C, Ad), 44.00 c (Adчетв),
2-(адамантан-1-ил)этилизоцианата (3) и 0.115 г
104.14 д (4-Cаром, J 26.4 Гц), 107.04 д (2-Cаром, J
транс-4-(циклогексилокси)бензойной кислоты.
21.4 Гц), 113.16 с (6-Cаром), 130.01 д (5-Cаром,
Выход 0.190 г (88%), т.пл. 214-215°C. Спектр ЯМР
J 10.0 Гц), 142.53 д (1-Cаром, J 11.3 Гц), 154.83 с
1Н (DMSO-d6), δ, м.д.: 1.12-1.17 м (2H, Ad-CH2),
(C=O), 162.41 с (3-Cаром, J 240.0 Гц). Спектр ЯМР
1.22-1.30 м (2H, CH2 циклогексан), 1.40-1.48 м
19F (DMSO-d6), δ, м.д.: -112.51 (1F). Масс-спектр,
(2H, CH2 циклогексан), 1.46 д (6H, Ad, J 2.2 Гц),
m/z (Iотн, %): 316 (33.3) [М]+, 135 (16.8) [Ad]+, 111
1.63 д.д (6H, Ad, J1 12.0, J2 32.8 Гц), 1.83-1.87 м
(100) [C6H4FNH2]+. Найдено, %: С 72.15; Н 7.95; N
(2H, CH2 циклогексан), 1.91 с (3H, Ad), 2.00-2.05
8.81. C19H25FN2О. Вычислено, %: С 72.12; Н 7.96;
(2H, CH2 циклогексан), 2.95-3.00 м (2H, CH2-NH),
N 8.85. М 316.42.
3.38-3.44 м (1H, CH-NH), 4.38-4.43 с (1H, CH-O),
5.51 т (1H, CH2-NH, J 5.5 Гц), 5.70 д (1H, CH-NH,
1-[2-(Адамантан-1-ил)этил]-3-(4-фторфенил)
J 7.7 Гц), 7.01 д (2H, 2CHаром, J 8.8 Гц), 7.86 д (2H,
мочевина (6k). Получена аналогично соедине-
2CHаром, J 8.8 Гц), 12.55 уш.с (1H, COOH). Масс-
нию 6a из 0.3 г 2-(адамантан-1-ил)этиламина (4) и
спектр, m/z (Iотн, %): 394 (0.8) [М - HCOOH]+, 303
0.23 г 4-фторфенилизоцианата. Выход 0.37 г (70%),
(100) [M - Ad]+, 135 (62.2) [Ad]+. Найдено, %: С
т.пл. 180-181°C. Спектр ЯМР 1Н (DMSO-d6), δ,
70.90; Н 8.28; N 6.39. C26H36N2О4. Вычислено, %:
м.д.: 1.20-1.24 м (2H, Ad-CH2), 1.49 д (6H, Ad, J
С 70.88; Н 8.24; N 6.36. М 440.58.
2.5 Гц), 1.64 д.д (6H, Ad, J1 12.0, J2 31.3 Гц), 1.92
1-[2-(Адамантан-1-ил)этил]-3-(3,4-дифтор-
с (3H, Ad), 3.05-3.11 м (2H, CH2-NH), 5.94 т (1H,
CH2-NH, J 5.5 Гц), 7.01-7.06 м (2H, 3,5-СHаром),
фенил) мочевина (6i). Получена аналогично со-
7.36-7.40 м (2H, 2,6-СHаром), 8.39 с (1H, NH-Ph).
единению 6a из 0.6 г 2-(адамантан-1-ил)этилизо-
цианата (3) и 0.4 г 3,4-дифторанилина. Выход 0.1 г
Спектр ЯМР 13C (DMSO-d6), δ, м.д.: 27.92 c (3C,
Ad), 31.39 c (Ad-CH2), 33.97 c (CH2-NH), 36.51 c
(10%), т.пл. 154-155°C. Спектр ЯМР 1Н (DMSO-d6),
δ, м.д.: 1.12-1.16 м (2H, Ad-CH2), 1.46 д (6H, Ad,
(3C, Ad), 41.83 c (3C, Ad), 44.02 c (Adчетв), 114.92 д
J 2.5 Гц), 1.63 д.д (6H, Ad, J1 11.6, J2 33.7 Гц), 1.90
(2C, 3,5-Cаром, J 21.4 Гц), 119.03 д (2C, 2,6-Cаром, J
с (3H, Ad), 2.94-2.99 м (2H, CH2-NH), 5.50 c (1H,
7.5 Гц), 136.91 с (1-Cаром), 155.07 с (C=O), 156.69 с
CH2-NH), 6.97-7.02 м (1H, 6-Hаром), 7.15 к (1H,
(3-Cаром, J 236.8 Гц). Спектр ЯМР 19F (DMSO-d6),
5-Hаром, J 9.0 Гц), 7.62 д.д.д (1H, 2-Hаром, J1 2.5, J2
δ, м.д.: -122.80 (1F). Масс-спектр, m/z (Iотн, %):
7.5, J3 13.5 Гц), 8.18 с (1H, NH). Спектр ЯМР 19F
316
(14.9)
[М]+,
135
(10.8)
[Ad]+,
111
(100)
(DMSO-d6), δ, м.д.: -137.82 (1F, 3-F), -148.50 (1F,
[C6H4FNH2]+. Найдено, %: С 72.16; Н 7.97; N 8.88.
4-F). Масс-спектр, m/z (Iотн, %): 334 (2.5) [М]+, 206
C19H25FN2О. Вычислено, %: С 72.12; Н 7.96; N
(37.0)
[Ad-CH2CH2NH-C=O]+, 135 (100) [Ad]+,
8.85. М 316.42.
129 (76.0) [C6H4FNCO]+, 111 (14.1) [C6H4FNH2]+.
1-[2-(Адамантан-1-ил)этил]-3-(2-хлорфенил)
Найдено, %: С 68.28; Н 7.19; N 8.42. C19H24F2N2О.
мочевина (6l). Получена аналогично соединению
Вычислено, %: С 68.24; Н 7.23; N 8.38. М 334.41.
6a из 0.34 г 1-(адамантан-1-ил)этиламина (4) и
1-[2-(Адамантан-1-ил)этил]-3-(3-фторфенил)
0.28 г 2-хлорфенилизоцианата. Выход 0.52 г (84%),
мочевина (6j). Получена аналогично соединению
т.пл. 195-196°C. Спектр ЯМР 1Н (DMSO-d6), δ,
6a из 0.3 г 2-(адамантан-1-ил)этиламина (4) и 0.23 г
м.д.: 1.21-1.26 м (2H, Ad-CH2), 1.50 д (6H, Ad,
3-фторфенилизоцианата. Выход 0.37 г (70%), т.пл.
J 2.5 Гц), 1.64 д.д (6H, Ad, J1 12.0, J2 30.8 Гц),
164-165°C. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.:
1.92 с (3H, Ad), 3.07-3.12 м (2H, CH2-NH), 6.87
1.20-1.25 м (2H, Ad-CH2), 1.49 д (6H, Ad, J 2.5 Гц),
т (1H, CH2-NH, J 5.3 Гц), 6.93 т.д (1H, 4-Hаром,
1.64 д.д (6H, Ad, J1 12.0, J2 31.3 Гц), 1.92 с (3H, Ad),
J
1.5, J2 7.7 Гц), 7.22 тд (1H, 5-Hаром, J1 1.5, J2
1
3.06-3.12 м (2H, CH2-NH), 6.04 c (1H, CH2-NH),
7.7 Гц), 7.38 д.д (1H, 3-Hаром, J1 1.5, J2 8.0 Гц),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1012
ДАНИЛОВ и др.
7.92 с (1H, NH-Ph), 8.14 д.д (1H, 6-Hаром, J1 1.5, J2
S0514749220060038 [Danilov D.V., Burmistrov V.V.,
8.3 Гц). Масс-спектр, m/z (Iотн, %):
332
(9.8)
Rasskazova E.V., Butov G.M. Russ. J. Org. Chem.
[М]+, 135 (13.0) [Ad]+, 127 (100) [C6H4ClNH2]+.
2020, 56.] doi 10.1134/S1070428020060032
Найдено, %: С 68.60; Н 7.60; N 8.38. C19H25ClN2О.
2.
Schmelzer K.R., Kubala L., Newman J.W., Kim I.H.,
Вычислено, %: С 68.56; Н 7.57; N 8.42. М 332.87.
Eiserich J.P., Hammock B.D. Proc. Natl. Acad.
Sci. U.S.A.
2005,
102,
9772-9777. doi
10.1073/
1-[2-(Aдамантан-1-ил)этил]-3-(3-хлорфенил)
pnas.0503279102
мочевина (6m). Получена аналогично соедине-
нию 6a из 0.17 г 1-(адамантан-1-ил)этиламина
3.
Fleming I., Rueben A., Popp R., Fisslthaler B.,
Schrodt S., Sander A., Haendeler J., Falck J.R.,
(4) и 0.14 г 3-хлорфенилизоцианата. Выход 0.26 г
Morisseau C., Hammock B.D., Busse R. Arterioscler.
(83%), т.пл. 128-129°C. Спектр ЯМР 1Н (DMSO-d6),
Thromb Vasc. Biol. 2007, 27, 2612-2618. doi 10.1161/
δ, м.д.: 1.20-1.24 м (2H, Ad-CH2), 1.49 д (6H, Ad,
ATVBAHA.107.152074
J 2.5 Гц), 1.64 д.д (6H, Ad, J1 12.0, J2 31.5 Гц), 1.92
с (3H, Ad), 3.06-3.11 м (2H, CH2-NH), 6.07 т (1H,
4.
Imig J.D. Expert Opin. Drug Metab. Toxicol. 2008, 4,
CH2-NH, J 5.5 Гц), 6.89-6.92 м (1H, 4-СHаром),
165-174. doi 10.1517/17425255.4.2.165
7.14-7.17 м (1H, 5-СHаром), 7.21 т (1H, 6-CHаром, J
5.
Burmistrov V., Morisseau C., D’yachenko V., Ryba-
8.0 Гц), 7.67 т (1H, 2-CHаром, J 2.0 Гц), 8.62 с (1H,
kov V.B., Butov G.M., Hammock B.D. J. Fluor.
NH-Ph). Масс-спектр, m/z (Iотн, %): 332 (3.9) [М]+,
Chem.
2019,
220,
48-53. doi
10.1016/
153 (5.6) [C6H4ClNCO]+, 135 (11.5) [Ad]+, 127 (100)
j.jfluchem.2019.02.005
[C6H4ClNH2]+. Найдено, %: С 68.61; Н 7.59; N
6.
Burmistrov V., Morisseau C., Harris T.R., Butov G.,
8.39. C19H25ClN2О. Вычислено, %: С 68.56; Н 7.57;
Hammock B.D. Bioorg. Chem. 2018, 76, 510-527.
N 8.42. М 332.87.
doi 10.1016/j.bioorg.2017.12.024
1,3-Бис-[2-(адамантан-1-ил)этил] мочевина
7.
Burmistrov V., Morisseau C., Lee K.S.S., Shiha-
(7). К 0.5 г (2.8 ммоль) 1-(адамантан-1-ил)этила-
dih D.S., Harris T.R., Butov G.M., Hammock B.D.
мина (4) в 40 мл тетрагидрофурана прибавляли
Bioorg. Med. Chem. Lett. 2014, 24, 2193-2197. doi
0.225 г (1.4 ммоль) N,N'-карбонил-диимидазола и
10.1016/j.bmcl.2014.03.016
выдерживали смесь в течение 4 ч при температуре
8.
Burmistrov V., Morisseau C., Pitushkin D., Karlov D.,
кипения растворителя. Выпавший белый осадок
Fayzullin R.R., Butov G.M., Hammock B.D. Bioorg.
отфильтровывали. Выход 0.225 г (42%), т.пл. 232-
Med. Chem. Lett. 2019, 28, 2302-2313. doi 10.1016/
233°C. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 1.14 с
j.bmcl.2018.05.024
(4H, Ad-CH2), 1.46 с (12H, Ad), 1.63 д.д (12H, Ad,
9.
Tanaka K., Hiraoka T., Ishiguro F., Jeon J.-H.,
J1 12.7, J2 33.6 Гц), 1.90 с (6H, Ad), 2.96 с (2H, CH2-
Chujo Y. RSC Adv.
2014,
4,
28107-28110. doi
NH), 5.47 с (2H, 2NH). Масс-спектр, m/z (Iотн, %):
10.1039/c4ra02575j
384 (16.7) [М]+, 206 (80.1) [Ad-CH2CH2NH-C=O]+,
10.
Новаков И.А., Орлинсон Б.С., Савельев Е.Н., По-
135 (100) [Ad]+, 93 (50.1). Найдено, %: С 78.10; Н
таенкова Е.А., Вострикова О.В., Тараканов Д.П.,
10.52; N 7.25. C25H40N2О. Вычислено, %: С 78.07;
Наход М.А. ЖОХ. 2017, 87, 1942-1946. [Nova-
Н 10.48; N 7.28. М 384.61.
kov I.A., Orlinson B.S., Savel’ev E.N., Potaenko-
ФОНДОВАЯ ПОДДЕРЖКА
va E.A., Vostrikova O.V., Tarakanov D.P.,
Работа выполнена при финансовой поддерж-
Nakhod M.A. Russ. J. Gen. Chem. 2017, 87, 2762-
ке Российского научного фонда (грант № 19-73-
2765]. doi 10.1134/S1070363217120027
10002).
11.
Hermant P., Bosc D., Piveteau C., Gealageas R.,
КОНФЛИКТ ИНТЕРЕСОВ
Lam B., Ronco C., Roignant M., Tolojanahary H.,
Jean L., Renard P.-Y., Lemdani M., Bourotte M.,
Авторы заявляют об отсутствие конфликта ин-
Herledan A., Bedart C., Biela A., Leroux F.,
тересов.
Deprez B., Deprez-Poulain R. J. Med. Chem. 2017, 60,
СПИСОК ЛИТЕРАТУРЫ
9067-9089. doi 10.1021/acs.jmedchem.7b01444
1. Данилов Д.В., Бурмистров В.В., Рассказова Е.В.,
12.
Бутов Г.М., Бурмистров В.В., Питушкин Д.А.
Бутов Г.М. ЖОрХ. 2020, 56, 870-878. doi 10.31857/
ЖОрХ. 2017, 53, 667-671 [Butov G.M., Burmis-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : III.
1013
trov V.V., Pitushkin D.A. Russ. J. Org. Chem. 2017, 53,
16. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J.
673-678.] doi 10.1134/S1070428017050050
Adv. Drug Del. Rev. 2001, 46, 3-26. doi 10.1016/
S0169-409X(00)00129-0
13. Nugent J., Campbell S.G., Vo Y., Schwartz B.D. Eur.
J. Org. Chem. 2017, 34, 5110-5118.
17. Новаков И.А., Кулев И.А., Радченко С.С., Бирзни-
енс К.А., Борейко Е.И., Владыко Г.В., Коробчен-
14. Wong E.C.N., Reekie T.A., Werry E.L.,
ко Л.В. Хим.-фарм. ж. 1987, 21, 454-458.
O’Brien-Brown J., Bowyer S.L., Kassiou M. Bioorg.
Med. Chem. Lett. 2017, 27, 2439-2442.
18. Gerzon K., Krumkalns E.V., Brindle R.L., Marshall F.J.,
Root M.A. J. Med. Chem. 1963, 6, 760-763. doi
15. Бурмистров В.В., Данилов Д.В., Дьяченко В.С.,
10.1021/jm00342a029
Рассказова Е.В., Бутов Г.М. ЖОрХ. 2020, 56, 672-
678. doi
10.31857/S051474922005002X
[Burmis-
19. Hwang S.H., Wecksler A.T., Zhang G., Morisseau C.,
trov V.V., Danilov D.V., D’yachenko V.S., Rasskazo-
Nguyen L.V., Fu S.H., Hammock B.D. Bioorg. Med.
va E.V., Butov G.M. Russ. J. Org. Chem. 2020, 56,
Chem. Lett.
2013,
23,
3732-3737. doi
10.1016/
735-740.] doi 10.1134/S1070428020050024
j.bmcl.2013.05.011
Synthesis and Properties of 1,3-Disubstituted Ureas
and its Isosteric Analogs Containing Polycyclic Fragments: III.
Synthesis and Properties of 1-[2-(Adamantan-1-yl)ethyl]-
3-R-ureas
D.V. Danilova, V.V. Burmistrova, b, and G.M. Butova, b, *
a Volgograd State Technical University (VSTU), 400005, Russia, Volgograd, pr. Lenina 28
b Volzhsky Polytechnic Institute (Branch) VSTU, 404121, Russia, Volgograd obl., Volzhsky, ul. Engelsa 42a
*e-mail: butov@post.volpi.ru
Received March 4, 2020; revised March 18, 2020; accepted March 26, 2020
Methods for the preparation of adamantylcontaining 1,3-disubstituted ureas with ethylene bridge between ad-
amantane fragment and the urea group have been developed based on 2-(adamantan-1-yl)ethylisocyanate (or
amine) with 29-88% yield. For the first time N,N'-carbonyldiimidazole was used to prepare 2-(adamantan-1-yl)-
ethylisocyanate. Synthesis of the isocyanate was carried out through the formation of stable N-[2-(adaman-
tan-1-yl)ethyl]-1H-imidazol-1-carboxamide, which could be used as precursor for the preparation of symmetric
ureas.
Keywords: adamantane, isocyanate, N,N'-carbonyldiimidazole, urea, halogenated anilines, soluble epoxide
hydrolase, sEH
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020