ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1014-1020
УДК 547-326+547-312+547.363
СИНТЕЗ И ИЗОМЕРИЗАЦИЯ ВО ФРАГМЕНТЕ
2-МЕТИЛ-ЕНАЛЯ АЦИКЛИЧЕСКИХ
ПРЕДШЕСТВЕННИКОВ В ПОДХОДАХ
К 9,11-ДИЕНОВЫМ АНАЛОГАМ ЭПОТИЛОНОВ
© 2020 г. Р. Ф. Валеев*, Г. Р. Сунагатуллина, М. С. Мифтахов
Уфимский институт химии - обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра РАН»,
450054, Россия, Республика Башкортостан, г. Уфа, пр. Октября 71
*e-mail: rusl0@yandex.ru
Поступила в редакцию 20 февраля 2020 г.
После доработки 26 марта 2020 г.
Принята к публикации 30 марта 2020 г.
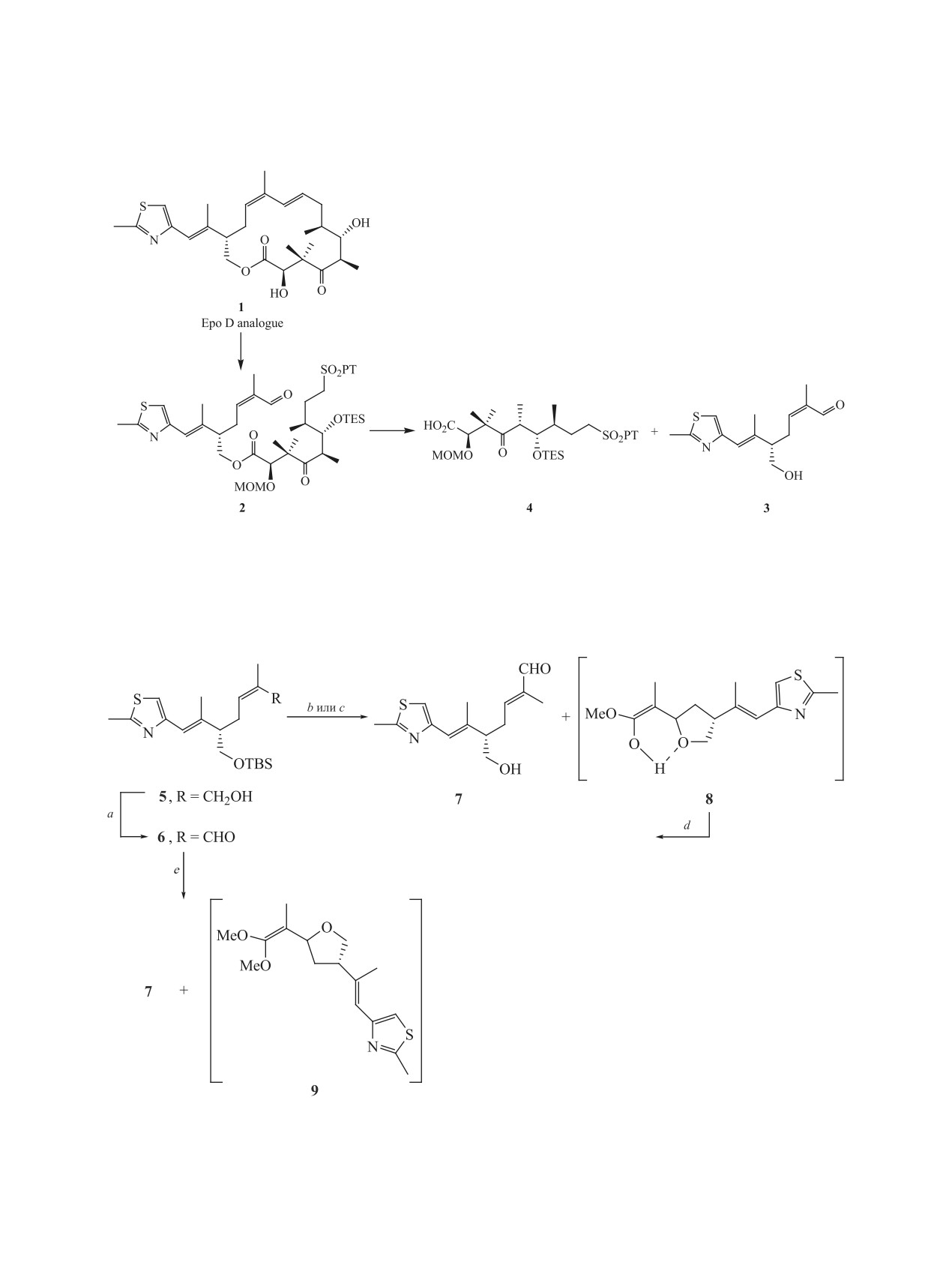
Этерификацией по Ямагучи (2Z,5S,6E)-5-(гидроксиметил)-2,6-диметил-7-(2-метил-1,3-тиазол-4-ил)геп-
та-2,6-диеналя с (2R,5R,6S,7S)-2-(метоксиметокси)-3,3,5,7-тетраметил-4-оксо-9-[(1-фенил-1H-тетразол-
5-ил)сульфонил-6-[(триэтилсилил)окси]нонановой кислотой синтезирован ожидаемый ациклический
сложный эфир. Обнаружена промотируемая кислотами и основаниями Z,E-изомеризация в фрагменте
2-метил-еналя предциклизационных предшественников.
Ключевые слова: этерификация по Ямагучи, реакция Джулиа-Кочински, 2-метил-еналь, изомеризация,
аналоги эпотилона D.
DOI: 10.31857/S0514749220070034
Синтез и изучение свойств модифицированных
при катализе p-TSA протекала с изомеризацией
эпотилонов (Epo) является одним из перспектив-
С2,С3-цис-двойной связи. После колоночной хро-
ных направлений в поиске эффективных противо-
матографии на SiO2 были выделены транс-еналь 7
раковых средств [1]. В продолжение работ по син-
и промежуточный енол предположительной струк-
тезу нового диенового типа аналога эпотилона D 1
туры 8. Видимо, в этом случае возможна некото-
[2] в данной статье мы приводим результаты пред-
рая стабилизация структуры енола с образованием
принятых усилий в направлении к соединению 1
водородной связи. При этом соединение 8 полно-
через ациклический блок 2 с его последующей вну-
стью превращались в транс-еналь 7 при выдержи-
тримолекулярной реакцией по Джулиа-Кочински
вании в хлороформе в течение 48 ч. Очевидно, эта
(J-K) [3] (схема 1). В свою очередь синтез соедине-
реакция катализируется содержащимся в CHCl3
ния 2 запланировали осуществить этерификацией
следовым количеством HCl.
по Ямагучи [4] альдегидоспирта 3 с содержащим
Деблокирование спирта 6 действием тетрабу-
фенилтетразолсульфонильную группу кислотой 4
тиламмонийфторида привело к аналогичному ре-
[5]. В подходах к альдегидной составляющей 3 по-
зультату, а в случае использования ионообменных
лученный ранее TBS-блокированный спирт 5 [6]
смол Amberlyst® в MeOH наряду с транс-еналем
ввели в реакцию окисления системой PhI(OAc)2-
7 было выделено устойчивое производное кетена
TEMPO и получили ожидаемый еналь 6 (схема 2).
диметилацеталя 9.
Однако, последующая стадия деблокирования
Далее мы изменили последовательность про-
гидроксильной группы еналя 6 в MeOH-CH2Cl2
ведения реакций, проведя первоначально дебло-
1014
СИНТЕЗ И ИЗОМЕРИЗАЦИЯ ВО ФР
АГМЕНТЕ 2-МЕТИЛ-ЕНАЛЯ
1015
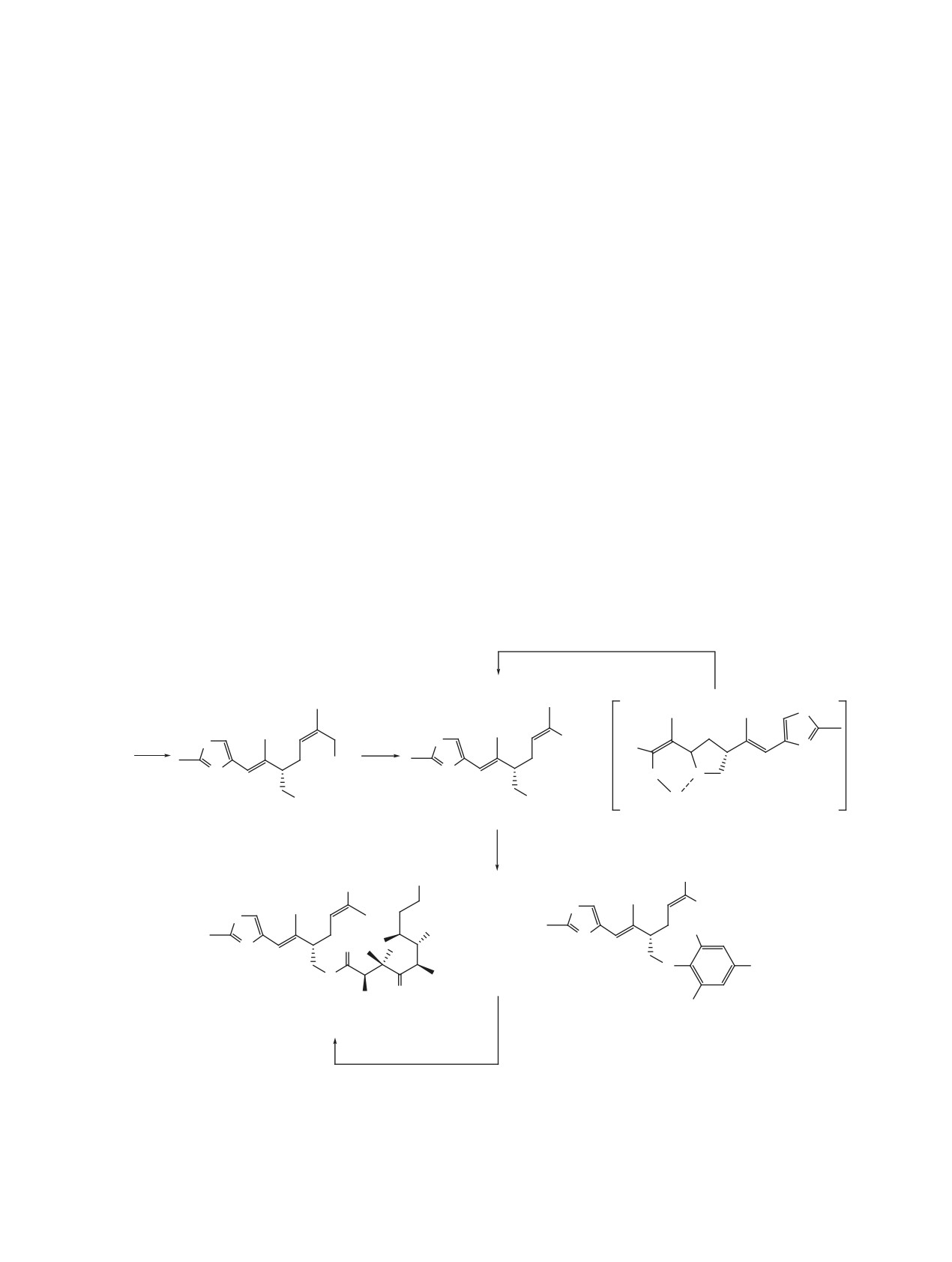
Схема 1.
кирование гидроксильной группы в соединении
ем неразделимой на SiO2 смеси изомеров 7 и 11
5, а затем региоселективное окисление диола 10
в соотношении 1:1 (ЯМР 1Н) и промежуточного
(схема 3). В данном варианте процесс изомериза-
продукта предположительной структуры 12, кото-
ции протекал на стадии окисления с образовани-
рый также превращался в транс-изомер 7 в сре-
Схема 2.
Реагенты и условия: a, TEMPO, PhI(OAc)2, CH2Cl2, 92%; b, p-TSA, MeOH-CH2Cl2 (1:1);
c, TBAF, THF; d, CHCl3, 48 h; e, Amberlyst®, MeOH.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1016
ВАЛЕЕВ и др.
де хлороформа. Отнесения еналей 11 и 7 с цис- и
вания (LDA, Na-, K-HMDS) так же как и катализ
транс-конфигурацией С2-С3 двойной связи сде-
диазабициклоундеценом (DBU) приводили лишь
лано на основании данных спектров ЯМР 1Н по
к изомеризации альдегидной части молекулы с
характерным различающимся сигналам альдегид-
образованием транс- изомера. По всей видимости
ных протонов. Так, сигнал альдегидного протона
протекающая в условиях J-K Z-E-изомеризация в
в случае цис- еналя 11 наблюдался при 10.1 м.д., в
енальной части 2 с образованием неблагоприятно-
то время как у транс-изомера 7 - в более сильном
го для макроциклизации E-изомера и есть одна из
поле при 9.4 м.д., что находится в соответствии с
причин, препятствующих процессу циклизации.
известными данными для сходных еналей [7].
Возможности альтернативных вариантов выхода
к соединению 1 исследуется в настоящее время в
На заключительном этапе выделенную после
нашей лаборатории.
колоночной хроматографии смесь изомеров 7 и 11
сразу же ввели в реакцию сочетания по Ямагучи
Полученные результаты дают основание
с кислотой 4. В результате были получены соот-
сделать вывод, что подход к макроциклизации
ветствующие изомерные эфиры 2, 13 и побочные
по J-K имеет ряд ограничений, в особенности,
продукты 14, 15, возможные в реакции Ямагучи
если функциональная альдегидная группа нахо-
при использовании первичных спиртов (схема 3).
дится в сопряжении с двойной связью. Данное
Все продукты оказались легко разделимы на SiO2,
обстоятельство в нашем случае способствует
и необходимый для целевого синтеза цис-изомер 2
образованию интермедиатов, препятствующих
был исследован во внутримолекулярной реакции
процессу циклизации, а также изомеризации суб-
по J-K. Испытав ряд условий [8], нам не удалось
страта в стерически менее выгодный для циклиза-
получить макроцикл. Металлорганические осно-
ции побочный продукт.
Схема 3.
c
7
+
S
S
S
CHO
a
b
HO
N
5
+
OH
N
N
O
O
OH
OH
H
10
11
12
d
SO PT
R1
CHO
2
2
R
S
S
OTES
Cl
+
2
+
N
N
O
O
Cl
O
O
MOMO
Cl
13
14, R1 = Me, R2 = CHO;
15, R1 = CHO,R2 = Me.
e, f
Реагенты и условия: a, p-TSA, MeOH-CH2Cl2 (1:1), 90%; b, TEMPO, PhI(OAc)2, CH2Cl2;
c, CHCl3, 12 h; d, TCB-Cl, Et3N, 4, THF, 1 h; затем, 7 + 11, DMAP, THF;
e, KHMDS, THF, -78-20°С, 18%; f, DBU, CH2Cl2, 16 h, 64%.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И ИЗОМЕРИЗАЦИЯ ВО ФР
АГМЕНТЕ 2-МЕТИЛ-ЕНАЛЯ
1017
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ли, концентрировали на вакууме, остаток очища-
ли методом колоночной хроматографии на SiO2
В работе использовалось оборудование ЦКП
(элюент
50%-ный EtOAc-петролейный эфир).
«Химия» УфИХ РАН. ИК спектры записывали на
Выход 7 43.2 мг (50%), выход 8 19.2 мг (21%).
спектрофотометре UR-20 в тонком слое или вазе-
линовом масле. Спектры ЯМР 1H и 13С записаны
б. К раствору альдегида 5 (0.11 г, 0.33 ммоль)
на спектрометре Bruker AM-300 [300 МГц (1Н)] и
в тетрагидрофуране в атмосфере аргона добавля-
AM-500 [125 МГц (13С)] для растворов веществ в
ли эквимолярное количество тетрабутиламмоний
CDCl3, внутренний стандарт - ТМС. Масс-спектры
фторида (TBAF) при 0°С. Смесь перемешивали в
сняты в этаноле на спектрометре Shimadzu LCMS-
течение 30 мин, затем добавили водный раствор
2010 EV. Для ТСХ анализа применяли хроматогра-
NaCl, экстрагировали EtOAc, экстракт сушили
фические пластины Sorbfil (Россия). Для колоноч-
MgSO4, фильтровали, концентрировали на вакуу-
ной хроматографии применяли силикагель марки
ме, остаток очищали методом колоночной хрома-
«Lancaster» (England). Оптическое вращение изме-
тографии на SiO2 (элюент 50%-ный EtOAc-пе-
рено на поляриметре «Perkin-Elmer 241 МС».
тролейный эфир). Выход 7 46.6 мг (54%), выход 8
17.3 мг (18%).
(2Z,5S,6E)-5-({[трет-Бутил(диметил)силил]-
окси}метил)-2,6-диметил-7-(2-метил-1,3-тиа-
в. К раствору альдегида 5 (0.11 г, 0.33 ммоль)
зол-4-ил)гепта-2,6-диеналь (6). К перемешивае-
в 20 мл MeOH добавляли 50 масс % Amberlyst®.
мому раствору спирта 5 (0.18 г, 0.47 ммоль) в 20 мл
Смесь выдерживали при комнатной температуре в
CH2Cl2 в атмосфере аргона добавляли PhI(OAc)2
течение 16 ч, затем фильтровали, концентрировали
(0.21 г, 0.71 ммоль) и каталитическое количество
на вакууме, остаток очищали методом колоночной
TEMPO при 0°С. Полученный раствор перемеши-
хроматографии на SiO2 (элюент 50%-ный EtOAc-
вали при комнатной температуре в течение 5 ч,
петролейный эфир). Выход 7 28.5 мг (33%), выход
затем концентрировали на вакууме, остаток очи-
9 45.4 мг (45%).
щали методом колоночной хроматографии на SiO2
(2E,5S,6E)-5-(Гидроксиметил)-2,6-диметил-
(элюент
10%-ный EtOAc-петролейный эфир).
7-(2-метил-1,3-тиазол-4-ил)гепта-2,6-диеналь
Выход 0.16 г (92%). Светло-желтая жидкость,
(7). Светло-желтая жидкость, Rf 0.43 (EtOAc),
Rf
0.52
(25%-ный EtOAc-петролейный эфир),
[α]D20 +1.5 (c 1.16, CH2Cl2). ИК спектр, ν, см-1:
[α]D20 +9.2 (c 2.02, CH2Cl2). ИК спектр, ν, см-1:
3347, 2924, 1684, 1436, 1378, 1183, 1054. Спектр
2954, 2928, 2857, 1678, 1472, 1253, 1109, 837, 776.
ЯМР 1Н, δ, м.д.: 1.76 с (3H), 2.03 с (3H), 2.55-2.58
Спектр ЯМР 1Н, δ, м.д.: 0.04 с (6H), 0.88 с (9H),
м (2Н), 2.71 с (3Н), 2.72-2.78 м (1Н), 3.70-3.73 м
1.75 с (3H), 2.01 c (3H), 2.41-2.50 м (1Н), 2.70 с
(2Н), 6.42 с (1Н), 6.48 т (1Н, J 8.0 Гц), 6.93 с (1Н),
(3Н), 2.71-2.76 м (1Н), 2.89-3.04 м (1Н), 3.60-3.66
9.37 с (1Н). Спектр ЯМР 13С, δ, м.д.: 9.4, 16.0, 18.9,
м (1Н), 3.72-3.77 м (1Н), 6.36 с (1Н), 6.53 т (1Н,
29.2, 51.3, 64.0, 115.1, 115.7, 139.6, 140.3, 151.8,
J 8.0 Гц), 6.88 с (1Н), 10.16 с (1Н). Спектр ЯМР
159.7, 164.9, 195.1. Масс-спектр, m/z: 266 [M +
13С, δ, м.д.: -5.5, 16.5, 16.9, 18.2, 19.1, 25.8, 26.8,
H]+. Найдено, %: C 63.18; H 7.11; N 5.14; S 12.14.
52.1, 65.3, 115.1, 121.0, 136.6, 139.5, 147.7, 152.7,
C14H19NO2S. Вычислено, %: C 63.36; H 7.22; N
164.5, 191.2. Масс-спектр, m/z: 381 [M + H]+.
5.28; S 12.08. М 265.37.
Найдено, %: C 63.42; H 8.84; N 3.47; S 8.34; Si 7.52.
C20H33NO2SSi. Вычислено, %: C 63.28; H 8.76; N
(1E)-1-Метокси-2-{(4S)-4-[(E)-1-метил-2-(2-
3.69; S 8.45; Si 7.40. М 379.63.
метил-1,3-тиазол-4-ил)винил]тетрагидрофу-
ран-2-ил}проп-1-ен-1-ол (8). Светло-желтая жид-
Методики деблокирования гидроксильной
кость, Rf 0.53 (EtOAc). Спектр ЯМР 1Н, δ, м.д.:
группы еналя 6. а. К раствору альдегида 5 (0.11 г,
1.62 с (3H), 2.01 с (3H), 2.08-2.12 м (2Н), 2.71 с
0.33 ммоль) в 20 мл смеси растворителей СH2Cl2-
(3Н), 3.03-3.16 м (1Н), 3.48 с (3Н), 3.70-4.09 м
MeOH (1:1) добавляли p-TSA∙H2O
(31.0 мг,
(2Н), 4.13-4.39 м (1Н), 6.39 с (1Н), 6.89 с (1Н).
0.16 ммоль) при 0°С. Смесь выдерживали при
комнатной температуре в течение 16 ч, затем ней-
4-{(1E)-2-[(3S)-5-(2,2-Диметокси-1-метил-
трализовали добавлением NaHCO3, фильтрова-
винил)тетрагидрофуран-3-ил]проп-1-ен-1-ил}-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1018
ВАЛЕЕВ и др.
2-метил-1,3-тиазол (9). Светло-желтая жидкость,
(11). Светло-желтая жидкость, Rf 0.43 (EtOAc).
Rf 0.6 (EtOAc), [α]D20 +2.1, (c 1.04, CH2Cl2). ИК
ИК спектр, ν, см-1: 3347, 2924, 1684, 1436, 1378,
спектр, ν, см-1: 2921, 1440, 1375, 1180, 1012. Спектр
1183, 1054. Спектр ЯМР 1Н, δ, м.д.: 1.75 с (3H),
ЯМР 1Н, δ, м.д.: 0.89-1.02 м (3H), 1.60-1.96 м (2Н),
2.03 с (3H), 2.51-2.58 м (2Н), 2.70 с (3Н), 2.74-2.83
2.04 с (3H), 2.71 с (3Н), 2.92-3.11 м (1Н), 3.36-3.45
м (1Н), 3.66-3.73 м (2Н), 6.41 с (1Н), 6.48 т (1Н, J
м (6Н), 3.60-3.73 м (1Н), 3.94-4.04 м (1Н), 4.24-4.37
8.0 Гц), 6.92 с (1Н), 10.13 с (1Н).
м (1Н), 6.39 с (1Н), 6.88 с (1Н). Спектр ЯМР 13С,
2-{(4R)-4-[(E)-1-Метил-2-(2-метил-1,3-тиа-
δ, м.д.:11.4, 18.5, 19.1, 41.1, 43.2, 56.5, 66.6, 67.3,
зол-4-ил)винил]тетрагидрофуран-2-ил}проп-
76.5, 114.9, 121.4, 139.1, 152.1, 152.8, 164.5. Масс-
1-ен-1,1-диол (12). Светло-желтая жидкость, Rf
спектр, m/z: 310 [M + H]+. Найдено, %: C 61.92; H
0.50 (EtOAc). Спектр ЯМР 1Н, δ, м.д.: 1.78 с (3H),
7.55; N 4.39; S 10.25. C16H23NO3S. Вычислено, %:
2.14 с (3H), 2.48-2.54 м (2Н), 2.72 с (3Н), 2.76-2.91
C 62.11; H 7.49; N 4.53; S 10.36. М 309.42.
м (1Н), 3.67-4.01 м (2Н), 4.05-4.30 м (1Н), 6.39 с
(2Z,5S)-2-Метил-5-[(E)-1-метил-2-(2-метил-
(1Н), 6.89 с (1Н).
1,3-тиазол-4-ил)винил]гекс-2-ен-1,6-диол
(10).
Общая методика этерификации по Ямагучи.
К перемешиваемому раствору спирта 5 (0.2 г,
К раствору 0.12 г (0.19 ммоль) кислоты 4 в
0.52 ммоль) в 20 мл смеси растворителей СH2Cl2-
20 мл ТГФ добавили 0.05 мл (0.38 ммоль) Et3N и
MeOH (1:1) добавляли p-TSA∙H2O
(49.2 мг,
0.05 мл (0.19 ммоль) 2,4,6-трихлорбензоилхлори-
0.26 ммоль) при 0°С. Смесь выдерживали при
да. Реакционную массу перемешивали при комнат-
комнатной температуре в течение 16 ч, затем ней-
ной температуре в течение 1 ч, после чего после-
трализовали добавлением NaHCO3, фильтровали,
довательно добавляли раствор 0.05 г (0.19 ммоль)
концентрировали на вакууме, остаток очищали
смеси спиртов 7 и 11 в 5 мл THF и каталитическое
методом колоночной хроматографии на SiO2 (элю-
количество DMAP. Через 3 ч реакционную массу
ент 50%-ный EtOAc-петролейный эфир). Выход
декантировали, концентрировали на вакууме, очи-
10 0.13 г (90%). Светло-желтая жидкость, Rf 0.15
щали на SiO2 методом колоночной хроматографии
(EtOAc), [α]D20 -1.5 (c 0.56, CH2Cl2). ИК спектр,
(элюент 15%-ный EtOAc-петролейный эфир).
ν, см-1: 3394, 2970, 2931, 2875, 1452, 1375, 1261,
1092, 802. Спектр ЯМР 1Н, δ, м.д.: 1.80 с (3H, СH3),
(2S,4Z)-5-Метил-2-[(E)-1-метил-2-(2-метил-
2.0 с (3H, CH3), 2.34-2.42 м (3H, СH2, CH), 2.69
1,3-тиазол-4-ил)винил]-6-оксогекс-4-ен-1-ил
c (3H, CH3тиазол), 3.63-3.72 м (2Н, СН2ОН), 4.06-
(2R,5R,6S,7S)-2-(метоксиметокси)-3,3,5,7-
4.14 м (2Н, СН2ОН), 5.25-5.27 м (1Н, =СН), 6.35
тетраметил-4-окса-9-[(1-фенил-1H-тетразол-5-
с (1Н, =СН), 6.89 с (1Н, =СНтиазол). Спектр ЯМР
ил)сульфонил]-6-[(триэтилсилил)окси]наноат
13С, δ, м.д.: 15.5, 18.7, 20.2, 29.7, 53.5, 66.1, 66.4,
(2). Выход 46.8 мг (28%). Светло-желтая жидкость,
114.5, 120.6, 126.8, 131.3, 141.1, 151.7, 164.2. Масс-
Rf
0.32
(30%-ный EtOAc-петролейный эфир),
спектр, m/z: 268 [M + H]+.
[α]D20 +3.8 (c 0.34, CH2Cl2). ИК спектр, ν, см-1:
2957, 2937, 2918, 1744, 1689, 1499, 1465, 1341,
Методика окисления диола 10. К перемеши-
1153, 1045, 922, 739. Спектр ЯМР 1Н, δ, м.д.:
ваемому раствору спирта 10 (0.12 г, 0.45 ммоль)
0.59-0.67 м (6H), 0.95 т (9Н, J 7.7 Гц), 1.01 д (3Н, J
в 20 мл CH2Cl2 в атмосфере аргона добавляли
6.8 Гц), 1.10 д (3Н, J 6.8 Гц), 1.17 д (3Н, J
PhI(OAc)2 (0.14 г, 0.45 ммоль) и каталитическое
5.3 Гц), 1.31 с (3Н, J 7.8 Гц), 1.55-1.60 м (2H), 1.76
количество TEMPO при 0°С. Полученный раствор
с (3Н), 1.82-1.85 м (1H), 2.03 с (3Н), 2.55-2.63 м
перемешивали при этой температуре в течение
(2Н), 2.73-2.79 м (4Н), 3.13-3.16 м (1Н), 3.30 с
4 ч, затем концентрировали на вакууме, остаток
(3Н), 3.60-3.66 м (1Н), 3.85-3.87 м (2Н), 4.11-4.14
очищали методом колоночной хроматографии
м (1Н), 4.21-4.24 м (1Н), 4.35-4.36 м (1Н), 4.56 д
на SiO2 (элюент 10%-ный EtOAc-петролейный
(2Н, J 3.0 Гц), 6.41-6.49 м (2Н), 6.93 с (1Н), 7.62-
эфир). Выход смеси соединений 7 и 11 66.7 мг
7.71 м (5Н), 10.12 с (1Н). Спектр ЯМР 13С, δ, м.д.:
(56%), выход 12 13.9 мг (11%).
5.4, 7.1, 9.3, 15.7, 16.4, 17.9, 18.9, 20.1, 20.4, 22.6,
(2Z,5S,6E)-5-(Гидроксиметил)-2,6-диметил-
23.3, 29.6, 29.5, 36.3, 45.5, 47.8, 51.3, 54.9, 56.2,
7-(2-метил-1,3-тиазол-4-ил)гепта-2,6-диеналь
66.4, 78.2, 80.6, 97.1,
116.1, 125.0, 129.6, 131.4,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И ИЗОМЕРИЗАЦИЯ ВО ФР
АГМЕНТЕ 2-МЕТИЛ-ЕНАЛЯ
1019
133.1, 139.5, 149.3, 153.5, 165.6, 170.9, 194.6, 216.6.
1.76 с (3Н), 2.07 с (3Н), 2.62-2.72 м (2Н), 2.80 с
Масс-спектр, m/z: 875 [M + H]+.
(3Н), 2.90-2.92 м (1Н), 4.42-4.45 м (1Н), 4.53-4.56
м (1Н), 6.49-6.53 м (2Н), 6.98 с (1Н), 7.34 с (2Н),
(2S,4E)-5-Метил-2-[(E)-1-метил-2-(2-метил-
9.40 с (1Н). Спектр ЯМР 13С, δ, м.д.: 9.5, 16.0, 29.3,
1,3-тиазол-4-ил)винил]-6-оксогекс-4-ен-1-ил
29.7, 47.7, 67.5, 114.2, 115.8, 126.6, 128.1, 129.2,
(2R,5R,6S,7S)-2-(метоксиметокси)-3,3,5,7-
тетраметил-4-окса-9-[(1-фенил-1H-тетразол-5-
132.6, 140.7, 150.3, 152.6, 156.7, 159.8, 164.0, 194.9.
ил)сульфонил]-6-[(триэтилсилил)окси]нона-
Масс-спектр, m/z: 474 [M + H]+.
ноат (13). Выход 61.9 мг (37%). Светло-желтая
БЛАГОДАРНОСТИ
жидкость, Rf 0.22 (30%-ный EtOAc-петролейный
Спектральная часть исследования и теорети-
эфир), [α]D20 +1.6 (c 0.59, CH2Cl2). ИК спектр, ν,
ческие вычисления проведены на оборудовании
см-1: 2957, 2937, 2918, 1744, 1689, 1499, 1465,
1341, 1153, 1045, 922, 739. Спектр ЯМР 1Н, δ,
ЦКП «Химия» УфИХ УФИЦ РАН.
м.д.: 0.59-0.67 м (6H), 0.95 т (9Н, J 7.7 Гц), 1.01
ФОНДОВАЯ ПОДДЕРЖКА
д (3Н, J 6.8 Гц), 1.11 д (3Н, J 6.8 Гц), 1.18 д (3Н, J
Работа выполнена по государственно-
5.3 Гц), 1.31 с (3Н, J 7.8 Гц), 1.55-1.62 м (2H), 1.75
му заданию
№ АААА-А17-117011910032-4 и
с (3Н), 1.82-1.85 м (1H), 2.04 с (3Н), 2.55-2.63 м
(2Н), 2.75-2.79 м (4Н), 3.12-3.17 м (1Н), 3.31 с
№ AAAA-A20-120012090021-4.
(3Н), 3.57-3.66 м (1Н), 3.86-3.88 м (2Н), 4.09-4.17
КОНФЛИКТ ИНТЕРЕСОВ
м (1Н), 4.22-4.25 м (1Н), 4.37-4.38 м (1Н), 4.57 д
Авторы заявляют об отсутствии конфликта ин-
(2Н, J 3.0 Гц), 6.44-6.49 м (2Н), 6.94 с (1Н), 7.60-
7.71 м (5Н), 9.39 с (1Н). Спектр ЯМР 13С, δ, м.д.:
тересов.
5.5, 7.1, 9.5, 15.9, 16.4, 17.9, 18.8, 20.3, 20.4, 22.8,
СПИСОК ЛИТЕРАТУРЫ
23.0, 29.4, 29.7, 36.2, 45.3, 47.8, 51.3, 54.7, 56.6,
1. Cao Y.-N., Zheng L-Li, Wang D., Liang X.-X., Gao F.,
66.1, 78.3, 80.6, 97.2, 115.9, 125.1, 129.8, 131.5,
133.1, 140.6, 150.6, 153.5, 165.6, 170.9, 195.0, 216.6.
Zhou X.-L. Eur. J. Med. Chem. 2018, 143, 806-828.
doi 10.1016/j.ejmech.2017.11.062
Масс-спектр, m/z: 875 [M + H]+.
2. Valeev R.F., Sunagatullina G.R., Biglova R.Z.
(2S,4Z)-5-Метил-2-[(E)-1-метил-2-(2-метил-
Mendeleev Commun. 2018, 28, 587-588. doi 10.1016/
1,3-тиазол-4-ил)винил]-6-оксагекс-4-ен-1-ил
jmencom.2018.11.007
2,4,6-трихлорбензоат (14). Выход 7.2 мг (8%).
Светло-желтая жидкость, Rf
0.84
(30%-ный
3. Jakubec P., Cockfield D.M., Dixon D.J. J. Am. Chem.
EtOAc-петролейный эфир), [α]D20 -0.6 (c 0.32,
Soc. 2009, 46, 16632-16633. doi 10.1021/ja908399s
CH2Cl2). ИК спектр, ν, см-1:2955, 2925, 1741, 1686,
4. Inanaga J., Kirata K., Saeki H., Katsuki T., Yamagu-
1580, 1548, 1272, 1121. Спектр ЯМР 1Н, δ, м.д.:
chi M. Bull. Chem. Soc. Jpn. 1979, 52, 1989-1993. doi
1.76 с (3Н), 2.08 с (3Н), 2.71 с (3Н), 2.80-2.83 м
10.1246/bcsj.52.1989
(1Н), 2.93-2.95 м (2Н), 4.42-4.46 м (1Н), 4.51-4.56
5. Валеев Р.Ф., Сунагатуллина Г.Р., Мифтахов М.С.
м (1Н), 6.43-6.47 м (2Н), 6.91 с (1Н), 7.34 с (2Н),
ЖОрХ.
2019,
55,
1465-1468.
[Valeev R.F.,
10.13 с (1Н). Спектр ЯМР 13С, δ, м.д.: 9.5, 16.0,
Sunagatullina G.R., Miftakhov M.S. Russ. J. Org.
29.3, 29.7, 47.7, 67.5, 114.7, 115.8, 126.6, 128.1,
Chem.
2019,
55,
1439-1441.] doi
10.1134/
129.2, 132.6, 140.7, 150.3, 152.3, 156.7, 158.8, 164.0,
S1070428019090264
195.0. Масс-спектр, m/z: 474 [M + H]+.
6. Valeev R.F., Bikzhanov R.F., Yagafarov N.Z.,
(2S,4E)-5-Метил-2-[(E)-1-метил-2-(2-метил-
Miftakhov M.S. Tetrahedron. 2012, 68, 6868-6872.
1,3-тиазол-4-ил)винил]-6-оксагекс-4-ен-1-ил
doi 10.1016/j.tet.2012.06.020
2,4,6-трихлорбензоат (15). Выход 10.8 мг (12%).
7. Dash U., Sengupta S., Sim T. Eur. J. Org. Chem. 2015,
Светло-желтая жидкость, Rf
0.73
(30%-ный
3963-3970. doi 10.1002/ejoc.201500380
EtOAc-петролейный эфир), [α]D20 -2.4 (c 0.34,
CH2Cl2). ИК спектр, ν, см-1: 2955, 2925, 1742, 1688,
8. Blakemore P.R., Ho D.K.H., Nap W.M. Org. Biomol.
1580, 1548, 1273, 1121. Спектр ЯМР 1Н, δ, м.д.:
Chem. 2005, 3, 1365-1368. doi 10.1039/B500713E
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1020
ВАЛЕЕВ и др.
Synthesis and Isomerization in a Fragment of Terminal
2-Methyl-Enal Acyclic Precursors of Epothilone Analogues
R. F. Valeev*, G. R. Sunagatullina, and M. S. Miftakhov
Ufa Institute of Chemistry, Ufa Federal Research Center, Russian Academy of Sciences,
450054, Russia, Republic of Bashkortostan, Ufa, pr. Oktyabrya 71
*e-mail: rusl0@yandex.ru
Received February 20, 2020; revised March 26, 2020; accepted March 30, 2020
Yamaguchi esterification of (2Z,5S,6E)-5-(hydroxymethyl)-2,6-dimethyl-7-(2-methyl-1,3-thiazol-4-yl)hep-
ta-2,6-dienal with (2R,5R,6S,7S)-2-(methoxymethoxy)-3,3,5,7-tetramethyl-4-oxo-9-[(1-phenyl-1H-tetrazol-5-yl)-
sulfonyl-6-[(triethylsilyl)hydroxy]nonanoic acid, the expected acyclic ester is synthesized. The Z,E-isomeri-
zation promoted by acids and bases was detected in the 2-methyl-enal fragment of precyclization precursors.
Keywords: Yamaguchi etherification, Julia-Kochiensky reaction, 2-methyl-enal, isomerization, epothilone D
analogues
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020