ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1021-1029
УДК 547.789.1:615.012.1.076
СИНТЕЗ И ПЕРВИЧНЫЙ СКРИНИНГ
ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ
4-[5-(1H-ИНДОЛ-3-ИЛМЕТИЛЕН)-4-ОКСО-
2-ТИОКСОТИАЗОЛИДИН-3-ИЛ]БУТИРИЛАМИДОВ
© 2020 г. В. Я. Горишнийa, В. С. Матийчукb, *
a Львовский национальный медицинский университет им. Данила Галицкого,
79010, Украина, г. Львов, ул. Пекарская 69
b Львовский национальный университет им. Ивана Франко, 79005, Украина, г. Львов, ул. Кирила и Мефодия 6
*e-mail: v_matiychuk@ukr.net
Поступила в редакцию 11 марта 2020 г.
После доработки 05 апреля 2020 г.
Принята к публикации 06 апреля 2020 г.
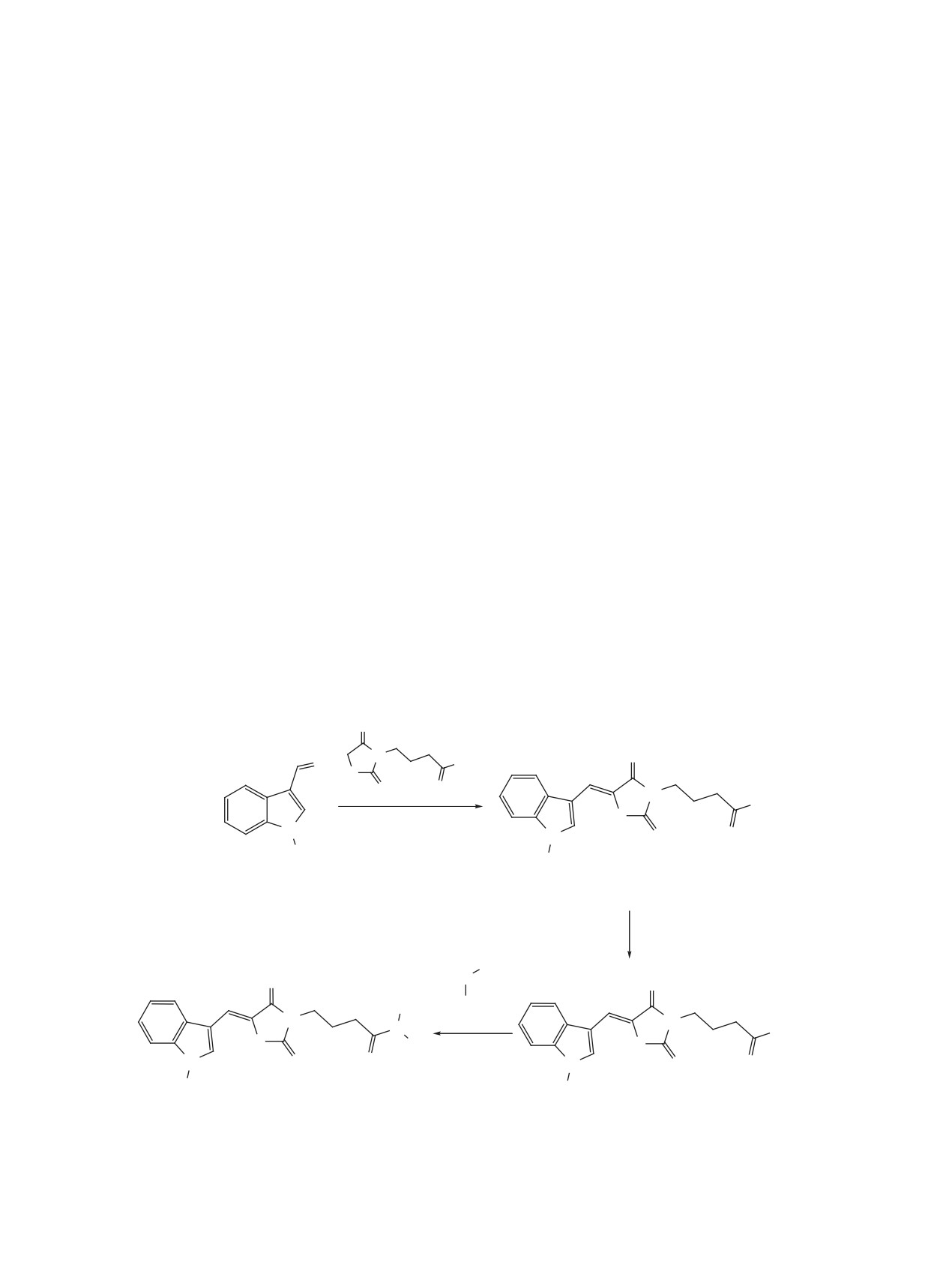
Разработан препаративный метод синтеза 4-[5-(1-R-1H-индол-3-илметилен)-4-оксо-2-тиоксотиазолидин-
3-ил]бутановых кислот. Взаимодействием их хлорангидридов с ароматическими и гетероциклическими
аминами получен ряд неописанных в литературе 5-(1H-индол-3-илметилен)-4-оксо-2-тиоксотиазоли-
дин-3-ил]бутириламидов. Проведено исследование противоопухолевой активности синтезированных
соединений. Установлено, что они проявляют умеренную активность в отношении большинства клеток
злокачественных опухолей. Наиболее чувствительными к большинству соединений оказались клетки
линий UO31 рака почек.
Ключевые слова: органический синтез, 2-тиоксотиазолидин-4-он, индол, противоопухолевая актив-
ность.
DOI: 10.31857/S0514749220070046
Химия индола обязана началом своего развития
тивности разнонаправленого профиля действия.
изучению индиго - вещества, известного челове-
Информация о биологических свойствах произ-
честву еще задолго до возникновения органиче-
водных 4-тиазолидона обобщена в обзорах [3-5],
ской химии как науки. Уникальность индольного
вышедших в последние десятилетия.
цикла стала понятна после того, как было уста-
Несмотря на это, углубленное изучение назван-
новлено строение многих белков, различных алка-
ных гетероциклических систем, синтез гибридов
лоидов и нейромедиаторов, внедрено в медицин-
на их основе, изучение биологической активности
скую практику большое количество фармакологи-
полученных соединений и установление взаимос-
ческих препаратов этого класса. На сегодняший
вязи между структурой и действием представляет
день индольный гетероцикл считается привиле-
несомненный интерес как с теоретической точки
гированным [1, 2]. Его исследованию направлены
зрения, так и в плане направленного поиска потен-
работы ученых разных направлений.
циальных лекарственных средств.
Аналогично индолу роданиновый (2-тиоксо-
В данной работе, продолжающей наши ис-
1,3-тиазолидин-4-оновый) и родственные гетеро-
следования по изучению биологически важ-
циклы также считаются привилегированными.
ных гетероциклических соединений
[6-20],
Соединения, содержащие этот фармакофор, об-
мы сообщаем о синтезе и противоопухоле-
ладают широким спектром биологической ак-
вой активности амидов
4-[5-(1H-индол-3-
1021
1022
ГОРИШНИЙ, МАТИЙЧУК
илметилен)-4-оксо-2-тиоксо-1,3-тиазолидин-3-
виде двух триплетов и одного мультиплета при
ил]бутановых кислот. Следует отметить, что про-
1.85-4.14 м. д. Сигнал метилиденового протона
изводные 5-(1H-индол-3-илметилен)-2-тиоксо-1,3-
находится при 8.00-8.10 м. д, что свидетельствует
тиазолидин-4-она обладают широким спектром
о Z-конфигурации синтезированных соединений.
биологической активности. Сообщалось о про-
Для активации карбоксильной функции
тивомикробной [21, 22], противовирусной [23] и
4-[5-(1H-индол-3-илметилен)-оксо-2-тиоксотиа-
противоопухолевой [24, 25] активностях. Они яв-
золидин-3-ил]-бутановых кислот 3а, b они были
ляются ингибиторами разнообразных ферментов
преобразованы в соответствующие хлоранги-
[26-29].
дриды 4a, b. Для этого их кипятили в смеси тио-
Исходные
4-[5-(1H-индол-3-илметилен)-4-
нилхлорида и безводного бензола. Окончанием
реакции считалось полное растворение исход-
оксо-2-тиоксо-1,3-тиазолидин-3-ил]бутановые
ных кислот. Выделенные из реакционной смеси и
кислоты 3a, b получали взаимодействием ин-
очищенные перекристаллизацией хлорангидриды
дол-3-карбальдегида 1а и его N-метилпроизводно-
4a, b - это оранжевые кристаллические веще-
го 1b с 4-(4-оксо-2-тиоксо-1,3-тиазолидин-3-ил)-
ства, растворимые в бензоле, диоксане, ацетоне и
бутановой кислотой 2. Оптимальными условиями
ДМФА, нерастворимые в гексане, гептане, изоок-
для проведения этой реакции являются кипящая
тане и петролейном эфире.
уксусная кислота в присутствии ацетата натрия в
качестве основания.
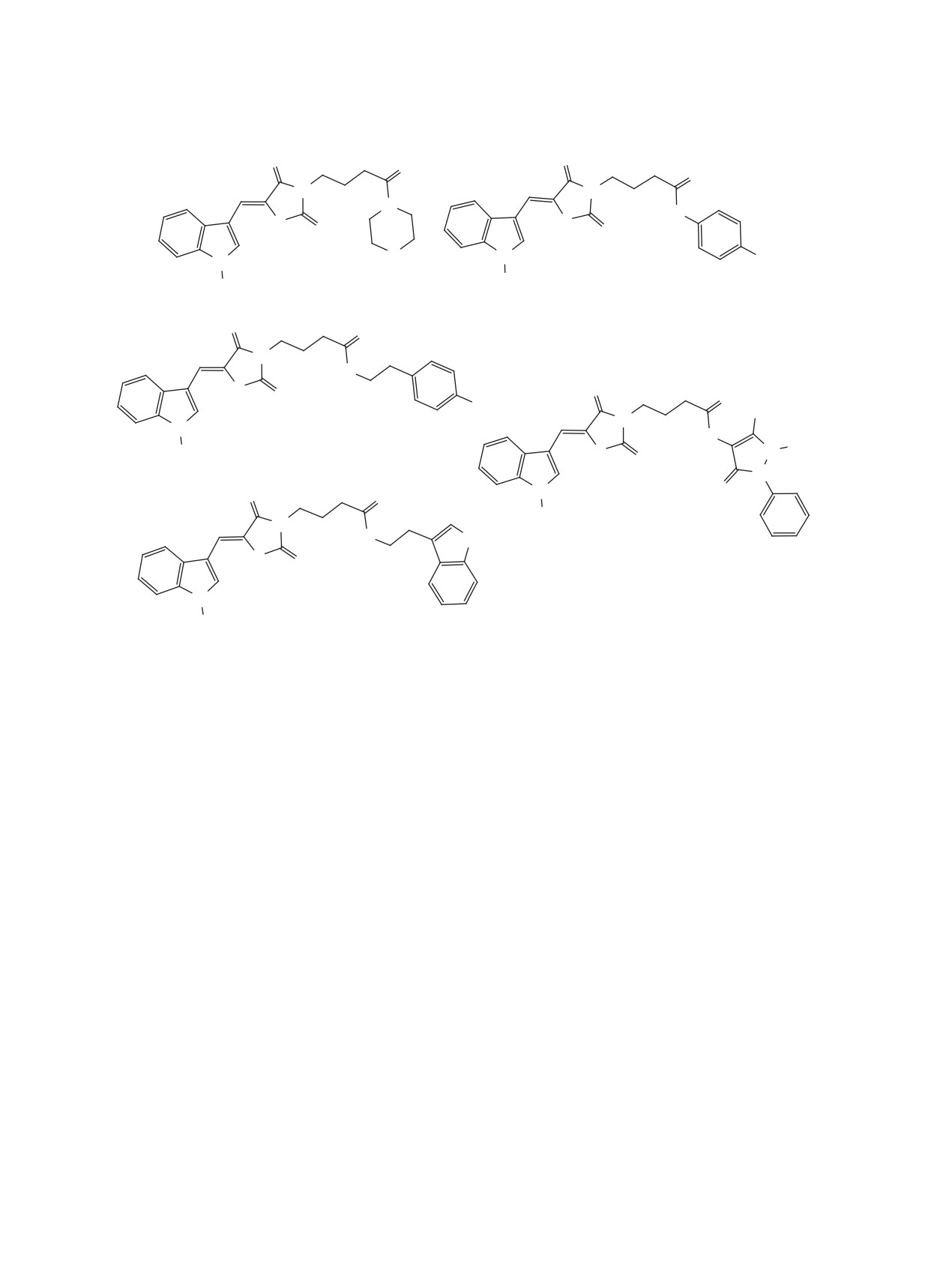
Целевые амиды 6a, b-10a, b получены взаимо-
действием хлорангидридов 4а, b с алифатически-
Строение полученных кислот подтверждено
ми, ароматическими и гетероциклическими ами-
при помощи 1Н ЯМР-спектроскопии. В области
нами 5а-е (схема 1). Реакцию проводили в среде
сильного магнитного поля наблюдаются харак-
диоксана в присутствии триэтиламина.
терные сигналы алифатических протонов мети-
леновой цепочки (CH2)3, которыe соединяют ти-
В качестве аминного компонента использованы
азолидиновый цикл с карбоксильной группой в
морфолин 5a, пара-аминофенол 5b, тирамин 5c,
Схема 1.
O
N
O
O
OH
S
S
O
2
N
OH
S
N
N
S
O
R
R
1a, b
3a, b
SOCl2
1
R
O
HN
O
R1
R2
N
5a-e
N
N
Cl
S
R2
NEt3
S
N
S
O
N
S
O
R
R
6-10
4a, b
1, 3, 4, 6-10, R = H (a), CH3 (b).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И ПЕРВИЧНЫЙ СКРИНИНГ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ
1023
O
O
O
O
N
N
N
HN
S
S
S
S
O
N
N
OH
R
R
6a, b
7a, b
O
O
N
HN
S
O
S
O
OH
CH3
N
N
HN
CH3
R
S
N
S
8a, b
N
N
O
O
O
R
N
HN
NH
10a, b
S
S
N
R
9a, b
6-10, R = H (a), CH3 (b).
Структуры полученных амидов 6-10.
триптамин 5d и 4-аминоантипирин 5e. Морфолин
при 8.05-8.10 м. д., а амидной - в пределах 9.75-
5a является классическим представителем алици-
10.30 м.д.
клических аминов и по его взаимодействию с 4
Противоопухолевую активность синтезирован-
можно судить о реакционной способности указан-
ных соединений изучали методом высокоэффек-
ных хлорангидридов. Тирамин 5с и триптамин 5d
тивного биологического скрининга согласно меж-
являются простыми алкалоидами, и их введение в
дународной научной программы Национального
молекулы органических веществ очень часто со-
института здоровья США - DTP (Developmental
провождается проявлением фармакологического
Therapeutic Program) Национального института
эффекта. К аналогичному результату приводит и
рака (Бетезда, Мэриленд, США) [30-33] in vitro
использование фармакофорных пара-аминофено-
на 60 линиях клеток, охватывающих практиче-
ла 5b и 4-аминоантипирина 5e.
ски весь спектр раковых заболеваний человека
Структуры полученных амидов 6-10 приведе-
(в том числе лейкемии, немелкоклеточного рака
ны на рисунке.
легких, эпителиального рака кишечника, мела-
Строение полученных амидов 6-10 также под-
номы, рака яичников и молочной железы). Ее ис-
тверждено при помощи 1Н ЯМР-спектроскопии.
следовали в концентрации веществ 10-5 моль/л.
Как и в случае 3a, b, сигналы алифатических про-
Количественным критерием активности соедине-
тонов метиленовых цепочек (CH2)3 и (CH2)2 на-
ний был рассчитан процент роста клеток линий
блюдаются при 1.85-4.12 м. д. Протон метили-
рака (GP, %) по сравнению с контролем [30-33].
деновой группы проявляется в виде синглета
Результаты исследования приведены в таблице.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1024
ГОРИШНИЙ, МАТИЙЧУК
Цитотоксичность синтезированных соединений в концентрации 10-5 М на 60 линиях раковых клеток.
Митотическая активность
на 60 линиях, GP, %
Соединение
Наиболее чувствительные линии (линия рака/тип), GP, %
средняя
диапазон
UO-31 (Рак почек) 73.93
6а
98.67
73.93-127.05
IGROV1 (Рак яичников) 81.04
UO-31 (Рак почек) 75.79
6b
99.48
75.79-124.96
IGROV1 (Рак яичников) 77.91
UO-31 (Рак почек) 67.77
7a
96.27
67.77-133.75
IGROV1 (Рак яичников) 73.08
UO-31 (Рак почек) 71.31
7b
95.44
71.31-113.28
MOLT-4 (Лейкемия) 77.20
UO-31 (Рак почек) 67.00
8а
98.18
67.00-127.84
IGROV1 (Рак яичников) 72.55
UO-31 (Рак почек) 42.20
CCRF-CEM (Лейкемия) 44.56
SK-MEL-5 (Меланома) 47.89
MOLT-4 (Лейкемия) 50.35
8b
81.83
42.20-126.36
K-562 (Лейкемия) 54.04
HL-60(TB) (Лейкемия) 55.83
MDA-MB-468 (Рак молочной железы) 58.63
MCF7 (Рак молочной железы) 59.06
M14 (Меланома) 36.82
9a
87.40
36.82-115.54
K-562 (Лейкемия) 46.55
UO-31 (Рак почек) 49.71
UO-31 (Рак почек) 35.50
HL-60(TB) (Лейкемия) 37.22
9b
79.67
35.50-108.43
K-562 (Лейкемия) 49.60
SK-MEL-5 (Меланома) 56.16
CCRF-CEM (Лейкемия) 57.53
10а
93.80
54.11-117.36
A498 (Рак почек) 54.11
UO-31 (Рак почек) 69.45
10b
94.20
69.45-120.83
SF-268 (Рак ЦНС) 75.01
A549/ATCC (Немелкоклеточный рак легких) 83.34
Как показал эксперимент, полученные соеди-
Разработан удобный метод получения
нения обладают умеренным противоопухолевым
5-(1H-индол-3-илметилен)-4-оксо-2-тиоксотиазо-
действием. Самыми активными оказались трип-
лидин-3-ил]бутириламидов. Проведен скрининг
противоопухолевой активности полученных ве-
тамиды 9b (Mean GP = 79.67%) и 9a (Mean GP =
ществ. Установлено, что они обладают умеренным
87.40%) и тираминамид 8b (Mean GP = 81.83%).
противоопухолевым действием.
Наибольшая активность наблюдалась относитель-
но линии UO-31 рака почек в случае соединения
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
9b (GP = 35.50%). Эта же линия оказалась наибо-
Спектры ЯМР 1H растворов веществ в ДМСО-d6
лее чувствительной к большинству других соеди-
регистрировали на спектрометре Varian Mercury
нений.
VX-400 (400 МГц), внутренний стандарт - ТМС.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И ПЕРВИЧНЫЙ СКРИНИНГ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ
1025
4-Оксо-2-тиоксотиазолидин-3-илбутановая
31.01, 33.42, 43.53, 110.10, 110.95, 114.31, 118.62,
кислота (2). В плоскодонную колбу с обратным
123.40, 125.32, 127.26, 133.89, 136.95, 166.74,
холодильником помещают
50 ммоль γ-амино-
173.71, 192.41. Найдено, %: C 56.75; H 4.35; N 7.69.
масляной кислоты, 5.7 г (5.5 ммоль) CS2, 5.6 г
C17H16N2O3S2. Вычислено, %: C 56.65; H 4.47; N
(100 ммоль) КОН и 15 мл воды, перемешивают
7.77.
на магнитной мешалке и прибавляют по каплям
Общая методика синтеза 4-[5-(1-R-1H-индол-
при перемешивании в 15 минут раствор 5.2 г
3-илметилен)-4-оксо-2-тиоксотиазолидин-3-
(5.5 ммоль) хлоруксусной кислоты, предваритель-
ил]бутирил хлоридов 4a, b. В круглодонную кол-
но нейтрализованной 5.5 ммоль натрия гидрокар-
бу объемом 50 мл помещают 2 ммоль соответству-
боната в 25 мл воды. Оставляют при температу-
ющей кислоты 3a, b, 1.2 мл тионилхлорида, 3 мл
ре ~20°C на 2 сут. К образовавшемуся раствору
безводного толуола и реакционную смесь кипятят
добавляют 20 мл 6н раствора HCl и нагревают
10 минут до образования раствора, выливают в
при кипении 1 ч. Охлаждают, осадок поочередно
5 мл петролейного эфира, охлаждают, осадок от-
дважды перекристаллизовывают из разбавленной
фильтровывают, промывают петролейным эфи-
уксусной кислоты и спирта. Выход 91%, т.пл. 121-
ром, высушивают и перекристаллизовывают из
122°С.
смеси толуол-петролейный эфир.
Общая методика синтеза 4-[5-(1-R-1H-индол-
4-[5-(1H-Индол-3-илметилен)-4-оксо-2-тиок-
3-илметилен)-4-оксо-2-тиоксотиазолидин-3-
сотиазолидин-3-ил]бутирил хлорид (4а). Выход
ил]бутановых кислот 3a, b. В круглодонную
63%, т.пл. 163-165°С.
колбу с обратным холодильником помещают 1.1 г
(5 ммоль) 4-оксо-2-тиоксотиазолидин-3-илбутано-
4-[5-(1-Метил-1H-Индол-3-илметилен)-4-
вой кислоты 2, 6 ммоль соответствующего альде-
оксо-2-тиоксотиазолидин-3-ил]бутирил хлорид
гида 1, 0.41 г 5 ммоль безводного ацетата натрия и
(4b). Выход 92%, т.пл. 154-155°С.
5 мл уксусной кислоты. Реакционную смесь
Общая методика синтеза 5-(1-R-1H-индол-3-
кипятят в течение 3 ч. Охлаждают, продукт реак-
илметилен)-4-оксо-2-тиоксотиазолидин-3-ил]-
ции отфильтровывают, промывают уксусной кис-
бутириламидов
6-10. Соответствующий амин
лотой и водой, высушивают и перекристаллизовы-
5а-е (2.1 ммоль) растворяют в 4 мл безводного
вают с уксусной кислоты.
диоксана при легком нагревании и добавляют
4-[5-(1H-Индол-3-илметилен)-4-оксо-2-тиок-
1 ммоль хлорангидрида 4a или 4b в 4 мл безводного
сотиазолидин-3-ил]-бутановая кислота
(3а).
диоксана, выдерживают при 90-95°C в течение
Выход 67%, т.пл. 227-229°С. Спектр ЯМР 1H, δ,
10 мин, охлаждают, разбавляют водой, подкис-
м.д.: 1.95-1.85 м (2H, NCH2CH2CH2), 2.29 т (1H,
ленной несколькими каплями соляной кислоты.
NCH2CH2CH2, J 7.2 Гц), 4.08 т (2H, NCH2CH2CH2,
Осадок отфильтровывают, промывают водой, вы-
J 6.9 Гц), 7.30-7.19 м (2H, индол), 7.51 д (1H, ин-
сушивают и перекристаллизовывают с уксусной
дол, J 7.8 Гц), 7.96 д (1H, индол, J 7.5 Гц), 8.08 с
кислоты.
(1H, =CH), 12.15 с (1H, COOH), 12.39 c (1H, NH).
5-(1H-Индол-3-илметилен)-3-(4-морфолин-4-
Найдено, %: C 55.29; H 4.01; N 8.01. C16H14N2O3S2.
ил-4-оксобутил-2-тиоксотиазолидин-4-он
(6а).
Вычислено, %: C 55.47; H 4.07; N 8.09.
Выход 98%, т.пл. 205-207°С. Спектр ЯМР 1H, δ,
4-[5-(1-Метил-1H-индол-3-илметилен)-4-
м.д.: 1.97-1.84 м (2H, NCH2CH2CH2), 2.38 т (2H,
оксо-2-тиоксотиазолидин-3-ил]-бутановая кис-
NCH2CH2CH2, J 7.1 Гц), 3.42-3.36 м (4H, мор-
лота (3b). Выход 83%, т.пл. 223-225°С. Спектр
фолин), 3.59-3.47 м (4H, морфолин), 4.08 т (2H,
ЯМР 1H, δ, м.д.: 2.04-1.89 м (2H, NCH2CH2CH2),
NCH2CH2CH2, J 6.9 Гц), 7.31-7.19 м (2H, индол),
2.30 т (2H, NCH2CH2CH2, J 7.4 Гц), 3.97 с (3H
7.51 д (1H, индол, J 7.8 Гц), 7.91 с (1H, индол), 7.96
CH3), 4.14 т (2H, NCH2CH2CH2, J 7.1 Гц), 7.33-
д (1H, индол, J 7.6 Гц), 8.07 с (1H, СН=), 12.39 с
7.22 м (2H, индол), 7.48 д (1H, индол, J 7.6 Гц),
(1H, NH). Найдено, %: C 57.72; H 5.17; N 10.01.
7.79 с (1H, индол), 7.88 д (1H, индол, J 7.3 Гц),
C20H21N3O3S2. Вычислено, %: C 57.81; H 5.09; N
8.00 с (1H, CH=). Спектр ЯМР 13С, δ, м.д.: 22.13,
10.11.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1026
ГОРИШНИЙ, МАТИЙЧУК
5-(1-Метил-1H-индол-3-илметилен)-3-(4-
J 7.9 Гц), 7.99-7.87 м (2H, индол), 8.09 с (1H, =CH),
морфолин-4-ил-4-оксобутил-2-тиоксотиазоли-
9.17 с (1H, OH), 12.40 с (1H, NH). Найдено, %: C
дин-4-он (6b). Выход 82%, т.пл. 186-188°С. Спектр
61.78; H 5.03; N 8.89. C24H23N3O3S2. Вычислено,
ЯМР 1H, δ, м.д.: 1.95-1.86 м (2H, NCH2CH2CH2),
%: C 61.91; H 4.98; N 9.02.
2.38 т (2H, NCH2CH2CH2, J 6.8 Гц), 3.42-3.36 м
N-[2-(4-Гидроксифенил)-этил]-4-[5-(1-ме-
(4H, морфолин), 3.54 д (2H, морфолин, J 16.8 Гц),
тил-1H-индол-3-илметилен)-4-оксо-2-тиоксоти-
3.94 с (3H, СН3), 4.06 т (2H, NCH2CH2CH2, J
азолидин-3-ил]бутириламид (8b). Выход 84%,
6.6 Гц), 7.27 т (1H, индол, J 7.4 Гц), 7.34 т (1H,
т.пл. 208-210°С. Спектр ЯМР 1H, δ, м.д.: 1.93-1.84
индол, J 7.4 Гц), 7.57 д (1H, индол, J 8.1 Гц), 8.00-
м (2H, NCH2CH2CH2), 2.12 т (2H, NCH2CH2CH2,
7.94 м (2H, индол), 8.03 с (1H, СН=). Найдено, %:
J 7.6 Гц), 2.56 т (2H ArCH2CH2, J 7.6 Гц), 3.17 д.д
C 58.86; H 5.29; N 9.91. C21H23N3O3S2. Вычислено,
(2H, ArCH2CH2, J 13.9, 6.7 Гц), 3.95 с (3H, CH3),
%: C 58.72; H 5.40; N 9.78.
4.04 т (2H, NCH2CH2CH2, J 7.0 Гц), 6.65 д (2H,
N-(4-Гидроксифенил)-4-[5-(1H-индол-3-ил-
4-OH-C6H4, J 8.4 Гц), 6.96 д (2H, 4-OH-C6H4, J
метилен)-4-оксо-2-тиоксотиазолидин-3-ил]бу-
8.3 Гц), 7.28 т (1H, индол, J 7.4 Гц), 7.35 т (1H,
тириламид (7а). Выход 97%, т.пл. 219-221°С.
индол), 7.58 д (1H, индол, J 8.1 Гц), 7.87 т (1H, ин-
Спектр ЯМР
1H, δ, м.д.:
2.02-1.92 м
(2H,
дол, J 5.6 Гц), 7.98 д (1H, индол, J 8.5 Гц), 8.05 с
NCH2CH2CH2),
2.32 т
(2H, NCH2CH2CH2, J
(1H, =CH), 9.17 с (1H, OH). Найдено, %: C 62.55;
7.5 Гц), 4.11 т (2H, NCH2CH2CH2, J 6.9 Гц), 6.65 д
H 5.17; N 8.84. C25H25N3O3S2. Вычислено, %: C
(2H, 4-OH-C6H4, J 8.7 Гц), 7.31-7.24 м (2H, индол),
62.61; H 5.25; N 8.76.
7.33 д (2H, 4-OH-C6H4, J 8.7 Гц), 7.51 д (1H, индол,
N-[2-(1H-Индол-3-ил)-этил]-4-[5-(1H-индол-
J 7.8 Гц), 7.91 с (1H, индол), 7.96 д (1H, индол, J
3-илметилен)-4-оксо-2-тиоксотиазолидин-3-
7.7 Гц), 8.09 с (1H, =CH), 9.13 с (1H, OH), 9.64 с
ил]бутириламид (9a). Выход 99%, т.пл. 179-
[1H, C(O)NH], 12.38 с (1H, NH). Найдено, %: C
181°С. Спектр ЯМР 1H, δ, м.д.: 1.94-1.89 м (2H,
60.21; H 4.28; N 9.75. C22H19N3O3S2. Вычислено,
NCH2CH2CH2),
2.14 т
(2H, NCH2CH2CH2, J
%: C 60.39; H 4.38; N 9.60.
7.5 Гц), 2.80 т (2H, CH2CH2индол, J 7.4 Гц),
N-(4-Гидроксифенил)-4-[5-(1-метил-1H-
3.32-3.27 м
(2H, CH2CH2индол),
4.07 т
(2H
индол-3-илметилен)-4-оксо-2-тиоксотиазоли-
NCH2CH2CH2, J 7.0 Гц), 6.94 т (1H, индол, J
дин-3-ил]бутириламид (7b). Выход 90%, т.пл.
7.2 Гц), 7.04 т (1H, индол, J 7.6 Гц), 7.13 с (1H,
223-225°С. Спектр ЯМР 1H, δ, м.д.: 2.03-1.91 м
индол), 7.34-7.19 м (3H, индол), 7.51 т (2H, ин-
(2H, NCH2CH2CH2), 2.32 т (2H, NCH2CH2CH2, J
дол, J 7.6 Гц), 7.91 д (1H, индол, J 2.8 Гц), 7.96 д
7.4 Гц), 3.95 с (3H, CH3), 4.10 т (2H, NCH2CH2CH2,
(2H, индол, J 7.0 Гц), 8.10 с (1H, =CH), 10.81 с [1H,
J 6.9 Гц), 6.65 д (2H, 4-OH-C6H4, J 8.8 Гц), 7.38-7.23
C(O)NH], 12.36 с (1H, NH). Найдено, %: C 63.78;
м (4H, 4-OH-C6H4 + индол), 7.58 д (1H, индол, J
H 5.04; N 11.55. C26H24N4O2S2. Вычислено, %: C
8.1 Гц), 8.01-7.95 м (2H, индол), 8.05 с (1H, =CH),
63.91; H 4.95; N 11.47.
9.17 уш.с (1H, OH), 9.65 с [1H, C(O)NH]. Найдено,
N-[2-(1H-индол-3-ил)-этил]-4-[5-(1-метил-
%: C 61.01; H 4.48; N 9.46. C23H21N3O3S2. Вы-
1H-индол-3-илметилен)-4-оксо-2-тиоксотиа-
числено, %: C 61.18; H 4.69; N 9.31.
золидин-3-ил]бутириламид
(9b). Выход
88%,
N-[2-(4-Гидроксифенил)-этил]-4-[5-(1H-
т.пл. 134-136°С. Спектр ЯМР 1H, δ, м.д.: 1.95-1.85
индол-3-илметилен)-4-оксо-2-тиоксотиазоли-
м (2H, NCH2CH2CH2), 2.15 т (2H, NCH2CH2CH2, J
дин-3-ил]бутириламид (8a). Выход 89%, т.пл.
7.5 Гц), 2.80 т (2H, CH2CH2-индол, J 7.4 Гц), 3.32-
198-201°С. Спектр ЯМР
1H, δ, м.д.: 1.86 д
3.27 м (2H, CH2CH2-индол), 3.94 с (3H, СН3), 4.06
(2H, NCH2CH2CH2, J 7.1 Гц), 2.11 т (2H, CH2CH2N·
т (2H, NCH2CH2CH2, J 7.2 Гц), 6.94 т (1H, индол,
CH2CH2CH2, J 7.6 Гц), 2.59 т (2H, ArCH2CH2, J
J 7.4 Гц), 7.04 т (1H, индол, J 7.4 Гц), 7.13 д (1H,
7.6 Гц), 3.15 д.д (2H, ArCH2CH2, J 14.2, 6.4 Гц),
индол, J 2.1 Гц), 7.37-7.24 м (3H, индол), 7.50 д
4.04 т (2H, NCH2CH2CH2, J 7.0 Гц), 6.64 д (2H,
(1H, индол, J 7.9 Гц), 7.58 д (1H, индол, J 8.1 Гц),
4-OH-C6H4, J 8.4 Гц), 6.95 д (2H, 4-OH-C6H4, J
8.01-7.93 м (3H, индол), 8.06 с (1H, =CH), 10.78
8.4 Гц), 7.29-7.23 м (2H, индол), 7.51 д (1H, индол,
с [1H, C(O)NH]. Найдено, %: C 64.34; H 5.35; N
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И ПЕРВИЧНЫЙ СКРИНИНГ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ
1027
11.01. C27H26N4O2S2. Вычислено, %: C 64.52; H
6.
Походыло Н.Т., Матийчук В.С., Обушак Н.Д. ХГС.
5.21; N 11.15.
2010, 2, 173-179. [Pokhodylo N.T., Matiychuk V.S.,
Obushak M.D. Chem. Heterocycl. Compd. 2010, 46,
N-(1,5-Диметил-3-оксо-2-фенил-2,3-ди-
140-145.] doi 10.1007/s10593-010-0484-3
гидро-1H-пиразол-4-ил)-4-[5-(1H-индол-3-ил-
метилен)-4-оксо-2-тиоксотиазолидин-3-ил]бу-
7.
Походыло Н.Т., Матийчук В.С., Обушак Н.Д. ХГС.
тириламид (10а). Выход 96%, т.пл. 253-255°С.
2008, 1, 140-142. [Pokhodylo N.T., Matiychuk V.S.,
Спектр ЯМР 1H, δ, м.д.: 1.95-2.00 м (2H, NCH2CH2·
Obushak M.D. Chem. Heterocycl. Compd. 2009, 45,
CH2), 2.13 с (3H, CH3), 2.36 т (2H, NCH2CH2CH2,
121-122.] doi 10.1007/s10593-009-0238-2
J 7.4 Гц), 3.03 с (3H, CH3), 4.12 т (2H NCH2CH2·
8.
Chaban T.I., Ogurtsov V.V., Matiychuk V.S.,
CH2, J 7.2 Гц), 7.37-7.20 м (6H, Ph + индол), 7.53-
Chaban I.G., Demchuk I.L., Nektegayev I.A. Acta
7.47 м (3H, индол), 7.90 д (1H, индол, J 2.6 Гц),
Chim. Slov.
2019,
66,
103-111. doi
10.17344/
7.96 д (1H, индол, J 7.7 Гц), 8.10 с (1H, =CH), 9.08
acsi.2018.4570
с [1H, C(O)NH], 12.35 с (1H, NH). Найдено, %: C
9.
Obushak M.D., Matiychuk V.S., Turytsya V.V.
61.17; H 4.86; N 13.01. C27H25N5O3S2. Вычислено,
Tetrahedron Lett. 2009, 50, 6112-6115. doi 10.1016/
%: C 61.00; H 4.74; N 13.17.
j.tetlet.2009.08.024
N-(1,5-Диметил-3-оксо-2-фенил-2,3-дигидрo-
10.
Zubkov F.I., Ershova J.D., Zaytsev V.P., Obushak M.D.,
1H-пиразол-4-ил)-4-[5-(1-метил-1H-индол-3-
Matiychuk V.S., Sokolova E.A., Khrustalev V.N.,
илметилен)-4-оксо-2-тиоксотиазолидин-3-ил]-
Varlamov A.V. Tetrahedron Lett. 2010, 51, 6822-
бутириламид (10b). Выход 90%, т.пл. 239-241°С.
6824. doi 10.1016/j.tetlet.2010.10.046
Спектр ЯМР
1H, δ, м.д.:
2.01-1.89 м
(1H,
11.
Pokhodylo N.T., Matiychuk V.S., Obushak M.D.
NCH2CH2CH2), 2.12 с (3H, CH3), 2.35 т (1H, NCH2·
Tetrahedron.
2009,
65,
2678-2683. doi
10.1016/
CH2CH2, J 7.4 Гц), 3.35 с (3H, CH3), 3.95 с (3H,
j.tet.2009.01.086
CH3), 4.10 т (1H, NCH2CH2CH2, J 7.0 Гц), 7.38-
12.
Chaban T., Matiychuk V., Ogurtsov V., Chaban I.,
7.24 м (5H, Ph), 7.38-7.24 м (5H, Ph), 7.49 т (2H,
Harkov S., Nektegaev I. Pharmacia. 2018, 65, 51-62
индол, J 7.7 Гц), 7.58 д (1H, индол, J 8.0 Гц), 8.02-
7.98 д (2H, индол, J 6.9 Гц), 8.06 с (1H, CH=), 9.12
13.
Походыло Н.Т., Савка Р.Д., Матийчук В.С., Обу-
с (1H, NH). Найдено, %: C 61.77; H 5.08; N 12.97.
шак Н.Д. ЖОХ. 2009, 79, 320-325. [Pokhodylo N.T.,
C28H27N5O3S2. Вычислено, %: C 61.63; H 4.99; N
Savka R.D., Matiichuk V.S., Obushak N.D. Russ.
12.83.
J. Gen. Chem. 2009, 79, 309-314.] doi 10.1134/
S1070363209020248
КОНФЛИКТ ИНТЕРЕСОВ
14.
Зименковский Б.С., Куцык Р.В., Лесык Р.Б., Ма-
Авторы заявляют об отсутствии конфликта ин-
тийчук В.С., Обушак Н.Д, Клюфинска Т.И. Хим.-
тересов.
фарм. ж. 2006, 40, 13-16. [Zimenkovskii B.S.,
СПИСОК ЛИТЕРАТУРЫ
Kutsyk R.V., Lesyk R.B., Matyichuk V.S., Obu-
1. Brase S. Privileged Scaffolds in Medicinal Chemistry.
shak N.D., Klyufinska T.I. Pharm. Chem. J. 2006, 40,
Design, Synthesis, Evaluation. Cambridge, 2015.
303-306.] doi 10.1007/s11094-006-0115-6
2. Welsch M.E., Snyder S.A., Stockwell B.R. Curr.
15.
Chaban T., Ogurtsov V., Mahlovanyy A., Sukho-
Opin. Chem. Biol. 2010, 14, 347-361. doi 10.1016/
dolska N., Chaban I., Harkov S., Matiychuk, V.
j.cbpa.2010.02.018
Pharmacia.
2019,
66,
171-180. doi.org/10.3897/
3. Tomasić T., Masic L.P. Curr. Med. Chem. 2009, 16,
pharmacia.66.e36764
1596-1629. doi 10.2174/092986709788186200
16.
Матийчук В.С., Потопнык М.А., Обушак Н.Д.
4. Kaminskyy D., Kryshchyshyn A., Lesyk R. Expert
ЖОрХ. 2008, 44, 1368-1376. [Matiichuk V.S., Potop-
Opin. Drug Discov.
2017,
12,
1233-1252. doi
nyk M.A., Obushak N.D. Russ. J. Org. Chem. 2008, 44,
10.1080/17460441.2017.1388370
1352-1361.] doi 10.1134/S1070428008090182
5. Kaminskyy D., Kryshchyshyn A., Lesyk R. Eur.
17.
Zelisko N., Atamanyuk D., Vasylenko O., Bryhas A.,
J. Med. Chem. 2017, 140, 542-594. doi 10.1016/
Matiychuk V., Gzella A., Lesyk R. Tetrahedron. 2014,
j.ejmech.2017.09.031
70, 720-729. doi 10.1016/j.tet.2013.11.083
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1028
ГОРИШНИЙ, МАТИЙЧУК
18.
Klenina O., Chaban T., Zimenkovsky B., Harkov S.,
Knapp S., Liu G., Nadali A., Quevedo C.E., Rus-
Ogurtsov V., Chaban I., Myrko I. Pharmacia. 2017, 64,
sell A.J., Walker R.G., Westwood R., Wynne G.M.
49-71.
Bioorg. Med. Chem.
2017,
25,
2657-2665. doi
19.
Bryhas A.O., Horak Y.I., Ostapiuk Y.V., Obushak M.D.,
10.1016/j.bmc.2017.02.056
Matiychuk V.S. Tetrahedron Lett. 2011, 52, 2324-2326.
27.
Pinson J.A., Schmidt-Kittler O., Zhu J., Jennings I.G.,
doi 10.1016/j.tetlet.2011.02.081
Kinzler K.W., Vogelstein B., Chalmers D.K., Thom-
20.
Zelisko N., Atamanyuk D., Ostapiuk Y., Bryhas A.,
pson P.E. ChemMedChem. 2011, 6, 514-522. doi
Matiychuk V., Gzella A., Lesyk R. Tetrahedron. 2015,
10.1002/cmdc.201000467
71, 9501-9508. doi 10.1016/j.tet.2015.10.019
28.
Song H., Lee Y.S., Roh E.J., Seo J.H., Oh K.S.,
21.
Song M.X., Li S.H., Peng J.Y., Guo T.T., Xu W.H.,
Lee B.H., Han H., Shin K.J. Bioorg. Med. Chem. Lett.
Xiong S.F., Deng X.Q. Molecules. 2017, 22, 970. doi
2012, 22, 5668-5674. doi 10.1016/j.bmcl.2012.06.088
10.3390/molecules22060970
29.
Ambeu N’ta C., Dago C.-D., Coulibaly W.-K.,
22.
Villain-Guillot P., Gualtieri M., Bastide L., Roquet F.,
Martinez J., Amblard M., Pugniere M., Leonetti J.P.
Mamyrbekova-Bekro J.A., Bekro Y.-A., Anoubilé B.,
J. Med. Chem. 2007, 50, 4195-4204. doi 10.1021/
Defontaine A., Baratte B., Bach S., Rucheau S.,
jm0703183
Ravache M., Le Guével R., Corlu A., Bazureau J.-P.
23.
Kamila S., Ankati H., Biehl E.R. Tetrahedron Lett.
Med. Chem. Res. 2016, 25, 2940-2958. doi 10.1007/
2011, 52, 4375-4377. doi 10.1016/j.tetlet.2011.05.114
s00044-016-1719-3
24.
Lafayette E.A., de Almeida S.M.V., Cavalcanti
30.
Monks A., Scudiero D., Skehan P., Shoemaker R.,
Santos R.V., de Oliveira J.F., Amorim C.A.D.C.,
Paull K., Vistica D., Hose C., Langley J., Cronise P.,
da Silva R.M.F., Pitta M.G.D.R., Pitta I.D.R., de
Vaigro-Wolff A. J. Nat. Cancer Inst. 1991, 83, 757. doi
Moura R.O., de Carvalho Júnior L.B., de Melo
10.1093/jnci/83.11.757
Rêgo M.J.B., de Lima M.D.C.A. Eur. J. Med. Chem.
31.
Boyd M.R., Paull K.D. Drug Dev. Res. 1995, 34, 91-
2017, 136, 511-522. doi 10.1016/j.ejmech.2017.05.012
109. doi 10.1002/ddr.430340203
25.
Li W., Zhai X., Zhong Z., Li G., Pu Y., Gong P.
32.
Boyd M.R., Teicher B.A. Humana Press. 1997, 2, 23-
Arch. Pharm.
2011,
344,
349-357. doi
10.1002/
ardp.201000326
43.
26.
Bataille C.J., Brennan M.B., Byrne S., Davies S.G.,
33.
Shoemaker R.H. Nature Rev. Cancer. 2006, 6, 813-
Durbin M., Fedorov O., Huber K.V., Jones A.M.,
823. doi 10.1038/nrc1951
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И ПЕРВИЧНЫЙ СКРИНИНГ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ
1029
Synthesis and Primary Screening of Antitumor Activity
4-[5-(1H-Indol-3-ylmethylene)-4-oxo-2-thioxothiazolidin-
3-yl]butyramides
V. Ya. Horishnya and V. S. Matiychukb, *
a Danylo Halytsky Lviv National Medical University, 79010, Ukraine, Lviv, ul. Pekarskaya 69
b Ivan Franko National University of Lviv, 79005, Ukraine, Lviv, ul. Kyryla і Mefodiya 6
*e-mail: v_matiychuk@ukr.net
Received March 11, 2020; revised April 5, 2020; accepted April 6, 2020
A preparative method for the synthesis of 4-[5-(1-R-1H-indol-3-ylmethylene)-4-oxo-2-thioxothiazolidin-3-yl]-
butanoic acids has been developed. By reaction of their acid chlorides with aromatic and heterocyclic amines,
a number of new 5-(1H-indol-3-ylmethylene)-4-oxo-2-thioxothiazolidin-3-yl]butyramides were obtained. The
antitumor activity of the synthesized compounds was carried out. It was found that they exhibit moderate activity
against most malignant tumor cells. The most sensitive to most compounds was UO31 cell line of kidney cancer.
Keywords: organic synthesis, 2-thioxo-thiazolidin-4-one, indol, antitumor activity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020