ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1039-1045
УДК 547.785.51 + 547-316
СИНТЕЗ И ПРЕВРАЩЕНИЯ
9-ЗАМЕЩЕННЫХ ИМИДАЗО[1,2-а]БЕНЗИМИДАЗОЛ-
2-КАРБАЛЬДЕГИДОВ
© 2020 г. Т. А. Кузьменко, Л. Н. Диваева*, А. С. Морковник
Научно-исследовательский институт физической и органической химии
ФГАОУ ВО «Южного федерального университета»,
344090, Россия, г. Ростов-на-Дону, пр. Стачки 194/2
*e-mail: divaevaln@mail.ru
Поступила в редакцию 18 марта 2020 г.
После доработки 16 апреля 2020 г.
Принята к публикации 20 апреля 2020 г.
При нагревании раствора 2-дибромметил-9-метил-3-этоксикарбонил-9Н-имидазо[1,2-а]бензимидазола
в этаноле с высоким выходом впервые получен 9-метил-3-этоксикарбонил-9Н-имидазо[1,2-а]бензими-
дазол-2-карбальдегид, кислотный гидролиз которого приводит к менее доступному 9-метилимидазо-
бензимидазол-2-карбальдегиду. 2-Формил-3-этоксикарбонилимидазобензимидазол при взаимодействии
с гидразингидратом циклизуется с замыканием оксопиридазинового цикла и как типичный альдегид
реагирует с ароматическими метилкетонами, гидроксиламином, малононитрилом, вступает в трехком-
понентную конденсацию по реакции Биджинелли.
Ключевые слова: 9-метил-3-этоксикарбонил-9Н-имидазо[1,2-а]бензимидазол-2-карбальдегид, 9-ме-
тил-9Н-имидазо[1,2-а]бензимидазол-2-карбальдегид, 6-метил-2Н-бензо[4',5']имидазо[1',2':1,2]имида-
зо[4,5-d]пиридазин-1(6Н)-он, 9-метил-3-этоксикарбонил-9Н-имидазо[1,2-а]бензимидазол-2-карбонитрил,
реакция Биджинелли.
DOI: 10.31857/S051474922007006X
2-Формилимидазо[1,2-а]бензимидазолы, в от-
Предложен другой подход к
2-формили-
личие от 3-формилпроизводных этого ряда, изу-
мидазобензимидазолам и начато изучение их
чены мало. В публикации
[1], посвященной
реакционной способности, что представляется
немаловажным в связи с разнообразной фар-
поиску новых ингибиторов β-лактамазы, опи-
макологической активностью производных этой
сан синтез
9-метилимидазо[1,2-а]бензимида-
конденсированной системы
[2-5]. В качестве
зол-2-карбальдегида, который охарактеризован
исходного соединения нами был выбран пре-
лишь коричневым цветом кристаллов и ве-
паративно доступный 2-дибромметил-9-метил-3-
личиной молекулярной массы. Получен этот
этоксикарбонилимидаз[1,2-а]бензимидазол
(1).
альдегид путём конденсации
2-амино-1-метил-
Синтез его
3-метоксикарбонильного аналога,
бензимидазола с эфиром бромпировиноградной
действием N-бромсукцинимида на 2,9-диметил-3-
кислоты, восстановления образующегося 2-эток-
метоксикарбонилимидазобензимидазол, был опи-
сикарбонилимидазо[1,2-а]бензимидазола до соот-
сан ранее [6]. Несмотря на то, что гидролиз гем-
ветствующего спирта и его последующего окис-
дигалогенпроизводных в альдегиды обычно
ления с суммарным выходом не превышающим
проводят в присутствии нитрата серебра или
16%.
слабощелочных агентов, в нашем случае
1039
1040
КУЗЬМЕНКО и др.
Схема 1.
EtOOC
EtOOC
CHO
3
CHBr2
CHO
5
2
4
N
N
EtOH
N
H+
6
N
N
N
1
∆
∆
7
N
N
N
8
9
Me
Me
Me
1
2
3
NH2NH2
CH3COAr
Ar
H
R
N
O
N
CH=CHCOAr
EtOOC
N
N
N
N
N
H
NH2NH2
N
N
N
N
для 4b
N
N
Me
Me
Me
7
4a-c, 5a, b
6
4, R = COOEt; 5, R = H; 4, 5, Ar = 4-NO2C6H4 (a), 1,1'-бифенил-4-ил (b), нафт-1-ил (c);
6, Ar = 1,1'-бифенил-4-ил.
дибромпроизводное
1
наиболее успешно
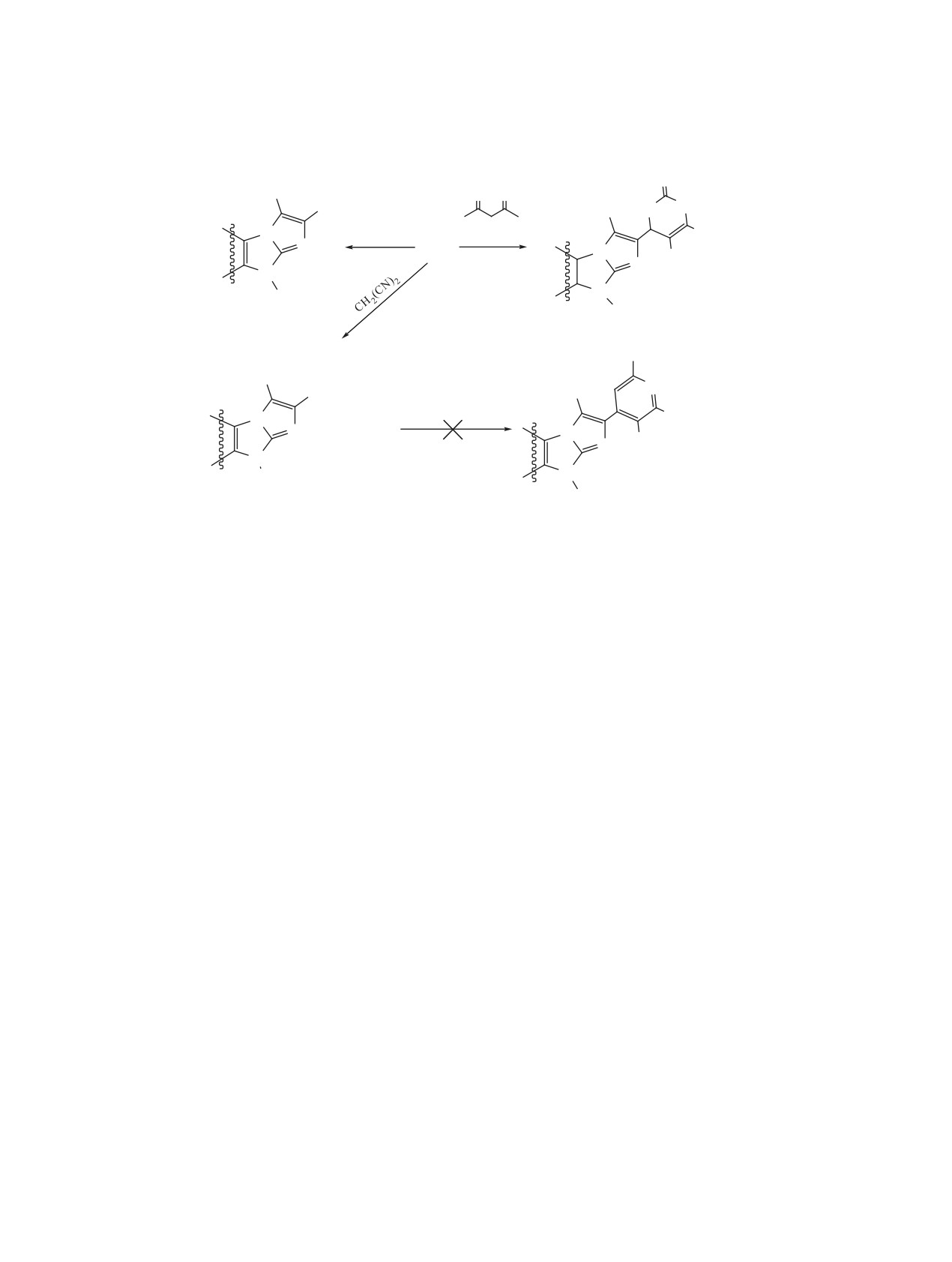
2-Формилимидазобензимидазолы 2, 3 в спир-
превращается в альдегид 2 в кипящем этаноле
тово-щелочной среде конденсируются с аромати-
(выход ~80%) (схема 1). Кислотный гидролиз
ческими метилкетонами с образованием аналогов
соединения
2,
сопровождающийся декар-
халкона 4 и 5, существующих по данным спектров
боксилированием промежуточной
3-карбоновой
ЯМР 1Н исключительно в форме транс-изомеров.
Как и большинство 9-R-имидазобензимидазолов с
кислоты, приводит к альдегиду 3. Но идет это
незамещенным положением 3, соединения 5 обра-
превращение с сильным осмолением, которое
зуют электростатически стабилизированные ком-
усугубляется при подщелачивании образующегося
плексы с ДМСО [7]. Поэтому, например, в спектре
раствора на этапе выделения продукта реакции
ЯМР 1Н халкона 5a при переходе от CDCl3 к по-
3, что понижает его выход до 42%. Возможно
лярному ДМСО наблюдается выраженное смеще-
такое повышенное смолообразование вызывается
ние сигнала протона Н3 в слабое поле примерно
межмолекулярным присоединением альдегидной
на 0.6 м.д. в область 8.29 м.д. В отличие от многих
группы к незамещенному атому С3, несущему
α,β-ненасыщенных кетонов, являющихся люми-
в имидазобензимидазолах максимальный отри-
нофорами, производные имидазобензимидазола 4
цательный заряд.
и 5 такими свойствами практически не обладают.
Как известно в спектрах ЯМР 1Н (CDCl3)
При действии гидразина в кипящем этаноле хал-
многих 2,9-дизамещенных имидазобензимидазо-
коны 4, как было показано на примере соединения
лов сигнал протона Н3 вычленяется в более силь-
4b, циклизуются в соответствующие пиразоли-
ны 6.
ное поле (~7 м.д.) по сравнению с сигналами
протонов Н5-8 [7]. В спектре же альдегида 3,
Реакция альдегида 2 или дибромметилпроизво-
напротив, синглет протона Н3 под влиянием
дного 1 с гидразингидратом приводит к образова-
электроноакцепторного и анизотропного эффек-
нию ранее неизвестного имидазобензимидазола с
тов соседней карбонильной группы смещен в
аннелированным оксопиридазиновым циклом 7,
самое слабое поле в область 8.04 м.д.
близкие структурные аналоги которого обладают
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И ПРЕВР
АЩЕНИЯ 9-ЗАМЕЩЕННЫХ ИМИДАЗО[1,2-а]БЕНЗИМИДАЗОЛ-...
1041
Схема 2.
S
EtOOC
O O
CN
EtOOC
HN
NH
,
1. NH2OH
N
2. Ac2O
(NH2)2CS
Me
N
2
N
COMe
N
N
N
Me
Me
8
11
C6H4-4NO2
EtOOC
N
CH=C(CN)2
EtOOC
CH3COC6H4-4NO2
AcONH4
NH2
N
N
N
CN
N
N
Me
N
Me
9
10
цитотоксическим [8] и антимикробным [9] дей-
Предложена достаточно удобная методика син-
ствием (схема 1).
теза неизвестных ранее 9-алкил-3-алкоксикарбо-
нилимидазо[1,2-а]бензимидазол-2-карбальдеги-
Альдегид 2 реагирует с гидроксиламином, пре-
дов. Кислотный гидролиз таких эфиров позволяет
вращаясь в соответствующий оксим, который при
с более высокой эффективностью, чем описано в
кратковременном нагревании с уксусным ангидри-
работе [1], получать 9-алкилимидазобензимида-
дом дегидратируется в нитрил 8 с выходом 75%
зол-2-карбальдегиды со свободным положением
(схема 2).
С3, которые, тем не менее, до сих пор остают-
По данным сообщения [10] 2-(имидазо[1,2-a]-
ся довольно труднодоступными соединениями.
пиридин-2-илметилен)малононитрил является хо-
Продемонстрирована перспективность исполь-
рошей основой для синтеза разнообразных 2-ге-
зования
2-формилимидазо[1,2-а]бензимидазолов
тарилпроизводных этой бициклической системы.
для синтеза новых производных этой трицикличе-
Нами из альдегида 2 и малононитрила с почти
ской системы.
количественным выходом получен подобный ди-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
нитрил 9, однако, его сплавление с 4-нитроаце-
Спектры ЯМР 1Н соединений 1, 3, 5b, 6 и 9
тофеноном и ацетатом аммония, при котором по
сняты на приборе Varian Unity-300 (300 МГц),
аналогии с [10] ожидалось образование 2-пириди-
остальных - на спектрометре Bruker Avance 600
лимидазобензимидазола 10, приводит к сложной
(600 МГц) для соединений 6, 7, 4c и 11 в раство-
смеси продуктов превращения, разделить которую
ре ДМСО-d6, остальных - в CDCl3. Сдвиги ядер
не удалось.
1H приведены относительно остаточного сигнала
С учетом широкого спектра фармакологиче-
дейтерорастворителя. ИК спектр сняты на при-
ской активности, в том числе противораковой,
боре Varian Excalibur 3100 FT-IR в твердой фазе
производных 3,4-дигидропиримидин-2-тиона [11,
в суспензии с вазелиновом маслом. Температуры
12] из альдегида 2, тиомочевины и 2,4-пентандио-
плавления определены на приборе Fisher-Johns
на в результате трехкомпонентной конденсации по
Melting Point Apparatus. Элементный анализ про-
реакции Биджинелли был синтезирован соответ-
веден классическим методом микроанализа [13].
ствующий дигидропиримидин-2-тион 11.
Контроль за протеканием реакций и индивидуаль-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1042
КУЗЬМЕНКО и др.
ностью полученных соединений осуществлялся
0.42 г (42%), светло-бежевые кристаллы, т.пл.
методом ТСХ (пластины с Al2O3 III степени актив-
138-139°С (изо-октан-толуол 9:1). Спектр ЯМР
ности, элюент CHCl3, проявление парами йода во
1Н, δ, м.д.: 3.83 с (3Н, СН3), 7.23-7.43 м (2Н, Н6,7),
влажной камере).
7.44 д (1Н, Н8, J 8,0 Гц), 7.64 д (1Н, Н5, J 8.1 Гц),
8.04 с (1Н, Н3), 9.93 с (1Н, СНО). Найдено, %: С
Все использованные реагенты коммерчески до-
66.12; Н 4.28; N 21.30. С11Н9N3O. Вычислено, %:
ступны.
С 66.32; Н 4.55; N 21.09.
2-Дибромметил-9-метил-3-этоксикарбонил-
Синтез халконов 4 и 5 (общая методика).
9Н-имидазо[1,2-а]бензимидазол (1) получен с
Раствор 2 ммоль альдегида 2 или 3 и 2 ммоль со-
выходом 78% по методике [6], предложенной для
ответствующего кетона в 5 мл этанола кипятили
3-метоксикарбонильного аналога. Бесцветные
5-7 мин в присутствии каталитических количеств
кристаллы, т.пл. 215-216°С. Спектр ЯМР 1Н, δ,
40%-го раствора NaOH. Образовавшийся осадок
м.д.: 1.50 т (3Н, СН2СН3, J 7.0 Гц), 3.86 с (3Н,
после охлаждения отфильтровывали, промывали
СН3), 4.51 к (2Н, СН2СН3, J 7.1 Гц), 7.22-7.41
спиртом, эфиром.
м (3Н, Н6-8), 7.59 с (1Н, СН), 8.12 д (1Н, Н5, J
(Е)-9-Метил-2-[3-(4-нитрофенил)-3-оксо-
8.4 Гц). Найдено, %: С 40.74; Н 2.95; Br 38.24; N
проп-1-ен-1-ил]-3-этоксикарбонил-9Н-имида-
10.30. С14Н13Br2N3O2. Вычислено, %: С 40.51; Н
зо[1,2-а]бензимидазол (4а). Выход 0.69 г (83%),
3.16; Br 38.50; N 10.12.
оранжевые кристаллы т.пл. 226-227°С (ДМФА).
9-Метил-3-этоксикарбонил-9Н-имида-
Спектр ЯМР 1Н, δ, м.д.: 1.48 т (3Н, СН2СН3, J
зо[1,2-а]бензимидазол-2-карбальдегид (2). Сус-
7.1 Гц), 3.84 с (3Н, СН3), 4.49 к (2Н, СН2СН3, J
пензию 4.15 г (0.01 моль) дибромпроизводного 1
7.1 Гц), 7.26 т [1Н, Н6(7), J 8.1 Гц], 7.30 д (1Н, Н8, J
в 50 мл этанола кипятили 1.5 ч до полного рас-
7.9 Гц), 7.39 т [1Н, Н7(6), J 7.9 Гц], 7.93 д (1Н, СН=,
творения осадка, а затем ещё 0.5 ч, контролируя
J 15.2 Гц), 8.19 д ]2Н, Н2',6'(3',5'), J 8.9 Гц], 8.31 д
окончание реакции методом ТСХ (Rf соединения
[2Н, Н3',5'(2',6'), J 8.9 Гц], 8.51 д (1Н, СН=, J 15.2 Гц),
1 - 0.9, альдегида 2 - 0.7). Растворитель упарива-
8.54 д (1Н, Н5, J 7.9 Гц)1. Найдено, %: С 63.37; Н
ли до 1/3 объёма, нейтрализовывали 20% раство-
4.12; N 13.52. С22Н18N4O5. Вычислено, %: С 63.15;
ром NaHCO3, выделившийся осадок отфильтро-
Н 4.34; N 13.39.
вывали, промывали водой. Выход 2.25 г (83%).
(Е)-2-({3-[(1',1''-Бифенил)-4-ил]-3-оксопроп-
Бесцветные кристаллы, т.пл. 211-212°С (AcOEt).
1-ен-1-ил})-9-метил-3-этоксикарбонил-9Н-
ИК спектр, ν, см-1: 1695 с (С=О), 1681 с (С=О).
имидазо[1,2-а]бензимидазол (4b). Выход 0.65 г
Спектр ЯМР 1Н, δ, м.д.: 1.46 т (3Н, СН2СН3, J
(72%), бледно-жёлтые кристаллы т.пл. 239-241°С
7.1 Гц), 3.81 с (3Н, СН3), 4.51 к (2Н, СН2СН3, J
(ДМФА). Спектр ЯМР 1Н, δ, м.д.: 1.50 т (3Н,
7.1 Гц), 7.26 т [1Н, Н6(7), J 7.4 Гц], 7.29 д (1Н, Н8, J
СН2СН3, J 7.1 Гц), 3.84 с (3Н, СН3), 4.49 к (2Н,
8.0 Гц), 7.42 т [1Н, Н7(6), J 7.4 Гц], 8.52 д (1Н, Н5, J
СН2СН3, J 7.1 Гц), 7.25-7.47 м [6Н, Н6(7),2''-6''],
8.3 Гц), 10.51 с (1Н, СНО). Найдено, %: С 62.15; Н
7.63-7.65 м [2Н, Н7(6),8], 7.71 д (2Н, Н2',6', J
5.03; N 15.72. С14Н13N3O3. Вычислено, %: С 61.99;
8.4 Гц), 8.04 д (1Н, СН=, J 15.2 Гц), 8.16 д (2Н,
Н 4.83; N 15.49.
Н3',5', J 8.4 Гц), 8.50 д (1Н, СН=, J 15.2 Гц), 8.55 д
9-Метил-9H-имидазо[1,2-а]бензимидазол-
(1Н, Н5, J 8.0 Гц). Найдено, %: С 74.98; Н 5.03; N
9.57. С28Н23N3O3. Вычислено, %: С 74.82; Н 5.16;
2-карбальдегид (3). Раствор 1.35 г (5 ммоль) аль-
N 9.35.
дегида 2 в 15 мл конц. HCl кипятили 3.5 ч, кон-
тролируя окончание реакции методом ТСХ, обра-
(Е)-9-Метил-2-[3-(нафтален-1-ил)-3-оксо-
батывали 20% раствором NaHCO3 до нейтральной
проп-1-ен-1-ил]-3-этоксикарбонил-9-Н-имида-
реакции, а затем полученную темно-коричневую
зо[1,2-а]бензимидазол (4c). Выход 0.60 г (70%),
реакционную массу экстрагировали хлороформом
жёлтые кристаллы т.пл.
196-197°С (BuOH).
(3×15 мл). Хлороформный экстракт упаривали и
остаток хроматографировали на колонке с Al2O3,
1 Цифрами со штрихами обозначены протоны в арильных
элюент - CHCl3, отбирая фракцию с Rf 0.6. Выход
заместителях.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И ПРЕВР
АЩЕНИЯ 9-ЗАМЕЩЕННЫХ ИМИДАЗО[1,2-а]БЕНЗИМИДАЗОЛ-...
1043
Спектр ЯМР 1Н, δ, м.д.: 1.41 т (3Н, СН2СН3, J
С4Н2 пиразолина), 3.68-3.74 м (1Н, С4Н2 пира-
7.1 Гц), 3.78 с (3Н, СН3), 4.28 к (2Н, СН2СН3, J
золина), 3.81 с (3Н, СН3), 4.52 к (2Н, СН2СН3, J
7.1 Гц), 7.28 т [1Н, Н6(7), J 7.4 Гц], 7.42 т.д [1Н,
7.0 Гц), 5.59-5.66 м (1Н, С5Н пиразолина), 6.58
Н7(6), J 7.4, 1.2 Гц], 7.57 д (1Н, СН=, J 15.5 Гц),
уш.с (1Н, NH), 7.26-7.82 (12Н, Наром), 8.50 д (1Н,
7.59-7.66 м (4Н, Н3',5'-7'), 7.84 д.д (1Н, Н8, J 7.0,
Н5, J 8.1 Гц). Найдено, %: С 72.68; Н 5.27; N 14.88.
1.2 Гц), 8.02-8.04 м (1Н, Н4'), 8.09 д (1Н, СН=, J
С28Н25N5O2. Вычислено, %: С 72.55; Н 5.44; N
15.5 Гц), 8.13 д (Н8', J 8.3 Гц), 8.20-8.22 м (1Н, Н2'),
15.11.
8.34 д (1Н, Н5, J 8.1 Гц). Найдено, %: С 73.52; Н
6-Метил-2Н-бензо[4',5']имидазо[1',2':1,2]-
5.23; N 10.18. С26Н21N3O3. Вычислено, %: С 73.74;
имидазо[4,5-d]пиридазин-1(6Н)-он (7). Раствор
Н 5.00; N 9.92
0.42 г (1 ммоль) дибромпроизводного 1 в 5 мл ги-
(Е)-9-Метил-2-[3-(4-нитрофенил)-3-оксо-
дразингидрата кипятили 0.5 ч. Выделившийся оса-
проп-1-ен-1-ил]-9Н-имидазо[1,2-а]бензимида-
док после охлаждения отфильтровывали, промы-
зол (5a). Оранжевые кристаллы, т.пл. 237-238°С
вали водой. Выход 0.21 г (88%). Бесцветные кри-
(BuOH), выход 0.52 г (75%). Спектр ЯМР 1Н
сталлы, т.пл. > 300°С (ДМФА). Спектр ЯМР 1Н, δ,
(CDCl3), δ, м.д.: 3.81 с (3Н, СН3), 7.22 т [1Н, Н6(7),
м.д.: 3.85 с (3Н, СН3), 7.37 т [1Н, Н8(9), J 7.1 Гц],
J 7.8 Гц], 7.29 д (1Н, Н8, J 8.0 Гц), 7.36 т [1Н, Н7(6),
7.40 т [1Н, Н9(8), J 7.1 Гц], 7.70 д (1Н, Н7, J 8.1 Гц),
J 7.9 Гц], 7.54 д (1Н, Н5, J 8.0 Гц), 7.66 с (1Н, Н3),
8.25 д (1Н, Н10, J 8.0 Гц), 8.40 с (1Н, Н4), 12.90 с
7.76 д (1Н, СН=, J 14.9 Гц), 7.85 д (1Н, СН=, J
(1H, NH). Найдено, %: С 60.12.15; Н 3.95; N 29.17.
14.9 Гц), 8.22 д [2Н, Н2',6'(3',5'), J 8.5 Гц], 8.32 д [2Н,
С12Н9N5O. Вычислено, %: С 60.25; Н 3.79; N 29.27.
Н3',5'(2',6'), J 8.5 Гц]. Спектр ЯМР 1Н, ДМСО-d6, δ,
9-Метил-3-этоксикарбонил-9Н-имида-
м.д.: 3.74 с (3Н, СН3), 7.22 т [1Н, Н6(7), J 7.8 Гц],
зо[1,2-а]бензимидазол-2-карбонитрил (8). Рас-
7.36 т [1Н, Н7(6), J 7.8 Гц], 7.54 д (1Н, Н8, J 8.1 Гц),
твор 0.27 г (1 ммоль) альдегида 2 и 0.14 г
7.65 д (1Н, СН=, J 14.9 Гц), 7.78 д (1Н, СН=, J
(2 ммоль) солянокислого гидроксиламина в 3 мл
14.9 Гц), 7.81 д (1Н, Н5, J 7.9 Гц), 8.23 д [2Н,
ледяной уксусной кислоты кипятили в присутст-
Н2',6'(3',5'), J 8.7 Гц], 8.29 с (1Н, Н3), 8.36 д [2Н,
вии 0.17 г (2 ммоль) безводного ацетата натрия
Н3',5'(2',6'), J 8.7 Гц]. Найдено, %: С 66.12; Н 4.27; N
0.5 ч. Охлаждали, добавляли 15 мл воды, выделив-
16.40. С19Н14N4O3. Вычислено, %: С 65.89; Н 4.07;
шийся осадок оксима отфильтровывали, промыва-
N 16.18.
ли водой, высушивали, выход 0.24 г (84%). Затем
(Е)-2-({3-[(1',1''-Бифенил)-4-ил]-3-оксопроп-
раствор оксима в 2 мл уксусного ангидрида кипя-
1-ен-1-ил})-9-метил-9Н-имидазо[1,2-а]бензи-
тили 0.5 ч, избыток уксусного ангидрида разла-
мидазол (5b). Выход 0.51 г (69%), ярко жёлтые
гали 7 мл воды, образовавшийся при этом осадок
кристаллы т.пл. 223-224°С (BuOH). Спектр ЯМР
отделяли, промывали водой. Выход 0.2 г (75%) в
1Н, δ, м.д.: 3.84 с (3Н, СН3), 7.21-7.69 м (10Н,
пересчете на исходный альдегид. Бесцветные кри-
Н3,5-8,2''-6''), 7.73 д (2Н, Н2',6', J 8.4 Гц), 7.86 д (1Н,
сталлы, т.пл. 177-178°С (AcOEt). ИК спектр, ν,
СН=, J 15.0 Гц), 7.90 д (1Н, СН=, J 15.0 Гц), 8.22 д
см-1: 2237 с (СN), 1712 с (С=О). Спектр ЯМР 1Н,
(2Н, Н3',5', J 8.4 Гц). Найдено, %: С 79.73; Н 4.80; N
δ, м.д.: 1.46 т (3Н, СН2СН3, J 7.1 Гц), 3.79 с (3Н,
11.42. С25Н19N3O. Вычислено, %: С 79.55; Н 5.07;
СН3), 4.46 к (2Н, СН2СН3, J 7.1 Гц), 7.27 т [1Н,
N 11.13.
Н6(7), J 7.4 Гц], 7.32 д (1Н, Н8, J 8.1 Гц), 7.42 т [1Н,
Н7(6), J 7.4 Гц], 8.47 д (1Н, Н5, J 8.3 Гц). Найдено, %:
2-{3-[(1',1''-Бифенил)-4-ил]-4,5-дигидро-1H-
С 62.51; Н 4.67; N 20.75. С14Н12N4O2. Вычислено,
пиразол-5-ил}-9-метил-3-этоксикарбонил-9Н-
%: С 62.68; Н 4.51; N 20.88.
имидазо[1,2-а]бензимидазол (6). Раствор 0.45 г
(1 ммоль) халкона 4b и 0.2 мл гидразингидрата в
2-(2,2-Дициановинил)-9-метил-3-этокси-
10 мл этанола кипятили 45 мин. Выделившийся
карбонил-9Н-имидазо[1,2-а]бензимидазол
(9).
бесцветный осадок после охлаждения отфильтро-
Раствор 1.35 г (5 ммоль) альдегида 2 и 0.35 г
вывали, промывали ацетоном, выход 0.32 г (69%),
(5 ммоль) динитрила малоновой кислоты в 25 мл
т.пл. 187-189°C (i-PrOH). Спектр ЯМР 1Н, δ, м.д.:
этанола кипятили 3-5 мин и оставляли при 25°С на
1.52 т (3Н, СН2СН3, J 7.0 Гц), 3.51-3.55 м (1Н,
1 ч. Выделившийся жёлтый осадок отфильтровы-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1044
КУЗЬМЕНКО и др.
вали, выход 1.50 г (94%), т.пл. 264-265°С (BuOH).
Med. Chem. Lett. 2005, 15, 4029-4032. doi 10.1016/
Спектр ЯМР 1Н, δ, м.д.: 1.55 т (3Н, СН2СН3, J
j.bmcl.2005.06.02
7.2 Гц), 3.88 с (3Н, СН3), 4.57 к (2Н, СН2СН3, J
3.
Spasov A.A., Vassiliev P.M., Lenskaya K.V., Kosola-
7.2 Гц), 7.31 т [1Н, Н6(7), J 7.4 Гц], 7.38 д (1Н, Н8, J
pov V.A., Babkov D.A., Anisimova V.A., Kuzmen-
8.2 Гц), 7.48 т [1Н, Н7(6), J 7.5 Гц], 8.46 с (1Н, СН=),
ko T.A., Morkovnik A.S. Pure Appl. Chem. 2017, 89,
8.54 д (1Н, Н5, J 8.1 Гц). Найдено, %: С 63.72; Н
1007-1016. doi 10.1515/pac-2016-1024
4.27; N 22.18. С17Н13N5O2. Вычислено, %: С 63.94;
4.
Spasov A.A., Grechko O.Yu., Shtareva D.M.,
Н 4.10; N 21.93.
Rashchenko A.I., Eliseeva N.V., Anisimova V.A.
2-(5-Ацетил-6-метил-2-тио-1,2,3,4-тетра-
J. Clin. Health Sci. 2018, 3, 13-18. doi 10.24191/
гидропиримидин-4-ил)-9-метил-3-этоксикарбо-
jchs.v3i2.7275
нил-9Н-имидазо[1,2-а]бензимидазол (11). Сус-
5.
Спасов А.А., Яковлев Д.С., Мальцев Д.В., Жу-
пензию 0.54 г (2 ммоль) альдегида 2, 0.23 г
ковская О.Н., Анисимова В.А., Ковалев Г.И., Зи-
(3 ммоль) тиомочевины и 0.2 мл (2 ммоль) 2,4-пен-
мин И.А., Морковина Ю.А. Биоорг. хим. 2016, 42,
тандиона в 10 мл этанола нагревали до кипения, а
440-447. [Spasov A.A., Yakovlev D.S., Maltsev D.V.,
затем полученный раствор выдерживали при 50°C
Zhukovskaya O.N., Anisimova V.A., Kovalev G.I.,
8 ч. Образовавшийся осадок отфильтровывали,
Zimin I.A., Morkovina Y.V. Russ. J. Bioorg. Chem.
промывали этанолом. Выход 0.49 г (60%), бесцвет-
2016, 42, 397-403.] doi 10.1134/S1068162016040178
ные кристаллы, т.пл. 284-285°C (ДМФА). Спектр
ЯМР 1Н, δ, м.д.: 1.41 т (3Н, СН2СН3, J 7.1 Гц), 2.09
6.
Анисимова В.А., Лукова О.А. ХГС. 1994, 30, 369-
с (3Н, СН3), 2.31 с (3Н, СОСН3), 3.71 с (3Н, NСH3),
376. [Anisimova V.A., Lukova O.A. Chem. Heterocycl.
4.38-4.45 м (2Н, СН2СН3), 6.18 с (1Н, СН), 7.25 т
Compd. 1994, 30, 325-330.] doi 10.1007/BF01165699
[1Н, Н6(7), J 7.8 Гц], 7.38 т [1Н, Н7(6), J 7.9 Гц], 7.57
7.
Кузьменко Т.А., Диваева Л.Н., Морковник А.С.,
д (1Н, Н8, J 8.2 Гц), 8.33 д (1Н, Н5, J 8.3 Гц), 9.39 с
Анисимова В.А., Бородкин Г.С., Кузьменко В.В.
(1Н, NH), 10.16 с (1H, NH). Найдено, %: С 58.59; Н
ЖОрХ. 2014, 50, 727-734. [Kuzmenko T.A., Divae-
5.27; N 16.85; S 7.51. С20Н21N5O3S. Вычислено, %:
va L.N., Morkovnik A.S., Anisimova V.A., Borod-
С 58.38; Н 5.14; N 17.02; S 7.79.
kin G.S., Kuzmenko V.V. Russ. J. Org. Chem. 2014, 50,
БЛАГОДАРНОСТИ
716-724.] doi 10.1134/S1070428014050169
8.
Murineddu G., Cignarella G., Chelucci G., Loriga G.,
Работа выполнена с использованием оборудо-
вания ЦКП Южного федерального университета.
Pinna G.A. Chem. Pharm. Bull. 2002, 50, 754-759. doi
10.1248/cpb.50.754
ФОНДОВАЯ ПОДДЕРЖКА
9.
Avan I., Guven A., Guven K. Turk. J. Chem. 2013, 37,
Работа выполнена при финансовой поддерж-
271-291. doi 10.3906/kim-1210-22
ке Министерства науки и высшего образования
10.
Haouchine A.-L., Kabri Y., Bakhta S., Curti Ch.,
РФ в рамках Госзадания № БАЗ 0110.20-3-11ИХ
Nedjar-Kolli B., Vanelle P. Synth. Commun. 2018, 48,
(ЮФУ).
2159-2168. doi 10.1080/00397911.2018.1479759
КОНФЛИКТ ИНТЕРЕСОВ
11.
Кулаков И.В., Талипов С.А., Шульгау З.Т., Сейл-
Авторы заявляют об отсутствии конфликта ин-
ханов Т.М. ХГС. 2014, 1604-1613. [Kulakov I.V.,
тересов.
Talipov S.A., Shulgau Z.T., Seilkhanov T.M. Chem.
СПИСОК ЛИТЕРАТУРЫ
Heterocycl. Compd.
2015,
50,
1478-1486.] doi
10.1007/s10593-014-1613-1
1. Venkatesan A.M., Agarwal A., Abe T., Ushirogochi H.,
12.
Cheng Q., Wang Q., Tan T., Chen N., Shuai M.
Ado M., Tsuyoshi T., Dos Santos O., Li Zh., Francis-
J. Heterocycl. Chem.
2012,
49,
1352-1356. doi
co G., Lin Y.I., Petersen P.J., Yang Y., Weiss W.J.,
Shlaes D.M., Mansour T.S. Bioorg. Med. Chem. 2008,
10.102/jhet.978
16, 1890-1902. doi 10.1016/j.bmc.2007.11.006
13.
Гельман Н.Э., Терентьева Е.А., Шанина Т.М., Кипа-
2. Han X., Pin S.S., Burris K., Fung L.K., Huang S.,
ренко Л.М.. Методы количественного органическо-
Taber M.T., Zhang J., Dubowchik G.M. Bioorg.
го элементного анализа. М: Химия. 1987.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ И ПРЕВР
АЩЕНИЯ 9-ЗАМЕЩЕННЫХ ИМИДАЗО[1,2-а]БЕНЗИМИДАЗОЛ-...
1045
Synthesis and Transformation 9-Substituted
Imidazo[1,2-a]benzimidaole-2-carbaldehyde
T. A. Kuz’menko, L. N. Divaeva*, and A. S. Morkovnik
Research Institute of Physical and Organic Chemistry, Southern Federal University,
344090, Russia, Rostov-on-Don, pr. Stachki 194/2
*e-mail: divaevaln@mail.ru
Received March 18, 2020; revised April 16, 2020; accepted April 20, 2020
By heating a solution of 2-dibromethyl-9-methyl-3-ethoxycarbonyl-9H-imidazo[1,2-a]benzimidazole in ethanol
with a high yield 9-methyl-3-ethoxycarbonyl-9H-imidazo[1,2-a]benzimidazole-2-carbaldehyde was obtained for
the first time, the acid hydrolysis of which leads to the less available 9-methylimidazobenzimidazole-2-carbalde-
hyde. 3-Ethoxycarbonyl-2-formilimidazobenzimidazole in interaction with hydrazine hydrate cyclizes with the
closure of the oxopyridazine cycle and as a typical aldehyde reacts with aromatic methylketones, hydroxylamine,
malononitrile, enters a three-component condensation by the Bijinelli reaction.
Keywords: 3-ethoxycarbonyl-9-methyl-9H-imidazo[1,2-a]benzimidazole-2-carbaldehyde, 9-methylimidazo-
[1,2-a]benzimidazole-2-carbaldehyde, 6-methyl-2H-benzo[4',5']imidazo[1',2':1,2]imidazo[4,5-d]pyridaz-
in-1(6H)-one, 3-ethoxycarbonyl-9-methyl-9H-imidazo[1,2-a]benzimidazole-2-carbonitrile, Bijinelli reaction
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020