ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1046-1054
УДК 547.745
СИНТЕЗ СПИРО[ПИРРОЛ-ПИРРОЛИЗИДИНОВ]
1,3-ДИПОЛЯРНЫМ ЦИКЛОПРИСОЕДИНЕНИЕМ
АЗОМЕТИНИЛИДОВ К 3-ИЛИДЕНПИРРОЛ-2-ОНАМ
© 2020 г. А. А. Мороз, М. В. Дмитриев, А. Н. Масливец*
ФГБОУ ВО «Пермский государственный национальный исследовательский университет»,
614990, Россия, г. Пермь, ул. Букирева 15
*e-mail: koh2@psu.ru
Поступила в редакцию 27 февраля 2020 г.
После доработки 14 апреля 2020 г.
Принята к публикации 15 апреля 2020 г.
Конденсацией Кневенагеля 1H-пиррол-2,3-дионов с малононитрилом синтезированы 3-илиденпир-
рол-2-оны. 1,3-Диполярное циклоприсоединение азометинилидов, генерируемых in situ из арилкарбаль-
дегидов и пролина или саркозина, к экзоциклической двойной связи 3-илиденпиррол-2-онов приводит
к образованию региоизомерных спиро[пиррол-3,2'-пирролизинов], спиро[пиррол-3,1'-пирролизинов] и
диазоспиро[4.4]нонана.
Ключевые слова: поликарбонильные соединения, 1Н-пиррол-2,3-дионы, диполярное циклоприсоеди-
нение, азометинилиды, спиропирролизины, спиропирролидины.
DOI: 10.31857/S0514749220070071
Структурные фрагменты пирролидинов и пир-
продукты конденсации Кневенагеля альдегидов
ролизидинов широко распространены в природе и
или кетонов с производными малоновой кислоты
встречаются в составе многочисленных биологи-
[10, 13, 14]. Описана трехкомпонентная реакция
чески активных соединений [1, 2] и алкалоидов,
азометинилидов с 2-оксо-3Н-индол-3-илиденма-
например, спиротрипростатина А [3], использу-
лононитрилом, в результате которой образуются
ющегося в качестве основы противораковых пре-
спиропирролидин-оксиндолы и спиропирроли-
паратов, элакомина [4] и хорсфилина [5], облада-
зидин-оксиндолы [15]. В настоящей работе в ка-
ющих анальгетической активностью, азаспирена
честве диполярофилов использованы продукты
[6], казуарина [7], природного алкалоида, являю-
конденсации Кневенагеля 1Н-пиррол-2,3-дионов
щегося эффективным ингибитором глюкозидазы I
с малононитрилом - 3-илиденпиррол-2-оны, реак-
и применяемого в терапии сахарного диабета 2-го
ции 1,3-диполярного циклоприсоединения кото-
типа (рис. 1).
рых не изучены.
Некоторые синтетические спиро-пирролидины
Конденсацией
5-фенил-4-этоксикарбонил-1H-
являются перспективными антилейкемическими и
пиррол-2,3-дионов 1a, b с малононитрилом в
противосудорожными агентами [8, 9].
соотношении 1:1 при кипячении в безводном
Известен метод синтеза пирролидинов реакци-
ацетонитриле в течение 2 ч в присутствии триэтил-
ей диполярного циклоприсоединения азометини-
амина получены замещенные 3-илиденпиррол-2-
лидов, генерируемых из α-аминокислот и арома-
оны - этил 1-алкил-4-(дицианометилен)-5-оксо-
тических альдегидов [10-12]. В качестве диполя-
2-фенил-4,5-дигидро-1H-пиррол-3-карбоксилаты
рофилов в данной реакции могут использоваться
2a, b.
1046
СИНТЕЗ СПИРО[ПИРРОЛ-ПИРРОЛИЗИДИНОВ] 1,3-ДИПОЛЯРНЫМ ЦИКЛОПРИСОЕДИНЕНИЕМ 1047
MeO
O
NH
O
H
Et
O
N
NH
HN
N
O
Bn
N
OH
H
HO
O
H
O OH
O
Спиротрипростатин А
Элакомин
Азаспирен
OH
N
HO H
HO
OH
N
O
N
H
HO
Хорсфилин
Казуарин
Рис. 1. Алкалоиды, содержащие фрагменты пирролидинов и пирролизидинов.
При взаимодействии
3-илиденпиррол-2-онов
водном ацетонитриле в течение 1-2 ч (контроль
2a, b с азометинилидами, генерируемыми in situ
методами ТСХ и ВЭЖХ-МС) образуются регио-
из L-пролина и ароматических альдегидов 3a-c, в
изомерные спиро[пиррол-3,2'-пирролизины] 4a-d
соотношении 1:1 при кипячении реагентов в без-
и спиро[пиррол-3,1'-пирролизины] 5a-d (схема 1).
Схема 1.
1a, b
4a-d
5a-d
2a, b
3a-c
6
1, 2, R = Bn (a), Me (b); 3, R1 = R2 =Н (а); R1 = Br, R2 =Н (b); R1 = R2 = OMe (c);
4, 5, R = Bn; R1 = R2 = H (a); R = Bn; R1 = R2 = OMe (b); R = Me; R1 = Br; R2 = H (c);
R = Bn; R1 = Br; R2 = H (d).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1048
МОРОЗ и др.
С помощью колоночной хроматографии на сили-
а также два дублета неэквивалентных протонов
кагеле разделены все региоизомерные пары. При
метиленовой группы в пирролидиновом цикле
использовании саркозина вместо L-пролина в ана-
(3.78 и 4.13 м.д.).
логичных условиях удалось выделить в индивиду-
В спектрах ЯМР 13C соединений 4-6 присут-
альном виде только основной региоизомер - диа-
ствуют характерные сигналы сложноэфирной
зоспиро[4.4]нонен 6.
(162.2-163.3 м.д.) и лактамной (172.5-174.9 м.д.)
Соединения 4-6 - бесцветные кристаллические
карбонильных групп.
вещества, легкорастворимые в ДМСО, хлорофор-
Для однозначного установления относитель-
ме и ацетоне, нерастворимые в алканах и воде.
ной конфигурации хиральных центров в продук-
В спектрах ЯМР 1Н соединений 4 и 5, кроме
тах реакций выполнен РСА соединений 4a, 5a и
сигналов протонов заместителей в положении 1
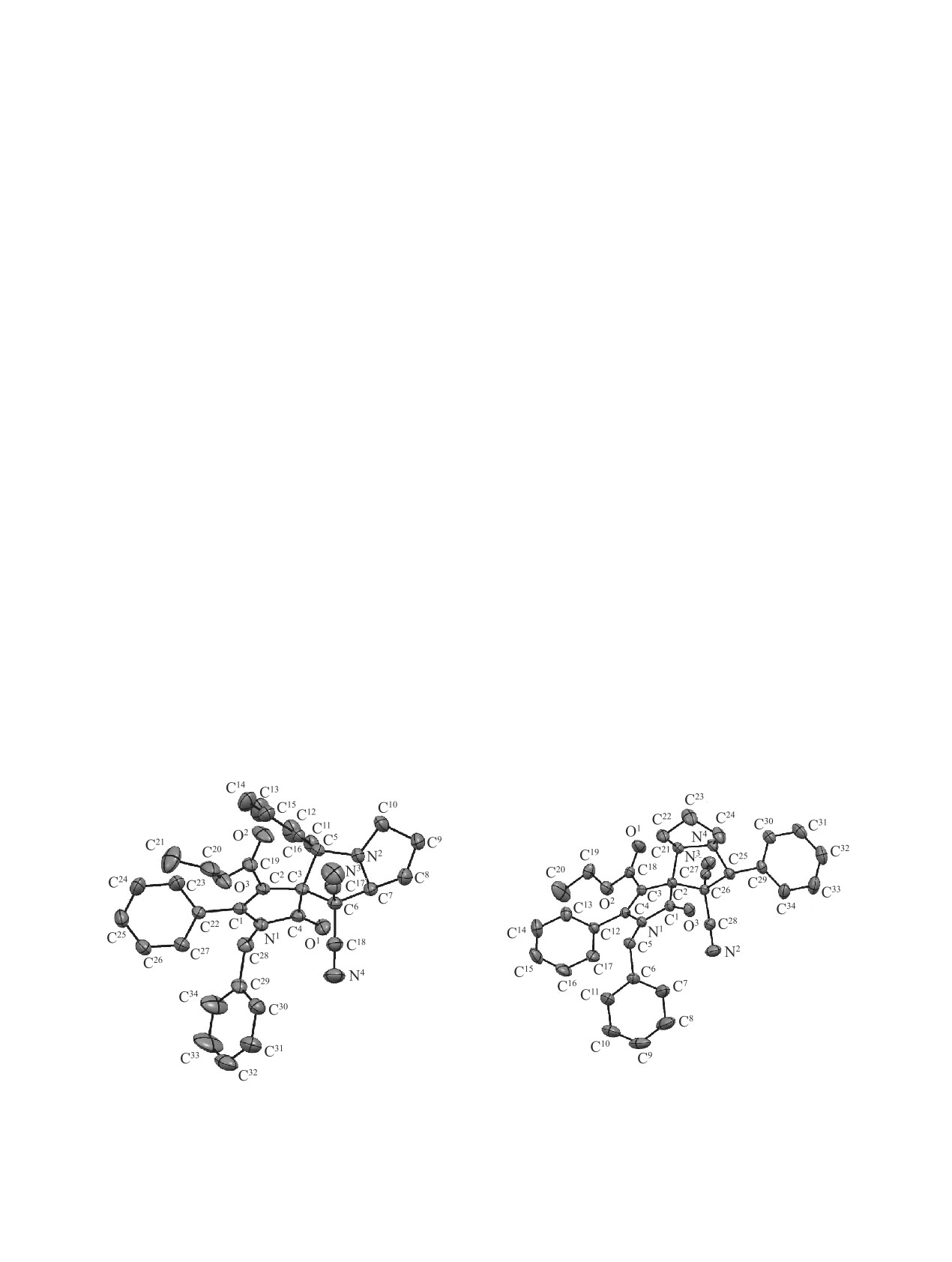
6. Согласно данным РСА соединение 4a (рис. 2)
пиррольного цикла, ароматических колец и свя-
кристаллизуется в центросимметричной про-
занных с ними групп, присутствуют триплет и
странственной группе P-1. Значения длин связей
мультиплет протонов этоксикарбонильной группы
и углов в молекуле находятся в пределах стан-
(0.90-0.98 м.д. и 3.84-4.15 м.д. соответственно),
дартных величин. Пиррол-2-оновый фрагмент
мультиплеты протонов трех метиленовых групп
плоский в пределах 0.05 Å. Пиррольные циклы
пирролидинового цикла (1.68-3.16 м.д.), синглет
C3C5N2C7C6 и C7C8C9C10N2 пирролизидиново-
метинового протона, связанного с арильным за-
го фрагмента находятся в конформации конверт.
местителем (5.32-5.62 м.д.), а также триплет или
Атомы C3 и C9 выведены из плоскости остальных
дублет дублетов метинового протона C7a'H (5.11-
четырех атомов циклов на 0.616 и 0.597 Å соответ-
5.47 м.д.). В спектре ЯМР 1Н соединения 6, кроме
ственно. Торсионный угол, образованный атомами
сигналов протонов ароматических колец, присут-
C6C7N2C10, составляет 122.7(2)°. Этильный фраг-
ствуют триплет и мультиплет протонов этоксикар-
мент этоксикарбонильной группы C20-C21 и атом
бонильной группы (0.89 м.д. и 3.92-4.10 м.д. со-
С9 пиррольного цикла C7C8C9C10N2 испытывают
ответственно), два дублета неэквивалентных про-
разупорядочение по двум позициям с равной засе-
тонов метиленовой группы бензильного замести-
ленностью (для удобства восприятия на рис. 2 ми-
теля (3.92 и 4.46 м.д.), синглет метильной группы
норные компоненты не показаны). Соединения 5a
(2.41 м.д.), синглет метинового протона (4.63 м.д.),
(рис. 3) и 6 (рис. 4) кристаллизуются в центросим-
Рис. 2. Молекулярная структура соединения 4a в пред-
Рис. 3. Молекулярная структура соединения 5a в пред-
ставлении неводородных атомов эллипсоидами тепло-
ставлении неводородных атомов эллипсоидами тепло-
вых колебаний с 30% вероятностью.
вых колебаний с 30% вероятностью.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
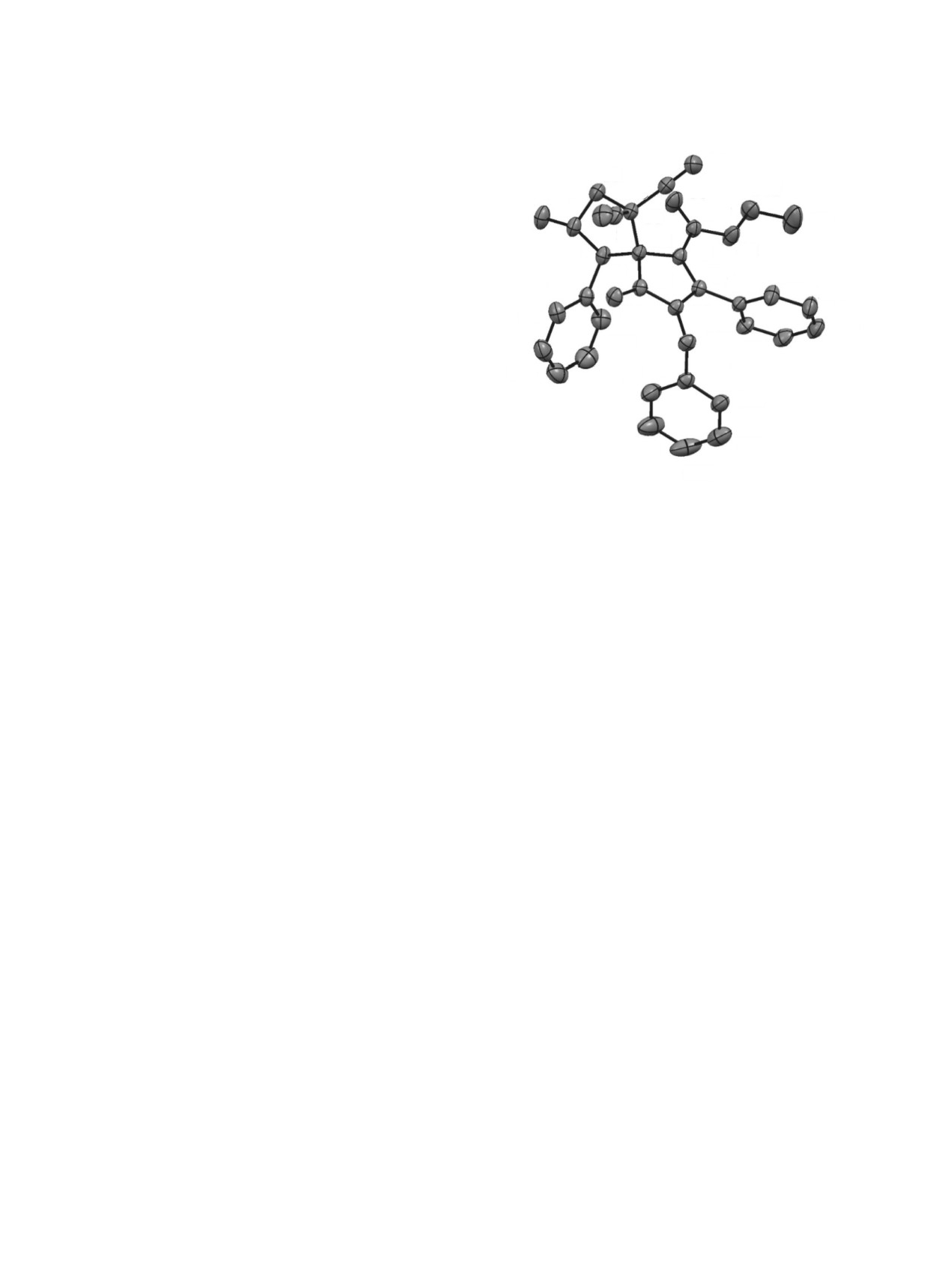
СИНТЕЗ СПИРО[ПИРРОЛ-ПИРРОЛИЗИДИНОВ] 1,3-ДИПОЛЯРНЫМ ЦИКЛОПРИСОЕДИНЕНИЕМ 1049
метричной пространственной группе моноклин-
N3
ной сингонии. Геометрия молекул соединений 5a
C15
C6
и 6 близка к таковой для соединения 4a.
C16
O3
C18
14
C
17
C
C5
C19
Образование соединений
4-6 происходит
N2
C2
вследствие 1,3-диполярного [3+2]-циклоприсое-
N4
C3
O2
C7
динения азометинилидов, генерируемых in situ по-
C1
C4
C25
средством конденсации L-пролина или саркозина
C8
C20
C24
с арилкарбальдегидом, сопровождающейся после-
C9
O1
N1
дующим декарбоксилированием, к экзоцикличе-
C23
C13
C10
C26
ской двойной связи 3-илиденпиррол-2-онов 2. На
C21
C22
схеме 2 изображен предполагаемый механизм ре-
C12
C27
C28
акции на примере образования соединений 4 и 5.
C11
32
C
В ходе реакции циклоприсоединения в про-
дуктах 4 и 5 возникают 3 стереогенных центра,
C29
C31
что делает возможным существование 4 диасте-
C30
реомеров. В условиях реакции образуется только
Рис. 4. Молекулярная структура соединения 6 в пред-
анти-изомер азометинилида 7, что согласуется с
ставлении неводородных атомов эллипсоидами тепло-
литературными данными [16, 17]. По-видимому,
вых колебаний с 30% вероятностью.
вследствие стерических факторов и вторичных
орбитальных взаимодействий при образовании
рованных соединений подтверждена методом ТСХ
региоизомеров
4 реализуется преимуществен-
на пластинках Merck Silica gel 60 F254, элюенты -
но экзо-переходное состояние, при образовании
толуол-этилацетат,
5:1, этилацетат, проявляли
региоизомеров 5 - эндо. В связи с вышесказанным
парами йода и УФ излучением 254 нм. Оптимиза-
из 4 возможных пар энантиомеров в реакции обра-
ция условий реакций проведена методом ВЭЖХ-
зуется преимущественно одна пара энантиомеров
МС на приборе Waters ACQUITY UPLC I-Class
для каждого из региоизомерных продуктов 4 и 5.
(колонка Acquity UPLC BEH C18 1.7 мкм, под-
Стоит отметить, что образование в незначитель-
вижная фаза - ацетонитрил-вода, скорость потока
ных количествах альтернативных диастереомеров
0.6 мл/мин, УФ детектор PDA eλ Detector, масс-
соединений 4 и 5 в реакционной смеси регистри-
спектрометрический детектор Xevo TQD). Для ко-
ровалось методами ВЭЖХ-МС и ЯМР.
лоночной хроматографии применяли Silicagel 60
Описанная реакция - пример получения труд-
(Acros Organics, 0.06-0.2 мм). Исходные пиррол-
нодоступных замещенных спиро-пирролизидинов
дионы 1 синтезировали взаимодействием соответ-
и спиро-пирролидинов (диазоспиро[4.4]ноненов),
ствующих енаминов с оксалилхлоридом по ранее
структурные фрагменты которых встречаются в
описанной методике [18].
целом ряде природных и синтетических соедине-
Рентгеноструктурное исследование соединений
ний, обладающих различной биологической ак-
4a, 5а и 6 выполнено на дифрактометре Xcalibur
тивностью.
Ruby (Agilent Technologies) по стандартной мето-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
дике (MoKα-излучение, Т 295(2) K, ω-сканирова-
ИК спектры полученных соединений записа-
ние c шагом 1°) с использованием пакета программ
ны на спектрофотометре Perkin Elmer Spectrum
CrysAlisPro [19]. Поглощение учтено эмпирически
Two в виде пасты в вазелиновом масле. Спектры
c использованием алгоритма SCALE3 ABSPACK
ЯМР 1Н и 13С записаны на спектрометре Bruker
[19]. Структуры расшифрованы прямым методом
AVANCE III HD 400 [рабочая частота 400 (1Н) и
по программе SHELXS-97 [20] и уточнены с по-
100 (13С) МГц] в CDCl3, внутренний стандарт -
мощью программы SHELXL [21] с графическим
ГМДС. Элементный анализ выполнен на анализа-
интерфейсом OLEX2 [22] по F2 в анизотропном
торе Vario Micro cube. Индивидуальность синтези-
приближении для неводородных атомов (ато-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1050
МОРОЗ и др.
Схема 2.
R2
R1
R1
R2
H
N
NC
N
NC
NC
H
N
R1
EtOOC
NC
O
EtOOC
H
R2
N
Ph
O
CHO
N
R
Ph
R
4
CO2H
5
+
N
H
R2
R1
-CO2
H
H
-H2O
R2
N
N
R2
H
R1
R1
N
NC
O
COOEt
Ph
N R
NC
NC
R1
N
O
NC
R
Ph
R2
O
7
OEt
экзо
+
эндо
CN
O
H
H
N
R2
R2
NC
N
N
R
1
R
R1
O
EtOOC
NC
R
Ph
EtOOC
N
NC
2
Ph
NC
Ph
NC
N
EtOOC
O R
эндо
экзо
мы водорода включены в уточнение в модели
из этанола. Выход 70%, т.пл. 100-102°С (этанол).
наездника). Результаты РСА зарегистрированы
ИК спектр, ν, см-1: 2218 (CN), 1733, 1705 (C=O).
в Кембриджском центре кристаллографических
Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д. (J, Гц):
данных под номерами CCDC 1883708 (4a), CCDC
1.08 т (3H, CH3CH2, J 7.2) 4.14 к (2Н, CH3CH2, J
1883709 (5a), CCDC 1883710 (6) и могут быть за-
7.1), 4.71 с (2H, CH2Ph), 6.83-6.87 м (2Наром), 7.19-
7.27 м (5Наром), 7.45-7.50 м (2Наром), 7.55-7.61 м
(1Наром). Спектр ЯМР 13C, δ, м.д.: 13.8 (CH3CH2),
Этил 1-бензил-4-(дицианометилен)-5-оксо-2-
фенил-4,5-дигидро-1H-пиррол-3-карбоксилат
45.6 (CH2Ph), 61.4 (CH3CH2), 83.0, 106.6, 112.3,
(2а). К раствору 3 ммоль 1H-пиррол-2,3-диона
112.4, 127.4, 127.8 (2С), 128.5 (3C), 128.8 (2С),
(1а) и 3 ммоль малононитрила в безводном аце-
129.0 (2С), 132.0, 134.9, 144.9, 160.7, 164.9, 166.0.
тонитриле добавляли 0.3 ммоль триэтиламина,
Масс-спектр, m/z: 384 [М + H]+. Найдено, %: C
смесь кипятили в течение 2 ч. Растворитель упа-
72.01; H 4.55; N 11.03. C23H17N3O3. Вычислено, %:
ривали в вакууме, остаток перекристаллизовывали
C 72.05; H 4.47; N 10.96. М + H 384.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ СПИРО[ПИРРОЛ-ПИРРОЛИЗИДИНОВ] 1,3-ДИПОЛЯРНЫМ ЦИКЛОПРИСОЕДИНЕНИЕМ 1051
Соединение 2b синтезировано аналогично.
единения 5a - 21%, т.пл. 148-150°С (этанол), Rf
0.46 (толуол-этилацетат, 20:1). Спектр ЯМР 1Н
Этил 4-(дицианометилен)-1-метил-5-оксо-2-
(400 МГц, CDCl3), δ, м.д. (J, Гц): 0.90 т (3H,
фенил-4,5-дигидро-1H-пиррол-3-карбоксилат
CH3CH2, J 7.1), 1.70-2.23 м (4H, C6'H2 + C7'H2),
(2b). Выход 60%, т.пл. 89-90°С (этанол). Спектр
2.84 т.д (1H, C5'H2, J 9.1, 6.3), 3.03 д.д.д (1H, C5'H2,
ЯМР 1Н (400 МГц, CDCl3), δ, м.д. (J, Гц): 1.12 т
J 10.0, 6.6, 3.7), 3.88-4.04 м (2Н, CH3CH2), 4.55 д
(3H, CH3CH2, J 7.1), 3.06 с (3H, CH3), 4.17 к (2Н,
(1H, CH2Ph, J 15.3), 4.66 д (1H, CH2Ph, J 15.3), 5.40-
CH3CH2, J 7.1), 7.40-7.44 м (2Наром), 7.53-7.65 м
5.44 м (2Н, C3'H + C7a'H), 6.89-6.91 м (2Наром), 7.13
(3Наром). Спектр ЯМР 13C, δ, м.д.: 13.9 (CH3CH2),
д (2Hаром, J 7.2), 7.17-7.23 м (3Наром), 7.34-7.47 м
28.9, 61.4 (CH3CH2), 82.7, 106.0, 112.3, 112.4, 127.3,
(6Наром), 7.73 д.д (2Наром, J 7.9, 1.6). Масс-спектр,
128.6 (2C), 129.0 (2C), 132.3, 145.1, 160.8, 164.7,
m/z: 543 [М + H]+. Найдено, %: C 75.08; H 5.42; N
166.1. Масс-спектр, m/z: 308 [М + H]+. Найдено, %:
10.19. C34H30N4O3. Вычислено, %: C 75.26; H 5.57;
C 66.62; H 4.37; N 13.81. C17H13N3O3. Вычислено,
N 10.33. М + H 543.
%: C 66.44; H 4.26; N 13.67. М + H 308.
Для рентгеноструктурного анализа соедине-
Этил
(3R*,3'S*,7a'S*)-1-бензил-2-оксо-3',5-
ния 4a использован обломок бесцветного кри-
дифенил-1',1'-дициано-1,2,5',6',7',7a'-гекса-
сталла размером 0.57×0.45×0.41 мм. Кристаллы
гидро-1'H,3'H-спиро[пиррол-3,2'-пирроли-
соединения (C34H30N4O3, M
542.62) триклин-
зин]-4-карбоксилат (4а) и этил (3S*,3'R*,7a'R*)-
ные, пространственная группа P-1, при 295(2) K:
1-бензил-2-оксо-3',5-дифенил-2',2'-дициано-
a
9.9446(3), b
11.498(2), c
14.4261(18) Å, α
1,2,2',3',5',6',7',7a'-октагидроспиро[пиррол-
91.935(13), β
107.794(14), γ
109.981(17)°; V
3,1'-пирролизин]-4-карбоксилат (5a). В 10 мл
1458.3(5)Å3, Z 2. Окончательные параметры уточ-
безводного ацетонитрила растворяли 1.0 ммоль
нения: R1 0.0563, wR2 0.1401 [для 11586 отраже-
L-пролина, 1.0 ммоль арилкарбальдегида 3a и
ний с I > 2σ(I)], R1 0.0886, wR2 0.1652 (для всех
1.0 ммоль 3-илиденпиррол-2-она 2a, раствор кипя-
11586 независимых отражений), S 1.029.
тили в течение 2 ч (контроль методами ТСХ и
ВЭЖХ-МС). Растворитель упаривали в вакууме,
Для рентгеноструктурного анализа соединения
остаток разделяли с помощью колоночной хрома-
5a использован обломок бесцветного кристал-
тографии на силикагеле, элюент - толуол-этил-
ла размером 0.5×0.35×0.22 мм. Кристаллы сое-
ацетат (25:1). Образовавшийся осадок перекри-
динения (C34H30N4O3, M 542.62) моноклинные,
сталлизовывали из этанола. Выход соедине-
пространственная группа P21/c, при 295(14) K: a
ния 4а - 31%, т.пл. 163-165°С (этанол), Rf 0.56
11.799(2), b 19.212(3), c 14.190(3) Å, β 113.15(2),
(толуол-этилацетат,
20:1). Спектр ЯМР
1Н
V 2957.8(11)Å3, Z 4. Окончательные параметры
(400 МГц, CDCl3), δ, м.д. (J, Гц): 0.94 т (3H,
уточнения: R1 0.0601, wR2 0.1422 [для 12653 отра-
CH3CH2, J 7.1), 2.09-2.40 м (4H, C6'H2 + C7'H2),
жений с I > 2σ(I)], R1 0.0900, wR2 0. 0.1686 (для
2.80-2.88 м (1H, C5'H2), 3.13 д.д.д (1H, C5'H2, J 6.3,
всех 6761 независимых отражений), S 1.026.
5.6, 3.2), 3.97-4.12 м (2Н, CH3CH2), 4.00 д (1H,
Соединения 4b-d, 5b-d, 6 и 7 синтезированы
CH2Ph, J 15.5), 4.42 д (1H, CH2Ph, J 15.6), 5.18 т
аналогично.
(1H, C7a'H, J 6.5), 5.62 c (1Н, C3'H), 6.14-6.16 м
(2Наром), 6.79-6.97 м (4Наром), 7.03-7.08 м (1Наром),
Этил
(3R*,3'S*,7a'S*)-1-бензил-3'-(3,4-диме-
7.21-7.38 м (6Наром), 7.56-7.60 м (2Наром). Спектр
токсифенил)-2-оксо-5-фенил-1',1'-дициано-
ЯМР 13C, δ, м.д.: 13.6 (CH3CH2), 27.3, 29.0, 44.6
1,2,5',6',7',7a'-гексагидро-1'H,3'H-спиро[пир-
(CH2Ph), 45.6, 54.2, 60.7 (CH3CH2), 69.6, 70.8, 71.1,
рол-3,2'-пирролизин]-4-карбоксилат
(4b) и
104.0, 112.1, 113.5, 126.9 (2C), 127.2, 127.7 (2C),
этил
(3S*,3'R*,7a'R*)-1-бензил-3'-(3,4-диме-
128.1 (2С), 128.4 (2С), 128.4 (2С), 128.5 (2C), 128.5,
токсифенил)-2-оксо-5-фенил-2',2'-дициано-
129.3, 129.8, 135.4, 136.6, 158.3, 163.2 (СОО), 173.0
1,2,2',3',5',6',7',7a'-октагидроспиро[пиррол-3,1'-
(C2=O). Масс-спектр, m/z: 543 [М + H]+. Найдено, %:
пирролизин]-4-карбоксилат
(5b). Выход сое-
C 75.06; H 5.49; N 10.21. C34H30N4O3. Вычислено,
динения 4b - 27%, т.пл. 160-162°С (этанол). ИК
%: C 75.26; H 5.57; N 10.33. М + H 543. Выход со-
спектр, ν, см-1: 2244 (CN), 1729,
1700 (C=O).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1052
МОРОЗ и др.
Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д. (J, Гц):
2.50 с (3Н, CH3), 2.76-2.82 м (1H, C5'H2), 3.05-3.12
0.93 т (3H, CH3CH2, J 7.1), 2.11-2.42 м (4H,
м (1H, C5'H2), 3.99-4.15 м (2Н, CH3CH2), 5.11 д.д
C6'H2 + C7'H2), 2.80-2.86 м (1H, C5'H2), 3.16 д.т
(1H, C7a'H, J 7.2, 5.7), 5.51 с (1H, C3'H), 7.08-7.13
(1H, C5'H2, J 10.9, 5.4), 3.80 c (3H, OCH3), 3.91 с
м (2Наром), 7.40-7.50 м (7Наром). Спектр ЯМР 13C,
(3H, OCH3), 3.94-4.11 м (3H, CH2Ph + CH3CH2),
δ, м.д.: 13.7 (CH3CH2), 27.3, 28.0, 29.0, 45.4, 54.2,
4.48 д (1H, CH2Ph, J 15.5), 5.17 д.д (1Н, C7a'H, J
60.8 (CH3CH2), 69.1, 70.8, 71.1, 103.2, 111.9, 113.2,
7.1, 5.7), 5.55 с (1Н, C3'H), 6.20-6.23 м (2Наром),
122.5, 128.4 (2С), 128.7 (2С), 129.2 (2С), 129.3,
6.79-6.88 м (3Наром), 6.95-7.10 м (4Наром), 7.22-
130.4 (2С), 131.4, 135.7, 158.4, 162.2 (СОО), 172.9
7.26 м (3Наром), 7.36 т.т (1Hаром, J 7.5, 1.3). Спектр
(C2=O). Масс-спектр, m/z: 545 [М + H]+. Найдено,
ЯМР 13C, δ, м.д.: 13.7 (CH3CH2), 27.1, 29.2, 44.7
%: C 61.80; H 4.83; N 10.15. C28H25BrN4O3.
(CH2Ph), 45.4, 54.2, 56.1 (OCH3), 56.1 (OCH3),
Вычислено, %: C 61.66; H 4.62; N 10.27. М + H
60.7 (CH3CH2), 69.6, 70.6, 70.9, 104.0, 111.0, 111.1,
545. Выход соединения 5c - 24%, т.пл. 176-177°С
112.0, 113.4, 120.1, 126.8 (2С), 127.5, 128.1 (2С),
(этанол). Спектр ЯМР 1Н (400 МГц, CDCl3), δ,
128.3 (2С), 128.5 (3С), 129.3, 129.9, 135.3, 149.2,
м.д. (J, Гц): 0.94 т (3H, CH3CH2, J 7.1), 1.68-2.23
149.4, 158.4, 163.2 (СОО), 173.1 (C2=O). Масс-
м (4H, C6'H2 + C7'H2), 2.77-2.84 м (1H, C5'H2), 2.91
спектр, m/z: 603 [М + H]+. Найдено, %: C 71.58; H
с (3Н, CH3), 2.99 д.д.д (1Н, C5'H2, J 9.5, 6.7, 3.8),
5.63; N 9.13. C36H34N4O5. Вычислено, %: C 71.74;
3.90-4.11 м (2Н, CH3CH2), 5.32 с (1H, C3'H), 5.39 т
H 5.69; N 9.30. М + H 603. Выход соединения
(1H, C7'H2, J 7.7), 7.33-7.36 м (2Наром), 7.43-7.61 м
5b - 19%, т.пл. 145-146°С (этанол). 2247 (CN), 1720,
(7Наром). Спектр ЯМР 13C, δ, м.д.: 13.6 (CH3CH2),
1694 (C=O). Спектр ЯМР 1Н (400 МГц, CDCl3), δ,
27.7, 28.3, 29.0, 29.9, 52.7, 52.9, 60.7 (CH3CH2),
м.д. (J, Гц): 0.90 т (3H, CH3CH2, J 7.1), 1.70-2.24
65.5, 65.6, 71.8, 105.0, 111.1, 112.6, 123.8, 128.7
м (4H, C6'H2 + C7'H2), 2.85 д.д.д (1H, C5'H2, J 9.7,
(4С), 129.4, 129.9 (2С), 130.4, 132.2 (2С), 157.7,
8.6, 6.2), 3.06 д.д.д (1H, C5'H2, J 10.3, 6.7, 4.3),
162.4 (СОО), 174.7 (C2=O). Масс-спектр, m/z: 545
3.84-4.05 м (2Н, CH3CH2), 3.91 с (3Н, OCH3), 3.95
[М + H]+. Найдено, %: C 61.39; H 4.45; N 10.11.
с (3Н, OCH3), 4.56 д (1H, CH2Ph, J 15.3), 4.65 д (1H,
C28H25BrN4O3. Вычислено, %: C 61.66; H 4.62; N
CH2Ph, J 15.4), 5.39 с (1Н, C3'H) 5.47 т (1Н, C7a'H,
10.27. М + H 545.
J 7.6), 6.87-6.95 м (3Наром), 7.11-7.27 м (6Наром),
Этил
(3R*,3'S*,7a'S*)-1-бензил-3'-(4-бром-
7.32-7.40 м (3Наром), 7.43-7.47 м (1Наром). Спектр
фенил)-2-оксо-5-фенил-1',1'-дициано-1,2,5',-
ЯМР 13C, δ, м.д.: 13.6 (CH3CH2), 27.7, 28.7, 45.2
6',7',7a'-гексагидро-1'H,3'H-спиро[пиррол-
(CH2Ph), 52.7, 53.0, 56.1 (OCH3), 56.3 (OCH3), 60.8
3,2'-пирролизин]-4-карбоксилат
(4d) и этил
(CH3CH2), 65.0, 65.9, 72.7, 106.0, 111.3, 111.4, 112.9,
(3S*,3'R*,7a'R*)-1-бензил-3'-(4-бромфенил)-2-
121.0, 126.8, 127.7 (2С), 128.0 (2С), 128.4 (2С),
оксо-5-фенил-2',2'-дициано-1,2,2',3',5',6',7',7a'-
128.7 (2С), 129.0 (2C), 129.3, 130.2, 135.7, 149.5,
октагидроспиро[пиррол-3,1'-пирролизин]-4-
150.3, 156.9, 162.6 (СОО), 174.9 (C2=O). Масс-
карбоксилат
(5d). Выход соединения
4d
-
спектр: m/z 603 [М + H]+. Найдено, %: C 71.87; H
28%, т.пл. 174-175°С (этанол). Спектр ЯМР 1Н
5.78; N 9.44. C36H34N4O5. Вычислено, %: C 71.74;
(400 МГц, CDCl3), δ, м.д. (J, Гц): 0.90 т (3H,
H 5.69; N 9.30. М + H 603.
CH3CH2, J 7.1), 1.69-2.24 м (4Н, C6'H2 + C7'H2),
Этил (3R*,3'S*,7a'S*)-3'-(4-бромфенил)-1-ме-
2.81 т.д (1Н, C5'H2, J 9.1, 6.1), 3.02 д.д.д (1Н, C5'H2,
тил-2-оксо-5-фенил-1',1'-дициано-1,2,5',6',-
J 9.4, 6.8, 3.8), 3.89-4.05 м (2Н, CH3CH2), 4.56 д
7',7a'-гексагидро-1'H,3'H-спиро[пиррол-
(1Н, CH2Ph, J 15.4), 4.64 д (1Н, CH2Ph, J 15.2), 5.40
3,2'-пирролизин]-4-карбоксилат
(4c) и этил
с (1Н, C3'H), 5.43 т (1H, C7a'H, J 7.7), 6.86-6.92 м
(3S*,3'R*,7a'R*)-3'-(4-бромфенил)-1-метил-2-
(2Наром), 7.11-7.23 м (5Наром), 7.33-7.48 м (3Наром),
оксо-5-фенил-2',2'-дициано-1,2,2',3',5',6',7',7a'-
7.56-7.65 м (4Наром). Спектр ЯМР 13C, δ, м.д.: 13.6
октагидроспиро[пиррол-3,1'-пирролизин]-4-
(CH3CH2), 27.5, 28.9, 45.2 (CH2Ph), 52.3, 52.9, 60.8
карбоксилат
(5c). Выход соединения
4c
-
(CH3CH2), 65.0, 66.0, 72.1, 105.6, 111.0, 112.6, 123.9,
32%, т.пл. 127-130°С (этанол). Спектр ЯМР 1Н
127.7 (2С), 128.0, 128.4 (2С), 128.7 (2С), 128.9 (2C),
(400 МГц, CDCl3), δ, м.д. (J, Гц): 0.98 т (3H,
129.2, 129.9 (2С), 130.2, 132.2 (2С), 134.1, 135.6,
CH3CH2, J 7.1), 2.02-2.36 м (4H, C6'H2 + C7'H2),
157.2, 162.5 (СОО), 174.8 (C2=O). Масс-спектр, m/z:
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ СПИРО[ПИРРОЛ-ПИРРОЛИЗИДИНОВ] 1,3-ДИПОЛЯРНЫМ ЦИКЛОПРИСОЕДИНЕНИЕМ 1053
621 [М + H]+. Найдено, %: C 65.54; H 4.83; N 8.86.
КОНФЛИКТ ИНТЕРЕСОВ
C34H29BrN4O3. Вычислено, %: C 65.70; H 4.70; N
Авторы заявляют об отсутствии конфликта ин-
9.01. М + H 621. Выход соединения 5d - 23%, т.пл.
тересов.
161-163°С (этанол). Спектр ЯМР 1Н (400 МГц,
CDCl3), δ, м.д. (J, Гц): 0.91 (3H, CH3CH2, J 7.1),
СПИСОК ЛИТЕРАТУРЫ
1.70-2.23 м (4H, C6'H2 + C7'H2), 2.80-2.87 м (1H,
1.
El-Shazly A., Wink M. Diversity. 2014, 6, 188-282.
C5'H2), 3.03-3.07 м (1H, С5'H2), 3.90-4.10 м (2Н,
doi 10.3390/d6020188
CH3CH2), 4.56 д (1H, CH2Ph, J 15.3), 4.64 д (1H,
2.
Robertson J., Stevens K. Nat. Prod. Rep. 2014, 31,
CH2Ph, J 15.3), 5.42 с (1H, C3'H), 5.47 т (1H, C7a'H,
1721-1788. doi 10.1039/C4NP00055B
J 7.7), 6.87-6.90 м (2Наром), 7.07-7.22 м (3Наром),
3.
Puerto Galvis C.E., Kouznetsov V.V. Org. Biomol.
7.32-7.36 м (2Наром), 7.42-7.63 м (7Наром). Масс-
Chem. 2013, 11, 7372-7386. doi 10.1039/C3OB41302K
спектр, m/z: 621 [М + H]+. Найдено, %: C 65.52;
4.
Prado E.G., Gimenez M.G., De la Puerta Vázquez R.,
H 4.59; N 8.92. C34H29BrN4O3. Вычислено, %: C
Sánchez J.E., Rodriguez M.S. Phytomedicine. 2007,
65.70; H 4.70; N 9.01. М + H 621.
14, 280-284. doi 10.1016/j.phymed.2006.12.023
Этил (5R*,6S*)-2-бензил-7-метил-1-оксо-3,6-
5.
James M.N.G., Williams G.J.B. Can. J. Chem. 1972,
дифенил-9,9-дициано-2,7-диазаспиро[4.4]нон-
50, 2407-2412. doi 10.1139/v72-386
3-ен-4-карбоксилат (6). Выход 28%, т.пл. 154-
6.
Caruano J., Mucciolib G.G., Robiette R. Org.
155°С (этанол). Спектр ЯМР 1Н (400 МГц, CDCl3),
Biomol. Chem. 2016, 14, 10134-10156. doi 10.1039/
δ, м.д. (J, Гц): 0.89 т (3H, CH3CH2, J 7.1), 2.41 с
C6OB01349J
(3Н, СН3), 3.78 д (1Н, C8H2, J 9.2), 3.92 д (1Н,
CH2Ph, J 15.9) 3.92-4.10 м (2Н, CH3CH2), 4.13 д
7.
Nash R.J., Watson A.A., Asano N. Alkaloids: Chemical
(1Н, C8H2, J 9.2), 4.46 д (1Н, CH2Ph, J 15.4), 4.63 с
and Biological Perspectives. Ed. S.W. Pelletier.
(1Н, C6H), 6.10-6.12 м (2Наром), 6.80-7.10 (5Hаром),
Oxford: Pegamon. 1996, 11, 345-376. doi 10.1016/
7.24-7.42 м (8Наром). Спектр ЯМР 13C, δ, м.д.: 13.7
S0735-8210(96)80009-4
(CH3CH2), 39.5, 40.5. 44.8 (CH2Ph), 60.5 (CH3CH2),
8.
Abou-Gharbia M.A., Doukas P.H. Heterocycles. 1979,
65.3, 65.5, 73.6, 106.7, 113.7, 114.5, 127.2 (2С),
12, 637-640. doi 10.3987/R-1979-05-0637
127.3, 128.1 (2С), 128.4 (2С), 128.5 (2C), 128.6 (2С),
9.
Kornet M.J., Thio A.P. J. Med. Chem. 1976, 19, 892-
128.9 (2С), 129.0, 129.5, 129.9, 134.2, 135.6, 159.5,
898. doi 10.1021/jm00229a007
163.3 (СОО), 172.5 (C2=O). Масс-спектр, m/z: 517
10.
Lashgari N., Ziarani G.M. Arkivoc. 2012, 277-320. doi
[М + H]+. Найдено, %: C 74.51; H 5.39; N 10.97.
10.3998/ark.5550190.0013.108
C32H28N4O3. Вычислено, %: C 74.40; H 5.46; N
11.
Gayen B., Banerji A., Dhara K. Synth. Comm. 2016, 46,
10.85. М + H 517.
293-308. doi 10.1080/00397911.2015.1135954
Для рентгеноструктурного анализа соединения
12.
Moshkin V.S., Sosnovskikh V.Y., Röschenthaler G.V.
6 использован обломок бесцветного кристалла раз-
Tetrahedron.
2013,
69,
5884-5892. doi
10.1016/
мером 0.28×0.21×0.07 мм. Кристаллы соединения
j.tet.2013.05.018
(C32H28N4O3, M 516.48) моноклинные, простран-
13.
Ghandi M., Rezaei S.J.T., Yari A., Taheri A.
ственная группа P21/c, при 295(2) K: a 14.462(4),
Tetrahedron Lett. 2008, 49, 5899-5901. doi 10.1016/
b
11.035(2), c
18.349(5) Å, β
109.77(3), V
j.tetlet.2008.07.127
2755.7(13) Å3, Z 4. Окончательные параметры
14.
Носачев С.Б., Поддубный О.Ю., Великородов А.В.,
уточнения: R1 0.0626, wR2 0.1461 [для 3349 отра-
Тырков А.Г. ЖОрХ. 2010, 46, 683-686. [Nosa-
жений с I > 2σ(I)], R1 0.1294, wR2 0.1953 (для всех
chev S.B., Poddubnyi O.Yu., Velikorodov A.V., Tyr-
6482 независимых отражений), S 1.019.
kov A.G. Russ. J. Org. Chem. 2010, 46, 674-677.] doi
ФОНДОВАЯ ПОДДЕРЖКА
10.1134/S1070428010050131
Работа выполнена при финансовой поддерж-
15.
Ghandi M., Yari A., Rezaei S.J.T., Taheri A.
ке Российского научного фонда (грант № 19-13-
Tetrahedron Lett. 2009, 50, 4724-4726. doi 10.1016/
00290).
j.tetlet.2009.06.033
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1054
МОРОЗ и др.
16. Coldham I., Hufton R. Chem. Rev. 2005, 105, 2765-
19. CrysAlisPro,
Agilent
Technologies,
Version
2810. doi 10.1021/cr040004c
1.171.36.28.
17. Grigg R., Idle J., McMeekin P., Surendrakumar S.,
20. Sheldrick G.M. Acta Crystallogr, Sect. A. 2008, 64,
Vipond D. J. Chem. Soc., Perkin Trans.
1.
1988,
112-122. doi 10.1107/S0108767307043930
2703-2713. doi 10.1039/P19880002703
21. Sheldrick G.M. Acta Crystallogr, Sect. C. 2015, 71,
18. Силайчев П.С., Дмитриев М.В., Алиев З.Г., Мас-
3-8. doi 10.1107/S2053229614024218
ливец А.Н. ЖОрХ. 2010, 46, 1173-1177. [Silai-
22. Dolomanov O.V., Bourhis L.J., Gildea R.J, Ho-
chev P.S., Dmitriev M.V., Aliev Z.G., Maslivets A.N.
Russ. J. Org. Chem. 2010, 46, 1173-1177.] doi 10.1134/
ward J.A.K., Puschmann H. J. Appl. Cryst. 2009, 42,
S1070428010080105
339-441. doi 10.1107/S0021889808042726
Synthesis of Spiro[pyrrole-pyrrolizidines] by the 1,3-Dipolar
Cycloaddition of Azomethine Ylides to 3-Ylidenpyrrole-2-oned
A. A. Moroz, M. V. Dmitriev, and A. N. Maslivets*
Perm State University, 614990, Russia, Perm, ul. Bukireva 15
*e-mail: koh2@psu.ru
Received February 27, 2020; revised April 14, 2020; accepted April 15, 2020
3-Ylidenepyrrole-2-ones are synthesized by Knoevenagel condensation of 1H-pyrrole-2,3-diones with malono-
nitrile. The 1,3-dipolar cycloaddition of azomethine ylides generated in situ from arylcarbaldehydes and proline
or sarcosine to the exocyclic double bond of 3-ylidenepyrrol-2-ones leads to the formation of regioisomeric
spiro[pyrrole-3,2'-pyrrolizines], spiro[pyrrole-3,1'-pyrrolizines] and diazospiro[4.4]nonane.
Keywords: polycarbonyl compounds, 1H-pyrrole-2,3-diones, dipolar cycloaddition, azomethine ylides, spiro-
pyrrolizines, spiropyrrolodines
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020