ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1055-1063
УДК 547.856.1+547.789.13+547.1.123
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННОГО
2,3-ДИГИДРО-5H-[1,3]ТИАЗОЛО[2,3-b]ХИНАЗОЛИН-
5-OНА МЕТОДОМ ЭЛЕКТРОФИЛЬНОЙ
ВНУТРИМОЛЕКУЛЯРНОЙ ЦИКЛИЗАЦИИ
© 2020 г. Н. М. Кут*, М. Ю. Онисько, В. Г. Лендел
Государственное высшее учебное заведение «Ужгородский национальный университет»,
88000, Украина, г. Ужгород, ул. Фединца 53/1
*e-mail: mykola.kut@uzhnu.edu.ua
Поступила в редакцию 31 марта 2020 г.
После доработки 21 апреля 2020 г.
Принята к публикации 21 апреля 2020 г.
3-(2-Метилпроп-2-ен-1-ил)-2-тиоксо-7-трифторметил-2,3-дигидрохиназолин-4(1H)-oн региоселективно
реагирует с галогенами (бром и йод), тетрагалогенидами халькогенидов и п-метоксифенилтеллуртрихло-
ридом с образованием соответственно гидротригалогенидов 2-галогенометил-2-метил-8-трифтор-
метил-2,3-дигидро-5H-[1,3]тиазоло[2,3-b]хиназолин-5-она, гидрогалогенидов 2-метил-2-[(три-
галогенохалькогено)метил]-8-фторметил-2,3-дигидро-5H-[1,3]тиазоло[2,3-b]хиназолин-5-oна и 2-ме-
тил-2-{[дихлор(4-метоксифенил)теллуро]метил}-8-трифторметил-2,3-дигидро-5H-[1,3]тиазоло[2,3-b]-
хиназолин-5-oна линейного строения.
Ключевые слова: электрофильная циклизация, галогенсодержащий электрофил, п-метоксифенилтел-
луртрихлорид, региоселективность, 3-(2-метилпроп-2-ен-1-ил)-2-тиоксо-7-(трифторметил)-2,3-дигидро-
хиназолин-4(1H)-oн, 2,3-дигидро-5H-[1,3]тиазоло[2,3-b]хиназолин-5-oн.
DOI: 10.31857/S0514749220070083
Функционализированные хиназолины и их кон-
его конденсированных производных - хиназолина
денсированные производные являются перспек-
[19-22], тиено[2,3-d]пиримидина [22-26], пира-
тивными объектами в синтезе биологически актив-
золо[3,4-d]пиримидина
[27-31], пиридо[2,3-d]-
ных соединений. Оксо(тио)замещенные хиназоли-
пиримидина [32], пиридо[3,4-d]пиримидина [33],
ны проявляют противораковые, противовирусные,
пиридо[3,2-d]пиримидина [34]. Поэтому изучение
противогрибковые и антибактериальные свойства
реакций электрофильной циклизации 3-алкениль-
[1-8]. Особое место в ряде хиназолинов занима-
ных производных 2-тиоксохиназолин-4-она под
ют фторпроизводные, поскольку фторсодержащие
действием галогенсодержащих электрофильных
реагентов и определение влияния трифторметиль-
гетероциклические соединения входят в состав
ного заместителя на региоселективность процесса
лекарственных препаратов [9-14]. Эффективным
является актуальной задачей.
методом синтеза конденсированных хиназолино-
вых систем является электрофильная внутримоле-
Объектом исследования был выбран
3-ме-
кулярная гетероциклизация алкенильных произво-
таллил-2-тиоксо-7-трифторметил-2,3-дигидрохи-
дных гетероциклов. С помощью электрофильной
назолин-4(1H)-он (1), полученный с высоким вы-
гетероциклизации разработан удобный и управля-
ходом
(92%) из
4-трифторметилантраниловой
емый метод аннелирования тиазольного или тиа-
кислоты и металлилизотиоцианата в присутствии
зинового циклов к остову пиримидина [15-18] и
триэтиламина (схема 1).
1055
1056
КУТ и др.
Схема 1.
O
O
Me
(C2H5)N
N
OH
+
Me
NCS
F3C
N
S
F3C
NH2
H
1
3-Металлил-2-тиоксо-7-трифторметилхиназо-
генметиленовой и метиленовой групп проявляют-
лин-4-он (1) имеет несколько нуклеофильных цен-
ся в виде 2 дублетов с константой спин-спинового
тров для атаки электрофильных реагентов - крат-
взаимодействия (КССВ) 10 и 13 Гц соответствен-
ную С=С связь алкенильного заместителя, экзо-
но, а в спектрах ЯМР 13С сигналы углерода С-S
циклические атомы кислорода и серы, что пред-
группы - при 161 и 166 м.д., что свидетельствует
полагает возможность 2 направлений в процессе
о циклизации на атоме серы. Данные элементного
электрофильной внутримолекулярной циклиза-
анализа соединений 2, 3 свидетельствуют об об-
ции. Также важным является изучение влияния
разовании
2-(галогенметил)-2-метил-8-(трифтор-
электроноакцепторной трифторметильной группы
метил)-2,3-дигдро-5H-[1,3]тиазоло[2,3-b]хиназо-
на процесс циклизации. В качестве галогенсодер-
лин-5-онов 2, 3 в виде гидротригалогенидов, что
жащих электрофильных реагентов использованы
согласуется с литературными данными [29].
галогены (бром и йод), тетрагалогениды селена и
Использование тетрагалогенидов селена или
теллура, арилтеллуртрихлориды.
теллура в реакции электрофильной циклизации с
Взаимодействие N-металлил-2-тиоксо-7-три-
CF3-замещенным тиоксохиназолоном 1 предпо-
фторметилхиназолин-4-она (1) с двукратным из-
лагает образование потенциально биологически
бытком галогена (бром - 6 ч, йод - 24 ч) в ледя-
активных халькогенфункционализированных кон-
ной уксусной кислоте при комнатной температуре
денсированных хиназолинов. Такие электрофиль-
приводит к региоселективному аннелированию
ные реагенты в реакциях с алкенильными ацикли-
тиазолинового цикла к остову хиназолина с об-
ческими и гетероциклическими соединениями
разованием линейных тиазолохиназолинов 2, 3
могут образовывать как продукты присоединения,
с выходами 86 и 79% соответственно (схема 2).
так и циклизации [35-46], которые проявляют ши-
Образование тиазолохиназолинов 2, 3 доказано с
рокий спектр биологической активности [47-56].
помощью спектральных методов исследования.
Тетрагалогениды халькогенидов получали in situ
Циклизацию на атоме серы доказывает наличие
взаимодействием диоксида селена или теллура с
интенсивных полос поглощения карбонильной
6-кратным избытком соответствующей галогено-
группы в ИК спектрах соединений 2, 3 при 1673
водородной кислоты [41-46]. Проведение реак-
и 1730 см-1 соответственно. В спектрах ЯМР 1Н
ции тетрагалогенидов селена с 3-металлил-2-ти-
тиазолохиназолинов 2, 3 сигналы протонов гало-
оксо-7-трифторметилхиназолин-4-она (1) в среде
Схема 2.
O
O
Me
AcOH
N
N
Me
+
2Hal
2
CH2Hal
F3C
N S
F3C
N
S
H
HHal3
1
2, 3
Hal = Br (2), I (3).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННОГО 2,3-ДИГИДРО-5H-[1,3]ТИАЗОЛО[2,3-b]ХИНАЗОЛИН-... 1057
Схема 3.
O
O
Me
CHCl3
N
N
Me
+
SeHal4
CH2SeHal3
S
F3C
N
F3C
N
S
H
HHal
1
4, 5
Hal = Cl (4), Br (5).
ледяной уксусной кислоты приводит к осмолению
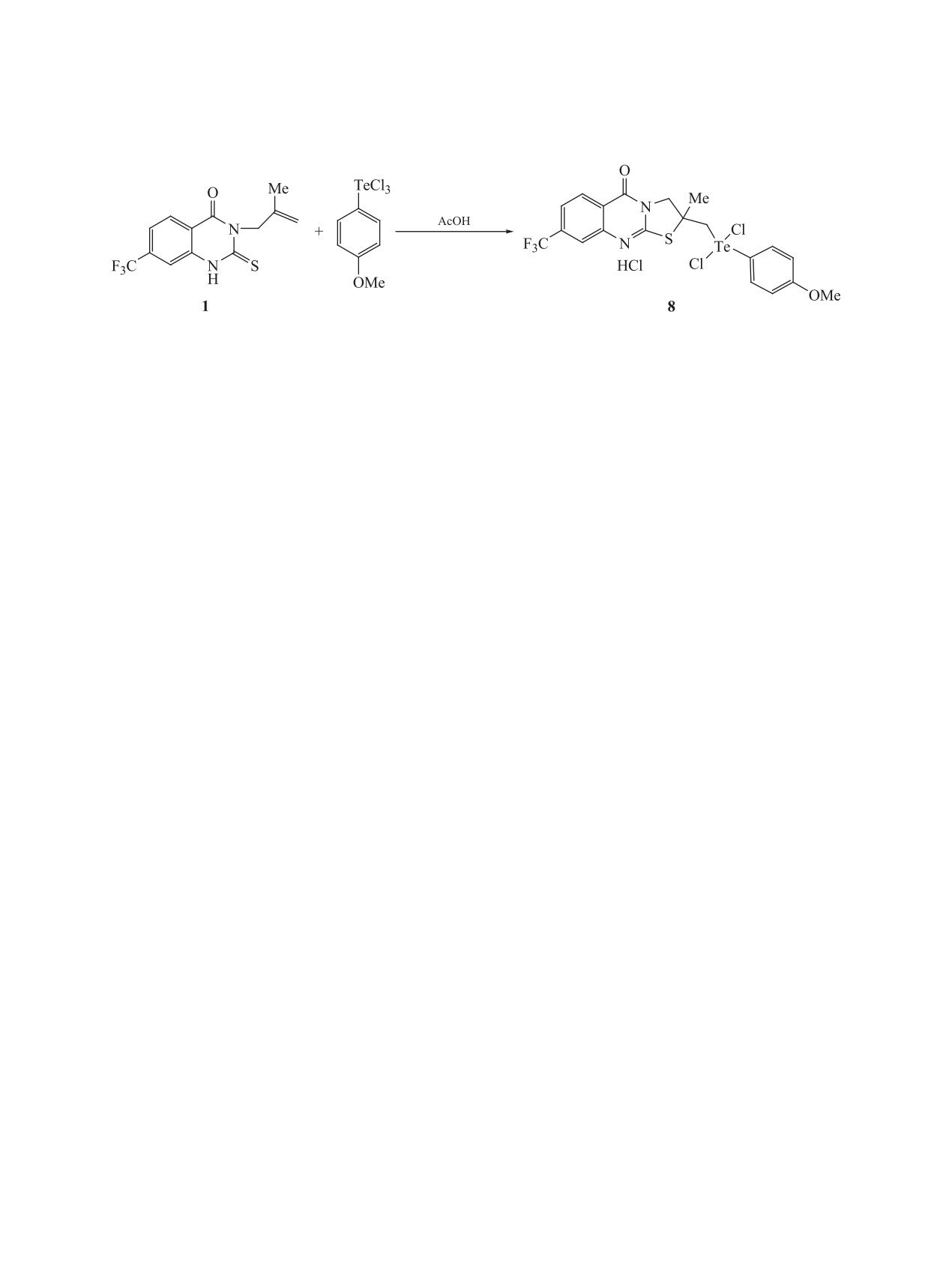
электрофильной гетероциклизации использован
реакционной смеси и экструзии селена. В то же
п-метоксифенилтеллуртрихлорид. Из литературы
время реакция в среде хлороформа приводит к
известно, что арилтеллуртрихлориды используют-
образованию гидрогалогенидов 2-метил-2-[(три-
ся для построения функционально замещенного
галогенселено)метил]-8-(трифтор)-2,3-дигидро-
тиазольного цикла [57] и его конденсированных
5H-[1,3]тиазоло[2,3-b]хиназолин-5-oнов 4, 5 ли-
производных [58, 59] с экзоциклическим атомом
нейного строения (схема 3). Об образовании ги-
теллура. Реакция алкенилхиназолина 1 и п-меток-
сифенилтеллуртрихлорида в ледяной уксусной
дрогалогенидов с аннелированным тиазольным
циклом свидетельствуют данные спектров ЯМР
кислоте приводит к региоселективному образова-
нию тиазолинохиназолина 8 линейного строения
1Н и 13С, которые коррелируют с данными спек-
с экзоциклическим атомом теллура (схема 5). В
тров гидротригалогенидов 2, 3. Следует отметить,
спектре ЯМР 13С соединения 8 сигналы углеро-
что трихлорселенометилтиазолохиназолин 4 в ус-
дов карбонильной и C-S групп проявляются при
ловиях эксперимента ЯМР 13С в ДМСО оказался
166.2 и 166.4 м.д., а валентные колебания С=О
неустойчивым и разложился с выделением эле-
группы - при 1673 см-1 в ИК спектре подтвержда-
ментарного селена. В ИК спектре соединения 5
ют образование линейной структуры 2-метил-2-
валентные колебания С=О группы наблюдаются в
{[дихлор(4-метоксифенил)теллуро]метил}-8-(три-
области 1722 см-1.
фторметил)-2,3-дигидро-5H-[1,3]тиазоло[2,3-b]-
При использовании тетрагалогенидов теллура
хиназолин-5-oна (8).
в реакции с 3-металлил-2-тиоксо-7-трифторметил-
Исследована региохимия электрофильной
хиназолин-4-оном (1) в уксусной кислоте происхо-
циклизации 3-металлил-2-тиоксо6-трифторметил-
дит циклизация с образованием устойчивых тел-
2,3-дигидрохиназолин-4(1H)-она под действием
луртрихлортиазолинохиназолинов 6, 7 (схема 4).
галогенсодержащих электрофильных реагентов и
Спектральные данные хорошо коррелируют со
получены потенциально биологически активные
спектральными данными селеновых аналогов 4, 5.
халькогенсодержащие тиазолохиназолины линей-
Для изучения влияния арильного заместителя
ного строения. Показано, что природа галогенсо-
в халькогенсодержащем электрофиле на процесс
держащего электрофила и наличие трифторме-
Схема 4.
O
O
Me
AcOH
N
N
Me
+
TeHal
4
CH2TeHal3
F3C
N S
F3C
N
S
H
HHal
1
6, 7
Hal = Cl (6), Br (7).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1058
КУТ и др.
Схема 5.
тильного заместителя не влияют на региохимию
δ, м.д.: -62.7. Найдено, %: С 51.99; Н 3.74; N 9.26;
процесса.
S 9.63. C13H11F3N2OS. Вычислено, %: С 51.99; Н
3.69; N 9.33; S 10.68.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез гидротригалогенидов
2-(галоген-
Спектры ЯМР 1H (400 и 500 МГц) и 13C
метил)-2-метил-8-(трифторметил)-2,3-дигидро-
(125 МГц) зарегистрированы на приборе
5H-[1,3]тиазоло[2,3-b]хиназолин-5-она 2, 3 (об-
Mercury-400 (СШA), внутренний стандарт ТМС.
щая методика). К раствору 2 ммоль 3-металлил-
Спектры ЯМР 19F зарегистрированы на спек-
2-тиоксо-7-трифторметил-2,3-дигидрохиназолин-
трометре Bruker AVANCE DRX 500 (470 МГц)
4(1H)-она (1) в 15 мл ледяной уксусной кислоты по
(США) внешний стандарт СCl3F (δ 0 м.д.). ИК
каплям прибавляли двукратный избыток галогена
спектры зарегистрированы на приборе Jasco
(бром, йод) (4 ммоль) в 5 мл ледяной уксусной
FTIR
4700 (Япония). Температуры плавления
кислоты. Реакционную смесь перемешивали 6 ч
определены на приборе Stuart SMP30 (Обьеде-
(бром) или 24 ч (йод) при комнатной температуре.
ненное Королевство Великобритании). Элемен-
Осадок отфильтровывали и промывали ледяной
тный анализ выполнен на приборе Elementar
уксусной кислотой.
Vario MICRO (Германия). Металлилизотио-
цианат получали по методике
[60]. п-Ме-
2-(Бромметил)-2-метил-8-(трифторметил)-
токсифенилтеллуртрихлорид синтезирован по
2,3-дигидро-5H-[1,3]тиазоло[2,3-b]хиназолин-
методике [61]. 4-Трифторметилантраниловая кис-
5-она гидротрибромид (2). Выход 1.07 г (86%),
лота куплена у коммерческих поставщиков и
желтый порошок, т.пл. 102-103°C. ИК спектр, ν,
использовалась без предварительной очистки.
см-1: 1673 с (С=О). Спектр ЯМР 1Н (400 МГц,
ДМСО), δ, м.д.: 1.74 с (3H, CH3), 4.06 д (1H, CH2Br,
3-(2-Метилпроп-2-ен-1-ил)-2-тиоксо-7-(три-
J 10.4 Гц), 4.14 д (1Н, CH2Br, J 10.0 Гц), 4.22 д (1Н,
фторметил)-2,3-дигидрохиназолин-4(1H)-oн (1).
NCH2, J 13.2 Гц), 4.60 д (1Н, NCH2, J 12.8 Гц), 7.71
К раствору 4-трифторметилантраниловой кислоты
д (1Наром, J 7.6 Гц), 7.81 с (1Наром), 8.23 д (1Наром,
(12 ммоль) в 15 мл триэтиламина прибавляли
J 8.0 Гц). Спектр ЯМР 13C (125 МГц, ДМСО), δ,
металлилизотиоцианат (14 ммоль). Полученную
м.д.: 24.7, 42,4, 54.0, 57.1, 122.0 д (J 2.5 Гц), 122.7,
смесь нагревали в течение 2 ч. Выпавший осадок
123.4 д (J 3.8 Гц), 124.0 к (J 272.5 Гц), 128.3, 134.6
отфильтровывали и перекристаллизовывали из
к (J 32.5 Гц), 149.0, 159.3, 161.3. Найдено, %: С
этилового спирта. Выход 3.64 г (92%), белый
25.12; Н 1.72; N 4.45; S 5.10. C13H11Br4F3N2OS.
порошок, т.пл. 178-179°C. ИК спектр, ν, см-1: 1660
Вычислено, %: С 25.19; Н 1.79; N 4.52; S 5.17.
с (C=O). Спектр ЯМР 1Н (500 МГц, ДМСО), δ,
м.д.: 1.75 с (3H, CH3), 4.52 с (1H, =CH2), 4.74 д (1H,
2-(Иодметил)-2-метил-8-(трифторметил)-
=CH2, J 8.5 Гц), 4.91 д (2H, NCH2, J 8.5 Гц), 7.62
2,3-дигидро-5H-[1,3]тиазоло[2,3-b]хиназолин-
д (1Наром, J 8.5 Гц), 7.70 с (1Наром), 8.14 д (1Наром,
5-oна гидротрийодид (3). Выход 1.27 г (79%),
J 8.5 Гц), 13.14 с (1H, NH). Спектр ЯМР 13C
коричневый порошок, т.пл. 135-136°C. ИК спектр,
(125 МГц, ДМСО), δ, м.д.: 20.9, 50.7, 109.9, 113.2
ν, см-1: 1730 с (С=О). Спектр ЯМР 1Н (400 МГц,
д (J 5.0 Гц), 118.6, 120.5 д (J 3.8 Гц), 123.6 к (J
ДМСО), δ, м.д.: 1.76 с (3H, СН3), 3.91 д (1Н, CH2I,
271.0 Гц), 129.6, 138.8, 139.7, 135.00 к (J 32.5 Гц),
J 10.0 Гц), 3.97 д (1Н, CH2I, J 10.0 Гц), 4.22 д (1Н,
158.7, 176.3. Спектр ЯМР 19F (470 МГц, ДМСО),
NCH2, J 12.8 Гц), 4.55 д (1Н, NCH2, J 12.8 Гц), 7.69
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННОГО 2,3-ДИГИДРО-5H-[1,3]ТИАЗОЛО[2,3-b]ХИНАЗОЛИН-... 1059
д (1Наром, J 8.4 Гц), 7.79 с (1Наром), 8.22 д (1Наром,
гидро-5H-[1,3]тиазоло[2,3-b]хиназолин-5-oна
J 8.4 Гц). Спектр ЯМР 13C (125 МГц, ДМСО), δ,
4-7 (общая методика). К раствору
2 ммоль
м.д.: 23.7, 31.3, 58.3, 62.7, 126.6 д (J 4.0 Гц), 127.3,
3-металлил-2-тиоксо-7-трифторметил-2,3-дигид-
128.1 д (J 4.0 Гц), 128.7 к (J 271.0 Гц), 133.0, 139.3
рохиназолин-4(1H)-она
(1) в
15 мл ледяной
к (J 32.5 Гц), 153.7, 164.0, 166.0. Найдено, %: С
уксусной кислоты по каплям прибавляли раствор,
19.26; Н 1.29; N 3.36; S 3.86. C13H11F3I4N2OS.
полученный из диоксида теллура (2 ммоль) и
Вычислено, %: С 19.33; Н 1.37; N 3.47; S 3.97.
шестикратного количества концентрированной
галогеноводородной кислоты. Реакционную смесь
Синтез гидрогалогенидов
2-метил-2-[(три-
перемешивали 6 ч при комнатной температуре.
галогенселено)метил]-8-(фторметил)-2,3-ди-
Осадок отфильтровывали и промывали ледяной
гидро-5H-[1,3]тиазоло[2,3-b]хиназолин-5-
уксусной кислотой.
oна 4-7 (общая методика). К раствору 2 ммоль
3-металлил-2-тиоксо-7-трифторметил-2,3-дигид-
2-Метил-2-[(трихлортеллуро)метил]-8-(три-
рохиназолин-4(1H)-она (1) в 15 мл хлорофор-
фторметил)-2,3-дигидро-5H-[1,3]тиазоло[2,3-b]-
ма по каплям прибавляли раствор, полу-
хиназолин-5-oна гидрохлорид (6). Выход 0.73 г
ченный из диоксида селена
(2 ммоль) и
(64%), белый порошок, т.пл.
144-145°C. ИК
шестикратного количества концентрированной
спектр, ν, см-1: 1732 с (C=O). Спектр ЯМР 1Н
галогеноводородной кислоты. Реакционную смесь
(400 МГц, ДМСО), δ, м.д.: 2.08 с (3H, СН3), 4.18-
перемешивали 4 ч при комнатной температуре.
4.26 м (2Н, CH2TeCl3), 4.33 д (1Н, NCH2, J 13.2 Гц),
Осадок отфильтровывали и промывали хлоро-
5.27 д (1Н, NCH2, J 12.8 Гц), 7.66 д (1Наром J
формом.
8.4 Гц), 7.76 с (1Hаром), 8.20 д (1Наром, J 8.4 Гц).
Спектр ЯМР 13C (125 МГц, ДМСО), δ, м.д.: 25.5,
2-Метил-2-[(трихлорселено)метил]-8-(три-
56.8, 57.7, 73.2, 121.9 д (J 2.5 Гц), 122.3, 123.3 д
фторметил)-2,3-дигидро-5H-[1,3]тиазоло[2,3-b]-
(J 3.8 Гц), 123.9 к (J 272.5 Гц), 128.3, 134.6 к (J
хиназолин-5-oна гидрохлорид (4). Выход 0.66 г
31.0 Гц), 148.7, 158.8, 161.6. Найдено, %: С
(63%), белый порошок, т.пл. 123-124°C. Спектр
27.32; Н 1.87; N 4.83; S 5.56. C13H11Cl4F3N2OSTe.
ЯМР 1Н (500 МГц, ДМСО), δ, м.д.: 1.71 с (3H,
СН3), 4.10 д (1Н, CH2SeCl3, J 11.0 Гц), 4.16 д (1Н,
Вычислено, %: С 27.41; Н 1.95; N 4.92; S 5.63.
CH2SeCl3, J 11.0 Гц), 4.22 д (1Н, NCH2, J 12.8 Гц),
2-Метил-2-[(трибромтеллуро)метил]-8-(три-
4.58 д (1Н, NCH2, J 12.8 Гц), 7.71 д (1Н, Наром, J
фторметил)-2,3-дигидро-5H-[1,3]тиазоло[2,3-b]-
8.5 Гц), 7.81 с (1Hаром), 8.24 д (1Наром, J 8.5 Гц).
хиназолин-5-она гидробромид (7). Выход 0.99 г
2-Метил-2-[(трибромселено)метил]-8-(три-
(66%), белый порошок, т.пл.136-137°C. Спектр
фторметил)-2,3-дигидро-5H-[1,3]тиазоло[2,3-b]-
ЯМР 1Н (400 МГц, ДМСО), δ, м.д.: 2.15 с (3H, СН3),
хиназолин-5-oна гидробромид (5). Выход 0.81 г
4.36 д (1Н, NCH2, J 13.2 Гц), 4.49 д (1Н, CH2TeBr3,
(58%), желтый порошок, т.пл. 115-116°C. ИК
J 11.6 Гц), 4.54 д (1Н, CH2TeBr3, J 11.6 Гц), 5.39 д
спектр, ν, см-1: 1722 с (С=О). Спектр ЯМР 1Н
(1Н, NCH2, J 13.2 Гц), 7.72 д (1Наром, J 8.8 Гц), 7.83
(400 МГц, ДМСО), δ, м.д.: 1.73 с (3H, СН3), 4.06 д
с (1Hаром), 8.25 д (1Наром, J 8.4 Гц). Спектр ЯМР
(1Н, CH2SeBr3, J 10.0 Гц), 4.14 д (1Н, CH2SeBr3, J
13C (125 МГц, ДМСО), δ, м.д.: 25.9, 56.9, 57.7, 66.6,
10.4 Гц), 4.22 д (1Н, NCH2, J 12.8 Гц), 4.60 д (1Н,
122.0 д (J 2.5 Гц), 122.5, 123.5 д (J 2.5 Гц), 124.0 к
NCH2, J 12.8 Гц), 7.71 д (1Наром, J 8.4 Гц), 7.80 с
(J 271.0 Гц), 128.5, 134.7 к (J 32.5 Гц), 148.9, 158.9,
(1Наром), 8.22 д (1Наром, J 8.4 Гц). Спектр ЯМР 13C
161.4. Найдено, %: С 20.81; Н 1.39; N 3.68; S 4.22.
(125 МГц, ДМСО), δ, м.д.: 24.7, 42.4, 54.0, 57.1,
C13H11Br4F3N2OSTe. Вычислено, %: С 20.89; Н
122.0 д (J 3.8 Гц), 122.7, 123.4 д (J 3.8 Гц), 124.0 к
1.48; N 3.75; S 4.29.
(J 271.0 Гц), 128.3, 134.6 к (J 32.5 Гц), 149.0, 159.3,
2-Метил-2-{[дихлор(4-метоксифенил)теллу-
161.3. Найдено, %: С 22.27; Н 1.48; N 3.94; S 4.47.
ро]метил}-8-(трифторметил)-2,3-дигидро-5H-
C13H11Br4F3N2OSSe. Вычислено, %: С 22.34; Н
[1,3]тиазоло[2,3-b]хиназолин-5-oна гидрохлорид
1.59; N 4.01; S 4.59.
(8). К раствору 2 ммоль 3-металлил-2-тиоксо-7-
Синтез гидрогалогенидов
2-метил-2-[(три-
трифторметил-2,3-дигидрохиназолин-4(1H)-она
галогентеллуро)метил]-8-(фторметил)-2,3-ди-
(1) в
15 мл ледяной уксусной кислоты по
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1060
КУТ и др.
каплям прибавляли раствор п-метоксифенил-
Inhib. Med. Chem.
2016,
31,
253-265. doi
теллуртрихлорида (2 ммоль) в 5 мл ледяной
10.3109/14756366.2015.1018243
уксусной кислоты. Реакционную смесь пере-
9.
Palanki M.S.S., Erdman P.E., Ren M., Suto M.,
мешивали 8 ч при комнатной температуре. Оса-
Bennett B.L., Manning A., Ransone L., Spooner C.,
док отфильтровывали и промывали ледяной
Desai S., Ow A., Totsuka R., Tsaob P., Toriumi W.
уксусной кислотой. Выход 1.07 г (81%), белый
Bioorg. Med. Chem. Lett. 2003, 13, 4077-4080. doi
порошок, т.пл. 212-213°C. ИК спектр, ν, см-1:
10.1016/j.bmcl.2003.08.047
1673 с (С=О). Спектр ЯМР 1Н (400 МГц, ДМСО),
10.
Tobe M., Isobe Y., Tomizawa H., Nagasaki T., Obara F.,
δ, м.д.: 1.95 с (3H, СН3), 3.81 с (3H, ОСН3), 4.26
Hayashi H. Bioorg. Med. Chem. 2003, 11, 609-616.
д (1Н, CH2TeCl2PhOCH3, J 11.2 Гц), 4.34 д (1Н,
doi 10.1016/S0968-0896(02)00338-3
CH2TeCl2PhOCH3, J 11.2 Гц), 4.47 д (1Н, NCH2,
11.
Wang W., Zhao X., Li T., Tian Q., Chen L., Zhou Z.,
J 12.8 Гц), 4.95 д (1Н, NCH2, J 12.8 Гц), 7.10 д
Li Z., Wang X., Rong Y., Jiang L., Liu Y., Sun J. Амер.
(2Наром, J 8.8, Н Ar), 7.74 д (1Наром, J 8.8 Гц), 7.85
заявка US 20160168129A1. 2016.
с (1Hаром), 8.05 д (2Наром, J 8.8 Гц), 8.26 д (1Наром,
12.
Casuscelli F., Piutti C., Ermoli A., Faiardi D. Амер.
J 8.8 Гц). Спектр ЯМР 13C (125 МГц, ДМСО), δ,
заявка US 20120190678A1. 2012.
м.д.: 33.6, 59.0, 60.7, 62.6, 64.2, 120.1, 126.7 д (J
2.5 Гц), 127.4, 128.3 д (J 2.5 Гц), 129,9 к (J
13.
Hartwig, J., Fier, P. Междунар. заявка WO
271.0 Гц), 130.3, 133.1, 139.3 к (J 31.0 Гц), 140.5,
2015013715A2. 2015.
153.8, 163.9, 166.2, 166.4. Найдено, %: С 37.23;
14.
Ravez S., Castillo-Aguilera O., Depreux P., Goossens L.
Н 2.14; N 4.19; S 4.95. C20H18Cl3F3N2O2STe. Вы-
Expert Opin. Ther. Patents. 2015, 25, 789-804. doi
числено, %: С 37.45; Н 2.83; N 4.37; S 5.00.
10.1517/13543776.2015.1039512
КОНФЛИКТ ИНТЕРЕСОВ
15.
Сливчук С.В., Броварец В.С., Драч В.С. ЖОХ.
2008, 78, 982-986. [Slivchuk S.V., Brovarets V.S.,
Авторы заявляют об отсутствии конфликта ин-
Drach B.S. Russ. J. Gen. Chem. 2008, 78, 1210-1214.]
тересов.
doi 10.1134/S1070363208060194
СПИСОК ЛИТЕРАТУРЫ
16.
Slivka N.Yu., Gevaza Yu.I., Staninets V.I. Chem.
1. Wan Z., Hu D., Li P., Xie D., Gan X. Molecules. 2015,
Heterocycl. Compd. 2004, 40, 660-666. doi 10.1023/
20, 11861-11874. doi 10.3390/molecules200711861
B:COHC.0000037323.22839.9f
2. Long C., Li P., Chen M., Dong L., Hu D., Song B.
17.
Фролова T.В., Слепухин П.A., Kим Д.Г. ХГС. 2011,
Eur. J. Med. Chem. 2015, 102, 639-647. doi 10.1016/
47, 310-312. [Frolova T.V., Slepuhin P.A., Kim D.G.
j.ejmech.2015.08.029
Chem. Heterocycl. Compd. 2011, 47, 252-254.] doi
3. Pati B., Banerjee S. J. Adv. Pharm. Edu. Res. 2013, 3,
10.1007/s10593-011-0751-y
136-151.
18.
StudzińskaR.,WróblewskiM.,Karczmarska-WódzkaA.,
4. Ighachane H., Sedra M.H., Lazrek H.B. J. Mater.
Kołodziejska R. Tetrahedron Lett. 2014, 55, 1384-
Environ. Sci. 2017, 8, 134-143.
1386. doi 10.1016/j.tetlet.2014.01.033
5. Rahman M.U., Jeyabalan G., Saraswat P., Parveen G.,
19.
Бахтеева E.И., Kим Д.Г., Дмитриев M.В., Крыло-
Khan S., Yar M.S. Synth. Commun. 2017, 47, 379-408.
ва Ю.E. ЖОрХ. 2019, 55, 841-847. [Bakhteeva E.I.,
doi 10.1080/00397911.2016.1269926
Kim D.G., Dmitriev M.V., Krylova Y.E. Russ.
6. Xie D., Shi J., Zhang A., Lei Z., Zu G., Fu Y., Gan X.,
J. Org. Chem. 2019, 55, 748-754.] doi 10.1134/
Yin L., Song B., Hu D. Bioorg. Chem. 2018, 80, 433-
S0514749219060028
443. doi 10.1016/j.bioorg.2018.06.026
20.
Zborovskii Yu.L., Orysyk V.V., Dobosh A.A.,
7. Bilyi A.K., Antypenko L.M., Ivchuk V.V.,
Staninets V.I., Pirozhenko V.V., Chernega A.N.
Kamyshnyi O.M., Polishchuk N.M., Kovalenko S.I.
Chem. Heterocycl. Compd. 2003, 39, 1099-1106. doi
ChemPlusChem. 2015, 80, 950-989. doi 10.1002/
10.1023/B:COHC.0000003532.58469.cc
cplu.201500051
21.
Orysyk V.V., Zborovskii Yu.L., Staninets V.I.,
8. Antypenko L., Kovalenko S.I., Posylkina Y.,
Dobosh A.A., Khripak S.M. Chem. Heterocycl. Compd.
Nikitin V., Fedyunina N., Ivchuk V. J. Enzyme.
2003, 39, 640-644. doi 10.1023/A:1025154317771
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННОГО 2,3-ДИГИДРО-5H-[1,3]ТИАЗОЛО[2,3-b]ХИНАЗОЛИН-... 1061
22.
Wippich P., Gütschow M., Leistner S. Synthesis. 2000,
33.
Дяченко И.В., Васькевич Р.И., Вовк M.В. ЖОрХ.
5, 714-720. doi 10.1055/s-2000-6390
2014, 50, 270-277. [Dyachenko I.V., Vas’Kevich R.I.,
Vovk M.V. Russ. J. Org. Chem. 2014, 50, 263-270.]
23.
Vas’kevich R.I., Khripak S.M., Staninets V.I.,
doi 10.1134/S1070428014020201
Zborovskii Yu.L., Chernega A.N. Russ. J. Org. Chem.
2000, 36, 1061-1066.
34.
Дяченко И.В., Васькевич Р.И., Васькевич A.И., По-
ловинко В.В., Вовк M.В. ЖОрХ. 2018, 54, 431-438.
24.
Vaskevich R.I., Khripak S.M., Staninets V.I., Zborovs-
[Dyachenko I.V., Vas’kevich R.I., Vas’kevich A.I.,
kij Y.L., Nesterenko A.M., Pirozhenko V.V. Ukr. Khim.
Polovinko V.V., Vovk M.V. Russ. J. Org. Chem. 2018,
Zh. 2000, 66, 47-52.
54, 436-443.] doi 10.1134/S1070428018030119
25.
Васькевич A.И., Васькевич Р.И., Станинец В.И.,
35.
Потапов В.A., Хабибулина A.Г., Удалова С.И.,
Бут С.А., Чернега A.Н. ЖОрХ. 2007, 43, 1530-1535.
[Vas’kevich A.I., Vas’kevich R.I., Staninets V.I.,
Mусалов M.В., Mусалова M.В., Шкурченко И.В.,
But S.A., Chernega A.N. Russ. J. Org. Chem. 2007, 43,
Aбанов A.И., Aмосова С.В. ЖОХ. 2019, 89, 1467-
1526-1531.] doi 10.1134/S107042800710020X
1470. [Potapov V.A., Khabibulina A.G., Udalova S.I.,
Musalov M.V., Musalova M.V., Shkurchenko I.V.,
26.
Slivka M., Krivovjaz A., Slivka M., Lendel V.
Albanov A.I., Amosova S.V. Russ. J. Gen. Chem. 2019,
Heterocycl. Commun. 2013, 19, 189-193. doi 10.1515/
89, 1931-1933.] doi 10.1134/S1070363219090317
hc-2013-0036
36.
Мусалова M.В., Иванова Л.A., Mусалов M.В., По-
27.
Бентя A.В., Васькевич Р.И., Больбут A.В., Вовк M.В.,
тапов В.A., Зинченко С.В., Aмосова С.В. ЖОрХ.
Станинец В.И., Туров A.В., Русанов Э.Б. ЖОрХ.
2018, 54, 1708-1709. [Musalova M.V., Ivanova L.A.,
2008, 44, 1377-1383. [Bentya A.V., Vas’kevich R.I.,
Musalov M.V., Potapov V.A., Zinchenko S.V.,
Bol’but A.V., Vovk M.V., Staninets V.I., Turov A.V.,
Amosova S.V. Russ. J. Org. Chem. 2018, 54, 1725-
Rusanov E.B. Russ. J. Org. Chem. 2008, 44, 1362-
1727.] doi 10.1134/S1070428018110179
1368.] doi 10.1134/S1070428008090194
37.
Mусалов M.В., Куркутов E.O., Потапов В.A., Ха-
28.
Васькевич Р.И., Бентя A.В., Tуров A.В., Руса-
бибулина A.Г., Албанов A.И., Aмосова С.В. ЖОрХ.
нов Э.Б., Станинец В.И., Вовк M.В. ЖОрХ. 2012,
2017, 53, 1774-1779. [Musalov M.V., Kurkutov E.O.,
48, 714-721. [Vas’Kevich R.I., Bentya A.V., Tu-
Potapov V.A., Khabibulina A.G., Albanov A.I.,
rov A.V., Rusanov E.B., Staninets V.I., Vovk M.V.
Amosova S.V. Russ. J. Org. Chem. 2017, 53, 1809-
Russ. J. Org. Chem. 2012, 48, 713-720.] doi 10.1134/
1814.] doi 10.1134/S1070428017120041
S1070428012050144
38.
Amosova S.V., Shagun V.A., Martynov A.V.,
29.
Свалявин O.В., Oнисько M.Ю., Tуров A.В., Вла-
Makhaeva N.A., Larina L.I., Lysenko K.A., Voron-
сенко Ю.Г., Лендел В.Г. ХГС. 2013, 49, 526-531.
kov M.G. J. Organomet. Chem. 2007, 692, 3307-3315.
[Svaljavyn O.V., Onysko M.Y., Turov A.V., Vlasen-
doi 10.1016/j.jorganchem.2007.01.023
ko Y.G., Lendel V.G. Chem. Heterocycl. Compd. 2013,
49, 491-495.] doi 10.1007/s10593-013-1273-6
39.
Amosova S.V., Martynov A.V., Penzik M.V., Ma-
khaeva N.A., Potapov V.A., Albanov A.I., Zhilits-
30.
Oнисько M.Ю., Свалявин O.В., Tуров A.В., Лен-
kaya L.V., Voronkov M.G. J. Organomet. Chem. 2008,
дел В.Г. ХГС. 2008, 44, 1085-1088. [Onysko M.Yu.,
693, 3650-3654. doi 10.1016/j.jorganchem.2008.05.037
Svalyavin O.V., Turov A.V., Lendel V.G. Chem.
Heterocycl. Compd. 2008, 44, 872-875.] doi 10.1007/
40.
Amosova S.V., Penzik M.V., Martynov A.V., Ma-
s10593-008-0123-4
khaeva N.A., Yarosh N.O., Voronkov M.G. J.
Organomet. Chem.
2008,
693,
3346-3350. doi
31.
Oнисько M.Ю., Свалявин O.В., Лендел В.Г. ХГС.
10.1016/j.jorganchem.2008.07.008
2007, 43, 602-604. [Onisko M.Yu., Svalyavin O.V.,
Lendel V.G. Chem. Heterocycl. Compd. 2007, 43, 496-
41.
Oнисько М.Ю., Лендел В.Г., Станинець В.И. Укр.
498.] doi 10.1007/s10593-007-0072-3
хим. ж. 1999, 65, 116-118.
32.
Васькевич Р.И., Дяченко И.В., Васькевич A.И., Ру-
42.
Лендел В.Г., Пак Б.Й., Балог И.М., Кияк М.Ю., Ми-
санов Э.Б., Вовк M.В. ЖОрХ. 2015, 51, 573-582.
галина Ю.В. ХГС. 1990, 26, 126-128. [Lendel V.G.,
[Vas’kevich R.I., Dyachenko I.V., Vas’kevich A.I.,
Pak B.I., Balog I.M., Kijak M.V., Migalina Yu.M.
Rusanov E.B., Vovk M.V. Russ. J. Org. Chem. 2015,
Chem. Heterocycl. Compd. 1990, 26, 108-110.] doi
51, 556-565.] doi 10.1134/S1070428015040168
10.1007/BF00506860
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1062
КУТ и др.
43.
Хрипак С.М., Якубец В.И., Лендел В.Г., Ваське-
51.
Silberman A., Kalechman Y., Hirsch S., Erlich Z.,
вич Р.И., Станинец В.И. Укр. хим. ж. 1998, 64, 128-
Sredni B., Albeck A. ChemBioChem. 2016, 17, 918-
132.
927. doi 10.1002/cbic.201500614
44.
Мигалина Ю.В., Лендел В.Г., Балог И.М., Стани-
52.
Cunha R.L.O.R., Gouvea I.E., Juliano L. An. Acad.
нец В.И. Укр. хим. ж. 1981, 47, 1293-1295.
Bras. Ciênc. 2009, 81, 393-407. doi 10.1590/S0001-
45.
Мигалина Ю.В., Станинец В.И., Лендел В.Г.,
37652009000300006
Балог И.М., Полюлин В.А., Козьмин А.С., Зефи-
53.
Halpert G., Sredni B. Autoimmun. Rev. 2014, 13, 1230-
ров Н.С. ХГС. 1977, 13, 58-62. [Migalina Yu.V.,
1235. doi 10.1016/j.autrev.2014.08.003
Staninets V.I., Lendel V.G., Balog I.M., Palyulin V.A.,
54.
Abdel-Hafez Sh.H. Russ. J. Bioorg. Chem. 2010, 36,
Koz’min A.S., Zefirov N.S. Chem. Heterocycl. Compd.
370-376. doi 10.1134/S1068162010030131
1977, 13, 49-53.] doi 10.1007/BF00479868
55.
Pesarico A.P., Sartori G., dos Santos C.F.A.,
46.
Мигалина Ю.В., Сани А.Ю., Балог И.М., Пет-
Neto J.S.S., Bortolotto V., Santos R.C.V., Noguei-
рус В.В., Ершова И.И., Лендел В.Г. ХГС. 1989, 25,
743-745. [Migalina Yu.V., Sani A.Yu., Balog I.M.,
ra C.W., Prigol M. Microbiol. Res. 2013, 168, 563-
Petrus V.V., Ershova I.I., Lendel V.G. Chem. Heterocycl.
568. doi 10.1016/j.micres.2013.04.009
Compd. 1989, 25, 610-612.] doi 10.1007/BF00470015
56.
Libero F.M., Xavier M.C.D., Victoria F.N., Nascen-
47.
Maluf S.E., Melo P.M.S., Varotti F.P., Gazarini M.L.,
te P.S., Savegnago L., Perin G., Alves D. Tetrahedron
Cunha R.L.O.R., Carmona A.K. Parasitol. Int. 2016,
Lett.
2012,
53,
3091-3094. doi
10.1016/j.
65, 20-22. doi 10.1016/j.parint.2015.09.006
tetlet.2012.04.040
48.
Grecco S. dos S., Reimão J.Q., Tempone A.G., Sartorel-
57.
Kut M., Fizer M., Onysko M., Lendel V. J. Heterocycl.
li P., Cunha R.L.O.R., Romoff P., Ferreira M.J.P.,
Chem. 2018, 55, 2284-2290. doi 10.1002/jhet.3281
Fávero O.A., Lago J.H.G. Experim. Parasitol. 2012,
58.
Kut M., Onysko M., Lendel V. J. Heterocycl. Chem.
130, 141-145. doi 10.1016/j.exppara.2011.11.002
2018, 55, 888-892. doi 10.1002/jhet.3114
49.
Pimentel I.A.S., de Siqueira Paladi C., Katz S., de Souza
59.
Kut M., Onysko M., Lendel V. Heterocycl. Commun.
Júdice W.A., Cunha R.L.O.R., Barbiéri C.L. PLOS
2016, 22, 347-350. doi 10.1515/hc-2016-0169
ONE. 2012, 7, 1-7. doi 10.1371/journal.pone.0048780
60.
Fizer M. Synlett. 2013, 24, 2019-2020. doi 10.1055/s-
50.
Caracelli I., Maganhi S.H., de Oliveira Cardoso J.,
0033-1339703
Cunha R.L.O.R., Vega-Teijidoa M.A., Zukerman-
Schpector J., Tiekink E.R.T. Z. Kristallogr. 2018, 233,
61.
Reichel L., Kirschbaum E. Ann. Chem. 1936, 523, 211-
113-124. doi 10.1515/zkri-2017-2079
223. doi 10.1002/jlac.19365230113
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННОГО 2,3-ДИГИДРО-5H-[1,3]ТИАЗОЛО[2,3-b]ХИНАЗОЛИН-... 1063
Synthesis of Functionalized 2,3-Dihydro-5H-[1,3]thiazolo-
[2,3-b]quinazolin-5-on with the Electrophilic Intramolecular
Cyclization Method
M. M. Kut*, M. Yu. Onysko, and V. G. Lendel
Uzhhorod National University, 88000, Ukraine, Uzhgorod, ul. Fedintsa 53/1
*e-mail: mykola.kut@uzhnu.edu.ua
Received March 31, 2020; revised April 21, 2020; accepted April 21, 2020
3-(2-Methylprop-2-en-1-yl)-2-thioxo-7-trifluoromethyl-2,3-dihydroquinazolin-4(1H)-one regioselectively reacts
with halogens (bromine and iodine), chalcogen tetrahalides and p-methoxyphenyltelluriumtrichloride with the
formation of corresponding 2-halogenomethyl-2-methyl-8-trifluoromethyl-2,3-dihydro-5H-[1,3]thiazolo[2,3-b]-
quinazolin-5-one hydrotrihalides, hydrohalides 2-methyl-2-[(trihalohalcogeno)methyl]-8-fluoromethyl-2,3-di-
hydro-5H-[1,3]thiazolo[2,3-b]quinazolin-5-one and 2-{[dichloro (4-methoxyphenyl)telluro]methyl}-2-me-
thyl-8-trifluoromethyl-2,3-dihydro-5H-[1,3]thiazolo[2,3-b]quinazolin-5-one as linear structure.
Keywords: electrophilic cyclization, halogen-containing electrophile, p-methoxyphenyltellurium trichloride,
regioselectivity, 3-(2-methylprop-2-en-1-yl)-2-thioxo-7-(trifluoromethyl)-2,3-dihydroquinazolin-4(1H)-one,
2,3-dihydro-5H-[1,3]thiazolo[2,3-b]quinazolin-5-one
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020