ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1071-1075
УДК 547.823
СИНТЕЗ 6-АЛКОКСИ- И 1,6-ДИАЛКОКСИ 4-АМИНО-
1-АРИЛ-3-ОКСО-2,3-ДИГИДРО-1H-ПИРРОЛО-
[3,4-с]ПИРИДИН-7-КАРБОНИТРИЛОВ
© 2020 г. Я. С. Каюковa, *, А. А. Григорьевa, С. В. Карповa,
О. В. Каюковаb, **, А. А. Михайловc
a ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»,
428015, Россия, Чувашская Республика, г. Чебоксары, Московский пр. 15
*e-mail: kaukovyakov@mail.ru
b ФГБОУ ВО «Чувашская государственная сельскохозяйственная академия»,
428003, Россия, Чувашская Республика, г. Чебоксары, ул. К. Маркса 29
**e-mail: olgakajukova@mail.ru
c ФГБУН «Институт общей и неорганической химии им. Н.С. Курнакова РАН»,
119991, Россия, г. Москва, Ленинский пр. 31
Поступила в редакцию 06 марта 2020 г.
После доработки 09 марта 2020 г.
Принята к публикации 13 марта 2020 г.
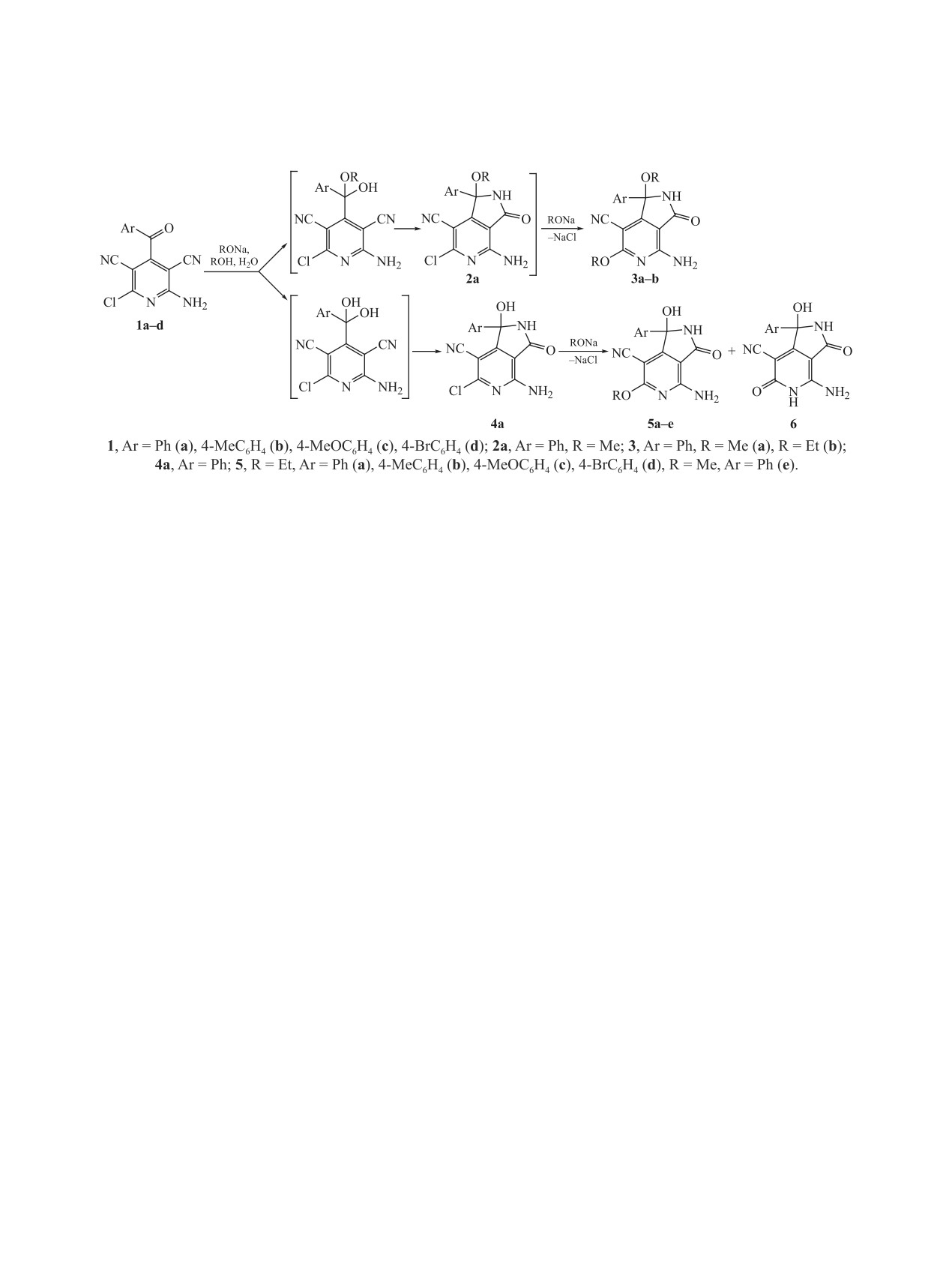
Взаимодействие 3-ароил-6-галогенпиридин-3,5-дикарбонитрилов со спиртами в условиях основного
катализа приводит к последовательно протекающим региоселективному аннелированию пиррольного
цикла по связи [с] пиридина и замещению хлора. Процесс образования пиррольного цикла включает
формирование фуранового цикла с участием карбонильной и цианогрупп и иминолактон-лактамную
перегруппировку. В среде абсолютного спирта реакция приводит к 4-амино-1-арил-1,6-диалкокси-3-
оксо-2,3-дигидро-1H-пирроло[3,4-c]пиридин-7-карбонитрилам. При наличии воды в спирте реакция
идет с образованием 4-амино-1-гидрокси-3-оксо-1-арил-6-алкокси-2,3-дигидро-1H-пирроло[3,4-c]пи-
ридин-7-карбонитрилам.
Ключевые слова: пиридин, спирт, пирроло[3,4-с]пиридин, аннелирование, иминолактон-лактамная
перегруппировка.
DOI: 10.31857/S0514749220070101
Взаимодействие
2-амино-4-ароил-6-хлор-3,5-
С целью получения алкоксипроизводных пир-
дикарбонитрилов 1 с аммиаком [1] и гидроксидами
роло[3,4-с]пиридина мы изучили взаимодействие
[2] приводит к аннелированию пиррольного цикла
пиридинов 1 со спиртами в условиях основно-
го катализа. Было установлено, что взаимодей-
по связи [с] пиридинового кольца и служит удоб-
ствие пиридинов 1 со спиртами приводит к раз-
ным методом синтеза производных пирроло[3,4-с]
личным результатам в зависимости от наличия
пиридина. Полифункциональные производные
воды в используемом спирте. При проведении
пирроло[3,4-c]пиридина исследуются в качестве
реакции в абсолютном спирте основными про-
потенциальных лекарственных веществ, так среди
дуктами являются
4-амино-1-арил-1,6-диалкок-
них обнаружены ингибиторы SYK (противоопу-
си-3-оксо-2,3-дигидро-1H-пирроло[3,4-c]пири-
холевая активность) [3], MDM2 (апоптотическая
дин-7-карбонитрилы 3а, b. При наличии воды
активность) [4] и InhA (противотуберкулезная ак-
вначале образуются 4-амино-1-арил-1-гидрокси-
тивность) [5].
3-оксо-6-хлор-2,3-дигидро-1H-пирроло[3,4-c]пи-
1071
1072
КАЮКОВ и др.
Схема 1.
ридин-7-карбонитрилы 4, а при более длительном
присоединение к карбонильной группе чувстви-
воздействии
-
6-алкокси-4-амино-1-арил-1-гид-
тельно к стерическим затруднениям, вследствие
рокси-3-оксо-2,3-дигидро-1H-пирроло[3,4-c]пи-
чего алкоксид-ион присоединяется значительно
ридин-7-карбонитрилы 5a-e с примесью 4-ами-
медленнее, чем гидроксид. Если спирт содержит
но-1-гидрокси-1-арил-3,6-диоксо-2,3,5,6-тетра-
небольшое количество воды (3-5%), то к карбо-
гидро-1H-пирроло[3,4-c]пиридин-7-карбонитри-
нильной группе присоединяется гидроксид-ион,
лов 6 [6] (схема 1).
а замещение галогена идет, преимущественно,
алкоксид-ионом и образуются 6-алкокси-1-гидрок-
Структура синтезированных соединений уста-
сипроизводные 5, а соответствующие пиридоны 6
новлена по данным ЯМР-спектроскопии 1Н и 13С
образуются в следовых количествах. В процессе
и масс-спектрометрии.
замещения хлора гидроксид и алкоксид ионы так-
При взаимодействии пиридинов 1 с нуклео-
же конкурируют между собой, поэтому при более
филами конкурируют процессы замещения гало-
высоком содержании воды в результате образова-
гена и присоединения по карбонильной группе.
ния пиридонов 6 сокращается выход соединений
Аннелирование пиррольного цикла, предшеству-
5а-e и затрудняется их очистка. Таким образом,
ет замещению галогена, в подтверждение чего
взаимодействие пиридинов 1 со спиртами может
промежуточные
4-амино-1-метокси-3-оксо-1-
лежать в основе удобного метода синтеза 1,6-ди-
фенил-6-хлор-2,3-дигидро-1Н-пирроло[3,4-c]-
алкоксипирроло[3,4-c]пиридинов 3 и 6-алкокси-1-
пиридин-7-карбонитрил (2а) и 4-амино-1-гидрок-
гидрокси-пирроло[3,4-c]пиридинов 5.
си-3-оксо-1-фенил-6-хлор-2,3-дигидро-1Н-пир-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
роло[3,4-c]пиридин-7-карбонитрил (4а) были вы-
делены и охарактеризованы. Начинается реакция
Индивидуальность синтезированных соеди-
с присоединения нуклеофила к карбонильной
нений подтверждена методом ТСХ на пластинах
группе, после чего следует формирование фура-
Sorbfil PTSH-AF-A-UF, элюент этилацетат или
нового кольца и его рециклизация в пиррольное
смеси этилацетата с гексаном, проявление УФ-
в ходе иминолактон-лактамной перегруппиров-
свет (254 нм), термическое разложение. ИК спек-
ки. Реакция идет региоселективно, из двух циа-
тры снимали на приборе ИК Фурье-спектрометре
ногрупп в превращениях участвует находящаяся
ФСМ-1202 в тонком слое (суспензия в вазелино-
со стороны аминогруппы. В спиртах содержащих
вом масле). Спектры ЯМР 1Н и 13C регистриро-
воду реакция осложняется конкуренцией между
вали на спектрометре Bruker Avance III HD 400
алкоксид- и гидроксид- ионами. По-видимому,
при рабочих частотах 400 МГц и 101 МГц соот-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ 6-АЛКОКСИ- И 1,6-ДИАЛКОКСИ 4-АМИНО-1-АРИЛ-3-ОКСО-2,3-ДИГИДРО-...
1073
ветственно, растворитель - ДМСО-d6, внутрен-
168.0. Масс спектр, m/z (Iотн, %): 338 (21.8) [М]+,
ний стандарт - ТМС. Масс-спектры снимали на
293 (100) [M - OC2H5]+, 265 (28.9), 248 (24.6),
приборе Shimadzu GCMS-QP 2010 SE (электрон-
105 (21.5) [PhCO]+, 77 (51.3) [Ph]+. Найдено, %: C
ный удар, 70 эВ). Элементный анализ выполнен
63.80; H 5.32; N 16.63. C18H18N4O3. Вычислено, %:
на анализаторе Vario MICRO cube. Температуры
C 63.89; H 5.36; N 16.56. M 338.14.
плавления были определены с использованием
4-Амино-1-метокси-3-оксо-1-фенил-6-хлор-
Electrothermal IA 9000 series II. 2-Амино-4-ароил-
2,3-дигидро-1Н-пирроло[3,4-c]пиридин-7-кар-
6-хлорпиридин-3,5-дикарбонитрилы 1a-d получе-
бонитрил (2а). К суспензии 0.565 г (0.002 моль)
ны по литературным методикам [1].
пиридина 1а в 5 мл MeOH добавляли р-p 0.07 г Na
4-Амино-1,6-диметокси-3-оксо-1-фенил-2,3-
в 1 мл MeOH, реакционную смесь перемешивали
дигидро-1H-пирроло[3,4-c]пиридин-7-карбо-
до исчезновения исходного пиридина (контроль
нитрил (3а). К суспензии 0.565 г (0.002 моль)
ТСХ, УФ после нагревания), затем разбавляли во-
пиридина 1а в 5 мл MeOH добавляли раствор
дой, нейтрализовывали 5% р-ром H2SO4, осадок
0.07 г Na в 1 мл MeOH, при этом наблюдалось
отфильтровывали, промывали водой, разделяли
окрашивание реакционной смеси в желто-оранже-
колоночной хроматографией (элюент AcOEt-
вый цвет, затем обесцвечивание и формирование
CH2Cl2, 1:1). Выход соединение 3а 0.198 г (32%)
осадка. Перемешивание продолжали при нагре-
и 0.075 г (12%) соединения 2а т.разл. > 210°С.
вании до 60°С до завершения реакции (контроль
Спектр ЯМР 1Н, δ, м. д.: 3.20 c (3H, OCH3), 7.34-
ТСХ, гексан-этилацетат, 1:1), затем реакцион-
7.44 м (3Hаром), 7.46-7.49 м (2Hаром), 7.53 уш.с
ную смесь нейтрализовывали 5%-ным раствором
(1H, NH2), 8.68 уш.с (1H, NH2), 9.40 с (1Н, NH).
H2SO4, осадок отфильтровывали, промывали во-
Спектр ЯМР 13С, δ, м. д.: 50.9, 90.2, 91.5, 108.0,
дой, очищали кристаллизацией из смеси MeCN-
113.6, 126.7, 128.8, 129.4, 137.2, 155.7, 156.5, 161.8,
H2O (3:1). Выход 0.291 г (47%), белый порошок,
167.5. Масс спектр, m/z (Iотн, %): 316/314 (6.4/19.1)
т.пл. 219-221°С (разл.). Спектр ЯМР 1Н, δ, м.д.:
[М]+, 285/283 (29.5/100) [M - OCH3]+, 247 (24.5),
3.21 с (3H, СН3), 3.92 с (3H, СН3), 7.15 уш.с (1H,
239/237 (5.0/15.2) [M - Ph]+, 207/205 (8.8/27.3),
NH2), 7.32-7.40 м (3Hаром), 7.40-7.48 м (2Hаром),
105 (39.7) [PhCO]+, 77 (78.7) [Ph]+. Найдено, %: C
8.24 уш.с (1H, NH2), 9.11 с (1H, NH). Спектр ЯМР
57.14; H 3.57; N 17.71. C15H11ClN4O2. Вычислено,
13С, δ, м.д.: 50.2, 55.4, 76.7, 88.4, 113.4, 102.3,
%: C 57.24; H 3.52; N 17.80. M 314.06.
126.2, 128.4, 128.9, 138.0, 156.4, 164.2, 167.1, 167.6.
4-Амино-1-гидрокси-3-оксо-1-фенил-6-
Масс спектр, m/z (Iотн, %): 310 (28.6) [М]+, 279
этокси-2,3-дигидро-1H-пирроло[3,4-c]пири-
(100) [M - OCH3]+, 201 (18.8), 105 (14.1) [PhCO]+,
дин-7-карбонитрил (5a). К суспензии 0.565 г
77 (29.4) [Ph]+. Найдено, %: C 61.89; H 4.56; N
(0.002 моль) пиридина 1а в 3 мл EtOH добав-
18.03. C16H14N4O3. Вычислено, %: C 61.93; H 4.55;
ляли р-р 0.12 г (0.003 моль) NaOH в 3 мл EtOH.
N 18.06. M 310.11.
Перемешивание продолжали при нагревании
Соединение 3b получали аналогично, исполь-
до 60°С до завершения реакции (контроль ТСХ,
зуя абсолютизированный этанол.
гексан-этилацетат,
1:1), затем реакционную
4-Амино-1,6-диэтокси-3-оксо-1-фенил-2,3-
смесь нейтрализовали 5% р-ром H2SO4, осадок
дигидро-1H-пирроло[3,4-c]пиридин-7-карбо-
отфильтровали, промыли водой, и очищали кри-
нитрил (3b). Выход 0.379 г (56%), белый поро-
сталлизацией из смеси MeCN H2O (3:1). Выход
шок, т.пл. 251-253°С (разл.). Спектр ЯМР 1Н, δ,
0.391 г (63%), белый порошок, т.пл. 246-248°С (c
м.д.: 1.21 т (3H, СН3, 3J 7.0 Гц), 1.27 т (3H, СН3,
разл.). ИК спектр, ν, см-1: 3480, 3287, 3278 (NH,
3J 7.0 Гц), 3.10-3.17 м (1H, СН2), 3.45-3.55 м (1H,
OH), 2222 (C≡N), 1708 (C=O), 1687, 1630 (C=N,
СН2), 4.35 к (2H, СН2, 3J 7.0 Гц), 7.13 уш.с (1H,
δNH2). Спектр ЯМР 1Н, δ, м.д.: 1.28 т (3H, СН3,
NH2), 7.34-7.41 м (3Hаром), 7.44-7.47 м (2Hаром),
3J 7.0 Гц), 4.36 к (2H, СН2, 3J 7.0 Гц), 7.09 уш.с
8.11 уш.с (1H, NH2), 9.07 с (1H, NH). Спектр ЯМР
(1H, NH2), 7.24 с (1H, OH), 7.32-7.40 м (3Hаром),
13С, δ, м.д.: 14.4, 15.3, 58.5, 63.6, 76.6, 90.8, 101.8,
7.44-7.50 м (2Hаром), 8.02 уш.с (1H, NH2), 9.08 с
113.6, 126.2, 128.4, 128.8, 138.1, 156.4, 162.9, 166.7,
(1H, NH). Спектр ЯМР 13С, δ, м.д.: 14.3, 63.2, 76.5,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1074
КАЮКОВ и др.
86.5, 100.8, 113.6, 126.1, 165.8, 128.0, 128.1, 138.9,
8.06 уш.с (1H, NH2), 9.11 с (1H, NH). Спектр ЯМР
156.2, 166.5, 167.5. Масс спектр, m/z (Iотн, %): 310
13С, δ, м.д.: 14.3, 55.2, 63.2, 76.3, 86.1, 100.8, 113.6,
(15.2) [М]+, 292 (39.0) [М - Н2О]+, 233 (14.4) [M -
121.6, 128.4, 131.0, 138.4, 156.2, 165.3, 166.5, 167.4.
Ph]+, 205 (29.3), 161 (30.6), 133 (53.9), 105 (65.4)
Масс спектр, m/z (Iотн, %): 390/388 (4.9/5.0) [М]+,
[PhCO]+, 77 (100) [Ph]+. Найдено, %: C 62.04; H
373/371 (7.2/7.6) [M - OH]+, 345/343 (6.5/6.8)
4.59; N 17.97. C16H14N4O3. Вычислено, %: C 61.93;
[M - OEt]+, 233 (10.2), 185/183 (16.9/15.6) [ArCO]+,
H 4.55; N 18.06. M 310.11.
157/155 (14.7/14.9) [Ar]+, 57 (100). Найдено, %: C
49.42; H 3.39; N 14.38. C16H13BrN4O3. Вычислено,
Соединения 5b-e получали аналогично
%: C 49.38; H 3.37; N 14.40. M 388.02.
4-Амино-1-гидрокси-3-оксо-1-(p-толил)-6-
4-Амино-1-гидрокси-3-оксо-1-фенил-6-
этокси-2,3-дигидро-1H-пирроло[3,4-c]пири-
метокси-2,3-дигидро-1H-пирроло[3,4-c]пири-
дин-7-карбонитрил (5b). Выход 0.343 г (53%),
дин-7-карбонитрил (5е). Выход 0.408 г (69%),
белый порошок, т.пл. 250-252°С (c разл.). Спектр
белый порошок, т.пл. 255-256°С (c разл.). Спектр
ЯМР 1Н, δ, м.д.: 1.28 т (3H, СН3СН2, 3J 7.0 Гц), 2.29
ЯМР 1Н, δ, м.д.: 3.88 с (3H, СН3), 7.10 уш.с (1H,
с (3H, СН3), 4.36 к (2H, СН2, 3J 7.0 Гц), 7.07 уш.с
NH2), 7.31 с (1H, OH), 7.32-7.39 м (3Hаром), 7.41-
(1H, NH2), 7.14-7.18 м (2Hаром + 1H OH), 7.31-7.36
7.46 м (2Hаром), 8.01 уш.с (1H, NH2), 9.08 с (1H,
м (2Hаром), 8.00 уш.с (1H, NH2), 9.03 (1H, NH).
NH). Спектр ЯМР 13С, δ, м.д.: 55.0, 76.6, 86.7,
Спектр ЯМР 13С, δ, м.д.: 14.3, 20.7, 63.2, 76.5, 86.5,
101.2, 113.9, 126.2, 128.3, 128.6, 139.0, 156.4, 166.1,
100.8, 113.7, 126.0, 128.6, 136.0, 137.5, 156.1, 166.0,
167.1, 167.7. Масс спектр, m/z (Iотн, %): 296 (9.1)
166.5, 167.5. Масс спектр, m/z (Iотн, %): 324 (5.9)
[М]+, 278 (47.5) [М - Н2О]+, 219 (14.8) [M - Ph]+,
[М]+, 306 (26.7) [М - H2O]+, 296 (20.3) [М - C2H4]+,
175 (21.5), 147 (57.7), 105 (21.7) [PhCO]+, 77 (43.6)
119 (80.7) [ArCO]+, 91 (100) [Ar]+. Найдено, %: C
[Ph]+, 57 (100). Найдено, %: C 60.78; H 4.09; N
63.05; H 5.01; N 17.20. C17H16N4O3. Вычислено, %:
18.87. C15H12N4O3. Вычислено, %: C 60.81; H 4.08;
C 62.95; H 4.97; N 17.27. M 324.12.
N 18.91. M 296.09.
4-Амино-1-гидрокси-3-оксо-6-этокси-1-(4-
БЛАГОДАРНОСТИ
метоксифенил)-2,3-дигидро-1H-пирроло[3,4-c]-
Часть работы выполнена в рамках государ-
пиридин-7-карбонитрил
(5c). Выход
0.326 г
ственного задания ИОНХ РАН в области фунда-
(48%), белый порошок, т.разл. > 205°С. Спектр
ментальных научных исследований.
ЯМР 1Н, δ, м.д.: 1.27 т (3H, СН3, 3J 7.0 Гц), 3.74 c
ФОНДОВАЯ ПОДДЕРЖКА
(3H, OСН3), 4.36 к (2H, OСН2, 3J 7.0 Гц), 6.89-6.92
м (2Hаром), 7.06 уш.с (1H, NH2), 7.16 с (1H, OH),
Исследование выполнено при финансовой под-
7.35-7.38 м (2Hаром), 7.98 уш.с (1H, NH2), 9.01 с
держке Российского фонда фундаментальных ис-
(1H, NH). Спектр ЯМР 13С, δ, м.д.: 14.4, 55.2, 63.2,
следований (проект № 18-33-01204 мол_а).
76.5, 86.4, 100.7, 113.4, 113.8, 127.5, 130.9, 156.2,
КОНФЛИКТ ИНТЕРЕСОВ
159.2, 166.2, 166.5, 167.5. Масс спектр, m/z (Iотн,
Авторы заявляют об отсутствии конфликта ин-
%): 340 (24.3) [М]+, 323 (22.0) [M - OH]+, 322
тересов
(35.8) [M - H2O]+, 295 (10.2), 293 (11.6), 161 (18.6),
135 (100) [ArCO]+. Найдено, %: C 60.10; H 4.78; N
СПИСОК ЛИТЕРАТУРЫ
16.39. C17H16N4O4. Вычислено, %: C 60.00; H 4.74;
1. Григорьев А.А., Каюков Я.С., Никифорова А.Л.,
N 16.46. M 340.12.
Карпов С.В., Щегравина Е.С., Каюкова О.В.,
4-Амино-1-(4-бромфенил)-1-гидрокси-3-
Тафеенко В.А. ХГС.
2019,
55,
167-171.
[Gri-
оксо-6-этокси-2,3-дигидро-1H-пирроло[3,4-c]-
gor’ev A.A., Kayukov Ya.S., Nikiforova A.L., Kar-
пиридин-7-карбонитрил
(5d). Выход
0.428 г
pov S.V., Shchegravina E.S., Kayukova O.V., Tafeen-
(55%), белый порошок, т.пл. 272-274°С (c разл.).
ko V.A. Chem. Heterocycl. Compd. 2019, 55, 167-
Спектр ЯМР 1Н, δ, м.д.: 1.28 т (3H, СН3, 3J 7.0 Гц),
171.] doi 10.1007/s10593-019-02434-4
4.32-4.44 м (2H, СН2), 7.10 уш.с (1H, NH2), 7.35 с
2. Каюков Я.С., Карпов С.В., Григорьев А.А., Ни-
(1H, OH), 7.37-7.41 м (2Hаром), 7.54-7.59 м (2Hаром),
кифорова А.Л., Насакин О.Е., Щегравина Е.С.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ 6-АЛКОКСИ- И 1,6-ДИАЛКОКСИ 4-АМИНО-1-АРИЛ-3-ОКСО-2,3-ДИГИДРО-...
1075
Каюкова О.В., Тафеенко В.А. ХГС. 2017, 53, 568-
lev N.A., Tribulovich V.G. Bioorg. Med. Chem. Lett.
574. [Kayukov Ya.S., Karpov S.V., Grigor’ev A.A.,
2017, 27, 5197-5202. doi 10.1016/j.bmcl.2017.10.049
Nikiforova A.L., Nasakin O.E., Shchegravina E.S.,
5. Deraeve C., Dorobantu I.M., Rebbah F., Le Quémé-
Kayukova O.V., Tafeenko V.A. Chem. Heterocycl.
ner F., Constant P., Quémard A., Bernardes-Génis-
Compd. 2017, 53, 568-574.] doi 10.1007/s10593-017-
2093-x
son V., Bernadou J., Pratviel G. Bioorg. Med. Chem.
3. Lam B., Arikawa Y., Cramlett J., Dong Q., de Jong R.,
2011, 19, 6225-6232. doi 10.1016/j.bmc.2011.09.017
Feher V., Grimshaw C.E., Farrell P.J., Hoffman I.D.,
6. Каюков Я.С., Бардасов И.Н., Карпов С.В., Ер-
Jennings A., Jones B., Matuszkiewicz J., Miura J.,
шов О.В., Насакин О.Е., Каюкова О.В., Тафе-
Miyake H., Natala S.R., Shi L., Takahashi M.,
енко В.А. ЖОрХ. 2012, 48, 1463-1471. [Kayu-
Taylor E., Wyrick C., Yano J., Zalevsky J., Nie Z.
kov Ya.S., Bardasov I.N., Karpov S.V., Ershov O.V.,
Bioorg. Med. Chem. Lett. 2016, 26, 5947-5950. doi
10.1016/j.bmcl.2016.10.087
Nasakin O.E., Kayukova O.V., Tafeenko V.A. Russ.
4. Grigoreva T.A., Novikova D.S., Petukhov A.V.,
J. Org. Chem. 2012, 48, 1447-1455.] doi 10.1134/
Gureev M.A., Garabadzhiu A.V., Melino G., Bar-
S1070428012110073
Synthesis of 6-Alkoxy- and 1,6-Dialkoxy-4-amino-1-aryl-
3-oxo-2,3-dihydro-1H-pyrrolo[3,4-c]pyridine-7-carbonitriles
Ya. S. Kayukova, A. A. Grigor’eva, *, S. V. Karpova, O. V. Kayukovab, **, and A. A. Mikhaylovc
a Chuvash State University named after I.N. Ulianov,
428015, Russia, Chuvash Republic, Cheboksary, Moskovskii pr. 15
*e-mail: grigorev.arth@gmail.com
b Chuvash State Agricultural Academy, 428003, Russia, Chuvash Republic, Cheboksary, ul. K. Marksa 29
**e-mail: olgakajukova@mail.ru
c Kurnakov Institute of General and Inorganic Chemistry, RAS, 119991, Russia, Moscow, Leninskii pr. 31
Received March 6, 2020; revised March 9, 2020; accepted March 13, 2020
The interaction of 3-aroyl-6-halo-pyridin-3,5-dicarbonitriles with alcohols under the conditions of basic ca-
talysis leads to sequential regioselective annulation of the pyrrole ring to the c bond of pyridine and chlorine
substitution. The formation of the pyrrole cycle includes the formation of a furan ring with the participation of
carbonyl and cyano groups and iminolactone-lactam rearrangement. In absolute alcohol, the reaction leads to
4-amino-1,6-dialkoxy-1-aryl-3-oxo-2,3-dihydro-1H-pyrrolo[3,4-c]pyridin-7-carbonitriles. In the presence of
water in the alcohol, the reaction proceeds with the formation of 6-alkoxy-4-amino-1-aryl-1-hydroxy-3-oxo-
2,3-dihydro-1H-pyrrolo[3,4-c]pyridin-7-carbonitriles.
Keywords: pyridine, alcohol, pyrrolo[3,4-c]pyridine, annulation, iminolactone-lactam rearrangement
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020