ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1076-1081
УДК 547.537.9
СИНТЕЗ НОВЫХ ЛИПОФИЛЬНЫХ
ЦИКЛОПЕНТЕНОФУЛЛЕРЕНОВ С60
НА ОСНОВЕ АЛЛЕНОАТОВ ЖИРНЫХ КИСЛОТ
© 2020 г. А. Ф. Мухаметьяноваa, И. М. Сахаутдиновa, *, Т. Р. Нугумановa, Ю. Н. Бигловаb
a ФГБУН «Уфимский Институт химии Уфимского федерального исследовательского центра РАН»,
450054, Россия, Республика Башкортостан, г. Уфа, пр. Октября 69
*e-mail: ioh039@mail.ru
b ФГБОУ ВО «Башкирский государственный университет»,
450076, Россия, Республика Башкортостан, г. Уфа, ул З. Валиди 32
Поступила в редакцию 25 февраля 2020 г.
После доработки 20 апреля 2020 г.
Принята к публикации 21 апреля 2020 г.
Синтезированы алленоаты на основе жирных кислот. В результате фосфин-катализируемого [3+2]-
циклоприсоединения алленоатов к фуллереновому каркасу получены новые липофильные моноаддукты
фуллерена С60.
Ключевые слова: [3+2]-циклоприсоединение, жирные кислоты, алленоаты, реакция Виттига, цикло-
пентенофуллерены, фуллерен С60, аминокислоты.
DOI: 10.31857/S0514749220070113
Общеизвестная высокая способность фуллере-
мических реакций. Растворимость же в воде край-
на С60 улавливать свободные радикалы может
не низка и этот факт сдерживает ее использование
быть использована при создании антиоксидантов
как среды для синтеза фуллеренсодержащих сое-
нейрозащитного действия [1-3]. В основе его
динений. Поэтому синтез производных фуллерена
антиокислительных свойств лежит электроноде-
с улучшенной растворимостью является задачей
фицитность молекул и легкость присоединения
первостепенной важности. Так как основным
радикальных частиц. Необходимо отметить, что
источником активных форм кислорода в клетке
антиоксидантное действие присуще не только
являются митохондрии, синтез липофильных
самому фуллерену, но и его производным, при-
митохондриально-адресованных антиоксидантов
чем как in vitro, так и in vivo [4]. Соединения
представляется ключевой проблемой. Располагая
фуллерена, введенные в организм животных, су-
положительным опытом синтеза конъюгатов
щественно повышают их устойчивость к окис-
фуллерена С60 с улучшенной растворимостью
лительным стрессам и препятствуют протека-
в органических растворителях, полученных на
нию нейродегеративных процессов. Как представ-
основе алленоатов различных кислот и проявивших
ляется, систематический прием таких препаратов
выраженную антиокислительную активность
поможет снизить риск возникновения заболеваний
[5, 6], мы продолжили исследования в этой области.
человека, связанных с высоким уровнем свобод-
ных радикалов в организме (например, болезнь
Настоящая работа касается синтеза неопи-
Альцгеймера и болезнь Паркинсона).
санных в литературе липофильных конъюгатов
Молекулярное строение С60 обуславливает воз-
фуллерена С60 с участием аллеонатов лауриновой,
можность растворения в типовых органических
миристиновой, стеариновой и бегеновой кислот в
растворителях, что важно для проведения хи-
результате процессов [3+2]-циклоприсоединения.
1076
СИНТЕЗ НОВЫХ ЛИПОФИЛЬНЫХ ЦИКЛОПЕНТЕНОФУ
ЛЛЕРЕНОВ С60
1077
Схема 1. Синтез алленоатов на основе жирных кислот.
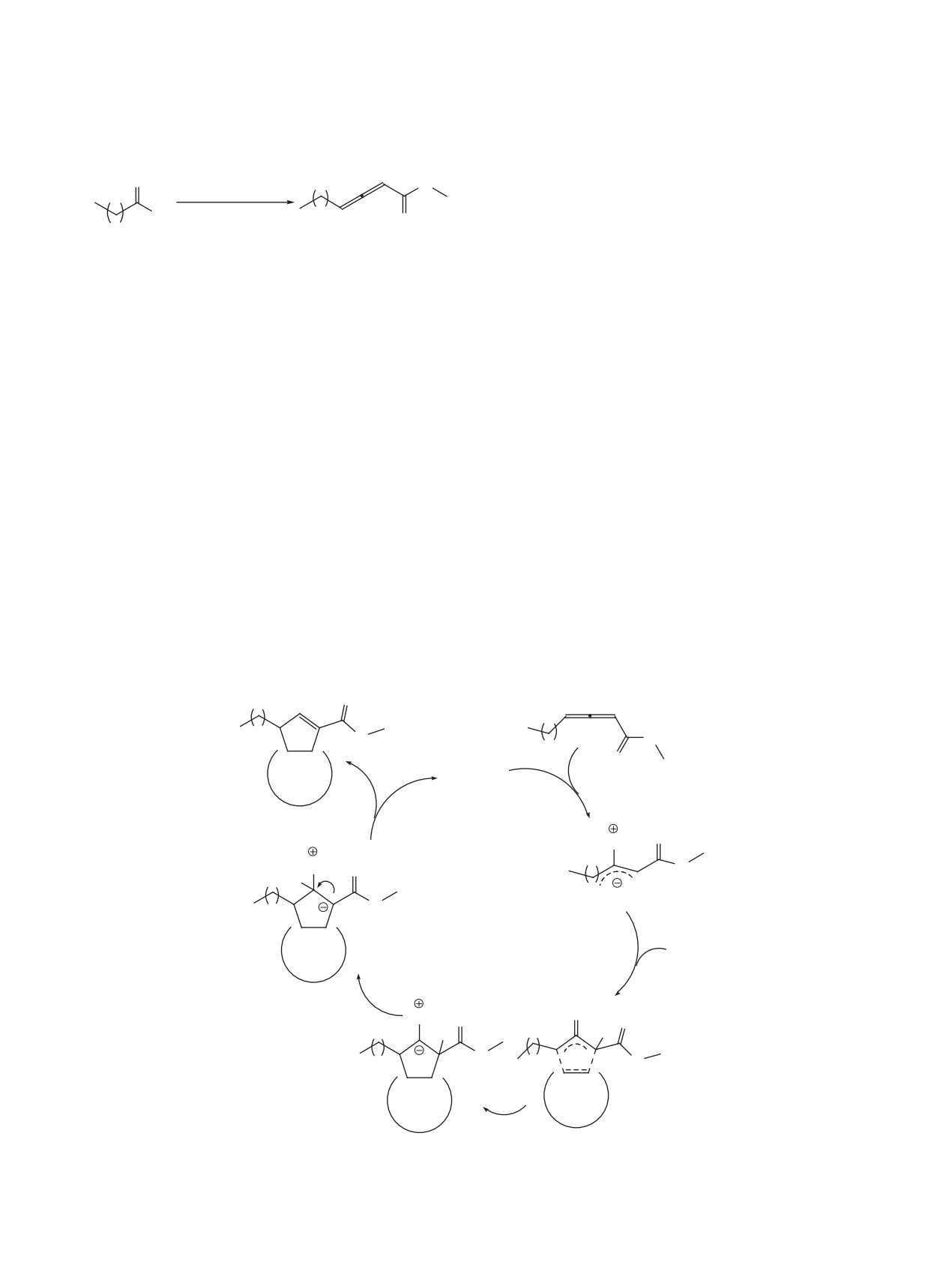
циклопентенофуллерены. Причем, процесс начи-
1. SOCl2
нается с нуклеофильной атаки центрального ато-
O
O
2. Ph3P=CHCO2Me
ма углерода алленоата фосфином, что приводит
OH
n-1
к цвиттер-ионному интермедиату. Далее послед-
n
O
ний, выступающий в роли 1,3-диполя, атакует по
1a-d
2a-d
двойной связи С60 и возникает пятичленный фос-
1, 2, n = 10 (a), n = 12 (b), n = 16 (c), n = 20 (d).
форный илид, который в результате элиминирова-
ния катализатора преобразуется в целевой аддукт
Алленоаты 2a-d синтезировали олефинирова-
(схема 2) [5].
нием кетенов фосфониевым илидом по Виттигу
(схема 1).
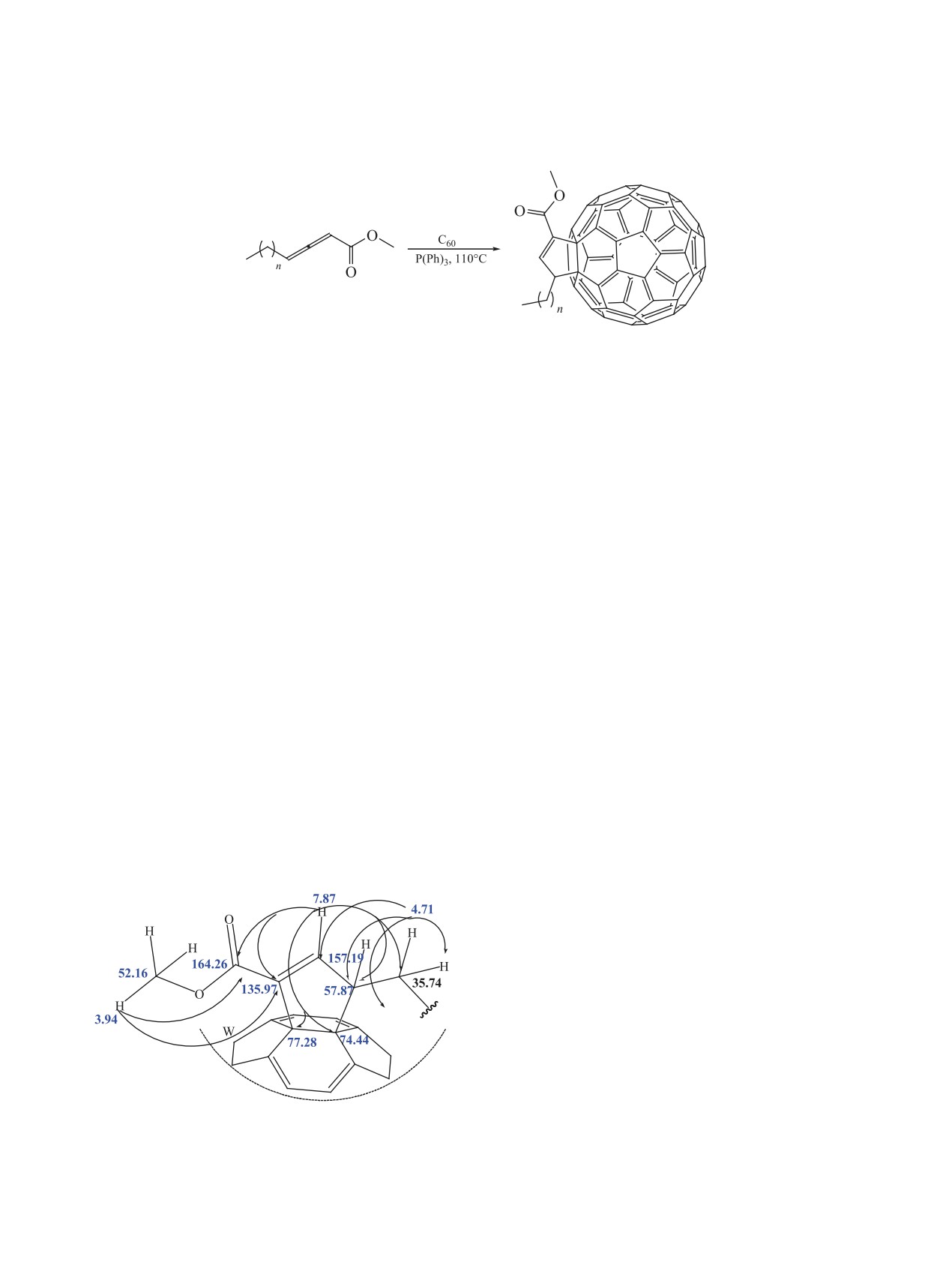
В условиях реакции Moрита-Бейлиса-Хилмана
по методике [5] из алленоатов 2a-d в среде толу-
Строение соединений
2а-d доказано cпек-
тральными методами анализа. В спектре ЯМР
ола синтезировали новые, хорошо растворимые в
типовых органических растворителях моноаддук-
1Н характерные сигналы 2 протонов алленового
фрагмента наблюдали в области от δ 5.53 до
ты фуллерена С60 3a-d (схема 3). У выделенных
5.61 м.д. В спектре ЯМР 13С характерные сигналы
продуктов обнаружена умеренная способность
терминальных алленовых углеродов отмечали
растворяться в растительных маслах с образова-
в области от δ 87.81 до 95.38 м.д. В области δ
нием 10% растворов.
212.36 м.д. присутствует сигнал центрального
Структуры индивидуально выделенных соеди-
алленового углеродного атома [6-9].
нений были подтверждены набором физико-хими-
Данные литературы [10-12] свидетельствуют
ческих методов, включая HSQC и HMBC ЯМР 2D
о том, что в результате фосфин-катализируемого
эксперименты. Корреляции Heteronuclear Multiple
[3+2]-присоединения алленоатов к фуллереново-
Bond Correlation в циклопентеновом фрагменте
му каркасу как диполярофилу, образуются новые
соединения 3a представлены на рисунке.
Схема 2. Механизм фосфин-катализируемого [3+2]-циклоприсоединения алленоатов к фуллерену.
O
n
O
n
O
O
C60
PPh3
O
PPh3
PPh3
O
O
H
n
n
O
C60
C60
PPh3
PPh3
O
O
H
H
n
O
n
O
C
60
C60
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1078
МУХАМЕТЬЯНОВА и др.
Схема 3. Синтез циклопентенофуллеренов C60 3a-d.
2a-d
3a-d
3a-d, n = 9 (a), n = 12 (b), n = 15 (c), n = 19 (d).
Как видно из рисунка, имеет место корреляция
Shimadzu, Япония) в вазелиновом масле. Спектры
протонов циклопентенового фрагмента со всеми
ЯМР получали на спектрометре Bruker-AM
соседними атомами углерода. Однако взаимодей-
500 (Германия) с рабочей частотой 500.13 (1Н),
ствие протона при алкильном фрагменте молеку-
125.76 (13С) МГц, внутренний стандарт - тетраме-
лы с углеродом в фуллереновой сфере, резонирую-
тилсилан. С целью корректного отнесения сигна-
щем при 77.28 м.д., не отмечается. Наблюдаемый
лов в спектрах ЯМР для продуктов реакций при-
эффект можно объяснить тем, что двугранный
меняли методы гомо- и гетероядерной двумерной
угол плоскости расположен перпендикулярно по
корреляции COSY, NOESY, HSQC и HMBC. Ход
отношению к этим атомам.
реакции контролировали методом ТСХ на пла-
В результате фосфин-катализируемого [3+2]-
стинках Sorbfil ПТСХ-АФ-А, вещества обнару-
циклоприсоединения алленоатов жирных кислот
живали с помощью УФ-облучения, паров йода,
к ядру С60 синтезированы неописанные в лите-
опрыскивания пластинок раствором нингидрино-
ратуре конъюгаты фуллерена. Полученные
вого проявителя с последующим нагреванием при
циклопентафуллерены отличаются улучшенной
100-120°С. Масс-спектры MALDI регистрирова-
растворимостью в типовых органических раст-
ли на масс-спектрометре ULTRAFLEX III (Bruker
ворителях, и в растительных маслах, в ко-
Daltonik GmbH, Бремен, Германия) в линейном
торых их концентрация достигает
10%.
режиме с использованием п-нитроанилина в каче-
Циклопентафуллерены можно использовать для
стве матрицы. Температуру плавления определяли
разработки липофильных антиоксидантов нового
на нагревательном столике Buetius с наблюдатель-
поколения.
ным устройством PHMK 05 фирмы VEBAnalytik
(Россия). Продукты реакции выделяли с помо-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
щью колоночной хроматографии на силикагеле
ИК спектры регистрировали на приборе IR-
«Chemapol» (Германия) с размером частиц 40/100
Prestige-21 (Fourier Transform Spectrophotometer -
и 100/160 мкм. Хлористый метилен, этилацетат
перегоняли над P2O5. Толуол, петролейный эфир,
бензол, кипятили и перегоняли над натрием.
Хлористый тионил, триэтиламин (Aldrich) исполь-
зовали без дополнительной очистки.
Общая методика получения алленоатов ме-
жмолекулярной реакцией Виттига. К суспен-
зии 6.25 ммоль кислоты в 15 мл сухого бензола
добавляли 31.25 ммоль (2.34 мл) хлористого ти-
онила. Смесь кипятили с обратным холодильни-
ком с хлоридкальциевой трубкой в течение 3 ч.
Растворитель и избыток хлористого тионила от-
Данные корреляции HMBC для циклопентенового
фрагмента в молекуле 3a.
деляли на роторном испарителе. Хлорангидрид
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ НОВЫХ ЛИПОФИЛЬНЫХ ЦИКЛОПЕНТЕНОФУ
ЛЛЕРЕНОВ С60
1079
далее использовали без дополнительной очистки.
(С13Н2), 28.94 (С15Н2), 29.34 (С14Н2), 29.35 (С4Н2),
К раствору 6.25 ммоль (2 г) метил(трифенилфос-
29.58 (С5Н2), 29.63 (С6,8,9Н2), 29.65 (С10Н2), 29.68
форанилиден)ацетата в CH2Cl2 прикапывали эк-
(С11,12Н2), 31.91 (С3Н2), 51.81 (OСH3), 87.83 (=СН),
вимольное количество Et3N, раствор охлаждали
95.37 (=СН), 166.60 (С=О), 212.35 (=С=). Найдено,
до -10°С. К этому раствору медленно по каплям
%: С 78.18; H 11.87. C21H38O2. Вычислено, %: С
добавляли охлажденный раствор хлорангидрида
78.20; H 11.88; O 9.92. М 322.525.
кислоты. Реакционную массу перемешивали в те-
Метилтетракоза-2,3-диеноат (2d). Белое кри-
чение 0.5 ч, а далее 4-6 ч выдерживали при 0°C.
сталлическое вещество. Выход 2.06 г (87%). ИК
Растворитель отгоняли, продукты реакции выде-
спектр, ν, см-1: 1962 (С=С=С), 1722 (СО). Спектр
ляли в индивидуальном виде с помощью колоноч-
ЯМР 1H (CDCl3), δ, м.д.: 0.87-0.90 м (3Н, СН3), 1.25
ной хроматографии на силикагеле (элюент петро-
с (18Н, 9С8-16Н2), 1.34-1.38 м (2Н, С2Н2), 1.43-1.46
лейный эфир-этилацетат, 4:1).
м (16Н, 8СН2), 2.12 м (2Н, С20Н2), 3.72 c (3Н, СН3),
Метилтетрадека-2,3-диеноат (2a). Прозрачное
5.57-5.61 м (2Н, 2НС=). Спектр ЯМР 13C (CDCl3),
масло. Выход 0.79 г (53%). ИК спектр, ν, см-1: 1955
δ, м.д.: 14.05 (СH3), 22.64 (С2Н2), 27.43 (С16-20Н2),
(С=С=С), 1724 (СО). Спектр ЯМР 1H (CDCl3), δ,
28.65 (С13Н2), 28.91 (С15Н2), 29.31 (С14Н2), 29.55
м.д.: 0.86 т (3Н, С1Н3), 1.25-1.34 м (14Н, С2-8Н2),
(С4Н2), 29.59 (С5Н2), 29.65 (С6-12Н2), 31.88 (С3Н2),
1.45-1.46 м (2Н, С9Н2), 2.12-2.15 м (2Н, С10Н2),
51.83 (OСH3), 87.82 (=СН), 95.38 (=СН), 166.64
3.72 c (3Н, СН3), 5.56-5.62 м (2Н, 2НС=). Спектр
(С=О), 212.33 (=С=). Найдено, %: С 79.32; H 12.27.
ЯМР 13C (CDCl3), δ, м.д.: 14.03 (СH3), 22.62 (С2Н2),
C25H46O2. Вычислено, %: С 79.30; H 12.25; O 8.45.
27.42 (С8Н2), 28.63 (С9Н2), 28.90 (С10Н2), 29.18
М 378.6315.
(С4Н2), 29.28 (С5Н2), 29.38 (С7Н2), 29.53 (С6Н2),
31.84 (С3Н2), 51.84 (OСH3), 87.81 (=СН), 95.38
Методика получения циклопентенофулле-
ренов С60 3a-d. Фуллерен С60 (0.1 г, 0.14 ммоль)
(=СН), 166.65 (С=О), 212.33 (=С=). Найдено, %: С
75.60; H 11.00. C15H26O2. Вычислено, %: С 75.58;
растворяли в 35 мл толуола. Через 12 ч добавля-
H 10.99; O 13.42. М 238.3657.
ли раствор, состоящий из 0.14 ммоль алленоата,
5 мл толуола и эквимольного количества PPh3.
Метилгептадека-2,3-диеноат (2b). Прозрачное
Полученную смесь кипятили в течение 12 ч.
масло. Выход 1.40 г (80%). ИК спектр, ν, см-1: 1962
Соединения 3a-d выделяли с помощью колоноч-
(С=С=С), 1722 (СО). Спектр ЯМР 1H (CDCl3),
ной хроматографии (элюент - толуол, петролей-
δ, м.д.: 0.86 т (3Н, С1Н3), 1.14-1.39 м (20Н,
ный эфир-этилацетат, 4:1).
С2-8,11-13Н2), 1.46-1.48 м (2Н, С9Н2), 2.12-2.14 м
(2Н, С10Н2), 3.94 c (3Н, СН3), 5.53-5.58 м (2Н,
1'-Метилкарбонил-3'-метилтетрадека-1-
2НС=). Спектр ЯМР 13C (CDCl3), δ, м.д.: 14.06
циклопентено[4',5':1,2][60]фуллерен
(3a). Вы-
(СH3), 22.67 (С2Н2), 28.67 (С13Н2), 28.94 (С7Н2),
ход 40 мг (30%). Спектр ЯМР 1H (CDCl3), δ, м.д.:
29.35 (С4Н2), 29.58 (С5Н2), 29.63 (С6,8,9Н2), 29.65
0.86 т (3Н, С1Н3), 1.14-1.39 м (14Н, С2-8Н2), 1.46
(С10Н2),
29.68 (С11,12Н2),
31.91 (С3Н2),
51.88
м (2Н, С9Н2), 2.12 м (2Н, С10Н2), 3.94 c (3Н, СН3),
(OСH3), 87.83 (=СН), 95.10 (=СН), 166.61 (С=О),
4.71-4.74 м (1Н, СН), 7.87-7.90 м (1Н, =СН).
212.36
(=С=). Найдено, %: С 77.10; H 11.52.
Спектр ЯМР 13C (CDCl3), δ, м.д.: 14.16 (СH3), 22.71
C18H32O2. Вычислено, %: С 77.09; H 11.50; O
(С2H2), 28.57 (С9H2), 29.37 (С8H2), 29.58 (С5H2),
11.41. М 280.4455.
29.64 (С7H2), 29.70 (С6H2), 29.88 (С4H2),
31.92
Метиликоза-2,3-диеноат (2c). Прозрачное мас-
(С3H2), 35.74 (С11H2), 52.16 (OСH3), 57.87 (CH),
ло. Выход 1.67 г (83 %). ИК спектр, ν, см-1: 1953
74.44, 77.28, 132.96, 133.65, 133.98, 135.34, 135.70,
(С=С=С), 1723 (СО). Спектр ЯМР 1H (CDCl3), δ,
135.97, 140.21, 141.57, 141.93, 142.19, 142.41(=CH),
м.д.: 0.85 м (3Н, СН3), 1.23 с (10Н, 5СН2), 1.31-
142.60,
142.72,
143.11,
144.46,
144.87,
144.98,
1.34 м (2Н, С13Н2), 1.39-1.40 м (2Н, С2Н2), 1.41-
145.17, 145.96, 146.19, 146.27, 147.25, 147.34,
1.44 м (14Н, 8СН2), 2.11 м (2Н, С15Н2), 3.70 c (3Н,
148.15, 148.31, 157.19, 164.26 (С=O). Найдено, %:
СН3), 5.55-5.59 м (2Н, 2НС=). Спектр ЯМР 13C
С 93.90; H 3.32. C75H26O2. Вычислено, %: С 93.93;
(CDCl3), δ, м.д.: 14.06 (СH3), 22.67 (С2Н2), 28.67
H 2.73; O 3.34. М 959.0077.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1080
МУХАМЕТЬЯНОВА и др.
1'-Метилкарбонил-3'-метилгептадека-1-
(3Н, С1Н3), 1.28 с (18Н, 9С8-16Н2), 1.39-1.41 м (2Н,
циклопентено[4',5':1,2][60]фуллерен
(3b). Вы-
С2Н2), 1.43-1.55 м (16Н, 8СН2), 2.37-2.40 м (2Н,
ход 57 мг (41%). Спектр ЯМР 1H (CDCl3), δ, м.д.:
С20Н2), 3.95 c (3Н, СН3), 4.71-4.74 м (1Н, СН),
0.86 т (3Н, С1Н3), 1.14-1.39 м (14Н, С2-8Н2), 1.46-
7.72-7.74 м (1Н, =СН). Спектр ЯМР 13C (CDCl3),
1.49 м (2Н, С9Н2), 2.12-2.14 м (2Н, С10Н2), 3.94
δ, м.д.: 14.14 (СH3), 22.70 (С2Н2), 28.59 (С19Н2),
c (3Н, СН3), 4.71 м (1Н, СН), 7.87 м (1Н, =СН).
29.37 (С4,17,18Н2), 29.67 (С5,16Н2), 29.73 (С6,8-15Н2),
Спектр ЯМР 13C (CDCl3), δ, м.д.: 14.17 (СH3),
29.90 (С7Н2), 31.93 (С3Н2), 35.73 (С20Н2), 52.12
22.72 (С2Н2), 28.63 (С13Н2), 28.94 (С15Н2), 29.34
(OСH3), 57.87 (СH), 128.20, 128.45, 128.50, 128.55,
(С14Н2), 29.41 (С4Н2), 29.58 (С5Н2), 29.71 (С6,8,9Н2),
128.72, 131.97, 132.06, 132.14, 133.64, 133.79,
29.77 (С10Н2),
29.95 (С11,12Н2),
31.96 (С3Н2),
133.99, 135.34, 135.72, 135.97, 137.01, 137.09,
52.20 (СH), 57.88 (OСH3), 74.42, 128.59, 129.65,
139.19, 139.32, 139.68, 140.21, 141.55, 141.61,
131.77, 131.93, 132.00, 132.01, 132.06, 132.14,
141.88,
141.91,
141.97,142.13,
142.18,
142.23,
132.76, 134.00, 135.27, 135.74, 135.97, 139.19,
142.40 (=CH), 142.63,142.69, 143.05, 143.10, 144.39,
139.33, 139.69, 140.22, 141.54, 141.62, 141.87,
144.45, 144.49, 144.86, 144.97, 145.07, 145.16,
141.93,
142.14,
142.19,
142.40
(=CH),
142.71,
145.29, 145.34, 145.44, 145.55, 145.91, 145.94,
146.07, 146.17, 146.25, 146.32, 146.34, 147.22,
143.08, 144.39, 144.47, 144.86, 144.97, 145.10,
145.18, 145.30, 145.34, 145.42, 145.35, 145.96,
147.32, 148.15, 148.15, 150.81, 151.08, 153.03,
157.17, 164.17 (С=O). Найдено, %: С 92.89; H 4.21.
146.07, 146.15, 146.26, 146.38, 148.18, 148.35,
C85H46O2. Вычислено, %: С 92.87; H 4.22; O 2.91.
157.37, 166.21 (С=O). Найдено, %: С 93.56; H 3.23.
М 1099.2735.
C78H32O2. Вычислено, %: С 93.58; H 3.22; O 3.20.
М 1001.0875.
КОНФЛИКТ ИНТЕРЕСОВ
1'-Метилкарбонил-3'-метиликоза-1-цик-
Авторы заявляют об отсутствии конфликта ин-
лопентено[4',5':1,2][60]фуллерен
(3c). Выход
тересов.
75 мг (52%). ЯМР 1H (CDCl3), δ, м.д.: 0.87 т (3Н,
СПИСОК ЛИТЕРАТУРЫ
С1Н3), 1.25 с (8Н, 4СН2), 1.39-1.41 м (2Н, С2Н2),
1.41 м (2Н, С13Н2), 1.42-1.44 м (14Н, 8СН2), 1.92-
1. Думпис М.А., Николаев Д.Н., Литасова Е.В.,
1.96 м (2Н, С15Н2), 3.93 c (3Н, СН3), 4.71-4.75 м
Ильин В.В., Брусина М.А., Пиотровский Л.Б.
(1Н, СН), 7.86-7.90 м (1Н, =СН). Спектр ЯМР
Обзоры по клин. фармакол. и лек. тер. 2018, 16,
13C (CDCl3), δ, м.д.: 14.20 (СH3), 22.74 (С2Н2),
4-20. doi 10.17816/RCF1614-20
28.63 (С13Н2), 28.94 (С15Н2), 29.34 (С14Н2), 29.41
2. Wharton T., Wilson L.J. Bioorg. Med. Chem. 2002, 10,
(С4Н2),
29.58 (С5Н2),
29.71 (С6,8,9Н2),
29.77
3545-3554. doi 10.1016/s0968-0896(02)00252-3
(С10Н2),
29.95 (С11,12Н2),
31.96 (С3Н2),
52.20
3. Трошина О.А. Дис. … канд. хим. наук. Черноголов-
(СH), 57.88 (OСH3), 74.42, 128.59, 129.65, 131.77,
ка. 2007.
131.93, 132.00, 132.01, 132.06, 132.14, 132.76,
4. Injac R., Prijatelj M., Strukelj B. Oxidative Stress
134.00, 135.27, 135.74, 135.97, 139.19, 139.33,
and Nanotechnology. Methods in Molecular Biology
139.69, 140.21, 141.55, 141.61, 141.89, 141.92,
(Methods and Protocols), Eds. D. Armstrong, D.J.
141.98,
142.14,
142.18,
142.23,
142.40
(=CH),
Bharali. New York: Springer Science + Business Media.
142.63, 142.69, 143.05, 143.10, 144.40, 144.44,
2013, 1028, 75-100. doi 10.1007/978-1-62703-475-3
144.88, 144.97, 145.07, 145.16, 145.29, 145.33,
5. Sakhautdinov I.M., Malikova R.N., Biglova Yu.N.,
145.44, 145.56, 145.94, 146.07, 146.17, 146.25,
Khusnutdinov R.A., Gumerov A.M., Khamitov E.M.,
146.35, 147.22, 147.32, 148.15, 148.28, 148.36,
Ivanov S.P., Yunusov M.S. J. Iran. Chem. Soc. 2018,
157.17, 164.21 (С=O). Найдено, %: С 93.28; H 3.65.
15, 1975-1985. doi 10.1007/s13738-018-1395-y
C81H38O2. Вычислено, %: С 93.26; H 3.67; O 3.07.
6. Мухаметьянова А.Ф., Сахаутдинов И.М., Нугума-
М 1043.1672.
нов Т.Р., Юнусов М.С. ЖОрХ. 2019, 55, 742-746.
1'-Метилкарбонил-3'-метилтетракоза-1-
doi 10.1134/S0514749219050112 [Sakhautdinov I.M.,
циклопентено[4',5':1,2][60]фуллерен
(3d). Вы-
Mukhametyanova A.F. Russ. J. Org. Chem. 2019, 55,
ход 55 мг (36%). ЯМР 1H (CDCl3), δ, м.д.: 0.91 т
1280-1286.] doi 10.1134/S1070428019090033
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ НОВЫХ ЛИПОФИЛЬНЫХ ЦИКЛОПЕНТЕНОФУ
ЛЛЕРЕНОВ С60
1081
7. Elshater A.A., Haridy MAM, Salman MMA,
10. Girón R. M., Reboredo S., Marco-Martínez J.,
Fayyad A.S., Hammad S. Biomed. Pharmacother.
Filippone S., Martín N. Faraday Discuss. 2014, 173,
2018, 97, 53-59. doi 10.1016/j.biopha.2017.10.134
311-322. doi 10.1039/c4fd00065j
8. Krause N., Hashmi A.S., Weinheim K. Modern Allene
11. Shu L.H., Sun W.Q., Zhang D.W., Wu Sh.H.,
Chemistry. Weinheim: WILEY-VCH Verlag GmbH
Wu H.M., Xu J.F., Lao X.F. Chem. Commun. 1997, 1,
and Co. 2004, 401-406.
79-80.
9. Ikuma N., Inaba S., Kokubo K., Oshima T. Chem.
12. Marco-Martnez J., Marcos V., Reboredo S.,
Commun.
2014,
50,
581-583. doi
10.1039/
Filippone S., Mart N. Angew. Chem. Int. Ed. 2013,
C3CC45783D
52, 5115-5119. doi 10.1002/anie.201301292
Synthesis of New Lipophilic Cyclopentenofullerenes C60 Based
on Fatty Acid Allenoates
A. F. Mukhametyanovaa, I. M. Sakhautdinova, *, T. R. Nugumanova, and Y. N. Biglovab
a Ufa Institute of Chemistry, Russian Academy of Sciences,
450054, Russia, Republic of Bashkortostan, Ufa, pr. Oktyabrya 69
*e-mail: ioh039@mail.ru
b Department of Chemistry, Bashkir State University, 450054, Russia, Republic of Bashkortostan, Ufa, ul. Z. Validi 32
Received February 25, 2020; revised April 20, 2020; accepted April 21, 2020
Synthesized fatty acid allenoates. As a result of phosphine-catalyzed [3+2]-addition of allenoates to the fullerene
frame, new lipophilic monoadducts of fullerene C60 were obtained.
Keywords: [3+2]-cycloaddition, fatty acids, allens, Wittig reaction, cyclopentenofullerenes, fullerene C60,
amino acids
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020