ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1082-1091
УДК 547.796.1
ОСОБЕННОСТИ АЛКИЛИРОВАНИЯ
5-R-ТЕТРАЗОЛОВ СПИРТАМИ РАЗЛИЧНЫХ ТИПОВ
В СРЕДЕ ЭФИРАТА ТРЕХФТОРИСТОГО БОРА
И 1,2-ДИХЛОРЭТАНА
© 2020 г. С. А. Егоров*, М. А. Ищенко, Я. В. Прокопович, В. И. Иванова
ФГБОУ ВО «Санкт-Петербургский государственный технологический институт (технический университет)»,
190013, Россия, г. Санкт-Петербург, Московский пр. 26
*e-mail: sergey.egorov93@mail.ru
Поступила в редакцию 22 февраля 2020 г.
После доработки 21 апреля 2020 г.
Принята к публикации 21 апреля 2020 г.
Исследовано алкилирование 5-R-тетразолов первичными, вторичными, третичными спиртами, а так-
же спиртами бензилового и аллилового типа в среде эфирата трехфтористого бора и 1,2-дихлорэтана.
Предельные первичные и вторичные спирты не способны алкилировать тетразолы в данной системе.
Третичные спирты (трет-бутиловый спирт, адамантанол-1) региоселективно алкилируют 5-R-тетразолы
с выходами 70-85% 2-изомеров. Бензиловый спирт региоселективно алкилирует 1H-тетразол с выходом
55%. Изучены закономерности алкилирования 1H-тетразола спиртами аллилового типа в зависимости
от строения алкилирующего агента.
Ключевые слова: тетразол, эфират трехфтористого бора, региоселективное алкилирование, спирты.
DOI: 10.31857/S0514749220070125
Тетразолы являются ценными продуктами ор-
лов являются радиопротекторами и обладают про-
ганического синтеза. Данный класс соединений
тивоопухолевым эффектом [12, 13]. Множество
особо интересен с точки зрения энергетических,
других потенциальных и уже доказанных эффек-
фармакологических свойств. Это обусловлено вы-
тов различных соединений тетразола найдено в
сокой энтальпией образования, содержанием азота
области медицинской химии [14, 15].
и биологической активностью тетразольного цик-
Помимо указанных выше областей, тетразолы
ла.
применяются в ряде других сфер: ионообменные
Энергетические характеристики позволяют
мембраны [16], координационные полимеры [17],
применять тетразолсодержащие соединения в ка-
фоточувствительные полимеры [18], катализ [19,
честве первичных [1, 2] и вторичных взрывчатых
20], ионные жидкости [21], ингибиторы коррозии
веществ [3, 4], связующих [5] и энергоемких до-
и др. [22, 23].
бавок [6] для порохов и твердых ракетных топлив.
Из сказанного выше следует, что расширение
Фармацевтические субстанции на основе тет-
знаний о химии тетразолов является актуальной
разолов проявляют противовирусную активность
задачей.
[7], противогрибковое [8], антибактериальное и
гипотензивное действие [9, 10], а также они приме-
Алкилирование
5-R-тетразолов
3-хлорбу-
нимы для лечения некоторых кожных заболеваний
тен-2-олом-1 в среде эфирата трехфтористого бора
[11]. Вероятно, некоторые производные тетразо-
и 1,2-дихлорэтана рассматривалось нами ранее
1082
ОСОБЕННОСТИ АЛКИЛИРОВАНИЯ 5-R-ТЕТР
АЗОЛОВ СПИРТАМИ РАЗЛИЧНЫХ ТИПОВ
1083
[24]. Установлено, что в случае 3-хлорбутен-2-
Ph (соединения 1c и 2c). В случае с 5-аминотет-
ола-1 данная система значительно более эффек-
разолом продуктов алкилирования получено не
тивна по сравнению с такими протонными кисло-
было, что связано, по-видимому, с взаимодействи-
тами, как фосфорная, трифторуксусная и серная,
ем трифторида бора с аминогруппой и, как след-
что достигается за счет мягкости кислотного аген-
ствие, дезактивацией тетразольного цикла. При
та и высокой кислотности системы.
анализе спектров ЯМР продуктов алкилирования
1-N-изомеров тетразолов не обнаружено. Высокая
В связи с этим решено продолжить исследова-
реакционная способность данных спиртов связана
ния в данной области, чтобы расширить диапазон
с эффективной стабилизацией третичных карбка-
применения системы, а также изучить законо-
тионов.
мерности алкилирования тетразолов различными
спиртами с целью обобщения и объяснения фено-
Реакционную способность спиртов при кислот-
мена взаимодействия первичного спирта 3-хлор-
но-катализируемом алкилировании исследовали
бутен-2-ола-1 с тетразолами.
дополнительно на примере бензилового и салици-
лового спиртов.
Объектами исследования являлись первичные,
вторичные, третичные спирты, спирты аллилового
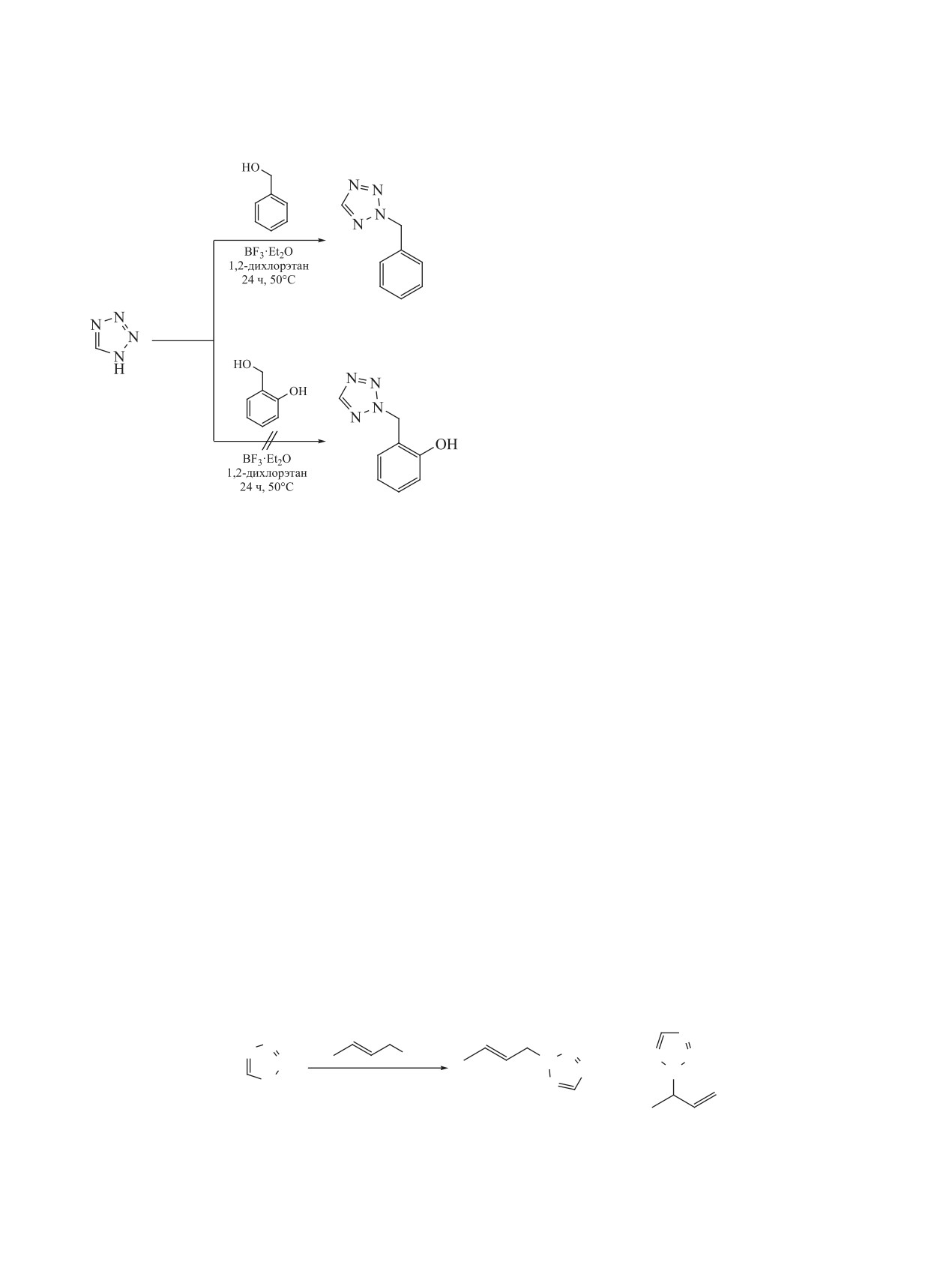
Установлено, что бензиловый спирт при темпе-
типа, а также бензиловый и салициловый спирты.
ратуре 55°С в течение 24 ч алкилирует 1H-тетразол
с выходом 46% (схема 2). При комнатной темпера-
Первичные и вторичные спирты - пропанол-1,
туре и выдержке в течение 3 сут выход достигал
бутанол-1, пропанол-2 и бутанол-2 - не способны
35%. Необходимо заметить, что в протонных кис-
алкилировать тетразолы в исследуемой системе,
лотных системах бензиловый спирт либо разла-
что связано с низкой степенью стабилизации обра-
гается (серная кислота), либо не взаимодействует
зующихся карбкатионов.
с тетразолом (трифторуксусная, фосфорная кис-
Установлено, что из предельных алифатиче-
лоты).
ских спиртов только третичные спирты алкилиру-
Неожиданным оказался результат в случае с
ют тетразолы в среде эфирата трехфтористого бора
салициловым спиртом. Данный спирт не алкили-
и 1,2-дихлорэтана при комнатной температуре
рует 1H-тетразол в используемой системе ни при
(схема 1). Это показано на примере трет-бу-
комнатной температуре, ни при кипячении. При
тилового спирта и адамантанола-1. Выходы
добавлении салицилового спирта к раствору эфи-
2-N-изомеров составляли 70-80% при R = H
рата трехфтористого бора выпадает осадок розо-
(соединения 1a и 2a), Me (соединения 1b и 2b),
вого цвета. По-видимому, образуется комплекс
Схема 1.
трифторида бора и салицилового спирта. При за-
OH
мене растворителя с 1,2-дихлорэтана на диэтило-
N
N
вый эфир, в котором осадок растворим, реакция с
N N
N
N
1H-тетразолом также не привела к образованию
N
1,2-дихлорэтан
R
N
H
BF3·Et2O
R
продукта алкилирования. Данный факт можно
20-25°C, 48 ч
объяснить влиянием фенольной гидроксильной
1a-c
2a-c
группы, которая, по-видимому, дезактивирует
спиртовый гидроксил и не позволяет ему вступать
OH
R
в реакцию с эфиратом трехфтористого бора.
N
N
N
N
Большую долю в нашем исследовании зани-
N
N
N
мало изучение спиртов аллилового типа. Как уже
N
1,2-дихлорэтан
R
было сказано, алкилирование тетразолов одним из
H
BF3·Et2O
20-25°C, 48 ч
спиртов данного класса - 3-хлорбутен-2-олом-1 -
прошло достаточно успешно (выходы составляли
1a-c
3a-c
75-85% для 5-R = H, Me, Ph, региоселективность
R = H, Me, Ph.
по 2-N-изомеру превышала 99%).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1084
ЕГОРОВ и др.
(схема 3) и сравнив его со строением 3-хлорбу-
Схема 2.
тен-2-ола-1, можно заметить, что все непрореа-
гировавшие спирты сходны между собой отсут-
ствием метильной группы при двойной связи. В
то же время отсутствие метильной группы отли-
чает их от 3-хлорбутен-2-ола-1. Единственный
спирт из приведенного списка, который содержит
метильную группу при двойной связи, - кроти-
4
ловый спирт - алкилирует 1H-тетразол в среде
1,2-дихлорэтана и эфирата трехфтористого бора.
При этом в продуктах реакции обнаружено два
2-N-изомера, образованных за счет присоединения
1a
катиона тетразолия к атому 1 (5a) и 3 (5b) углерода
кротилового спирта с миграцией двойной связи во
втором случае в конец молекулы 5b (схема 3).
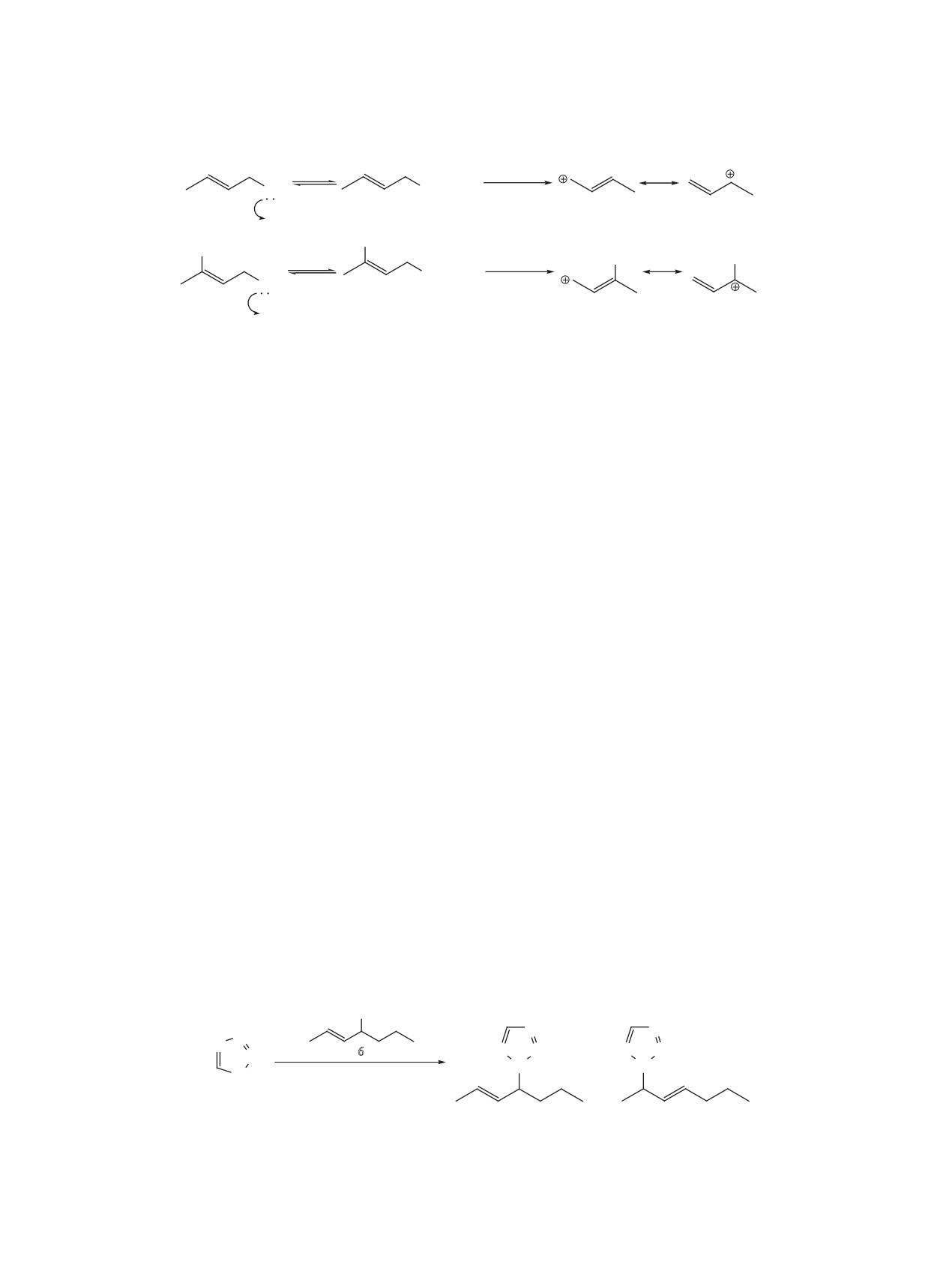
Можно говорить о значительном влиянии
метильной группы, находящейся при двойной
связи, в стабилизации промежуточно образую-
щегося карбкатиона за счет электронодонорных
Для этого факта очевидной кажется гипотеза
свойств метильной группы.
о стабилизации карбкатиона за счет мезомерного
эффекта с двойной связью. Если принять данную
В результате алкилирования тетразола кроти-
гипотезу как достаточную для исчерпывающего
ловым спиртом получили 2 изомера - 5a и 5b. В
объяснения, то можно предположить, что и любые
то же время алкилирование тетразола 3-хлорбу-
другие спирты аллилового типа будут алкилиро-
тен-2-олом дало только один изомер с терминаль-
вать тетразолы похожим образом. В действитель-
ным положением тетразольной группы. Сравнивая
ности это не совсем так.
результаты алкилирования 1H-тетразола 3-хлор-
В качестве объектов исследования исполь-
бутен-2-олом-1 и кротиловым спиртом, можно
зовали следующий список первичных спиртов:
прийти к следующему выводу. Атом хлора, нахо-
аллиловый спирт, бутен-2-диол-1,4,
4-хлорбу-
дящийся при двойной связи, влияет на изомер-
тен-2-ол-1, 4-бромбутен-2-ол-1, 2-хлорбутен-2-ди-
ный состав продуктов алкилирования. Когда атом
ол-1,4, 2-хлорпропен-2-ол-1, кротиловый спирт.
хлора находится в γ-положении по отношению к
гидроксильной группе (при двойной связи) при-
Ни один из перечисленных спиртов, кроме
соединения катиона тетразолия по γ-атому угле-
кротилового спирта, не алкилирует 1H-тетразол в
рода не происходит, что наблюдается в реакции
среде эфирата трехфтористого бора и 1,2-дихлор-
тетразола с 3-хлорбутен-2-олом-1. В то же время в
этана при комнатной температуре. Повышение
случае кротилового спирта, когда атома хлора нет,
температуры реакции в некоторых случаях приво-
образуются 2 изомера в соотношении, близком 1:1.
дило к получению целевого продукта в следовых
количествах, загрязненного большим количеством
Объяснение этому следующее (схема 4). В ре-
примесей. Проанализировав строение спиртов
зультате взаимодействия кротилового спирта с
Схема 3.
N
N
N
OH
N
N
N
N
N
N
+
N
N
1,2-дихлорэтан
N
H
BF3·Et2O
20-25°C, 48 ч
1a
5a
5b
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
ОСОБЕННОСТИ АЛКИЛИРОВАНИЯ 5-R-ТЕТР
АЗОЛОВ СПИРТАМИ РАЗЛИЧНЫХ ТИПОВ
1085
Схема 4.
-
OH
-Et2O
OH+BF3
-[BF3OH]
I
=
II
BF3·Et2O
Cl
Cl
Cl
Cl
-
OH+BF3
-[BF3OH]
OH
-Et2O
>>
III
IV
BF3·Et2O
эфиратом трехфтористого бора образуется катион,
разольный фрагмент присоединился к атому угле-
в реальную структуру которого вносят существен-
рода, при котором находилась гидроксильная
ный вклад обе резонансные структуры I и II. В
группа, с образованием дихлорпроизводного 9. В
случае 3-хлорбутен-2-ола-1 атом хлора, вероятно,
то же время «удаление» атома хлора (соединение
сильно снижает вклад резонансной структуры IV
10) приводит к образованию продукта терминаль-
в реальное распределение электронной плотности
ного присоединения тетразола и следовых коли-
катиона, поэтому для атаки катионом тетразолия
честв прямого замещения гидроксильной группы.
предпочтительным является α-углеродный атом по
Отсутствие продукта интернального присоедине-
отношению к гидроксильной группе.
ния тетразола можно объяснить отталкивающим
действием концевого атома хлора соединения 10.
Далее мы решили проверить, будут ли вести
себя вторичные спирты таким же образом, как кро-
Результатом работы является расширение зна-
тиловый спирт и 3-хлорбутен-2-ол-1, т.е. при ал-
ний о закономерностях кислотно-катализируемого
килировании тетразола давать смесь 2-N-изомеров
алкилирования тетразолов различными спиртами
или только один 2-N-изомер в зависимости от на-
и увеличение спектра применимости системы эфи-
личия или отсутствия атома хлора при двойной
рата трехфтористого бора и 1,2-дихлорэтана для
связи.
региоселективного алкилирования тетразолов. В
данной системе с высоким выходом и региоселек-
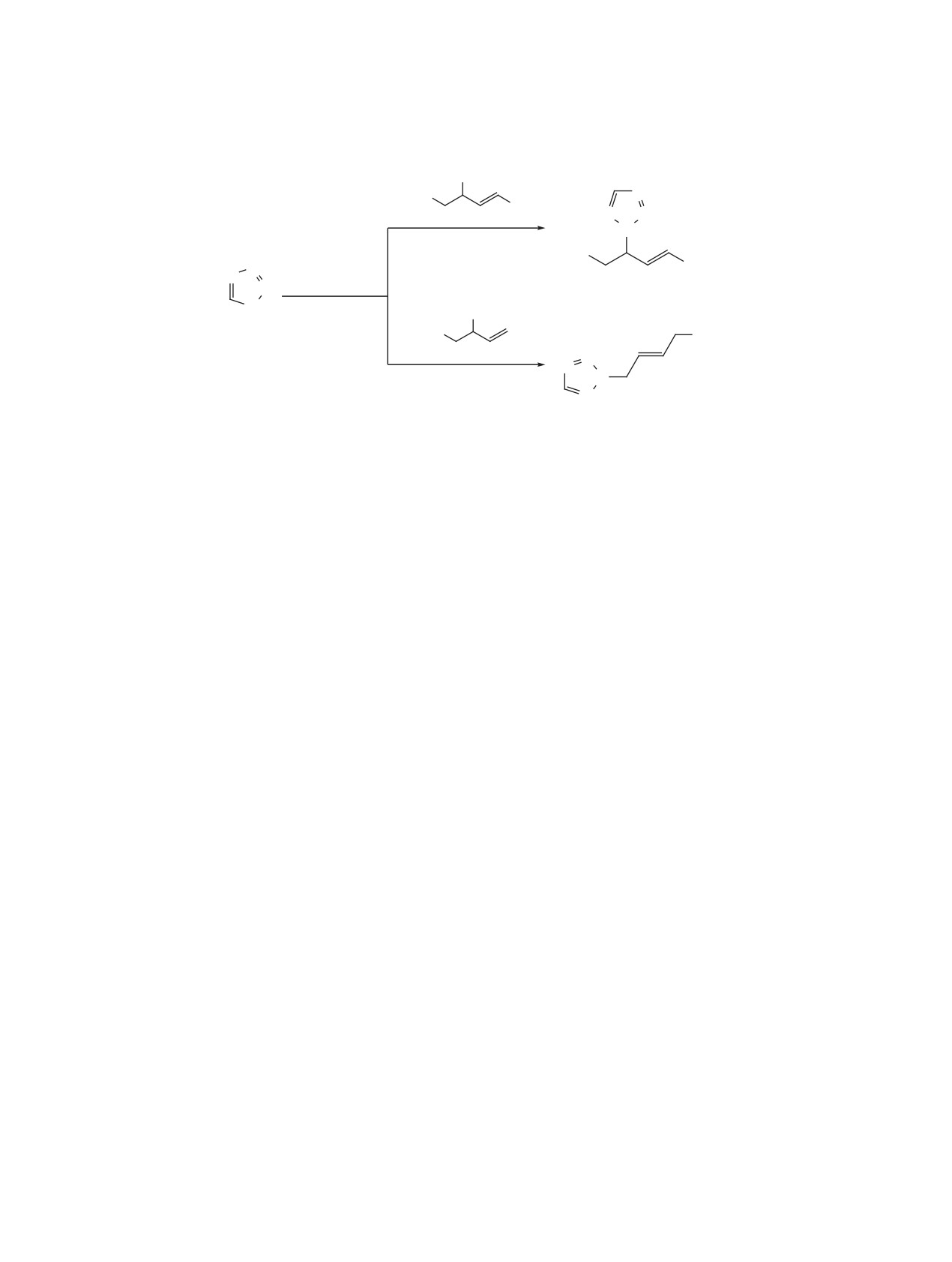
Примером вторичного спирта аллилового типа,
тивно алкилируют третичные спирты. Бензиловый
не содержащего атом хлора, был выбран гептен-
спирт алкилирует тетразол с выходом до 50%, что
2-ол-4. Алкилирование им
1H-тетразола, так
не является отличным результатом, но может быть
же как в случае с кротиловым спиртом, привело
использовано в практических целях. Исследованы
к образованию двух 2-N-изомеров в соотноше-
закономерности взаимодействия тетразолов со
нии, близком к 1:1, с суммарным выходом 41%
спиртами аллилового типа в зависимости от их
(схема 5).
строения. Установлено, что эффективно алкилиру-
Далее исследовали алкилирование 1H-тетра-
ют первичные спирты аллилового типа, у которых
зола 2 хлорсодержащими спиртами - 1,4-дихлор-
есть метильная группа в β-положении по отноше-
бутен-3-олом-2
(8) и
1-хлорбутен-3-олом-2
(9)
нию к двойной связи, а также вторичные спир-
(схема 6). В первом случае, когда при двойной
ты аллилового типа. Когда спирт содержит атом
связи находился атом хлора (соединение 8), тет-
хлора при двойной связи, образуется только один
Схема 5.
OH
N
N
N
N
6
N
N
N
N
N
N
+
N
1,2-дихлорэтан
N
H
BF3·Et2O
20-25°C, 48 ч
1a
7a
7b
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1086
ЕГОРОВ и др.
Схема 6.
OH
Cl
N
Cl
8
N
N
N
Cl
N
Cl
N
9
N
N
BF3·Et2O
OH
H
1,2-дихлорэтан
Cl
48 ч, rt
Cl
1a
10
N
N
N
N
11
2-N-изомер тетразола, в то время как в отсутствие
натрия и отгоняли растворитель на ротационном
атома хлора алкилирование приводит к образова-
испарителе. Для съемки 1H и 13C ЯМР, ИК спек-
нию двух 2-изомеров в соотношении, близком 1:1,
тров и проведения элементного анализа остаток
что связано с электроноакцепторным действием
очищали методом колоночной хроматографии или
атома хлора.
перекристаллизовывали из этанола.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2-(трет-Бутил)-2H-тетразол
(2a). Очистка
методом колоночной хроматографии, элюент -
Спектры ЯМР 1H и 13C регистрировали на при-
н-гексан-этилацетат, 80:20. Выход 0.127 г (72%).
боре Avance 400 (Германия) с рабочими частота-
Бесцветная маслянистая жидкость. ИК спектр,
ми 400 (1H), 100 (13C) МГц. ИК спектры снима-
ν, см-1: 2970, 2932, 2884, 1464, 1375, 1310, 1290,
ли на приборе Shimadzu IRTracer-100 (Япония) с
1202, 1161, 1161, 1130, 1099, 1024, 951, 818, 702,
использованием приставки НПВО. Контроль за
590. Спектр ЯМР 1H (400 МГц, CDCl3), δ, м.д.:
ходом реакции осуществляли с помощью ТСХ на
1.72 с (9H), 8.44 с (1H). Спектр ЯМР 13C (100 МГц,
пластинах Sorbfil ПТСХ-П-А-УФ. Для колоноч-
CDCl3), δ, м.д.: 29.3, 63.9, 152.3. Найдено, %: C
ной хроматографии использовали силикагель L
47.64; H 7.91; N 44.45. С5H10N4. Вычислено, %: C
100/400. Для проведения элементного анализа ис-
47.60; H 7.99; N 44.41.
пользовали элементный CHNS анализатор LECO-
932 (Великобритания).
2-(трет-Бутил)-5-метил-2H-тетразол
(2b).
Очистка методом колоночной хроматографии,
Общая методика алкилирования 5-R-тет-
элюент - н-гексан-этилацетат, 80:20. Выход 0.137 г
разолов в среде эфирата трехфтористого бора
(70%). Бесцветная маслянистая жидкость. ИК
и 1,2-дихлорэтана. Готовили раствор эфирата
спектр, ν, см-1: 2986, 2939, 2878, 1502, 1477, 1462,
трехфтористого бора в 1,2-дихлорэтане. Для это-
1404, 1371, 1362, 1313, 1279, 1236, 1194, 1175, 1074,
го к 2 мл 1,2-дихлорэтана добавляли 1 г эфирата
1028, 985, 935, 825, 714, 577, 500, 465. Спектр ЯМР
трехфтористого бора. К полученному раствору до-
1H (400 МГц, CDCl3), δ, м.д.: 1.72 с (9H), 2.52 с
бавляли 1.4 ммоль 5-R-тетразола. После полного
(3H). Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.:
растворения 5-R-тетразола полученный раствор
10.9, 29.3, 63.3, 162.2. Найдено, %: C 51.43; H 8.58;
приливали к 1.6 ммоль спирта при температуре
N 39.99. С6H12N4. Вычислено %: C 51.41; H 8.63;
20-25°С. Реакционную смесь выдерживали при
N 39.97.
перемешивании при температуре 20-25°С в тече-
ние 48 ч. Продукт экстрагировали 5 мл дихлор-
2-(трет-Бутил)-5-фенил-2H-тетразол
(2c).
метана 3 раза при интенсивном перемешивании в
Очистка методом колоночной хроматографии,
течение 5 мин. Экстракты промывали 2%-ным рас-
элюент - н-гексан-этилацетат, 80:20. Выход 0.209 г
твором соды, водой, сушили безводным сульфатом
(74%). Бесцветная маслянистая жидкость. ИК
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
ОСОБЕННОСТИ АЛКИЛИРОВАНИЯ 5-R-ТЕТР
АЗОЛОВ СПИРТАМИ РАЗЛИЧНЫХ ТИПОВ
1087
спектр, ν, см-1: 2954, 2112. 1531, 1450, 1369, 1315,
желтая маслянистая жидкость. ИК спектр, ν, см-1:
1267, 1236, 1201, 1072, 1026, 1006, 924, 823, 789,
2918, 2850, 2361, 1602, 1494, 1454, 1340, 1281,
733. Спектр ЯМР 1H (400 МГц, CDCl3), δ, м.д.:
1124, 1074, 1026, 881, 825, 694. Спектр ЯМР 1H
1.79 с (9H), 7.44-7.50 м (3H), 8.17-8.19 м (2H).
(400 МГц, CDCl3), δ, м.д.: 5.79 с (2H), 7.39 с (5H),
Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.: 29.4,
8.52 с (1H). Спектр ЯМР 13C (100 МГц, CDCl3), δ,
63.8, 126.8, 127.9, 128.8, 130.0, 164.3. Найдено, %:
м.д.: 56.7, 128.5, 129.1, 153.3. Найдено, %: C 60.06;
C 65.41; H 6.86; N 27.73. С11H14N4. Вычислено, %:
H 5.08; N 34.86. С8H8N4. Вычислено, %: C 59.99; H
C 65.32; H 6.98; N 27.70.
5.03; N 34.98.
2-(Адамантан-1-ил)-2H-тетразол (3a). Перек-
Смесь 2-(бутаен-2-ил-1)-2H-тетразола (5a) и
ристаллизация из этанола. Выход 0.243 г (85%).
2-(бутен-2-ил-3)-2H-тетразола (5b). Разделение
Белый кристаллический порошок. ИК спектр,
методом колоночной хроматографии, элюент -
ν, см-1: 2905, 2851, 1456, 1352, 1346, 1304, 1254,
н-гексан-бутанол-1, 95:5. Масса продукта 0.122 г.
1205, 1115, 1078, 1055, 1033, 1022, 981, 927, 841,
Общий выход 70%. Соотношение изомера 5a к
816, 770, 694, 656, 551, 521, 466, 428. Спектр ЯМР
изомеру 5b 1.2:1. Светло-желтая маслянистая жид-
1H (400 МГц, CDCl3), δ, м.д.: 1.81 м (6H), 2.29 м
кость.
(3H), 2.34 м (6H), 8.48 с (1H). Спектр ЯМР 13C
2-(Бутаен-2-ил-1)-2H-тетразол
(5a).
ИК
(100 МГц, CDCl3), δ, м.д.: 29.4, 35.8, 42.2, 64.0,
спектр, ν, см-1: 3136, 2961, 2934, 2874, 1676, 1450,
152.1. Найдено, %: C 64.70; H 7.92; N 27.38.
1379, 1340, 1283, 1188, 1134, 1097, 1026, 1007,
С11H16N4. Вычислено, %: C 64.68; H 7.90; N 27.43.
966, 881, 793, 706, 683. Спектр ЯМР 1H (400 МГц,
2-(Адамантан-1-ил)-5-метил-2H-тетразол
CDCl3), δ, м.д.: 1.72-1.73 м (3H), 5.15 д (2H, J
(3b). Перекристаллизация из этанола. Выход
6.8 Гц), 5.66-5.74 м (1H), 5.84-5.93 м (1H), 8.48 с
0.244 г (80%). Белый кристаллический порошок.
(1H). Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.:
ИК спектр, ν, см-1: 2916, 2850, 1499, 1452, 1356,
19.9, 54.9, 118.2, 133.3, 152.7. Найдено, %: C 48.50;
1315, 1188, 1167, 1103, 1088, 1053, 1022, 983, 970,
H 6.51; N 44.99. С5H8N4. Вычислено, %: C 48.37; H
937, 847, 816, 771, 712, 669, 472. Спектр ЯМР 1H
6.50; N 45.13.
(400 МГц, CDCl3), δ, м.д.: 1.38 м (6H), 1.84 м (3H),
2-(Бутен-2-ил-3)-2H-тетразол (5b). ИК спектр,
1.88 м (6H), 2.07 с (3H). Спектр ЯМР 13C (100 МГц,
ν, см-1: 3132, 2960, 2934, 2877, 1675, 1460, 1385,
CDCl3), δ, м.д.: 10.4, 29.0, 35.5, 41.8, 62.6, 161.2.
1341, 1279, 1190, 1134, 1099, 1021, 1013, 969, 881,
Найдено, %: C 66.12; H 8.25; N 25.63. С12H18N4.
793, 710, 686. Спектр ЯМР 1H (400 МГц, CDCl3), δ,
Вычислено, %: C 66.02; H 8.31; N 25.67.
м.д.: 1.75 д (3H, J 10.0 Гц), 5.22-5.29 м (2H), 6.05-
2-(Адамантан-1-ил)-5-фенил-2H-тетразол
6.14 м (1H), 5.51 квинтет (1H, J 27.4, 13.7 Гц), 8.49
(3c). Перекристаллизация из этанола. Выход
с (1H). Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.:
0.314 г (80%). Белый кристаллический порошок.
17.7, 62.1, 122.6, 136.6, 152.9. Найдено, %: C 48.42;
ИК спектр, ν, см-1: 2912, 2853, 1528, 1463, 1447,
H 6.53; N 45.05. С5H8N4. Вычислено, %: C 48.37; H
1358, 1346, 1306, 1186, 1168, 1107, 1049, 1030,
6.50; N 45.13.
926, 843, 816, 789, 770, 729, 702, 692, 596, 525,
Гептен-2-ол-4 (6). Магний 5.0 г (0.206 моль)
507, 474. Спектр ЯМР 1H (400 МГц, CDCl3), δ,
и 1 кристалл йода помещали в трехгорлую колбу
м.д.: 1.77 м (6H), 2.25 м (3H), 2.36 м (6H), 7.41-
(250 мл). Колбу нагревали до появления фиоле-
7.44 м (3H), 8.13-8.15 м (2H). Спектр ЯМР 13C
товых паров йода, после чего охлаждали до ком-
(100 МГц, CDCl3), δ, м.д.: 34.0, 40.5, 46.9, 68.5,
натной температуры. Далее в колбу помещали
158.8. Найдено, %: C 72.84; H 7.26; N 19.90.
100 мл безводного диэтилового эфира. Около 2 г
С17H20N4. Вычислено, %: C 72.83; H 7.19; N 19.98.
(0.016 моль) 1-бромпропана по каплям добавляли
2-Бензил-2H-тетразол (4). Температура реак-
в колбу к диэтиловому эфиру при перемешивании.
ции 55°С, время выдержки 24 ч. Очистка методом
Смесь аккуратно нагревали на водяной бане до
колоночной хроматографии, элюент - н-гексан-
начала реакции, которое фиксируется по харак-
этилацетат, 80:20. Выход 0.103 г (46%). Светло-
теру кипения диэтилового эфира. После начала
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1088
ЕГОРОВ и др.
реакции к реакционной массе по каплям добавля-
1.46 м (2H), 2.04 м (2H), 5.18 квинтет (1H, J 27.7,
ли 24.3 г (0.198 моль) 1-бромпропана. По завер-
13.9 Гц), 5.58-5.64 м (1H), 5.72-5.79 м (1H), 8.64 с
шении добавления 1-бромпропана реакционную
(1H). Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.:
массу охлаждали до 0-5°С и при этой температу-
13.4, 18.9, 20.9, 36.9, 57.6, 127.6, 136.3, 141.1.
ре и перемешивании по каплям дозировали 10 г
Найдено, %: C 57.89; H 8.54; N 33.57. С8H14N4.
(0.143 моль) кротонового альдегида. После добав-
Вычислено, %: C 57.80; H 8.49; N 33.71.
ления кротонового альдегида реакционную массу
1,4-Дихлорбутен-3-ол-2
(8).
Для синтеза
выдерживали при температуре 0-5°С и перемеши-
1,4-дихлорбутен-3-ола-1 предварительно проводи-
вании в течение 10 мин и выливали в смесь 100 г
ли последовательный синтез хлорацетилхлорида
льда и 15 г хлорида аммония. Полученную смесь
(8a) и 1,4-дихлорбутен-3-она-2 (8b).
экстрагировали 3×50 мл хлороформа. Экстракт
промывали водой и сушили безводным сульфатом
Хлорацетилхлорид (8a). К 95 г (0.798 моль)
натрия. Растворитель отгоняли, а полученный оса-
тионилхлорида добавляли 8 г ДМФА при комнат-
док перегоняли. Выход 14.0 г (86%). Бесцветная
ной температуре и перемешивании. Далее к полу-
жидкость. ИК спектр, ν, см-1: 3345, 2959, 2934,
ченной смеси добавляли 50 г (0.575 моль) хлор-
2874, 1674, 1452, 1441, 1377, 1309, 1217, 1177,
уксусной кислоты при комнатной температуре и
1143, 1121, 1067, 1011, 964, 903, 847, 745, 507.
перемешивании. Полученную смесь выдержи-
Спектр ЯМР 1H (400 МГц, CDCl3), δ, м.д.: 0.81 т
вали в течение 24 ч при комнатной температуре.
(3H), 1.27 м (2H), 1.43 м (2H), 1.59 м (3H), 3.90 м
По завершении выдержки продукт отгоняли в ва-
(1H), 5.33-5.54 м (2H). Спектр ЯМР 13C (100 МГц,
кууме водоструйного насоса при температуре 50-
CDCl3), δ, м.д.: 13.8, 17.5, 18.6, 39.3, 72.5, 125.9,
55°С (10 мм рт.ст.). Выход 42 г (70%). Бесцветная
134.5. Найдено, %: C 73.73; H 12.17; O 14.10.
или светло-желтая жидкость. Спектр ЯМР 1H
Вычислено, %: C 73.63; H 12.36; O 14.01.
(400 МГц, CDCl3), δ, м.д.: 4.54 с (2H). Спектр ЯМР
13C (100 МГц, CDCl3), δ, м.д.: 48.7, 167.5.
Смесь
2-(гептен-2-ил-4)-2H-тетразола
(7a)
и 2-(гептен-3-ил-2)-2H-тетразола (7b). Синтез
1,4-Дихлорбутен-3-он-2 (8b). В трехгорлую
проводили согласно общей методике. Разделение
колбу (100 мл) загружали 30 мл дихлорметана,
методом колоночной хроматографии, элюент -
5 г
(0.044 моль) хлорацетилхлорида и
6.2 г
н-гексан-бутанол-1, 90:10. Масса продукта 0.122 г.
(0.047 моль) хлорида алюминия безводного. Смесь
Общий выход 41%. Соотношение изомера 7a к
охлаждали до -8°С и пропускали через нее ацети-
изомеру 7b 1.2:1. Светло-желтая маслянистая жид-
лен в течение 2 ч при температуре не выше 0°С
кость.
(около 0.1 л/мин). Полученную смесь выливали в
2-(Гептен-2-ил-4)-2H-тетразол
(7a).
ИК
20 мл смеси воды и льда. Полученную массу экс-
трагировали 3×10 мл хлороформа. Экстракт про-
спектр, ν, см-1: 3128, 2961, 2932, 2874, 1647, 1558,
1541, 1466, 1458, 1423, 1379, 1340, 1307, 1256,
мывали 2% раствором карбоната натрия и водой.
1163, 1097, 1017, 966, 870, 679, 669, 660. Спектр
Промытый экстракт сушили сульфатом натрия в те-
ЯМР 1H (400 МГц, CDCl3), δ, м.д.: 0.87 м (3H),
чение 4 ч. После осушения растворитель удаляли.
1.39 м (2H), 1.71 м (3H), 2.10 м (2H), 5.03 к (1H,
Выход 4.0 г (64%). Полученный продукт использо-
J 22.5, 7.5 Гц), 5.69-5.60 м (1H), 5.75-5.84 м (1H),
вали без очистки на следующей стадии. Жидкость
8.60 с (1H). Спектр ЯМР 13C (100 МГц, CDCl3), δ,
черного цвета. Спектр ЯМР 1H (400 МГц, CDCl3),
м.д.: 13.5, 17.7, 21.8, 34.0, 62.1, 127.3, 131.9, 141.4.
δ, м.д.: 4.17 с (2H), 6.70-6.74 м (1H), 7.40-7.43 м
Найдено, %: C 57.88; H 8.53; N 33.59. С8H14N4.
(1H). Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.:
Вычислено, %: C 57.80; H 8.49; N 33.71.
47.3, 128.4, 139.4, 188.8.
2-(Гептен-3-ил-2)-2H-тетразол
(7b).
ИК
1,4-Дихлорбутен-3-ол-1 (8). В трехгорлую кол-
спектр, ν, см-1: 3131, 2957, 2931, 2872, 1647, 1558,
бу (100 мл) помещали 25 мл этанола, 25 мл воды и
1530, 1468, 1455, 1423, 1379, 1340, 1307, 1256,
5 г (0.036 моль) 1,4-дихлорбутен-3-она-2. Раствор
1163, 1065, 1022, 966, 870, 681. Спектр ЯМР 1H
охлаждали до 0°С на ледяной бане с солью. К ох-
(400 МГц, CDCl3), δ, м.д.: 0.90 м (3H), 1.66 м (3H),
лажденному раствору добавляли при перемешива-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
ОСОБЕННОСТИ АЛКИЛИРОВАНИЯ 5-R-ТЕТР
АЗОЛОВ СПИРТАМИ РАЗЛИЧНЫХ ТИПОВ
1089
нии и температуре не выше 2°С 0.8 г (0.021 моль)
выдержки реакционную массу нейтрализовали
боргидрида натрия небольшими порциями. По
карбонатом калия и фильтровали. Органический
завершении добавления смесь выдерживали при
слой отделяли, а водный слой экстрагировали
температуре 0-5°С в течение 10 мин. Полученную
2×20 мл хлороформа. Объединенный экстракт
смесь экстрагировали 2×20 мл дихлорметана, объ-
промывали 20 мл воды и сушили над сульфатом
единенные экстракты промывали водой и суши-
натрия. Экстракт упаривали на роторном испари-
ли сульфатом натрия безводным. По завершении
теле. Остаток перегоняли в вакууме водоструй-
сушки расторитель отгоняли, остаток отгоняли в
ного насоса. Выход 3.1 г (32%). Спектр ЯМР 1H
вакууме водоструйного насоса. Выход 3.6 г (72%).
(400 МГц, CDCl3), δ, м.д.: 3.43-3.59 м (2H), 4.36 м
ИК спектр, ν, см-1: 3366, 2959, 1640, 1626, 1429,
(1H), 5.26-5.42 д.д (2H, J 66.7, 39.0 Гц), 5.83-5.91
1286, 1256, 1192, 1084, 1051, 933, 887, 812, 736,
м (1H). Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.:
615, 517, 474. Спектр ЯМР 1H (400 МГц, CDCl3),
49.1, 72.3, 117.3, 136.6.
δ, м.д.: 3.18 с (OH), 3.49-3.63 м (2H), 4.36-4.40 к
2-(4-Хлорбутен-2-ил-1)-2H-тетразол
(11).
(1H, J 4.7, 16.8 Гц), 5.94-5.99 м (1H), 6.37 д.д (1H, J
Очистка методом колоночной хроматографии,
12.4, 14.3 Гц). Спектр ЯМР 13C (100 МГц, CDCl3),
элюент - н-гексан-этилацетат, переход от 90:10 до
δ, м.д.: 48.8, 70.6, 122.5, 131.6. Найдено, %: C
80:20. Масса продукта 0.067 г. Выход 0.067 г (30%).
34.16; H 4.20; Cl 50.18; O 11.46. Вычислено, %: C
Светло-желтая маслянистая жидкость. ИК спектр,
34.08; H 4.29; Cl 50.29; O 11.35.
ν, см-1: 3143, 2956, 2868, 2127, 1440, 1350, 1282,
2-(1,4-Дихлорбутен-3-ил-2)-2H-тетразол
(9).
1251, 1192, 1128, 1080, 1026, 1006, 968, 883, 742,
Синтез проводили согласно общей методике,
707, 682, 574. Спектр ЯМР 1H (400 МГц, CDCl3), δ,
очистку - методом колоночной хроматографии,
м.д.: 4.06 м (2H), 5.27 м (2H), 6.25-6.31 м (2H), 8.53
элюент
- н-гексан-этилацетат,
80:20. Выход
с (1H). Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.:
0.092 г (34%). Светло-желтая маслянистая жид-
43.2, 53.8, 125.4, 132.4, 153.0. Найдено, %: C 37.95;
кость. ИК спектр, ν, см-1: 2959, 2920, 2850, 1738,
H 4.47; Cl 22.30; N 35.28. С5H7ClN4. Вычислено,
1628, 1429, 1285, 1242, 1091, 1053, 1026, 935, 743,
%: C 37.87; H 4.45; Cl 22.35; N 35.33.
669, 609, 527, 476. Спектр ЯМР 1H (400 МГц,
БЛАГОДАРНОСТИ
CDCl3), δ, м.д.: 3.98-4.16 с (2H), 6.25-6.31 м 1H),
6.51 д (1H, J 13.3 Гц), 5.67-5.72 м (1H), 8.59 с (1H).
Работа выполнена с использованием обору-
Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.: 44.3,
дования Инжинирингового центра Санкт-
65.1, 126.3, 126.8, 153.2. Найдено, %: C 31.15; H
Петербургского Государственного Технологичес-
3.16; Cl 36.69; N 29.00. С5H6Cl2N4. Вычислено, %:
кого института (Технического университета).
C 31.11; H 3.13; Cl 36.73; N 29.03.
ФОНДОВАЯ ПОДДЕРЖКА
1-Хлорбутен-3-ол-2 (10). В трехгорлую колбу
Работа выполнена при поддержке Министерства
(250 мл) загружали 100 мл воды и 30 мл ледяной
науки и высшего образования Российской
уксусной кислоты. Полученную смесь охлажда-
Федерации (госзадание 0785.00.X06019).
ли до 0°С. В отдельный стакан загружали 30 мл
дихлорметана и охлаждали его как минимум до
КОНФЛИКТ ИНТЕРЕСОВ
0°С. К охлажденному дихлорметану приливали
Авторы заявляют об отсутствии конфликта ин-
10 г (0.185 моль) свежеперегнанного бутадие-
тересов.
на-1,3. Полученный раствор бутадиена-1,3 в
дихлорметане приливали в трехгорлую колбу к
СПИСОК ЛИТЕРАТУРЫ
смеси воды и ледяной уксусной кислоты. К полу-
1. Stierstorfer J., Wurzenberger M., Klapotke T., Gruh-
ченной смеси при интенсивном перемешивании
ne M.S. Asian J. 2019, 14, 2018-2030. doi 10.1002/
и температуре 0-3°С в течение 45 мин по каплям
asia.201900269
дозировали 10 г (0.092 моль) трет-бутилгипохло-
2. Zhang Q., Chena D., Jing D., Fan G., He L., Li H.,
рита. Смесь интенсивно перемешивали в течение
Wang H., Nie F. Green Chem. 2019, 21, 1947-1958.
1 ч при температуре не более 5°С. По окончании
doi 10.1039/C8GC03973A
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1090
ЕГОРОВ и др.
3.
Yu Q., Imler G.H., Parrish D.A., Shreeve J.M. Org. Lett.
15.
Ostrovskii V.A., Popova E.A., Trifonov R.E. Adv.
2019, 21, 4684-4689. doi 10.1021/acs.orglett.9b01565
Heterocycl. Chem. 2017, 123, 1-62. doi 10.1016/
4.
Wang Q., Shaoa Y., Lu M. Chem. Commun. 2019, 55,
bs.aihch.2016.12.003
6062-6068. doi 10.1039/C9CC01777A
16.
Bakangura E., He Y., Ge X., Zhu Y., Wu L., Ran J.,
5.
Cheng T. Des. Monomers Polym. 2019, 22, 54-67. doi
Cheng C., Emmanuel K., Yang Z., Xu T. Front. Chem.
10.1080/15685551.2019.1575652
Sci. Eng. 2018, 12, 306-311. doi 10.1007/s11705-017-
6.
Лемперт Д.Б., Казаков А.И., Согласнова С.И., Да-
1690-7
лингер И.Л., Шереметев А.Б. Изв. РАН Сер. Хим.
17.
Zhang M., Xu J., Zhang N., Lu J., Xin X., Zheng F.,
2018, 9, 1580-1588. [Lempert D.B., Kazakov A.I.,
Guo G. New J. Chem. 2018, 42, 13927-13934. doi
Soglasnova S.I., Dalinger I.L., Sheremetev A.B. Russ.
10.1039/C8NJ02659A
Chem. Bull. 2018, 67, 1580-1589.] doi 10.1007/
s11172-018-2261-x
18.
Hooker J.P., Delafresnaye L., Barner L., Barner-
7.
Трифонов Р.Е., Сараев В.В., Зарубаев В.В., Ан-
Kowollik C. Mater. Horiz. 2019, 6, 356-364. doi
фимов П.М., Киселев О.И., Островский В.А.,
10.1039/c8mh01078a
Бокач Н.А., Кукушкин В.Ю. Пат. 2526263, 2014. РФ.
19.
Kritchenkov A.S., Egorov A.R., Krytchankou I.S.,
№ 23.
Dubashynskaya N.V., Volkova O.V., Shakola T.V.,
8.
Monk B.C., Keniya M.V., Sabherwal M., Wilson R.K.,
Kurliuk A.V., Skorik Y.A. Int. J. Biol. Macromol. 2019,
Graham D.O., Hassan H.F., Chen D., Tyndall J.D.A.
132, 340-351. doi 10.1016/j.ijbiomac.2019.03.153
Am. Soc. Microbiol.
2018,
1-59. doi
10.1128/
AAC.02114-18
20.
Stepinski D.C., Hess J.N., Herlinger A.W. Synthetic
Commun. 2003, 33, 3483-3492. doi 10.1081/SCC-
9.
Vitaku E., Smith D.T., Njardarson J.T. J. Med. Chem.
2014, 57, 10257. doi 10.1021/jm501100b
120024727
10.
Renslo A.R., Luehr G.W., Gordeev M.F. Bioorg.
21.
Ogihara W., Yoshizawa M., Ohno H. Chem. Lett. 2004,
Med. Chem. 2006, 14, 4227-4245. doi 10.1016/j.
33, 1022-1024. doi 10.1246/cl.2004.1022
bmc.2006.01.068
22.
Dhayabaran V.V., Lydia I.S., Merlin J.P., Srirenga-
11.
Eriksson L.G., Sirsjo A.O., Strid A.O. Пат.
nayaki P. Ionics. 2004, 10, 123-125. doi 10.1007/
20190040020A1 US, 2019. США.
BF02410319
12.
Zhang J., Wang S., Ba Y., Xu Z. Eur. J. Med. Chem.
23.
Колдобский Г.И., Островский В.А. Усп. хим.
2019, 178, 341-352. doi 10.1016/j.ejmech.2019.05.071
1994, 63, 847-865. [Koldobskii G.I., Ostrovskii V.A.
13.
Китаева В.Г., Ишметова Р.И., Латош Н.И., Мал-
Rus. Chem. Rev. 1994, 63, 797-814.] doi 10.1070/
кина Р.М., Аношина Г.М. Хим.-фарм. ж. 1986, 20,
RC1994v063n10ABEH000119
559-563. [Kitaeva V.G., Ishmetova R.I., Latosh N.I.,
24.
Егоров С.А., Ищенко М.А., Кирилов Н.А., Исха-
Malkina R.M., Anoshina G.M. Pharm. Chem. J. 1986,
ков Р.С. ЖОрХ. 2019, 55, 628-634. [Egorov S.A.,
20, 336-341.] doi 10.1007/BF00758615
Ishchenko M.A., Kirilov N.A., Iskhakov R.S. Russ.
14.
Wei C., Bian M., Gong G. Molecules. 2015, 20, 5528-
J. Org. Chem. 2019, 55, 525-529.] doi 10.1134/
5554. doi 10.3390/molecules20045528
S1070428019040183
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
ОСОБЕННОСТИ АЛКИЛИРОВАНИЯ 5-R-ТЕТР
АЗОЛОВ СПИРТАМИ РАЗЛИЧНЫХ ТИПОВ
1091
Particularities of 5-R-Tetrazoles Alkylation with Various
Alcohols in Boron Trifluoride Etherate-1,2-Dichloroethane
Media
S. A. Egorov*, M. A. Ishchenko, Y. V. Prokopovich, and V. I. Ivanova
St. Petersburg State Institute of Technology, 190013, Russia, St. Petersburg, Moskovskii pr. 26
*e-mail: sergey.egorov93@mail.ru
Received February 22, 2020; revised April 21, 2020; accepted April 21, 2020
Alkylation of 5-R-tetrazoles with primary, secondary, tertiary as well benzylic type and allylic type alcohols
in acid media using boron trifluoride etherate in the 1,2-dichloroethane solution was investigated. It has been
established that alkylation in boron trifluoride etherate - 1,2-dichloroethane media takes place with a yield of
70-80% for tertiary alcohols (and 46% for benzyl alcohol) and provides high regioselectivity for 2-isomers
(>99%), while primary and secondary alcohols do not alkylate tetrazoles under these conditions. Alkylation
regularities of 1H-tetrazole with allylic alcohols depending on their structure were studied.
Keywords: tetrazole, boron trifluoride etherate, regioselective alkylation, alcohols
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020