ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1092-1100
УДК 547.796.1
МЕТОД КИСЛОТНО-КАТАЛИЗИРУЕМОГО
АЛКИЛИРОВАНИЯ ДЛЯ ПОЛУЧЕНИЯ
ПРЕДШЕСТВЕННИКОВ
ТЕТРАЗОЛСОДЕРЖАЩИХ МОНОМЕРОВ
© 2020 г. С. А. Егоров*, М. А. Ищенко, А. С. Аликберов
ФГБОУ ВО «Санкт-Петербургский государственный технологический институт (технический университет)»,
190013, Россия, г. Санкт-Петербург, Московский пр. 26
*e-mail: sergey.egorov93@mail.ru
Поступила в редакцию 22 февраля 2020 г.
После доработки 23 апреля 2020 г.
Принята к публикации 23 апреля 2020 г.
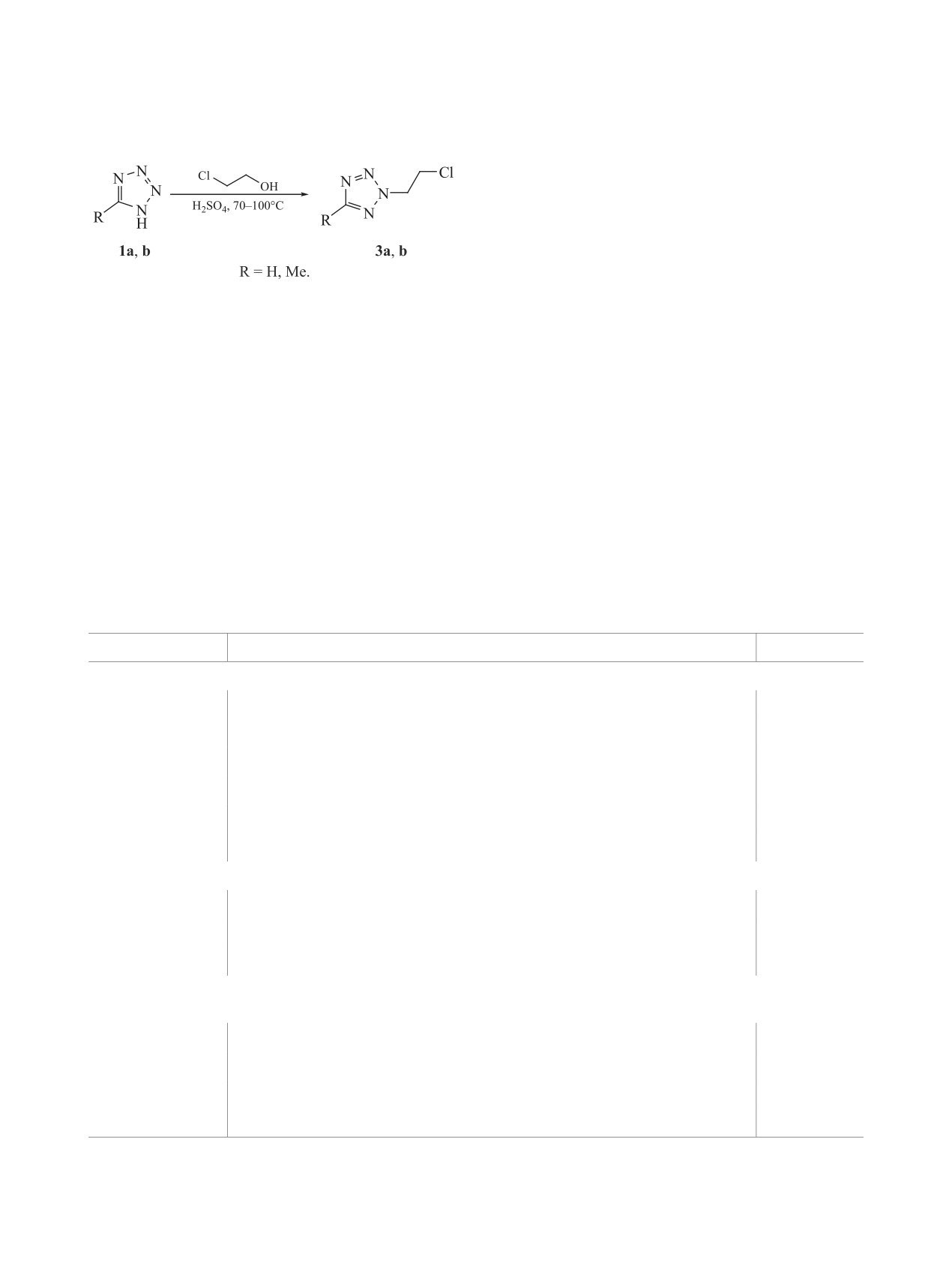
Проведено алкилирование 1H-тетразола и 5-метилтетразола 2-галогенэтанолами (X = Cl, Br) в среде
концентрированной серной кислоты. Применение кислотно-катализируемого алкилирования позволяет
препаративно получать прекурсоры 2-винилтетразола и 2-винил-5-метилтетразола. Изучен процесс ал-
килирования тетразолов 2-галогенэтанолами методом 1H ЯМР-спектроскопии в дейтерированной серной
кислоте. Выходы целевых продуктов составляли 14-76 % в зависимости от условий и реагирующих
веществ. Содержание 2-изомеров в получаемых продуктах составляет не менее 99%.
Ключевые слова: тетразол, прекурсоры тетразолсодержащих мономеров, региоселективное алкилиро-
вание, 2-хлорэтанол, 2-бромэтанол.
DOI: 10.31857/S0514749220070137
В последние годы тематика тетразолсодер-
Перспективным методом получения произво-
жащих полимеров активно развивается. Первые
дных тетразолов является кислотно-катализируе-
упоминания о данном классе полимеров касались
мое алкилирование, которое было впервые описа-
исключительно применения их в области высоко-
но в работе [10]. Метод заключается в проведении
энергетических материалов и порохов в частности
реакции тетразолов со спиртами в среде сильных
[1]. Сегодня они находят применение в таких сфе-
минеральных кислот, что приводит к региоселек-
рах, как медицина [2], энергоемкие материалы [3],
тивному получению 2-изомеров тетразолов. В слу-
катализ [4], ионообменные мембраны [5], коорди-
чаях высокой стабилизации карбкатионов, образу-
национные [6] и фоточувствительные полимеры
ющихся из спиртов, выходы реакции составляют
70-90%, а время выдержки - от 1 ч до нескольких
[7] и др. Разнообразие областей применения связа-
часов при комнатной температуре. Несмотря на
но с уникальным набором свойств тетразольного
продуктивность данного метода, в литературе най-
цикла, обладающего высокой энтальпией образо-
ден лишь один пример попытки его применения
вания, высоким содержанием азота, способностью
(схема 1) для получения предшественников тет-
к комплексообразованию. Для данной группы
разолсодержащих мономеров [11].
веществ также характерны фармакологические и
фотохимические свойства. Обстоятельный обзор,
Для 1-бромпропанола-2 выходы целевых про-
посвященный тетразолсодерджащим полимерам,
дуктов были достаточно высоки - 58-88%. Выходы
дан в работе [8]. Отдельно рассматриваются ви-
с 1-хлорпропанолом-2 составляли 15-45%. Такое
нильные производные тетразолов [9].
снижение вызвано акцепторным действием хлора,
1092
МЕТОД КИСЛОТНО-КАТАЛИЗИРУЕМОГО АЛКИЛИРОВАНИЯ
1093
Схема 1.
R
R
OH
N
N
N
N
X
KOH, EtOH
N
N
N
N
N
N
N
N
R
H
X
1a-d
7a-d, 8a-d
9a-d
R = H, Me, Ph, CF3; X = Cl, Br.
понижающего стабильность образующегося карб-
Проинтегрированные сигналы представляют
катиона. Реакция проводилась в среде 96% серной
собой сигналы протонов целевого соединения, два
кислоты в течение 7 сут при комнатной темпера-
триплета 2.6 м.д. и 3.7 м.д. - сигналы 2-бромэтано-
туре.
ла, сигнал 9.2 м.д. относится к 1H-тетразолу (1a).
Наиболее интенсивный сигнал в области 9.7 - ин-
Дальнейшие попытки развития области полу-
дивидуальный сигнал серной кислоты.
чения предшественников тетразолсодержащих
мономеров не предпринимались, по-видимому, из-
Результаты исследования алкилирования
за низкой реакционной способности галогенсодер-
1H-тетразола (1a) 2-бромэтанолом в среде дей-
жащих алкилирующих агентов. Таким образом по-
терированной серной кислоты с концентрацией
94.5% представлены в табл. 1. Исходя из фак-
лучены 2-(1-галоген-2-метилэтил)тетразолы [11].
Вместе с тем анализ литературы свидетельствует
та, что в среде серной кислоты 1H-тетразол (1a)
устойчив и не разлагается, как, впрочем, и продукт
о том, что наибольшую ценность имеют винилтет-
реакции, рассчитана конверсия 1H-тетразола (1a)
разолы, предшественниками для которых являют-
в 2-(2-бромэтил)-2H-тетразол 2a (схема 2).
ся соответственно 2-(2-галогенэтил)-5-R-тетразо-
лы, поэтому исследование способов их получения
После исследования реакции
1H-тетразола
является важной задачей.
(1a) с 2-бромэтанолом в среде дейтерированной
серной кислоты было проведено многофакторное
Исследовалось региоселективное кислот-
исследование процесса. Изучалось влияние тем-
но-катализируемое алкилирование 1H-тетразола
пературы, времени выдержки, модуля по серной
и
5-метилтетразола
2-галогенэтанолами (X
=
кислоте, а также добавления оксида фосфора(V) к
Cl, Br) для получения предшественников
реакционной массе на выходы целевого продукта
2-N-винилтетразолов - 2-(2-бромэтил)- и 2-(2-
реакции. Экспериментальные данные приведены в
хлорэтил)-5-R-тетразолов. Кроме того, сделана
табл. 2.
попытка найти подход к синтезу предшествен-
ников принципиально нового класса тетразол-
Резюмируя данные табл. 2, отметим, что опти-
содержащих мономеров - бутадиенилтетразолов
мальными условиями проведения алкилирования
[12].
являются диапазон температур 70-100°С, время
выдержки 48 ч, модуль по серной кислоте 10-20.
Проведено исследование алкилирования
1H-тетразола (1a) и 5-метилтетразола (1b) 2-хлор-
Положительное влияние, связанное с возмож-
и 2-бромэтанолом в среде концентрированной сер-
ностью использования более мягких условий при
ной кислоты.
одинаковых выходах, оказывает добавка оксида
Алкилирование 2-бромэтанолом 1H-тетразола
Схема 2.
(1a) изучали методом ЯМР-спектроскопии, реак-
N
Br
N
N
Br
цию проводили в среде дейтерированной серной
OH
N
N
N
D2SO4, 70°C
кислоты с концентрацией 94.5%. Модуль по сер-
N
N
H
ной кислоте (массовое отношение серной кислоты
1a
2a
к навеске тетразола 1a) - 180.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1094
ЕГОРОВ и др.
Таблица 1. Экспериментальные данные алкилирования 1H-тетразола 1a 2-бромэтанолом в среде дейтерированной
серной кислоты.
Время реакции, ч
Мольное соотношение 1a:2a
Конверсия, %
0.60
4.6:1.0
18
4.00
1.0:1.1
52
20.0
1.0:5.4
84
27.6
1.0:6.9
87
49.5
1.0:7.5
88
фосфора(V). Химическое связывание воды окси-
рования 5-фенилтетразола пропанолом-2 в среде
дом фосфора(V) приводит к увеличению кислот-
серной кислоты [13]. Известно, что снижение или
ности среды.
увеличение на 1% концентрации серной кислоты
приводит к изменению наблюдаемой константы
Модуль по серной кислоте играет важную роль,
скорости реакции в 1.5-2 раза. Этим объясняется
однако данное влияние существенно до значения
зависимость выхода продуктов реакции от модуля
10. Объяснение данного факта следующее. Во
по серной кислоте при низких абсолютных значе-
время реакции выделяется вода, которая снижа-
ниях модуля.
ет кислотность среды. Это наиболее заметно при
низких модулях по серной кислоте, что можно
Влияние метильной группы в положении 5 тет-
подтвердить расчетом конечной концентрации
разольного цикла проявилось в увеличении выхо-
серной кислоты при условии полной дегидрата-
да продукта алкилирования, что можно объяснить
ции 2-бромэтанола. Для эксперимента 2 (табл. 2)
электронодонорным эффектом данной группы.
конечная концентрация составляет - 85%, для
Экспериментально подтверждено [13], что реак-
эксперимента 4-89%. Изучена кинетика алкили-
ция заключается во взаимодействии катионов, об-
Таблица 2. Экспериментальные данные по получению 2-(2-бромэтил)тетразола (2a) и 2-(2-бромэтил)-5-метилтет-
разола (2b).
Соотношение
Время
Эксперимент
R (соединение)
5-RTz:BrCH2CH2OH
Температура, °С
СКa/ RTz, г/г
Выход, %
выдержки, ч
(моль/моль)
1
1:1.20
20
163
55.1
2
2
H (2a)
1:1.14
73
48
2.8
18
3
1:1.20
68
46
56
35
4
1:1.15
73
48
5.53
38
5
1:1.21
65
88
19.9
58
6
1:0.95
85
101
11.0
60
7
1:1.11
82
40
15.8
60
8
1:1.16
67
69
10b
70
9
1:1.12
100
96
53.5
76
10
1:1.10
100
48
10b
76
11
Me (2b)
1:1.15
68
46
100
52
a СК - серная кислота.
b Смесь 94%-ной серной кислоты и оксида фосфора(V) в массовом отношении 1:0.45.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
МЕТОД КИСЛОТНО-КАТАЛИЗИРУЕМОГО АЛКИЛИРОВАНИЯ
1095
Для 1H-тетразола (1a) получены неудовлетво-
Схема 3.
рительные результаты. При температуре 120°С
за 118 ч конверсия достигла лишь 7%. В связи с
этим очевидно, что концентрация серной кисло-
ты 94.5% является недостаточной для проведения
процесса. Резкое отличие в реакционной способ-
ности 2-хлорэтанола от 2-бромэтанола связано
разованных из спирта и тетразола, поэтому груп-
с электроноакцепторным влиянием атома хлора.
пы, способные стабилизировать положительный
Кислотно-катализируемое алкилирование проте-
заряд, влияют благотворно на ход реакции и, как
кает с промежуточным образованием карбкатио-
следствие, на выход продуктов реакции.
нов. Наличие электроноакцепторной группы дес-
табилизирует карбокатион, что приводит к сниже-
Далее исследовали алкилирование тетразолов
нию скорости реакции.
в среде серной кислоты 2-хлорэтанолом (схема 3).
Эксперименты с 5-метилтетразолом (1b) пока-
Чтобы определить закономерности протекания
зали, что алкилирование идет, однако исходный
алкилирования 1H-тетразола (1a) и 5-метилтет-
разола (1b) 2-хлорэтанолом, реакцию исследовали
2-хлорэтанол, судя по динамике уменьшения его
методом спектроскопии ЯМР 1H в среде дейтери-
сигналов на спектрах ЯМР 1H реакционной мас-
рованной серной кислоты. Концентрация дейтери-
сы, разлагается в данных условиях, в связи с чем
рованной серной кислоты 94.5%. Результаты при-
реакция остановилась по достижении конвер-
ведены в табл. 3.
сии 5-метилтетразола (1b) 17%. При добавлении
Таблица 3. Экспериментальные данные алкилирования 1H-тетразола (1a) и 5-метилтетразола (1b) 2-хлорэтанолом в
среде дейтерированной серной кислоты.
Время реакции, ч
Мольное соотношение 1a:3a
Конверсия, %
1H-Тетразол (1a) (120°С)
0.5
-
0
2.0
-
0
6.0
-
0
22.0
-
0
24.5
15.8:1.0
6
118
13.4:1.0
7
5-Метилтетразол (1b) (100°С)
19
1.0:0.2
17
70
1.0:0.2
17
145
1.0:0.2
17
После выдержки 145 ч, к реакционной массе добавили дополнительно 2-хлорэтанола [избыток 2-хлорэтанола по
отношению к 5-метилтетразолу (1b) составил 15:1 масс %]
15
1.00:0.6
38
39
0.80:1.0
56
67
0.54:1.0
65
166
0.26:1.0
79
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1096
ЕГОРОВ и др.
избытка
2-хлорэтанола реакция возобновилась
избытке 2-хлорэтанола 10. В случае 5-метилтет-
(15:1 масс %). Конверсия по 5-метилтетразолу 1b
разола (1b) при мольном избытке 2-хлорэтанола
в 5-метил-2-(2-хлорэтил)тетразол (3b) достигла
7.9 выход составил 75%.
77% за 7 сут (166 ч).
Дальнейшее изучение алкилирования тетразо-
Далее изучали практические выходы хлор-
лов в среде серной кислоты строилось на перспек-
этильных производных тетразолов 3a и 3b в за-
тиве получения предшественника следующего
висимости от соотношения исходных реагентов.
тетразолсодержащего мономера - 2-(1,4-дихлор-
Температура во всех экспериментах составляла
бутан-2-ил)тетразола (4), мономер - 2-(бута-1,3-
100°С, поскольку при меньшем ее значении реак-
диен-2-ил)тетразол (5). Исходя из того, что воз-
ция протекает слишком медленно. Время выдерж-
можность алкилирования 2-хлорэтанолом экспе-
ки также было постоянным и составляло 168 ч или
риментально подтверждена, выдвинули предполо-
7 сут. Модуль по кислоте во всех случаях равнялся
жение о том, что в среде серной кислоты должна
идти следующая реакция (схема 4).
70, концентрация серной кислоты составляла 98%.
Увеличение концентрации серной кислоты связа-
Гипотеза тем более справедлива, что речь идет
но с результатами исследования алкилирования
о вторичном спирте. Благодаря возможности боль-
5-R-тетразолов в среде дейтерированной серной
шей стабилизации карбкатионов, вторичные спир-
кислоты. Из них следует, что концентрация 94.5%
ты являются более предпочтительными для алки-
серной кислоты недостаточна для данной реакции,
лирования тетразолов в кислотной среде, чем пер-
поэтому ее увеличивали, добавляя к концентриро-
вичные спирты.
ванной серной кислоте соответствующее количе-
Несмотря на ожидаемую реакционную способ-
ство олеума с известной концентрацией. В качестве
ность 1,4-дихлорбутанола-2, целевого продукта
изменяющегося параметра использовали мольное
алкилирования в среде серной кислоты не полу-
соотношение
2-хлорэтанола и
5-R-тетразолов.
чено. Как показало исследование реакционной
Экспериментальные данные приведены в табл. 4.
массы в среде дейтерированной серной кислоты,
Экспериментальные данные табл. 4 свидетель-
исходный спирт при температуре 36°С разлагает-
ствуют о том, что избыток 2-хлорэтанола по от-
ся, что выражается в полном отсутствии каких-
ношению к тетразолам оказывает существенное
либо сигналов на спектре ЯМР 1H, кроме сигналов
влияние. Наибольший выход целевого продукта
1H-тетразола (1a) и индивидуального пика серной
для 1H-тетразола (1a) составил 41% при мольном
кислоты.
Таблица 4. Экспериментальные данные по получению 2-(2-хлорэтил)тетразола (3a) и 5-метил-2-(2-хлорэтил)тет-
разола (3b).
Эксперимент
R (соединение)
Соотношение RTz:ClCH2CH2OH, моль/моль
Выход, %
1
1:2.30
14
2
1:2.40
27
H (3a)
3
1:4.10
29
4
1:10.0
41
5
1:3.00
46
6
1:3.20
47
7
1:5.00
60
Me (3b)
8
1:4.70
65
9
1:7.70
74
10
1:7.90
75
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
МЕТОД КИСЛОТНО-КАТАЛИЗИРУЕМОГО АЛКИЛИРОВАНИЯ
1097
Схема 4.
Cl
Cl
Cl
N
OH
N
Cl
N
6
N
N
N
H2SO4
N
N
N N
H
N
N
1a
4
5
Поскольку предполагаемая температура реак-
зируемого алкилирования 5-R-тетразолов для по-
ции с 1H-тетразолом (1a) значительно выше (по
лучения предшественников тетразолсодержащих
аналогии с 2-хлорэтанолом, когда удовлетвори-
мономеров.
тельно реакция протекает лишь при 100°С), серная
Установлено, что 2-хлорэтанол и 2-бромэтанол
кислота не подходит для проведения алкилирова-
способны алкилировать 1H-тетразол (1a) и 5-ме-
ния. Вероятно, неустойчивость 1,4-дихлорбутано-
тилтетразол (1b) в среде концентрированной сер-
ла-2 (6) в сильнокислой среде связана с электроно-
ной кислоты при нагревании, что делает данный
акцепторным действием 2 атомов хлора, и при об-
метод пригодным для получения предшественни-
разовании карбкатиона в такой среде стабильность
ков винилпроизводных 5-R-тетразолов - 2-(2-га-
его столь низкая, что он распадается.
логенэтил)-5-R-тетразолов.
В среде трифторуксусной кислоты происхо-
В более мягких условиях протекает реакция
дит межмолекулярная дегидратация 1,4-дихлор-
5-R-тетразолов с 2-бромэтанолом, что связано с
бутанола-2 (4) с образованием простого эфира, а
меньшей электроотрицательностью атома брома
не алкилирование тетразола. Это подтверждает-
по сравнению с атомом хлора. Алкилирование
ся спектрами ЯМР
1H и 13C продукта реакции.
проводили в среде серной кислоты с концентраци-
Кроме того, проведена выдержка чистого спирта
ей 94%. Выходы целевых продуктов находились в
без 1H-тетразола (1a) в трифторуксусной кислоте.
диапазоне 18-76% в зависимости от условий реак-
Полученный продукт характеризовался точно та-
ции. Установлено, что добавление оксида фосфо-
кими же спектрами ЯМР 1H и 13C.
ра(V) увеличивает выход целевого продукта при
В среде фосфорной кислоты при комнатной
прочих равных условия, либо дает возможность
температуре при выдержке в течение 48 ч в каче-
смягчить условия реакции при одинаковом выхо-
стве продукта выделено только исходное вещест-
де.
во - 1,4-дихлорбутанол-2 (6). В случае же прове-
Алкилирование
5-R-тетразолов
2-хлорэтано-
дения реакции в среде 100% фосфорной кислоты
лом проводили в более жестких условиях: при
при температурах 55°С (120 ч) и 90°С (48 ч) целе-
температуре 100°С, времени выдержки 7 сут и кон-
вой продукт найден в следовых количествах, что
центрации серной кислоты 98%. Установлено, что
наблюдалось на спектрах ЯМР 1H и 13C.
увеличение избытка спирта кардинально влияет
Отрицательный результат также получен при
на выход целевого продукта, что связано с посте-
проведении процесса в среде смеси 1,2-дихлор-
пенным разложением 2-хлорэтанола в данных ус-
этана и эфирата трехфтористого бора при комнат-
ловиях. 1H-Тетразол (1a) вступает в реакцию зна-
ной температуре в течение 48 ч - выделено только
чительно хуже 5-метилтетразола (1b), что связано
исходное вещество.
со стабилизирующей способностью метильной
группы по отношению к промежуточным карбка-
Результатом работы является расширение зна-
тионам за счет электронодонорного эффекта.
ний о закономерностях взаимодействия 2-гало-
генэтанолов (X = Cl, Br) с 1H-тетразолом (1a) и
Предпринята попытка получения предшествен-
5-метилтетразолом (1b) в среде серной кислоты
ника бутадиенового производного тетразола
-
94-98% и применимости метода кислотно-катали-
2-(1,4-дихлорбутан-2-ил)тетразола (4) - методом
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1098
ЕГОРОВ и др.
кислотно-катализируемого алкилирования. В каче-
тетразола в продукт алкилирования определяли по
стве исходного соединения применяли 1,4-дихлор-
следующей формуле:
бутанол-2 (6). Установлено, что в среде серной
×
кислоты с концентрацией 94.5% данный спирт
полностью разлагается при температуре 36°С. В
где S1
- площадь под пиком
2-(2-галоген-
других кислотных системах, например, трифто-
этил)-5-R-тетразола; S2 - площадь под пиком
руксусная кислота, фосфорная кислота, раствор
5-R-тетразола.
эфирата трехфтористого бора в 1,2-дихлорэтане,
Химические сдвиги протонов
1H-тетразола
реакция не идет, либо происходит межмолекуляр-
(тетразольный CH),
5-метилтетразола (метиль-
ная дегидратация, как в случае трифторуксусной
ная группа CH3) и алкилированных продуктов, по
кислоты (ТФК).
которым рассчитывали конверсию, приведены в
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
табл. 5.
Спектры ЯМР 1H и 13C регистрировали на при-
2-(2-Бромэтил)тетразол (2a). В реакционную
боре Avance 400 (Германия) с рабочими частота-
колбу помещали 8.7 мл серной кислоты 94% и при
ми 400 (1H), 100 (13C) МГц. ИК спектры снимали
перемешивании 1 г (0.0143 моль) 1H-тетразола
на приборе Shimadzu IRTracer-100 (Япония) с ис-
(1a). После полного растворения 1H-тетразола
пользованием приставки НПВО. Для проведения
(1a) к полученной смеси добавляли
2.00 г
элементного анализа использовали элементный
(0.0159 моль) 2-бромэтанола. Реакционную колбу
CHNS анализатор LECO-932 (Велкобритания).
закрывали и выдерживали в термостате при тем-
Все эксперименты по синтезу
2-(2-галоген-
пературе 82°С в течение 40 ч. По истечении време-
этил)-5-R-тетразолов проводили 2 раза для устра-
ни выдержки реакционную массу охлаждали и вы-
нения случайных ошибок, в качестве выхода при-
ливали в смесь, состоящую из 5 г хлорида натрия,
нимали среднее значение 2 экспериментов.
5 мл воды и 20 г льда. Полученный раствор экстра-
Общая методика анализа реакционной
гировали 3×30 мл дихлорметана. Объединенный
массы при алкилировании тетразолов 2-гало-
экстракт промывали раствором карбоната натрия
генэтанолами (X = Cl, Br) в дейтерированной
2% и водой, сушили сульфатом натрия в течение
серной кислоте. В реакционную колбу поме-
4 ч, отгоняли растворитель. Выход 1.51 г (60%).
щали 18 г (0.177 моль) дейтерированной серной
Светло-желтая маслянистая жидкость.
кислоты 94.5% и при перемешивании 1.4 ммоль
Примечание к методике. Если во время экс-
5-R-тетразола. После полного растворения тет-
трагирования формируется устойчивая эмульсия,
разола к полученной смеси добавляли 1.6 ммоль
смесь необходимо подогреть до температуры 50-
2-галогенэтанола. Реакционную колбу закрывали
70°С.
и выдерживали в термостате при заданной тем-
пературе. Отбор пробы производили стеклянной
ИК спектр, ν, см-1: 3142, 3036, 1450, 1429,
пипеткой в пробирку для ЯМР-спектроскопии.
1358, 1311, 1282, 1255, 1178, 1132, 1109, 1028,
Высота столба жидкости составляла 4 см. Далее
1004, 945, 879, 760, 708, 692, 663, 640, 570, 449.
проводили анализ ЯМР на ядрах 1H. Конверсию
Спектр ЯМР 1H (400 МГц, CDCl3), δ, м.д.: 3.86 т
Таблица 5. Значения химических сдвигов протонов в исследуемых соединениях.
Наименование
Тип анализируемого протона
Значение химического сдвига, м.д.
1H-тетразол
CH (тетразольный)
9.11
5-Метилтетразол
CH3
1.63
2-(2-Хлорэтил)тетразол
CH (тетразольный)
8.44
5-Метил-2-(2-хлорэтил)тетразол
CH3
1.51
2-(2-Бромэтил)тетразол
CH (тетразольный)
8.53
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
МЕТОД КИСЛОТНО-КАТАЛИЗИРУЕМОГО АЛКИЛИРОВАНИЯ
1099
(2H), 5.04 т (5H), 8.54 с (1H, CH). Спектр ЯМР 13C
си добавляли 11.5 г (0.143 моль) 2-хлорэтанола.
(100 МГц, CDCl3), δ, м.д.:
27.2,
53.9,
153.2.
Реакционную колбу закрывали и выдерживали
C3H5BrN4. Найдено, %: C 20.39; H 2.90; Br 45.10;
в термостате при температуре 100°С в течение
N 31.61. Вычислено, %: C 20.36; H 2.85; Br 45.14;
168 ч. По истечении времени выдержки реак-
N 31.65.
ционную массу охлаждали и выливали в смесь,
состоящую из 15 г хлорида натрия и 100 г льда.
2-(2-Бромэтил)тетразол (2a) с оксидом фос-
Полученный раствор экстрагировали
3×30 мл
фора(V). В реакционную колбу помещали 6.8 мл
хлороформа. Объединенный экстракт промывали
серной кислоты 94% и при перемешивании и ох-
раствором карбоната натрия 2% и водой, суши-
лаждении на водяной бане 5.76 г оксида фосфо-
ли сульфатом натрия в течение 4 ч, отгоняли рас-
ра(V). Перемешивание вели до полного раство-
творитель 2. Выход 1.29 г (41%). Светло-желтая
рения оксида фосфора(V). Далее к полученному
маслянистая жидкость. ИК спектр, ν, см-1: 3145,
раствору прибавляли при перемешивании 1 г
3026, 2968, 2115, 2083, 1753, 1436, 1402, 1381,
(0.0143 моль) тетразола (1a). После полного рас-
1282, 1188, 1122, 1070, 1028, 1006, 958, 925, 798,
творения 1H-тетразола (1a) к полученной смеси
709, 694, 677, 655, 602, 584, 524. Спектр ЯМР 1H
добавляли 2.07 г (0.0165 моль) 2-бромэтанола.
(400 МГц, CDCl3), δ, м.д.: 2.54 с (3H), 3.82 т (3H),
Реакционную колбу закрывали и выдержива-
4.94 т (3H). Спектр ЯМР 13C (100 МГц, CDCl3),
ли в термостате при температуре 67°С в течение
δ, м.д.: 40.7, 54.0, 153.2. Найдено, %: C 25.19; H
48 ч. По истечении времени выдержки реакцион-
3.64; Br 41.80; N 29.37. C3H5ClN4. Вычислено, %:
ную массу охлаждали и выливали в смесь, сос-
C 25.15; H 3.69; Br 41.83; N 29.33.
тоящую из 10 г хлорида натрия, 10 мл воды и
30 г льда. Полученный раствор экстрагировали
5-Метил-2-(2-хлорэтил)тетразол (3b). Мето-
3×30 мл дихлорметана. Объединенный экстракт
дика синтеза 5-метил-2-(2-хлорэтил)тетразола (3b)
промывали раствором карбоната натрия 2% и во-
аналогична методике получения 2-(2-хлорэтил)-
дой, сушили сульфатом натрия в течение 4 ч, отго-
тетразола (3a). Выход 1.54 г (75%). Светло-желтая
няли растворитель. Выход 1.77 г (70%).
маслянистая жидкость. ИК спектр, ν, см-1: 2964,
2924, 2852, 2115, 2098, 1755, 1703, 1508, 1435,
Полные экспериментальные данные по алкили-
1381, 1317, 1190, 1132, 1080, 1031, 999, 956, 910,
рованию тетразолов 2-бромэтанолом приведены в
798, 746, 715, 671, 617. Спектр ЯМР 1H (400 МГц,
табл. 2.
), δ, м.д.: 2.54 с (3H), 3.82 т (3H), 4.94 т (3H).
CDCl3
2-(2-Бромэтил)-5-метилтетразол (2b). Мето-
Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.: 10.8,
дика синтеза 5-метил-2-(2-бромэтил)тетразола 2b
40.8, 53.8, 163.3. Найдено, %: C 32.83; H 4.80; Cl
аналогична методике получения 2-(2-бромэтил)-
24.17; N 38.20. C4H7ClN4. Вычислено, %: C 32.78;
тетразола (2a). Масса продукта 1,42 г. Выход
H 4.81; Cl 24.19; N 38.22.
1.42 г (52%). Светло-желтая маслянистая жид-
Полные экспериментальные данные по алкили-
кость. ИК спектр, ν, см-1: 2918, 2848, 2220, 1995,
рованию тетразолов 2-хлорэтанолом приведены в
1971, 1506, 1450, 1429, 1392, 1379, 1354, 1311,
табл. 4.
1255, 1186, 1118, 1078, 1031, 943, 883, 796, 734,
715, 623, 569, 461. Спектр ЯМР 1H (400 МГц,
БЛАГОДАРНОСТИ
CDCl3), δ, м.д.: 2.54 с (3H), 3.82 т (3H), 4.94 т (3H).
Работа выполнена с использованием обо-
Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.: 10.8,
рудования Инжинирингового центра Санкт-
27.6, 53.6, 163.0. Найдено, %: C 25.19; H 3.64; Br
Петербургского Государственного Технологичес-
41.80; N 29.37. C4H7BrN4 Вычислено, %: C 25.15;
кого института (Технического университета).
H 3.69; Br 41.83; N 29.33.
ФОНДОВАЯ ПОДДЕРЖКА
2-(2-Хлорэтил)тетразол (3a). В реакционную
колбу помещали 40 мл серной кислоты 98% и 1 г
Работа выполнена при поддержке Министерства
(0.0142 моль) тетразола (1a). После полного рас-
науки и высшего образования Российской
творения 1H-тетразола (1a) к полученной сме-
Федерации (госзадание № 0785.00.X06019).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1100
ЕГОРОВ и др.
КОНФЛИКТ ИНТЕРЕСОВ
7. Hooker J.P., Delafresnaye L., Barner L., Barner-
Kowollik C. Mater. Horiz. 2019, 6, 356-364. doi
Авторы заявляют об отсутствии конфликта ин-
тересов.
10.1039/c8mh01078a
СПИСОК ЛИТЕРАТУРЫ
8. Гапоник П.Н., Ивашкевич О.А. Вестн. БГУ. 2013,
1, 3-29.
1. Finnegan W.G., Henry R.A.J. Org. Chem. 1959, 24,
1565-1567.
9. Кижняев В.Н., Верещагин Л.И. Усп. хим. 2003,
2. Березин А.С., Ишметова Р.И., Русинов Г.Л., Ско-
72, 159-182. [Kizhnyaev V.N., Vereshchagin L.I.
рик Ю.А. Изв. АН, Сер. хим. 2014, 7, 1624-1632.
Russ. Chem. Rev. 2003, 72, 143-164.] doi 10.1070/
[Berezin A.S., Ishmetova R.I., Rusinov G.L., Sko-
RC2003v072n02ABEH000731
rik Yu.A. Russ. Chem. Bull. 2014, 63, 1624-1632.] doi
10.1007/s11172-014-0645-0
10. Корень А.О., Гапоник П.Н. ХГС. 1990, 26, 1643-1647
3. Cheng T. Des. Monomers Polym. 2019, 22, 54-67. doi
[Koren’ A.O., Gaponik P.N. Chem. Heterocycl. Compd.
10.1080/15685551.2019.1575652
1990, 26, 1366-1371.] doi 10.1007/BF00473965
4. Yang G., Chen D., Tang X., Li Q., Miao Z., Jin J.,
11. Voitekhovich S.V., Gaponk P.N., Koren’ A.O.
Ding H. Inorg. Chem. Commun. 2011, 14, 913-916.
Mendeleev Commun. 1997, 1, 41-42. doi 10.1070/
doi 10.1016/j.inoche.2011.03.029
MC1997v007n01ABEH000654
5. Bakangura E., He Y., Ge X., Zhu Y., Wu L., Ran J.,
Cheng C., Emmanuel K., Yang Z., Xu T. Front. Chem.
12. Щетинина Т.В., Братилов С.Б., Пантилеенко С.В.,
Sci. Eng. 2018, 12, 306-311. doi 10.1007/s11705-017-
Петров В.В. ЖОХ. 1992, 28, 2349-2354.
1690-7
13. Koren’ A.O., Gaponik P.N., Ostrovskii V.A. Int. J.
6. Zhang M., Xu J., Zhang N., Lu J., Xin X., Zheng F.,
Guo G. New J. Chem. 2018, 42, 13927-13934. doi
Chem. Kinet. 1993, 25, 1043-1052. doi 10.1002/
10.1039/C8NJ02659A
kin.550251209
The Method of the Acis-Catalysed Alkylation Method
for Obtaining Precursors of Tetrazole-Containing Monomers
S. A. Egorov*, M. A. Ishchenko, and A. S. Alikberov
St. Petersburg State Institute of Technology, 190013, Russia, St. Petersburg, Moskovskii pr. 26
*e-mail: sergey.egorov93@mail.ru
Received February 22, 2020; revised April 23, 2020; accepted April 23, 2020
It has been researched alkylation of 1H-tetrazole and 5-methyltetrazole with 2-halogenethanols (X = Cl, Br)
in sulfuric acid media. Using of the acid-catalysed alkylation method allows obtaining efficiently precursors
of 2-vinyltetrazole and 5-methyl 2-viniltetrazole. It has been studied a process of tetrazoles alkylation with
2-halogenethanols by 1H-NMR method in d2-sulfuric acid. Yields of target products were 14-76% depending
on the conditions and reacting compound. Contain of 2-isomers in prepared products is more than 99%.
Keywords: tetrazole, precursor of tetrazole-containing monomers, regioselective alkylation, 2-chloroethanol,
2-bromoethanol
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020