ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1109-1114
Удк 547.745 + 547.816.8
ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ ПИРРОЛДИОНОВ,
МАЛОНОНИТРИЛА И АЦИКЛИЧЕСКИХ ЕНОЛОВ
© 2020 г. А. А. Сабитов, М. В. Дмитриев, А. И. Белозерова,
Т. В. Сальникова, А. Н. Масливец*
ФГБОУ ВО «Пермский государственный национальный исследовательский университет»
614990, Россия, г. Пермь, ул. Букирева 15
*e-mail: koh2@psu.ru
Поступила в редакцию 10 февраля 2020 г.
После доработки 31 марта 2020 г.
Принята к публикации 03 апреля 2020 г.
Трехкомпонентная реакция замещенных 1Н-пиррол-2,3-дионов, малононитрила и ациклических енолов
(ацетилацетона, алкил ацетоацетатов или этил бензоилацетата) приводит к образованию замещенных
этил 9-амино-1-оксо-3-фенил-10-циано-8-окса-2-азаспиро[4.5]дека-3,6,9-триен-4-карбоксилатов, пред-
ставляющих интерес для медицинской химии.
Ключевые слова: 1Н-пиррол-2,3-дионы, малононитрил, 2-амино-4H-пиран-3-карбонитрилы, 1,3-ди-
карбонильные соединения, енолы, трехкомпонентные реакции.
DOI: 10.31857/S0514749220070150
Ранее нами изучены трехкомпонентные реак-
ствии триэтиламина (20 мол %) в течение 19-
ции 1H-пиррол-2,3-дионов с малононитрилом и
20 ч (контроль ВЭЖХ-МС) получены замещенные
шестичленными карбо- и гетероциклическими
9-амино-1-оксо-3-фенил-10-циано-8-окса-2-аза-
енолами
(5,5-диметилциклогексан-1,3-дионом и
спиро[4.5]дека-3,6,9-триен-4-карбоксилаты
3a-g
4-гидроксикумарином), протекающие с образо-
(схема 1). Стоит отметить, что в отличие от ана-
ванием спиро[хромен-4,3'-пирролов] и спиро[пи-
логичных реакций с циклическими енолами [1-4]
рано[3,2-с]хромен-4,3'-пирролов] соответственно
реакция с енолами 2а-d требует более жестких
[1, 2]. Также исследованы реакции 1H-пиррол-
условий: длительного нагревания и использования
2,3-дионов с малононитрилом и пятичленны-
избытка енола.
ми карбо- и гетероциклическими енолами (ин-
Соединения 3a-g - бесцветные кристалличе-
дан-1,3-дионом, циклопентан-1,3-дионом и фу-
ские вещества с высокими температурами плавле-
ран-2,4(3H,5H)-дионом), протекающие с образо-
ния, легкорастворимые в ДМСО и ацетоне, труд-
ванием спиро[индено[1,2-b]пиран-4,3'-пирролов],
норастворимые в этаноле и толуоле, нераствори-
спиро[циклопента[b]пиран-4,3'-пирролов] и спи-
мые в алканах и воде.
ро[пиррол-3,4'-фуро[3,4-b]пиранов] соответствен-
В ИК спектрах соединений 3a-g присутствуют
но [3, 4]. Трехкомпонентные реакции 1Н-пиррол-
полосы валентных колебаний группы NH2 (3175-
2,3-дионов с малононитрилом и ациклическими
3502 см-1), группы СN (2185-2198 см-1), лактам-
енолами не известны.
ной, а также двух сложноэфирных или сложно-
эфирной и кетонной (у соединения 3b) карбониль-
При кипячении
5-фенил-4-этоксикарбо-
ных групп (1626-1758 см-1).
нил-1H-пиррол-2,3-дионов 1a-d с малононитри-
лом и ациклическими енолами 2а-d в соотноше-
В спектрах ЯМР 1Н соединений 3а-g, кроме
нии 1:1:4 в безводном ацетонитриле в присут-
сигналов протонов ароматических колец и прото-
1109
1110
САБИТОВ и др.
Схема 1.
NC
O
OH
EtOOC
O
CN
OH
R3
R3
NC
EtOOC
C
CN
R2
R2
EtOOC
CH2(CN)2, Et3N
2a-d
R2
–H2O
Ph
N O
R3
Ph
N O
Ph
N O
R1
R1
R1
1a-d
4a-d
H2N
O
NC
R2
EtOOC
R3
Ph
N O
R1
3a-g
1, 4, R1 = Bn (a), C6H4Me-4 (b), Ph (c), Me (d); 2, R2 = Me, R3 = COOMe (a), COMe (b), COOEt (c),
R2 = Ph, R3 = COOEt (d); 3, R1 = Bn, R2 = Me, R3 = COOMe (a), COMe (b), COOEt (c),
R1 = C6H4Me-4, R2 = Me, R3 = COOEt (d), R1 = Ph, R2 = Me, R3 = COOEt (e),
R1 = R2 = Me, R3 = COOEt (f), R1 = Bn, R2 = Ph, R3 = COOEt (g).
нов заместителей R1, R2 и R3, присутствуют три-
(161.3-165.0 м.д.) карбонильных групп, кетон-
плет (0.78-0.90 м.д.) и мультиплет (3.73-3.96 м.д.)
ной карбонильной группы (197.1 м.д. у соедине-
ния 3b), а также спироуглеродного атома (49.8-
протонов этоксикарбонильного заместителя, а так-
50.7 м.д.).
же уширенный синглет двух протонов группы NH2
(7.11-7.28 м.д.).
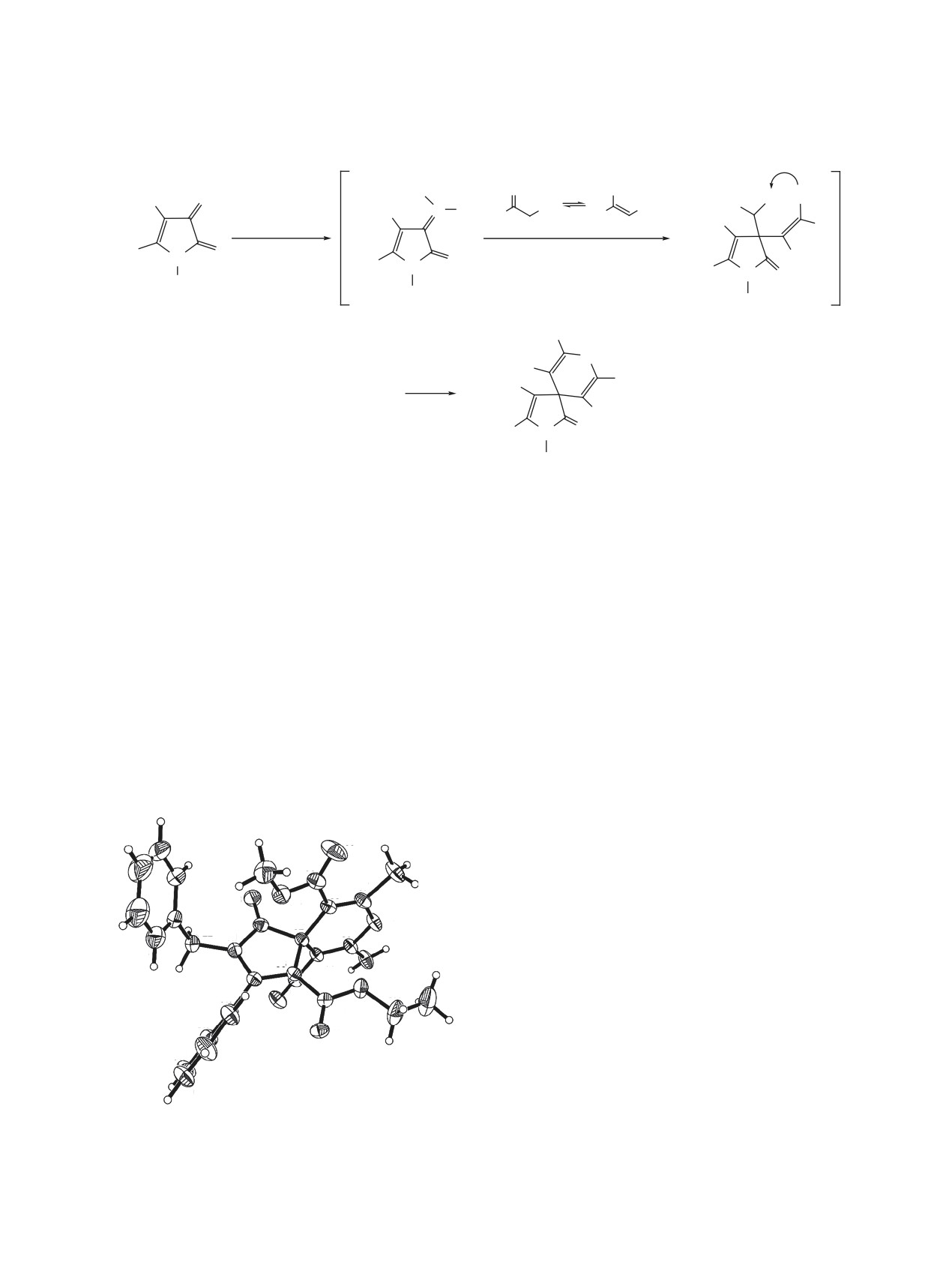
Структура соединения 3а подтверждена РСА.
Согласно данным РСА (см. рисунок), соедине-
В спектрах ЯМР 13С соединений 3а-g при-
ние 3а кристаллизуется в центросимметричной
сутствуют характерные сигналы атомов углерода
пространственной группе моноклинной синго-
лактамной (178.1-179.0 м.д.) и сложноэфирных
нии. Пирановый цикл находится в конформации
искаженная ванна, атомы C2 и O4 выходят из
плоскости C5C6C7C8 на 0.17 и 0.08 Å соответ-
C25
O5
ственно. Пиррольный цикл плоский в пределах
C11
C10
C26
C9
0.04 Å. Планарный этоксикарбонильный заме-
C24
C7
C8
ститель лежит приблизительно в плоскости пир-
O3
O6
C27
C23
рольного цикла. Метоксикарбонильный фрагмент
C1
O4
C2
C22
C6
N1
также отклонен на небольшой угол относительно
C28
H3A
пиранового цикла: торсионные углы C7C8C9O5
C3
N3
C5
C4
H3B O2
7.5(4)° и C2C8C9O6 3.5(3)°. В кристалле молеку-
C15
C12
лы связаны в бесконечные двумерные сети за счет
C16
C13
N2
межмолекулярных водородных связей N3-H3A∙∙∙O1
C17
C14
C21
[-x, -0.5+y, 0.5-z] и N3-H3B∙∙∙O1 [x, 0.5-y, -0.5+z].
O1
C18
C20
Образование соединений
3a-g происходит,
C19
по-видимому, вследствие конденсации кетонной
карбонильной группы пирролдионов 1a-d с мети-
Общий вид молекулы соединения 3а по данным РСА в
тепловых эллипсоидах 30 % вероятности.
леновой группой малононитрила и последующего
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ ПИРРОЛДИОНОВ
1111
присоединения групп β-CH и ОН енольной формы
(1.0 ммоль) малононитрила, 432 мкл (4.0 ммоль)
соединений 2a-d к атому углерода в положении 3
метил 3-оксобутаноата и 28 мкл (0.2 ммоль) три-
пирролонов 4a-d и цианогруппе соответственно.
этиламина в
10 мл безводного ацетонитрила
Подобная спиро-гетероциклизация описана при
кипятили 19 ч, охлаждали, образовавшийся оса-
двухкомпонентной конденсации
2-(5-арил-4-ме-
док отфильтровывали. Выход 338 мг (68%), т.пл.
тил-2-оксо-1,2-дигидро-3H-пиррол-3-илиден)ма-
206-208°С (ацетон), бесцветные кристаллы. ИК
лононитрилов (аналогов пирролонов 4a-d) с этил
спектр, ν, см-1: 3410, 3324, 3217, 3197 (NH2), 2190
ацетоацетатом [5].
(CN), 1733, 1721, 1668, 1626 (C=O). Спектр ЯМР
1Н (ДМСО-d6), δ, м.д.: 0.84 т (3Н, CH3CH2, J
Предложенная в настоящей работе реакция
7.1 Гц), 2.33 с (3Н, Me), 3.52 с (3Н, OMe), 3.74-
представляет собой первый пример трехкомпо-
3.86 м (2Н, CH3CH2), 4.43 д, 4.48 д (2Н, CH2Ph, J
нентной спиро-гетероциклизации замещенных
15.9 Гц), 6.95-7.03 м (2Наром), 7.08-7.13 м (2Наром),
1Н-пиррол-2,3-дионов под действием малоно-
7.17 уш.с (2Н, NH2), 7.18-7.22 м (3Наром), 7.35-
нитрила и ациклических енолов с образованием
7.49 м (3Наром). Спектр ЯМР 13C (ДМСО-d6), δ,
малодоступной гетероциклической системы 8-ок-
м.д.: 13.4 (CH3CH2), 18.8 (Me), 44.0 (CH2Ph), 49.8
са-2-азаспиро[4.5]дека-3,6,9-триена. 2-Амино-4H-
(спиро), 51.5 (OMe), 54.5, 58.7 (CH3CH2), 103.5,
пиран-3-карбонитриловый фрагмент, входящий в
112.6, 117.5, 127.1 (3С), 127.9 (2С), 128.0 (2С),
состав соединений 3, является основой соедине-
128.4 (2С), 129.4, 129.5, 136.3, 154.7, 159.3, 159.6,
ний, проявляющих цитотоксическую [6], противо-
161.3 (COOEt), 165.0 (COOMe), 179.0 (C1=O).
микробную [7-9] и противогрибковую [9] актив-
Масс-спектр: m/z 521.99 [М + Na]+. Найдено, %: C
ность.
. Вычислено, %:
67.63; H 5.18; N 8.39. C28H25N3O6
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
C 67.33; H 5.04; N 8.41. M + Na 522.16.
ИК спектры полученных соединений записа-
Рентгеноструктурный анализ соединения 3a
ны на спектрофотометре Perkin Elmer Spectrum
выполнен на монокристальном дифрактометре
Two в виде пасты в вазелиновом масле. Спектры
Xcalibur Ruby с ССD-детектором по стандартной
ЯМР 1Н и 13С записаны на спектрометре Bruker
методике (MoKα-излучение, 295(2) K, ω-скани-
AVANCE III HD 400 [рабочая частота 400 (1Н) и
рование с шагом 1°). Поглощение учтено эмпи-
100 (13С) МГц] в ДМСО-d6, внутренний стан-
рически с использованием алгоритма SCALE3
дарт - ГМДС. Элементный анализ выполнен на
ABSPACK [11]. Сингония кристалла (C28H25N3O6,
анализаторе vario Micro cube. Индивидуальность
M 499.51) моноклинная, пространственная груп-
синтезированных соединений подтверждена мето-
па P21/c, a 14.912(3), b 12.190(2), c 14.942(3) Å, β
дом ТСХ на пластинках Merck Silica gel 60 F254,
108.92(2)°, V 2569.4(10) Å3, Z 4, dвыч 1.291 г/см3, μ
элюенты - толуол-этилацетат, 3:1, проявляли па-
0.092 мм-1. Структура расшифрована с помощью
рами иода и УФ излучением 254 нм. Оптимизация
программы SHELXS [12] и уточнена полноматрич-
условий реакций методом ВЭЖХ-МС и регистра-
ным МНК по F2 в анизотропном приближении для
ция масс-спектров выполнены на приборе Waters
всех неводородных атомов с использованием про-
Acquity UPLC I-Class, колонка Acquity UPLC BEH
граммы SHELXL [13] с графическим интерфейсом
C18 1.7 мкм, подвижные фазы - ацетонитрил-
OLEX2 [14]. Атомы водорода группы NH2 уточне-
вода, скорость потока 0.6 мл/мин, УФ детектор
ны независимо в изотропном приближении. При
PDA eλ, масс-спектрометрический детектор Xevo
уточнении остальных атомов водорода использо-
TQD, режим ионизации ESI+. Исходные пиррол-
вана модель наездника. Окончательные параметры
дионы 1 синтезированы взаимодействием соответ-
уточнения: R1 0.0567 [для 3899 отражений с I >
ствующих енаминов с оксалилхлоридом по ранее
2σ(I)], wR2 0.1662 (для всех 6129 независимых от-
описанной методике [10].
ражений), S 1.047. Результаты РСА зарегистриро-
6-Метил 4-этил 9-амино-2-бензил-7-метил-
ваны в Кембриджском центре кристаллографиче-
1-оксо-3-фенил-10-циано-8-окса-2-азаспи-
ских данных под номером CCDC 1981651 и могут
ро[4.5]дека-3,6,9-триен-4,6-дикарбоксилат (3a).
Раствор 335 мг (1.0 ммоль) пирролдиона 1а, 66 мг
data_request/cif.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1112
САБИТОВ и др.
Соединения 3b-g синтезированы аналогично.
3237, 3208 (NH2), 2190 (CN), 1758, 1694, 1668,
1627 (C=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
Этил 9-амино-6-ацетил-2-бензил-7-метил-1-
0.90 т (3Н, CH3CH2, J 7.1 Гц), 1.21 т (3Н, CH3CH2,
оксо-3-фенил-10-циано-8-окса-2-азаспиро[4.5]-
J 7.1 Гц), 2.22 с, 2.36 с (6Н, 2Me), 3.77-3.96 м (2Н,
дека-3,6,9-триен-4-карбоксилат
(3b). Выход
CH3CH2), 4.12-4.30 м (2Н, CH3CH2), 6.81-6.92 м
183 мг (38%), т.пл. 168-169°С (этанол), бесцвет-
(2Наром), 7.05-7.18 м (4Наром), 7.21 уш.с (2Н, NH2),
ные кристаллы. ИК спектр, ν, см-1: 3390, 3293,
7.25-7.35 м (3Наром). Спектр ЯМР 13C (ДМСО-d6),
3181 (NH2), 2188 (CN), 1723, 1698, 1682, 1651
δ, м.д.: 13.5 (CH3CH2), 14.1 (CH3CH2), 18.9 (Me),
(C=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.84 т
20.5 (Me), 50.0 (спиро), 54.8, 58.9 (CH3CH2), 60.7
(3H, CH3CH2, J 7.1 Гц), 2.34 с (3H, Me), 2.35 c (3H
(CH3CH2), 103.5, 112.7, 117.5, 127.6 (2С), 127.6
Me), 3.73-3.85 м (2H, CH3CH2), 4.44 c (2H, CH2Ph),
(2С), 129.0 (2С), 129.1, 129.3 (2С), 129.6, 131.5,
7.05-7.11 м (4Hаром), 7.12 уш. с (2H, NH2), 7.16-
137.4, 153.7, 159.5, 159.7, 161.6 (COOEt), 164.7
7.22 м (3Hаром), 7.30-7.42 м (3Hаром). Спектр ЯМР
(COOEt), 178.2 (C1=O). Масс-спектр: m/z 514.02
13C (ДМСО-d6), δ, м.д.: 13.5 (CH3CH2), 19.7 (Me),
[М + H]+. Найдено, %: C 68.05; H 5.14; N 8.10.
31.3 (Me), 44.0 (CH2Ph), 50.3 (спиро), 54.9, 58.7
C29H27N3O6. Вычислено, %: C 67.83; H 5.30; N
(CH3CH2), 112.1, 114.7, 117.6, 126.6 (2C), 126.9,
8.18. M + H 514.20.
127.8 (2C), 128.0 (2C), 128.3 (2C), 129.3, 129.7,
136.6, 154.7, 157.4, 159.9, 161.5 (COOEt), 179.0
Диэтил
9-амино-7-метил-1-оксо-2,3-дифе-
(C1=O), 197.1 (COMe). Масс-спектр: m/z 506.05
нил-10-циано-8-окса-2-азаспиро[4.5]дека-
[М + Na]+. Найдено, %: C 69.38; H 5.30; N 8.73.
3,6,9-триен-4,6-дикарбоксилат (3e). Выход 264 мг
C28H25N3O5. Вычислено, %: C 69.55; H 5.21; N
(53%), т.пл. 185-187°С (этанол), бесцветные крис-
8.69. M + Na 506.17.
таллы. ИК спектр, ν, см-1: 3435, 3328, 3265, 3222,
3193 (NH2), 2190 (CN), 1743, 1716, 1673, 1637
Диэтил
9-амино-2-бензил-7-метил-1-оксо-3-
фенил-10-циано-8-окса-2-азаспиро[4.5]дека-
(C=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.91
т (3H, CH3CH2, J 7.1 Гц), 1.22 т (3Н, CH3CH2, J
3,6,9-триен-4,6-дикарбоксилат (3c). Выход 210 мг
7.1 Гц), 2.37 c (3H, Me), 3.81-3.94 м (2Н, CH3CH2),
(41%), т.пл. 180-182°С (этанол), бесцветные крис-
таллы. ИК спектр, ν, см-1: 3454, 3328, 3175 (NH2),
4.15-4.28 м (2Н, CH3CH2), 6.98-7.02 м (2Наром),
7.13-7.17 м (2Наром), 7.20-7.37 м (8Н, 6Наром +
2186 (CN), 1738, 1697, 1667, 1630 (C=O). Спектр
ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.85 т (3Н, CH3CH2,
NH2). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.: 13.5
J 7.1 Гц), 1.11 т (3Н, CH3CH2, J 7.1 Гц), 2.33 с
(CH3CH2), 14.1 (CH3CH2), 19.0 (Me), 50.2 (спиро),
(3Н, Me), 3.73-3.87 м (2Н, CH3CH2), 3.97-4.18
54.8, 59.0 (CH3CH2), 60.7 (CH3CH2), 103.5, 112.9,
м (2Н, CH3CH2), 4.34 д, 4.54 д (2Н, CH2Ph, J
117.6, 127.6 (2С), 127.8 (2С), 127.9, 128.8 (2С),
16.0 Гц), 6.99-7.25 м (9Н, 7Наром + NH2), 7.33-7.49
129.0 (2С), 129.1, 129.5, 134.2, 153.6, 159.5, 159.8,
м (3Наром). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.:
161.6 (COOEt),
164.7 (COOEt),
178.1 (C1=O).
13.4 (CH3CH2), 13.9 (CH3CH2), 18.9 (Me), 44.2
Масс-спектр: m/z 500.11 [М + H]+. Найдено, %: C
(CH2Ph), 49.8 (спиро), 54.6, 58.7 (CH3CH2), 60.5
67.59; H 5.01; N 8.34. C28H25N3O6. Вычислено, %:
(CH3CH2), 103.7, 112.7, 117.6, 126.9 (2С), 127.1,
C 67.33; H 5.04; N 8.41. M + H 500.18
127.9 (2С), 128.0 (2С), 128.4 (2С), 129.5, 129.5,
Диэтил
9-амино-2,7-диметил-1-оксо-3-фе-
136.4, 154.6, 159.1, 159.7, 161.3 (COOEt), 164.6
нил-10-циано-8-окса-2-азаспиро[4.5]дека-
(COOEt), 179.0 (C1=O). Масс-спектр: m/z 514.11
3,6,9-триен-4,6-дикарбоксилат (3f). Выход 223 мг
[М + H]+. Найдено, %: C 67.99; H 5.47; N 8.27.
(51%), т.пл.
218-219°C (этанол), бесцветные
C29H27N3O6. Вычислено, %: C 67.83; H 5.30; N
кристаллы. ИК спектр, ν, см-1: 3427, 3285, 3266,
8.18. M + H 514.20.
3176 (NH2), 2185 (CN), 1716, 1697, 1678, 1661
Диэтил 9-амино-7-метил-1-оксо-2-(п-толил)-
(C=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.88
3-фенил-10-циано-8-окса-2-азаспиро[4.5]де-
т (3Н, СН3СН2 J 7.1 Гц), 1.14 т (3Н, СН3СН2 J
ка-3,6,9-триен-4,6-дикарбоксилат
(3d). Выход
7.1 Гц), 2.33 с (3Н, СН3), 2.74 с (3Н, СН3), 3.79-
272 мг (53%), т.пл. 181-183°С (этанол), бесцветные
3.85 м (2Н, СН3СН2), 4.05-4.13 м (2Н, СН3СН2),
кристаллы. ИК спектр, ν, см-1: 3502, 3406, 3333,
7.11 с (2Н, NH2), 7.29-7.34 м (2Наром), 7.50-7.55 м
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ ПИРРОЛДИОНОВ
1113
(3Наром). Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 13.4
2.
Дмитриев М.В., Силайчев П.С., Масливец А.Н.
(CH3CH2), 13.8 (CH3CH2), 18.7, 27.5, 49.9 (спиро),
ЖОрХ. 2015,
51,
77-80.
[Dmitriev M.V., Silai-
54.6, 58.7 (CH3CH2), 60.4 (CH3CH2), 103.4, 112.2,
chev P.S., Maslivets A.N. Russ. J. Org. Chem. 2015,
117.3, 128.2 (2C), 128.4 (2C), 129.6 (2C), 154.6,
51, 74-77.] doi 10.1134/S1070428015010121
159.5, 159.5, 161.4, 164.5, 178.9 (C1=O). Масс-
3.
Сальникова Т.В., Дмитриев М.В., Бушмеле-
спектр: m/z 437.92 [М + Н]+. Найдено, %: C 63.21;
ва Е.В., Силайчев П.С., Масливец А.Н. ЖОрХ.
H 5.18; N 9.58. C23H23N3O6. Вычислено, %: C
2018, 54, 564-567. [Sal’nikova T.V., Dmitriev M.V.,
63.15; H 5.30; N 9.61. M + H 438.17.
Bushmeleva E.V., Silaichev P.S., Maslivets A.N. Russ.
J. Org. Chem. 2018, 54, 564-567.] doi 10.1134/
Диэтил
9-амино-2-бензил-1-оксо-3,7-дифе-
S1070428018040073.
нил-10-циано-8-окса-2-азаспиро[4.5]дека-
3,6,9-триен-4,6-дикарбоксилат (3g). Выход 274 мг
4.
Сальникова Т.В., Дмитриев М.В., Масливец А.Н.
(48%), т.пл. 192-193°C (этанол), бесцветные кри-
ЖОрХ. 2017, 53, 129-130. [Sal’nikova T.V., Dmit-
riev M.V., Maslivets A.N. Russ. J. Org. Chem. 2017,
сталлы. ИК спектр, ν см-1: 3406, 3326, 3266, 3256,
53, 128-129.] doi 10.1134/S1070428017010249
3208 (NH2), 2198 (CN), 1735, 1697, 1668, 1627
(C=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.78
5.
Миловидова А.Г., Беликов М.Ю., Иевлев М.Ю.,
т (3H, СН3СН2, J 7.1 Гц), 0.87 т (3H, СН3СН2, J
Ершов О.В., Насакин О.Е. ЖОрХ. 2018, 54, 1776-
7.1 Гц), 3.80-3.90 м (4Н, СН3СН2), 4.41 д (1Н,
1779. [Milovidova A.G., Belikov M.Yu., Ievlev M.Yu.,
PhСН2, J 16.1 Гц), 4.57 д (1Н, PhСН2, J 16.1 Гц),
Ershov O.V., Nasakin O.E. Russ. J. Org. Chem. 2018,
7.01-7.14 м (4Наром), 7.17-7.24 м (3Наром), 7.28 с
54, 1790-1793.] doi 10.1134/S1070428018120084
(2H, NH2), 7.34-7.52 (8Hаром). Спектр ЯМР 13С
6.
Rahnamay M., Mahdavi M., Shekarchi A.A., Zare P.,
(ДМСО-d6), δ, м.д.: 13.1 (CH3CH2), 13.5 (CH3CH2),
Feizi M.A.H. Acta Biochim. Pol. 2018, 65, 397-402.
44.1 (PhCH2), 50.7 (спиро), 54.3, 58.9 (CH3CH2),
doi 10.18388/abp.2017_1629
60.4 (CH3CH2), 105.3, 112.3, 117.6,
126.7
(2C),
7.
Baitha A. Gopinathan A., Krishnan K., Dabhol-
127.0, 127.9 (2C), 128.0 (2C), 128.1 (4C), 128.3
kar V.V. J. Heterocycl. Chem. 2018, 55, 1189-1192.
(2C), 129.3, 129.4, 130.0, 133.0, 136.2, 155.1, 156.5,
doi 10.1002/jhet.3152
160.3, 161.3, 164.8, 178.5 (C1=O). Масс-спектр: m/z
8.
Sayed G.H., Azab M.E., Anwer K.E. J. Heterocycl.
576.09 [М + Н]+. Найдено, %: C 71.20; H 5.15; N
Chem. 2019, 56, 2121-2133. doi 10.1002/jhet.3606
7.24. C34H29N3O6. Вычислено, %: C 70.94; H 5.08;
9.
Bhat A.R., Shalla A.H., Dongre R.S. J. Adv. Res. 2015,
N 7.30. M + H 576.21.
6, 941-948. doi 10.1016/j.jare.2014.10.007
ФОНДОВАЯ ПОДДЕРЖКА
10.
Силайчев П.С., Дмитриев М.В., Алиев З.Г., Мас-
Работа выполнена при финансовой поддержке
ливец А.Н. ЖОрХ. 2010, 46, 1173-1176. [Silai-
Минобрнауки России (проект № FSNF-2020-0008)
chev P.S., Dmitriev M.V., Aliev Z.G., Maslivets A.N.
и Правительства Пермского края.
Russ. J. Org. Chem. 2010, 46, 1173-1177.] doi 10.1134/
S1070428010080105
КОНФЛИКТ ИНТЕРЕСОВ
11.
CrysAlisPro,
Agilent
Technologies,
Version
Авторы заявляют об отсутствии конфликта ин-
1.171.37.33
тересов.
12.
Sheldrick G.M. Acta Crystallogr., Sect. A. 2008, 64,
СПИСОК ЛИТЕРАТУРЫ
112-122. doi 10.1107/S0108767307043930
1. Дмитриев М.В., Силайчев П.С., Алиев З.Г., Мас-
13.
Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
ливец А.Н. ЖОрХ. 2011, 47, 1147-1150. [Dmit-
3-8. doi 10.1107/S2053229614024218
riev M.V., Silaichev P.S., Aliev Z.G., Maslivets A.N.
14.
Dolomanov O.V., Bourhis L.J., Gildea R.J, Ho-
Russ. J. Org. Chem. 2011, 47, 1165-1168.] doi
ward J.A.K., Puschmann H. J. Appl. Cryst. 2009, 42,
10.1134/S1070428011080082
339-341. doi 10.1107/S0021889808042726
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1114
САБИТОВ и др.
Three-Component Reaction of Pyrrolediones,
Malononitrile and Acyclic Enols
A. A. Sabitov, M. V. Dmitriev, A. I. Belozerova, T. V. Salnikova, and A. N. Maslivets*
Perm State University, 614990, Russia, Perm, ul. Bukireva 15
*e-mail: koh2@psu.ru
Received February 10, 2020; revised March 31, 2020; accepted April 3, 2020
The three-component reaction of substituted 1H-pyrrole-2,3-diones, malononitrile and acyclic enols (acetyl-
acetone, alkyl acetoacetates or ethyl benzoylacetate) leads to the formation of ethyl 9-amino-10-cyano-1-oxo-
3-phenyl-8-oxa-2-azaspiro[4.5]deca-3,6,9-triene-4-carboxylates, which are of interest for medicinal chemistry.
Keywords: 1H-pyrrole-2,3-diones, malononitrile, 2-amino-4H-pyran-3-carbonitriles, 1,3-dicarbonyl com-
pounds, enols, three-component reactions
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020