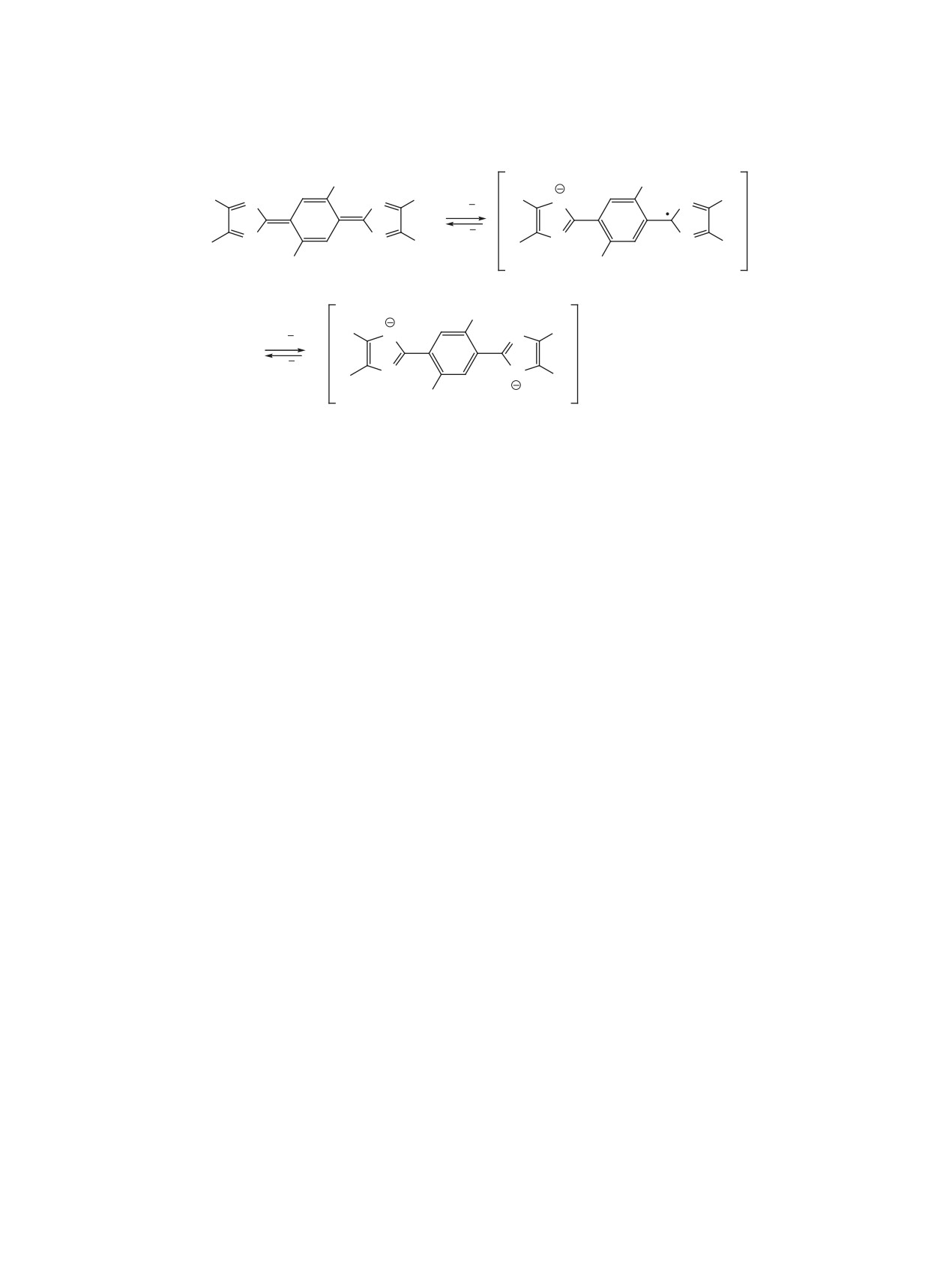ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1115-1122
УДК 547.653.1
ПОЛУЧЕНИЕ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА
2,5-ДИЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ
1,4-БИС(4,5-ДИФЕНИЛИМИДАЗОЛ-2-ИЛ)БЕНЗОЛА
©2020 г. Д. Б. Чугунов*, Е. В. Окина, А. С. Тимонина, Л. А. Климаева, Ю. М. Селиванова
ФГБОУ ВО «Национальный исследовательский Мордовский государственный университет им. Н. П. Огарёва»,
430005, Россия, Республика Мордовия, Саранск, ул. Большевистская, 68,
*e-mail: iman081@gmail.com
Поступила в редакцию 07 февраля 2020 г.
После доработки 17 апреля 2020 г.
Принята к публикации 21 апреля 2020 г.
Проведен синтез и получены электрохимические характеристики 2,5-дизамещённых производных
1,4-бис(4,5-дифенилимидазол-2-ил)бензола. Методом циклической вольтамперометрии подробно ис-
следовано влияние различных заместителей на значения редокс-характеристик. Изучены редокс-свой-
ства 2,5-дизамещённых 1,4-бис(4,5-дифенилимидазол-2-ил)бензола, электрохимически обратимая
редокс-трансформация хинон - бирадикал протекает при положительных потенциалах.
Ключевые слова: бирадикалы, монорадикалы, циклическая вольтамперометрия, 1,4-бис(4,5-дифени-
лимидазол-2-ил)бензол.
DOI: 10.31857/S0514749220070162
Монорадикалы триарилимидазолильного ряда
Представлены данные по получению 2-моно- и
являются достаточно удобными и широко приме-
2,5-дибромпроизводных 1,4-бис(4,5-дифенилими-
няемыми объектами для исследования взаимосвя-
дазолил-2)бензола - простейших диимидазолов. С
зи между строением и реакционной способностью
использованием метода циклической вольтамперо-
стабильных радикалов вследствие их высокой
метрии изучены электрохимические свойства по-
устойчивости по отношению к кислороду воздуха
лученных соединений. Показано, что стерическое
[1-3]. Однако бирадикалы данного класса до на-
напряжение создаваемого двумя атомами брома в
стоящего времени являются практически неизу-
«центральном» кольце «ответственно» за проявле-
ние нетривиальных редокс-свойств, в частности,
ченными.
смещение потенциалов восстановления в поло-
Ранее нами были синтезированы бис-имида-
жительную область. Полученные значения потен-
золильные системы, содержащие имидазольные
циалов восстановления для
2,5-дизамещённых
«остатки» в положениях 1,4 бензольного кольца и
производных 1,4-бис(4,5-дифенилимидазол-2-ил)-
дававшие при окислении хиноиды, которые про-
бензола являются рекордными среди замещённых
являли парамагнитную восприимчивость при на-
1,4-циклогексадиенов.
гревании за счет разрыва хиноидных связей. При
Синтез 2,5-дизамещённых 1,4-бис(4,5-дифени-
этом предполагалось, что наличие заместителя в
лимидазол-2-ил)бензолов был проведен согласно
о-положении центрального бензольного ядра по
следующей схеме 1.
отношению к имидазольному циклу должно пре-
пятствовать образованию хиноидных систем, а по-
Исходные моно- и дибромзамещённые пара-
лученные продукты - бирадикалы - должны обла-
ксилолы, необходимые для синтеза диальдегидов
дать нетривиальными редокс-свойствами.
1b, c, были получены согласно методикам [4, 5].
1115
1116
ЧУГУНОВ и др.
Схема 1.
R1 = R2 = H (a); R1 = H, R2 = Br (b); R1 = R2 = Br (c).
Полученные диальдегиды 1a-c были исполь-
На обратном ходе развертки потенциала имеется
зованы для синтеза диимидазолов
2a-c, при
пик окисления, свидетельствующий об обратимом
окислении которых были получены хиноны 3a-c
характере процесса восстановления. Этот пик не
(схема 2).
пропадает даже при малых скоростях развертки
потенциала, что указывает на высокую устойчи-
Окисление имидазолов проводилось гекса-
цианоферратом(III) калия в двухфазной системе
вость образовавшейся частицы. Следовательно,
бензол-вода в присутствии гидроксида калия.
образующиеся после электрохимического восста-
новления частицы устойчивы во времени и не пре-
При этом хиноны выделялись в виде осадка, час-
тично растворимого в бензоле. Судя по данным
терпевают никаких химических превращений.
ТСХ (Silufol, элюент бензол), в данных условиях
Следует отметить, что редко наблюдаются про-
имидазолы окисляются не полностью, в продук-
цессы электрохимического восстановления, при
тах окисления находились исходный имидазол, а
которых происходит одновременный перенос 2
также неидентифицированные продукты. Очистку
электронов при одном потенциале. Это может на-
и выделение чистых хинонов проводили следую-
блюдаться только в отдельных случаях. Например,
щим образом: растворяли при кипячении в бензо-
если второй электрон переходит при более поло-
ле, отделяли нерастворившийся осадок, маточник
жительном потенциале, чем первый, - это может
концентрировали упариванием под вакуумом, чи-
выглядеть, как двухэлектронный процесс. Также
стый хиноид осаждали н-гексаном.
это может произойти в случае, когда очень бы-
Для выяснения влияния заместителей в цен-
страя химическая реакция следует непосредствен-
тральном кольце хинонов 3a-c нами были изучены
но после переноса первого электрона (случай хи-
их электрохимические свойства методом цикличе-
нона при некоторых значениях pH) [6]. Тогда фор-
ской вольтамперометрии.
ма вольтамперограммы меняется - она сужается, и
Измерения проводили на Pt электроде в СH3CN.
разность потенциалов пиков прямого и обратного
На рис. 1 представлена циклическая вольтампе-
хода достигает 28 мВ, при этом увеличивается так-
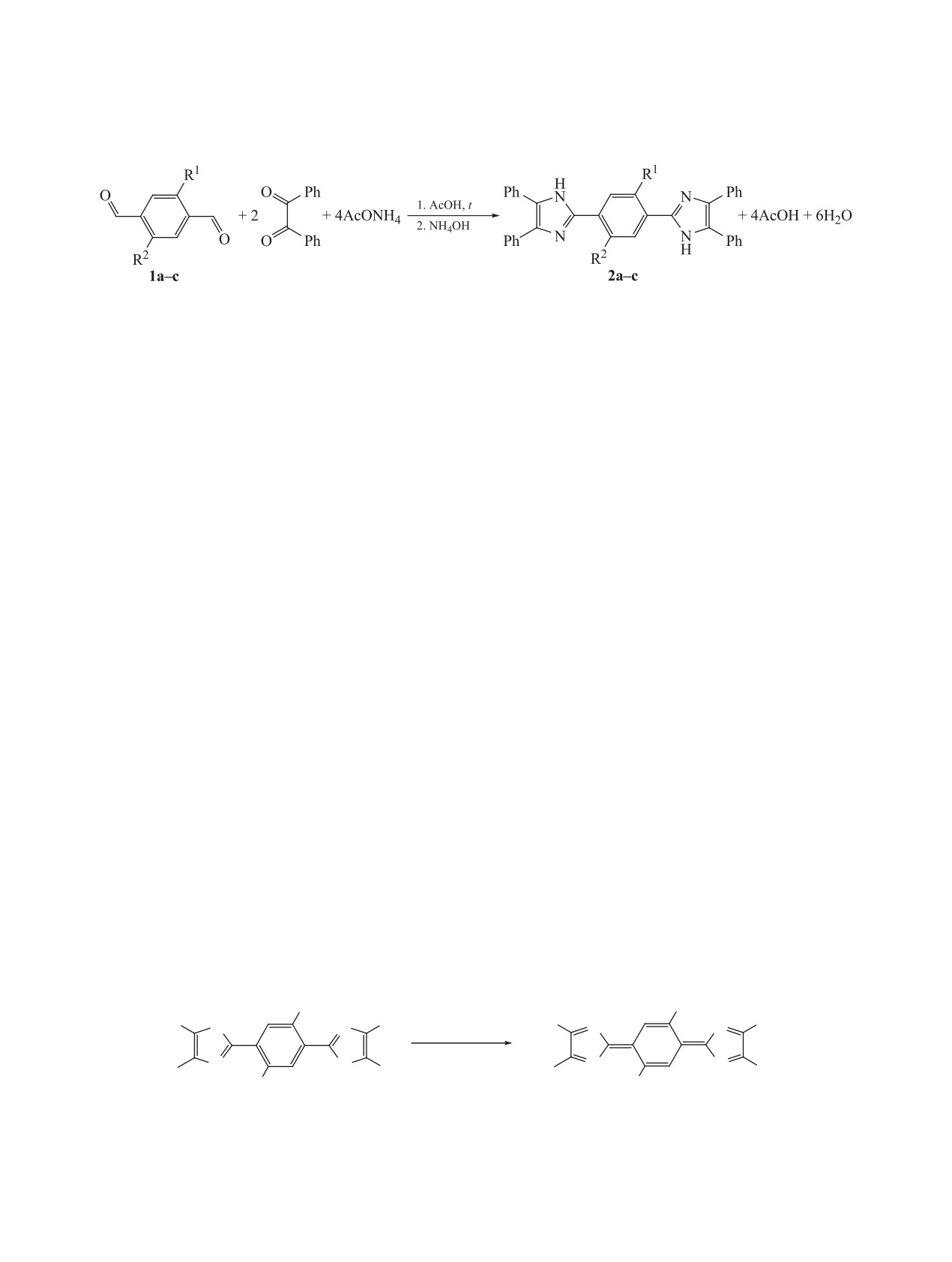
рограмма (ЦВА), полученная для соединения 3а.
же и ток в пике [6]. В случае, когда 2 одинаковых
Как видно из приведенного рисунка, в области по-
редокс-центра находятся на расстоянии друг от
тенциалов от 1 В до -1 В присутствует одна двух-
друга, то наблюдается простое сложение токов, и
электронная волна при Е = 0.17 В (отн. Ag/AgCl/
форма кривой практически не изменяется. Данный
KCl) с диффузионным ограничением тока (рис. 2).
случай наблюдается на ЦВА, представленной на
Схема 2.
R1
R1
H
Ph
Ph
Ph
Ph
N
N
N
N
K3[Fe(CN)6]
H2O, C6H
6
N
N
N
N
Ph
Ph
Ph
Ph
H
R2
R2
2a-c
3a-c
R1 = R2 = H (a); R1 = H, R2 = Br (b); R1 = R2 = Br (c).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
ПОЛУЧЕНИЕ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА 2,5-ДИЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ
1117
Рис. 2. Зависимость токов пиков восстановления сое-
Рис 1. ЦВА соединения 3а (1 мМ, Pt, CH2Cl2, 0.1 M
динения 3а от квадратного корня из скорости разверт-
Bu4NPF6, 100 мВ/с).
ки потенциала.
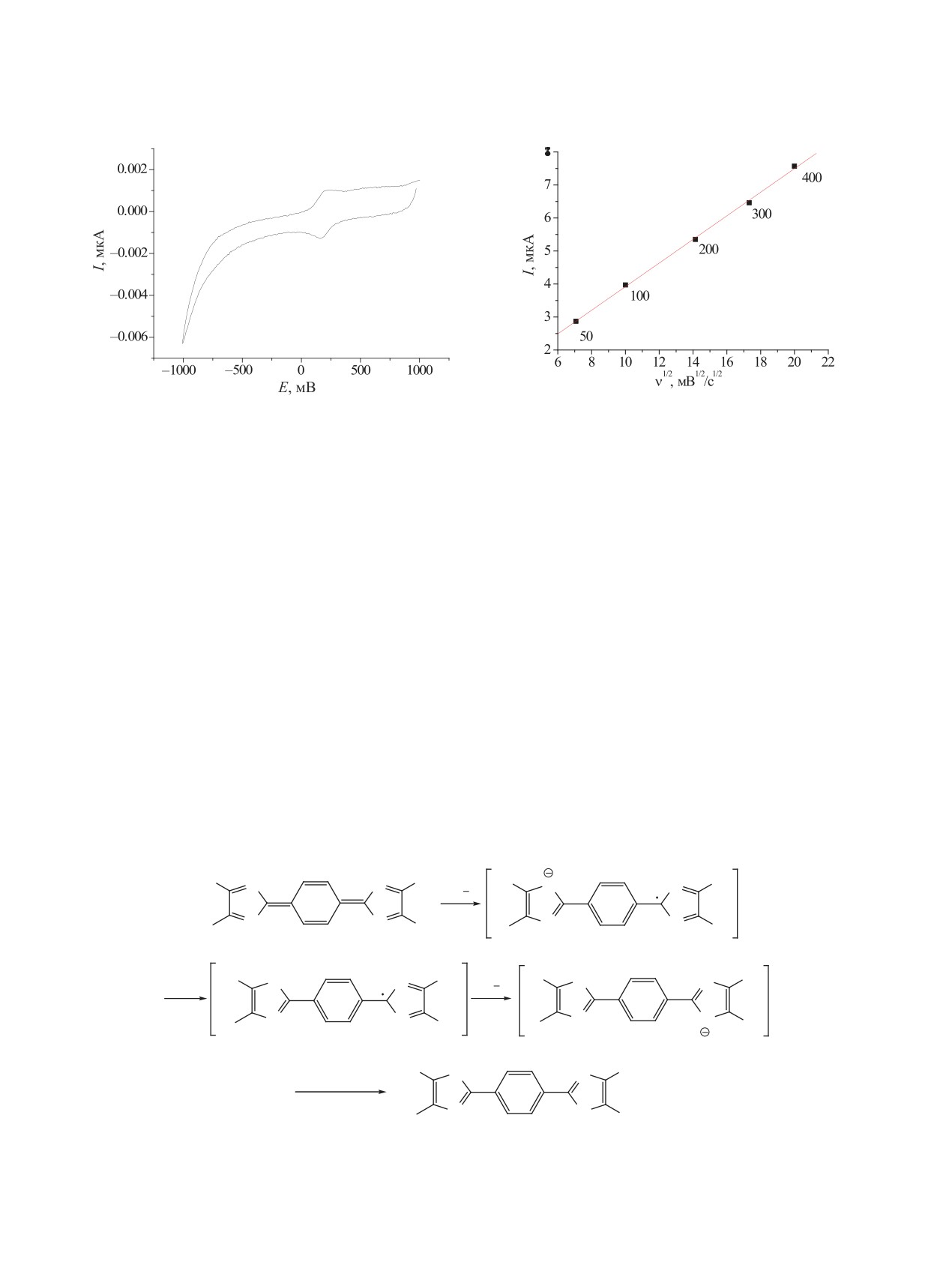
рис. 1. Следовательно, двухэлектронный характер
зано выше, на обратном скане ЦВА наблюдается
волны восстановления можно объяснить следую-
обратимая волна (рис. 1). Следовательно, данная
щим образом: образующийся на первой стадии
схема электрохимического процесса не объясняет
анион-радикал быстро отрывает протон от рас-
наблюдаемую экспериментальную картину. По-
творителя (или протонируется) и в тот же момент
видимому, дианион соединения 3а, окисление ко-
вновь восстанавливается при том же потенциале
торого наблюдали на обратном скане ЦВА, должен
до анион-радикала, который может вступать в раз-
образовываться по другому механизму. Можно
личные химические превращения, например, про-
предположить, что образующийся на первой ста-
тонироваться (схема 3).
дии анион-радикал подвергается очень быстрому
диспропорционированию с образованием дианио-
Такая цепь последовательных электрохими-
на и первоначального соединения, которое затем
ческих и химических процессов описывается как
вновь восстанавливается (схема 4).
ЭХЭХ-механизм (электрохимическая стадия, за-
тем химическая, вновь электрохимическая и хими-
На ЦВА-кривой при реализации данной схемы
ческая). Однако при реализации данного механиз-
должна наблюдаться волна, соответствующая фор-
ма волны восстановления должны быть необра-
мальному двухэлектронному процессу, что и име-
тимы, поскольку за электрохимической следует
ет место на самом деле. Можно предположить, что
химическая стадия. А в нашем случае, как пока-
образующийся на первой стадии анион-радикал
Схема 3.
Ph
Ph
Ph
Ph
N
N
N
N
+e
N
N
N
N
Ph
Ph
Ph
Ph
H
H
Ph
Ph
Ph
Ph
N
N
N
N
Solv
+
e
N
N
N
N
Ph
Ph
Ph
Ph
H
Ph
Ph
N
N
Solv
N
N
Ph
Ph
H
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1118
ЧУГУНОВ и др.
Схема 4.
Ph
Ph
Ph
Ph
N
N
N
N
+e
N
N
N
N
Ph
Ph
Ph
Ph
3a
Ph
Ph
N
N
диспр.
+ 3a
N
N
Ph
Ph
неустойчив, и это провоцирует его диспропорци-
формы можно увеличить введением акцепторного
онирование. Однако данный факт в некоторой сте-
заместителя в центральное кольцо. С этой целью
пени противоречит литературным данным о вос-
мы исследовали соединения 3b и 3c.
становлении соединений, содержащих хиноновую
На данной ЦВА, как и на ЦВА соединения 3а,
структуру [6], поскольку известно, что соединения
наблюдается также одна обратимая волна при Е
данной структуры восстанавливаются в 2 после-
0.195 В. По сравнению с соединением 3а, потенци-
довательные одноэлектронные стадии. В боль-
ал восстановления смещен в положительную сто-
шинстве случаев данные литературы о восстанов-
рону, что хорошо согласуется с электрономерным
лении соединений, имеющих хиноновую струк-
эффектом заместителя. Однако процесс диспро-
туру, приведены лишь в одном растворителе, что
порционирования анион-радикала, получаемого
не позволяет оценить или выделить роль природы
на первой стадии восстановления, введением ато-
растворителя на устойчивость промежуточно об-
ма брома не удалось предотвратить. Увеличение
разующихся интермедиатов. А это существенно,
скорости развертки потенциала до 1 В (рис. 3) не
поскольку известно, что очень важным фактором,
приводит к обнаружению анион-радикала. Таким
влияющим на устойчивость смешанно-валент-
образом, электрохимические свойства соединения
ных состояний, является природа растворителя. В
3b описываются схемой 4.
дальнейшем нами планируется изучение электро-
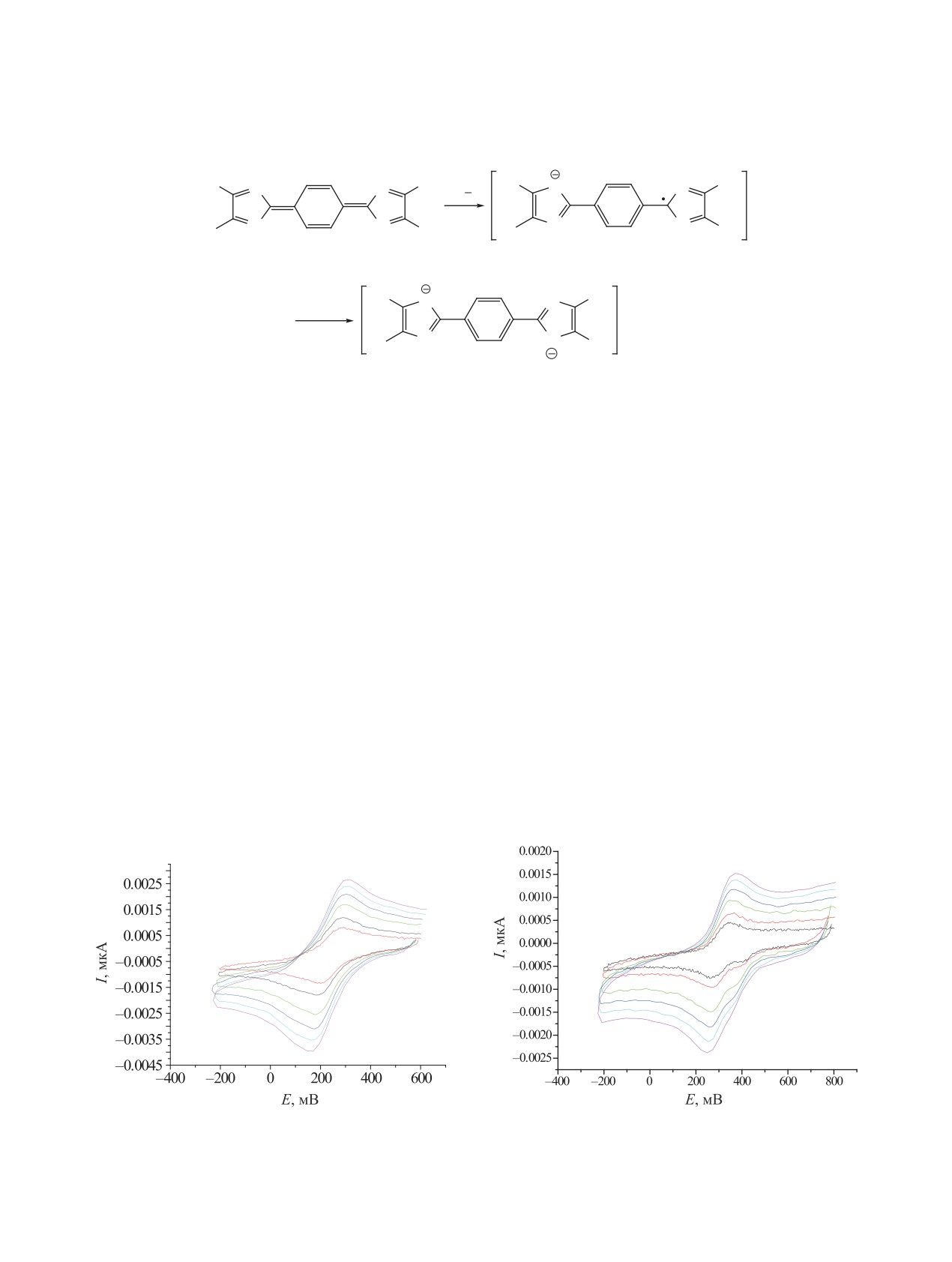
Введение второго атома брома в центральное
химических свойств соединений 3а-с и в других
фенильное кольцо качественно меняет электрохи-
растворителях.
мическую картину (рис. 4)
Кроме замены растворителя, устойчивость по-
Как видно из рис. 4, наблюдаются 2 обратимых
лученного на первой стадии анион-радикальной
пика восстановления при Е = 0.400 В и Е = 0.275 В
Рис. 3. ЦВА соединения 3b (1 мМ, Pt, CH2Cl2, 0.1 M
Рис 4. ЦВА соединения 3с (1 мМ, Pt, CH2Cl2, 0.1 M
Bu4NPF6, 100 мВ/с).
Bu4NPF6, 100 мВ/с).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
ПОЛУЧЕНИЕ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА 2,5-ДИЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ
1119
Схема 5.
Br
Br
Ph
Ph
Ph
Ph
N
N
N
N
+
e
-
e
N
N
N
N
Ph
Ph
Ph
Ph
Br
Br
Br
Ph
Ph
N
N
+e
-e
N
N
Ph
Ph
Br
даже при невысоких скоростях развертки потенци-
на А, который устойчив во времени и не претерпе-
ала. По сравнению с соединениями 3а и 3b потен-
вает химических превращений.
циал восстановления первой волны сильно сме-
На основе данных ЦВА можно предположить,
щен в анодную область. Столь сильное смещение
что соединение 3с в растворе довольно легко
потенциала нельзя объяснить только электрон-
переходит в бирадикальное состояние. При
ными эффектами дополнительно введенного ато-
этом оно обладает сильным акцепторным харак-
ма брома, поскольку потенциал восстановления
тером, причем как в нейтральной форме, так и в
соединения 3b лишь незначительно смещен по
форме анион-радикала. Этого удалось достичь за
сравнению с таковым для соединения 3a. Кроме
счет введения заместителей, которые нарушили
того, второй потенциал восстановления соеди-
компланарность хиноновой системы соединения
нения 3c находится также левее, чем первый
3с, что позволило локализовать радикалы по ими-
потенциал для соединений 3a и 3b, что свиде-
дазолильным фрагментам. Это, в свою очередь,
тельствует о том, что даже анион-радикал обла-
привело к тому, что формально бирадикальная си-
дает большей акцепторной способностью. Можно
стема проявляет свойства монорадикальной сис-
предположить, что в растворе соединение
3c
темы. При этом потенциал восстановления сое-
склонно к образованию бирадикальной частицы,
динения 3с сильно смещается в анодную область.
в которой 2 радикальных центра не взаимодей-
Этот факт хорошо согласуется с литературными
ствуют или взаимодействуют в слабой степени
данными о восстановлении монорадикальных со-
между собой и процесс восстановления идет по
единений.
этим радикальным центрам. Это может быть след-
ствием того, что атомы брома в положениях 2 и 5
Описан синтез и получены электрохимические
нарушают компланарность хиноидной системы
характеристики 2,5-дизамещённых производных
соединения 3c.
1,4-бис(4,5-дифенилимидазол-2-ил)бензола. С ис-
пользованием метода циклической вольтампе-
Электрохимические свойства соединения 3c
рометрии подробно исследовано влияние замес-
можно объяснить следующей схемой (схема 5).
тителей на значения редокс-характеристик.
На первой стадии происходит восстановле-
Неожиданные результаты получены при изучении
ние соединения 3с с образованием устойчивой
редок-свойств 2,5-дизамещённых 1,4-бис(4,5-ди-
анион-радикальной формы. Поскольку введение
фенилимидазол-2-ил)бензола: электрохимически
в центральное кольцо 2 атомов брома сильно по-
обратимая редок-трансформация хинон - биради-
нижает энергию верхней занятой молекулярной
кал протекает при положительных потенциалах.
орбитали ВЗМО, на которой локализован процесс
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
восстановления, то и потенциалы сильно смеща-
ются в анодную область. На второй стадии проис-
Растворители перед использованием сушили и
ходит восстановление анион-радикала до дианио-
перегоняли. Все реагенты приобретены у «Sigma-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1120
ЧУГУНОВ и др.
Aldrich» и использованы в том виде, в котором они
при непрерывном охлаждении и постоянном пе-
были получены. ИК спектры получены в таблет-
ремешивании приливали небольшими порциями
ках KBr на Фурье-спектрометре ИнфраЛЮМ ФТ-
8.5 мл (0.15 моль) H2SO4, поддерживая температу-
02 (Россия).
ру реакционной смеси в интервале 6-12°С. Затем
к реакционной смеси небольшими порциями до-
Спектры ЯМР 1Н и 13С растворов соедине-
бавили 10 г (0.1 моль) CrO3, поддерживая темпе-
ний сняты на спектрометре JNM-ECX400 фирмы
ратуру в реакционной колбе в пределах 5-10°С.
Jeol (Япония, 400.1 и 100.6 MГц соответственно)
По окончании прибавления CrO3 перемешивание
для растворов веществ в CDCl3 или ДМСО-d6.
продолжали 1.5 ч при температуре 6-12°С. Затем
Химические сдвиги приведены относительно
реакционную смесь выливали в ледяную воду и
остаточных сигналов дейтерированного раствори-
оставляли при комнатной температуре на 24 ч.
теля.
Выпавший осадок отфильтровывали. Сушили на
Элементные анализы выполнены на СHNS-
воздухе, перекристаллизовывали из этанола.
анализаторе Vario MICRO (Германия). Условия
аналитической ТСХ: адсорбент - Silufol UV-245,
В круглодонную колбу емкостью 250 см3, снаб-
женную обратным холодильником, помещали
элюент - метилен хлористый-этилацетат (2:1),
проявление в иодной камере. Для колоночной хро-
6.26 г (0.015 моль) соответствующего ацеток-
матографии использовали силикагель L40/100 μ;
сипроизводного, 60 мл этилового спирта, 60 мл
элюент - бензол.
10 см3 воды и 8 мл конц. H2SO4. Содержимое кол-
бы кипятили в течение 1.5 ч, после чего реакци-
Измерения электрохимических потенциалов
онную смесь охлаждали до комнатной температу-
восстановления проводили с помощью цифрового
ры и разбавляли водой (200 мл). Образовавшийся
потенциостата-гальваностата Gamry (Канада)
светло-желтый осадок отфильтровывали, очищали
в электрохимической ячейке объемом
5 мл,
кристаллизацией из смеси хлороформ-петролей-
подключенного к персональному компьютеру.
ный эфир.
Вольтамперограммы снимали на фоне 0.05 М
н-Bu4NBF4 в CH3CN при 20°С в специальной
2-Бромтерефталевый альдегид (1b). Выход
электрохимической ячейке объемом
10 мл.
2.56 г (80.1%). т.пл. 75-78°С. ИК спектр, ν, см-1:
Кислород из ячейки удаляли продуванием сухого
1696 c (С=О), 1199 cр, 817 ср, 694 ср. Спектр ЯМР
аргона. Вольтамперные кривые регистрировали
1Н (CDCl3), δ, м.д.: 7.72-7.81 м (2H), 8.15 с (1H,
методом циклической вольтамперометрии на
J 1.8, 0.4 Гц), 10.33 с (1H), 10.37 с (1H). Спектр
стационарном платиновом электроде (S 0.6 см2)
ЯМР 13С (CDCl3), δ, м.д.: 125.3, 126.1, 130.5, 131.7,
при различных скоростях развертки потенциала.
135.4, 137.6, 189.5, 190.2 (С=О). Найдено, %: C
В качестве электрода сравнения использовали
45.18; H 2.36. C8H5BrO2. Вычислено, %: C 45.11;
насыщенный хлорсеребряный электрод (потен-
H 2.37.
циал относительно Fc/Fc+ - 0.55 В в CH3CN).
Получение соединений 2а-с (общая методи-
Измеренные значения потенциалов пересчитывали
ка). В круглодонную колбу емкостью 50 мл, снаб-
с учетом омических потерь.
женную обратным холодильником, поместили
Терефталевый альдегид
(1а),
2,5-дибром-
0.7 ммоль соответствующего диальдегида 1-с,
терефталевый альдегид (1с) [7], имидазолы 2a-c и
300 мг (1.4 ммоль) бензила, 700 мг (1.9 ммоль)
хиноны 3a, b, c получали по модифицированным
ацетата аммония и 20 мл ледяной уксусной кисло-
методикам, описанным в работах [8, 9].
ты. Реакционную смесь кипятили в течение 2 ч. В
2-Бромтерефталевый альдегид (1b). В трёх-
процессе кипячения осадок растворился и раствор
горлую колбу емкостью 200 мл, снабженную об-
приобрел золотистый цвет. По истечении времени
ратным холодильником, механической мешалкой и
реакционную смесь охлаждали и добавляли 50 мл
термометром, помещали 3.7 г (0.02 моль) 2-бром-
воды и 10 мл раствора аммиака. Выпавший осадок
ксилола, 60 мл (0.95 моль) ледяной уксусной кис-
отфильтровывали. Сушили на воздухе. Получили
лоты, 56.5 мл (0.1 моль) уксусного ангидрида и
мелкокристаллический порошок желтого цвета.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
ПОЛУЧЕНИЕ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА 2,5-ДИЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ
1121
1,4-Бис(4,5-дифенилимидазолил-2)бензол
леный. По окончании добавления K3[Fe(CN)6] ре-
(2а). Выход 270 мг (75%), т.пл. 300°С, т.разл.
акционную смесь перемешивали в атмосфере ар-
305°С. ИК спектр, ν, см-1: 3375 ср (NH), 1659 ср
гона и температуре 5-7°C в течение 30 мин. Затем
(C=CAr), 1509 с (C=CAr), 1339 cр (С=N), 1126 ср,
выпавший осадок отфильтровывали и промывали
895 с. Спектр ЯМР 1Н, δ, м.д.: 7.29-7.52 м (12H),
на фильтре большим количеством воды, суши-
7.62-7.71 м (8H), 8.07 д.д (4H, J 8.7, 1.9 Гц), 12.92
ли на воздухе. Получали мелкокристаллический
уш.с (2H, NH). Спектр ЯМР 13C, δ, м.д.: 124.2,
порошок фиолетового цвета. С целью удаления в
126.9, 127.1, 128.6, 128.9, 130.4, 133.3, 137.7, 148.2.
продукте остатков непрореагировавшего вещества
Найдено, %: C 84.05; H 5.07; N 10.86. C36H26N4.
продукт растворяли в 50 мл бензола и отделяли от
Вычислено, %: C 84.02; H 5.09; N 10.89.
нерастворившегося остатка. Бензольный раствор
упаривали в вакууме до объема 10 мл и к остатку
1,4-Бис(4,5-дифенилимидазолил-2)-2-бром-
добавляли 5 мл октана. Выпавший осадок отфиль-
бензол (2b). Выход 350 мг (84%), т.пл. 300°С,
тровывали. Сушили на воздухе. Получили мелко-
т.разл. 315°С. ИК спектр, ν, см-1: 3360 ср (NH),
кристаллический порошок зеленого цвета.
1662 ср (C=CAr), 1504 с (C=CAr), 1343 cр (С=N),
1130 ср, 894 с, 698 с (С-Br). Спектр ЯМР 1Н, δ,
3,6-Бис(4,5-дифенилимидазолиден-2)-1,4-
м.д.: 7.45-7.64 м (12H), 7.78 д.д (1H, J 8.5, 1.9 Гц),
циклогексадиен (3а). Выход 120 мг (25%), т.пл.
7.83-7.92 м (4H), 7.95-8.02 м (3H), 8.08 д.д (1H,
135-137°С (С6Н6-C8H18). ИК спектр (KBr), ν, см-1:
J 1.9, 0.4 Гц), 12.71 уш.с (2H, NH). Спектр ЯМР
1610 ср (C=CAr), 1571 ср (C=CAr), 1333 ср (С=N),
13C, δ, м.д.: 122.7, 124.2, 126.3, 126.8, 126.9, 127.1,
1290 ср, 895 с. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
127.8, 128.6, 129.0, 130.4, 130.7, 133.3, 137.7, 148.2.
6.95 д (4H, J 10.2 Гц), 7.52-7.62 м (12H), 8.07 д.д.д
Найдено, %: C 72.66; H 4.24; N 9.46. C36H25BrN4.
(8H, J 7.9, 1.7, 1.5 Гц). Спектр ЯМР 13C (ДМСО-d6),
Вычислено, %: C 72.85; H 4.25; N 9.44.
δ, м.д.: 107.1, 128.2, 129.1, 131.2, 132.1, 133.2, 134.9,
140.1, 159.8. Найдено, %: C 84.32; H 4.71; N 10.96.
1,4-Бис(4,5-дифенилимидазолил-2)-2,5-ди-
C36H24N4. Вычислено, %: C 84.35; H 4.72; N 10.93.
бромбензол (2c). Выход 330 мг (70%), т.пл. 300°С,
т.разл. 325°С. ИК спектр (KBr), ν, см-1:
3325
3,6-Бис(4,5-дифенилимидазолиден-2)-2-бром-
ср (NH), 1672 с (C=CAr), 1594 ср (C=CAr), 1344
1,4-циклогексадиен (3b). Выход 140 мг (23.6%),
ср (С=N), 1284 с, 694 с (С-Br). Спектр ЯМР 1Н
т.пл. 157-158°С (С6Н6-C8H18). ИК спектр (KBr),
(ДМСО-d6), δ, м.д.: 7.45-7.63 м (12H), 7.87 д.д.д
ν, см-1: 1604 ср (C=CAr), 1566 ср (C=CAr), 1326
(4H, J 7.1, 2.0, 1.5 Гц), 7.93 д.д.д (4H, J 7.7, 1.7,
ср (С=N), 1280 ср, 894 с, 694 с (С-Br). Спектр
1.5 Гц), 8.08 д (2H, J 0.4 Гц), 12.75 уш.с (2H, NH).
ЯМР 1Н (ДМСО-d6), δ, м.д.: 7.51-7.58 м (4H),
Спектр ЯМР 13C (CDCl3), δ, м.д.: 120.7, 124.2,
7.58-7.68 м (8H), 7.78-7.85 м (4H), 7.93-8.04 м
126.3, 126.9, 128.6, 128.9, 129.2, 130.4, 130.7, 133.3,
(2H), 8.12 с (1Н), 8.20-8.26 м (4H). Спектр ЯМР
137.7, 148.2. Найдено, %: C 64.32; H 3.61; N 8.36.
13C (ДМСО-d6), δ, м.д.: 108.1, 114.2, 121.4, 127.2,
C36H24Br2N4. Вычислено, %: C 64.30; H 3.60; N
128.7, 128.9, 129.2, 132.2, 133.2, 134.9, 150.6, 158.9.
8.33.
Найдено, %: C 73.12; H 3.91; N 9.46. C36H23BrN4.
Вычислено, %: C 73.10; H 3.92; N 9.47.
Получение хинонов 3а-c (общая методика). В
четырехгорлую колбу, емкостью 100 мл, снабжен-
3,6-Бис(4,5-дифенилимидазолиден-2)-2,5-ди-
ную механической мешалкой, капельной воронкой
бром-1,4-циклогексадиен
(3с). Выход
270 мг
и системой для подвода газа, помещали 12.5 мл 6%
(30.2%), т.пл. 172-174°С (С6Н6-C8H18). ИК спектр
раствора КОН и суспензию 1 ммоль одного из сое-
(KBr), ν, см-1: 1609 ср (C=CAr), 1570 ср (C=CAr),
динений 2а-c в 25 мл диоксана. В течение 2 ч при
1333 ср (С=N), 1282 ср, 896 с, 699 с (С-Br). Спектр
постоянном перемешивании в атмосфере аргона
ЯМР 1Н (ДМСО-d6), δ, м.д.: 7.55-7.67 м (12H),
прикапывали 100 мл 20% раствора K3[Fe(CN)6],
7.78-7.85 м (8H), 8.02 с (2H). Спектр ЯМР 13C
поддерживая температуру реакционной смеси
(ДМСО-d6), δ, м.д.: 115.2, 120.4, 128.2, 129.2, 129.8,
5-7°С. При добавлении первых капель раствора
131.9, 133.0, 133.2, 158.9. Найдено, %: C 64.47; H
K3[Fe(CN)6] реакционная смесь приобрела пур-
3.32; N 8.39. C36H22Br2N4. Вычислено, %: C 64.50;
пурный цвет, который в дальнейшем перешел в зе-
H 3.31; N 8.36.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1122
ЧУГУНОВ и др.
ФОНДОВАЯ ПОДДЕРЖКА
3. Zeng C.-C., Zhang N.-T., Lam C.M., Little R.D. Org.
Lett. 2012, 14, 1314-1317. doi 10.1021/ol300195c
Работа выполнена при финансовой поддерж-
4. Englander F. Пат. 4465865. США.
ке Министерства науки и высшего образования
5. Gerrard W., Green W. J., Nutkins R.A., Sykes A.,
Российской Федерации в рамках правитель-
Tatlow J.C., Addison C.C., Lewis J., Jones R.L., Le
ственной задачи в области научной деятельности
Fèvre R. J. W., Northcott J., Hall R.H., Stern E.S.,
(проект № 4.4566.2017/8.9).
Naylor J.R., Islam A.M., Raphael R.A. J. Chem. Soc.
КОНФЛИКТ ИНТЕРЕСОВ
1952, 4076-4087.
Авторы заявляют об отсутствии конфликта ин-
6. Bard A.J., Faulkner L.R. Electrochemical Methods.
New York: John Wiley, 2001.
тересов.
7. Xia C., Advincula R.C. Macromol. 2001, 34, 6922-
СПИСОК ЛИТЕРАТУРЫ
6928. doi 10.1021/ma0100192
1. Lu N.-N., Yoo S.J., Li L.-J., Zeng C.-C., Little R.D.
8. Maeda K., Sakaino Y., Hayashi T. Nippon Kagaku
Electrochim. Acta. 2014, 142, 254-260. doi 10.1016/
Kaishi.
1972,
1972,
100-103. doi
10.1246/
j.electacta.2014.07.105
nikkashi.1972.100
2. Francke R., Little R.D. J. Am. Chem. Soc. 2014, 136,
9. Sakaino Y., Kakisawa H., Kusumi T., Maeda K. J. Org.
427-435. doi 10.1021/ja410865z
Chem. 1979, 44, 1241-1244. doi 10.1021/jo01322a010
2,5-Disubstituted Derivatives 1,4-Bis(4,5-diphenidimidazol-2-yl)-
benzene: Obtaining and Surprising Electrochemical Properties
D. B. Chugunov*, E. V. Okina, A. S. Timonina, L. A. Klimaeva, and Yu. M. Selivanova
National Research Ogarev Mordovia State University,
430005, Russia, Republic of Mordovia, Saransk, Bolshevistskaya ul. 68
*e-mail: iman081@gmail.com
Received February 7, 2020; revised April 17, 2020; accepted April 21, 2020
The synthesis was carried out and the electrochemical characteristics of 2,5-disubstituted derivatives of
1,4-bis(4,5-diphenilimidazol-2-yl)benzene were obtained. Using the cyclic voltammetry method was studied
in detail effect of various substituents on the values of redox characteristics. We studied the redox properties of
2,5-disubstituted 1,4-bis(4,5-diphenilimidazol-2-yl)benzene, the electrochemically reversible rare transformation
of quinone - biradical, proceeds at positive potentials.
Keywords: biradicals, monoradicals, cyclic voltammetry, 1,4-bis(4,5-diphenidimidazol-2-yl)benzene
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020