ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 7, с. 1132-1136
КРАТКИЕ СООБЩЕНИЯ
УДК 547.823
СИНТЕЗ 2-АМИНО-6-АРИЛСУЛЬФАНИЛ-
4-АЦИЛПИРИДИН-3,5-ДИКАРБОНИТРИЛОВ
© 2020 г. Я. С. Каюковa, С. В. Карповa, О. В. Каюковаb, *, А. А. Григорьевa, **
a ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»,
428015, Россия, Чувашская Республика, г. Чебоксары, Московский пр. 15
b ФГБОУ ВО «Чувашская государственная сельскохозяйственная академия»,
428003, Россия, Чувашская Республика, г. Чебоксары, ул. К. Маркса 29
*e-mail: olgakajukova@mail.ru
**e-mail: grigorev.arth@gmail.com
Поступила в редакцию 05 марта 2020 г.
После доработки 10 марта 2020 г.
Принята к публикации 15 марта 2020 г.
Взаимодействие 2-амино-4-ацил-6-хлоропиридин-3,5-дикарбонитрилов с ароматическими тиолами
приводит к образованию 2-амино-6-арилсульфанил-4-ацилпиридин-3,5-дикарбонитрилов. Превращение
реализуется в инертной среде в присутствии основания.
Ключевые слова: пиридин-3,5-дикарбонитрил, производные 2-сульфанилпиридина, тиофенол, нукле-
офильное замещение.
DOI: 10.31857/S0514749220070186
Производные 2-аминопиридин-3,5-дикарбони-
ному окружению пиридин-3,5-дикарбонитрилы
трила содержащие в шестом положении сульфа-
находят применение в качестве исходных соедине-
нильную группу являются соединениями, обла-
ний для синтеза конденсированных производных
дающие рядом биологически активных свойств.
пиридина [16].
Среди данных производных обнаружены предста-
Ранее нами было представлено, что 2-ацил-
вители с антимикробной [1-3], противораковой
1,1,3,3-тетрацианопропениды щелочных метал-
[4, 5] и противовирусной активностью [6, 7].
лов (АТЦП) 1 [17] в присутствии алифатических
Описаны примеры ингибиторов тирозинкиназы
тиолов могут подвергаться внутримолекулярной
[8], фермента МК-2
[9-11] и ДНК-метил-
гетероциклизации с образованием 6-алкилсульфа-
трансферазы 1 [12, 13]. Некоторые 2-амино-6-суль-
нил-2-амино-4-ацилпиридин-3,5-дикарбонитри-
фанилпиридин-3,5-дикарбонитрилы опробованы в
лов 2 [18] (схема 1).
качестве агентов, подавляющих репликацию бел-
ка PrPSc [14], который согласно исследованиям,
В ходе исследования данного превращения
является причиной инфекционных заболеваний.
нами было обнаружено, что наличие следов воды
Имеются сообщения о разработке селективных
в реакционной массе может приводить к более
агонистов и антагонистов аденозиновых рецепто-
глубоким превращениям с образованием пирро-
ров человека, некоторые из которых в настоящее
ло[3,4-c]пиридинов 3 [19]. Поэтому синтез соеди-
время находятся на стадии клинических испыта-
нений 2 требует применения безводного ДМСО.
ний [15]. Благодаря насыщенному функциональ-
Помимо этого, необходимо предварительно полу-
1132
СИНТЕЗ 2-АМИНО-6-АРИЛСУ
ЛЬФАНИЛ-4-АЦИЛПИРИДИН-3,5-ДИКАРБОНИТРИЛОВ
1133
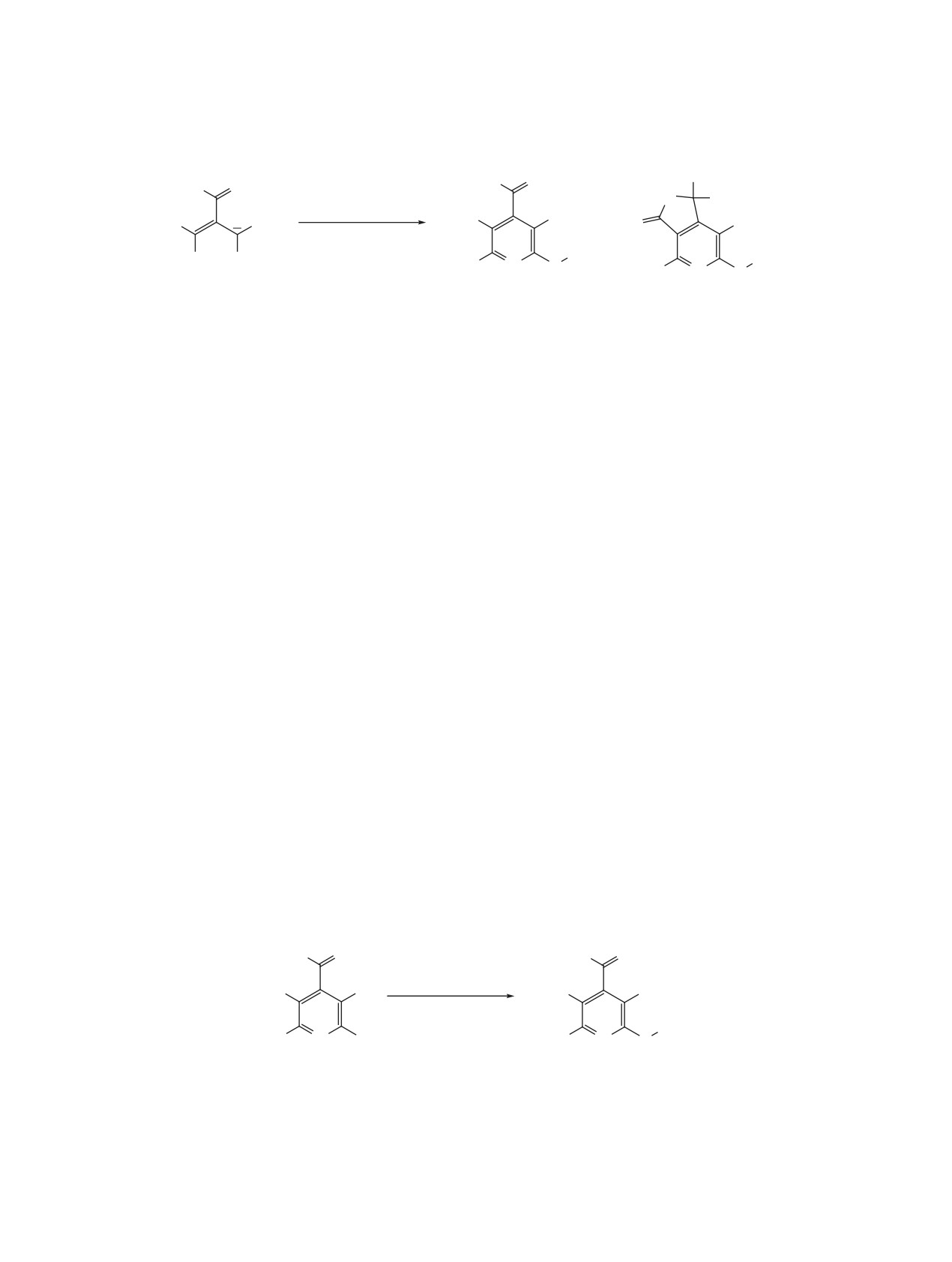
Схема 1.
R
R O
R O
AlkSH,
HN
OH
NaH, DMSO
NC
CN
NC
CN
+
O
CN
K+
Alk
CN
CN
Alk
H2N
N S
H2N
N S
1
2
3
чить димсил-натрий, который выступает в роли
карбонитрилы 2а-е в своем составе содержат
основания в превращении. Для того чтобы разра-
орто-кетокарбонитрильные группы, которые мо-
ботать метод синтеза 2, который не требует специ-
гут быть вовлечены в дальнейшие превращения
фических реагентов и условий, а также позволяет
с целью аннелирования дополнительного цикла
масштабировать процесс, было предложено опро-
по связи [c] пиридинового кольца. Таким обра-
бовать иной подход с применением в качестве ис-
зом, было показано, что с использованием арома-
ходных соединений 2-амино-4-ацил-6-хлорпири-
тических тиолов и 2-амино-4-ацил-6-хлорпири-
дин-3,5-дикарбонитрилов 4 (схема 2).
дин-3,5-дикарбонитрилов 4 могут быть получены
4-ацил-6-сульфанилпиридин-3,5-дикарбонитри-
Было обнаружено, что пиридины 4а-е при дей-
лы 2. Представленный метод синтеза не требует
ствии на них ароматическими тиолами, в качестве
специальных условий и реагентов и может найти
которых выступали тиофенол и пара-тиокрезол,
применение при целенаправленном исследовании
подвергаются превращению в
2-амино-6-арил-
реакционной способности пиридинов 2.
сульфанил-4-ацилпиридин-3,5-дикарбонитрилы
2а-е, с выходами 64-75%.
2-Амино-4-бензоил-6-(фенилсульфанил)пи-
ридин-3,5-дикарбонитрил
(2а). К раствору
Структура синтезированных соединений уста-
0.565 г
(2 ммоль)
6-хлорпиридин-3,5-дикар-
новлена по данным ИК, ЯМР 1Н и 13С спектроско-
бонитрила 4а в 20 мл 1,4-диоксана добавляли
пии и масс спектрометрии.
0.22 г (2 ммоль) тиофенола и 0.20 г (2 ммоль) три-
Данный метод синтеза пиридинов 2 удалось
этиламина. Полученный раствор перемешивали
реализовать только на примере ароматических
при комнатной температуре 5-10 мин (контроль
тиолов, применение алифатических производных
по ТСХ), затем разбавляли 100 мл дистиллиро-
приводит к образованию смесей соединений, ко-
ванной воды и нейтрализовывали 5% раствором
торые разделить не удалось. Полагаем это вызвано
H2SO4. Выпавшие кристаллы отфильтровывали и
тем, что алифатические тиолы вступают в конку-
промывали охлажденным EtOH (2×10 мл). Выход
рирующие превращения с карбонильной группой
0.506 г (71%), т.пл. 200-202°С. ИК спектр, ν, см-1:
исходных галогенпиридинов 4. Синтезированные
3329, 3227 (NH2), 2219 (C≡N), 1639 (C=O). Спектр
2-амино-6-арилсульфанил-4-ацилпиридин-3,5-ди-
ЯМР 1Н, δ, м.д.: 7.48-7.54 м (3Hаром), 7.62-7.69 м
Схема 2.
R O
R O
ArSH, Et3N, DiOx
NC
CN
NC
CN
-Et3N.HCl
Ar
H2N
N Cl
H2N N S
4a-e
2a-e
4, R = Ph (a), 4-CH3C6H4 (b), 4-CH3OC6H4 (c), 2-thienyl (d), tert-Bu (e);
2, R = Ph, Ar = Ph (a), R = 4-CH3C6H4, Ar = Ph (b), R = 4-CH3OC6H4, Ar = Ph (c),
R = 2-thienyl, Ar = Ph (d), R = tert-Bu, Ar = 4-CH3C6H4 (e).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1134
КАЮКОВ и др.
(4Hаром), 7.81 т (1Hаром, J 7.3 Гц), 8.01 д (2Hаром,
J 4.7, 4.1 Гц), 7.49-7.53 м (3Hаром, SC6H5), 7.62-
J 7.3 Гц), 8.15 уш.с
(2H, NH2). Спектр ЯМР
7.65 м (2H, SC6H5), 8.03 д.д (1Hаром, С4H3S, J 3.8,
13С, δ, м.д.: 83.8, 89.7, 113.7, 114.0, 126.7, 129.5,
0.9 Гц), 8.14 уш.с (2H, NH2), 8.38 д (1Hаром, С4H3S,
129.6, 129.9, 130.1, 133.1, 134.8, 136.1, 159.7, 159.2,
J 4.8 Гц). Спектр ЯМР 13С, δ, м.д.: 84.0, 89.8, 113.7,
166.67, 191.1. Масс-спектр, m/z (Iотн, %): 358 (5)
114.0, 126.8, 129.6, 129.9, 130.0, 134.8, 139.7, 139.9,
[M + 2]+,
356
(13)
[M]+,
105
(100)
[PhCO]+.
140.2, 155.9, 159.3, 166.7, 182.6. Масс-спектр, m/z
Найдено, %: C 67.26; H 3.40; N 15.86. C20H12N4OS.
(Iотн, %): 364 (4) [M + 2]+, 362 (18) [M]+, 111 (100)
Вычислено, %: C 67.40; H 3.39; N 15.72. М 356.40.
[ArCO]+. Найдено, %: C 59.40; H 2.79; N 15.51.
C18H10N4OS2. Вычислено, %: C 59.65; H 2.78; N
Соединения 2b-d были получены по аналогич-
15.46. М 362.43.
ной методике с применением тиофенола в каче-
стве тиола, для синтеза 2e использовали пара-ти-
2-Амино-4-пивалоил-6-(п-толилсульфанил)-
окрезол.
пиридин-3,5-дикарбонитрил (2e). Выход 0.477 г
(68%), т.пл. 197-198°С. ИК спектр, ν, см-1: 3336,
2-Амино-4-(4-метилбензоил)-6-(фенил-
3231 (NH2), 2223 (C≡N), 1638 (C=O). Спектр
сульфанил)пиридин-3,5-дикарбонитрил
(2b).
ЯМР 1Н, δ, м.д.: 1.29 c [9H, C(CH3)3], 2.36 c (3H,
Выход 0.474 г (64%), т.пл. 201-204°С. ИК спектр,
SC6H4CH3), 7.30 д (2Hаром, J 8.0 Гц), 7.47 д (2Hаром,
ν, см-1: 3330, 3226 (NH2), 2218 (C≡N), 1637 (C=O).
J 8.1 Гц), 8.09 уш.с (2H, NH2). Спектр ЯМР 13С, δ,
Спектр ЯМР 1Н, δ, м.д.: 2.45 с (3H, С6H4CH3), 7.46
м.д.: 20.9, 26.8, 45.1, 81.9, 87.9, 114.7, 115.0, 122.9,
д (2Hаром, C6H4СН3, J 8.3 Гц), 7.48-7.54 м (3Hаром,
130.2, 135.0, 139.8, 158.9, 159.1, 167.3, 208.5. Масс-
SC6H5), 7.62-7.69 м (2Hаром, SC6H5), 7.97 д (2H,
спектр, m/z (Iотн, %): 364 (6) [M + 2]+, 350 (23) [M]+,
C6H4СН3, J 8.3 Гц), 8.12 уш.с (2H, NH2). Спектр
265 (100). Найдено, %: C 65.23; H 5.20; N 15.81.
ЯМР 13С, δ, м.д.: 21.5, 83.8, 89.7, 113.7, 114.0,
C19H18N4OS. Вычислено, %: C 65.12; H 5.18; N
126.8, 129.5, 129.8, 130.2, 130.8, 134.8, 147.2, 157.0,
15.99. М 350.12.
159.2, 166.6, 190.4. Масс-спектр, m/z (Iотн, %):
372 (7) [M + 2]+, 370 (19) [M]+, 119 (100) [ArCO]+.
Индивидуальность синтезированных соеди-
Найдено, %: C 68.20; H 3.79; N 15.27. C21H14N4OS.
нений подтверждена методом ТСХ на пластинах
Вычислено, %: C 68.09; H 3.81; N 15.13. М 370.43.
Sorbfil ПТСХ-АФ-A-УФ (элюент EtOAc), проявле-
ние УФ-свет (365, 254 нм), термическое разложе-
2-Амино-4-(4-метоксибензоил)-6-(фенил-
ние. ИК спектры снимали на приборе ИК Фурье-
сульфанил)пиридин-3,5-дикарбонитрил
(2c).
спектрометре ФСМ-1202 в тонком слое (суспен-
Выход 0.580 г (75%), т.пл. 250-252°С. ИК спектр,
зия в вазелиновом масле). Спектры ЯМР 1Н и 13C
ν, см-1: 3329, 3228 (NH2), 2220 (C≡N), 1642 (C=O).
регистрировали на спектрометре Bruker Avance
Спектр ЯМР 1Н, δ, м.д.: 3.91 с (3H, ОCH3), 7.15 д
III HD 400 при рабочих частотах 400 и 101 МГц
(2Hаром, C6H4ОСН3, J 9.1 Гц), 7.48-7.53 м (3Hаром,
соответственно, растворитель - ДМСО-d6, вну-
SC6H5), 7.61-7.67 м (2Hаром, SC6H5), 7.89 д (2H,
тренний стандарт - остаточный сигнал раствори-
C6H4ОСН3, J 9.1 Гц), 8.10 уш.с (2H, NH2). Спектр
теля (2.50 и 39.53 м.д.). Масс-спектры снимали на
ЯМР 13С, δ, м.д.: 55.7, 83.65, 89.6, 113.5, 113.9,
приборе Shimadzu GCMS-QP 2010 SE (электрон-
114.8, 125.9, 126.6, 129.3, 129.6, 132.6, 134.6, 157.0,
ный удар, 70 эВ). Элементный анализ выполнен на
159.0, 165.13, 166.35, 188.7. Масс-спектр, m/z
CHN-анализаторе PerkinElmer 2400. Температуры
(Iотн, %): 388 (10) [M+2]+, 386 (21) [M]+, 135 (100)
плавления были определены на приборе OptiMelt
[ArCO]+. Найдено, %: C 65.31; H 3.66; N 14.69.
MPA100. 2-Амино-4-ацил-6-хлорпиридин-3,5-ди-
C21H14N4O2S. Вычислено, %: C 65.27; H 3.65; N
карбонитрилы 4a-е были получены по известной
14.50. М 386.43.
методике [20].
2-Амино-4-(тиен-2-оил)-6-(фенилсульфа-
ФОНДОВАЯ ПОДДЕРЖКА
нил)пиридин-3,5-дикарбонитрил
(2d). Выход
0.522 г (72%), т.пл. 206-207°С. ИК спектр, ν,
Исследование выполнено при финансовой под-
см-1: 3330, 3229 (NH2), 2224 (C≡N), 1640 (C=O).
держке Российского фонда фундаментальных ис-
Спектр ЯМР 1Н, δ, м.д.: 7.38 д.д (1Hаром, С4H3S,
следований (проект № 18-33-01204 мол_а).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
СИНТЕЗ 2-АМИНО-6-АРИЛСУ
ЛЬФАНИЛ-4-АЦИЛПИРИДИН-3,5-ДИКАРБОНИТРИЛОВ
1135
КОНФЛИКТ ИНТЕРЕСОВ
12.
Adams N.D., Benowitz A.B., Rueda Benede M.L.,
Evans K.A., Fosbenner D.T., King B.W., Li M.,
Авторы заявляют об отсутствии конфликта ин-
Miller W.H., Reif A.J., Romeril S.P., Schmidt S.J.,
тересов.
Wiggall K. Межднуар. заявка WO 2017216726, 2017.
СПИСОК ЛИТЕРАТУРЫ
13.
Adams N.D., Benowitz A.B., Rueda Benede M.L.,
1.
Kanani M.B., Patel M.P. Med. Chem. Res. 2013, 22,
Evans K.A., Fosbenner D.T., King B.W., Li M.,
2912-2920. doi 10.1007/s00044-012-0292-7
Luengo J.I., Miller W.H., Reif A.J., Romeril S.P.,
2.
Makawana J.A., Patel M.P., Patel R.G. Med. Chem. Res.
Schmidt S.J., Butlin R.J., Goldberg K.M., Jordan A.M.,
2012, 21, 616-623. doi 10.1007/s00044-011-9568-6
Kershaw C.S., Raoof A., Waszkowycs B. Межднар.
3.
Grigor’ev A.A., Shtyrlin N.V., Gabbasova R.R.,
заявка WO 2017216727, 2017.
Zeldi M.I., Grishaev D.Yu., Gnezdilov O.I., Bala-
14.
Guo K., Mutter R., Heal W., Reddy T.R.K., Cope H.,
kin K.V., Nasakin O.E., Shtyrlin Y.G. Synth.
Pratt S., Thompson M.J., Chen B. Eur. J. Med. Chem.
Commun.
2018,
48,
2288-2304. doi
10.1080/
2008, 43, 93-106. doi 10.1016/j.ejmech.2007.02.018
00397911.2018.1501487
15.
Vakalopoulos A., Meibom D., Albrecht-Kupper B.,
4.
Abbas H.-A.S., El Sayed W.A., Fathy N.M. Eur.
Zimmermann K., Keldenich J., Lerchen H.-G., Nell P.,
J. Med. Chem. 2010, 45, 973-982. doi 10.1016/
Sussmeier F., Krenz U. Амер. заявка US 8772498,
j.ejmech.2009.11.039
2014.
5.
Quintela J.M., Peinador C., Veiga M.C., Botana L.M.,
16.
Nell P., Vakalopoulos A., Sussmeier F., Albrecht-
Alfonso A., Riguera R. Eur. J. Med. Chem. 1998, 33,
Kupper B., Zimmermann K., Keldenich J., Meibom D.
887-897. doi 10.1016/S0223-5234(99)80013-0
Амер. заявка US 8609686, 2013.
6.
Attaby F.A., Elghandour A.H.H., Ali M.A.,
17.
Karpov S.V., Grigor’ev A.A., Kayukov Y.S., Karpo-
Ibrahem Y.M. Phosphorus, Sulfur Silicon Relat.
va I.V., Nasakin O.E., Tafeenko V.A. J. Org. Chem.
Elem.
2007,
182,
695-709. doi
10.1080/
10426500601087277
2016, 81, 6402-6408. doi 10.1021/acs.joc.6b01040
7.
Chen H., Zhang W., Tam R., Raney A.K. Междунар.
18.
Grigor’ev A.A., Karpov S.V., Kayukov Y.S., Beli-
заявка WO 2005058315, 2005.
kov M.Y., Nasakin O.E. Tetrahedron Lett. 2015, 56,
6279-6281. doi 10.1016/j.tetlet.2015.09.130
8.
Hoelzemann G., Graedler U., Greiner H., Amendt C.,
Musil D., Hillertz P. Амер. заявка US 8202882, 2012.
19.
Grigor’ev A.A., Karpov S.V., Kayukov Y.S., Grache-
9.
Reinhard E.J., Kolodziej S.A., Anderson D.R.,
va I.A., Tafeenko V.A. Synlett. 2017, 28, 1592-1595.
Stehle N.W., Vernier W.F., Lee L.F., Hegde S.G.
doi 10.1055/s-0036-1588823
Амер. заявка US 20040127519, 2004.
20.
Карпов С.В., Каюков Я.С., Бардасов И.Н., Каюко-
10.
Anderson D.R., Stehle N.W., Kolodziej S.A., Rein-
ва О.В., Липин К.В., Насакин O.E. ЖОрХ. 2011,
hard E.J., Lee L.F. Амер. заявка US 2004142978,
47, 1467-1472. [Karpov S.V., Kayukov Y.S., Barda-
2004.
sov I.N., Kayukova O.V., Lipin K.V., Nasakin O.E.
11.
Anderson D.R., Stehle N.W., Kolodziej S.A., Rein-
Russ. J. Org. Chem. 2011, 47, 1492-1497.] doi 10.1134/
hard E.J. Межднур. заявка WO 2004055015, 2015.
S107042801110006X
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020
1136
КАЮКОВ и др.
Synthesis of 2-Amino-4-acyl-6-arylsulfanylpyridine-
3,5-dicarbonitrile
Ya. S. Kayukova, S. V. Karpova, O. V. Kayukovab, *, and A. A. Grigor’eva, **
a Chuvash State University named after I.N. Ulianov,
428015, Russia, Chuvash Republic, Cheboksary, Moskovskii pr. 15
b Chuvash State Agricultural Academy, 428003, Russia, Chuvash Republic, Cheboksary, ul. K. Marksa 29
*e-mail: olgakajukova@mail.ru
**e-mail: grigorev.arth@gmail.com
Received March 5, 2020; revised March 10 2020; accepted March 15, 2020
The interaction of 4-acyl-2-amino-6-chloropyridin-3,5-dicarbonitriles with aromatic thiols leads to the formation
of 4-acyl-2-amino-6-arylsulfanylpyridin-3,5-dicarbonitriles. The transformation is realized in an inert medium
in the presence of a base.
Keywords: pyridine-3,5-dicarbonitrile, 2-sulfanylpyridine derivatives, thiophenol, nucleophilic substitution
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 7 2020