ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 8, с. 1242-1250
УДК 547.46
СИНТЕЗ ЗАМЕЩЕННЫХ МОСТИКОВЫХ
КАРБОНОВЫХ КИСЛОТ АДАМАНТАНОВОГО РЯДА
© 2020 г. Е. А. Ивлева*, А. И. Морозова, И. Д. Сучилин, А. К. Ширяев, Ю. Н. Климочкин
ФГБОУ ВО «Самарский государственный технический университет»,
443100, Россия, г. Самара, ул. Молодогвардейская 244
*e-mail: elena.a.ivleva@yandex.com
Поступила в редакцию 25 марта 2020 г.
После доработки 06 апреля 2020 г.
Принята к публикации 12 апреля 2020 г.
Синтезирован ряд новых 1,3,6-, 1,4,4-три- и 1,3,6,6-тетразамещенных полифункциональных производных
каркасного строения на основе мостиковых карбоновых кислот адамантанового ряда за счет реализации
реакций нуклеофильного замещения в кислых средах. Гидролизом 1-ацетиламино- и 1,3-диацетиламино-
производных в кислой среде синтезирован ряд амино- и диаминокислот каркасного строения. Получен-
ные соединения открывают пути к созданию функциональных материалов с комплексом ценных свойств.
Ключевые слова: 2-замещенные адамантаны, окисление, адамантан, карбоновые кислоты, аминокис-
лоты, серно-азотная смесь.
DOI: 10.31857/S0514749220080108
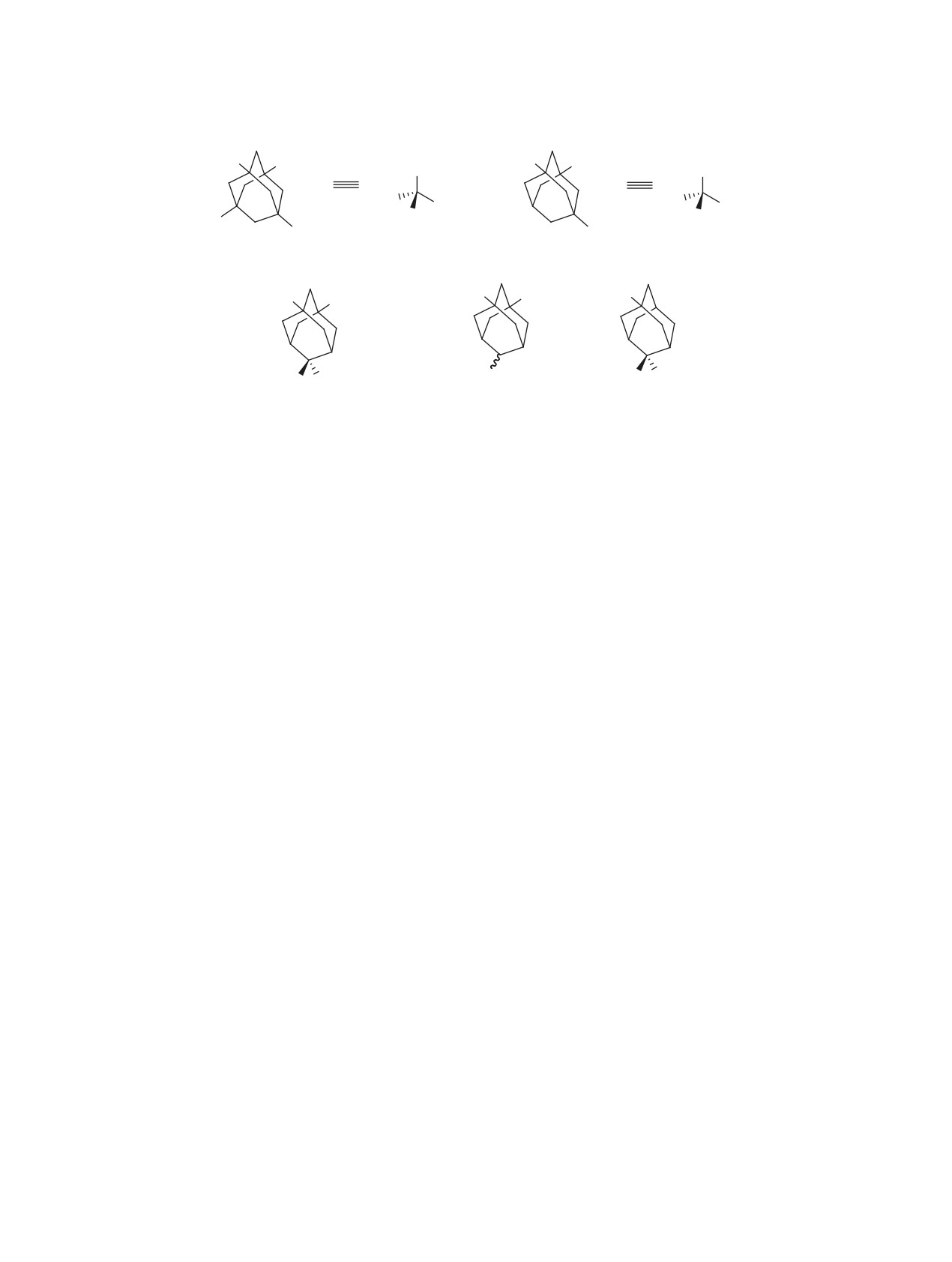
Уникальная геометрия практически сфериче-
ностью таких субстратов. Наличие нескольких
ского адамантанового ядра наряду с трипоидной
функциональных групп одновременно в узловых
(С3v группа симметрии) либо тетрагональной (Td
и мостиковом положениях каркаса видоизменяет
группа симметрии) конфигурацией его 1,3,5-три-
конфигурацию таких структур (Cs и C2v группы
или 1,3,5,7-тетразамещенных производных соз-
симметрии, см. рисунок), что может привести к
дает предпосылки конструирования полимерных
появлению новых свойств у макромолекул, по-
молекул с фиксированным расположением фраг-
лученных на основе таких полифункциональных
ментов, определяющих функциональные свойства
производных. Именно это диктует необходимость
материалов. В настоящее время данное направ-
проводить дальнейшие исследования по разработ-
ление интенсивно развивается, и на основе 1,3,5-
ке подходов к синтезу труднодоступных 1,3,6-,
три- или 1,3,5,7-тетразамещенных производных
1,4,4- и 1,3,6,6-полифункциональных производ-
адамантана уже созданы материалы, обладающие
ных адамантана.
ценными свойствами [1-20]. В то же время про-
Имеется ограниченное количество публикаций,
должает развиваться направление, посвященное
посвященных методам получения 1,3,6-тризаме-
разработке новых методов получения полифунк-
щенных производных адамантана. Большинство
циональных 1,3,5-три- или 1,3,5,7-тетразамещен-
из них строятся на использовании 1,3,6-триброма-
ных производных адамантана [21-23].
дамантана [24] в качестве исходного соединения:
В то же время отсутствуют данные об исполь-
в синтезе 1,3,6-адамантантриола [25], 1,3,6-три-
зовании 1,3,6-, 1,4,4-тризамещенных и 1,3,6,6-тет-
фениладамантана и 6-бром-1,3-дихлорадамантана
разамещенных производных адамантана в каче-
[26]. Имеются примеры использования 2-адаман-
стве синтетической платформы для создания ра-
танкарбоновой кислоты и 2-аминоадамантана, из
нее неизвестных три- и тетрапоидных систем, что
которых через стадию бромирования получают
связано с ограниченной синтетической доступ-
соответствующие 1,3,6-тризамещенные произво-
1242
СИНТЕЗ ЗАМЕЩЕННЫХ МОСТИКОВЫХ КАРБОНОВЫХ КИСЛОТ
1243
A
A
A
A
A
H
A A
A A
A
A
A
A
A
Td point group
С3v point group
A
A
A
A
A
B
B B
B B
С2v point group
Сs point group
Группы симметрии три- и тетразамещенных адамантанов.
дные - 5,7-дифенил-2-адамантанкарбоновую кис-
В качестве исходных соединений использова-
лоту [27] и 6-амино-1,3-адамантандиол [28].
ли 2-(2-адамантил)уксусную кислоту (1), 2-ада-
мантанкарбоновую кислоту (2), N-(2-адамантил)-
В качестве исходных соединений для получе-
ацетамид (3) и 2,2'-(2,2-адамантандиил)диуксус-
ния 1,4,4-тризамещенных и 1,3,6,6-тетразамещен-
ную кислоту (4). Синтез кислоты 1 осуществля-
ных адамантана используют 2,2-дизамещенные
ли по известным методикам [33-35]. Кислоту 2
производные. Например, из 2,2-динитроадаманта-
получали окислительным расщеплением спиро-
на получают 1,4,4-тринитроадамантан, 1,3,6,6-тет-
(адамантан-2,2'-оксирана) в дымящей азотной
ранитроадамантан и 1-гидрокси-3,6,6-тринитро-
кислоте [36], 2-ацетиламиноадамантан (3) - по
адамантан [29]. Из 2-гидрокси-2-адамантанкар-
модифицированной методике из 2-адамантанола.
боновой кислоты под действием тетрафторида
2,2'-(2,2-Адамантандиил)диуксусную кислоту (4)
серы в HF в различных условиях могут быть по-
получали окислительным расщеплением арома-
лучены 1,4,4-трифторадамантан, 1-трифторметил-
тического фрагмента
2-(2-бензил-2-адамантил)-
3,6,6-трифторадамантан [30]. Имеется единичный
уксусной кислоты в системе NaIO4-RuCl3 [37]
пример синтеза потенциального противоопухо-
(схема 1).
левого препарата на основе 1-гидрокси-4,4-диме-
Выход кислоты 4 после перекристаллизации из
тиладамантана, который получают окислением
воды составил 30%. По-видимому, в ходе реакции
2,2-диметиладамантана [31]. Взаимодействие мо-
происходят более глубокие окислительные про-
стиковых галогензамещенных адамантана с азот-
цессы, приводящие к деструкции каркаса адаман-
ной кислотой в присутствии уксусного ангидрида
тана. В спектре ЯМР 1Н сигналы протонов карбок-
приводит к введению нитроксигруппы в узловое
сильных групп проявляются в виде синглета при
положение каркаса и образованию 1,4,4-тризаме-
11.88 м.д. Сигналы протонов метиленовых групп,
щенных производных [32].
связанных с карбоксильными, проявляются в виде
На сегодняшний день отсутствуют методы син-
синглета при 2.69 м.д. В спектре ЯМР 13С сигна-
теза 1,3,6-, 1,4,4-тризамещенных и 1,3,6,6-тетра-
лы четвертичных атомов углерода карбоксильных
групп проявляются при 173.9 м.д. Сигнал четвер-
замещенных полифункциональных производных
тичного атома углерода каркаса адамантана прояв-
адамантана, которые позволяли бы вводить иные
ляется при 40.5 м.д.
функциональные группы в каркас. Решить постав-
ленную задачу можно функционализацией 2- и
В процессе очистки был выделен побочный
2,2-дизамещенных адамантанов за счет реализа-
продукт окисления - 2,2'-(5-гидрокси-2,2-адаман-
ции реакций нуклеофильного замещения в кислых
тандиил)диуксусная кислота
(5). Образование
средах.
гидроксикислоты (5) связано с повышенной тем-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 8 2020
1244
ИВЛЕВА и др.
Схема 1.
COOH
Ph
COOH
NaIO4-RuCl3
COOH
COOH
COOH
+
H2O-CH3CN-CCl4 (2:1:1)
1. ∆, 5 ч
HO
2. rt, 20 ч
4
5
пературой проведения реакции. В литературе
Соединения 6 и 7 получены с выходами 53 и 32%
имеются сведения об окислении третичной связи
соответственно. В спектрах ЯМР 1Н соединений
С-Н субстратов адамантанового ряда в системе
6 и 7 протоны NH проявляются в виде синглетов
KBrO3-RuCl3 [38]. Следует отметить, что при про-
в области 7.25-7.36 м.д. В спектрах ЯМР 13С сиг-
ведении реакции при комнатной температуре об-
налы четвертичных атомов углерода, связанных с
разования гидроксикислоты (5) не происходило. В
амидными фрагментами, проявляются при 52.1-
спектре ЯМР 1Н сигналы протонов карбоксильных
52.2 м.д., сигналы четвертичных атомов углерода
групп проявляются в виде уширенного сингле-
ацетамидного фрагмента проявляются при 169.1-
та при 12.20 м.д., сигнал протона гидроксильной
169.3 м.д.
группы проявляется в виде синглета при 4.28 м.д.
При проведении данной реакции с исполь-
В спектре ЯМР 13С сигналы четвертичных атомов
зованием 2-адамантанкарбоновой кислоты (2) и
углерода карбоксильных групп проявляются при
2-ацетиламиноадамантана (3) и 20%-ного оле-
173.8 и 174.0 м.д. Сигнал четвертичного атома
ума образования соответствующих диацетила-
углерода, связанного с ОН-группой, проявляется
минопроизводных не наблюдалось - были по-
при 66.3 м.д.
лучены смеси, состоящие из моноацетилами-
Из кислот 1 и 4 one-pot синтезом по методи-
нопроизводных в виде смеси Z/E-изомеров и
ке [21] были получены соответствующие 1,3,6- и
продуктов окисления, о чем свидетельствуют
1,3,6,6- производные адамантана:
2-(5,7-диаце-
сигналы четвертичных атомов углерода при
тамидо-2-адамантил)уксусная кислота
(6)
и
66.0-68.0 м.д. в спектрах ЯМР 13С (схема 3). По-
2,2'-(5,7-диацетамидо-2,2-адамантандиил)диук-
видимому, дальнейшего превращения гидрокси-
сусная кислота (7) (схема 2).
производного в продукт нуклеофильного заме-
щения не происходит из-за более выраженного
Метод заключается в последовательном ни-
дезактивирующего влияния ацетиламино- и кар-
троксилировании исходных каркасных субстратов
боксильной групп по сравнению с карбоксиме-
1, 4 дымящей азотной кислотой, взаимодействии с
тильной группой. Это подтверждается данными
ацетонитрилом по реакции Риттера и превращения
кинетических исследований нитроксилирования
образующихся in situ моноацетамидов в диацети-
[39-41] и окисления дезактивированных каркас-
ламиноадамантаны 6, 7 при добавлении серной
ных субстратов в серно-азотной смеси [42].
кислоты. Реакции проводили с использованием
20 экв дымящей азотной кислоты и избытка
Из кислоты 4 получены новые 1,4,4-тризаме-
98%-ной серной кислоты в случае субстрата 1 и
щенные производные:
2,2'-(5-карбокси-2,2-ада-
100%-ной серной кислоты в случае субстрата 4.
мантандиил)диуксусная кислота (8) и 2,2'-(5-аце-
Схема 2.
1. HNO3 (дым.)
2. CH3CN
COOH
COOH
3. H
2SO4
1
AcHN
R1
R
20-25°C
AcHN
1, 4
6, 7
R1 = H (1, 6), CH2COOH (4, 7).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 №8 2020
СИНТЕЗ ЗАМЕЩЕННЫХ МОСТИКОВЫХ КАРБОНОВЫХ КИСЛОТ
1245
Схема 3.
1. HNO3 (дым.)
R1
R1
R1
2. CH3CN
3. H2SO4
+ HO
20-25°C
AcHN
AcHN
2, 3
R1 = COOH (2), NHAc (3).
Схема 4.
COOH
COOH
COOH
COOH
COOH
1. H2SO4-HNO3
1. H2SO4-HNO3
COOH
2. CH3CN
2. HCOOH
AcHN
HOOC
9
4
8
тамидо-2,2-адамантандиил)диуксусная кислота
сигнал четвертичного атома углерода ацетамидно-
(9) (схема 4). Функционализацию проводили в
го фрагмента проявляется при 161.1 м.д., сигнал
серно-азотной смеси с дальнейшим добавле-
четвертичного атома углерода, связанного с ато-
нием муравьиной кислоты и ацетонитрила.
мом азота, присутствует при 51.1 м.д.
Реакции проводили с использованием 3 экв дымя-
Соединения 6, 7, 9 превращали в соответству-
щей азотной кислоты и 96%-ной серной кислоты.
ющие аминокислоты
10-12 путем длительно-
Соединения 8 и 9 получены с выходами 27 и 30%
го кипячения (24 ч) в 2%-ной соляной кислоте
соответственно.
(схема 5). Аминокислоты 10-12 получены в виде
гидрохлоридов с количественными выходами.
В спектре ЯМР 13С соединения 8 сигналы чет-
вертичных атомов углерода карбоксильных групп
В спектрах ЯМР 1Н соединений 10-12 сигна-
проявляются при 178.7, 173.8 и 173.7 м.д. В спек-
лы протонированных аминогрупп проявляются в
тре ЯМР 1Н соединения 9 сигнал протона ацета-
виде синглетов при 8.1-8.5 м.д., а спектрах ЯМР
мидного фрагмента проявляется в виде синглета
13С сигналы четвертичных атомов углерода ада-
при 7.32 м.д. В спектре ЯМР 13С соединения 9
мантанового фрагмента, связанных с протониро-
Схема 5.
COOH
COOH
-
Cl
+
AcHN
R1
H2O-HCl
H3N
R1
∆, 24 ч
-
Cl
+
AcHN
H3N
6, 7
10, 11
R1 = H (6, 10), CH2COOH (7, 11).
COOH
COOH
COOH
COOH
H2O-HCl
∆, 24 ч
Cl-
+
AcHN
H3N
9
12
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 8 2020
1246
ИВЛЕВА и др.
ванными аминогруппами, резонируют в диапазоне
2,2'-(2,2-Адамантандиил)диуксусная кисло-
52.0-53.0 м.д.
та (4). К интенсивно перемешиваемому раствору
5 г (0.018 моль) 2-(2-бензил-2-адамантил)уксус-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ной кислоты в смеси 170 мл H2O, 85 мл CH3CN и
ИК-спектры регистрировались на спектрометре
85 мл CCl4 добавляли 75 г (0.350 моль) метапери-
Shimadzu IR Affinity-1 (Япония) с использованием
одата натрия, затем 0.365 г (0.002 моль) хлорида
приставки НВПО. Спектры ЯМР 1Н и 13C реги-
рутения. Нагревали при кипении в течение 5 ч, за-
стрировали на спектрометре JEOL NMR-ECX400
тем перемешивали еще 20 ч при комнатной тем-
(Япония) (400, 100 МГц, соответственно), вну-
пературе. Реакционную смесь фильтровали через
тренний стандарт ТМС. Химические сдвиги сиг-
целит. Водную фазу экстрагировали этилацетатом
налов определялись в шкале δ, м.д. Температуры
(5×10 мл). Органические фракции объединяли и
плавления определялись капиллярным методом
сушили над Na2SO4. Органический слой упари-
на приборе MPM-H2 90-264V/AC (Германия), не
вали в вакууме. К полученному в остатке маслу
корректировались. Элементный анализ выполнял-
добавляли 150 мл ацетона. Нерастворившийся
ся на элементном анализаторе EuroVector 3000 EA
осадок неорганических солей отфильтровывали,
(Италия) с использованием в качестве стандарта
маточный раствор упаривали в вакууме. К остат-
L-цистина. Исходные соединения получали по из-
ку добавляли 50 мл диоксана и 50 мл ацетона,
вестным методикам {спиро(адамантан-2,2'-окси-
выпавший осадок
2,2'-(5-гидрокси-2,2-адаман-
ран) [43], 2-(2-бензил-2-адамантил)уксусную кис-
тандиил)диуксусной кислоты (5) отфильтровы-
лоту получили в две стадии [44, 45]}, либо брались
вали, маточный раствор упаривали. Полученное
из коллекции реактивов кафедры органической
в остатке масло перекристаллизовывали из воды.
химии СамГТУ; чистота составляет ≥ 95.0%.
Выход кислоты 4 1.33 г (30%). Бесцветные кри-
2-(2-Адамантил)уксусная кислота (1) получе-
сталлы, т.пл. 191-194°C. ИК спектр, ν, см-1: 2906,
на по методикам [33-35].
2881, 2862 (CHAd), 1739 (C=О). Спектр ЯМР 1Н
(ДМСО-d6), δ, м.д.: 1.48-1.51 м (4Н, СНAd), 1.62
2-Адамантанкарбоновая кислота (2). К пред-
с (2Н, СНАd), 1.76-1.82 м (4H, CHAd), 1.99-2.03 м
варительно охлажденному до -15÷10°C раствору
(4Н, СHAd), 2.69 с (4Н, 2СН2), 11.88 с (2H, COOH).
8.9 г (0.053 моль) спиро(адамантан-2,2'-оксира-
Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 27.4 (CH),
на) в 106.8 мл CCl4 по каплям добавляли 26.7 мл
32.8 (CH2), 33.4 (CH), 38.0 (CH2), 39.6 (CH2), 40.5,
(0.644 моль) дымящей азотной кислоты. Реак-
173.9. Найдено, %: С 66.70; Н 8.06. C14H20O4.
ционную смесь выдерживали 2-3 ч при охлажде-
Вычислено, %: С 66.65; Н 7.99.
нии, затем нагревали до комнатной температуры и
промывали водой. Органический слой отделяли и
2,2'-(5-Гидрокси-2,2-адамантандиил)ди-
обрабатывали раствором KOH. Водный слой под-
уксусная кислота
(5). Выход
0.15 г
(3.4%).
кисляли HCl до рН 1. Осадок отфильтровывали,
Бесцветные кристаллы, т.пл.
186-190°C. ИК
промывали водой и сушили. Выход 5.9 г (66%).
спектр, см-1: 3435 (OH), 2929, 2882, 2870 (CHAd),
Бесцветные кристаллы, т.пл. 139-142°C (лит. т.пл.
1693 (C=О). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
145.5-145.8°C [36]).
1.25-1.35 м (3Н, СНAd), 1.43-1.49 м (2Н, СНAd),
1.79-2.01 м (8Н, СНАd), 2.62 c (4H, 2CH2), 4.29 c
N-(2-Адамантил)ацетамид (3). К смеси 60 мл
(1H, OH), 12.20 уш.с (2Н, СООН). Спектр ЯМР
94%-ной серной кислоты и 20 мл (0.38 моль)
13С (ДМСО-d6), δ, м.д.: 29.6 (CH), 31.6 (CH2),
ацетонитрила прибавляли 10 г (0.07 моль) 2-ада-
35.9 (CH), 37.7 (CH2), 38.4 (CH2), 38.8 (C), 40.9
мантанола при температуре не выше 20°С. Затем
(CH2), 47.3 (CH2), 66.3, 173.8, 174.0. Найдено, %:
реакционную смесь выдерживали при перемеши-
С 62.73; Н 7.57. C14H20O5. Вычислено, %: С 62.67;
вании 15 мин и выливали на лед. Осадок отфиль-
Н 7.51.
тровывали, промывали водой, сушили и перекри-
сталлизовывали из петролейного эфира. Выход
Синтез 1,3,6-, 1,4,4-тризамещенных и 1,3,6,6-
12.06 г (95%). Бесцветные кристаллы, т.пл. 194-
тетразамещенных производных адамантаново-
195°C (лит. т.пл. 190°C [46]).
го ряда.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 №8 2020
СИНТЕЗ ЗАМЕЩЕННЫХ МОСТИКОВЫХ КАРБОНОВЫХ КИСЛОТ
1247
2-(5,7-Диацетамидо-2-адамантил)уксусная
кислоты 4 в 10 мл 96%-ной H2SO4 по каплям до-
кислота (6). К 8.7 мл (0.206 моль) дымящей азот-
бавляли 0.4 мл (0.010 моль) дымящей HNO3 при
ной кислоте при перемешивании при температуре
температуре не выше 20-25°C и выдерживали при
не выше 20°С порциями вносили 2 г (0.0103 моль)
заданной температуре в течение 2 ч. После этого
кислоты (1). Полученный раствор выдерживали
по каплям добавляли 2 мл (0.053 моль) 100%-ной
при перемешивании при температуре 20-25°С в
муравьиной кислоты. Выдерживали реакционную
течение 2 ч. Далее в реакционную смесь по ка-
смесь в течение 48 ч и выливали на лед. Выпавший
плям добавляли 8 мл (0.152 моль) ацетонитрила,
осадок отфильтровывали, промывали водой и су-
выдерживали 1 ч при 20°С, после чего по каплям
спендировали в этилацетате. После этого снова
добавляли 34.8 мл (0.653 моль) 98%-ной серной
отфильтровывали и сушили. Выход кислоты 8
кислоты и выдерживали при 20-25°С в течение
0.25 г (27%). Бесцветные кристаллы, т.пл. 170-
17 ч. Раствор выливали на 500 г измельченного
173°C. ИК спектр, ν, см-1: 2916, 2873, 2854 (CHAd),
льда и доводили до рН 5 с помощью NaHCO3 при
1720, 1683 (C=О). Спектр ЯМР 1Н (ДМСО-d6),
перемешивании. Продукт экстрагировали бута-
δ, м.д.: 1.42-1.45 м (2Н, CНAd), 1.56-1.70 м (4Н,
нолом (10×10 мл), бутанол сушили азеотропной
СНАd), 1.87-1.99 м (5Н, СНАd), 2.07-2.10 м (2H,
отгонкой воды и упаривали в вакууме. К получен-
CHАd), 2.64-2.69 м (4H, СН2). Спектр ЯМР 13С
ному остатку добавляли 30 мл этилацетата, выпав-
(ДМСО-d6), δ, м.д.: 27.2 (CH), 31.8 (CH2), 33.2
ший осадок отфильтровывали и сушили. Выход
(CH), 34.4 (CH2), 35.8, 38.9, 40.8 (CH2), 40.9 (CH2),
1.68 г (53%). Бесцветные кристаллы, т.пл. 237-
173.7, 173.8, 178.7. Найдено, %: С 60.84; Н 6.85.
239°C. ИК спектр, ν, см-1: 3342 (NH), 2970, 2924,
C15H20O6. Вычислено, %: С 60.80; Н 6.80.
2873 (CHAd), 1732, 1697 (C=O). Спектр ЯМР 1H,
2,2'-(5-Ацетамидо-2,2-адамантандиил)диук-
δ, м.д.: 1.52-1.54 м (2H, CHAd), 1.69 с (6H, CH3),
сусная кислота (9). К раствору 0.54 г (0.002 моль)
1.70-1.78 м (2H, CHAd), 1.84-1.90 м (5H, CHAd),
кислоты 4 в 6 мл 96%-ной H2SO4 по каплям до-
1.95-1.99 м (2H, CHAd), 2.05 c (2H, CHAd), 2.25 д
бавляли 0.3 мл (0.007 моль) дымящей HNO3 при
(2H, CH2COOH, J 7.3 Гц), 7.34 с (1H, NH), 7.35 c
температуре не выше 20-25°C и выдерживали при
(1H, NH), 11.83 уш.с. (1 H, COOH). Спектр ЯМР
заданной температуре в течение 2 ч. После этого
13C, δ, м.д.: 24.2 (CH3), 33.2 (CH), 34.6 (CH2), 37.3
по каплям добавляли 1 мл (0.019 моль) ацетони-
(CH2), 39.1 (CH), 41.7 (CH2), 45.8 (CH2), 52.1, 52.2,
трила. Реакционную смесь выдерживали при пе-
169.2, 169.3, 174.5. Найдено, %: С 62.37; Н 7.90; N
ремешивании в течение 3 ч. Раствор выливали
9.14. C16H24N2O4. Вычислено, %: С 62.32; Н 7.84;
на 15 г измельченного льда и доводили до рН 5 с
N 9.08.
помощью NaHCO3 при перемешивании. Продукт
2,2'-(5,7-Диацетамидо-2,2-адамантандиил)-
экстрагировали бутанолом (10×5 мл), бутанол су-
диуксусная кислота (7). Получена аналогично
шили азеотропной отгонкой воды и упаривали в
из 1.0 г (0.004 моль) кислоты 4, 3.3 мл (0.08 моль)
вакууме. К полученному остатку добавляли 30 мл
дымящей азотной кислоты, 2.5 мл (0.05 моль) аце-
этилацетата, выпавший осадок отфильтровывали и
тонитрила и 23.3 мл (0.44 моль) 100%-ной серной
сушили. Выход 0.21 г (32%). Бесцветные кристал-
кислоты. Выход 0.46 г (32%). Бесцветные кристал-
лы, т.пл. 220-222°C. Спектр ЯМР 1Н (ДМСО-d6),
лы, т.пл. 260-262°C. Спектр ЯМР 1H, δ, м.д.: 1.50-
δ, м.д.: 1.32-1.35 м (2Н, СНAd), 1.51-1.54 м (4Н,
1.53 м (4H, CHAd), 1.69 с (6H, CH3), 1.74 с (2H,
СНАd), 1.69-1.74 м (8Н, CH3, СНАd), 1.90-2.05 м
CHAd), 1.80-1.84 м (2H, CHAd), 1.90-2.06 м (4H,
(2H, CHАd), 2.35-2.42 м (4H, СН2), 7.32 с (1H, NH).
CHAd), 2.40 с (4H, CH2), 7.25 c (2H, NH). Спектр
Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 24.3 (CH3),
ЯМР 13C, δ, м.д.: 24.3 (CH3), 36.1 (CH), 36.8 (CH2),
28.8 (CH), 32.1 (CH2), 36.1 (CH), 36.8 (CH2), 39.4,
40.7, 42.8 (CH2), 44.0 (CH2), 52.1, 169.1, 175.1.
42.8 (CH2), 43.6 (CH2), 44.0 (CH2), 51.1, 169.1,
Найдено, %: С 59.05; Н 7.20; N 7.70. C18H26N2O6.
175.1, 175.2. Найдено, %: С 62.17; Н 7.54; N 4.58.
Вычислено, %: С 59.00; Н 7.15; N 7.65.
C16H23NO5. Вычислено, %: С 62.12; Н 7.49; N 4.53.
2,2'-(5-Карбокси-2,2-адамантандиил)диук-
6-(Карбоксиметил)адамантан-1,3-диаминий
сусная кислота (8). К раствору 0.8 г (0.003 моль)
хлорид (10). Смесь 0.6 г соединения 6, 28 мл воды
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 8 2020
1248
ИВЛЕВА и др.
и 2 мл 36%-ной соляной кислоты нагревали при
замещения в кислых средах. Полученные 1,3,6-,
кипении в течение 25 ч и упаривали досуха. Выход
1,4,4-тризамещенные и 1,3,6,6-тетразамещенные
0.58 г (100%). Бесцветные кристаллы, т.пл. 330°C
производные адамантана могут рассматриваться в
(с разл.). ИК спектр, ν, см-1: 3207 (NH), 2947,
качестве структурных блоков для создания нового
2908, 2862 (CHAd), 1726 (C=O). Спектр ЯМР 1H,
поколения функциональных материалов.
δ, м.д.: 1.50-1.53 м (2H, CHAd), 1.76-1.83 м (4H,
БЛАГОДАРНОСТИ
CHAd), 1.91-1.94 м (3H, CHAd), 2.01-2.04 м (4H,
CHAd), 2.26 д (2H, CH2COOH, J 7.3 Гц), 8.45 с (3H,
Работа выполнена с использованием научно-
NH3+), 8.49 c (3H, NH3+), 12.16 уш.с (1H, COOH).
го оборудования центра коллективного пользова-
Спектр ЯМР 13C, δ, м.д.: 32.3 (CH), 33.0 (CH2),
ния СамГТУ «Исследование физико-химических
36.5 (CH2), 37.8 (CH), 39.8 (CH2), 43.3 (CH2), 52.0,
свойств веществ и материалов».
52.1, 173.9. Найдено, %: С 48.54; Н 7.50; N 9.48.
ФОНДОВАЯ ПОДДЕРЖКА
C12H22Cl2N2O2. Вычислено, %: С 48.49; Н 7.46; N
Работа выполнена при финансовой поддержке
9.43.
Российского фонда фундаментальных исследова-
Соединения 11, 12 получены аналогично.
ний (договор № 18-33-00881). Структурные иссле-
6,6-Бис(карбоксиметил)адамантан-1,3-ди-
дования выполнены при финансовой поддержке
аминий хлорид (11) получен из 0.185 г (0.5 ммоль)
Минобрнауки РФ в рамках проектной части госу-
соединения 7. Выход 0.178 г (100%). Бесцветные
дарственного задания № 0778-2020-0005.
кристаллы, т.пл.
330°C (с разл.). Спектр ЯМР
КОНФЛИКТ ИНТЕРЕСОВ
1H, δ, м.д.: 1.52-1.57 м (4H, CHAd), 1.73 c (2H,
Авторы заявляют об отсутствии конфликта ин-
CHAd), 1.79-1.84 м (2H, CHAd), 1.92-2.04 м (4H,
тересов.
CHAd), 2.36 c (4H, CH2), 8.14 c (6H, NH3+), 12.02
уш.с (2H, COOH). Спектр ЯМР 13C, δ, м.д.: 31.0
СПИСОК ЛИТЕРАТУРЫ
(CH2), 34.3 (CH), 35.5 (CH2), 39.6, 42.1 (CH2),
1. Lamanna G., Russier J., Menard-Moyon C., Bianco A.
51.2, 173.6. Найдено, %: С 47.38; Н 6.86; N 7.94.
Chem. Commun. 2011, 47, 8955-8957. doi 10.1039/
C14H24Cl2N2O4. Вычислено, %: С 47.33; Н 6.81; N
c1cc11689d
7.89.
2. Grimaud M., de Garibay A.P.R., Bianco A. RSC Adv.
4,4-Бис(карбоксиметил)адамантан-1-ами-
2016, 6, 42933-42942. doi 10.1039/C6RA01281G
ний хлорид (12) получен из 0.150 г (0.48 ммоль)
3. Ma Z., Dong W., Hou J., Duan Q., Shao S., Wang L.
соединения 9. Выход 0.146 г (100%). Бесцветные
J. Mater. Chem. C. 2019, 7, 11845-11850. doi 10.1039/
кристаллы, т.пл. 290°C (с разл.). Спектр ЯМР 1H,
c9tc04143e
δ, м.д.: 1.33-1.36 м (2H, CHAd), 1.56-1.59 (2H,
4. Grimaud M., Bianco A. J. Pept. Sci. 2015, 21, 330-
CHAd), 1.72 с (2Н, CHAd), 1.93-1.97 м (3H, CHAd),
345. doi 10.1002/psc.2719
2.04-2.08 м (2H, CHAd), 2.18-2.21 м (2H, CHAd),
5. Štimac A., Šekutor M., Mlinarić-Majerski K.,
2.62-2.64 м (4H, CH2), 8.14 с (3H, NH3+), 12.03 уш.с
Frkanec L., Frkanec R. Molecules. 2017, 22, 297-310.
(2Н, СООН). Спектр ЯМР 13C, δ, м.д.: 28.1 (СН),
doi 10.3390/molecules22020297
31.0 (CH2), 34.3 (СН), 35.5 (CH2), 37.4 (CH2), 37.9
6. Gunawardana C.A., Sinha A.S., Reinheimer E.W.,
(CH2), 38.5, 42.1 (CH2), 51.2, 173.5, 173.6. Найдено,
Aakeröy C.B. Chemistry.
2020,
2,
179-192. doi
%: С 55.41; Н 7.36; N 4.67. C16H23NO5. Вычислено,
10.3390/chemistry2010011
%: С 55.35; Н 7.30; N 4.61.
7. Boldog I., Reiss G.J., Domasevitch K.V., Bräse T.B.
Cryst. Growth Des. 2019, 19, 5218-5227. doi 10.1021/
ВЫВОДЫ
acs.cgd.9b00594
Разработан подход к синтезу новых полифунк-
8. Grigg R., Elboray E.E., Aly M.F., Abbas-Temirek H.H.
циональных три- и тетразамещенных производных
Chem. Commun. 2012, 48, 11469-11584. doi 10.1039/
адамантана, содержащих заместители одновре-
C2CC35054H
менно в узловых и мостиковом положениях кар-
9. Sayed M., Lin B., Yang H. RSC Adv. 2016, 12, 6148-
каса, за счет реализации реакций нуклеофильного
6156. doi 10.1039/C6SM01019A
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 №8 2020
СИНТЕЗ ЗАМЕЩЕННЫХ МОСТИКОВЫХ КАРБОНОВЫХ КИСЛОТ
1249
10.
Xie L.-H., Suh M.P. Eur. J. Chem. 2013, 19, 11590-
1156-1161. [Klimochkin Yu.N., Ivleva E.A., Ser-
11597. doi 10.1002/chem.201301822
zhantova A.S., Shiryaev A.K., Moiseev I.K. Russ.
J. Org. Chem. 2017, 53, 1170-1175.] doi 10.1134/
11.
Pop L., Golban M., Hădade N., Socaci C., Grosu I.
S1070428017080024
Synthesis. 2015, 47, 2799-2804. doi 10.1055/s-0034-
1378782
22.
Ивлева Е.А., Ткаченко И.М., Гаврилова В.С., Кли-
мочкин Ю.Н. ЖОрХ. 2016, 52, 1406-1411. [Ivle-
12.
Li X., Guo J., Tong R., Topham P., Wang J. React.
va E.A., Tkachenko I.M., Gavrilova V.S., Klimoch-
Funct. Polym. 2018, 130, 126-132. doi 10.1016/
kin Yu.N. Russ. J. Org. Chem. 2016, 52, 1394-1399.]
j.reactfunctpolym.2018.06.008
doi 10.1134/S1070428016100043
13.
Schwenger A., Birchall N., Richert C. Eur. J. Org.
23.
Ивлева Е.А., Гаврилова В.С., Гнусарев Д.И., Ося-
Chem.
2017,
39,
5852-5864. doi
10.1002/
нин В.А., Климочкин Ю.Н. ЖОрХ. 2015, 51, 192-
ejoc.201700686
195.
[Ivleva E.A., Gavrilova V.S., Gnusarev D.I.,
14.
Вайнер А.Я., Дюмаев К.М., Коваленко А.М., Бе-
Osyanin V.A., Klimochkin Yu. N. Russ. J. Org. Chem.
ренштейн Л. Е., Кричевская С. А., Фридзон Р.З.
2015, 51, 180-183.] doi 10.1134/S1070428015020062
Докл. АН.
2017,
474,
573-576.
[Vainer A.Ya.,
24.
Симоненко Л.С., Котляров А.М., Новиков С.С. Изв.
Dyumaev K.M., Kovalenko A.M., Berenstain L.E.,
АН СССР. Сер. хим. 1973, 1, 49-53.
Krichevskaya S.A., Fridzon R.Z. Doklady Chem.
2017, 474, 129-132.] doi 10.1134/S0012500817060039
25.
Wang X., Dong Y., Ezell E., Garrison J., Wood J.,
Hagen J., Vennerstrom J. Tetrahedron. 2017, 73, 2972-
15.
Gu J., Zhou X., Li Y., Wu K., Wang F., Huang M.,
2976. doi 10.1016/j.tet.2017.04.006
Guo F., Wang Y., Gong S., Ma D., Yang C. Org.
Electron.
2015.
25,
193-199. doi
10.1016/
26.
Song H., Noble W.J. J. Org. Chem. 1994, 59, 58-66.
j.orgel.2015.06.036
doi 10.1021/jo00080a012
16.
Kitagawa T., Kawano T., Hase T., Hayakawa I.,
27.
Frantz M., Skoda E.M., Sacher J.R., Epperly M.W.,
Hirai K., Okazaki T. Molecules. 2018, 23, 2893-2901.
Goff J. P., Greenberger J.S., Wipf P. Org. Biomol.
doi 10.3390/molecules23112893
Chem.
2013,
25,
4147-4153. doi
10.1039/
C3OB40489G
17.
Barth B., Tkachenko B., Eußner J., Schreiner P.,
Dehnen S. Organometallics. 2014, 33, 1678-1688. doi
28.
Rohde J.J., Pliushchev M.A., Sorensen B.K., Wodka D.,
10.1021/om500014z
Shuai Q., Wang J. J. Med. Chem. 2007, 50, 149-164.
doi 10.1021/jm0609364
18.
Zulfiqar S., Mantione D., El Tall O., Sarwar M.I.,
Ruipérez F., Rothenbergere A., Mecerreyes D.
29.
Вишневский Е.Н., Кузьмин В.С., Голод Е.Л. ЖОрХ.
J. Mater. Chem. A. 2016, 4, 8190-8197. doi 10.1039/
1996, 32, 1030-1035.
C6TA01457G
30.
Сорочинский А.Е., Александров А.М., Гама-
19.
Ивлева Е.А., Баймуратов М.Р., Малиновская Ю.А.,
лея В.Ф., Кухарь В.П. ЖОрХ. 1981, 17, 1461-1466.
Климочкин Ю.Н., Тыщенко В.А., Куликова И.А.,
31.
Зефирова О.Н., Нуриева Е.В., Зык Н.В. ЖОрХ.
Поздняков В.В., Овчинников К.А. Нефтехимия.
2005, 41, 1313-1315. [Zefirova O.N., Nurieva E.V.,
2019, 59, 684-689. [Ivleva E.A., Baimuratov M.R.,
Zyk N.V. Russ. J. Org. Chem. 2005, 41, 1286-1288.]
Malinovskaya Yu.A., Klimochkin Yu.N., Tyshchen-
doi 10.1007/s11178-005-0336-2
ko V.A., Kulikova I.A., Pozdnyakov V.V., Ovchinni-
32.
Климочкин Ю.Н., Леонова М.В., Моисеев И.К.,
kov K.A. Petrol. Chem. 2019, 59, 1235-1239.] doi
Александров А.М. ЖОрХ. 1997, 33, 387-392.
10.1134/S0965544119110082
33.
Zhao M.-X., Wang M.-X., Yu Ch.-Y., Huang Zh.-T.,
20.
Ивлева Е.А., Баймуратов М.Р., Ткаченко И.М.,
Fleet W.J.G. J. Org. Сhem. 2004, 63, 997-1000. doi
Малиновская Ю.А., Климочкин Ю.Н., Поздня-
10.1021/jo0351320
ков В.В., Бескова А.В., Тыщенко В.А., Рудяк К.Б.,
34.
He Z., Luo T., Hu M., Cao Y., Hu J. Angew. Chem.
Овчинников К.А. Нефтехимия. 2017, 57, 708-712.
2012, 51, 3944-3947. doi 10.1002/anie.201200140
[Ivleva E.A., Baimuratov M.R., Tkachenko I.M.,
35.
Narayanan V.L., Setescak L. J. Org. Chem. 1971, 36,
Malinovskaya Yu.A., Klimochkin Yu.N., Pozdnya-
4127-4129. doi 10.1021/jo00825a026
kov V.V., Beskova A.V., Tyshchenko V.A., Ru-
dyak K.B., Ovchinnikov K.A. Petrol. Chem. 2017, 57,
36.
Ширяев А.К., Моисеев И.К., Строганов В.Ф. А.С.
1088-1092.] doi 10.1134/S0965544117120040
1504972 (1985) СССР.
21.
Климочкин Ю.Н., Ивлева Е.А., Сержантова А.С.,
37.
Griffin W.P. Ruthenium Oxidation Complexes. Eds.
Ширяев А.К., Моисеев И.К. ЖОрХ.
2017,
53,
C. Bianchini, D.J. Cole-Hamilton, P.W.N.M. van
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 8 2020
1250
ИВЛЕВА и др.
Leeuwen. Dordrecht: Springer.
2011,
1-134. doi
44. Kao K.-H., Sheu R.-S., Chen Y.-S., Lin W.-W.,
10.1007/978-1-4020-9378-4_1
Liu J.-T., Ya C.-F. J. Chem. Soc. Perkin Trans. 1. 1999,
38. McNeill E., Du Bois J. J. Am. Chem. Soc. 2010, 132,
16, 2383-2390. doi 10.1039/A901484E
10202-10204. doi 10.1021/ja1046999
45. Ye X.-Y., Yoon D., Chen S.Y., Nayeem A., Golla R.,
39. Климочкин Ю.Н., Моисеев И.К. ЖОрХ. 1988, 24,
Seethala R., Wang M. Gordon D.A., Robl J. Bioorg.
557-560.
Med. Chem. Lett. 2014, 24, 654-660. doi 10.1016/
40. Климочкин Ю.Н., Абрамов О.В., Моисеев И.К., Во-
логин М.Ф., Леонова М.В., Багрий Е.И. Нефтехи-
j.bmcl.2013.11.066
мия. 2000, 40, 454-457.
46. Аверина Н.В., Борисова Г.С., Зефирова О.Н., Се-
41. Климочкин Ю.Н., Леонова М.В., Моисеев И.К.
люнина Е.В., Зык Н.В., Зефиров Н.С. ЖОрХ. 2004,
ЖОрХ. 1997, 33, 381-386.
40, 528-532. [Averina N.V., Borisova G.S., Zefiro-
42. Ивлева Е.А., Гринь И.С., Учаев И.С., Климоч-
va O.N., Selyunina E.V., Zyk N.V., Zefirov N.S.
кин Ю.Н. ЖОрХ. 2020, 56, 402-413.
Russ. J. Org. Chem. 2004, 40, 497-501.] doi 10.1023/
43. Ширяев А.К., Моисеев И.К. ЖОХ. 1988, 58, 1680-
1681.
B:RUJO.0000036069.44467.04
Synthesis of Substituted Bridged Carboxylic Acids
of the Adamantane Series
E. A. Ivleva*, A. I. Morozova, I. D. Suchilin, A. K. Shiryaev, and Yu. N. Klimochkin
Samara State Technical University, 443100, Russia, Samara, ul. Molodogvardeiskaya 244
*e-mail: elena.a.ivleva@yandex.com
Received March 15, 2020; revised April 6, 2020; accepted April 12, 2020
A number of new 1,3,6-, 1,4,4-tri- and 1,3,6,6-tetrasubstituted polyfunctional derivatives was synthesized with
use bridged carboxylic acids of the adamantane series as a starting material. The reactions were carried out
in acidic media. A number of new aminoacids were synthesized from 1-acetylamino- and 1,3-diacetylamino
derivatives. The obtained compounds could be considered as a molecular platform for the synthesis of new
polymeric materials.
Keywords: 2-substituted adamantanes, oxidation, adamantane, carboxylic acids, aminoacids, system of sulfur
acid and nitrogen acid
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 №8 2020