ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 8, с. 1287-1291
КРАТКИЕ СООБЩЕНИЯ
УДК 547. 724
ВЗАИМОДЕЙСТВИЕ 2-ИМИНО-2,5-ДИГИДРОФУРАН-
3-КАРБОКСАМИДОВ С АНТРАНИЛОВОЙ КИСЛОТОЙ
© 2020 г. Л. В. Карапетян*, Г. Г. Токмаджян
Ереванский государственный университет, 0025, Республика Армения, г. Ереван, ул. А. Манукяна 1
*e-mail: lkarapetyan@ysu.am
Поступила в редакцию 20 февраля 2020 г.
После доработки 28 февраля 2020 г.
Принята к публикации 29 февраля 2020 г.
При взаимодействии 2-имино-2,5-дигидрофуран-3-карбоксамидов с антраниловой кислотой в среде
ледяной уксусной кислоты синтезированы 2-N-замещенные иминодигидрофураны, которые при кипя-
чении в 80% уксусной кислоте в зависимости от заместителей в положении 5 исходного иминодиги-
дрофуранового кольца превращаются в различные производные ненасыщенного γ-лактона. Последние
были получены также взаимодействием 2-имино-2,5-дигидрофуран-3-карбоксамидов с антраниловой
кислотой при кипячении в 80%-ной уксусной кислоте.
Ключевые слова: 2-имино-2,5-дигидрофуран-3-карбоксамид, антраниловая кислотa, N-замещенные
иминодигидрофураны, производные ненасыщенного γ-лактона.
DOI: 10.31857/S0514749220080157
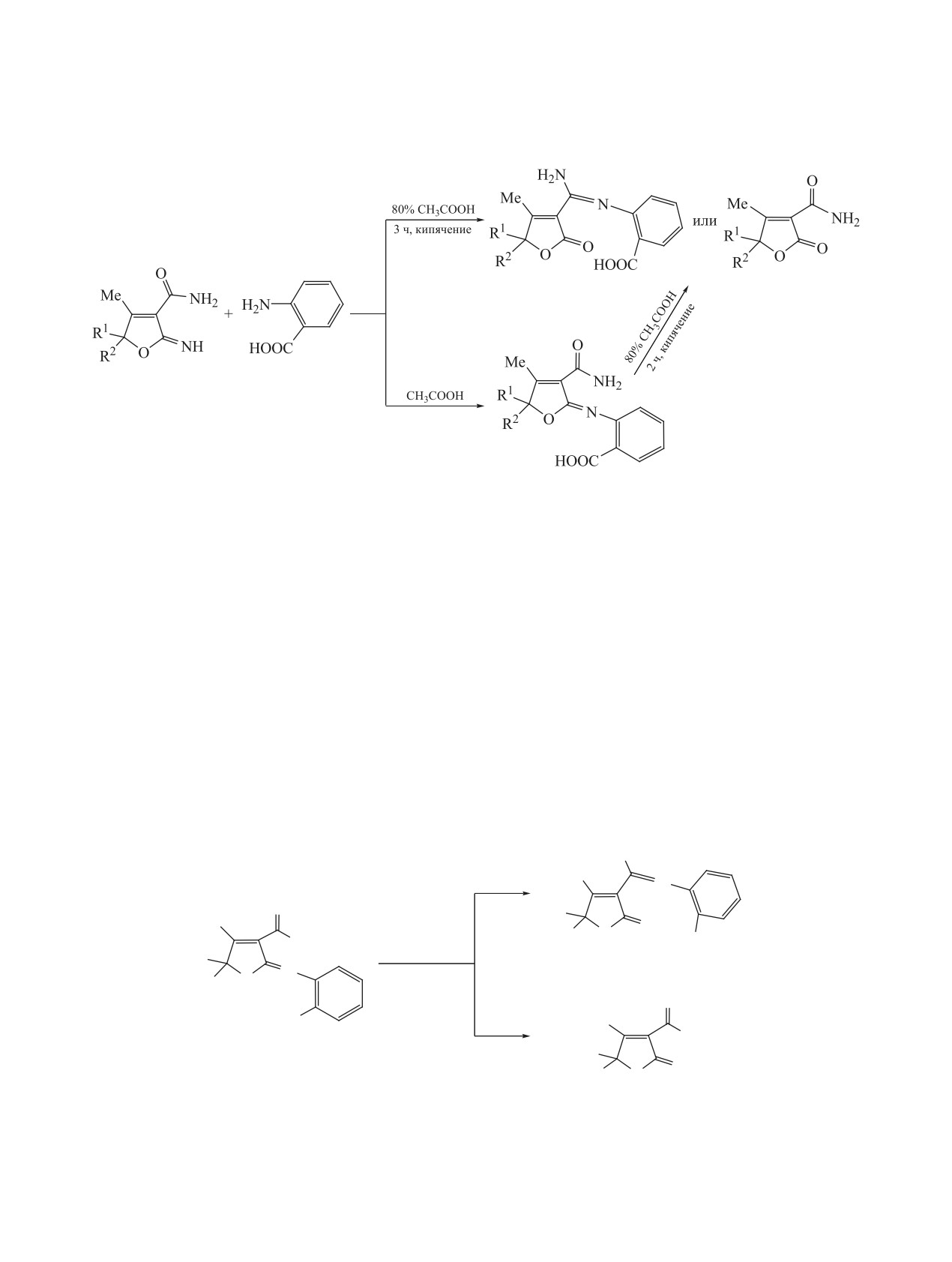
2-Имино-2,5-дигидрофурановая структура свя-
При проведении реакции
2-имино-4-ме-
зана с 2-оксо-2,5-дигидрофурановым фрагментом,
тил-2,5-дигидрофуран-3-карбоксамидов
1а-d с
который входит в состав многих природных соеди-
эквимолярным количеством антраниловой кис-
нений, в частности, аскорбиновой, пеницилловой и
лоты (2) в среде уксусной кислоты при комнат-
тетроновых кислот. Некоторые синтетические про-
ной температуре образуются соответствующие
изводные 2-оксо-2,5-дигидрофуранов используют-
2-N-замещенные иминодигидрофураны 3а-d с вы-
ся в производстве антибиотиков, противомикроб-
сокими выходами (схема 1).
ных, противовирусных, противораковых и других
Полученные 2-N-замещенные иминодигидро-
лекарственных средств [1, 2]. Предполагается, что
фураны 3а-d далее кипятили в 80%-ной уксусной
синтез соединений, сочетающих в своем составе
кислоте 1 ч. В результате реакции были получены
ароматическое и иминодигидрофурановое кольца,
конечные продукты различного строения - 4а, b
позволит выявить новые виды биологической ак-
и 4c, d. Так, в случае соединений 3a, b реакция
тивности у соединений этого класса.
протекает с раскрытием иминолактонного цикла
В последние годы интенсивно изучались син-
с образованием N-замещенных ненасыщенных
тез и реакционная способность 2-имино-2,5-ди-
γ-иминолактонов 4а, b. В случае соединений 3c,
гидрофуранов [2-7]. В продолжение проводимых
d наблюдается образование производных нена-
систематических исследований в данной работе
сыщенного γ-лактона 4c, d. Вероятно, в случае
осуществлено взаимодействие
2-имино-4-ме-
соединений 3c, d рециклизация стерически невоз-
тил-2,5-дигидрофуран-3-карбоксамидов [3] с ан-
можна из-за присутствия 5- или 6-членного кольца
траниловой кислотой.
в положении 5 иминолактонного цикла, поэтому
1287
1288
КАРАПЕТЯН, ТОКМАДЖЯН
Схема 1.
4a, b
4c, d
1a-d
2
3a-d
1a-d, 3a-d, R1 = R2 = Me (a); R1 = Me, R2 = C2H5 (b); R1, R2 = (CH2)4 (c); R1, R2 = (CH2)5 (d).
их кипячение в уксусной кислоте приводит к гид-
Подобное протекание реакции ранее наблюда-
ролизу и образованию ненасыщенных γ-лактонов
лось в ряду кумаринов [8-11]. Строение синтези-
4c, d (схема 2).
рованных соединений 3a-d и 4a-d доказано ИК и
ЯМР (1Н и 13С) спектральными методами и эле-
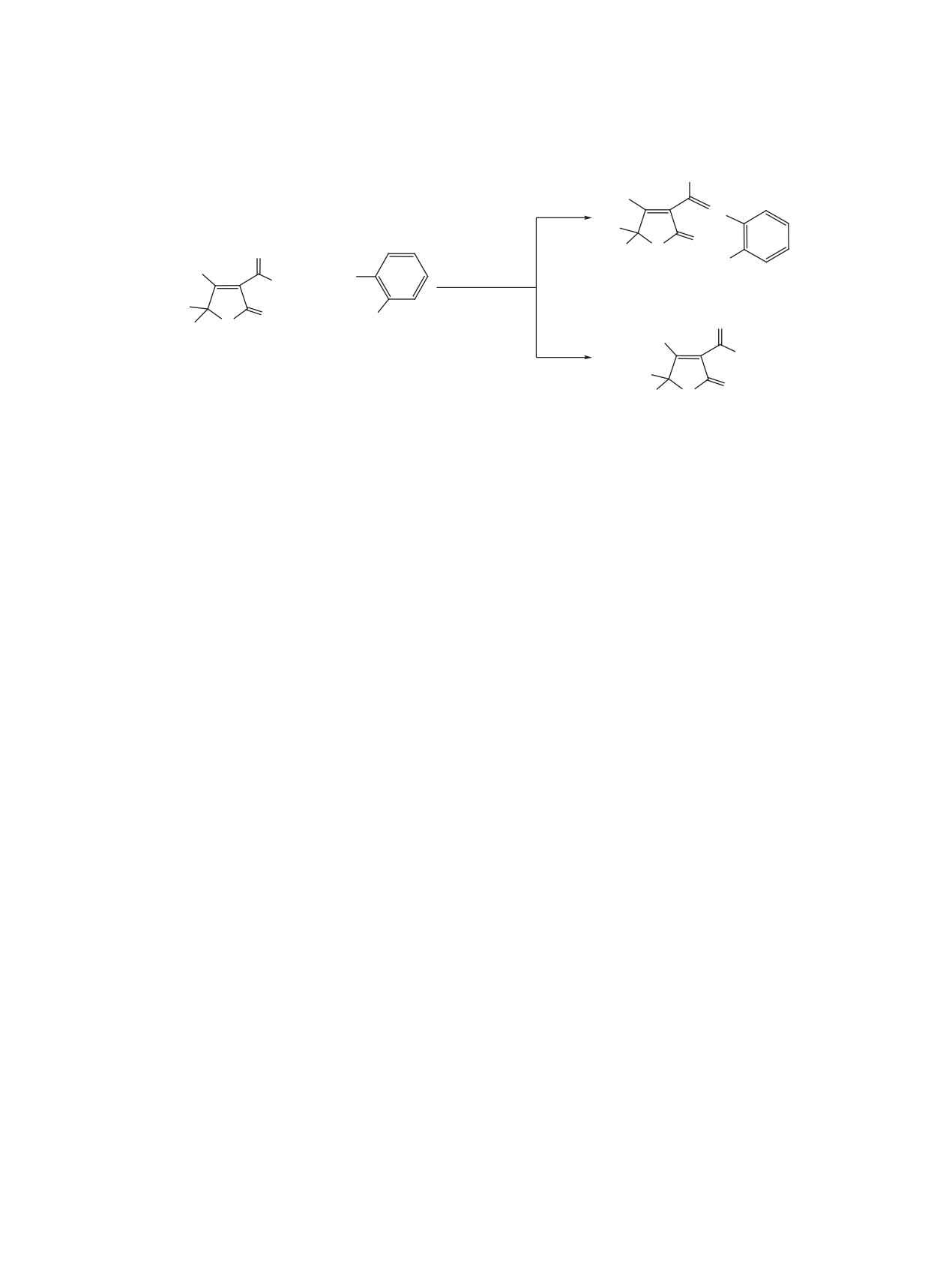
Как показали дальнейшие наши исследования,
ментным анализом.
взаимодействие 2-имино-4-метил-2,5-дигидрофу-
ран-3-карбоксамидов 1а-d и антраниловой кис-
Синтез соединений 3а-d (общая методика).
лоты (2), взятых в эквимолярном соотношении, в
Смесь 5 ммоль ненасыщенного γ-иминолактона
среде 80%-ной уксусной кислоты при кипячении
1а-с, 0.68 г (5 ммоль) антраниловой кислоты (2)
реакционной смеси в течение 3 ч приводит к со-
и 5 мл ледяной уксусной кислоты перемешивали
единениям 4а-d без промежуточного выделения
в течение 12 ч при комнатной температуре. К ре-
соединений 3а-d (схема 3).
акционной смеси добавляли воду, выделившийся
Схема 2.
H2N
Me
N
O
R1
Me
O
O
R2
HOOC
NH
2
80% CH3COOH
R1
4a, b
N
2 ч, кипячение
O
R2
O
HOOC
Me
NH
2
3a-d
R1
O
R2
O
4c, d
3a-d, R1 = R2 = Me (a); R1 = Me, R2 = C2H5 (b); R1, R2 = (CH2)4 (c); R1, R2 = (CH2)5 (d).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 8 2020
ВЗАИМОДЕЙСТВИЕ 2-ИМИНО-2,5-ДИГИДРОФУР
АН-3-КАРБОКСАМИДОВ
1289
Схема 3.
NH2
Me
N
R1
O
O
O
R2
HOOC
Me
H2N
80% CH3COOH
NH
4a, b
2
+
3 ч, кипячение
R1
NH
HOOC
O
O
R2
Me
1a-d
2
NH2
R1
O
O
R2
4c, d
1a-d, R1 = R2 = Me (a); R1 = Me, R2 = C2H5 (b); R1, R2 = (CH2)4 (c); R1, R2 = (CH2)5 (d).
осадок отфильтровывали, промывали водой, пере-
Найдено, %: С 63.68; Н 6.29; N 9.40. С16Н18N2О4.
кристаллизовывали из этанола.
Вычислено, %: С 63.56; Н 6.00; N 9.27.
4,5,5-Триметил-2-[(N-2-карбоксифенил)ими-
2-(3-Карбамоил-4-метил-1-оксаспиро[4.4]-
но]-2,5-дигидрофуран-3-карбоксамид (3a). Вы-
нон-3-ен-2-илиденамино)бензоиновая кислота
ход 95%, т.пл. 225-227°С, Rf 0.59. Спектр ЯМР 1Н
(3c). Выход 90%, т.пл. 202-204°С, Rf 0.56. Спектр
(ДМСО-d6-CCl4, 1:3), δ, м.д.: 1.45 с (6H, 2CH3),
ЯМР 1Н (ДМСО-d6-CCl4, 1:3), δ, м.д.: 1.42 м (2H)
2.40 с (3H, CH3), 7.01 т (1H, C6H5, J 8.0 Гц), 7.18 д
и 1.58-1.85 м [6H, (CH2)4], 2.38 с (3H, CH3), 7.01
(1H, C6H5, J 8.2 Гц), 7.40 т (1H, C6H5, J 8.2 Гц), 7.82
т (1H, C6H5, J 8.0 Гц), 7.18 д (1H, C6H5, J 8.2 Гц),
(1H, C6H5, J 8.2 Гц), 7.18 уш.с (1H) и 8.64 уш.с (1H,
7.40 т (1H, C6H5, J 8.2 Гц), 7.82 (1H, C6H5, J
CONH2), 12.6 уш.с (1H, OH). Спектр ЯМР 13С, δ,
8.2 Гц), 7.18 уш.с (1H) и 8.64 уш.с (1H, CONH2),
м.д.: 12.18 (CH3), 23.71 (2CH3), 85.45 (C5), 109.81
12.6 уш.с (1H, OH). Спектр ЯМР 13С, δ, м.д.:
(C3), 114.02 (Cаром), 115.92 (Cаром), 117.23 (Cаром),
22.10 (CH2), 22.22 (CH2), 25.09 (CH2), 26.95 (CH2),
130.98 (Cаром), 132.79 (Cаром), 151.14 (Cаром), 161.33
35.91 (CH3), 85.45 (C5), 109.81 (C3), 114.02 (Cаром),
(C4), 169.34 (C2), 169.31 (C=O), 179.14 (C=O).
115.92 (Cаром),
117.23 (Cаром),
130.98 (Cаром),
Найдено, %: С 62.54; Н 5.67; N 9.98. С15Н16N2О4.
132.79 (Cаром), 151.14 (Cаром), 161.33 (C4), 169.34
Вычислено, %: С 62.49; Н 5.59; N 9.71.
(C2), 169.31 (C=O), 179.14 (C=O). Найдено, %: С
65.14; Н 5.98; N 9.18. С17Н18N2О4. Вычислено, %:
4,5-Диметил-5-этил-2-[(N-2-карбоксифе-
С 64.95; Н 5.77; N 8.91.
нил)имино]-2,5-дигидрофуран-3-карбоксамид
(3b). Выход 90%, т.пл. 202-204°С, Rf 0.58. Спектр
2-(3-Карбамоил-4-метил-1-оксаспиро[4.5]-
ЯМР 1Н (ДМСО-d6-CCl4, 1:3), δ, м.д.: 0.79 т (3H,
нон-3-ен-2-илиденамино)бензоиновая кислота
CH2CH3, J 7.4 Гц), 1.44 с (3H, CH3), 1.79 д.к (1H,
(3d). Выход 87%, т.пл. 244-246°С, Rf 0.53. Спектр
CH2CH3, J 14.5, 7.4 Гц), 1.94 д.к (1H, CH2CH3, J
ЯМР 1Н (ДМСО-d6-CCl4, 1:3), δ, м.д.: 1.27 м (1H),
14.5, 7.4 Гц), 2.32 с (3H, CH3), 7.01 т (1H, C6H5,
1.47 м (2H) и 1.58-1.82 м (7H, (CH2)5), 2.38 с (3H,
J 8.0 Гц), 7.18 д (1H, C6H5, J 8.2 Гц), 7.40 т (1H,
CH3), 7.10 т (1H, C6H5, J 8.0 Гц), 7.18 д (1H, C6H5,
C6H5, J 8.2 Гц), 7.80 д (1H, C6H5, J 8.2 Гц), 7.18
J 8.2 Гц), 7.40 т (1H, C6H5, J 8.2 Гц), 7.82 (1H,
уш.с (1H) и 8.65 уш.с (1H, CONH2), 12.6 уш.с (1H,
C6H5, J 8.2 Гц), 7.18 уш.с (1H) и 8.64 уш.с (1H,
OH). Спектр ЯМР 13С, δ, м.д.: 6.97 (CH3), 11.95
CONH2), 12.6 уш.с (1H, OH).Спектр ЯМР 13С, δ,
(CH3), 22.98 (CH2), 29.44 (CH3), 91.96 (C5), 121.65
м.д.: 12.34 (CH3), 20.96 (2CH2), 23.91 (CH2), 32.39
(C3), 122.64 (Cаром), 122.80 (Cаром), 124.19 (Cаром),
(2CH2), 92.61 (C5), 121.65 (C3), 122.64 (Cаром),
130.38 (Cаром), 131.26 (Cаром), 145.67 (Cаром), 159.21
122.80 (Cаром),
124.19 (Cаром),
130.38 (Cаром),
(C4), 162.01 (C2), 167.07 (C=O), 168.66 (C=O).
131.26 (Cаром), 145.67 (Cаром), 159.21 (C4), 162.01
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 8 2020
1290
КАРАПЕТЯН, ТОКМАДЖЯН
(C2), 167.07 (C=O), 168.66 (C=O). Найдено, %: С
4-Метил-2-оксo-1-оксаспирo[4.4]нон-3-ен-3-
68.29; Н 5.97; N 8.21. С18Н20N2О4. Вычислено, %:
карбоксамид (4c). Выход 85% (метод а), 72% (ме-
С 68.16; Н 5.72; N 7.95.
тод б), т.пл. 142-143°С (из гексана), Rf 0.52. Спектр
ЯМР 1Н (ДМСО-d6-CCl4, 1:3), δ, м.д.: 1.42 м (2H)
Синтез соединений 4а-d (общая методика). а.
и 1.58-1.85 м [6H, (CH2)4], 2.40 с (3H, CH3), 7.41
Раствор 2.5 ммоль соединения 3а-d в 5 мл 80%-
уш.с (1H) и 7.58 уш.с (1H, CONH2). Найдено, %: С
ной уксусной кислоты кипятили 2 ч. При пони-
61.75; Н 6.95; N 7.46. С10Н13NО3. Вычислено, %: С
женном давлении удаляли растворитель, твердый
61.53; Н 6.71; N 7.17.
осадок перекристаллизовывали.
4-Метил-2-оксo-1-оксаспирo[4.5]дек-3-ен-
б. Раствор 5 ммоль ненасыщенного γ-иминолак-
3-карбоксамид (4d). Выход 91% (метод а), 84%
тона 1а-с и 0.68 г (5 ммоль) антраниловой кисло-
(метод б), т.пл. 161-163°С (из октана), Rf 0.51,
ты (2) в 5 мл 80%-ной уксусной кислоты кипятили
С11Н15NО3 [12].
3 ч. При пониженном давлении удаляли раствори-
Все реагенты приобретены в фирме Sigma
тель, твердый осадок перекристаллизовывали.
Aldrich и использовались без дальнейшей очистки.
2-{[Амино(4,5,5-триметил-2-oксo-2,5-ди-
Спектры ЯМР 1Н и 13С синтезированных соеди-
гидрофуран-3-ил)метилен]амино}бензойная
нений сняты на спектрометре Varian Mercury-300
кислота (4a). Выход 89% (метод а), 78% (метод б),
(300 и 75 МГц) (USA), внутренний стандарт -
т.пл. 76-78°С (из гексана), Rf 0.61. Спектр ЯМР 1Н
ТМС. Чистоту синтезированных соединений кон-
(ДМСО-d6-CCl4, 1:3), δ, м.д.: 1.45 с (6H, 2CH3),
тролировали методом ТСХ на пластинках Silufol
2.40 с (3H, CH3), 6.05 т (1H, C6H5, J 8.0 Гц), 6.35 д
UV-254 (Czech Republic) в системе элюентов
(1H, C6H5, J 8.2 Гц), 7.15 т (1H, C6H5, J 8.2 Гц), 7.7
ацетон-бензол (1.5:2), проявление парами йода.
(1H, C6H5, J 8.2 Гц), 7.46 уш.с (1H) и 7.53 уш.с (1H,
Температуру плавления определяли на приборе
NH2), 8.6 уш.с (1H, OH). Спектр ЯМР 13С, δ, м.д.:
Electrothermal 9100 (UK).
12.18 (CH3), 23.72 (2CH3), 85.45 (C5), 109.81 (C3),
КОНФЛИКТ ИНТЕРЕСОВ
114.02 (Cаром), 115.92 (Cаром), 117.23 (Cаром), 130.98
(Cаром), 132.79 (Cаром), 151.14 (Cаром), 161.33 (C4),
Авторы заявляют об отсутствии конфликта ин-
169.34 (C2), 169.31 (C= N), 179.14 (C=O). Найдено,
тересов.
%: С 62.64; Н 5.72; N 9.94. С15Н16N2О4. Вычислено,
СПИСОК ЛИТЕРАТУРЫ
%: С 62.49; Н 5.59; N 9.71.
1. Аветисян А.А., Токмаджян Г.Г. Хим. ж. Арм. 2007,
2-{[Амино(5-этил-4,5-диметил-2-oксo-2,5-ди-
60, 698-712.
гидрофуран-3-ил)метилен]амино}бензойная
2. Cheikh N., Bar N., Choukchou-Braham N., Mostefa-
кислота (4b). Выход 84% (метод а), 76% (ме-
Kara B., Lohier J.-F., Sopkova J., Villemin D.
тод б), т.пл. 92-94°С, Rf 0.56. Спектр ЯМР 1Н
Tetrahedron. 2011, 67, 1540-1551. doi 10.1016/j.
(ДМСО-d6-CCl4, 1:3), δ, м.д.: 0.79 т (3H, CH2CH3,
tet.2010.12.062
J 7.4 Гц), 1.44 с (3H, CH3), 1.79 д.к (1H, CH2CH3,
3. Avetissyan A., Karapetyan L. Synth. Commun. 2009,
J 14.5, 7.4 Гц), 1.94 д.к (1H, CH2CH3, J 14.5,
39, 7-19. doi 10.1080/00397910701739022
7.4 Гц), 2.32 с (3H, CH3), 6.05 т (1H, C6H5, J 8.0 Гц),
4. Avetisyan A.A., Karapetyan L.V. Heterocycl. Commun.
6.36 д (1H, C6H5, J 8.2 Гц), 7.18 т (1H, C6H5, J
2012, 18, 263-267. doi 10.1515/hc-2012-0113
8.2 Гц), 7.7 (1H, C6H5, J 8.2 Гц), 7.47 уш.с (1H) и
5. Tokmajyan G.G., Karapetyan L.V. J. Heterocycl. Chem.
7.54 уш.с (1H, NH2), 8.7 уш.с (1H, OH). Спектр
2017, 54, 1630-1639. doi 10.1002/jhet.2713
ЯМР 13С, δ, м.д.: 6.98 (CH3), 11.96 (CH3), 22.98
6. Карапетян Л.В., Токмаджян Г.Г. ЖОрX. 2019, 55,
(CH2), 29.44 (CH3), 91.96 (C5), 121.65 (C3), 122.64
801-804. [Karapetyan L.V., Tokmajyan G.G. Russ.
(Cаром),
122.80 (Cаром),
124.19 (Cаром),
130.39
J. Org. Chem. 2019, 55, 727-729.] doi 10.1134/
(Cаром), 131.26 (Cаром), 145.67 (Cаром), 159.22 (C4),
S1070428019050257
162.01 (C2), 167.07 (C=N), 168.66 (C=O). Найдено,
7. Карапетян Л.В., Токмаджян Г.Г., Макарян Г.М.
%: С 63.77; Н 6.26; N 9.37. С16Н18N2О4. Вычислено,
ЖОрX.
2019,
55,
1796-1799.
[Karapetyan L.V.,
%: С 63.56; Н 6.00; N 9.27.
Tokmajyan G.G., Makaryan G.M. Russ. J. Org.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 8 2020
ВЗАИМОДЕЙСТВИЕ 2-ИМИНО-2,5-ДИГИДРОФУР
АН-3-КАРБОКСАМИДОВ
1291
Chem.
2019,
55,
1806-1808.] doi
10.1134/
10. Kovalenko S.N., Bylov I.E., Sytnik K.M., Cher-
S1070428019110265
nykh V.P., Bilokin Y.V. Molecules. 2000, 5, 1146-1165.
doi 10.3390/51001146
8. Kovalenko S.N., Bylov I.E., Chernykh V.P.
Heterocycl. Commun. 1998, 4, 257-260. doi 10.1515/
11. Коваленко С.Н., Зубков В.А., Черных В.П., Ту-
HC.1998.4.3.257
ров А.В., Ивков С.М. ХГС. 1996, 32, 186-192.
[Kovalenko S.N., Zubkov V.A., Chernykh V.P., Tu-
9. Коваленко С.Н., Былов И.Е., Белоконь Я.В., Чер-
rov A.V., Ivkov S.M. Chem. Heterocycl. Compd. 1996,
ных В.П. ХГС. 2000, 36, 1175-1181. [Kovalen-
32, 163-168.] doi 10.1007/BF01165439
ko S.N., Bylov I.E., Bilokon’ Ya.V., Chernykh V.P.
Chem. Heterocycl. Compd. 2000, 36, 1026-1031.] doi
12. Аветисян А.А., Татевосян Г.Е, Дангян М.Т. Арм.
10.1023/A:1002773613250
хим. ж. 1971, 24, 688-693.
Interaction of 2-Imino-2,5-dihydrofuran-3-carboxamides
with Anthranilic Acid
L. V. Karapetyan* and G. G. Tokmajyan
Yerevan State University, 0025, Republic of Armenia, Yerevan, ul. Aleka Manukyana 1
*e-mail: lkarapetyan@ysu.am
Received February 20, 2020; revised February 28, 2020; accepted February 29, 2020
New derivatives of 2-N-substituted iminodihydrofurans have been synthesized by the interaction of 2-imi-
no-2,5-dihydrofuran-3-carboxamides with anthranilic acid in glacial acetic acid. Next, the synthesized 2-N-sub-
stituted iminodihydrofurans by boiling with aqueous 80% acetic acid and depending on substitutions of 5 posi-
tion iminodihidrofuran ring, have been transformed to different derivatives of unsaturated γ-lactone. The latter
have been obtained by boiling of 2-imino-2,5-dihydrofuran-3-carboxamides with anthranilic acid in aqueous
80% acetic acid, too.
Keywords: 2-imino-2,5-dihydrofuran-3-carboxamide, anthranilic acid, 2-N-substituted iminodihydrofurans,
derivatives of unsaturated γ-lactone
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 8 2020