ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 9, с. 1329-1336
УДК 547.859
ЭФФЕКТИВНЫЙ СИНТЕЗ
ПИРИДО[2,3-d]ПИРИМИДИНОВ НА ОСНОВЕ
РЕЦИКЛИЗАЦИИ N-АРИЛИТАКОНИМИДОВ
АМИНОПИРИМИДИНОНАМИ
© 2020 г. Я. Ю. Шмойлова, Ю. А. Ковыгин, Д. Ю. Вандышев, И. В. Леденёва,
Е. А. Кошелева, Х. С. Шихалиев*
ФГБОУ ВО «Воронежский государственный университет», 394018, Россия, г. Воронеж, Университетская пл. 1
*e-mail: chocd261@chem.vsu.ru
Поступила в редакцию 16 февраля 2020 г.
После доработки 22 февраля 2020 г.
Принята к публикации 28 февраля 2020 г.
Предложен удобный способ получения 2-(4,7-диоксопиридо[2,3-d]пиримидин-6-ил)ацетанилидов и
2-(2,4,7-триоксопиридо[2,3-d]пиримидин-6-ил)ацетанилидов, основанный на взаимодействии N-арили-
таконимидов с 6-аминопиримидин-4-онами и с 6-аминопиримидин-2,4-дионами, соответственно, при
кипячении реагентов в уксусной кислоте.
Ключевые слова: каскадные реакции, арилитаконимиды, аминопиримидиноны, аминоурацилы, пири-
до[2,3-d]пиримидины, рециклизация.
DOI: 10.31857/S0514749220090025
Гетероциклическая система пиридопиримиди-
пиридиновому. Такая же ступенчатая модель по-
на, является основой структуры многочисленных
строения конденсированной системы реализуется
биологически активных соединений. Так, среди
и при конденсации 2-аминоникотинонитрилов с
производных пиридо[2,3-d]пиримидинов обнару-
тиокарбамидом [11], гуанидином [12] или форма-
жены ингибиторы тирозинкиназ [1], чем объяс-
мидом [13] а также при циклизации 2-аминонико-
няется их противоопухолевая [2, 3] активность.
тинамида различными альдегидами [3]. Однако,
Структурное сходство с птеридинами объясняет
основным синтетическим подходом к построению
конкурентное ингибирование дигидрофолатредук-
пиридо[2,3-d]пиримидиновой матрицы являются
тазы [4, 5], с которым связывают их антибактери-
методы, связанные с аннелированием пиридино-
альную [6, 7] и противогрибковую [8] активность.
вого кольца к пиримидиновому. К ним относятся
Кроме того, производные пиридопиримидинов на-
сопряжённое присоединение аминоурацилов к
ходят применение в терапии ВИЧ-индуцированной
енонам [7, 14], в том числе, генерируемым in situ,
пневмонии и других бактериальных инфекций [9].
в трёхкомпоненном синтезе [15]; сочетание ами-
Известно несколько подходов к синтезу пири-
ноурацилов с β-дикетонами [16] или же циклопри-
до[2,3-d]пиримидиновой системы. Так, возможно
соединение α-аминоальдегидов пиримидинового
формирование обоих циклов в многокомпонент-
ряда к активированным непредельным соединени-
ной реакции [10] акрилата, малонодинитрила и
ям [17]. В числе последних методов выделяются
гуанидина. Маршрут этого процесса, по мнению
рециклизации малеимидов аминоурацилами [18],
авторов, включает аннелирование пиримиди-
позволяющие получить полизамещённые гидри-
нового цикла к первоначально образующемуся
рованные матрицы.
1329
1330
ШМОЙЛОВА и др.
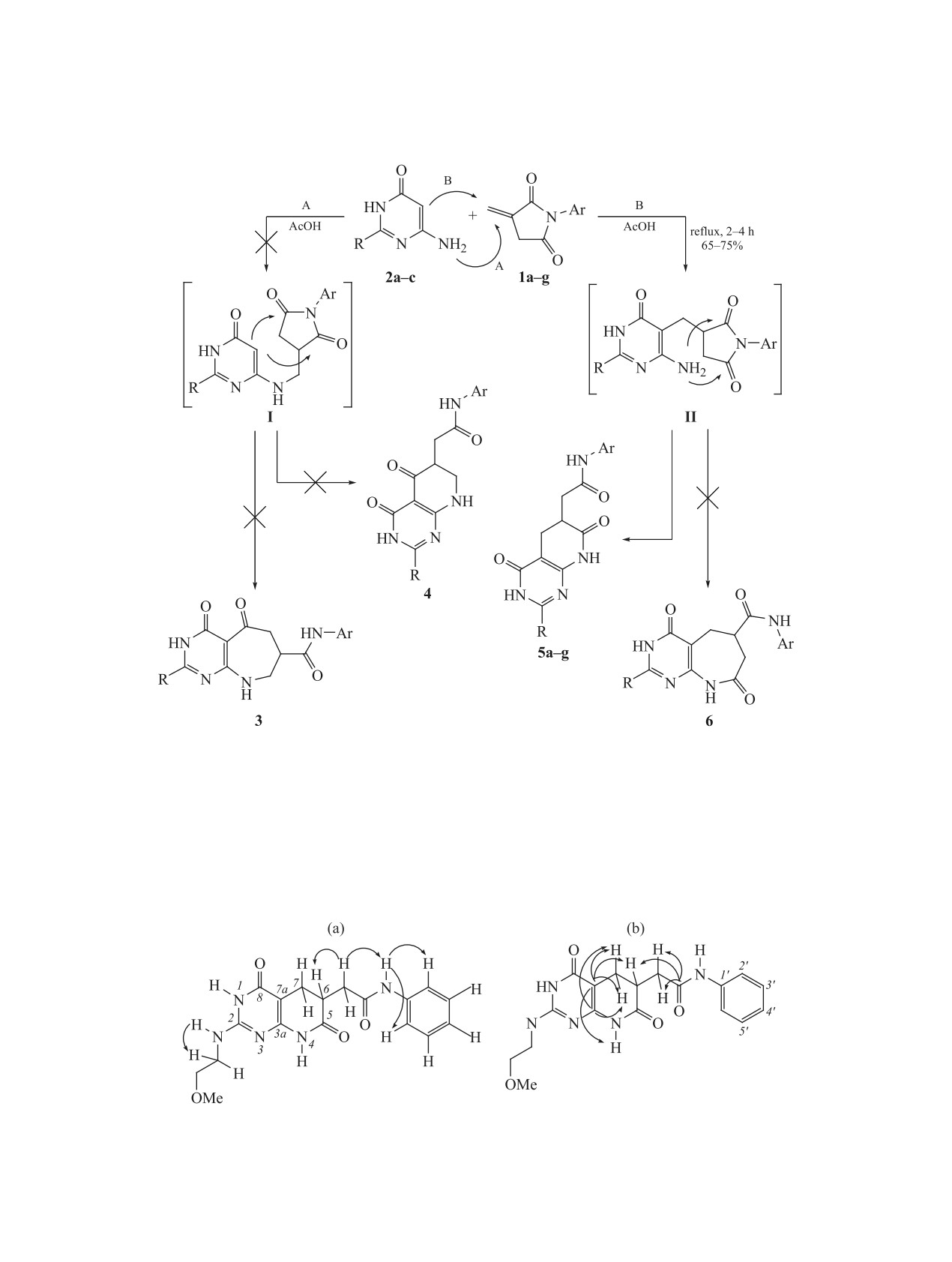
Для малеимидов известен целый ряд рецикли-
(путь А), после чего аддукт I, может рецикли-
заций при взаимодействии их с тиоамидами [19,
зоваться в
4,5-диоксогетеросистемы
3 и
4.
20], карбоксимидоамидами
[21], аминоазолами
Альтернативный путь
- присоединение по
[22, 23]. В то же время, реакционная способность
Михаэлю метиленовой группы (С5) аминоурацила
их структурных аналогов - итаконимидов, изуче-
по активированной кратной связи имида (путь B)
на недостаточно, несмотря на то, что доступность
с возможным образованием интермедиата II, даль-
этих соединений открывает широкие возможности
нейшее трансамидирование которого может при-
для построения комбинаторных библиотек на их
водить к 4,7-диоксопроизводным 5 и 6.
основе. Так, имеются сведения о взаимодействии
Анализ спектральных данных продуктов под-
их с мононуклеофилами - меркаптанами [24],
тверждает протекание реакции по маршруту В с
оксазол-4-оном [25]. Однако, упоминания о воз-
образованием N-(арил)-2-(2-R-4,7-диоксо-3,4,5,-
можных рециклизациях довольно редки и ограни-
6,7,8-гексагидропиридо[2,3-d]пиримидин-6-ил)-
чиваются работами авторов, посвящёнными взаи-
ацетамидов 5а-g. Структуры полученных сое-
модействию с 3-аминоциклогексен-2-онами [26] и
динений были охарактеризована с использова-
1,2-диаминобензимидазолом [27]. В настоящей ра-
нием данных ИК, ЯМР 1Н, и двумерной ЯМР-
боте нами изучены реакции N-арилитаконимидов
спектроскопии, а также высокоэффективной жид-
с гетероциклическими C,N-динуклеофилами
-
костной хроматографии в сочетании с масс-спек-
6-аминопиримидинонами и 1,3-диметил-6-амино-
трометрией высокого разрешения (электроспрей-
пиримидиндионом.
ная ионизация, HPLC-HRMS-ESI).
Ранее отмечалось [18], что предпочтительной
В спектре ЯМР 1Н соединений 5a-g в области
средой для рециклизации малеимидов с аминопи-
слабого поля (9.8-10.5 м.д.) присутствуют три
римидиндионами являются высокополярные рас-
синглета, соответствующие амидным протонам.
творители, такие как ацетонитрил, диметилфор-
Это позволяет однозначно исключить из рассмо-
мамид, уксусная кислота. Сообщалось также [27],
трения структуры 3 и 4, содержащие лишь по два
что применение уксусной кислоты препятству-
амидных протона. Соответственно, маршрут вза-
ет изомеризации итаконимида в цитраконимид.
имодействия А и интермедиат I в условиях реак-
Кроме того, выбор её в качестве среды обусловлен
ции, по-видимому, не реализуются. Также, важны-
хорошей растворимостью в ней бинуклеофилов и
ми для установления региохимии процесса явля-
ограниченной - продуктов реакции.
ются сигналы протонов двух метиленовых групп
Нами установлено, что максимальные выходы
и третичного протона в области 2.15-2.75 м.д.
в реакции N-арилитаконимидов 1а-g с 6-амино-2-
Однозначное отнесение сигналов диастереотроп-
(R)пиримидин-4(3H)-онами
2а-с действительно
ных метиленовых протонов основано на корреля-
достигаются при кипячении реагентов в уксусной
циях, обнаруженных в спектрах NOESY 1H-1H и
кислоте в течение 2-4 ч. Основными продуктами
HMBC 1H-13C для соединения 5d (см. рисунок).
являются N-(арил)-2-(2-R-4,7-диоксо-3,4,5,6,7,8-
Двумерный спектр NOESY 1H-1H позволяет
гексагидропиридо[2,3-d]пиримидин-6-ил)ацета-
обнаружить взаимодействие протонов СН2-групп.
миды 5а-g, образующиеся с выходами 65-75%.
Так, наблюдаются чёткие кросс-пики между
Было исследовано протекание реакции в смесях
двойными дублетами при 2.20 и 2.76 м.д., а также
уксусной кислоты с диметилформамидом, про-
между сигналами 2.42 и 2.85 м.д., что указывает
пан-2-олом, ксилолом. Показано, что в перечис-
на геминальное положение соответствующих
ленных системах выходы целевых продуктов со-
протонов. Существенно, что для пары сигналов
ставляют менее 20%, что делает их применение
при
2.42 и
2.85 м.д наблюдается чёткая
неэффективным (схема 1).
корреляция с синглетом NH при 9.97 м.д. Кроме
Для полифункциональных предшественников
того, сигнал данного амидного протона даёт кросс-
1 и 2 теоретически могут реализоваться несколь-
пик с парой эквивалентных ароматических СН
ко маршрутов их взаимодействия. На первой ста-
(7.60 м.д.). Это однозначно указывает на близкое
дии возможна атака итаконимида аминогруппой
расположение взаимодействующих групп, которое
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
ЭФФЕКТИВНЫЙ СИНТЕЗ ПИРИДО[2,3-d]ПИРИМИДИНОВ НА ОСНОВЕ РЕЦИКЛИЗАЦИИ
1331
Схема 1.
1, Ar = 3,4-diMe-C6H3 (a); 4-Me-C6H4 (b); C6H5 (c); 4-Me-C6H4 (d); 2,3-diCl-C6H3 (e);
2-Me-3-Cl-C6H3 (f); 3-Cl-4-Me-C6H3 (g); 2, R = NH(CH2)2OMe (a); S(CH2)2CHMe2 (b);
NH(2-MeO-C6H4) (c); 5, R = NH(CH2)2OMe, Ar = 3-Cl-4-Me-C6H3 (a);
Ar = 4-Et-C6H4 (b); Ar = 3,4-diMe-C6H3 (c); Ar = C6H5 (d).
реализуется только в структуре 5d. Очевидно,
группа. Для альтернативной структуры 6d картина
отнесение сигналов должно быть следующим:
взаимодействия была бы иной: для экзо-амидного
9.97 м.д.
- экзоциклическая амидная группа,
протона наблюдался бы единственный кросс-пик с
2.42 и 2.85 м.д. - экзоциклическая метиленовая
метиновым протоном азепиновой системы.
Наиболее значимые взаимодействия в спектрах NOESY (a) и HMBC (b) N-фенил-2(2-метоксиэтиламино-4,7-диоксо-
3,4,5,6,7,8-гексагидропиридо[2,3-d]пиримидин-6-ил)ацетамида (5d).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1332
ШМОЙЛОВА и др.
Схема 2.
R = 3,4-diMe (a), 4-Me (b), H (c), 4-Et (d), 2,3-diCl (e).
В спектре HMBC 1H-13C соединения 5d ана-
мидин-6-илуксусных кислот на основе региосе-
логичную информацию несут кросс-пики мети-
лективной рециклизации N-арилитаконимидов
нового протона (2.85 м.д.) с эндо-карбонильным
при их взаимодействии с 6-амино-2-(R)пирими-
атомом углерода
(172.94 м.д.). Карбонильный
дин-4(3H)-онами и
6-аминоурацилами. Пред-
углерод С8 в альтернативной структуре 6d кор-
положительный каскадный маршрут реакции
релировал бы с двумя протонами α-метиленовой
включает присоединение С-нуклеофильного цен-
группы.
тра по активированной кратной связи электрофила
и последующее внутримолекулярное трансамиди-
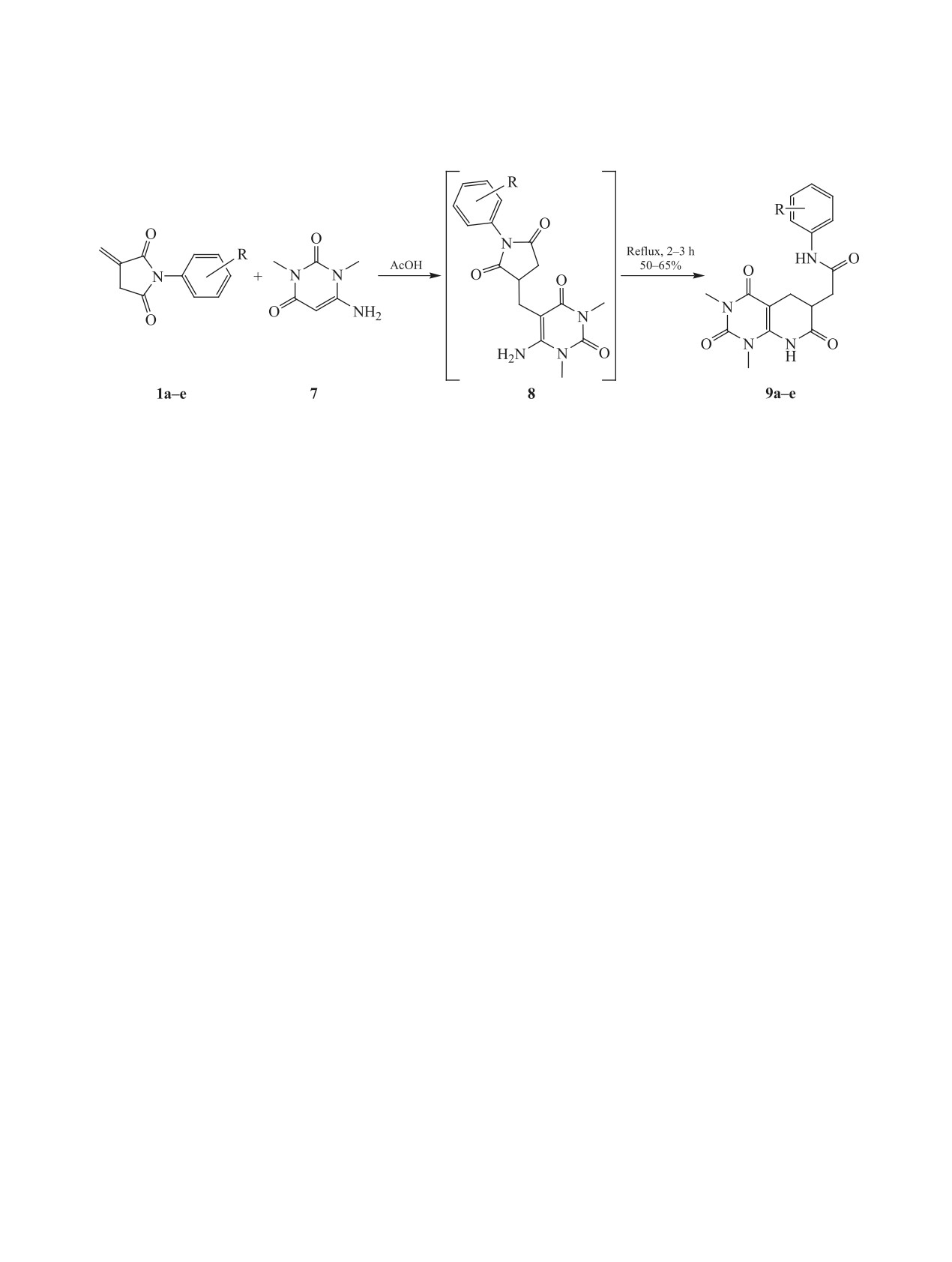
Нами также исследовано взаимодействие
рование интермедиата с одновременной рецикли-
N-арилитаконимидов 1a-e, со структурным анало-
зацией. В дальнейшем планируется использование
гом 6-амино-2-(R)-пиримидин-4(3Н)-онов 2а-с -
полученных производных пиридо[2,3-d]пирими-
6-амино-1,3-диметилурацилом (7). Установлено,
дин-6-илуксусных кислот для синтеза гибридных
что кипячение реагентов в уксусной кислоте в те-
молекул с различной физиологической активно-
чение 2-3 ч ожидаемо приводит к образованию
стью, в том числе ростстимулирующей.
2-(1,3-диметил-2,4,7-триоксо-1,2,3,4,5,6,7,8-окта-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
гидропиридо[2,3-d]пиримидин-6-ил)-N-арилаце-
тамидов 9a-e с выходами 50-65% (схема 2).
Спектры ЯМР 1Н зарегистрированы на спек-
трометре Bruker DRX 500 в ДМСО-d6 при 30°С,
Маршрут реакции, очевидно аналогичен при-
внутренний стандарт ТМС. Для записи двумерных
ведённому выше: каскадное взаимодействие начи-
спектров использованы стандартные методики
нается с атаки С-нуклеофильным центром 6-ами-
фирмы «Bruker». Время смешивания в спектрах
но-1,3-диметилурацила активированной двойной
NOESY 0.3 с. Масс-спектры высокого разреше-
связи итаконимида с образованием аддуктов 8,
ния записаны на приборе Agilent Technologies
рециклизующихся в 2-(1,3-диметил-2,4,7-триок-
LCMS 6230B (ESI). ИК спектры регистрирова-
со-1,2,3,4,5,6,7,8-октагидропиридо[2,3-d]пирими-
лись при помощи ИК Фурье-спектрометра «Vertex
дин-6-ил)-N-арилацетамиды 9a-e.
70». Отнесение сигналов осуществлено на основе
Химические сдвиги характеристических про-
справочных данных.
тонов и тонкая структура спектров ЯМР 1Н ана-
Температуры плавления определены на аппа-
логичны таковым для N-арил-2-(2-R-4,7-диоксо-
рате Stuart SMP30. Контроль индивидуальности
3,4,5,6,7,8-гексагидропиридо[2,3-d]пиримидин-6-
реагентов и полученных соединений, а также
ил)-ацетанилидов.
качественный анализ реакционных смесей осу-
Таким образом, нами разработан новый ва-
ществлен методом ТСХ на пластинах Merck TLC
риант синтеза производных пиридо[2,3-d]пири-
Silica gel 60 F254, элюенты: метанол, хлороформ и
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
ЭФФЕКТИВНЫЙ СИНТЕЗ ПИРИДО[2,3-d]ПИРИМИДИНОВ НА ОСНОВЕ РЕЦИКЛИЗАЦИИ
1333
их смеси в различных соотношениях. Проявление
350°С. ИК спектр, ν, см-1: 1645, 1606 (C=O, амид I),
хроматограмм - УФ и пары йода.
1512 (C=O, амид II). Спектр ЯМР 1Н, δ, м.д.: 2.15
с (3H, CH3), 2.17 д.д (1H, CH2СО, J 12.1, 15.5 Гц),
N-Арилитаконимиды 1а-е, аминопиримидино-
2.18 с (3Н, СН3), 2.37 д.д (1H, CH2СО, J 9.6,
ны 2а-d и 6-амино-1,3-диметилурацил (7) явля-
16.6 Гц), 2.73 д.д (1Н, СН2-5, J 6.9, 15.5 Гц), 2.74-
ются коммерческими препаратами, доступными в
2.86 м (2H, CH2-5 + CH-6), 3.28 с (3H, CH3O),
компании «Alinda Chemical».
3.39-3.45 м (4H, OCH2CH2N), 6.49 уш.с (1H, NH),
Синтез N-(3-хлор-4-метилфенил)-2-{2-(2-ме-
6.93-7.24 м (3Hаром), 9.79 с (1H, NH), 10.01 с (1H,
токсиэтил)амино-4,7-диоксо-3,4,5,6,7,8-гекса-
NH), 10.41 с (1H, NH). Масс-спектр, m/z: 400.1978
гидропиридо[2,3-d]пиримидин-6-ил}-ацетами-
[M]+. С20H25N5O4. M 400.1986.
да (5а). Смесь 1.85 г (0.01 моль) 4-амино-2-(2-ме-
N-фенил-2-{2-(2-метоксиэтил)амино-4,7-ди-
токсиэтокси)-1H-пиримидин-6-она (2а) и 2.35 г
оксо-3,4,5,6,7,8-гексагидропиридо[2,3-d]пири-
(0.01 моль) N-(3-хлор-4-метилфенил)итаконими-
мидин-6-ил}-ацетамид (5d). Выход 2.4 г (65%),
да (1g) кипятили в течение 2-4 ч в 5 мл АсОН.
бесцветные кристаллы, т.пл
333-334°С. ИК
Выделившийся осадок отфильтровывали и про-
спектр, ν, см-1: 1695, 1618 (C=O, амид I), 1512
мывали изопропиловым спиртом. Выход 2.7 г
(C=O, амид II). Спектр ЯМР 1Н, δ, м.д.: 2.20 д.д
(65%), бесцветные кристаллы, т.пл. 349-350°С.
(1H, CH2СО, J 12.5, 15.6 Гц), 2.42 д.д (1H, CH2СО,
ИК спектр, ν, см-1: 1643, 1604 (C=O, амид I), 1514
J 9.2, 16.4 Гц), 2.76 д.д (1Н, СН2-5, J 7.1, 15.6 Гц),
(C=O, амид II). Спектр ЯМР 1Н, δ, м.д.: 2.18 д.д
2.82-2.89 м (2H, CH2-5 + CH-6), 3.28 с (3H, CH3O),
(1H, СН2СО, J 12.2, 15.5 Гц), 2.26 с (3H, CH3),
3.39-3.46 (4H, OCH2CH2N), 6.51 уш.с (1H, NH),
2.40 д.д (1H, CH2СО, J 9.3, 16.8 Гц), 2.74 д.д (1Н,
7.01-7.60 м (5Hаром), 9.97 с (1H, NH), 10.03 с (1H,
СН2-5, J 6.3, 15.3 Гц), 2.80-2.86 м (2H, CH2-5 +
NH), 10.43 с (1H, NH). Масс-спектр, m/z: 372.1668
CH-6),
3.28 с
(3H, CH3O),
3.39-3.45 м
(4H,
[M]+. С18H20N5O4. M 372.1672.
OCH2СH2N), 6.49 уш.с (1H, NH), 7.26-7.79 м
(3Hаром), 10.02 с (1H, NH), 10.06 с (1H, NH), 10.42
N-(3-хлор-4-метилфенил)-2-(2-(2-метокси-
с (1H, NH). Масс-спектр, m/z:
420.1433
[M]+.
фенил)амино-4,7-диоксо-3,4,5,6,7,8-гексагидро-
С19H22ClN5O4. M 420.1439.
пиридо[2,3-d]пиримидин-6-ил)-ацетамид
(5e).
Выход 3.0 г (65%), бесцветные кристаллы, т.пл
Соединения 5b-g получали аналогично.
364-365°С. ИК спектр, ν, см-1: 1643, 1600 (C=O,
N-(4-этилфенил)-2-{2-(2-метоксиэтил)ами-
амид I), 1514 (C=O, амид II). Спектр ЯМР 1Н,
но-4,7-диоксо-3,4,5,6,7,8-гексагидропиридо-
δ, м.д.: 2.27 с (3Н, СН3), 2.28 д.д (1H, CH2СО, J
[2,3-d]пиримидин-6-ил}-ацетамид
(5b). Выход
12.3, 15.4 Гц), 2.45 д.д (1H, CH2СО, J 7.5, 15.1 Гц),
2.8 г (70%), бесцветные кристаллы, т.пл 358-
2.87-2.94 м (3H, CH2-5 + CH-6), 3.88 с (3H, CH3O),
359°С. ИК спектр, ν, см-1: 1641, 1600 (C=O,
7.00-8.57 м (8H, СНаром + NH), 10.05 с (1H, NH),
амид I), 1512 (C=O, амид II). Спектр ЯМР 1Н, δ,
10.28 с (1H, NH), 11.06 с (1H, NH). Масс-спектр,
м.д.: 1.15 т (3H, СH2CH3, J 7.6 Гц), 2.17 д.д (1H,
m/z: 468.1433 [M]+. С23H23ClN5O4. M 468.1439.
CH2СО, J 12.4, 15.5 Гц), 2.38 д.д (1H, CH2СО, J
N-(2-метил-3-хлорфенил)-2-(2-(3-метил-
9.4, 16.3 Гц), 2.51-2.57 м (2Н, СН2СН3), 2.74 д.д
бутил)сульфанил-4,7-диоксо-3,4,5,6,7,8-гекса-
(1Н, СН2-5, J 6.9, 15.6 Гц), 2.78-2.87 м (2H,
гидропиридо[2,3-d]пиримидин-6-ил)-ацетамид
CH2-5 + CH-6), 3.28 с (3H, CH3O), 3.39-3.44 м
(5f). Выход 3.2 г (70%), бесцветные кристаллы,
(4H, OCH2CH2N), 6.51 уш.с (1H, NH), 7.12-7.49 м
т.пл 316-317°С. ИК спектр, ν, см-1: 1699, 1623
(4Hаром), 9.87 с (1H, NH), 10.01 с (1H, NH), 10.43
(C=O, амид I), 1517 (C=O, амид II). Спектр ЯМР
с (1H, NH). Масс-спектр, m/z:
400.1978
[M]+.
1Н, δ, м.д.: 0.90 с (3Н, СН3), 0.91 с (3Н, СН3), 1.49-
С20H25N5O4. M 400.1986.
1.55 м (2Н, СН2), 1.63-1.70 м (1Н, СН), 2.23 с (1H,
N-(3,4-диметилфенил)-2-{2-(2-метоксиэтил)-
СН3), 2.31-2.39 м (1H, CH2СО), 2.51-2.55 м (1H,
амино-4,7-диоксо-3,4,5,6,7,8-гексагидропири-
CH2СО), 2.82-2.98 м (3H, CH2-5 + CH-6), 3.09-
до[2,3-d]пиримидин-6-ил}-ацетамид (5c). Выход
3.14 м (2H, SCH2), 7.17-7.32 м (3Hаром), 9.62 с (1H,
2.6 г (65%), бесцветные кристаллы, т.пл 349-
NH), 10.44 с (1H, NH), 12.48 уш.с (1Н, NH). Масс-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1334
ШМОЙЛОВА и др.
спектр, m/z:
449.1408
[M]+. С21H25ClN4O3S. M
Масс-спектр, m/z: 357.1557 [M]+. С18H20N4O4. M
449.1415.
357.1564.
N-фенил-2-{2-(3-метилбутил)сульфанил-
N-фенил-2-(1,3-диметил-2,4,7-триоксо-1,2,3,-
4,7-диоксо-3,4,5,6,7,8-гексагидропиридо[2,3-d]-
4,5,6,7,8-октагидропиридо[2,3-d]пиримидин-
пиримидин-6-ил}-ацетамид (5g). Выход 3.0 г
6-ил)-ацетамид (9c). Выход 2 г (60%), бесцвет-
(75%), бесцветные кристаллы, т.пл 313-314°С.
ные кристаллы, т.пл
249-250°С. ИК спектр,
ИК спектр, ν, см-1: 1662, 1612 (C=O, амид I), 1487
ν, см-1: 1664, 1621 (C=O, амид I), 1512 (C=O,
(C=O, амид II). Спектр ЯМР 1Н, δ, м.д.: 0.90 с (3Н,
амид II). Спектр ЯМР 1Н, δ, м.д.: 2.31 д.д (1H,
СН3), 0.92 с (3Н, СН3), 1.49-1.56 м (2Н, СН2),
CH2СО, J 13.6, 15.4 Гц), 2.49 д.д (1H, CH2СО, J
1.63-1.70 м (1Н, СН), 2.35 д.д (1H, CH2СО, J 12.6,
7.3, 15.6 Гц), 2.83-2.90 м (2H, CH2-5), 2.93-3.01 м
16.0 Гц), 2.47 д.д (1H, CH2СО, J 7.9, 15.3 Гц),
(1H, CH-6), 3.16 с (3H, NCH3), 3.32 с (3H, NCH3),
2.81-2.96 м (3H, CH2-5 + CH-6), 3.09-3.14 м (2H,
7.59-7.01 м (4Hаром), 9.99 с (1H, NH), 10.47 с (1Н,
SCH2), 7.60-7.01 м (5Hаром), 9.99 с (1H, NH), 10.44
NH). Масс-спектр, m/z: 343.1414 [M]+. С17H18N4O4.
с (1H, NH), 12.39 уш.с (1Н, NH). Масс-спектр, m/z:
M 343.1407.
401.1643 [M]+. С20H24N4O3S. M 401.1649.
N-(4-этилфенил)-2-(1,3-диметил-2,4,7-три-
Синтез N-(3,4-диметилфенил)-2-(1,3-диме-
оксо-1,2,3,4,5,6,7,8-октагидропиридо[2,3-d]пи-
тил-2,4,7-триоксо-1,2,3,4,5,6,7,8-октагидропи-
римидин-6-ил)-ацетамид (9d). Выход 1.8 г (50%),
ридо[2,3-d]пиримидин-6-ил)-ацетамида
(9a).
бесцветные кристаллы, т.пл 238-239°С. ИК спектр,
Смесь 1.55 г (0.01 моль) 6-аминодиметилураци-
ν, см-1: 1676, 1640 (C=O, амид I), 1517 (C=O,
ла (7) и 2.15 г (0.01 моль) N-(3,4-диметилфенил)-
амид II). Спектр ЯМР 1Н, δ, м.д.: 1.15 т (3Н,
итаконимида (1a) кипятили в течение 2-4 ч в
CH2СН3, J 7.6 Гц), 2.31 д.д (1H, CH2СО, J 13.6,
5 мл АсОН. Реакционную массу выливали в воду.
15.4 Гц), 2.47 д.д (1H, CH2СО, J 7.5, 15.6 Гц), 2.55
Образовавшийся осадок отфильтровывали и пе-
к (2Н, СН2СН3, J 7.5, 15.0 Гц), 2.82-2.89 м (2H,
рекристаллизовывали из метанола. Выход 2.4 г
CH2-5), 2.92-3.00 м (1H, CH-6), 3.16 с (3H, NCH3),
(65%), бесцветные кристаллы, т.пл 240-241°С.
3.32 с (3H, NCH3), 7.49-7.11 м (4Hаром), 9.91 с (1H,
ИК спектр, ν, см-1: 1668, 1615 (C=O, амид I), 1512
NH), 10.47 с (1Н, NH). Масс-спектр, m/z: 371.1718
(C=O, амид II). Спектр ЯМР 1Н, δ, м.д.: 2.26 с (3Н,
[M]+. С19H22N4O4. M 371.1721.
СН3), 2.31 д.д (1H, CH2СО, J 13.4, 15.6 Гц), 2.40
N-(2,3-дихлорфенил)-2-(1,3-диметил-2,4,7-
д.д (1H, CH2СО, J 7.2, 15.6 Гц), 2.51 с (3Н, СН3),
триоксо-1,2,3,4,5,6,7,8-октагидропиридо[2,3-d]-
2.82-2.90 м (2H, CH2-5), 2.93-3.00 м (1H, CH-6),
пиримидин-6-ил)-ацетамид (9e). Выход 2.5 г
3.16 с (3H, NCH3), 3.32 с (3H, NCH3), 7.79-7.25
(60%), т.пл 238-239°С. ИК спектр, ν, см-1: 1676,
м (3Hаром), 10.09 с (1H, NH), 10.47 с (1Н, NH).
1640 (C=O, амид I), 1517 (C=O, амид II). Спектр
Масс-спектр, m/z: 371.1717 [M]+. С19H22N4O4. M
ЯМР 1Н, δ, м.д.: 2.34 д.д (1H, CH2СО, J 12.7,
371.1721.
СО, J 8.3, 15.4 Гц), 2.79-
15.1 Гц), 2.59 д.д (1H, CH2
Соединения 9b-e получали аналогично.
3.01 м (3H, CH2-5 + CH-6), 3.17 с (3H, NCH3), 3.32
N-(4-метилфенил)-2-(1,3-диметил-2,4,7-три-
с (3H, NCH3), 7.33-7.71 м (3Hаром), 9.64 с (1H, NH),
оксо-1,2,3,4,5,6,7,8-октагидропиридо[2,3-d]пи-
10.49 с (1Н, NH). Масс-спектр, m/z: 411.0622 [M]+.
римидин-6-ил)-ацетамид (9b). Выход 2.2 г (60%),
С17H16C12N4O4. M 411.0628.
бесцветные кристаллы, т.пл 247-248°С. ИК спектр,
БЛАГОДАРНОСТИ
ν, см-1: 1664, 1621 (C=O, амид I), 1512 (C=O,
амид II). Спектр ЯМР 1Н, δ, м.д.: 2.24 с (3Н,
ИК и масс-спектры получены с помощью науч-
СН3), 2.30 д.д (1H, CH2СО, J 13.4, 15.6 Гц), 2.46
но-технической базы ЦКПНО ВГУ.
д.д (1H, CH2СО, J 7.5, 15.5 Гц), 2.51 с (3Н, СН3),
ФОНДОВАЯ ПОДДЕРЖКА
2.81-2.89 м (2H, CH2-5), 2.92-2.99 м (1H, CH-6),
3.16 с (3H, NCH3), 3.32 с (3H, NCH3), 7.47-7.08
Работа выполнена при поддержке Министерства
м (4Hаром), 9.89 с (1H, NH), 10.46 с (1Н, NH).
науки и высшего образования РФ в рамках
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
ЭФФЕКТИВНЫЙ СИНТЕЗ ПИРИДО[2,3-d]ПИРИМИДИНОВ НА ОСНОВЕ РЕЦИКЛИЗАЦИИ
1335
государственного задания ВУЗам в сфере научной
Heterocycl. Chem. 2007, 44, 775-782. doi 10.1002/
деятельности на 2020-2022 годы, проект № FZGU-
jhet.5570440404
2020-0044.
16.
Takahashi M., Nagaoka H., Inoue K. J. Heterocycl.
Chem. 2004, 41, 525-530. doi 10.1002/jhet.5570410408
КОНФЛИКТ ИНТЕРЕСОВ
17.
Devi I., Borah H.N., Bhuyan P.J. Tetrahedron Lett.
Авторы заявляют об отсутствии конфликта ин-
2004, 45, 2405-2408. doi 10.1016/j.tetlet.2004.01.094
тересов.
18.
Rudenko R.V., Komykhov S.A., Desenko S.M.,
Sen’ko Y.V., Shishkin O.V., Konovalova I.S., Shishki-
СПИСОК ЛИТЕРАТУРЫ
na S.V., Chebanov V.A. Synthesis. 2011, 19, 3161-
1.
Moreno E., Plano D., Lamberto I., Font M., Encío I.,
3167. doi 10.1055/s-0030-1260163
Palop J.A., Sanmartín C. Eur. J. Med. Chem. 2012, 47,
19.
Руденко Р.В., Комыхов С.А., Десенко С.М. ХГС.
283-298. doi 10.1016/j.ejmech.2011.10.056
2009, 45, 1272-1273. [Rudenko R.V., Komykhov S.A.,
2.
Flefel E.M., Sayed H.H., Hashem A.I., Shalaby E.A.,
Desenko S.M. Chem. Heterocycl. Compd. 2009, 45,
El-Sofany W., Abdel-Megeid F.M.E. Med. Chem. Res.
1017-1018.] doi 10.1007/s10593-009-0377-5
2014, 23, 2515-2527. doi 10.1007/s00044-013-0830-y
20.
Metwally M.A., Farahat A.A., Abdel-Wahab B.F.
3.
Krapf M.K., Gallus J., Vahdati S., Wiese M. J. Med.
J. Sulfur Chem. 2010, 31, 315-349. doi 10.1080/
Chem.
2018,
61,
3389-3408. doi
10.1021/
17415993.2010.482155
acs.jmedchem.7b01012
21.
Шихалиев Х.С., Ковыгин Ю.А., Потапов А.Ю.,
Сабынин А.Л., Кошелева Е.А. Изв. АН. Сер. Хим.
4.
Gangjee A., Vasudevan A., Queener S.F., Kisliukg R.L.
2017, 66, 86-90. [Shikhaliev Kh.S., Kovygin Yu.A.,
J. Med. Chem. 1995, 38, 1778-1785.
Potapov A.Yu., Sabynin A.L., Kosheleva E.A. Rus.
5.
Lakshmi Narayana B., Raghu Ram Rao A., Shanthan
Chem. Bull., Int. Ed. 2017, 66, 86-90.] doi 10.1007/
Rao P. Eur. J. Med. Chem. 2009, 44, 1369-1376. doi
s11172-017-1704-0
10.1016/j.ejmech.2008.05.025
22.
Rudenko R.V., Komykhov S.A., Desenko S.M.,
6.
Elagamey A.G., Abdel Sattar S., El-Taweel F., Said S.
Musatov V.I., Shishkin O.V., Konovalova I.S.,
J. Het. Chem. 2015. doi 10.1002/jhet.2487
Vashchenko E.V., Chebanov V.A. Synthesis. 2011, 5,
7.
El-Gazzar Abdel-Rahman B.A., El-Enanyb M.M.,
783-793. doi 10/1055/s-0030-1258421
Mahmoud N.M. Bioorg. Med. Chem. 2008, 16, 3261-
23.
Вандышев Д.Ю., Шихалиев Х.С., Потапов А.Ю.,
3273. doi 10.1016/j.bmc.2007.12.012
Крысин М.Ю. ХГС. 2015, 51, 829-833. [Vandy-
8.
Hanafy F.I. Eur. J. Chem. 2011, 2, 65-69. doi 10.5155/
shev D.Yu., Shikhaliev Kh.S., Potapov A.Yu., Kry-
eurjchem.2.1.65-69.303
sin M.Yu. Chem. Heterocycl. Compd. 2015, 51, 829-
9.
Buron F., Merour J.Y., Akssira M., Guillaumet G.,
833.] doi 10.1007/s10593-015-1782-6
Routier S. Eur. J. Med. Chem. 2015, 95, 76-95. doi
24.
Lin S., Leow D., Huang K., Tan C. Chem. Asian J.
10.1016/j.ejmech.2015.03.029
2009, 4, 1741-1744. doi 10.1002/asia.200900331
10.
Mont N., Teixido J., Borrella J.I., Kappeb C.O.
25.
Zhu B., Lee R., Li J., Ye X., Hong S., Qiu S.,
Tetrahedron Lett. 2003, 44, 5385-5387, doi 10.1016/
Coote M. L., Jiang Z. Angew. Chem. Int. Ed. 2016,
S0040-4039(03)01306-6
55, 1299-1303. doi 10.1002/anie.201507796
11.
Kumar N., Singh G., Yadav A.K. Heteroatom Chem.
26.
Ковыгин Ю.А., Шихалиев Х.С., Крысин М.Ю.,
2001,12,52-56.doi10.1002/1098-1071(2001)12:1<52::
Потапов А.Ю., Леденёва И.В. Кошелева Е.А.
AID-HC11>3.0.CO,2-0
ХГС. 2019, 55, 748-754. [Kovygin Yu.A., Shikha-
liev Kh.S., Krysin M.Yu., Potapov A.Yu., Ledenyo-
12.
Gangjee A., Adaira O., Queener S.F. Bioorg. Med.
va I.V., Kosheleva Ye.A., Vandyshev D.Yu. Chem.
Chem.
2001,
9,
2929-2935. doi
10.1016/S0968-
Heterocycl. Compd. 2019, 55, 748-754.] doi 10.1007/
0896(01)00223-1
s10593-019-02530-5
13.
Ibrahim D.A., Ismail N.S.M. Eur. J. Med. Chem. 2011,
27.
Вандышев Д.Ю., Шихалиев Х.С., Коконова А.В.,
46, 5825-5832. doi 10.1016/j.ejmech.2011.09.041
Потапов А.Ю., Колпакова М.Г., Сабынин А.Л.,
14.
Chebanov V.A., Saraev V.E., Gura E.A., Desenko S.M.,
Зубков Ф.И. ХГС.
2016,
52,
493-497.
[Vandy-
Musatov V.I. Collect. Czech. Chem. Commun. 2005,
shev, D.Y., Shikhaliev, K.S., Kokonova, A.V, Pota-
70, 350-360. doi 10.1135/cccc20050350
pov A.Yu., Kolpakova M.G., Sabynin A.L. Zub-
15.
Hassan N.A., Hegab M.I., Hashem A.I., Abdel-
kov F.I. Chem Heterocycl. Compd. 2016, 52, 493-497.]
Motti F.M., Hebah S.H.A., Abdel-Megeid F.M.E.
doi 10.1007/s10593-016-1914-7
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1336
ШМОЙЛОВА и др.
Efficient Synthesis of Pyrido[2,3-d]pyrimidines Based
on N-Arylitaconimides Recyclization
with Aminopyrimidinones
Y. U. Shmoylova, Yu. A. Kovygin, D. Yu. Vandyshev, I. V. Ledeneva,
E. A. Kosheleva, and Kh. S. Shikhaliev*
Voronezh State University, 394018, Russia, Voronezh, Universitetskaya pl. 1
*e-mail: chocd261@chem.vsu.ru
Received February 16, 2020; revised February 22, 2020; accepted February 28, 2020
A novice handy way of 2-(4,7-dioxo pyrido[2,3-d]pyrimidine-6-yl)acetanilide and 2-(2,4,7-trioxopyrido[2,3-d]-
pyrimidine-6-yl)acetanilides synthesis based on the interaction of N-arylitaconimides with 6-aminopyrimi-
dine-4-ones and with 6-aminopyrimidine-2,4-diones in boiling acetic acid was offered.
Keywords: cascade reactions, arylitaconimides, aminopyrimidinones, aminouracils, pyrido[2,3-d]pyrimidines,
recyclization
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020