ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 9, с. 1337-1343
УДК 547.789.61
БЕНЗАЗОЛЫ. III.1 СИНТЕЗ И ТРАНСФОРМАЦИЯ
6-ХЛОРСУЛЬФОНИЛБЕНЗОТИАЗОЛИН-2-ОНОВ
© 2020 г. Д. А. Душамовa, *, Ю. Р. Тахировa, Р. Ш. Курязовa, Н. С. Мухамедовb
a Ургенчский государственный университет, 220100, Республика Узбекистан, г. Ургенч, ул. Х. Алимджана 14
*e-mail: dilshod.d71@mail.ru
b Институт химии растительных веществ им. академика С.Ю. Юнусова, АН Республики Узбекистан,
100170, Республика Узбекистан, г. Ташкент, ул. Улугбека 77
Поступила в редакцию 18 мая 2020 г.
После доработки 01 июня 2020 г.
Принята к публикации 09 июня 2020 г.
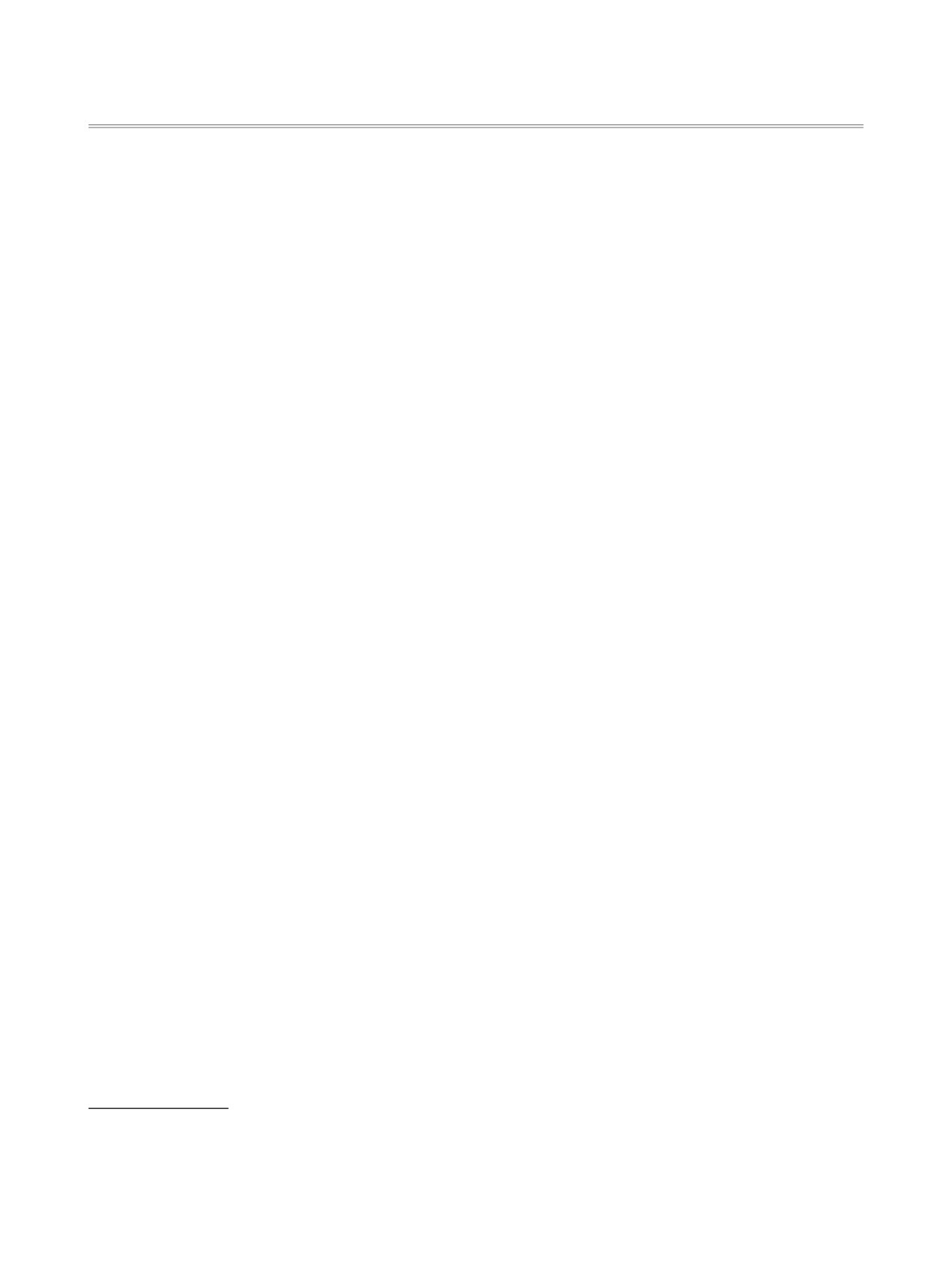
Из бензотиазолин-2-она и его 3-метилзамещенного обработкой хлорсульфоновой кислотой синтезиро-
ваны соответствующие 6-хлорсульфонилпроизводные. Воздействием на полученные соединения воды,
спиртов и других нуклеофильных агентов (алифатических и гетероциклических аминов) получены
2-оксобензотиазолин-6-сульфокислоты, их эфиры и амиды.
Ключевые слова: амиды 2-оксобензотиазолин-6-сульфокислот, эфиры 2-оксобензотиазолин-6-сульфо-
кислот, 2-оксобензотиазолин-6-сульфокислоты, 6-хлорсульфонилбензотиазолин-2-оны, электрофильное
замещение, нуклеофильное замещение.
DOI: 10.31857/S0514749220090037
Высокая биологическая активность и широкий
5-кратного избытка ХСК, - 83 и 87% соответствен-
спектр действия производных бензотиазола обу-
но (cхема 1).
славливает к ним большой интерес [2-5]. Среди
Следует отметить, что промежуточно образу-
них известны вещества, обладающие фунгицид-
ющиеся
2-оксобензотиазолин-6-сульфокислоты
ной [2], гербицидной [3], рострегулирующей [4] и
3а, b выделить не удается. Вероятно, это связано
дефолиирующей [5] активностью.
с легкостью нуклеофильного замещения гидрок-
В продолжение исследований по электрофиль-
сильной группы на атом хлора ХСК из-за повы-
ному замещению в ряду азотсодержащих гете-
шенного положительного заряда атома серы суль-
роциклических соединений [6-11], в настоящей
фогруппы.
работе изучены хлорсульфонилирование бензоти-
Сульфокислоты 3а, b получены с высокими
азолин-2-она 1а и его 3-метилзамещенного 1b, а
выходами гидролизом соединений 2а, b соответ-
также некоторые химические превращения полу-
ственно. В свою очередь сульфокислоты 3а, b при
ченных продуктов, позволяющие синтезировать
взаимодействии с ХСК гладко превращаются с
ряд новых производных соединений 1a, b.
почти количественными выходами в их хлорсуль-
При взаимодействии бензотиазолин-2-онов
фонилпроизводные 2а, b (cхема 1).
1а, b с хлорсульфоновой кислотой (ХСК) вне за-
Реакции соединений 2а, b с алифатически-
висимости от соотношения реагентов образуются
ми (диэтил- и н-дибутиламин) и гетероцикли-
соответствующие
6-хлорсульфонилбензотиазо-
ческими (пиперидин и морфолин) аминами при
лин-2-оны 2а, b. Наиболее высокие выходы соеди-
нений 2а, b были достигнуты при использовании
комнатной температуре легко протекают в аце-
тоне в присутствии триэтиламина и приводят к
1 Сообщение II см. [1].
соответствующим N,N-диалкиламидам
2-оксо-
1337
1338
ДУШАМОВ и др.
Схема 1.
R
R
N
N
O
O
O
HO
S
S
S
O
1a, b
3a, b
ClSO3H
R
50-60°C,
H2O
N
1 ч, 96-98%
ClSO3H
O
O
50-60°C, 2 ч,
Cl
S
100°C, 2 ч,
83-87%
S
91-92%
O
2a, b
1-3, R = H (a), R = Me (b).
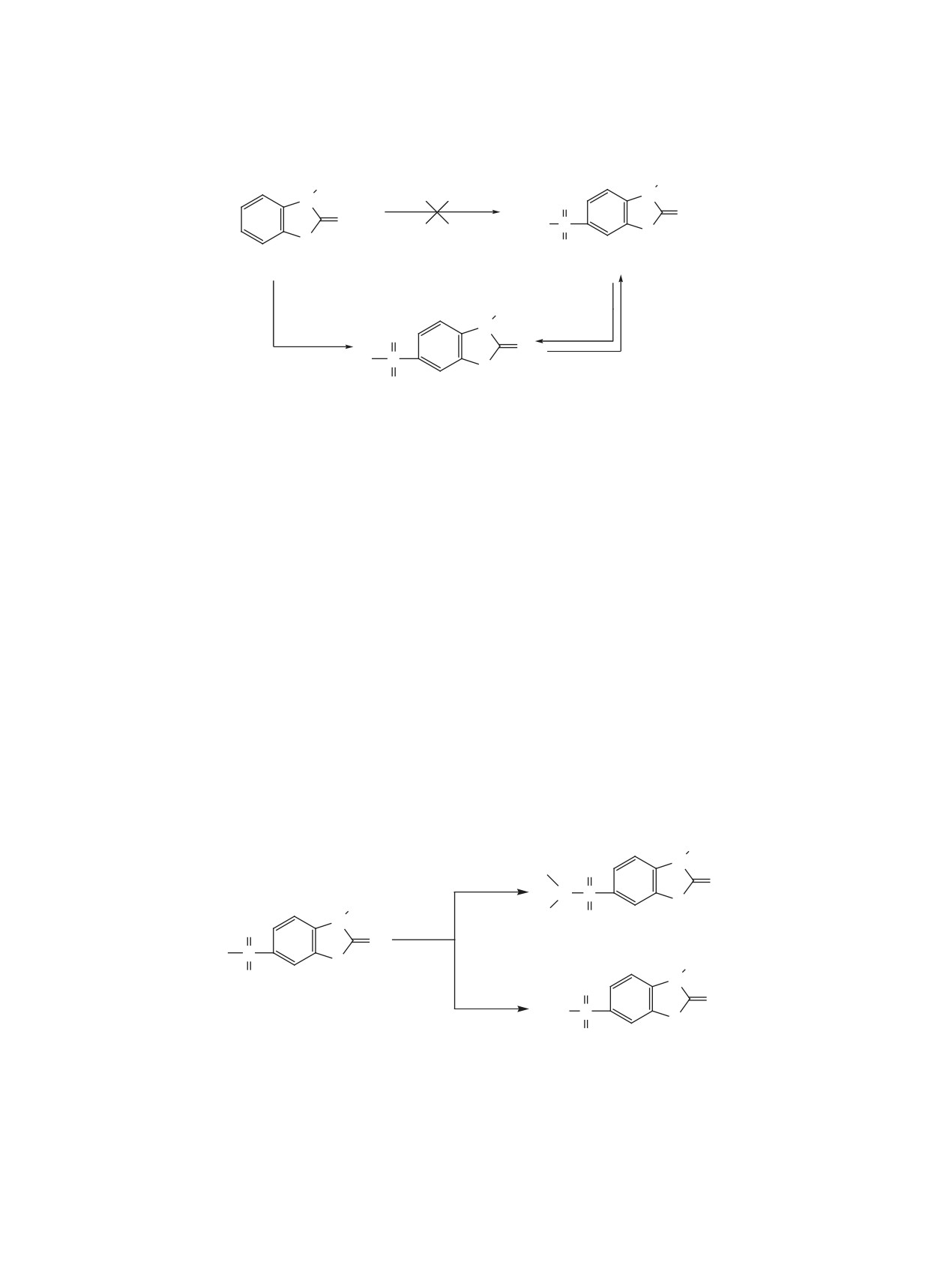
бензотиазолин-6-сульфокислот 4а-d, а также к
(1055-1215 см-1) колебаний групп SO2, а также
N-пиперидидам и N-морфолидам 2-оксобензотиа-
полосы поглощения валентных колебаний групп
золин-6-сульфокислот 4e-h с высокими выходами
C-S (709-756 см-1). Для сульфокислот 3a, b, наря-
(cхема 2).
ду с последними, наблюдаются также полосы по-
глощения валентных колебаний групп S-O (645-
Реакция сульфохлоридов 2а, b с метанолом и
655 см-1). Характерными также для соединений
этанолом приводит к образованию соответствую-
2-5 являются полосы поглощения неплоских де-
щих эфиров 2-оксобензотиазолин-6-сульфокислот
формационных колебаний групп СH 1,2,4-триза-
5а-d (cхема 2).
мещенного бензольного кольца (805-825 и 870-
Состав и строение синтезированных соеди-
880 см-1).
нений 2-5 подтверждено данными ИК, ЯМР 1H
В масс-спектрах соединений 2-5 имеются пики
спектроскопии, масс-спектрометрии и результата-
молекулярных ионов и фрагментов, которые пол-
ми элементного анализа.
ностью подтверждают предложенные структуры.
В ИК спектрах соединений 2-5 характерными
На первых этапах фрагментации в сульфохлориде
являются полосы поглощения валентных асим-
2а происходит разрыв связи S-Cl с образованием
метрических (1220-1409 см-1) и симметрических
фрагмента с m/z 214, а в случае его метильного
Схема 2.
R
N
R1
O
R1NHR1
O
N
S
R
S
R1
O
N
O
Ацетон
O
4a-h, 64-82%
20°С, 2 ч
Cl
S
S
R
O
N
O
2a, b
R2OH
O
R2O
S
S
O
5a-d, 64-68%
2, R = H (a), R = Me (b); 4, R = H (a, b, e, f), R = Me (c, d, g, h); R1 = Et (a, c), R1 = n-Bu (b, d);
R1 + R1 = (CH2)5 (e, g); R1 + R1 = (CH2)2O(CH2)2 (f, h);
5, R = H (a, b), R = Me (c, d), R2 = Me (a, c), R2 = Et (b, d).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
БЕНЗАЗОЛЫ. III.
СИНТЕЗ И ТРАНСФОРМАЦИЯ 6-ХЛОРСУЛЬФОНИЛБЕНЗОТИАЗОЛИН-2-ОНОВ
1339
+
H
N
O
O
+ Cl
S
S
+
R
O
N
m/z 214
O
O
N+
Cl
S
O
S
O
+ R
O
Cl
S
S
2a, b
O
m/z 248
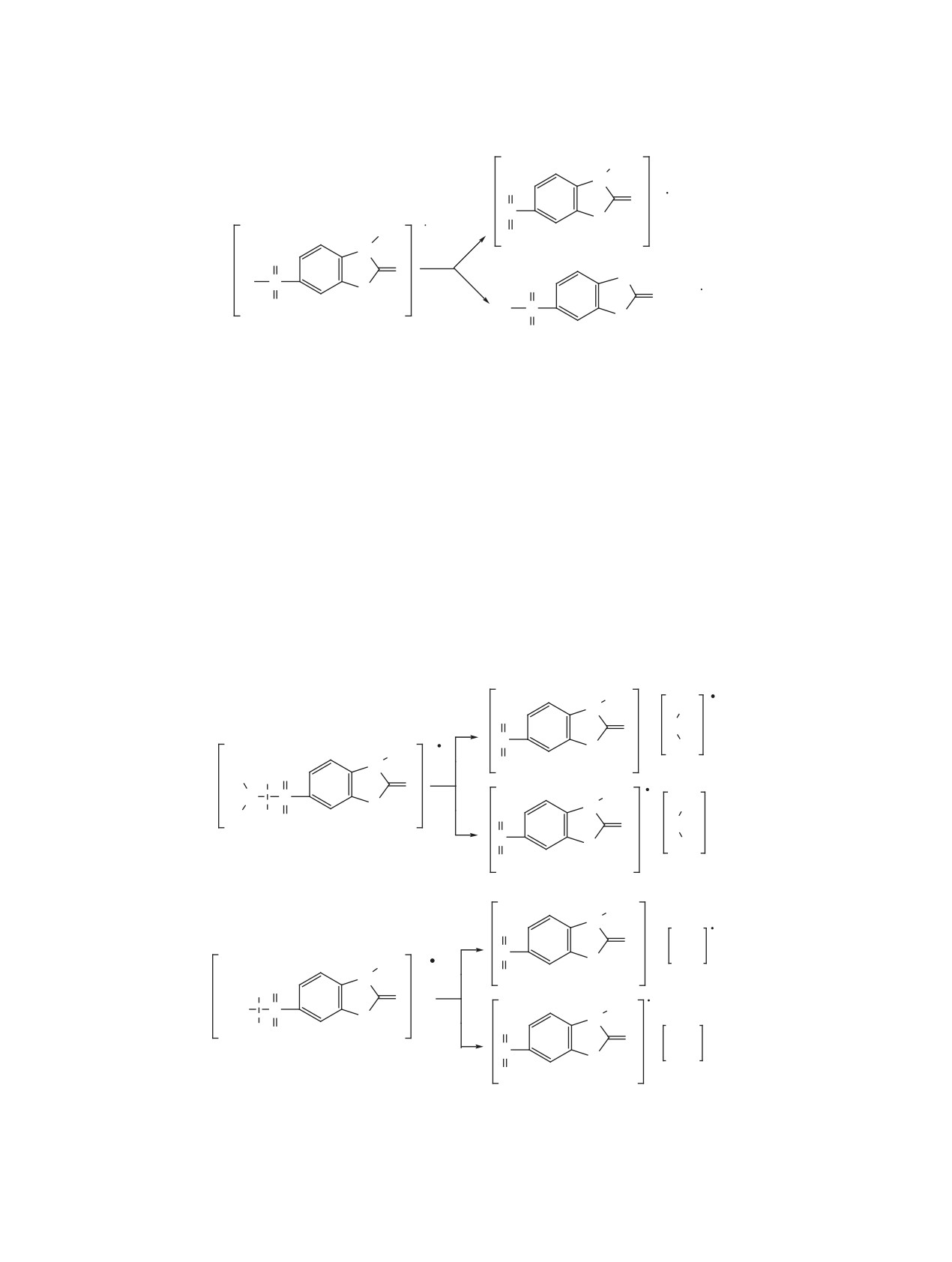
Рис. 1. Фрагментация сульфохлоридов бензотиазолин-2-онов 2а и 2b.
производного 2b отщепляется метильная группа с
7.59-7.79 м.д. (J5,4 8.4-8.9 Гц, J5,7 1.6-1.9 Гц),
возникновением фрагмента с m/z 248 (рис. 1).
а также дублет Н7 при 7.76-7.95 м.д. (J7,5 1.6-
1.9 Гц). Протоны групп NH проявляются в слабом
Масс-спектры эфиров и сульфамидов 4, 5, не-
поле (9.17-9.31 м.д.), а протоны алкильных групп
зависимо от природы заместителя R, а также от
амидной и алкоксильной части - в сильном поле
характера замещения алкокси- и аминогруппы, по-
(0.77-3.73 м.д.).
казывают однотипную фрагментацию с образова-
нием фрагментов А и В с разрывом связей SO2-OR
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
или SO2-N(R1)2 (рис. 2).
ИК спектры записаны на Фурье-спектрометре
В спектрах ЯМР 1H соединений 2-5 имеются
фирмы Perkin-Elmer (США) модели 2000 в таблет-
характерные сигналы протонов бензотиазоли-
ках KBr. Спектры ЯМР 1H сняты на спектрометре
нонового фрагмента: дублет H4 в области 7.02-
UNITY 400+ (США) (400 МГц) в ДМСО, внутрен-
7.21 м.д. (J4,5 8.4-8.9 Гц), дублет дублетов Н5 при
ний стандарт ТМС. Масс-спектры зарегистриро-
+
R
N
R1
O
O
N
+
S
+
S
R1
R
N
O
O
A
B
R1
O
N
S
R
+
S
N
R1
O
R1
O
+
O
N
S
4a-h
S
R1
O
A
B
+
R
N
O
O
+
OR2
S
R
+
S
N
O
O
A
B
O
R2O
S
R
S
N
O
+
O
O
+
OR2
5a-d
S
S
O
A
B
Рис. 2. Фрагментация эфиров и сульфамидов 2-оксобензотиазолин-6-сульфокислот и 3-метил-2-оксобензотиазолин-6-суль-
фокислот 4a-h, 5a-d.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1340
ДУШАМОВ и др.
ваны на приборе Kratos MS-30 (Англия) с непо-
H4, J 8.4 Гц), 7.77 д.д (1H, H5, J 1.6, 8.4 Гц), 7.93 д
средственным вводом образца в источник ионов
(1H, H7, J 1.6 Гц). Масс-спектр, m/z (Iотн, %): 263
(энергия ионизации 70 эВ). Элементный анализ
(81) [M]+ (для 35Сl). Найдено, %: C 36.27; H 2.19;
выполнен на автоматическом СНNS-анализаторе
N 5.12; S 24.14. C8H6ClNO3S2. Вычислено, %: C
EuroVector EA-3000 (Италия). Температуру плав-
36.43; H 2.27; N 5.31; S 24.29.
ления синтезированных веществ определяли на
2-Оксобензотиазолин-6-сульфокислота
(3а)
приборе «Boetius» (Германия) и «MEL-TEMP»
и 3-метил-2-оксобензотиазолин-6-сульфокисло-
(США). Контроль за ходом реакций и индиви-
та (3b) (общая методика). Смесь 10 ммоль соеди-
дуальностью синтезированных соединений осу-
нения 2 и 20 мл воды кипятили 2 ч, растворитель
ществляли методом ТСХ на пластинках Silufol
частично отгоняли, осадок продукта 3 отфильтро-
UV-254 в системе растворителей бензол-ацетон,
вывали и перекристаллизовывали из воды.
10:1, проявление в УФ-свете и парах иода.
Сульфокислоты 3а, b обрабатывали хлорсуль-
Исходный бензотиазолин-2-он
(1а) синтези-
фоновой кислотой по методике б и получали сое-
рован окислением бензотиазолин-2-тиона с пер-
динения 2а, b.
манганатом калия, а 3-метилбензотиазолин-2-он
(1b) - метилированием соединения 1а диметил-
б. К 2.33 г (20 ммоль) хлорсульфоновой кис-
сульфатом в условиях межфазного катализа.
лоты, охлажденной до 0°С, порциями добавляли
10 ммоль сульфокислоты 3 с такой скоростью,
6-Xлорсульфонилбензотиазолин-2-он (2а) и
чтобы температура реакционной массы не превы-
3-метил-6-хлорсульфонилбензотиазолин-2-он
шала 10°С. Смесь нагревали до 50-60°С, выдер-
(2b). а. К 5.83 г (50 ммоль) хлорсульфоновой кис-
живали при этой температуре 1 ч и выливали в
лоты, охлажденной до 5-10°С, порциями добавля-
измельченный лед. Полученный осадок продукта
ли 10 ммоль бензотиазолина 1а или 1b при пере-
2 отфильтровывали, промывали водой и перекри-
мешивании с такой скоростью, чтобы температура
сталлизовывали. Выходы продуктов 2а, b - 96 и
реакционной массы не превышала 15°С. Далее
98% соответственно. Образцы соединений 2а, b,
реакционную смесь нагревали до 50-60°С, выдер-
полученные по методикам а и б, идентичны (от-
живали при этой температуре в течение 2 ч и вы-
сутствие депрессии температуры плавления сме-
ливали в измельченный лед. Полученный осадок
шанной пробы).
продукта 2 отфильтровывали, промывали водой и
перекристаллизовывали.
2-Оксобензотиазолин-6-сульфокислота (3а).
Выход 2.10 г (91%), бесцветные кристаллы, т.пл.
Соединения 2а, b получали также из сульфо-
238-240°С (вода). ИК спектр, ν, см-1: 1220 с
кислот 3a, b по методике б (см. ниже).
(νasSO2), 1055 с (νsSO2), 745 с (С-S), 645 с (С-О).
6-Xлорсульфонилбензотиазолин-2-он
(2а).
Спектр ЯМР 1H, δ, м.д.: 7.04 д (1H, H4, J 8.5 Гц),
Выход 2.07 г (83%), бесцветные кристаллы, т.пл.
7.68 д.д (1H, H5, J 1.6, 8.5 Гц), 7.82 д (1H, H7, J
168-170°С (гептан). ИК спектр, ν, см-1: 1365 с
1.6 Гц), 9.27 с (1H, NH). Масс-спектр, m/z (Iотн, %):
(νasSO2), 1175 с (νsSO2), 725 с (С-S). Спектр ЯМР
231 (38) [M]+. Найдено, %: C 36.15; H 2.11; N 5.83;
1H, δ, м. д.: 7.14 д (1H, H4, J 8.4 Гц), 7.79 д.д (1H,
S 27.58. C7H5NO4S2. Вычислено, %: C 36.36; H
H5, J 1.6, 8.4 Гц), 7.95 д (1H, H7, J 1.6 Гц), 9.31 с
2.16; N 6.06; S 27.70.
(1H, NH). Масс-спектр, m/z (Iотн, %): 249 (81) [M]+
3-Метил-2-оксобензотиазолин-6-сульфо-
(для 35Сl). Найдено, %: C 33.43; H 1.58; N 5.83; S
кислота (3b). Выход 2.25 г (92 %), бесцветные
25.52. C7H4ClNO3S2. Вычислено, %: C 33.66; H
кристаллы, т.пл. 228-230°С (вода). ИК-спектр,
1.60; N 5.61; S 25.65.
ν, см-1: 1230 с (νasSO2), 1070 с (νsSO2), 757 с
3-Метил-6-хлорсульфонилбензотиазолин-2-
(С-S), 655 с (С-О). Спектр ЯМР 1H, δ, м.д.: 3.40
он (2b). Выход 2.29 г (87%), бесцветные кристал-
с (3H, 3-CH3), 7.09 д (1H, H4, J 8.6 Гц), 7.68 д.д
лы, т.пл. 151-152°С (бензол). ИК спектр, ν, см-1:
(1H, H5, J 1.7, 8.6 Гц), 7.83 д (1H, H7, J 1.7 Гц).
1370 с (νasSO2), 1181 с (νsSO2), 730 с (С-S). Спектр
Масс-спектр, m/z (Iотн, %): 245 (41) [M]+. Найдено,
ЯМР 1H, δ, м.д.: 3.41 с (3H, 3-CH3), 7.21 д (1H,
%: C 39.06; H 2.78; N 5.82; S 25.88. C8H7NO4S2.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
БЕНЗАЗОЛЫ. III.
СИНТЕЗ И ТРАНСФОРМАЦИЯ 6-ХЛОРСУЛЬФОНИЛБЕНЗОТИАЗОЛИН-2-ОНОВ
1341
Вычислено,
%: C
39.18; H
2.86; N
6.06; S
[6H, N(CH2CH3)2, J 7.2 Гц], 2.53 к [4H, N(CH2CH3)2,
26.12.
J 7.2 Гц], 7.02 д (1H, H4, J 8.6 Гц), 7.69 д.д (1H, H5,
J 1.8, 8.6 Гц), 7.85 д (1H, H7, J 1.8 Гц). Масс-спектр,
N,N-Диэтил- и N,N-дибутиламиды
2-ок-
m/z (Iотн, %): 300 (36) [M]+. Найдено, %: C 47.72; H
собензотиазолин-6-сульфокислоты 4а, b и 3-
5.15; N 9.61; S 21.21. C12H16N2O3S2. Вычислено,
метил-2-оксобензотиазолин-6-сульфокислоты
%: C 47.99; H 5.33; N 9.33, S 21.33.
(4c, d), N-пиперидино- и N-морфолиноамиды
2-оксобензотиазолин-6-сульфокислоты 4e, g и
N,N-Дибутиламид
3-метил-2-оксобензотиа-
3-метил-2-оксобензотиазолин-6-сульфокисло-
золин-6-сульфокислоты
(4d). Выход
2.35 г
ты (4f, h) (общая методика). К раствору 10 ммоль
(66%), бесцветные кристаллы, т.пл. 91-92°С (во-
соединения 2 в 20 мл ацетона добавляли по каплям
дный этанол). ИК спектр, ν, см-1: 1348 с (νasSO2),
10 ммоль диэтил- или дибутиламина, пиперидина
1164 с (νsSO2), 741 с (С-S). Спектр ЯМР 1H, δ,
или морфолина и 1.01 г (10 ммоль) триэтиламина в
м.д.: 0.77-0.87 м [6H, N(C3H6CH3)2], 1.38-1.46
10 мл ацетона. Реакционную массу перемешивали
м
[4H, N(C2H4CH2CH3)2],
1.57-1.64 м
[4H,
при комнатной температуре в течение 2 ч, затем
N(CH2CH2C2H5)2], 3.11-3.21 м [4H, N(CH2С3H7)2],
ацетон отгоняли, к остатку добавляли 100 мл воды.
3.39 с (3H, 3-CH3), 7.05 д (1H, H4, J 8.7 Гц), 7.69
Полученный осадок продукта 4 отфильтровывали
д.д (1H, H5, J 1.7, 8.7 Гц), 7.87 д (1H, H7, J 1.7 Гц).
и перекристаллизовывали.
Масс-спектр, m/z (Iотн, %): 356 (28) [M]+. Найдено,
%: C 53.77; H 6.66; N 8.15; S 17.76. C16H24N2O3S2.
N,N-Диэтиламид
2-оксобензотиазолин-6-
Вычислено, %: C 53.93; H 6.74; N 7.86; S 17.97.
сульфокислоты (4а). Выход 1.86 г (65%), бес-
цветные кристаллы, т.пл. 150-152°С (этанол). ИК
N-Пиперидиноамид
2-оксобензотиазолин-
спектр, ν, см-1: 1347 с (νasSO2), 1175 с (νsSO2),
6-сульфокислоты (4e). Выход 2.11 г (71%), бес-
746 с (С-S). Спектр ЯМР 1H, δ, м.д.: 1.05 т [6H,
цветные кристаллы, т.пл. 211-213°С (этанол). ИК
N(CH2CH3)2, J 7.2 Гц], 2.47 к [4H, N(CH2CH3)2, J
спектр, ν, см-1: 1343 с (νasSO2), 1166 с (νsSO2),
7.2 Гц], 7.09 д (1H, H4, J 8.9 Гц), 7.75 д.д (1H, H5, J
745 с (С-S). Спектр ЯМР 1H, δ, м.д.: 2.44-2.49 м
1.8, 8.9 Гц), 7.92 д (1H, H7, J 1.8 Гц), 9.21 с (1H, NH).
[2H, N(С2Н4)2CH2], 2.86 к [4H, N(СН2СН2)2СН2, J
Масс-спектр, m/z (Iотн, %): 286 (29) [M]+. Найдено,
6.9 Гц], 3.61 к [4H, N(CH2СН2)2СН2, J 6.9 Гц], 7.04
%: C 45.87; H 4.78; N 10.01; S 22.22. C11H14N2O3S2.
д (1H, H4, J 8.9 Гц), 7.65 д.д (1H, H5, J 1.8, 8.9 Гц),
Вычислено, %: C 46.15; H 4.89; N 9.79; S 22.37.
7.79 д (1H, H7, J 1.8 Гц), 9.18 с (1H, NH). Масс-
спектр, m/z (Iотн, %): 298 (100) [M]+. Найдено, %:
N,N-Дибутиламид
2-оксобензотиазолин-6-
C 48.09; H 4.57; N 9.09; S 21.22. C12H14N2O3S2.
сульфокислоты (4b). Выход 2.29 г (67%), бес-
Вычислено, %: C 48.32; H 4.69; N 9.39; S 21.47.
цветные кристаллы, т.пл. 95-97°С (этанол). ИК
спектр, ν, см-1: 1354 с (νasSO2), 1164 с (νsSO2), 734
N-Морфолиноамид
2-оксобензотиазолин-6-
с (С-S). Спектр ЯМР 1H, δ, м.д.: 0.83-0.91 м [6H,
сульфокислоты (4f). Выход 2.07 г (69%), бес-
N(C3H6CH3)2], 1.12-1.16 м [4H, N(C2H4CH2CH3)2],
цветные кристаллы, т.пл. 213-215°С (этанол). ИК
1.38-1.46 м [4H, N(CH2CH2C2H5)2], 3.11-3.21 м
спектр, ν, см-1: 1345 с (νasSO2), 1169 с (νsSO2), 749 с
[4H, N(CH2С3H7)2], 7.14 д (1H, H4, J 8.9 Гц), 7.73
(С-S). Спектр ЯМР 1H, δ, м.д.: 2.87 т [4H, О(СН2)2,
д.д (1H, H5, J 1.8, 8.9 Гц), 7.89 д (1H, H7, J 1.8 Гц),
J 7.9 Гц], 3.60 т [4H, N(СН2)2, J 7.9 Гц], 7.07 д (1H,
9.19 с (1H, NH). Масс-спектр, m/z (Iотн, %): 342 (32)
H4, J 8.8 Гц), 7.68 д.д (1H, H5, J 1.8, 8.8 Гц), 7.81
[M]+. Найдено, %: C 52.37; H 6.29; N 7.99; S 18.52.
д (1H, H7, J 1.8 Гц), 9.17 с (1H, NH). Масс-спектр,
C15H22N2O3S2. Вычислено, %: C 52.63; H 6.43; N
m/z (Iотн, %): 300 (56) [M]+. Найдено, %: C 43.87; H
8.18; S 18.71.
3.87; N 9.61; S 21.14. C11H12N2O4S2. Вычислено,
%: C 44.00; H 3.99; N 9.33; S 21.33.
N,N-Диэтиламид 3-метил-2-оксобензотиазо-
лин-6-сульфокислоты (4c). Выход 2.46 г (82%),
N-Пиперидиноамид 3-метил-2-оксобензотиа-
бесцветные кристаллы, т.пл. 136-138°С (водный
золин-6-сульфокислоты (4g). Выход 2.09 г (67%),
этанол). ИК спектр, ν, см-1: 1353 с (νasSO2), 1167 с
бесцветные кристаллы, т.пл.
201-203°С (вод-
(νsSO2), 756 с (С-S). Спектр ЯМР 1H, δ, м.д.: 1.08 т
ный этанол). ИК спектр, ν, см-1: 1346 с (νasSO2),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1342
ДУШАМОВ и др.
1166 с (νsSO2), 747 с (С-S). Спектр ЯМР 1H, δ,
цветные кристаллы, т.пл. 156-158°С (этанол). ИК
м.д.: 2.46-2.51 м [2H, N(С2Н4)2CH2], 2.85 т [4H,
спектр, ν, см-1: 1409 с (νasSO2), 1196 с (νsSO2),
N(СН2СН2)2СН2, J 6.9 Гц], 3.39 с (3H, 3-CH3), 3.61
714 с (С-S). Спектр ЯМР 1H, δ, м.д.: 3.68 т (3H,
т [4H, N(CH2СН2)2СН2, J 6.9 Гц], 7.06 д (1H, H4, J
OCH2CH3, J 7.1 Гц), 4.06 к (2H, OCH2, J 7.1 Гц),
8.9 Гц), 7.71 д.д (1H, H5, J 1.7, 8.6 Гц), 7.79 д (1H,
7.03 д (1H, H4, J 8.8 Гц), 7.64 д.д (1H, H5, J 1.9,
H7, J 1.7 Гц). Масс-спектр, m/z (Iотн, %): 312 (100)
8.8 Гц), 7.76 д (1H, H7, J 1.9 Гц), 9.19 с (1H, NH).
[M]+. Найдено, %: C 49.81; H 5.02; N 9.15; S 20.28.
Масс-спектр, m/z (Iотн, %): 259 (51) [M]+. Найдено,
C13H16N2O3S2. Вычислено, %: C 50.02; H 5.13; N
%: C 41.42; H 3.39; N 5.26; S 24.49. C9H9NO4S2.
8.97; S 20.51.
Вычислено, %: C 41.69; H 3.47; N 5.40; S 24.71.
N-Морфолиноамид 3-метил-2-оксобензотиа-
Метиловый эфир 3-метил-2-оксобензотиазо-
золин-6-сульфокислоты (4h). Выход 2.01 г (64%),
лин-6-сульфоновой кислоты (5c). Выход 1.65 г
бесцветные кристаллы, т.пл. 227-229 °С (водный
(64%), бесцветные кристаллы, т.пл. 142-144°С (вод-
этанол). ИК спектр, ν, см-1: 1353 с (νsSO2), 1152 с
ный этанол). ИК спектр, ν, см-1: 1402 с (νasSO2),
(νsSO2), 753 с (С-S). Спектр ЯМР 1H, δ, м.д.: 2.86
1215 с (νasSO2), 718 с (С-S). Спектр ЯМР 1H, δ,
т [4H, О(СН2)2, J 8.0 Гц], 3.39 с (3H, 3-CH3), 3.59
м.д.: 3.46 с (3H, 3-CH3), 3.71 с (3H, OCH3), 7.09 д
т [4H, N(СН2)2, J 8.0 Гц], 7.04 д (1H, H4, J 8.6 Гц),
(1H, H4, J 8.7 Гц), 7.59 д.д (1H, H5, J 1.7, 8.7 Гц),
7.65 д.д (1H, H5, J 1.8, 8.6 Гц), 7.76 д (1H, H7, J
7.76 д (1H, H7, J 1.7 Гц). Масс-спектр, m/z (Iотн, %):
1.8 Гц). Масс-спектр, m/z (Iотн, %): 314 (47) [M]+.
259 (29) [M]+. Найдено, %: C 41.39; H 3.35; N 5.56;
Найдено, %: C 45.57; H 4.33; N 8.65; S 20.12.
S 24.38. C9H9NO4S2. Вычислено, %: C 41.69; H
C12H14N2O4S2. Вычислено, %: C 45.85; H 4.45; N
3.47; N 5.40; S 24.71.
8.91; S 20.38.
Этиловый эфир 3-метил-2-оксобензотиазо-
лин-6-сульфоновой кислоты (5d). Выход 1.80 г
Метиловые и этиловые эфиры 2-оксобен-
зотиазолин-6-сульфоновой кислоты
5a, b и
(66%), бесцветные кристаллы, т.пл. 129-131°С
(водный этанол). ИК спектр, ν, см-1: 1405 с
3-метил-2-оксобензотиазолин-6-сульфоновой
кислоты 5c, d (общая методика). К раствору
(νasSO2), 1207 с (νsSO2), 716 с (С-S). Спектр ЯМР
1H, δ, м.д.: 3.45 с (3H, 3-CH3). 3.70 т (3H, OCH2CH3,
10 ммоль соединения 2 в 20 мл ацетона добавляли
J 7.1 Гц), 4.08 к (2H, OCH2, J 7.1), 7.08 д (1H, H4, J
по каплям смесь 10 ммоль метанола или этанола и
8.9 Гц), 7.62 д.д (1H, H5, J 1.8, 8.9 Гц), 7.81 д (1H,
1.01 г (10 ммоль) триэтиламина в 10 мл ацетона.
H7, J 1.8 Гц). Масс-спектр, m/z (Iотн, %): 273 (32)
Реакционную массу перемешивали при комнатной
[M]+. Найдено, %: C 43.77; H 3.94; N 4.88; S 23.25.
температуре в течение 2 ч, затем ацетон отгоняли,
C10H11NO4S2. Вычислено, %: C 43.95; H 4.03; N
к остатку добавляли 100 мл воды. Полученный
5.12; S 23.44.
осадок продукта 5 отфильтровывали и перекри-
сталлизовывали.
КОНФЛИКТ ИНТЕРЕСОВ
Метиловый эфир
2-оксобензотиазолин-6-
Авторы заявляют об отсутствии конфликта
сульфоновой кислоты
(5a). Выход
1.64 г
интересов.
(67%), бесцветные кристаллы, т.пл. 165-167°С
СПИСОК ЛИТЕРАТУРЫ
(этанол). ИК спектр, ν, см-1: 1417 с (νasSO2), 1205
с (νsSO2), 709 с (С-S). Спектр ЯМР 1H, δ, м.д.: 3.73
1. Кайпназаров Т.Н., Мухамедов Н.С., Окманов Р.Я.,
Бердимбетова Г.Е., Жонхожаева Ф.Б. ЖОрХ. 2013,
с (3H, OCH3), 7.05 д (1H, H4, J 8.7 Гц), 7.66 д.д
49, 1764-1767. [Kaipnazarov T.N., Mukhamedov N.S.,
(1H, H5, J 1.7, 8.7 Гц), 7.79 д (1H, H7, J 1.7 Гц),
Okmanov, R.Y., Berdimbetova G.Е., Zhonkhozhae-
9.18 с (1H, NH). Масс-спектр, m/z (Iотн, %): 245
va F.B. Russ. J. Org. Chem. 2013, 49, 1744-1747.] doi
(39) [M]+. Найдено, %: C 38.92; H 2.71; N 5.92; S
10.1134/S1070428013120063
25.88. C8H7NO4S2. Вычислено, %: C 39.18; H 2.85;
2. Graham H.P., Pomfret V.J. Пат. 137975 (1974). Вели-
N 5.71; S 26.12.
кобр. РЖХим. 1975, 23, O407.
Этиловый эфир 2-оксобензотиазолин-6-суль-
3. Баскаков Ю.А. Ж. Всесоюз. Хим. О-ва им. Д.И. Мен-
фоновой кислоты (5b). Выход 1.76 г (68%), бес-
делеева. 1984, 29, 22.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
БЕНЗАЗОЛЫ. III.
СИНТЕЗ И ТРАНСФОРМАЦИЯ 6-ХЛОРСУЛЬФОНИЛБЕНЗОТИАЗОЛИН-2-ОНОВ
1343
4. Dаmico J.J., Моrvеll J.T. Пат. 4283220 (1981). США.
2002, 503-506. [Mukhamedov N.S., Dushamov D.A.,
РЖХим. 1982, 8, O410.
Aliyev N.A., Bobokulov Kh.M., Levkovich M.G.,
5. Рожкова Н.К. Тезисы докладов «Материалы I Все-
Abdullaev N.D. Chem. Heterocycl. Compd. 2002, 38,
союзное совещание по дефолиации и десикации
438-441.] doi 10.1023/A:1016083322553
сельскохозяйственных культур». Ташкент, 1974, 35.
9. Жуманиязова М.Э., Якубов У.Х., Душамов Д.А.,
6. Душамов Д.А., Мухамедов Н.С., Бобокулов Х.М.,
Мухамедов Н.С., Жонхожаев Ф.Б., Алиев Н.А. Узб.
Алиев Н.А. ХПС. 2001, 83.
хим. ж. 2004, 3, 34-36.
7. Мухамедов Н.С., Душамов Д.А., Бобокулов Х.М.,
10. Тахиров Ю.Р., Душамов Д.А., Мухамедов Н.С., Ша-
Алиев Н.А., Левкович М.Г., Абдуллаев Н.Д. ХГС.
хидоятов Х.М. Химия и хим. технол. 2010, 1, 18-20.
2002, 385-389. [Mukhamedov N.S., Dushamov D.A.,
Aliyev N.A., Bobokulov Kh.M., Levkovich M.G.,
11. Каримова М.Э., Душамов Д.А., Курязов Р.Ш., Му-
Abdullaev N.D. Chem. Heterocycl. Compd. 2002, 38,
хамедов Н.С. ХГС. 2011, 117-123. [Karimova M.E.,
344-348.] doi 10.1023/A:1015647606680
Dushamov D.A., Kuryazov R.Sh., Mukhamedov N.S.
8. Душамов Д.А., Мухамедов Н.С., Бобокулов Х.М.,
Chem. Heterocycl. Compd. 2011, 47, 90-95.] doi
Алиев Н.А., Левкович М.Г., Абдуллаев Н.Д. ХГС.
10.1007/s10593-01-0724-1
Benzazoles: III. Synthesis and Transformation
of 6-Chlorosulfonylbenzothiazolin-2-ones
D. А. Dushamova, *, Y. R. Тakhirova, R. Sh. Kuryazova, and N. S. Mukhamedovb
a Urgench State University, 220100, Republic of Uzbekistan, Urgench, ul. H. Аlimdjana 14
*e-mail: dilshod.d71@mail.ru
b Institute of the Chemistry of Plant Substances named by academician S.Yu. Yunusov,
Academy of Sciences, 100170, Republic of Uzbekistan, Tashkent, ul. Ulugbeka 77
Received May 18, 2020; revised June 1, 2020; accepted June 9, 2020
The corresponding 6-chlorosulfonyl derivatives were synthesized from benzothiazolin-2-one and its 3-methyl-
substituted by treatment with chlorosulfonic acid. By the action of water, alcohols and other nucleophilic agents
(aliphatic and heterocyclic amines) on the obtained compounds, 2-oxobenzothiazoline-6-sulfonic acids, their
esters and amides are obtained.
Keywords: amides of 2-oxobenzothiazoline-6-sulfonic acids, esters of 2-oxobenzothiazoline-6-sulfonic acids,
2-oxobenzothiazoline-6-sulfonic acids, 6-chlorosulfonylbenzothiazolin-2-ones, electrophilic substitution,
nucleophilic substitution
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020