ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 9, с. 1402-1409
УДК 547.495
АМИНИРОВАНИЕ, АЦЕТАМИНИРОВАНИЕ
И АМИДИРОВАНИЕ ЗАМЕЩЕННЫХ
АРОМАТИЧЕСКИХ КАРБАМАТОВ
В ПОЛИФОСФОРНОЙ КИСЛОТЕ
© 2020 г. А. В. Великородовa, b, *, Э. Н. Кутлалиеваb, Н. Н. Степкинаa,
Е. А. Шустоваb, О. Ю. Поддубныйc
a ФГБОУ ВО «Астраханский государственный университет», 414000, Россия, г. Астрахань, пл. Шаумяна 1
*e-mail: avelikorodov@mail.ru
b ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России,
414000, Россия, г. Астрахань, ул. Бакинская 121
c ФГБОУ ВО «Армавирский государственный педагогический университет»,
352901, Россия, г. Армавир, ул. Р. Люксембург 159
Поступила в редакцию 05 мая 2020 г.
После доработки 15 мая 2020 г.
Принята к публикации 26 мая 2020 г.
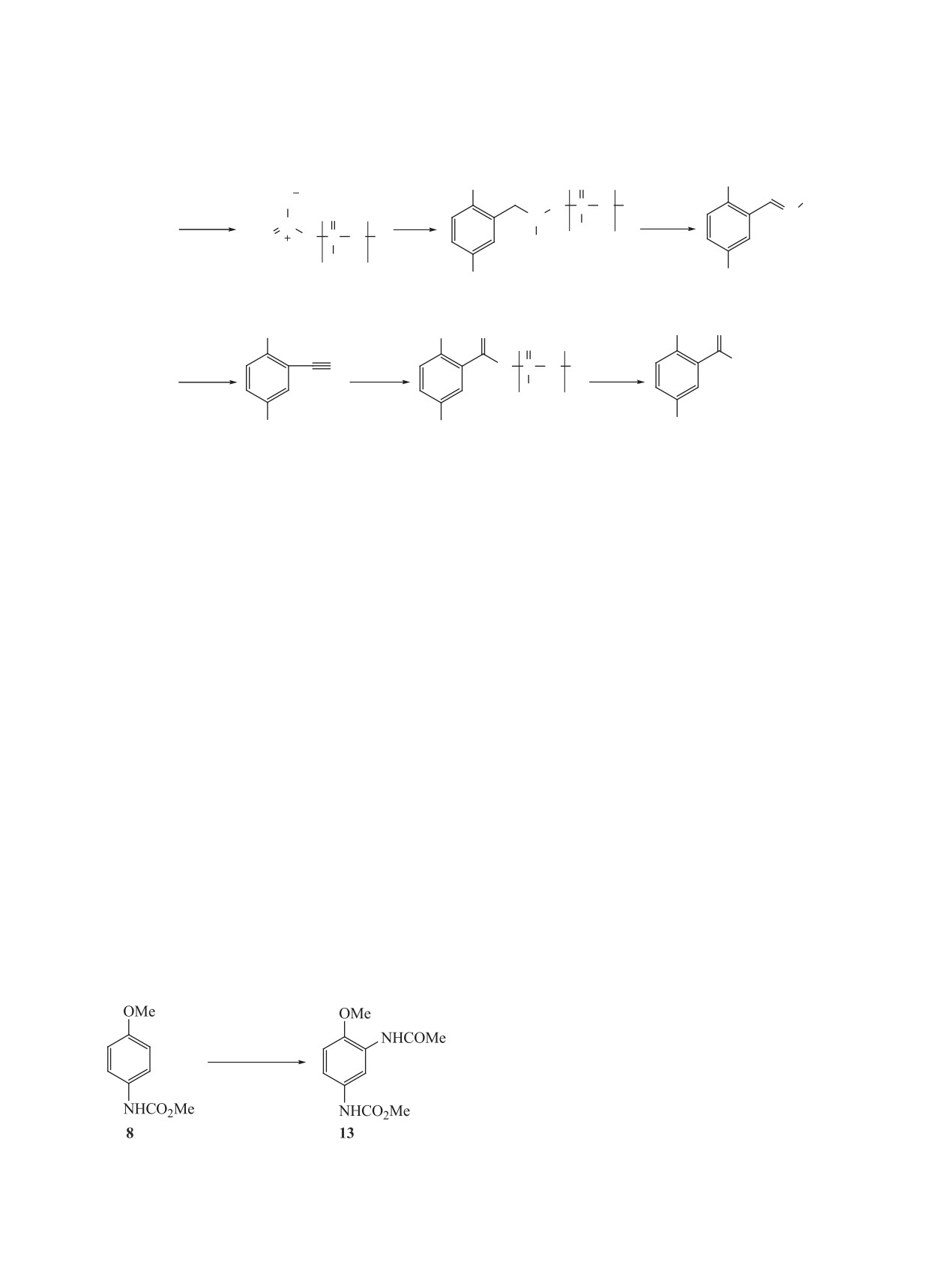
Электрофильное аминирование 2(3,4)-гидроксизамещенных метил-N-фенилкарбамата и метил-N-(4-ме-
токсифенил)карбамата азидом натрия в 86%-ной полифосфорной кислоте (PPA) при 55-60°С протекает
региоселективно в орто-положении к гидроксильной или метоксильной группе и приводит к получе-
нию метил-N-(3-амино-2-гидроксифенил)-, (4-амино-3-гидроксифенил)-, (3-амино-4-гидроксифенил)-,
(3-амино-4-метоксифенил)карбаматов соответственно. Взаимодействием метил-N-(4-метоксифенил)-
карбамата с нитрометаном и нитроэтаном в 80%-ной РРА при 95-110°С получены метил-N-[3-(аминокар-
бонил)-4-метоксифенил]карбамат и метил-N-[3-(ацетиламино)-4-метоксифенил]карбамат соответственно.
Взаимодействием 4-[(метоксикарбонил)амино]бензойной кислоты с избытком нитроэтана в 86%-ной РРА
при 125°С получен метил-N-(4-{[1-N-гидроксиэтанимидоил]амино}фенил)карбамат.
Ключевые слова: гидроксизамещенные метил-N-фенилкарбаматы, азид натрия, полифосфорная кислота,
электрофильное аминирование, метил-N-(3-амино-2-гидроксифенил)карбамат, метил-N-(4-амино-3-гид-
роксифенил)карбамат, метил-N-(3-амино-4-гидроксифенил)карбамат, метил-N-(3-амино-4-метоксифенил)-
карбамат, нитрометан, нитроэтан, ацетаминирование, метил-N-[3-(аминокарбонил)-4-метоксифенил]-
карбамат, метил-N-[3-(ацетиламино)-4-метоксифенил]карбамат, 4-[(метоксикарбонил)амино]бензойная
кислота, метил-N-{4-[(1-N-гидроксиэтанимидоил)амино]фенил}карбамат.
DOI: 10.31857/S0514749220090116
Полифосфорная кислота (PPA) нашла широкое
Ранее сообщалось об использовании системы
применение в органическом синтезе в качестве эф-
азид натрия-PPA для осуществления электрофиль-
фективного дегидратирующего и циклизующего
ного аминирования ряда ароматических и гетеро-
реагента [1-6].
ароматических соединений [7-9].
Эффективность PPA обусловлена возможно-
Нами была изучена возможность получения
стью варьирования в ней содержания P2O5, хоро-
аминопроизводных ароматических карбаматов
шей растворимостью органических соединений
посредством электрофильного аминирования ме-
различных типов, а также отсутствием заметного
тил-N-фенилкарбамата (1), а также его гидрокси-
окислительного действия.
замещенных производных 2-4, метил-N-(4-меток-
1402
АМИНИРОВАНИЕ, АЦЕТАМИНИРОВАНИЕ И АМИДИРОВАНИЕ
1403
Схема 1.
OH
OH
PPA-NaN3
NH2
NHCO2Me
NHCO2Me
2-4
8-10
сифенил)карбамата (5), метил-N-(4-нитрофенил)-
1 ч с 50 до 55°С и в течение последующего часа с
карбамата
(6) и метил-N-(пиридин-2-ил)карба-
55 до 60°С.
мата (7).
Установлено, что аминирование карбаматов
Попытки аминирования карбаматов 1, 6, 7 под
2-4 протекает региоселективно в орто-положении
действием системы реагентов PPA-NaN3 при ва-
по отношению к фенольному гидроксилу и приво-
рьировании температуры (40-70°С) и продолжи-
дит к получению соответствующих орто-амино-
тельности реакции (1-6 ч) не увенчались успе-
фенолов 8-10 с карбаматной группой с выходами
хом - выделяли исходные карбаматы. Такой ре-
90-95% соответственно (схема 1).
зультат, вероятно, обусловлен незначительной
Строение соединений 8-10 подтверждено ме-
активацией бензольного кольца под действием
тодами ИК и ЯМР 1Н спектроскопии.
слабого электронодонорного заместителя (карба-
матной группы) или присутствием электроноак-
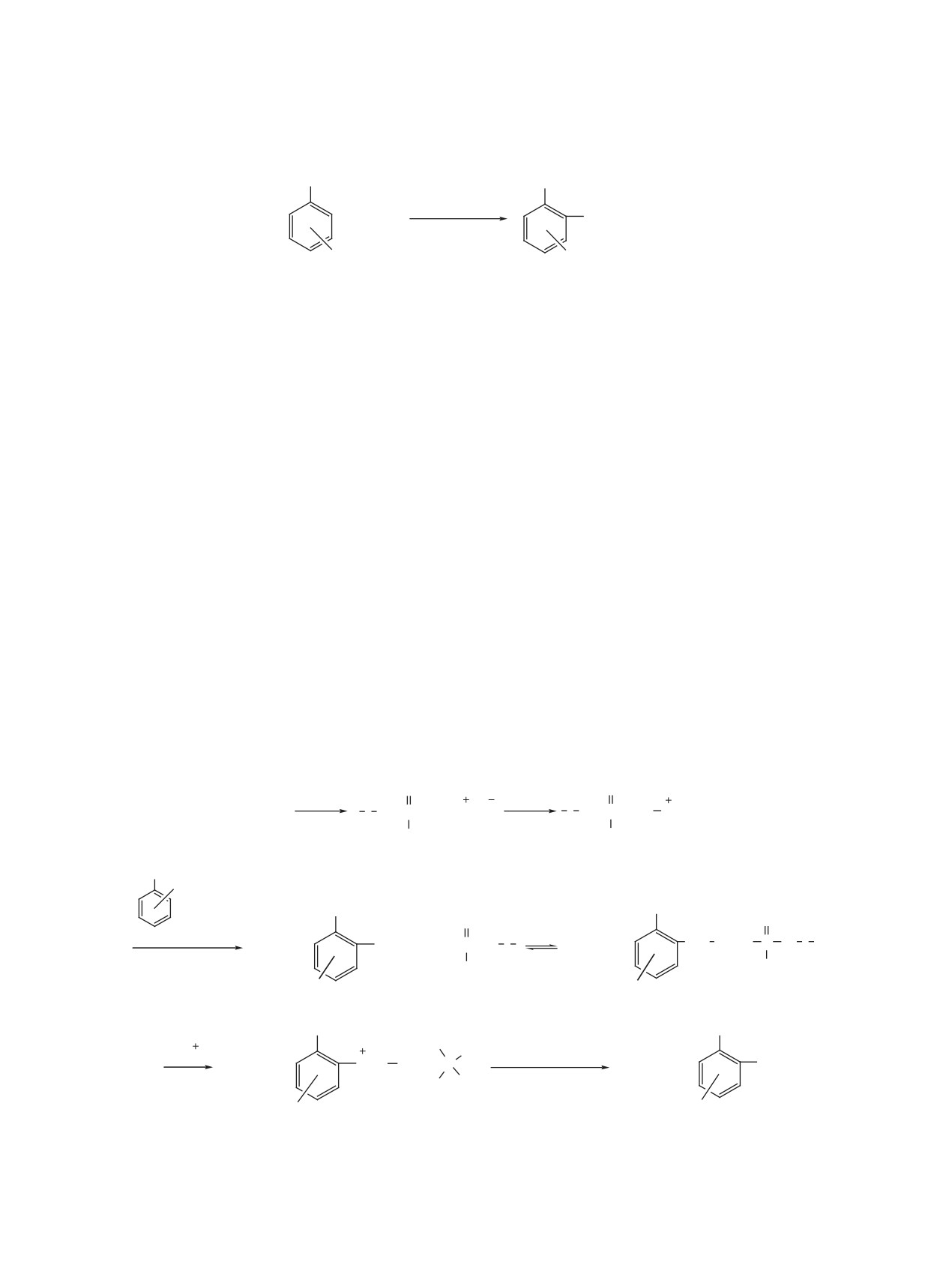
Вероятный механизм протекания реакции элек-
цепторных заместителей.
трофильного аминирования соединений 2-4 вклю-
чает в себя стадии [7, 8], приведенные на схеме 2.
В то же время установлено, что гидроксизаме-
щенные метил-N-фенилкарбаматы 2-4 достаточно
Взаимодействие азида натрия с полифосфор-
легко подвергались аминированию системой ре-
ной кислотой приводит к образованию азида A, ко-
агентов PPA-NaN3. Найдено, что наиболее опти-
торый при протонировании превращается в интер-
мальными условиями проведения реакции являет-
медиат B, взаимодействие которого с соединения-
ся поэтапное повышение температуры в течение
ми 2-4 приводит к интермедиату C, находящемуся
Схема 2.
O
O
PPA
PPA
NaN3
O P N N N
O P NH N N
OH
OH
A
B
OH
NHCO2Me
OH
OH
O
O
2-4
N N NH P O
NH N N P O
OH
OH
MeO2CHN
MeO2CHN
C
D
OH
OH
HO
H
OH
NH2
N N P
NH2
OH
–N2, -H3PO4, -H+
HO
MeO2CHN
MeO2CHN
E
8-10
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1404
ВЕЛИКОРОДОВ и др.
в равновесии с интермедиатом D. Протонирование
Ранее [10-13] установлено, что алифатические
D приводит к интермедиату E, гидролиз которого
нитросоединения являются перспективными ре-
сопровождается отщеплением молекулярного азо-
агентами для электрофильной С-Н активации,
та, фосфорной кислоты, протона и образованием
были разработаны новые методы амидирования
продуктов аминирования 8-10.
и ацетамидирования различных ароматических и
гетероароматических соединений.
С целью расширения ряда аминопроизводных
ароматических карбаматов нами изучено амини-
Нами изучено взаимодействие метил-N-(4-ме-
токсифенил)карбамата (8) с нитрометаном и ни-
рование метил-N-(4-метоксифенил)карбамата (5) в
аналогичных условиях с использованием системы
троэтаном в присутствии РРА при варьировании
температурного режима реакции.
NaN3-PPA.
Установлено, что взаимодействие карбамата 8 с
На основе изучения строения продукта реакции
нитрометаном в 80%-ной PPA при 95°С в течение
установлено, что и в этом случае реакция проте-
5 ч приводит к образованию бензамида 12 с выхо-
кает региоселективно в орто-положении к меток-
дом 45% (схема 4).
сигруппе (схема 3) с образованием метил-N-(3-
амино-4-метоксифенил)карбамата (11) с выходом
Строение бензамида 12 подтверждено метода-
92%.
ми ИК, ЯМР 1Н спектроскопии.
В ИК спектрах соединений 8-11 имеется по-
В ИК спектре метил-N-[3-(аминокарбонил)-
лоса поглощения аминогруппы в области 3440-
4-метоксифенил]карбамата (12), помимо полос по-
3435 см-1.
глощения С-С связей бензольного кольца и карба-
матной группы, присутствуют две полосы погло-
В спектрах ЯМР 1Н соединений 8-11, наряду с
щения в области 3495 и 3400 см-1, обусловленные
сигналами протонов карбаматной группы, бензо-
колебаниями группы NH2, а также две полосы
льного кольца и ОН (OMe) группы, присутствует
поглощения карбонильной группы при 1690 см-1
синглетный сигнал аминогруппы в области 3.10-
(амид I) и 1590 см-1 (амид II).
4.65 м.д.
В спектре ЯМР 1Н соединения 12 протоны
Региоселективное протекание аминирования
амидной группы проявляются в виде синглетного
карбаматов 2-5 в орто-положении по отноше-
сигнала (δ 6.80 м.д.).
нию к активирующей ОН(ОМе)-группе также
Образование соединения 12, вероятно, проис-
подтверждается данными спектров ЯМР 1Н. Так
ходит по механизму, приведенному на схеме 5.
в спектре ЯМР 1Н аминопроизводного 8 прото-
ны бензольного кольца проявляются в виде двух
На первой стадии из нитрометана и РРА об-
дублетных сигналов при 7.69 и 6.40 м.д. и одного
разуется кислота F, которая атакует бензольное
триплетного сигнала при 7.10 м.д. (J 8.2 Гц). При
кольцо карбамата 8 в орто-положении к меток-
атаке электрофила в пара-положении к гидрок-
сильной группе с образованием интермедиата
сильной группе в спектре ЯМР 1Н продукта реак-
G. Отщепление РРА приводит к образованию
ции следовало бы ожидать наличия двух дублет-
гидроксиламина H, который в среде PPA подвер-
ных и одного синглетного сигналов.
гается дегидратации с получением нитрила I.
Схема 3.
Схема 4.
OMe
OMe
OMe
OMe
PPA-NaN3
NH2
MeNO2-PPA
CONH2
NHCO2Me
NHCO2Me
NHCO2Me
NHCO2Me
5
11
8
12
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
АМИНИРОВАНИЕ, АЦЕТАМИНИРОВАНИЕ И АМИДИРОВАНИЕ
1405
Схема 5.
OMe
O
OMe
O
OH
O
P
O
H
PPA
O
8
N
N
CH3NO2
N
OH
n
H2C
O
P
O
H
-PPA
OH
OH
n
NHCO2Me
NHCO2Me
F
G
H
OMe
OMe
NH
OMe O
O
PPA
N PPA
O
P
O
H H2O
NH2
–H2O
OH
n
NHCO2Me
NHCO2Me
NHCO2Me
I
J
12
Присоединение к нитрилу PPA дает интермедиат
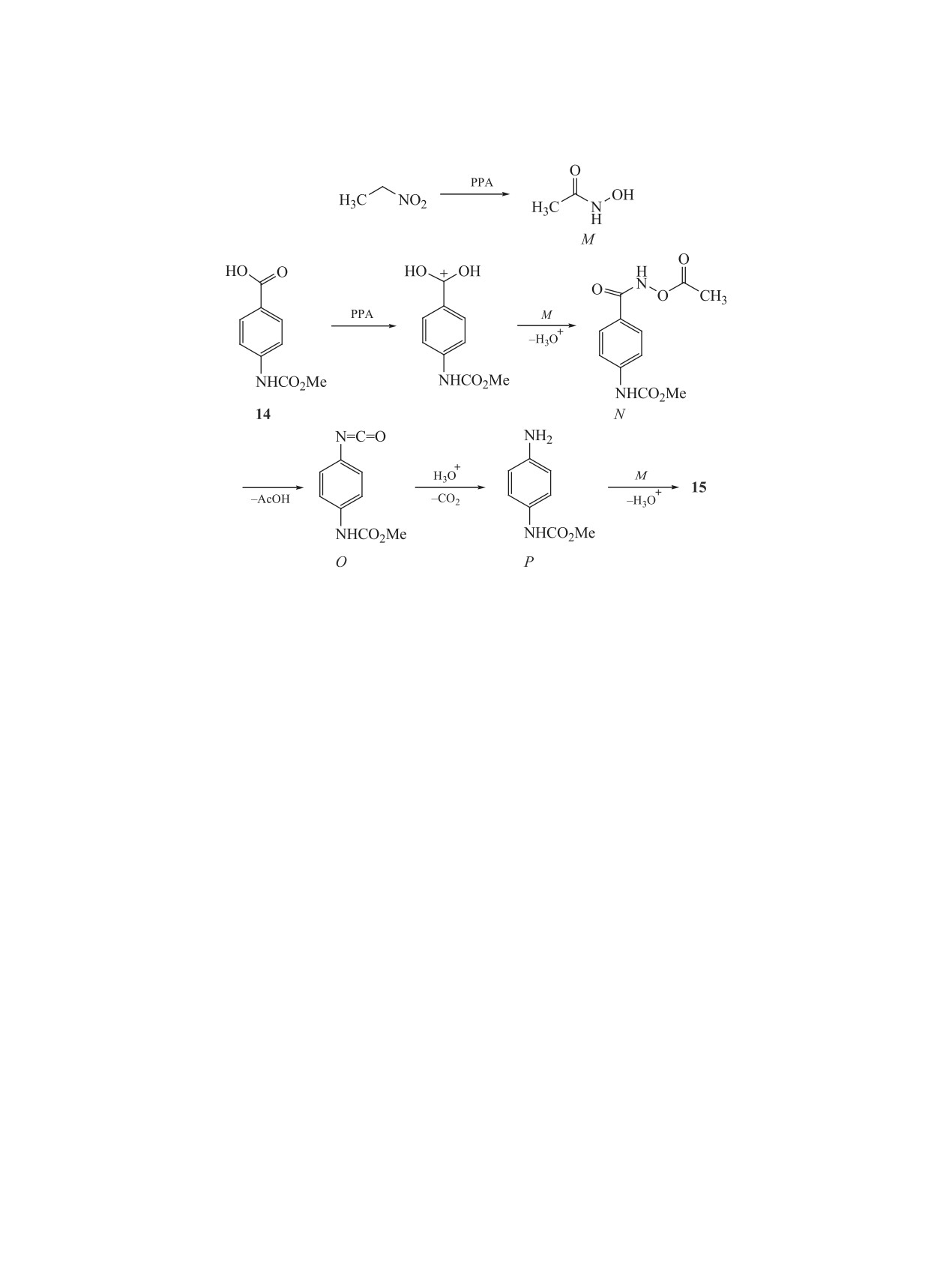
Реакция, вероятно, протекает по схеме 7, вклю-
J, гидролиз которого приводит к получению бен-
чающей образование из нитроалкана и PPA ни-
замида 12.
тронатного интермедиата K, который в результате
реакции SEAr в орто-положении к фенольному
В то же время взаимодействие карбамата 8 с
гидроксилу дает оксим L, подвергающийся далее
нитроэтаном в присутствии 80%-ной PPA при
перегруппировке Бекмана в амид 13 [10].
температуре 105°С в течение 2 ч сопровождается
Попытки ввести в реакцию с нитроалканами
его ацетамидированием в орто-положении к ме-
незамещенный метил-N-фенилкарбамат, метил-
токсигруппе и образованием метил-N-[3-(ацетил-
N-(4-метилфенил)карбамат, а также метил-N-фе-
амино)-4-метоксифенил]карбамата (13) с выходом
нилкарбаматы, содержащие в пара-положении ак-
74% (схема 6).
цепторные заместители (Br, NO2), не увенчались
Строение полученного продукта реакции под-
успехом - выделяли исходные карбаматы.
тверждено методом спектроскопии ЯМР 1Н. В
Таким образом, нами показано, что изученные
спектре ЯМР 1Н карбамата 13, наряду с сигналами
превращения под действием системы нитроалкан-
протонов метоксильной группы (δ 3.37 м.д.), ме-
РРА возможны только при наличии достаточно
токсикарбониламиногруппы (δ 3.71 м.д.), бензоль-
сильного электронодонорного заместителя, в част-
ного кольца (δ 6.87-7.76 м.д.), присутствуют два
ности, в присутствии метоксигруппы.
синглетных сигнала в области 2.12 и 10.45 м.д.,
Ранее сообщалось о взаимодействии некоторых
обусловленные протонами ацетамидной группы.
п-замещенных бензойных кислот [4-RC6H4CO2H
Повышение температуры до 135°С приводит к
(R = Cl, Me, OMe)] с нитроэтаном в PPA, приво-
уменьшению выхода соединения 13 до 31% за счет
дящем к образованию производного амидоксима
образования смолообразных продуктов.
[14]. С целью изучения границ применения дан-
ного метода синтеза амидоксимов нами изучено
Схема 6.
взаимодействие 4-[(метоксикарбонил)амино]бен-
зойной кислоты (14) с полуторным избытком ни-
троэтана в 86%-ной РРА при 125°С в течение 2 ч
EtNO2-PPA
при интенсивном перемешивании.
На основании изучения состава и строения
выделенного продукта установлено, что дан-
ное взаимодействие приводит к образованию
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1406
ВЕЛИКОРОДОВ и др.
Схема 7.
O
OH
O
O
H
Me NO2PPA Me N
Me N O P
OH
O
P
OH
OH
OH
K
OH
OMe
OMe
N
NHCOMe
8
Me
NHCO2Me
NHCO2Me
L
13
производного амидоксима
15 с выходом
79%
2.31 м.д.), гидроксильной группы малой интен-
(схема 8).
сивности (δ 8.51 м.д.), а также NH группы при
8.72 м.д.
Реакция, вероятно, протекает по механизму,
включающему в себя следующие стадии (схема 9):
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
образование под действием РРА из нитроэтана
Спектры ЯМР 1Н получены на спектрометре
N-гидроксиацетамида M и его последующее вза-
Bruker DRX-500 (500.13 МГц) (Германия). ИК
имодействие с протонированной формой соедине-
спектры измерены на ИК Фурье-спектрофотомет-
ния 14 с получением интермедиата N, подвергаю-
ре InfraLUM FT-02 (Россия) в интервале 4000-
щегося далее перегруппировке Лоссена в арили-
400 см-1 в KBr. Чистоту полученных соединений
зоцианат O, который гидролизуется в метил-N-(4-
контролировали методом ТСХ на пластинах Silufol
аминофенил)карбамат P, и, наконец, образова-
UV-254, проявление - в парах иода. Карбаматы
ние соединения 15 в результате взаимодействия
1-7 получали по методикам, приведенным в рабо-
гидроксиацетамида M с метил-N-(4-аминофенил)-
те [15].
карбаматом P.
Метил-N-(3-амино-2-гидроксифенил)кар-
Строение метил N-{4-[1-(N-гидроксиэтаними-
бамат (8). К 5 г 86%-ной PPA добавляли 1.67 г
доил)амино]фенил}карбамата (15) подтверждено
(0.01 моль) метил-N-(2-гидроксифенил)карбамата
методами ИК и ЯМР 1Н спектроскопии.
(2), 0.78 г (0.012 моль) азида натрия и при энер-
В спектре ЯМР 1Н амидоксима 15, наряду
гичном перемешивании выдерживали 1 ч, под-
с сигналами, обусловленными протонами бен-
держивая температуру 50-55°С, а затем в течение
зольного кольца (δ 8.51-6.96 м.д.), метоксикар-
1 ч - 60°С. Реакционную массу охлаждали, выли-
бониламиногруппы (δ 3.76 и 9.76 м.д.), имеют-
вали в 100 мл ледяной воды, образовавшийся кри-
ся синглетные сигналы метильной группы (δ
сталлический продукт отфильтровывали, промы-
вали на фильтре водой (50 мл), сушили на воздухе
Схема 8.
и очищали колоночной жидкостной хроматогра-
NOH
фией (сорбент - нейтральный оксид алюминия,
CO2H
элюент - ацетон). Выход 1.71 г (94%), бесцветные
HN Me
кристаллы, т.пл. 78-80°С (из ацетона). ИК спектр,
–PPA
EtNO2
ν, см-1: 3440 (NH2), 3330-3315 (NH, OH), 1710
(C=O), 1610, 1560 (C-Cаром). Спектр ЯМР 1Н, δ,
м.д.: 2.79 с (1Н, OH), 3.10 с (2Н, NH2), 3.71 c (3H,
NHCO2Me
NHCO2Me), 6.40 д (1Наром, J 8.2 Гц), 7.10 т (1Наром,
NHCO2Me
J 8.2 Гц), 7.69 д (1Наром, J 8.2 Гц), 9.85 уш.с (1Н,
14
15
NHCO2Ме). Найдено, %: С 52.34; Н 5.24; N 15.09.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
АМИНИРОВАНИЕ, АЦЕТАМИНИРОВАНИЕ И АМИДИРОВАНИЕ
1407
Схема 9.
C8H10N2O3. Вычислено, %: С 52.75; Н 5.50; N
Метил-N-(3-амино-4-метоксифенил)карба-
15.39.
мат (11). Получали по приведенной выше мето-
дике из 1.81 г (0.01 моль) метил-N-(4-метоксифе-
Метил-N-(4-амино-3-гидроксифенил)карба-
нил)карбамата (8). Выход 1.80 г (92%), бесцвет-
мат (9). Получали по приведенной выше методике
ные кристаллы, т.пл. 124-126°С (из ацетона). ИК
из 1.67 г (0.01 моль) метил-N-(3-гидроксифенил)
спектр, ν, см-1: 3435 (NH2), 3314 (NH), 1710 (C=O),
карбамата (3). Выход 1.73 г (95%), бесцветные
1610, 1567 (C-Cаром). Спектр ЯМР 1Н, δ, м.д.:
кристаллы, т.пл. 98-100°С (из ацетона). ИК спектр,
3.29 уш.с (2Н, NH2), 3.62 с (3Н, ОМе), 3.71 c (3H,
ν, см-1: 3440 (NH2), 3334-3310 (NH, OH), 1710
NHCO2Me), 7.08 д (1Наром, J 8.5 Гц), 7.30 c (1Наром),
(C=O), 1608, 1567 (C-Cаром). Спектр ЯМР 1Н, δ,
7.47 д (1Наром, J 8.5 Гц), 9.97 уш.с (1Н, NНCO2Me).
м.д.: 3.71 с (3Н, NHCO2Me), 4.65 c (2H, NH2), 5.50
Найдено, %: С 54.82; Н 5.99; N 14.12. C9H12N2O3.
c (1H, OH), 6.64 д (1Наром, J 8.6 Гц), 6.79 д (1Наром, J
Вычислено, %: С 55.10; Н 6.12; N 14.29.
8.6 Гц), 7.12 с (1Наром), 9.87 уш.с (1Н, NHCO2Me).
Найдено, %: С 52.65; Н 5.60; N 15.18. C8H10N2O3.
Метил-N-[3-(аминокарбонил)-4-метоксифе-
Вычислено, %: С 52.75; Н 5.50; N 15.39.
нил]карбамат (12). К смеси 3 г 80%-ной РРА,
0.181 г (1 ммоль) метил-N-(4-метоксифенил)кар-
Метил-N-(3-амино-4-гидроксифенил)карба-
мат (10). Получали по приведенной выше мето-
бамата (8) добавляли 0.21 мл (4 ммоль) нитромета-
дике из 1.67 г (0.01 моль) метил-N-(4-гидроксифе-
на, выдерживали при температуре 95°С в течение
нил)карбамата (4). Выход 1.64 г (90%), бесцветные
5 ч при энергичном перемешивании, охлаждали,
кристаллы, т.пл. 95-97°С (из ацетона). ИК спектр,
выливали в ледяную воду (10 мл), продукт экстра-
ν, см-1: 3435 (NH2), 3330-3310 (NH, OH), 1710
гировали метиленхлоридом (10×30 мл), сушили
(C=O), 1605, 1565 (C-Cаром). Спектр ЯМР 1Н, δ,
безводным сульфатом магния, растворитель уда-
м.д.: 3.71 c (3H, NHCO2Me), 4.54 c (2H, NH2), 5.60
ляли. Продукт реакции очищали перекристалли-
c (1H, OH), 6.75 д (1Наром, J 8.4 Гц), 7.04 д (1Наром, J
зацией из 50%-ного этанола. Выход 0.1 г (45%),
8.4 Гц), 7.33 c (1Наром), 9.95 уш.с (1Н, NНCO2Me).
бесцветные кристаллы, т.пл.
118-120°С. ИК
Найдено, %: С 52.55; Н 5.38; N 15.17. C8H10N2O3.
спектр, ν, см-1: 3495, 3400 (NH2), 3314 (NH), 1710
Вычислено, %: С 52.75; Н 5.50; N 15.39.
(C=O), 1690 (амид I), 1590 (амид II), 1610, 1567
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1408
ВЕЛИКОРОДОВ и др.
(C-Cаром). Спектр ЯМР 1Н, δ, м.д.: 3.40 с (3Н,
СПИСОК ЛИТЕРАТУРЫ
ОМе), 3.71 c (3H, NHCO2Me), 6.80 c (2Н, CONH2),
1.
Pizey J.S. Synthetic Reagents: Chloramine-T, Hydrogen
7.01 c (1Наром), 7.26 д (1Наром, J 8.5 Гц), 7.58 д
Peroxide, Polyphosphoric Acid. Ellis Horwood series.
(1Наром, J 8.5 Гц), 9.58 уш.с (1Н, NНCO2Me). Най-
1985, 6, 156-414.
дено, %: С 53.38; Н 5.13; N 12.31. C10H12N2O4.
2.
Aksenov A.V., Ovcharov D.S., Aksenov N.A., Akse-
Вычислено, %: С 53.57; Н 5.36; N 12.50.
nov D.A., Nadein O.N., Rubin M. RSC Adv. 2017, 7,
29927-29932. doi 10.1039/C7RA04751G
Метил-N-[3-(ацетиламино)-4-метоксифе-
нил]карбамат (13). К смеси 2 г 86%-ной РРА,
3.
Masson J.-F. Energy Fuels. 2008, 22, 2637-2640. doi
10.1021/ef800120x
0.181 г (1 ммоль) метил-N-(4-метоксифенил)кар-
бамата (8) добавляли 0.1 мл (1.4 ммоль) нитроэта-
4.
López S.E., Restrepo J., Salazar J. J. Chem. Res. 2007,
на, выдерживали при температуре 105°С в течение
497-502. doi 10.3184/030823407X245598
2 ч при энергичном перемешивании, охлаждали,
5.
Van de Sande C., Vandewalle M. Bull. Soc. Chim. Belg.
выливали в охлажденный 10%-ный раствор соды
1973, 82, 705-710. doi 10.1002/bscb.19730820912
(40 мл), продукт экстрагировали метиленхлори-
6.
Blickenstaff R.T., Hanson W.R., Reddy S., Witt R.
дом (10×30 мл), сушили безводным сульфатом
Bioorg. Med. Chem. 1995, 3, 917-922. doi 10.1016/
магния, растворитель удаляли. Выход 0.176 г
0968-0896(95)00076-s
(74%), бесцветные кристаллы, т.пл. 104-106°С (из
7.
Караиванов Н.Ц. Дис. …канд. хим. наук. Ставро-
50%-ного этанола). ИК спектр, ν, см-1: 3315-3310
поль. 2010.
(NH), 1710 (C=O), 1612, 1565 (C-Cаром). Спектр
8.
Аксенов А.В., Ляховненко А.С., Караиванов Н.Ц.
ЯМР 1Н, δ, м.д.: 2.12 с (3Н, NHCOMe), 3.37 c (3Н,
ХГС. 2009, 45, 1091-1093. [Aksenov A.V., Lyakho-
ОМе), 3.71 с (3Н, NHCO2Me), 6.87 д (1Наром, J
vnenko A.S., Karaivanov N.C. Chem. Heterocycl.
8.4 Гц), 7.21 д (1Наром, J 8.4 Гц), 7.76 c (1Hаром),
Compd. 2009, 45, 871-872.] doi 10.1007/s10593-009-
0342-3
9.85 уш.с
(1Н, NHCO2Ме),
10.45 уш.с
(1Н,
NHСОМе). Найдено, %: С 55.31; Н 5.75; N 11.56.
9.
Аксенов А.В., Аксенов Н.А., Надеин О.Н., Смуш-
кевич Ю.И. Обзорный ж. хим.
2011,
1,
350-
C11H14N2O4. Вычислено, %: С 55.46; Н 5.88; N
375.
[Aksenov A.V., Aksenov N.A., Nadein O.N.,
11.77.
Smushkevich Yu.I. Rev. J. Chem. 2011, 1, 359-384.]
Метил-N-{4-[(гидроксиэтанимидоил)ами-
doi 10.1134/S2079978011040017
но]фенил}карбамат
(15). Перемешивали при
10.
Aksenov A.V., Aksenov N.A., Nadein O.N., Akseno-
125°С в течение 2 ч смесь 1.638 г (8.4 ммоль)
va I.V. Synlett. 2010, 2628-2630. doi 10.1055/s-0030-
4-[(метоксикарбонил)амино]бензойной кислоты
1258767
(14), 0.95 мл (13.4 ммоль) нитроэтана, 1 г 86%-ной
11.
Аксенов Н.А., Малюга В.В., Абакаров В.В., Аксе-
РРА, охлаждали, выливали в 100 мл ледяной воды,
нов Д.А., Воскресенский Л.Г. Изв. РАН. Сер. хим.
выпавший осадок отфильтровывали, сушили на
2019, 68, 1047-1051. [Aksenov N.A., Malyuga V.V.,
воздухе и перекристаллизовывали из 50%-ного
Abakarov G.M., Aksenov D.A., Voskressensky L.G.,
этанола. Выход 1.48 г (79%), бесцветные кристал-
Aksenov A.V. Russ. Chem. Bull. 2019, 68, 1047-1051.]
лы, т.пл. 175-178°С. ИК спектр, ν, см-1: 3310-3000
doi 10.1007/s11172-019-2518-z
(NH, ОН), 1710 (C=O), 1610, 1565 (C-Cаром).
12.
Aksenov A.V., Aksenov N.A., Orazova N.A., Akse-
Спектр ЯМР 1Н, δ, м.д.: 2.31 с (3Н, CH3), 3.76 c
nov D.A., Dmitriev M.V., Rubin M. RSC Adv. 2015, 5,
(3Н, NHCO2Me), 6.96 д (2Наром, J 8.7 Гц), 7.34 д
84849-84855. doi 10.1039/C5RA17668A
(2Наром, J 8.7 Гц), 8.51 c (1H, OH), 8.72 c (1H, NH),
13.
Aksenov N.A., Aksenov A.V., Nadein O.N., Akse-
9.76 уш.с (1Н, NHCO2Me). Найдено, %: С 53.69; Н
nov D.A., Smirnov A.N., Rubin M. RSC Adv. 2015, 5,
5.47; N 18.61. C10H13N3O3. Вычислено, %: С 53.81;
71620-71626. doi 10.1039/c5ra15128g
Н 5.83; N 18.83.
14.
Bachman G.B., Goldmacher J.E. J. Org. Chem. 1964,
29, 2576-2579. doi 10.1021/jo01032a020
КОНФЛИКТ ИНТЕРЕСОВ
15.
Максимова Т.Н., Штонда Н.П., Великородов А.В.,
Авторы заявляют об отсутствии конфликта ин-
Хабарова О.В. Изв. Вузов. Хим. Хим. Технол. 1987,
тересов.
30, 132-133.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
АМИНИРОВАНИЕ, АЦЕТАМИНИРОВАНИЕ И АМИДИРОВАНИЕ
1409
Amination, Acetamination and Amidation of Substituted
Aromatic Carbamates in Polyphosphoric Acid
A. V. Velikorodova, b, *, E. N. Kutlalievab, N. N. Stepkinaa, E. A. Shustovab, and O. Yu. Poddubnyc
a Astrakhan State University, 414000, Russia, Astrakhan, pl. Shahumyan 1
*e-mail: avelikorodov@mail.ru
b Astrakhan State Medical University, 414000, Russia, Astrakhan, ul. Bakinskaya 121
c Armavir State Pedagogical University, 352901, Russia, Armavir, ul. R. Luxembourg 159
Received May 5, 2020; revised May 15, 2020; accepted May 26, 2020
Electrophilic amination of 2 (3,4)-hydroxy-substituted methyl N-phenylcarbamate and methyl-N-(4-methoxy-
phenyl)carbamate with sodium azide in 86% polyphosphoric acid (PPA) at 55-60°C occurs regioselectively in
the ortho-position to the hydroxyl or a methoxy group and produces methyl-N-(3-amino-2-hydroxyphenyl)-,
(4-amino-3-hydroxyphenyl)-, (3-amino-4-hydroxyphenyl)-, (3-amino-4-methoxyphenyl)carbamates, respective-
ly. By the interaction of methyl-N-(4-methoxyphenyl)carbamate with nitromethane and nitroethane in 80% PPA
at 95-110°C, methyl-N-[3-(aminocarbonyl)-4-methoxyphenyl]carbamate and methyl-N-[3-(acetylamino)-4-me-
thoxyphenyl]carbamate are received, respectively. The reaction of 4-[(methoxycarbonyl)amino]benzoic acid
with an excess of nitroethane in 86% PPA at 125°C yields methyl-N-(4-{[1-N-hydroxyethanimidoyl]amino}-
phenyl)carbamate.
Keywords: hydroxy-substituted methyl-N-phenyl carbamates, sodium azide, polyphosphoric acid, electro-
philic amination, methyl-N-(3-amino-2-hydroxyphenyl)carbamate, methyl-N-(4-amino-3-hydroxyphenyl)-
carbamate, methyl-N-(3-amino-4-hydroxyphenyl)carbamate, methyl-N-(3-amino-4-methoxyphenyl)carbamate,
nitromethane, nitroethane, acetamination, methyl-N-[3-(aminocarbonyl)-4-methoxyphenyl]carbamate, me-
thyl-N-[3-(acetylamino)-4-methoxyphenyl] carbamate, 4-[(methoxycarbonyl)amino]benzoic acid, methyl-N-
(4-{[1-N-hydroxyethanimidoyl]amino}phenyl)carbamate
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020