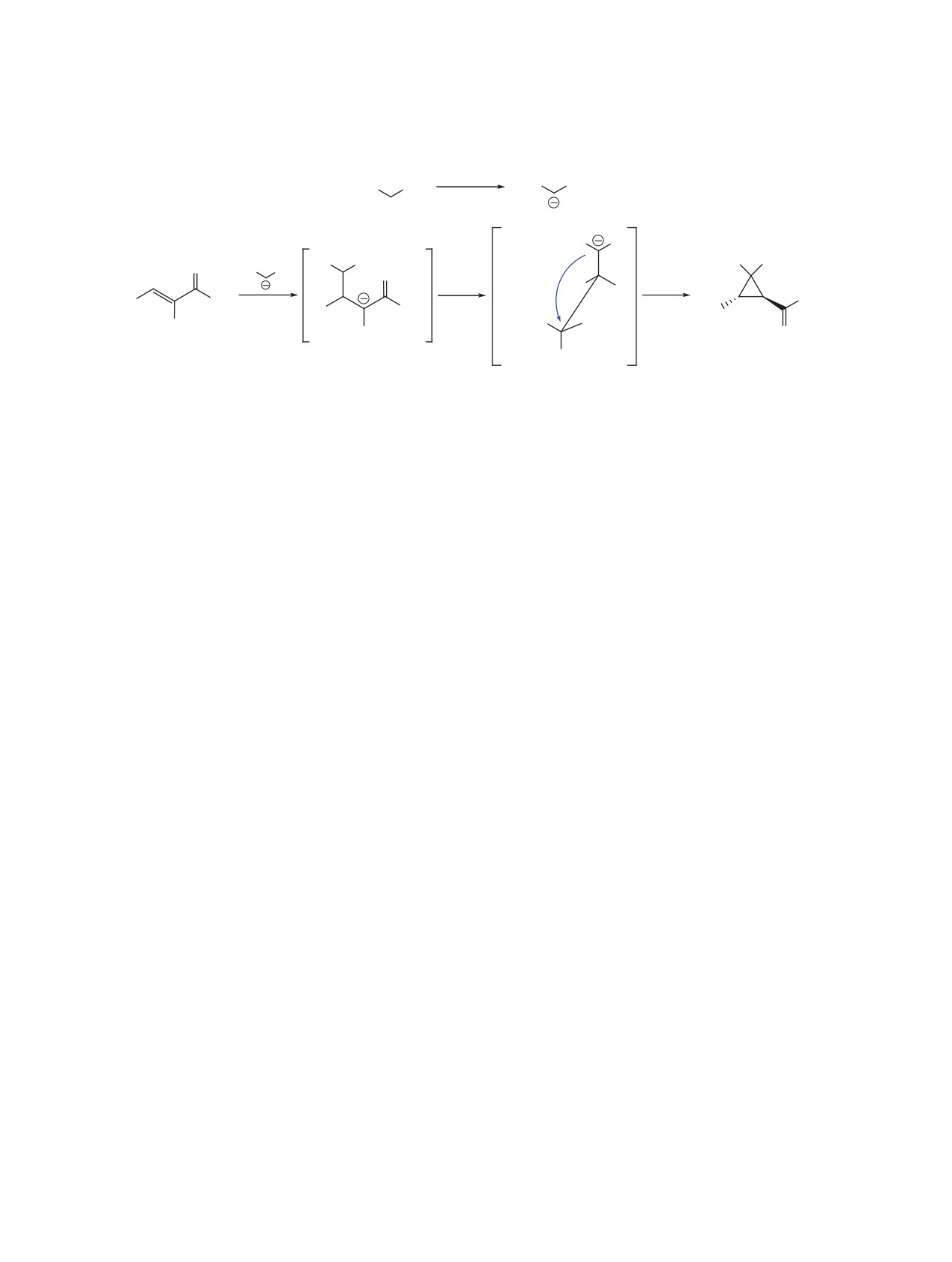ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 9, с. 1410-1416
УДК 547.038 + 547.461.3
ОДНОРЕАКТОРНЫЙ СИНТЕЗ
3-(ТРИФТОРАЦЕТИЛ)ЦИКЛОПРОПАН-
1,1-ДИКАРБОКСИЛАТОВ
© 2020 г. А. Р. Романов*, А. В. Мареев, А. В. Попов, С. В. Зинченко
ФБГУН «Иркутский институт химии им. А. Е. Фаворского СО РАН», 664033, Россия, г. Иркутск, ул. Фаворского 1
*e-mail: romanov@irioch.irk.ru
Поступила в редакцию 15 мая 2020 г.
После доработки 26 мая 2020 г.
Принята к публикации 02 июня 2020 г.
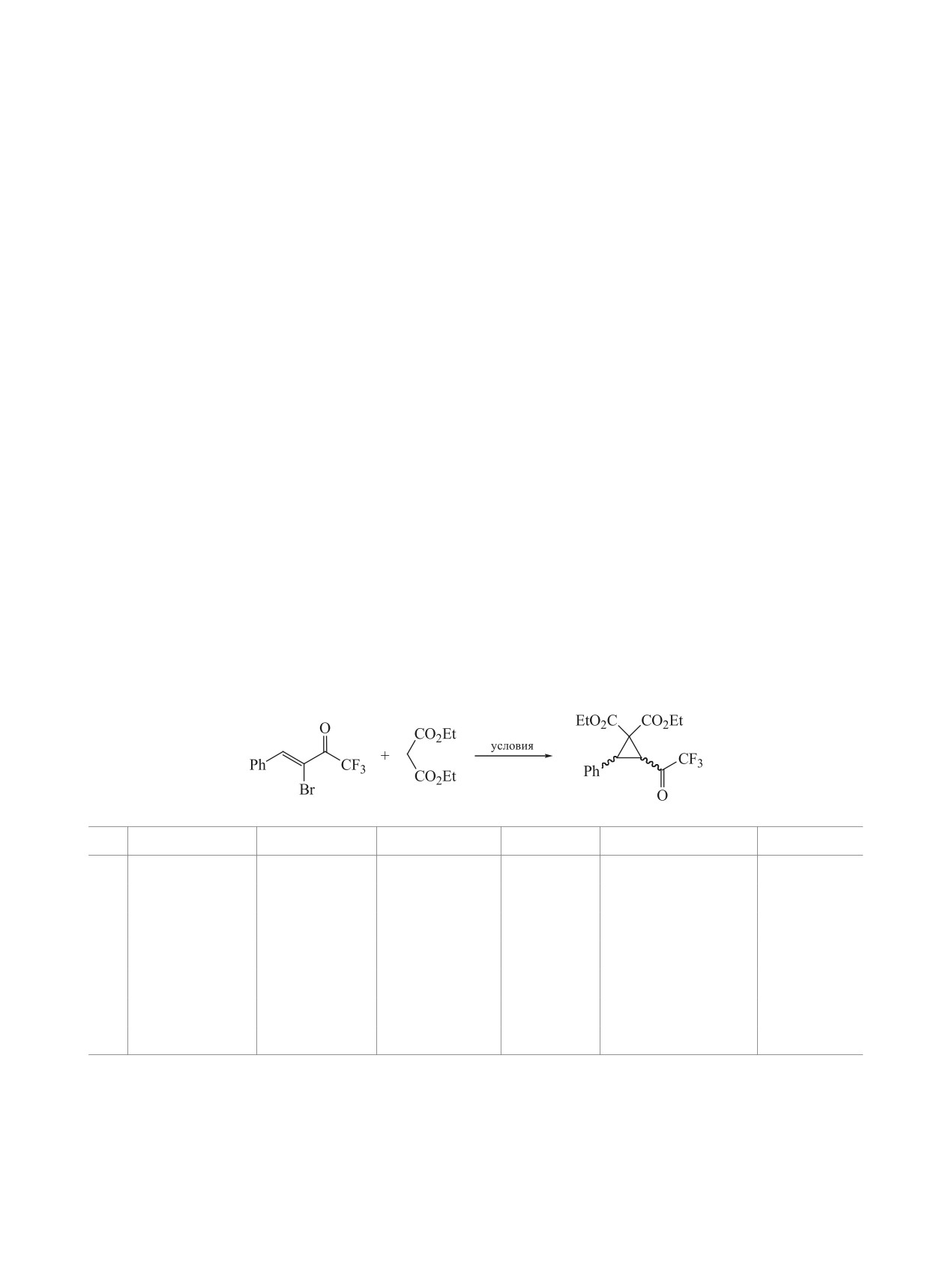
Взаимодействие трифторметил(α-бромалкенил)кетонов с диэтилмалонатом приводит к образованию
3-(трифторацетил)циклопропан-1,1-дикарбоксилатов, входящих в семейство донорно-акцепторных ци-
клопропанов - важнейших прекурсоров в реакциях циклоприсоединения. Реакции с участием CF3-α-бро-
менонов протекают в мягких условиях и за более короткое время по сравнению с нефторированными
аналогами. Выделяемые целевые циклопропаны имеют только транс-конфигурацию.
Ключевые слова: α,β-ненасыщенные кетоны, реакция Михаэля, метод каскадных реакций, циклопро-
паны, CF3-α-броменоны.
DOI: 10.31857/S0514749220090128
Донорно-акцепторные циклопропаны (ДАЦ) -
малоновой кислоты. При этом для успешного про-
подкласс соединений, содержащих электронодо-
текания реакции авторы использовали катализа-
норный и электроноакцепторный заместители у
торы межфазного переноса [9], ионные жидкости
вицинальных атомов углерода циклопропанового
[10] и сильные неорганические основания [13].
кольца [1]. Присутствие этих заместителей создаёт
Что касается CF3- или C(O)CF3-содержащих
пуш-пульный эффект, активируя карбоцикл для ре-
циклопропанов, в литературе встречаются лишь
акций с электрофилами, нуклеофилами и диполя-
единичные случаи их получения [13-15]. Вместе
рофилами [2, 3]. Как правило, реакции протекают
с тем, трифторметильная или трифторацетильная
с раскрытием цикла, и в зависимости от природы
группы как мощные электроноакцепторы извест-
реагента, приводят либо к ценным аддуктам [4],
ны своими уникальными свойствами, а их присут-
либо к замыканию большего по размеру карбо- или
ствие в структуре способно значительно повлиять
гетероцикла [4-6]. За последнее десятилетие было
на химические, конформационные и биологиче-
опубликовано множество обзоров, посвящённых
ские свойства молекулы [16]. Поэтому мы зада-
различным аспектам химии ДАЦ [2, 3, 7, 8], что
лись целью разработать подход к трифторацили-
указывает на их несомненную синтетическую
рованным циклопропанам.
ценность. В настоящее время одним из основных
подходов к донорно-акцепторным циклопропанам
В качестве исходных акцепторов Михаэля мы
остаётся метод каскадных реакций, инициируе-
выбрали трифторметил(α-бромалкенил)кетоны,
мый реакцией Михаэля (MIRC-синтез). В качестве
поскольку они обладают рядом преимуществ.
акцептора Михаэля, как правило, используются
Во-первых, они являются доступными и амбива-
различные циклические [9, 10] и ациклические
лентными фторсодержащими строительными бло-
[11-13] α,β-ненасыщенные карбонильные соеди-
ками, во-вторых, эти кетоны, благодаря наличию
нения, а в качестве C-нуклеофила - производные
трифторметильной группы, зарекомендовали себя
1410
ОДНОРЕАКТОРНЫЙ СИНТЕЗ 3-(ТРИФТОР
АЦЕТИЛ)ЦИКЛОПРОПАН-1,1-ДИКАРБОКСИЛАТОВ
1411
как очень активные акцепторы Михаэля. Так, их
протекала даже при длительном стоянии (табл. 1,
реакции с N-центрированными моно- и бинукле-
строка 1). Более сильные основания (Cs2CO3 и
офилами были систематически изучены нашей
DBU) не только не приводили к желаемому ре-
научной группой и послужили основой для мето-
зультату (табл. 1, строки 2, 3), но и способство-
дов синтеза различных карбо- [17, 18] и гетеро-
вали фрагментации исходных реагентов или ин-
циклов [19-21]. Кроме того, недавно мы показа-
термедиатов. Более того, в этаноле в присутствии
ли, что CF3-α-броменоны прекрасно реагируют с
сильных оснований наблюдалось частичное (кон-
C-нуклеофилами, а именно реактивами Гриньяра,
версия не более 20%) обратимое присоединение
давая преимущественно 1,4-аддукты [22]. Поэтому
молекулы спирта к карбонильной группе кетона с
изучение реакций фторированных α,β-ненасыщен-
образованием полукеталя 4 (схема 1).
ных кетонов с производными малоновой кислоты
Далее мы перешли к тетрагидрофурану как
нам видится логичным продолжением исследова-
растворителю, инертному по отношению к ис-
ний в этой области.
ходным реагентам. Органические (DBU, DABCO,
Поскольку сильный электроноакцепторный
i-Pr2NH) и мягкие неорганические основания
эффект трифторметильной группы активирует
(K2CO3, Cs2CO3) слабо активировали нуклеофил
двойную связь α-броменонов, их взаимодействие
2a. Образование циклопропана 3 наблюдалось
с C-нуклеофилами должно протекать в более мяг-
только в случае сильных оснований, таких как
ких условиях и за меньшее время по сравнению
NaH, t-BuOK и (Me3Si)2NNa (табл. 1, строки 4-6).
с нефторированными аналогами. Для начала мы
При этом бис(триметилсилил)амид лития (табл. 1,
изучили модельную реакцию
3-бром-4-фенил-
строка 7) в тех же условиях приводил к смеси неи-
1,1,1-трифторбутен-3-она-2 1a с диэтилмалонатом
дентифицируемых продуктов. Наилучшие резуль-
2a, варьируя растворитель и основание (табл. 1).
таты были получены при использовании бис(три-
Однако получить целевой циклопропан-1,1-дикар-
метилсилил)амида натрия в качестве основания,
боксилат 3a оказалось не так просто. Так, при ис-
поскольку он не обладает восстановительными
пользовании карбоната калия в этаноле реакция не
свойствами, а его применение в виде двухмоляр-
Таблица 1. Поиск оптимальных условий для синтеза циклопропанов 3.
1a
2a
3a
№
Основание
Кол-во, эквa
Растворитель
Время, ч
Температура, °C
Выходb, %
1
K2CO3
1.2
EtOH
2-40
rt
0
2
Cs2CO3
1.2
EtOH
2
rt
0c
3
DBU
1.2
EtOH
2
rt
0c
4
NaH
1.5
THF
2
-30 → rtd
30
5
t-BuOK
1.5
THF
5
rt
30
6
(Me3Si)2NNa
1.5
THF
5
rt
34
7
(Me3Si)2NLi
1.5
THF
5
rt
0
a Количество основания (в мольн. эквивалентах) относительно количества исходного кетона.
b Выход по данным 19F ЯМР спектроскопии.
c Фрагментация исходного CF3-кетона 1a в условиях реакции.
d Смешивание реагентов проводилось при -30°C, затем реакционной смеси позволяли самопроизвольно нагреться до комнатной
температуры.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1412
РОМАНОВ и др.
Схема 1. Обратимое присоединение этанола к молекуле исходного броменона.
O
HO OEt
Cs2CO3 или DBU
Ph
CF3
Ph
CF3
EtOH, rt, 2 ч
Br
Br
1a
4
ного раствора в ТГФ позволяет проводить синтез в
Во всех случаях выделенные циклопро-
гомогенных условиях.
пан-1,1-карбоксилаты находились в форме
транс-диастереомера. Структура продуктов была
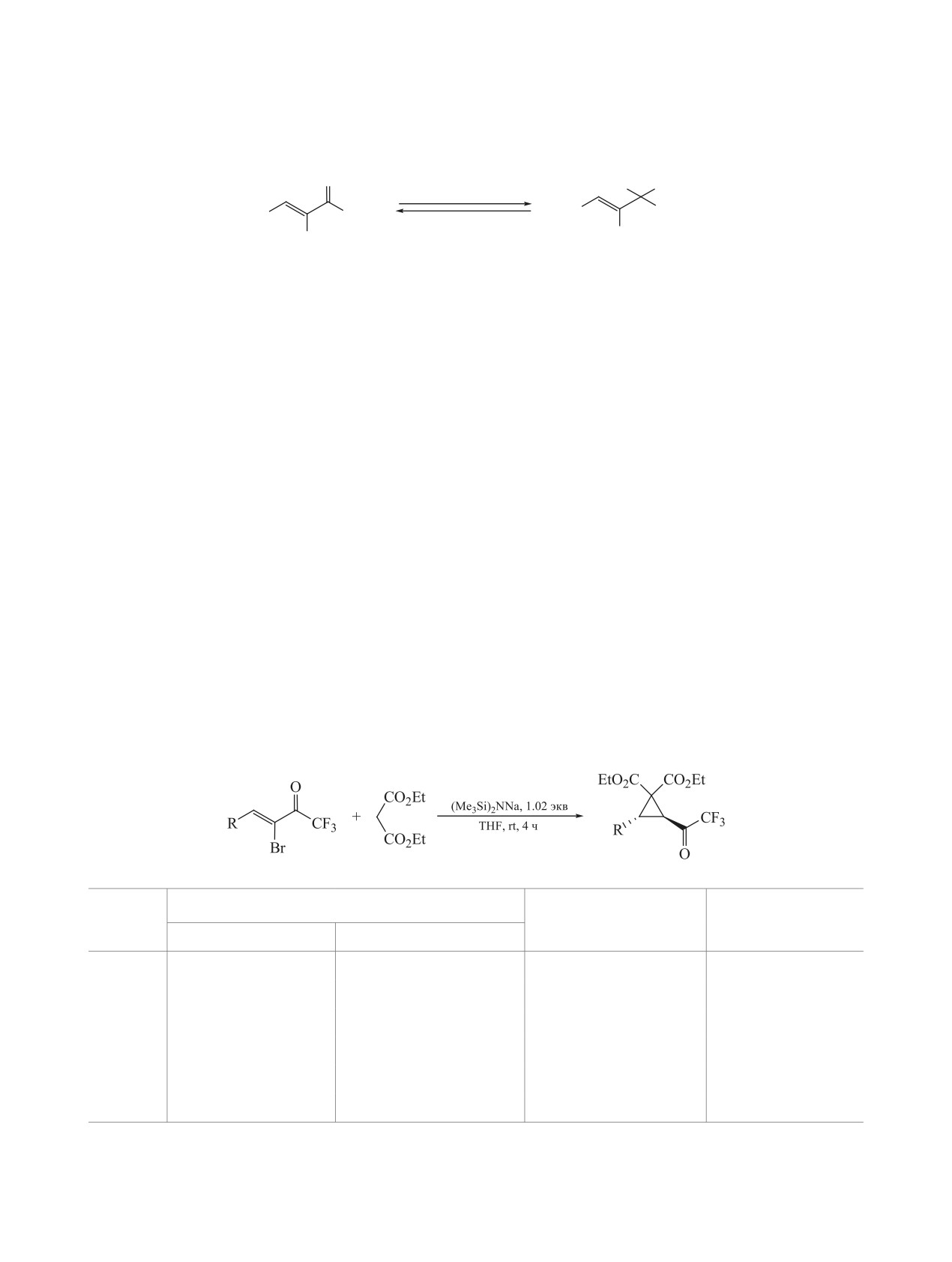
Используя оптимальные условия, мы вве-
однозначно доказана с помощью 1D и 2D ЯМР
ли в реакцию различные CF3-α-броменоны 1a-f
спектроскопии. Так, константа спин-спинового
(табл. 2). В результате были получены 3-(трифтор-
взаимодействия между вицинальными протонами
ацетил)циклопропаны 3a-f с выходами от умерен-
карбоцикла составляет около 7.2 Гц, что соответ-
ных до высоких.
ствует конфигурации транс-изомера [11]. Кроме
Было обнаружено, что выход и конверсия за-
того, в NOESY-спектре отсутствует кросс-пик
висит от природы заместителя в бензольном
между этими протонами.
кольце. Так, в случае CF3-броменона 1b с донор-
Мы попытались ввести в эту реакцию дру-
ным (MeO)-заместителем в арильном фрагменте
гие производные малоновой кислоты, а именно
(табл. 2, строка 2) конверсия исходного не превы-
этил-2-цианоацетат 2b и малононитрил 2c. Однако
шает 75%, что может объяснять невысокий выход
в обоих случаях в результате образовывалась смесь
циклопропана 3b. Неполная конверсия также на-
неидентифицируемых продуктов. К сожалению,
блюдалась и для броменонов 1e (73%) и 1f (79%),
нам не удалось подобрать условия для получения
содержащих стерически объёмные
5-бром-за-
целевых циклопропанов в этом случае.
мещённые гетероциклы (табл. 2, строки 5 и 6).
Наконец, енон 1d с электроноакцепторной нитро-
Механизм сборки циклопропанов довольно
группой в бензольном кольце (табл. 2, строка 4)
прост (схема 2). Сильное основание активирует
даёт циклопропан с лучшим выходом.
нуклеофил, акцептируя протон от метиленовой
Таблица 2. Синтез 3-(трифторацетил)циклопропанов 3.
1a-f
2a
trans-3a-f
CF3-α-Броменон
№
Продукт
Выхода, %
1
R1
1
1a
Ph
3a
55
2
1b
4-MeOC6H4
3b
41
3
1c
4-ClC6H4
3c
57
4
1d
4-NO2C6H4
3d
74
5
1e
5-бромтиенил-2
3e
46
6
1f
5-бромфурил-2
3f
59
a Выход выделенного продукта.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
ОДНОРЕАКТОРНЫЙ СИНТЕЗ 3-(ТРИФТОР
АЦЕТИЛ)ЦИКЛОПРОПАН-1,1-ДИКАРБОКСИЛАТОВ
1413
Схема 2. Предполагаемый механизм образования циклопропанов 3.
B
R
R
R
R
-BH+
2a
R
R
R
R
EtO
2C
CO2Et
O
R
R
O
BH+
H Ar
CF3
Ar
CF3
-HBr
Ar
CF
3
Ar
F3COC
H
Br
Br
O
Br
1
5
6
trans-3
R = CO2Et.
группы малоната 2a. Далее происходит сопряжён-
1H и 77.2 м.д. для 13C) как внутренних стандартов.
ное нуклеофильное присоединение (интермеди-
Константы спин-спинового взаимодействия (J)
аты 5 и 6) с последующим внутримолекулярным
даны в Герцах (Гц). ИК спектры записаны на спек-
нуклеофильным замещением брома этим же ну-
трометрах Bruker Vertex 70 FT-IR и portable Varian
клеофильным центром с замыканием циклопро-
3100 diamond ATR/FT-IR. Анализы GC/MS выпол-
панового цикла 3. Трифторметильная группа как
нены на спектрометре Shimadzu GCMS-QP5050A
сильный электроноакцептор повышает стабиль-
instrument (EI, 70 эВ).
ность интермедиатов 5 и 6, что оказывает вли-
Для колоночной хроматографии были исполь-
яние на скорость реакции (2-5 ч против 13-78 ч
зован сорбент силикагель (коммерческий продукт
для ациклических нефторированных аналогов
Alfa Aesar) с размером частиц 70-230 меш.
[9, 11]). Судя по всему, интермедиат 6 (замести-
тели Ar и COCF3 находятся в транс-положении)
Растворители и реагенты были высушены по
термодинамически более стабилен (в сравнении с
стандартным методикам и/или перегнаны перед
интермедиатом с цис-расположением арильного и
использованием. CF3-α-Броменоны 1a-f получены
трифторацильного фрагментов) ввиду отсутствия
бромированием соответствующих енонов и после-
стерических факторов, чем и обусловлено преиму-
дующим дегидробромированием по общей мето-
щественное образование транс-изомера 3.
дике [17, 18].
Таким образом, мы предложили простой одно-
Синтез
3-(трифторацетил)циклопропанов.
реакторный способ получения 3-(трифторацетил)-
К раствору диэтилмалоната 2a (84-86 мг, 0.53-
циклопропан-1,1-дикарбоксилатов - донорно-ак-
0.54 ммоль) в 3.5 мл ТГФ по каплям при переме-
цепторных циклопропанов, содержащих в струк-
шивании прибавляли 2 М раствор (Me3Si)2NNa
туре акцепторную трифторацетильную группу. По
в ТГФ (0.26 мл, 0.52 ммоль). Реакционная смесь
сравнению с нефторированными аналогами, реак-
перемешивалась при rt в течение 30 мин, затем
к ней по каплям при перемешивании прибавля-
ции CF3-броменонов с диэтилмалонатом, как пра-
вило, протекают за более короткое время, при этом
ли раствор CF3-α-броменона 1 (0.5 ммоль) в 4 мл
выделяемые циклопропаны образуются в виде од-
ТГФ. Реакционная смесь перемешивалась при rt
ного транс-диастереомера.
в течение 4 ч. В реакционную смесь прибавляли
7.5 мл н-гексана, полученный раствор пропуска-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ли через короткий слой силикагеля и промывали
Спектры ЯМР 1H (400.1 МГц), 13C (100.6 МГц)
диэтиловым эфиром, чтобы избавиться от солей.
и 19F (376.5 МГц) записаны на спектрометре
Растворитель упарили, сырой продукт очищали
Bruker AVANCE 400 MHz. Химические сдвиги
колоночной хроматографией (силикагель, элюент
(δ) приведены в м.д. с использованием остаточ-
диэтиловый эфир-гексан,
1:2). Циклопропаны
ных сигналов растворителя CDCl3 (7.24 м.д. для
3a-f были получены по этой методике.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1414
РОМАНОВ и др.
Диэтил-3-(2,2,2-трифторацетил)-2-фенил-
319 (15), 297 (24), 296 (12), 295 (71), 275 (24), 267
циклопропан-1,1-дикарбоксилат
(3a). Светло-
(14), 246 (10), 223 (31), 222 (14), 221 (100), 193 (25),
жёлтое масло, выход 98 мг (55%). ИК спектр
178 (10), 151 (15), 149 (46), 141 (16), 139 (27), 125
(плёнка) ν, см-1: 1737 (C=O), 1178, 1156 (C-F).
(10), 115 (21), 114 (16), 113 (13), 74 (12). Найдено,
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.92 т (3H, CH3,
%: C 51.77; H 4.38. C17H16ClF3O5S. Вычислено, %:
J 7.0 Гц), 1.22 т (3H, CH3, J 7.0 Гц), 3.72 к (2H,
C 51.99; H 4.11.
CH2, J 7.0 Гц), 3.89-3.98 м (2H, C2H, C3H), 4.21 к
Диэтил-2-(4-нитрофенил)-3-(2,2,2-трифтор-
(2H, CH2, J 7.0 Гц), 7.16-7.29 м (5H, Ph). Спектр
ацетил)циклопропан-1,1-дикарбоксилат
(3d).
ЯМР 13C (CDCl3), δ, м.д.: 13.9 (CH3), 14.0 (CH3),
Белые кристаллы, т.пл. 88-89°C, выход 149 мг
32.2 (C2), 38.2 (C3), 47.6 (C1), 62.6 (CH2), 62.7
(74%). ИК спектр (плёнка), ν, см-1: 1737 (C=O),
(CH2), 115.6 к (CF3, J 290.7 Гц), 128.4, 128.6, 128.7,
1188, 1158 (C-F). Спектр ЯМР 1Н (CDCl3), δ, м.д.:
132.0 (Ph), 164.4, 164.8 (C1C=O), 186.5 к (C3C=O, J
1.03 т (3H, CH3, J 7.1 Гц), 1.26 т (3H, CH3, J 7.1 Гц),
37.5 Гц). Спектр ЯМР 19F (CDCl3), δ, м.д.: -78.5
3.79 к (2H, CH2, J 7.7 Гц), 3.92-4.07 м (2H, C2H,
(CF3). Масс-спектр, m/z (Iотн, %): 358 (<1) [M]+, 262
C3H), 4.25 к (2H, CH2, J 7.1 Гц), 7.42 д (2Hаром, J
(11), 261 (71), 241 (23), 233 (11), 188 (13), 187 (100),
8.4 Гц), 8.16 д (2Hаром, J 8.8 Гц). Спектр ЯМР 13C
170 (9), 159 (26), 131 (11), 116 (12), 115 (51), 105
(CDCl3), δ, м.д.: 14.0 (CH3), 14.0 (CH3), 32.3 (C2),
(26), 91 (15), 77 (10).
36.9 (C3), 47.5 (C1), 63.0 (CH2), 63.1 (CH2), 115.5
Диэтил-2-(4-метоксифенил)-3-(2,2,2-три-
к (CF3, J 290.4 Гц), 123.9, 129.8, 139.3, 148.0 (Ar),
фторацетил)циклопропан-1,1-дикарбоксилат
164.0, 164.1 (C1C=O), 185.8 к (C3C=O, J 37.8 Гц).
(3b). Жёлтое масло, выход 80 мг (41%). ИК спектр
Спектр ЯМР 19F (CDCl3), δ, м.д.: -78.5 c (CF3).
(плёнка), ν, см-1: 1735 (C=O), 1178, 1156 (C-F).
Масс-спектр, m/z (Iотн, %): 403 (<1) [M]+, 330 (3),
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.01 т (3H, CH3,
307 (13), 306 (75), 286 (15), 278 (26), 258 (11), 250
J 7.1 Гц), 1.26 т (3H, CH3, J 7.1 Гц), 3.67-3.73 м
(10), 233 (14), 232 (100), 204 (18), 180 (9), 152 (12),
(2H, CH2), 3.76 с (3H, OCH3), 3.94-4.04 м (2H, C2H,
150 (18), 115 (15), 114 (20), 113 (11), 102 (16), 63
C3H), 4.24 к (2H, CH2, J 7.1 Гц), 6.82 д (2Hаром, J
(10).
8.7 Гц), 7.15 д (2Hаром, J 8.5 Гц). Спектр ЯМР 13C
Диэтил-2-(5-бромтиенил-2)-3-(2,2,2-три-
(CDCl3), δ, м.д.: 14.0 (CH3), 14.0 (CH3), 32.5 (C2),
фторацетил)циклопропан-1,1-дикарбоксилат
37.8 (C3), 47.7 (C1), 55.4 (OCH3), 62.6 (CH2), 62.7
(3e). Светло-жёлтое масло, выход 101 мг (46%).
(CH2), 115.6 к (CF3, J 290.8 Гц), 114.1, 124.0, 129.8,
ИК спектр (плёнка), ν, см-1: 1739 (C=O), 1157
159.7 (Ar), 164.5, 164.9 (C1C=O), 186.5 к (C3C=O,
(C-F). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.12 т (3H,
J 37.3 Гц). Спектр ЯМР 19F (CDCl3), δ, м.д.: -78.5
CH3, J 7.2 Гц), 1.24 т (3H, CH3, J 7.1 Гц), 3.63-3.71
(CF3).
м (2H, C2H, C3H), 4.11 к (2H, CH2, J 7.0 Гц), 4.22
Диэтил-3-(2,2,2-трифторацетил)-2-(4-хлор-
к (2H, CH2, J 7.0 Гц), 6.68 д.д (1H, тиенил-2, J 3.8,
фенил)циклопропан-1,1-дикарбоксилат
(3c).
1.0 Гц), 6.87 д (1H, тиенил-2, J 3.8 Гц). Спектр ЯМР
Коричневое масло, выход 112 мг (57%). ИК спектр
13C (CDCl3), δ, м.д.: 14.0 (CH3), 14.0 (CH3), 32.2
(плёнка), ν, см-1: 1738 (C=O), 1156, 1187 (C-F).
(C2), 33.6 (C3), 47.7 (C1), 62.9 (CH2), 63.1 (CH2),
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.02 т (3H, CH3,
115.5 к (CF3, J 290.6 Гц), 112.5, 128.1, 129.9, 136.0
J 7.1 Гц), 1.25 т (3H, CH3, J 7.1 Гц), 3.67-3.74 м
(тиенил-2), 163.9, 164.1 (C1C=O), 185.5 к (C3C=O,
(2H, C2H, C3H), 3.95-4.06 м (2H, CH2), 4.24 к
J 37.9 Гц). Спектр ЯМР 19F (CDCl3), δ, м.д.: -78.4 c
(2H, CH2, J 7.1 Гц), 7.17 д (2Hаром, J 8.4 Гц), 7.27
(CF3). Масс-спектр, m/z (Iотн, %): 444 (18) [M + 1]+,
д (2Hаром, J 8.4 Гц). Спектр ЯМР 13C (CDCl3), δ,
442 (20) [M - 1]+, 371 (54), 370 (29), 369 (53), 368
м.д.: 14.0 (CH3), 14.0 (CH3), 32.3 (C2), 37.3 (C3),
(22), 327 (24), 326 (26), 325 (99), 324 (33), 323 (100),
47.6 (C1), 62.8 (CH2), 63.1 (CH2), 115.6 к (CF3, J
301 (47), 299 (47), 298 (34), 273 (96), 272 (61), 271
290.6 Гц), 128.9, 130.0, 130.6, 134.4 (Ar), 164.3,
(84), 246 (39), 245 (43), 243 (24), 218 (43), 205 (30),
164.5 (C1C=O), 186.3 к (C3C=O, J 37.9 Гц). Спектр
203 (35), 199 (76), 193 (26), 191 (30), 189 (30), 178
ЯМР 19F (CDCl3), δ, м.д.: -78.5 c (CF3). Масс-
(20), 177 (21), 166 (21), 165 (30), 149 (31), 148 (38),
спектр, m/z (Iотн, %): 394 (<1) [M + 2]+, 392 (1) [M]+,
121 (54), 120 (58), 119 (32), 108 (38), 95 (35), 82
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
ОДНОРЕАКТОРНЫЙ СИНТЕЗ 3-(ТРИФТОР
АЦЕТИЛ)ЦИКЛОПРОПАН-1,1-ДИКАРБОКСИЛАТОВ
1415
(21), 63 (59), 45 (65). Найдено, %: C 40.70; H 3.31.
2.
Schneider T.F., Kaschel J., Werz D.B. Angew.
C15H14BrF3O5S. Вычислено, %: C 40.65; H 3.18.
Chem. Int. Ed. 2014, 53, 5504-5523. doi 10.1002/
anie.201309886
Диэтил-2-(5-бромфурил-2)-3-(2,2,2-трифтор-
3.
Cavitt M.A., Phun L.H., France S. Chem. Soc. Rev.
ацетил)циклопропан-1,1-дикарбоксилат
(3f).
2014, 43, 804-818. doi 10.1039/c3cs60238a
Коричневое масло, выход 126 мг (59%). ИК спектр
4.
Thangamani M., Srinivasan K. J. Org. Chem. 2018, 83,
(плёнка), ν, см-1: 1740 (C=O), 1199, 1158 (C-F).
571-577. doi 10.1021/acs.joc.7b02335
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.16 т (3H, CH3, J
5.
Yang G., Shen Y., Li K., Sun Y., Hua Y. J. Org. Chem.
7.2 Гц), 1.24 т (3H, CH3, J 7.2 Гц), 3.58-3.66 м (2H,
2011, 76, 229-233. doi 10.1021/jo1020773
C2H, C3H), 4.15 к (2H, CH2, J 7.2 Гц), 4.21 к (2H,
6.
Ivanov K.L., Bezzubov S.I., Melnikova M.Ya.,
CH2, J 7.2 Гц), 6.22 с (2H, фуранил-2). Спектр ЯМР
Budynina E.M. Org. Biomol. Chem. 2018, 16, 3897-
13C (CDCl3), δ, м.д.: 14.0 (CH3), 14.1 (CH3), 29.5
3909. doi 10.1039/c8ob00377g
(C2), 32.4 (C3), 46.3 (C1), 63.0 (CH2), 63.1 (CH2),
7.
Pagenkopf B.L., Vemula N. Eur. J. Org. Chem. 2017,
115.4 к (CF3, J 290.5 Гц), 112.2, 112.7, 122.0, 148.3
2017, 2561-2567. doi 10.1002/ejoc.201700201
(фуранил-2), 164.0, 164.0 (C1C=O), 185.3 к (C3C=O,
8.
Grover H.K., Emmett M.R., Kerr M.A. Org. Biomol.
J 37.9 Гц). Спектр ЯМР 19F (CDCl3), δ, м.д.: -78.4
Chem. 2015, 13, 655-671. doi 10.1039/c4ob02117g
(CF3). Масс-спектр, m/z (Iотн, %): 428 (6) [M + 1]+,
9.
Arai S., Nakayama K., Hatano K., Shioiri T. J. Org.
426 (6) [M - 1]+, 382 (16), 380 (14), 355 (90), 354
Chem. 1998, 63, 9572-9575. doi 10.1021/jo981409y
(21), 353 (88), 337 (23), 331 (25), 329 (24), 327 (43),
10.
Mekonnen A., Carlson R. Synthesis. 2006, 2006, 1657-
325 (33), 311 (20), 310 (26), 309 (31), 308 (17), 307
1663. doi 10.1055/s-2006-926459
(15), 301 (58), 299 (13), 297 (14), 285 (40), 283 (51),
11.
Sun Y., Yang G., Shen Y., Hua Z., Chai Z. Tetrahedron.
282 (29), 281 (17), 280 (28), 273 (56), 257 (90), 256
2013, 69, 2733-2739. doi 10.1016/j.tet.2013.02.011
(53), 255 (100), 245 (33), 230 (28), 229 (77), 227 (38),
12.
Shen Y., Chai J., Yang G., Chen W., Chai Z.
217 (43), 213 (14), 211 (13), 205 (44), 203 (21), 202
J. Org. Chem. 2018, 83, 12549-12558. doi 10.1021/
(29), 201 (35), 189 (59), 187 (43), 185 (61), 183 (67),
acs.joc.8b01798
177 (53), 175 (40), 161 (16), 159 (17), 157 (22), 155
13.
Wang Y., Zhao X., Li Y., Lu L. Tetrahedron Lett. 2004,
(26), 149 (52), 147 (16), 145 (21), 143 (16), 133 (41),
45, 7775-7777. doi 10.1016/j.tetlet.2004.08.064
132 (19), 131 (19), 121 (39), 120 (20), 105 (33), 103
14.
Faigl F., Dévényi T., Laukó A., Töke L. Tetrahedron.
(32), 92 (28), 79 (42), 77 (36), 76 (82), 75 (74), 69
1997,
53,
13001-13008. doi
10.1016/S0040-
(49), 65 (33), 64 (19), 63 (34), 53 (45), 51 (93), 50
4020(97)00824-7
(63), 39 (24), 38 (29). Найдено, %: C 42.13; H 3.22.
15.
Winter M., Gaunersdorfer C., Roiser L., Zielke K.,
C15H14BrF3O6. Вычислено, %: C 42.18; H 3.30.
Monkowius U., Waster M. Eur. J. Org. Chem. 2018,
БЛАГОДАРНОСТИ
2018, 418-421. doi 10.1002/ejoc.201701699
16.
Shimizu M., Hiyama T. Angew. Chem. Int. Ed. 2005,
Работа выполнена с использованием оборудо-
44, 214-231. doi 10.1002/anie.200460441
вания Байкальского аналитического центра кол-
лективного пользования СО РАН.
17.
Rulev A.Yu., Ushakov I.A., Nenajdenko V.G.,
Balenkova E.S., Voronkov M.G. Eur. J. Org. Chem.
ФОНДОВАЯ ПОДДЕРЖКА
2007, 2007, 6039-6045. doi 10.1002/ejoc.200700606
Работа выполнена при поддержке Российского
18.
Rulev A.Yu., Ushakov I.A., Nenajdenko V.G.
фонда фундаментальных исследований (грант
Tetrahedron.
2008,
64,
8073-8077. doi
10.1016/
j.tet.2008.06.069
№ 18-33-00119 мол_а)
19.
Rulev A.Yu., Muzalevskiy V.M., Kondrashov E.V.,
КОНФЛИКТ ИНТЕРЕСОВ
Ushakov I.A., Romanov A.R., Khrustalev V.N.,
Авторы заявляют об отсутствии конфликта ин-
Nenajdenko V.G. Org. Lett. 2013, 15, 2726-2729. doi
тересов.
10.1021/ol401041f
20.
Rulev A.Yu., Romanov A.R., Kondrashov E.V.,
СПИСОК ЛИТЕРАТУРЫ
Ushakov I.A., Vashchenko A.V., Muzalevskiy V.M.,
1. Reissig H.-U., Hirsch E. Angew. Chem. Int. Ed. 1980,
Nenajdenko V.G. J. Org. Chem. 2016, 81, 10029-
19, 813-814. doi 10.1002/anie.198008131
10034. doi 10.1021/acs.joc.6b01927
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1416
РОМАНОВ и др.
21. Rulev A.Yu., Romanov A.R., Kondrashov E.V.,
22. Romanov A.R., Cahard D., Rulev A.Yu. Eur.
Ushakov I.A., Muzalevskiy V.M., Nenajdenko V.G.
J. Org. Chem. 2019, 2019, 2143-2149. doi 10.1002/
Eur. J. Org. Chem. 2018, 2018, 4202-4210. doi
10.1002/ejoc.201800659
ejoc.201900155
One-Pot Synthesis
of 3-(Trifluoroacetyl)cyclopropane-1,1-dicarboxylates
A. R. Romanov*, A. V. Mareev, A. V. Popov, and S. V. Zinchenko
Favorsky Irkutsk Institute of Chemistry SB RAS, 664033, Russia, Irkutsk, ul. Favorskogo 1
*e-mail: romanov@irioch.irk.ru
Received May 15, 2020; revised May 26, 2020; accepted June 2, 2020
The reaction of trifluoromethyl(α-bromoalkenyl)ketones with diethyl malonate leads to formation of 3-(trifluoro-
acetyl)cyclopropane-1,1-dicarboxylates which belong to a group of D-A- (donor-acceptor) cyclopropanes - the
prominent precursors in cycloaddition reactions. The reactions involving CF3-α-bromoenones proceed under
mild conditions and more rapidly in comparison to those with non-fluorinated analogs. The target cyclopropanes
were isolated as a lone trans-isomer.
Keywords: α,β-unsaturated ketones, Michael reaction, domino-reactions, cyclopropanes, CF3-α-bromoenones
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020