ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 9, с. 1454-1464
УДК 547.867
ВНУТРИМОЛЕКУЛЯРНАЯ ГЕТЕРОЦИКЛИЗАЦИЯ
орто-(1-ЦИКЛОАЛКЕНИЛ)АНИЛИНОВ:
III.1 СИНТЕЗ ОПТИЧЕСКИ АКТИВНЫХ
4Н-3,1-БЕНЗОКСАЗИНОВ НА ОСНОВЕ
α-АМИНОКИСЛОТ
© 2020 г. Ш. М. Салиховa, *, Р. Р. Зариповb, **, И. Б. Абдрахмановa
a ФГБУН «Уфимский Институт химии Уфимского федерального исследовательского центра РАН»,
450054, Россия, Республика Башкортостан, г. Уфа, пр. Октября 71
*e-mail: Salikhov@anrb.ru
b ФГБОУ ВО «Башкирский государственный аграрный университет»,
450001, Россия, Республика Башкортостан, г. Уфа, ул. 50-летия Октября 34
**e-mail: zramil87@mail.ru
Поступила в редакцию 08 июня 2020 г.
После доработки 19 июня 2020 г.
Принята к публикации 26 июня 2020 г.
Предлагается новый подход синтеза оптически активных 4H-3,1-бензоксазинов на основе α-аминокислот.
Образованию целевых продуктов предшествуют реакция взаимодействия орто-(циклопент-1-енил)-
анилина и N-Boc-(R)-аминокислот, снятие N-защитной группы и гетероциклизация действием HCl(г).
Ключевые слова: бензоксазины, орто-(циклопент-1-енил)анилин, α-аминокислоты, внутримолекуляр-
ная гетероциклизация.
DOI: 10.31857/S0514749220090189
Известно, что гетероциклические бензоксазины
бридные многофункциональные лекарства», пред-
проявляют различные виды фармакологической и
ставляющие собой соединение двух фармакофоров
биологической активности [1-6]. Они применяют-
в одну молекулу. Часто в качестве дополнительно-
ся в медицине в качестве противосудорожных и
го фармакофора используются аминокислоты [19-
противовирусных препаратов, проявляют транкви-
21]. Методы синтеза 3,1-бензоксазинов на основе
лизирующее, анальгетическое, спазмолитическое,
природных α-аминокислот в литературе не описа-
седативное действие, при низкой токсичности
ны. С целью получения гетероциклических про-
[7-11]. Ранее нами был разработан простой метод
изводных 3,1-бензоксазинов, модифицированных
синтеза 3,1-бензоксазинов и 3,1-бензотиазинов на
остатками аминокислот, в качестве карбонильной
основе о-(циклопент-1-енил)анилина 1 - продук-
компоненты в данной работе были использованы
та амино-перегруппировки Кляйзена и подробно
фталоил (Pht)- или трет-бутоксикарбонил Boc-
изучен механизм образования таких продуктов в
защищенные по аминогруппе оптически активные
α-аминокислоты: (R)-валин, (R)-норлейцин, (R)-
газовой и конденсированной фазе [12-18].
лейцин и (R)-метионин.
В последнее время одним из актуальных на-
Вначале сплавлением фталевого ангидрида с
правлений в медицинской химии являются «ги-
соответствующими α-аминокислотами по [22] с
1 Сообщение II см. [1].
дальнейшей обработкой с SOCl2 были синтезиро-
1454
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ГЕТЕРОЦИКЛИЗАЦИЯ орто-(1-ЦИКЛОАЛКЕНИЛ)АНИЛИНОВ: III.
1455
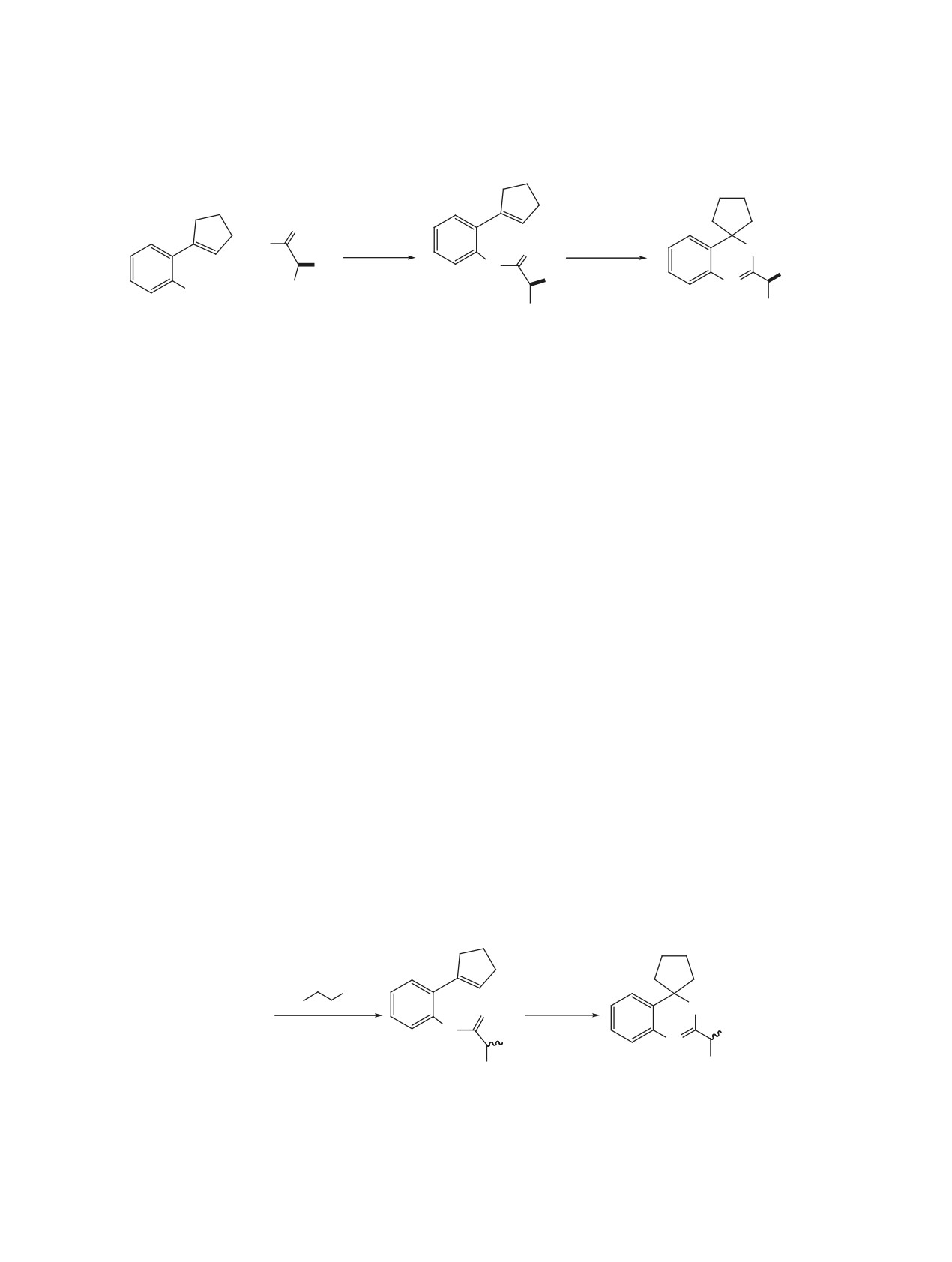
Схема 1.
4'
5'
4'
3'
3
1'
3'
2
CF3CO2H
5'
2'
O
4
5
4
K2CO3
2'
or HCl
4a
Cl
CH2Cl2
1
3
O
or H2O2
6
O
5
+
R
40-91%
N
6
1''
7
1
1''
R
H
R
2
8a
N
PhtN
2''
NH2
8
NPht
NPht
1
(R)-2a-d
(R)-3a-d
4
2, R = i-Pr (a); R = i-Bu (b); R = (CH2)2SMe (c); R = n-Bu (d);
3, R = i-Pr (a); R = i-Bu (b); R = (CH2)2SMe (c); R = n-Bu (d).
ваны хлорангидриды (R)-2a-d. Взаимодействие
с образованием амидов (RS)-5a-d с высокими вы-
(R)-2a-d с орто-(циклопент-1-енил)анилином 1
ходами (81-90%). Однако, оказалось, что при этом
в присутствии К2CO3 и дальнейшая обработка
происходила рацемизация продуктов реакции по
реакционной массы 10%-ным водным раствором
центру С2'', на что указывало отсутствие угла вра-
NaHCO3 привели к образованию амидов (R)-3a-d,
щения.
обладающих оптической активностью (схема 1).
Гетероциклизацию амидов (RS)-5a-d осу-
Энантиомерная чистота продуктов не определя-
ществляли в кислых условиях барботирова-
лась.
нием газообразного HCl в CH2Cl2. После об-
В поисках вариантов внутримолекулярной
работки реакционной массы 10% водным рас-
твором NaHCO3 были выделены рацемические
гетероциклизации амидов 3a-d в качестве элек-
трофильных агентов были использованы HCl,
3,1-бензоксазины (RS)-6a-d с выходами 68-80%
(схема 2). Механизмы образования таких гетеро-
CF3COOH или H2O2. Оказалось, что во всех слу-
циклов подробно обсуждались в [13].
чаях образование целевых 3,1-бензоксазинов 4 не
происходит, вероятно, это связано с электронным
Альтернативным способом получения 3,1-бен-
влиянием фталоильной защитной группы.
зоксазинов с сохранением R-конфигурации цен-
тра С1'' оказалось использование в качестве N-
После снятия защитной группы удалось до-
защитной группы трет-бутоксикарбонила (Boc),
стичь образования 3,1-бензоксазинового гетеро-
которую можно легко удалить в условиях кислот-
цикла. Использование классических методов с
ного гидролиза.
применением гидразина или NaBH4 не дало поло-
жительных результатов. Стадия снятия фталиль-
Boc-аминокислоты (R)-7a-с, полученные по
ной защиты аминогруппы нагреванием в моноэта-
[23], в результате конденсации с о-(циклопент-
ноламине при 80°С в течение 2 ч протекала гладко
1-енил)анилином 1 в присутствии N,N'-дицикло-
Схема 2.
NH2
HCl(g)
HO
CH2Cl2
O
O
(R)-3a-d
80°C, 2 h
68-80%
N
R
81-90%
H
R
N
NH2
NH2
(RS)-5a-d
(RS)-6a-d
5, R = i-Pr (a); R = i-Bu (b); R = (CH2)2SMe (c); R = n-Bu (d);
6, R = i-Pr (a); R = i-Bu (b); R = (CH2)2SMe (c); R = n-Bu (d).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1456
САЛИХОВ и др.
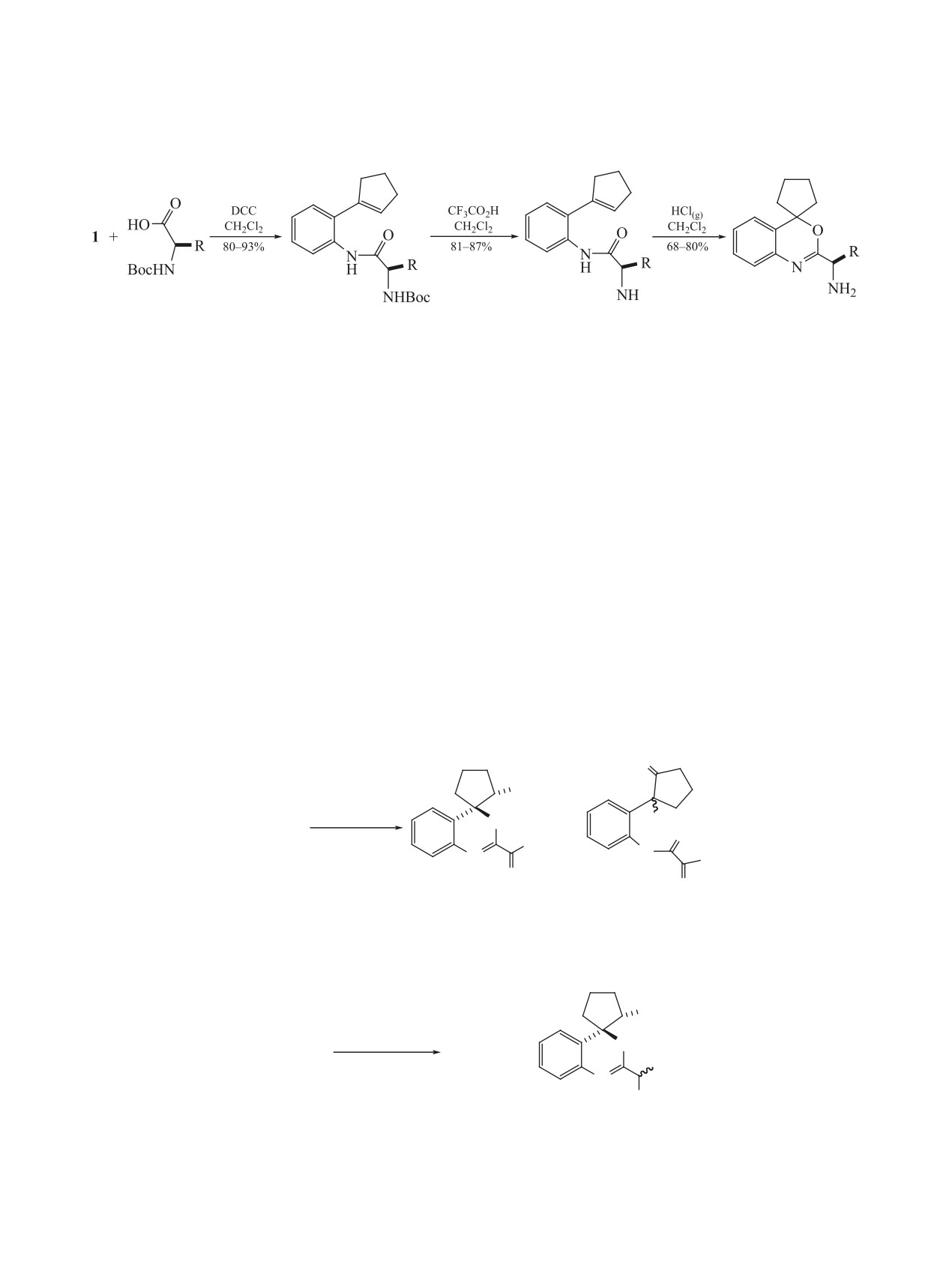
Схема 3.
2
(R)-7a-c
(R)-8a-c
(R)-5a-c
(R)-6a-c
7, R = i-Pr (a); R = i-Bu (b); R = (CH2)2SMe (c);
8, R = i-Pr (a); R = i-Bu (b); R = (CH2)2SMe (c).
гексилкарбодиимида (DCC) привели к соответ-
наблюдаются характеристичные сигналы атомов
ствующим амидам (R)-8a-с. Попытка гетеро-
углерода С1'' (δС 60.2), С4 (δС 88.7) и С2 (δС 163.9).
циклизации полученных амидов действием газо-
А в спектре ЯМР 1Н сигналы протонов Н1'' реги-
образного HCl(г) не увенчалась успехом, а обра-
стрируются при 3.22 м.д. с 3J1''-2'' 5.0 Гц.
ботка с CF3COOH привела только к снятию Boc-
Окислительная гетероциклизация амидов 5a-d
защитной группы с образованием амидов (R)-5a-с.
действием H2O2 протекала по различным направ-
Дальнейшее взаимодействие (R)-5a-с с HCl(г) в
лениям с образованием смеси оптически неактив-
CH2Cl2 и последующая обработка 10%-ным рас-
ных продуктов. Так, взаимодействие (RS)-5a-d
твором NaHCO3 привели к целевым оптически
или (R)-5a-d с 2 экв H2O2 в MeCN при рН 8 при-
активным 3,1-бензоксазинам (R)-6a-с с выходами
водило к возникновению гетероциклических N-
68-80% (схема 3).
оксимов 9a-с и рацемических кетонов (RS)-10a-с
Структуры синтезированных соединений пол-
в виде смеси, в соотношении 9:1, что было уста-
ностью охарактеризованы методами ЯМР 1Н и 13С
новлено по данным спектров ЯМР 1Н (схема 4).
(COSY, HSQC, HMBC). Анализ спектров ЯМР со-
Попытки препаративного разделения смеси ок-
единения (S)-6а показал, что в спектре ЯМР 13С
симов 9 и кетонов 10 с помощью хроматографии
Схема 4.
O
OH
2 equiv H2O2
(RS)-5a-d
MeCN
O
H
+
or (R)-5a-d
20-54%
O
R
N
N
R
H
NOH
NOH
9a-c
(RS)-10a-c
9, R = i-Pr (a); R = i-Bu (b); R = n-Bu (c);
10, R = i-Pr (a); R = i-Bu (b); R = n-Bu (c).
OH
3.5 equiv H2O2
(RS)-5a
MeCN
O
9a + 10a +
or (R)-5a
i-Pr
N
NO2
(RS)-11, 20%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ГЕТЕРОЦИКЛИЗАЦИЯ орто-(1-ЦИКЛОАЛКЕНИЛ)АНИЛИНОВ: III.
1457
были безуспешными. Вероятно, неполное окисле-
3-метилбутанамид
(3a). К раствору
860 мг
ние аминогруппы в оксимную [24] в бензоксазинах
(3.2 ммоль) хлорангидрида 2а и 662 мг (4.8 ммоль)
9a-c происходило одновременно с гетероцикли-
К2СО3 в 15 мл СН2Cl2 при перемешивании добав-
зацией, а образование кетонов 10a-с - результат
ляли 514 мг (3.2 ммоль) орто-(циклопент-1-енил)-
конкурентной реакции окисления двойной связи.
анилина 1, реакционную смесь перемешивали при
Попытки гетероциклизации серосодержащего
комнатной температуре. После окончания реак-
амида 5с в аналогичных условиях сопровождались
ции (контроль методом ТСХ, элюент петролейный
образованием сложной смеси неразделимых про-
эфир-этилацетат, 5:1) осадок отфильтровывали и
дуктов.
промывали СН2Cl2 (2×10 мл), фильтрат промыва-
ли H2O (2×10 мл), 10% водным раствором Na2CO3
При гетероциклизации амида (RS)-5a или (R)-
(1×10 мл) и органическую фазу сушили MgSO4.
5a с 3.5 экв H2O2 в аналогичных условиях в ре-
После удаления растворителя при пониженном
акционной смеси, кроме ожидаемых оксимов 9a
давлении продукт выделяли колоночной хрома-
и 10a, обнаружен рацемический 3,1-бензоксазин
тографией на SiO2 (элюент петролейный эфир-
(RS)-11, в котором аминогруппа подвергнута окис-
этилацетат, 3:1). Выход 113.3 г (73%), коричневое
лению до нитрогруппы.
масло, [α]D20 +30.2 (с 0.0036, CHCl3). Спектр ЯМР
Строение соединений было подтверждено дан-
1H, δ, м.д. (J, Гц): 0.94 д (3H, CH3, 3J5''-3'' 6.7), 1.22
ными ЯМР и хроматомасс-спектроскопии. Так, в
д (3H, CH3, 3J4''-3'' 6.7), 1.99-2.09 м (2H, H5'A, H5'B),
спектре ЯМР 13С бензоксазина 9b наблюдаются
2.53-2.58 м (2H, H3'A, H3'B), 2.63-2.67 м (2H, H4'A,
характеристичные сигналы атомов углерода С2' (δС
H4'B), 2.96-3.04 м (1H, H3''), 4.55 д (1H, H2'', 3J2''-3''
75.7), С4 (δС 90.6), С1'' (δС 153.9) и С2 (δС 154.7).
11.1), 5.83 т (1H, H2', 3J2'-3' 1.9), 7.11 т (1H, H4, 3J4-5
А в спектре ЯМР 13С кетона 10b регистрируются
7.6, 3J4-3 7.6), 7.19 д.д (1H, H3, 3J3-4 7.6, 3J3-5 1.2),
характеристичные сигналы атомов углерода С1'
7.25 д.д.д (1H, H5, 3J5-6 8.2, 3J5-4 7.6, 4J5-3 1.2),
(δС 51.5), С2'' (δС 154.7), С1'' (δС 162.4) и С2' (δС
7.79-7.83 м (2H, Pht), 7.91-7.94 м (2H, Pht), 8.27
220.6), что согласуется с литературными данными
д (1H, 6-CH, 3J6-5 8.2), 8.70 уш.с (1H, NH). Спектр
[25-27].
ЯМР 13C, δ, м.д.: 19.53 (C5''), 20.09 (C4 ), 23.46
(C5'), 27.20 (C3''), 37.80 (C3'), 37.01 (C4'), 63.64 (C2''),
На основе орто-(циклопент-1-енил)анилина 1
и N-Boc-аминокислот получены новые оптически
121.35 (C6), 123.71 (CPht), 124.12 (C4), 127.57 (C5),
127.94 (C3), 129.51 (C2), 131.24 (C2’), 131.34 (C1),
активные 3,1-бензоксазины, перспективные в пла-
134.49 (CPht), 134.54 (CPht), 140.13 (C1'),
166.49
не изучения их биологических свойств.
). Найдено, %: С 74.25; Н 6.21; N
(C1''), 168.15 (CPht
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
7.15. C24H24N2O3. Вычислено, %: С 74.22; Н 6.18;
Спектры ЯМР 1Н, 13С и 15N записаны на
N 7.21.
спектрометре Bruker Avance III 500 МГц (500,
(2R)-N-(2-Циклопент-1-ен-1-илфенил)-2-
125 и 51 МГц) в CDCl3, внутренний стандарт -
(1,3-диоксо-1,3-дигидро-2Н-изоиндол-2-ил)-
остаточные сигналы растворителя. Масс-спектры
4-метилпентанамид (3b) получали по методи-
соединений записаны на приборе Thermo Finnigan
ке синтеза соединения 3а из 1.902 г (6.8 ммоль)
MAT 95 XP при температуре источника ионов
хлорангидрида 2b и 1.076 г (6.8 ммоль) орто-
200°С и энергии ионизирующих электронов
(циклопент-1-енил)анилина 1. Выход 2.48 г (91%),
70 эВ. Элементный анализ выполнен на СНNS(O)-
коричневое масло, [α]D20 +10.3 (с 0.0028, CHCl3).
анализаторе Евро-2000. Для аналитической
Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.98 д (3H, CH3,
ТСХ использованы пластины Sorbfil марки
3J5''-3'' 5.8), 1.07 д (3H, CH3, 3J4''-3'' 5.8), 1.38-1.41 м
ПТСХ-АФ-А, изготовитель ЗАО «Сорбполимер»
(1H, H2''A), 1.80-1.83 м (1H, H2''B), 1.83-1.86 м (1H,
(Краснодар, Россия). Колоночная хроматография
H3''), 1.98-2.04 м (2H, H5'), 2.53-2.59 м (2H, H3'A,
проведена с использованием силикагеля Macherey-
H3'B), 2.58-2.63 м (2H, H4'A, H4'B), 4.21 д.д (1H, H1'',
Nagel 60 (размер частиц 0.063-0.2 мм).
3J1''-2''a 7.9, 3J1''-2''b 1.9), 5.86 т (1H, H2', 3J2'-3' 2.0),
(2R)-N-(2-Циклопент-1-ен-1-илфенил)-2-
7.18 д.д (1H, H4, 3J4-5 7.6, 3J4-3 7.6), 7.21 д.д (1H,
(1,3-диоксо-1,3-дигидро-2Н-изоиндол-2-ил)-
H3, 3J3-4 7.6, 4J3-5 1.3), 7.23 д.д.д (1H, H5, 3J5-6 8.2,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1458
САЛИХОВ и др.
3J5-4 7.6, 3J5-3 1.3), 7.80-7.84 м (2H, Pht), 7.92-7.96
3J2'-3' 1.8), 7.09 т (1Н, H4, 3J4-5 7.5, 3J4-3 7.5), 7.15
м (2H, Pht), 8.31 д (1H, H6, 3J6-5 8.2), 8.80 уш.с (1Н,
д.д (1Н, H3, 3J3-4 7.5, 4J3-5 1.4), 7.26 д.д.д (1Н, H5,
NH). Спектр ЯМР 13C, δ, м.д.: 21.18 (C4''), 23.27
3J5-6 8.3, 3J5-4 7.5, 4J5-3 1.4), 7.80-7.84 м (2Н, Pht),
(C3'), 23.87 (C5''), 24.61 (C2''), 25.19 (C3''),
33.17
7.92-7.96 м (2Н, Pht), 8.30 уш.с (1Н, NH), 8.38 д
(C4'), 36.31 (C5'), 45.25 (C2''), 59.46 (C1''),
120.91
(1Н, H6, 3J6-5 8.3). Спектр ЯМР 13C, δ, м.д.: 13.83
(C6), 123.12 (С4), 123.91 (CPht), 127.57 (C5), 127.98
(C6''), 22.14 (C5''), 23.31 (C4'), 27.98 (C3''), 28.51
(C3), 129.12 (C2), 131.02 (C2'), 132.12 (C1), 134.56
(C4''), 33.60 (C5'), 36.95 (C3'), 55.32 (C2''), 120.50
(CPht), 135.27 (CPht), 141.12 (C1'), 167.81 (C=O),
(C6), 123.69 (CPht), 123.94 (C4), 127.60 (C3), 127.72
168.24 (CPht). Найдено, %: С 68.52; Н 5.67; N 6.69.
(C5), 130.73 (C2'), 131.51 (CPht), 134.28 (C2), 134.55
C24H24N2O2S. Вычислено, %: С 68.57; Н 5.71; N
(CPht), 140.63 (C1), 166.66 (C=O), 167.86 (CPht).
6.66.
Найдено, %: С 74.52; Н 6.41; N 6.99. C25H26N2O3.
Вычислено, %: С 74.62; Н 6.46; N 6.96.
(2R)-N-(2-Циклопент-1-ен-1-илфенил)-2-
(1,3-диоксо-1,3-дигидро-2Н-изоиндол-2-ил)-4-
2-Амино-N-(2-циклопент-1-ен-1-илфенил)-3-
(метилтио)бутанамид (3c) получали по методике
метилбутанамид (5a). а. К 100 мг (0.26 ммоль)
синтеза соединения 3а из 2.57 г (9.2 ммоль) хло-
амида 3а добавляли 200 мг (3.27 моль) моноэта-
рангидрида 2с и 1.46 г (9.2 ммоль) орто-(цикло-
ноламина и смесь нагревали в течение 2 ч при
пент-1-енил)анилина 1. Выход 2.32 г (60%), корич-
температуре 80°С. После окончания реакции (кон-
невое масло, [α]D20 +20.5 (с 0.0046, CHCl3). Спектр
троль методом ТСХ) в реакционную массу добав-
ЯМР 1H, δ, м.д. (J, Гц): 1.65-1.74 м (1H, H3'A),
ляли 10 мл H2O и экстрагировали этилацетатом
1.76-1.83 м (1H, H3'B), 2.06 с (3H, CH3), 2.12-2.17
(3×10 мл). После удаления растворителя при по-
м (2Н, H4'A, H4'B), 2.46-2.58 м (4Н, H5'A, H5'B, H4''A,
ниженном давлении остаток разделяли колоноч-
H4''B), 2.58-2.65 м (2Н, H3''A, H3''B), 5.12 д.д (1H,
ной хроматографией на SiO2 (элюент петролейный
H2'', 3J2''-3''a 9.3, 3J2''-3''a 5.7), 5.63 т (1H, H2', 3J2'-3'
эфир-этилацетат, 4:1). Выход (RS)-5a 62 мг (93%),
1.9), 7.03 т (1H, H4, 3J4-3 7.6, 3J4-5 7.6), 7.09 д.д (1H,
коричневое масло.
H3, 3J3-4 7.6, 3J3-5 1.3), 7.20 д.д.д (1H, H5, 3J5-6 8.2,
б. К раствору 90 мг (0.25 ммоль) амида 7а
3J5-4 7.6, 3J5-3 1.3), 7.75-7.78 м (2Н, Pht), 7.86-7.90
в 5 мл CH2Cl2 добавляли 0.13 мл (1.75 ммоль)
м (2Н, Pht), 8.14 уш.с (1Н, NH), 8.32 д (1H, H6, 3J6-5
CF3COOH и перемешивали 3 ч при комнатной
8.2). Спектр ЯМР 13C, δ, м.д.: 15.37 (C6''), 23.24
температуре. После окончания реакции (контроль
(C3'), 27.30 (C3''), 31.03 (C4''), 33.54 (C4'), 36.93 (C5'),
по ТСХ) реакционнную смесь обрабатывали 10%-
53.77 (C2''), 120.37 (C6), 123.74 (CPht), 123.98 (C4),
ным раствором NaHCO3, экстрагировали CH2Cl2
127.58 (C3), 127.72 (C5), 128.34 (C2), 130.69 (C2'),
(2×10 мл), органическую фазу сушили MgSO4.
131.50 (CPht), 134.13 (C1), 134.64 (CPht),
140.59
После удаления растворителя при пониженном
(C1'), 166.13 (C=O), 167.67 (CPht). Найдено, %: С
давлении остаток разделяли колоночной хромато-
74.52; Н 6.41; N 6.99. C25H26N2O3. Вычислено, %:
графией на SiO2 (элюент петролейный эфир-эти-
С 74.62; Н 6.46; N 6.96.
лацетат, 4:1). Выход (R)-5a 55 мг (85%), коричневое
(2R)-N-(2-Циклопент-1-ен-1-илфенил)-2-
масло. Для (R)-5a: [α]D20 +18.7 (с 0.0018, CHCl3).
(1,3-диоксо-1,3-дигидро-2Н-изоиндол-2-ил)гек-
Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.91 д (3H, CH3, 3J
санамид (3d) получали по методике синтеза со-
5.0), 1.09 д (3H, CH3, 3J 5.0), 2.04-2.11 м (2H, H5'A,
единения 3а из 1.30 г (4.65 ммоль) хлорангидрида
H5'B), 2.48-2.52 м (1H, H3''), 2.59-2.63 м (2H, H4'A,
2d и 0.74 г (4.65 ммоль) орто-(циклопент-1-енил)-
H4'B), 2.69-2.74 м (2H, H3'A, H3'B), 3.44 д (1H, H2'',
анилина 1. Выход 0.749 г (40%), коричневое масло,
3J2''-3'' 3.1), 5.96 т (1H, H2', 3J 2.0), 7.10 т.д (1H, H4,
[α]D20 +10.7 (с 0.0032, CHCl3). Спектр ЯМР 1H, δ,
3J4-5 7.6, 3J4-3 7.6, 4J4-6 0.9), 7.23 д.д (1H, H3, 3J3-4
м.д. (J, Гц): 0.92 т (3Н, CH3, 3J 6.9), 1.26-1.46 м
7.6, 4J3-5 1.5), 7.29 д.д.д (1H, H5, 3J5-6 8.2, 3J5-4 7.6,
(4Н, H4''A, H4''B, H5''A, H5''B), 1.79-1.92 м (2Н, H4'A,
3J5-3 1.5), 8.45 д (1H, H6, 3J6-5 8.2), 9.97 уш.c (1Н,
H4'B), 2.26-2.33 м (3Н, H3''A, H5'A, H5'A), 2.36-2.42
NH). Спектр ЯМР 13C, δ, м.д.: 15.93 (C5''), 19.83
м (1Н, H3''B), 2.57-2.63 м (2Н, H3'A, H3'B), 4.95 д.д
(C4''), 23.63 (C5'), 30.83 (C3''), 33.79 (C4'), 36.75 (C3'),
(1Н, H2'', 3J2''-3''A 10.8, 3J2''-3''B 5.4), 5.75 т (1Н, H2',
60.78 (C2''), 120.18 (C6), 123.47 (C4), 127.66 (C5),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ГЕТЕРОЦИКЛИЗАЦИЯ орто-(1-ЦИКЛОАЛКЕНИЛ)АНИЛИНОВ: III.
1459
127.98 (C3), 128.69 (C2), 130.83 (C2'), 134.87 (C1),
(С1), 140.17 (С1'), 172.47 (С=O). Найдено, %: С
140.30 (C1'), 172.39 (C=O). Найдено, %: С 74.52; Н
74.91; Н 8.72; N 10.27. C17H24N2O. Вычислено, %:
8.49; N 10.87. C16H22N2O. Вычислено, %: С 74.41;
С 75.00; Н 8.82; N 10.29.
Н 8.52; N 10.85.
(RS)-2-Амино-N-(2-циклопент-1-ен-1-ил-
2-Амино-N-(2-циклопент-1-ен-1-илфенил)-3-
фенил)гексанамид (5d) получали аналогично по
метилпентанамид (5b) получали аналогично по
методу а из 1.50 г (3.73 ммоль) амида (RS)-3d и
методу а из 2.71 г (6.73 ммоль) амида 3b и 5.42 г
3.0 г (49.18 ммоль) моноэатаноламина. Выход
(88.85 ммоль) моноэатаноламина [выход 1.48 г
0.89 г (88%), коричневое масло. Спектр ЯМР 1H,
(81%)], или по методу б из 1.34 г (0.4 ммоль) ами-
δ, м.д. (J, Гц): 0.91 т (3H, CH3, 3J 3.0), 1.32-1.42 м
да 8b и 2.87 г (25.2 ммоль) CF3COOH [выход 0.83 г
(4H, H4''A, H4''B, H5''A, H5''B), 1.53-1.59 м (1H, H3''A),
(85%)]. Коричневое масло. Для (R)-5b: [α]D20 +32.5
1.89-1.95 м (1H, H3''B), 1.99-2.05 м (2H, H5'A, H5'B),
(с 0.0026, CHCl3). Спектр ЯМР 1H, δ, м.д. (J, Гц):
2.53-2.58 м (2H, H4'A, H4'B), 2.65-2.70 м (2H, H3'A,
0.96 д (3H, CH3, 3J6''-4'' 5.9), 1.00 д (3H, CH3, 3J5''-4''
H3'B), 3.45 д.д (1H, H2'', 3J2''-3''a 8.2, 3J2''-3''b 4.0), 5.92
5.9), 1.39-1.47 м (1H, H3''A), 1.73-1.83 м (2H, H3''B,
т (1H, H2', 3J 2.0), 7.03 т (1H, H4, 3J4-3 7.5, 3J4-5
H4''), 2.00-2.06 м (2H, H5'A, H5'B), 2.55-2.59 м (2H,
7.5), 7.18 д.д (1H, H3, 3J3-4 7.5, 4J3-5 1.2), 7.21 д.д.д
H4'A, H4'B), 2.66-2.70 м (2H, H3'A, H3'B), 3.50 д.д
(1H, H5, 3J5-6 8.1, 4J5-4 7.5, 4J5-3 1.2), 8.40 д (1H,
(1H, H2'', 3J2''-3''a 7.8, 3J2''-3''b 2.0), 5.92 т (1H, H2',
H6, 3J6-5 8.1), 9.92 уш.с (1H, NH). Спектр ЯМР 13C,
3J 1.9), 7.02 т (1H, H4, 3J4-5 7.5, 3J4-3 7.5), 7.19 д
δ, м.д.: 14.01 (C6''), 22.56 (C5''), 23.60 (C5'), 27.98
(1H, H3, 3J3-4 7.5), 7.23 д.д (1H, H5, 3J5-6 8.2, 3J5-4
(C4''), 33.77 (C4'), 34.71 (C3''), 36.69 (C3'), 55.93 (C2''),
7.5), 8.40 д (1H, H6, 3J6-5 8.2), 9.94 уш.с (1H, NH).
120.18 (C6), 123.46 (C4), 127.59 (C5), 128.70 (C3),
Спектр ЯМР 13C, δ, м.д.: 21.36 (C6''), 23.47 (C5'),
130.87 (C2'), 134.94 (C1), 140.21 (C1'), 173.18 (C=O).
23.62 (C5''), 24.99 (C4''), 33.79 (C4'), 36.70 (C3'), 44.00
Найдено, %: С 74.86; Н 8.69; N 10.32. C17H24N2O.
(C3''), 54.30 (C2''), 120.14 (C6), 123.44 (C4), 127.64
Вычислено, %: С 75.00; Н 8.82; N 10.29.
(C5), 127.97 (C3), 128.64 (C2), 130.88 (C2'), 135.00
2-Метил-1-спиро[3,1-бензоксазин-4,1'-цик-
(C1), 140.25 (C1'), 173.53 (C=O). Найдено, %: С
лопентан]-2-илпропан-1-амин (6а). Через рас-
51.93; Н 10.72; N 13.51. C9H22N2OS. Вычислено,
твор 0.540 г (2.1 ммоль) амида 5a в 20 мл CH2Cl2
%: С 52.42; Н 10.67; N 13.59.
барботировали газообразный HCl. После окон-
2-Амино-N-(2-циклопент-1-ен-1-илфенил)-4-
чания реакции (контроль методом ТСХ) раствор
(метилсульфанил)бутанамид
(5c) получали
обрабатывали 5% раствором NaHCO3 (2×10 мл),
аналогично по методу а из 0.70 г (1.66 ммоль)
промывали H2O (2×10 мл), сушили MgSO4. После
амида 3c и 1.40 г (3.33 моль) моноэатаноламина
удаления растворителя при пониженном давлении
[выход 0.41 г (85%)], или по методу б из 0.350 г
остаток разделяли колоночной хроматографией на
(0.89 ммоль) амида 8с и 0.720 г (6.27 ммоль)
SiO2 (элюент петролейный эфир-этилацетат, 7:1).
CF3COOH [выход 0.226 г (87%)]. Коричневое
Выход 0.043 г (80%), коричневое масло. Для (R)-
масло. Для (R)-5c: [α]D20 +54.0 (с 0.0073, CHCl3).
6a: [α]D20 +20.1 (с 0.0025, CHCl3). Спектр ЯМР 1H,
Спектр ЯМР 1H, δ, м.д. (J, Гц): 1.78-1.85 м (1H,
δ, м.д. (J, Гц): 0.96 д (3H, CH3, 3J4''-2'' 6.7), 1.02 д
H3''A), 1.98-2.04 м (2H, H5'A, H5'B), 2.10 с (3Н, CH3),
(3H, CH3, 3J3''-2'' 6.7), 1.83-2.07 м (7H, H2'', H2'A,
2.23-2.30 м (1H, H3''B), 2.53-2.58 м (2H, H4'A, H4'B),
H5'A, H3'A, H3'B, H4'A, H4'B), 2.16-2.24 м (2Н, H2'B,
2.60-2.69 м (4H, H4''A, H4''B, H3'A, H3'B), 3.61 д.д (1H,
H5'B), 3.22 д (1H, 3J1''-2'' 5.0, H1''), 7.06 д.д (1H, H5,
H2'', 3J2''-3''b 8.3, 3J2''-3''а 4.3), 5.91 т (1H, H2', 3J2'-3'
3J5-6 7.2, 3J5-6 1.2), 7.15 м (2H, H6, H7), 7.22 д (1H,
2.0), 7.05 т (1H, H4, 3J4-5 7.6, 3J4-3 7.6), 7.18 д.д (1H,
H8, 3J8-7 8.2). Спектр ЯМР 13C, δ, м.д.: 17.22 (C4''),
H3, 3J3-4 7.6, 4J3-5 1.3), 7.22 д.д.д (1H, H5, 3J5-6 8.2,
19.97 (C3''), 23.95 (C3'), 23.98 (C4'), 31.75 (C2''), 40.81
3J5-4 7.6, 4J5-3 1.3), 8.36 д (1H, H6, 3J6-5 8.2), 9.90
(C2'), 41.65 (C5'), 60.25 (C1''), 88.67 (C4), 122.33 (C5),
уш.с (NH). Спектр ЯМР 13C, δ, м.д.: 15.28 (C5''),
124.47 (C6), 126.40 (C7), 128.33 (C8), 128.94 (C4а),
23.59 (С5'), 30.67 (C4''), 33.80 (C4'), 33.87 (C3''), 36.72
138.58 (C8а), 163.97 (С2). Найдено, %: С 74.33; Н
(C3'), 54.97 (C2''), 120.16 (С6), 123.63 (С4), 127.63
8.56; N 10.41. C16H22N2О. Вычислено, %: С 74.41;
(С5), 128.01 (С3), 128.73 (С2), 130.96 (С2'), 134.77
Н 8.52; N 10.85.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1460
САЛИХОВ и др.
3-Метил-1-спиро[3,1-бензоксазин-4,1'-цик-
3J8-7 7.1, 4J8-6 1.2). Спектр ЯМР 13C, δ, м.д.: 14.02
лопентан]-2-илбутан-1-амин
(6b). Получали
(C5''), 22.25 (C4''), 23.96 (C3' + C4'), 28.02 (C3''), 34.59
аналогично из 0.40 г (1.47 ммоль) амида 5b при
(C2''), 40.59 (C2'), 40.59 (C5'), 54.76 (C1), 122.30 (C5),
барботировании газообразным HCl. Выход 0.27 г
124.44 (C6), 126.48 (C7), 128.24 (C8), 138.71 (C4a),
(68%), коричневое масло. Для (R)-6b: [α]D20 +10.1
143.95 (C8a), 164.56 (C1). Найдено, %: С 74.33; Н
(с 0.0052, CHCl3). Спектр ЯМР 1H, δ, м.д. (J, Гц):
8.56; N 10.41. C17H24N2О. Вычислено, %: С 74.41;
0.92 д (3H, CH3, 3J4''-3'' 6.7), 1.05 д (3H, CH3, 3J5''-3''
Н 8.52; N 10.85.
6.7), 1.81-2.02 м (9H, H3'', H2'A, H2'B, H3'A, H3'B, H4'A,
N'-(трет-Бутоксикарбонил)-N-(2-цикло-
H4'B, H5'A, H5'B), 2.58-2.61 м (2Н, H2''A, H2''B), 3.38
гекс-1-ен-1-илфенил)-3-метилбутанамид (8a). К
д.д (1H, H1'', 3J1''-2''а 7.4, 3J1''-2''b 5.6), 7.03 д.д (1H,
раствору 3.50 г (16.1 ммоль) Boc-аминокислоты
H5, 3J5-6 7.2, 3J5-6 1.2), 7.17-7.21 м (2H, H6, H7),
7а в 15 мл СН2Cl2 добавляли 2.56 г (16.1 ммоль)
7.24 д (1H, H8, 3J8-7 8.2). Спектр ЯМР 13C, δ, м.д.:
орто-(циклопент-1-енил)анилина
1,
4.21
г
17.13 (C4''), 19.86 (C3''), 23.91 (C5'), 24.02 (C2'), 31.74
(20.4 ммоль) дициклогексилкарбодиимида (DCC),
(C2''), 40.89 (C3'), 41.73 (C4'), 60.46 (C1''), 88.74 (C4),
2.8 мл (20.4 ммоль) ТЭА и перемешивали в течение
122.55 (C5), 124.51 (C6), 125.45(C7), 129.14 (C8),
2 ч при комнатной температуре. После окончания
128.91 (C4а), 133.35 (C8а), 161.93 (С2). Найдено, %:
реакции (контроль методом ТСХ, элюент бензол)
С 72.37; Н 6.58; N 8.15. C21H22N2ОS. Вычислено,
реакционнную смесь отфильтровывали, фильтрат
%: С 72.00; Н 6.28; N 8.00.
промывали 5% раствором NaHCO3 (2×10 мл), H2O
3-(Метилсульфанил)-1-спиро[3,1-бензокса-
(2×10 мл), органическую фазу сушили MgSO4.
зин-4,1'-циклопентан]-2-илпропан-1-амин
(6c)
После удаления растворителя при пониженном
получали аналогично из 0.078 г (0.27 ммоль) ами-
давлении, остаток разделяли колоночной хрома-
да 5с при барботировании газообразным HCl.
тографией на SiO2 (элюент петролейный эфир-
Выход 0.056 г (72%), коричневое масло. Для (R)-
этилацетат, 7:1). Выход 4.80 г (83%), коричневое
6c: [α]D20 +40.4 (с 0.0032, CHCl3). Спектр ЯМР 1H,
масло, [α]D20 +35.5 (с 0.0061, CHCl3). Спектр ЯМР
δ, м.д. (J, Гц): 1.90-2.22 м (10H, H2'A, H2'B, H3'A,
1H, δ, м.д. (J, Гц): 0.91 д (3H, CH3, 3J 5.0), 0.97 д
H3'B, H4'A, H4'B, H5'A, H5'B, H2''A, H2''B), 2.13 с (3H,
(3H, CH3, 3J 5.0), 1.42 с (9H, Boc), 2.23-2.26 м (1H,
CH3), 2.64-2.72 м (2H, H3''A, H3''B), 3.61 д.д (1H, H1'',
H3''), 1.97-2.01 м (2H, H3'A, H3'B), 2.53-2.58 м (2H,
3J1''-2''а 7.8, 3J1''-2''b 5.8), 7.10 д.д (1H, H5, 3J5-6 7.2,
H4'A, H4'B), 2.59-2.63 м (2H, H5'A, H5'B), 4.01-4.05 м
4J5-7 1.2), 7.17-7.20 м (2H, H6, H8), 7.25 т.д (1H, H7,
(1H, H2''), 5.18-5.26 м (1Н, NH), 5.84 т (1H, H2', 3J
3J7-6 7.5, 3J7-8 7.5, 3J7-5 1.2). Спектр ЯМР 13C, δ,
2.0), 7.02 т (1H, H4, 3J4-5 7.6, 4J4-3 7.6), 7.12-7.18
м.д.: 15.38 (C5''), 23.97 (C2' + C5'), 30.61 (C3''), 34.06
м (2H, H3, H5), 8.17 д (1H, H6, 3J6-5 8.2), 8.22 уш.c
(C2''), 40.66 (C3'), 41.21 (C4'), 53.52 (C1''), 89.10 (C4),
(1Н, NH). Спектр ЯМР 13C, δ, м.д.: 17.59 (C5''),
122.37 (C5), 124.33 (C6), 126.77 (C8), 128.47 (C7),
19.26 (C4''), 23.35 (C3'), 28.23 (Boc), 31.50 (C3''),
128.87 (C4a), 138.26 (C8a), 163.87 (C2). Найдено, %:
33.83 (C4'), 36.83 (C5'), 60.94 (C2''), 80.16 (Boc),
С 74.37; Н 8.58; N 10.55. C17H24N2О. Вычислено,
120.92 (C6), 123.99 (C4), 127.55 (C5), 127.78 (C3),
%: С 74.41; Н 8.52; N 10.85.
128.77 (C2), 130.75 (C2'), 134.24 (C1), 140.35 (C1'),
153.50 (C=O), 169.70 (C=O). Найдено, %: С 70.42;
1-Спиро[3,1-бензоксазин-4,1'-циклопентан]-
Н 8.27; N 7.65. C21H30N2O3. Вычислено, %: С
2-илпентан-1-амин [(RS)-6d] получали анало-
70.39; Н 8.37; N 7.82.
гично из 0.15 г (0.55 ммоль) амида (RS)-5d при
барботировании газообразным HCl. Выход 0.11 г
N'-(трет-Бутоксикарбонил)-N-(2-цикло-
(74%), коричневое масло. Спектр ЯМР 1H, δ, м.д.
гекс-1-ен-1-илфенил)-3-метилпентанамид
(8b)
(J, Гц): 0.92 т (3H, CH2, 3J5''-4'' 7.2), 1.34-1.47 м
получали аналогично из 2.98 г (12.9 ммоль) Boc-
(4Н, H3''A, H3''B, H4''A, H4''B), 1.55-1.62 м (1Н, H2''),
аминокислоты 7b и 2.05 г (12.9 ммоль) орто-
1.75-2.08 м (7Н, H2''B, H2'A, H3'A, H3'B, H4'A, H4'B,
(циклопент-1-енил)анилина 1. Выход 3.84 г (80%),
H5'A), 2.18-2.24 м (2Н, H2'B, H5'B), 3.41 д.д (1H, H1'',
коричневое масло, [α]D20 +26.1 (с 0.0023, CHCl3).
3J1''-2''а 7.2, 3J1''-2''b 6.0), 7.05 д.д (1H, H5, 3J5-6 7.4,
Спектр ЯМР 1H, δ, м.д. (J, Гц): 0.97 д (3H, CH3,
4J5-7 1.3), 7.15-7.18 м (2H, H6, H7), 7.25 д.д (1H, H8,
J5''-4''
5.0), 0.98 д (3H, CH3, J6''-4'' 5.0), 1.46 c (9H,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ГЕТЕРОЦИКЛИЗАЦИЯ орто-(1-ЦИКЛОАЛКЕНИЛ)АНИЛИНОВ: III.
1461
Boc), 1.54-1.59 м (1H, H3''A), 1.71-1.76 м (1H, H4''),
MgSO4. После выпаривания растворителя при по-
1.80-1.85 м (1H, H3''B), 2.02-2.08 м (2H, H5'A, H5'B),
ниженном давлении продукт выделяли колоноч-
2.60-2.64 м (2H, H4'A, H4'B), 2.65-2.69 м (2H, H3'A,
ной хроматографией на SiO2 (элюент петролейный
H3'B), 4.25-4.30 м (1H, H2''), 5.18 уш.с (1H, NH),
эфир-этилацетат, 5:1). Получили 0.11 г (50%) сме-
5.90 т (1H, H2', 3J2'-3' 2.0), 7.07 д.д (1H, H4, 3J4-5 7.6,
си бензоксазина 9а и кетона 10а в соотношении
3J4-3 7.6), 7.18-7.24 м (2H, H3, H5), 8.32 д (1H, H6,
9:1.
3J6-5 8.3), 8.45 уш.с (1H, NH). Спектр ЯМР 13C, δ,
Соединение 9а. Спектр ЯМР 1H, δ, м.д. (J, Гц):
м.д.: 22.91 (C6''), 23.14 (C5''), 23.38 (C5'), 24.90 (C4''),
1.30 д (3H, CH3, 3J3''-2'' 7.0), 1.33 д (3H, CH3, 3J4''-2''
28.29 (Boc), 33.88 (C4'), 36.87 (C3'), 41.33 (C3''), 54.22
7.0), 1.73-1.81 м (1H, H4'A), 1.93-2.02 м (2H, H5'A,
(C2''), 80.14 (Boc), 123.89 (C4), 127.63 (C5), 128.67
H5'B), 2.11-2.17 м (1H, H3'A), 2.20-2.27 м (1H, H4'B),
(C3), 128.77 (C2), 130.82 (C2'), 134.52 (C1), 140.36
2.48-2.55 м (1H, H3'B), 3.61-3.67 м (1H, H2''), 4.12
(C1'), 155.77 (C=O), 170.65 (C=O). Найдено, %: С
д.т (1H, H2', 3J2'-3'a 5.2, 3J2'-3'b 1.2, 4J2'-4'a 1.2), 7.13-
70.63; Н 8.42; N 7.41. C22H32N2O3. Вычислено, %:
7.30 м (4H, H5, H6, H7, H8). Спектр ЯМР 13C, δ,
С 70.96; Н 8.60; N 7.52.
м.д.: 18.48 (C4''), 18.59 (C3''), 20.53 (C5'), 26.25 (C2''),
N'-(трет-Бутоксикарбонил)-N-(2-цикло-
31.56 (C4'), 34.74 (C3'), 76.0 (C2'), 90.94 (C4), 124.66
гекс-1-ен-1-илфенил)-4-(метилсульфанил)-
(C4a), 125.61 (C6), 126.23 (C5), 126.62 (C8), 127.64
бутанамид (8с) получали аналогично из 3.50 г
(C7), 130.83 (C8a), 153.91 (C1''), 157.92 (C2).
(14.1 ммоль) Boc-аминокислоты
7с и
2.24 г
Соединение 10a. Спектр ЯМР 1H, δ, м.д. (J,
(14.1 ммоль) орто-(циклопент-1-енил)анилина 1.
Гц): 1.29 д (3H, CH3, 3J5''-3'' 7.0), 1.32 д (3H, CH3,
Выход 5.10 г (93%), коричневое масло, [α]D20 +54.0
3J4''-3''
7.0), 1.96-2.01 м (1H, H5'A), 2.13-2.20 м
(с 0.0053, CHCl3). Спектр ЯМР 1H, δ, м.д. (J, Гц):
(1H, H5'B), 2.25-2.41 м (4H, H3'A, H3'B, H4'A, H4'B),
1.45 c (9Н, Boc), 1.97-2.06 м (3H, H3''A, H5'A, H5'B),
3.52-3.56 м (2H, H1', H3''), 7.15-7.28 м (3H, H5, H7,
2.11 с (3Н, S-CH3), 2.17-2.24 м (1H, H3''B), 2.55-
H8), 7.67 д (1H, H6, 3J6-5 8.0), 9.35 уш.с (1H, NH).
2.70 м (6H, H4''A, H4''B, H3'A, H3'B, H4'A, H4'B), 4.38-
Спектр ЯМР 13C, δ, м.д.: 18.39 (C4''), 18.53 (C5''),
4.44 м (1H, H2''), 5.29 д (1H, NH, 3JNH-2'' 4.7), 5.90
21.16 (H5'), 29.20 (C3''), 28.69 (C4'), 38.45 (C3'), 51.52
т (1Н, H2', 3J2'-3' 1.8), 7.07 т (1H, H4, 3J4-3 7.5, 3J4-5
(C1'), 124.37 (C4), 125.22 (C6), 125.32 (C3), 127.09
7.5), 7.18 д (1Н, H3, 3J3-4 7.5), 7.23 т (1H, H5, 3J5-6
(C5), 129.33 (C2), 131.42 (C1), 157.63 (C2''), 162.36
7.5, 3J5-4 7.5), 8.31 д (1H, H6, 3J6-5 7.5), 8.42 уш.с
(С=O), 220.77 (С=O).
(1Н, NH). Спектр ЯМР 13C, δ, м.д.: 16.70 (S-СH3),
24.75 (C5'), 29.68 (Boc), 31.71 (C4'), 32.73 (C3''),
2-[(1Е)-N-Гидрокси-3-метилбутанимидо-
35.29 (C4''), 38.34 (C3'), 55.93 (C2''), 121.88 (C6),
ил]спиро[3,1-бензоксазин-4,1'-циклопентан]-
125.41 (C4), 129.06 (C3), 129.26 (C5), 132.46 (C2'),
2'-ол (9b) и (2E)-2-(гидроксиимино)-4-метил-
135.71 (C1), 141.60 (C2), 170.81 (C=O). Найдено, %:
N-[2-(2-оксоциклопентил)фенил]пентанамид
С 64.53; Н 7.83; N 7.12. C21H30N2O3S. Вычислено,
(10b) получали аналогично из 0.156 г (0.57 ммоль)
%: С 64.61; Н 7.69; N 7.17.
амида 5b при добавлении по каплям 66 мкл
(1.15 ммоль) 50%-ной перекиси водорода. Полу-
2-[(1Е)-N-Гидрокси-2-метилпропанимидо-
чили 0.061 г (35%) смеси бензоксазина 9b и кетона
ил]спиро[3,1-бензоксазин-4,1'-циклопен-
10b в соотношении 5:1.
тан]-2'-ол (9a) и (2E)-2-(гидроксиимино)-3-ме-
тил-N-[2-(2-оксоциклопентил)-фенил]бутан-
Соединение 9b. Спектр ЯМР 1H, δ, м.д. (J, Гц):
амид (10a). К раствору 0.20 г (0.78 ммоль) ами-
0.96 д (3H, CH3, 3J4''-3'' 6.6), 0.98 д (3H, CH3, 3J5''-3''
да 5a в 10 мл CH3CN по каплям добавляли
6.6), 1.77-1.83 м (1H, H4'A), 1.97-2.06 м (2H, H5'A,
89 мкл (1.56 ммоль) 50%-го водного раствора
H5'B), 2.12-2.19 м (2H, H3'A, H3''), 2.23-2.30 м (1H,
Н2О2. Далее добавляли 1%-ный раствор NaOH до
H4'B), 2.52-2.58 м (1H, H3'B), 2.66-2.72 м (2H,
pH 8. Реакционную смесь перемешивали в течение
H2''A, H2''B), 4.12 д.т (1H, H2', 3J2'-3'a 4.5, 3J2'-3'b 1.2,
20 ч при комнатной температуре, затем разбавля-
4J2'-4'b 1.2), 7.23-7.36 м (4H, H5, H6, H7, H8), 10.41
ли 15 мл CHCl3, промывали 10% водным раство-
уш.с (1H, N-OH). Спектр ЯМР 13C, δ, м.д.: 20.45
ром Na2S2O3 (1×10 мл) и H2O (1×10 мл) и сушили
(C5'), 22.77 (C5''), 22.85 (C4''), 26.75 (C3''),
31.43
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1462
САЛИХОВ и др.
(C4'), 32.90 (C2''), 34.27 (C3'), 75.75 (C2'), 90.64 (C4),
7.4), 7.26-7.29 м (1Н, H5), 7.73 д (1H, H6, 3J6-5 8.0),
124.82 (C4a), 125.16 (C6), 125.45 (C5), 127.08 (C8),
9.52 уш.с (1H, NH), 9.77 уш.с (1H, N-OH). Спектр
129.40 (C7), 139.46 (C8a), 153.98 (C1''), 154.70 (C2).
ЯМР 13C, δ, м.д.: 13.90 (C6''), 21.21 (C5'), 23.00 (C5''),
Масс-спектр, m/z (Iотн, %): 302 (9) [M]+.
23.30 (C3''), 28.24 (C4''), 32.00 (C4'), 38.50 (C3'), 51.54
(C1'), 125.23 (C4), 126.09 (C6), 126.51 (C3), 127.70
Соединение 10b. Спектр ЯМР 1H, δ, м.д. (J, Гц):
(C5), 130.19 (C2), 136.05 (C1), 155.38 (C2''), 162.26
0.95 д (3H, CH3, 3J7''-5'' 6.5), 0.97 д (3H, CH3, 3J6''-5''
(C1''), 220.77 (C2').
6.5), 1.96-2.03 м (2H, H5'A, H5'B), 2.17-2.23 м (1H,
H4''), 2.28-2.44 м (4H, H3'A, H3'B, H4'A, H4'B), 2.59-
2-[(1R,S)-2-Метил-1-нитропропил]спиро-
2.62 м (2H, H3''A, H3''B), 3.54 т (1H, H1', 3J1'-5'a 9.7,
[3,1-бензоксазин-4,1'-циклопентан]-2'-ол
(11)
3J1'-5'b 9.7), 7.15 т (1H, H4, 3J4-3 7.3, 3J4-5 7.3), 7.18
получали аналогично из 0.068 г (0.26 ммоль)
д.д (1H, H3, 3J3-4 7.3, 4J3-5 1.2), 7.27-7.29 м (1H,
амида 5а при добавлении по каплям 52 мкл
H5), 7.73 д (1H, H6, 3J6-5 8.0), 9.47 уш.с (1H, NH),
(0.91 ммоль) 50%-ной перекиси водорода. Полу-
9.82 уш.с (1H, N-OH). Спектр ЯМР 13C, δ, м.д.:
чили 0.016 г (20%) нитросединения 11 и 0.018 г
21.19 (C5), 22.78 (C6''), 22.82 (C5''), 26.57 (C4''), 28.65
(24%) смеси бензоксазина 9a и кетона 10a.
(C4'), 32.06 (C3''), 38.42 (C3''), 51.53 (C1'), 125.51
Соединение 11. Спектр ЯМР 1H, δ, м.д. (J, Гц):
(C4), 126.57 (C3), 127.68 (C5), 130.57 (C2), 136.04
1.04 [1.10] д (3H, CH3, 3J3''-2'' 7.0), 1.10 [1.16] д (3H,
(C1), 154.70 (C2''), 162.45 (C1''), 220.59 (C2'). Масс-
спектр, m/z (Iотн, %): 302 (12) [M]+.
CH3, 3J4''-2'' 7.0), 1.76-1.81 [1.77-1.82] м (1H, H3'A),
1.91-2.02 [1.90-2.01] м (2H, H4'A, H4'B), 2.06-2.10
2-[(1E)-N-Гидроксипентанимидоил]спи-
[2.07-2.11] м (1H, H5'A), 2.18-2.25 [2.17-2.24] м
ро[3,1-бензоксазин-4,1'-циклопентан]-2'-ол (9с)
(1H, H3'B), 2.47-2.55 [2.48-2.56] м (1H, H5'B), 2.73-
и
(2E)-2-(гидроксиимино)-N-[2-(2-оксоцикло-
2.77 [2.74-2.78] м (1H, H2''), 7.22-7.30 [7.23-7.31]
пентил)-фенил]гексанамид (10с) получали ана-
м (3H, H5, H6, H8), 7.35 м (1H, H7). Спектр ЯМР
логично из 0.15 г (0.55 ммоль) амида 5с при до-
13C, δ, м.д.: 18.31 [18.76] (C4''), 19.37 [19.38] (C3''),
бавлении по каплям 63 мкл (1.1 ммоль) 50%-ной
20.51 [20.35] (C4'), 29.30 [29.38] (C2''), 31.18 [31.24]
перекиси водорода. Получили 0.09 г (54%) смеси
(C3'), 34.61 [34.62] (C5'), 76.14 [75.89] (C2'), 91.45
бензоксазина 9с и кетона 10с в соотношении 9:1.
[91.16] (C4), 95.91 [95.28] (C1''), 125.02 [125.21]
Соединение 9с. Спектр ЯМР 1H, δ, м.д. (J, Гц):
(C5a), 125.87 [125.88] (C6), 126.46 [126.23] (C5),
0.94 т (3H, CH3, 3J5''-4'' 7.3), 1.37-1.44 м (2Н, H4''A,
126.85 [126.66] (C8), 128.03 [128.32] (C7), 129.81
H4''B), 1.54-1.61 м (2Н, H3''A, H3''B), 1.77-1.82 м
[129.43] (C8a), 153.60 [152.75] (C2). Масс-спектр,
(1Н, H4'A), 1.97-2.05 м (2Н, H5'A, H5'B), 2.11-2.17 м
m/z (Iотн, %): 304 (15) [M]+. Найдено, %: С 66.79; Н
(1Н, H3'A), 2.21-2.28 м (1Н, H4'B), 2.51-2.57 м (1Н,
6.82; N 9.65. C16H20N2О3. Вычислено, %: С 66.66;
H3'B), 2.73-2.79 м (2Н, H2''A, H2''B), 4.11 д.т (1H, H2',
Н 6.94; N 9.72.
3J2'-3'а 4.5, 3J2'-3'b 1.6, 4J2'-4'b 1.6), 7.25-7.35 м (4H,
БЛАГОДАРНОСТИ
H5, H6, H7, H8), 10.41 уш.с (1H, N-OH). Спектр
ЯМР 13C, δ, м.д.: 13.90 (C5''), 20.48 (C5'), 22.82 (C4''),
Химический анализ соединений выполнен на
22.99 (C2''), 28.35 (C3''), 31.43 (C4'), 34.32 (C3'), 51.54
оборудовании ЦКП «Химия» Уфимского институ-
(C1''), 75.75 (C2'), 90.65 (C4), 124.81 (C5a), 125.19
та химии УФИЦ РАН.
(C6), 125.50 (C5), 127.13 (C8), 129.45 (C7), 139.48
ФОНДОВАЯ ПОДДЕРЖКА
(C8a), 155.02 (C2), 153.65 (C1'').
Соединение 10с. Спектр ЯМР 1H, δ, м.д. (J,
Работа выполнена по теме госзадания
Гц): 1.25 т (3H, CH3, 3J6''-5'' 7.2), 1.31-1.44 м (2Н,
№ AAAA-A20-120012090029-0 и АААА-А19-
H5''A, H5''B), 1.48-1.52 м (2Н, H4''A, H4''B), 1.98-2.02
119011790021-4.
м (2Н, H5'A, H5'B), 2.13-2.21 м (2Н, H4'A, H4'B),
КОНФЛИКТ ИНТЕРЕСОВ
2.29-3.39 м (2Н, H3'A, H3'B), 2.66-2.69 м (2Н, H3''A,
H3''B), 3.53 т (1H, H1', 3J1'-5'а 9.1, 3J1'-5'b 9.1), 7.15
Авторы заявляют об отсутствии конфликта ин-
т (1H, H4, 3J4-5 7.4, 3J4-6 7.4), 7.18 д (1H, H3, 3J3-4
тересов.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ГЕТЕРОЦИКЛИЗАЦИЯ орто-(1-ЦИКЛОАЛКЕНИЛ)АНИЛИНОВ: III.
1463
СПИСОК ЛИТЕРАТУРЫ
nov I.B. Chem. Heterocycl. Compd. 2002, 38, 331-
335.] doi 10.1023/A:1015643505772
1.
Зарипов Р.Р., Салихов Ш.М., Абдрахманов И.Б.,
16.
Галкин Е.Г., Ерастов А.С., Вырыпаев Е.М., Фур-
Мустафин А.Г. Вестн. Башкир. ун-та. 2013, 18,
лей И.И., Абдрахманов И.Б., Салихов Ш.М., Крась-
1009-1018.
ко С.А. ХГС. 2013, 7, 1160-1165. [Galkin E.G., Eras-
2.
Saunthwal R.K., Patel M., Kumar S., Verma A.K.
tov A.S., Vyrypaev E.M., Furlei I.I., Abdrakhma-
Tetrahedron Lett. 2015, 56, 677-681. doi 10.1016/
nov I.B., Salikhov Sh.M. Chem. Heterocycl. Compd.
j.tetlet.2014.12.058
2013, 49, 1082-1086.] doi 10.1007/s10593-013-1346-
3.
Dong J.-L., Wei P.-S., Yu L.-S.-H., Xie J.-W.
6
J. Org. Chem. 2018, 83, 2219-2226. doi 10.1021/
17.
Галкин Е.Г., Ерастов А.С., Вырыпаев Е.М., Фур-
acs.joc.7b03120
лей И.И., Салихов Ш.М., Абдрахманов И.Б., Зари-
4.
Boissier J.R., Simon P., Zaczinska M., Fichelle J.
пов Р.Р. ХГС. 2013, 7, 1166-1170. [Galkin E.G., Eras-
Therapie. 1972, 27, 325-331.
tov A.S., Vyrypaev E.M., Furlei I.I., Salikhov Sh.M.,
5.
Kruse H.J., Kuch H. Arzneim.-Forsch. 1986, 36, 1320-
Abdrakhmanov I.B., Zaripov R.R. Chem. Heterocycl.
1329.
Compd. 2013, 49, 1087-1091.] doi 10.1007/s10593-
6.
Chinkov N., Warm A., Carreira E.M. Angew. Chem.,
013-1347-5
Int. Ed.
2011,
50,
2957-2961. doi
10.1002/
18.
Казарьянц С.А., Ерастов А.С., Галкин Е.Г., Выры-
anie.201006689
паев Е.М., Салихов Ш.М., Абдрахманов И.Б. ХГС.
7.
Zhang P., Terefenko E.A., Fensome A., Zhang Z.,
2011, 3, 432-440. [Kazaryants S.A., Erastov A.S.,
Zhu Y., Соhen J., Winneker R., Wrobel J.,
Galkin E.G., Vyrypaev E.M., Salikhov Sh.M., Abdra-
Yardley J. Bioorg. Med. Chem. Lett. 2002, 12, 787-
khmanov I.B. Chem. Heterocycl. Compd. 2011, 47,
790. doi 10.1016/S0960-894X(02)00025-2
355-362.] doi 10.1007/s10593-011-0764-6
8.
Zhang Z., Olland A.M., Zhu Y., Cohen J., Berrodin T.,
19.
Bendale A.R., Shah R., Narkhede S.B., Jadhav A.G.,
Chippari S., Appavu C., Li S., Wilhem J., Chopra R.,
Vidyasagar G. Int. J. Pharm. Tech. Res. 2011, 3, 841-
Fensome A., Zhang P., Wrobel J., Unwalla R.J.,
851.
Lyttle C.R., Winneker R.C. J. Biol. Chem. 2005, 280,
20.
Krasnov V.P., Vigorov A.Yu., Musiyak V.V., Nizova I.A.,
28468-28475. doi 10.1074/jbc.M504144200
Gruzdev D.A., Matveeva T.V., Levit G.L., Kravchen-
9.
Charmantray F., Demeunynck M., Carrez D., Croisy A.,
ko M.A., Skornyakov S.N., Bekker O.B., Danilen-
Lansiaux A., Bailly C., Colson P. J. Med. Chem. 2003,
ko V.N., Charushin V.N. Bioorg. Med. Chem. Lett.
46, 967-977. doi 10.1021/jm020389w
2016, 26, 2645-2648. doi 10.1016/j.bmcl.2016.04.017
10.
Tahri A., Hu L., Surleraux D.L., Wigerinck P.T. Пат.
21.
Gruzdev D.A., Chulakov E.N., Levit G.L., Kravchen-
7465727, 2008. США.
ko M.A., Krasnov V.P., Charushin V.N. Mendeleev
11.
Gala F., D’Auria M.V., De Marino S., Sepe V.,
Commun.
2017,
27,
547-549. doi
10.1016/
Zollo F., Smith C.D., Keller S.N., Zampella A.
j.mencom.2017.11.002
Tetrahedron.
2009,
65,
51-56. doi
10.1016/
22.
Гринштейн Дж., Виниц М. Химия аминокислот и
j.tet.2008.10.076
пептидов. М.: Мир. 1965.
12.
Казарьянц С.А., Салихов Ш.М., Абдрахманов И.Б.,
23.
Peter G.M. Greene’s Protective Groups in Organic
Иванова С.Р. Башкир. хим. ж. 2009, 16, 19-24.
Synthesis. 5th Edn. New York: John Wiley & Sons Inc.
13.
Салихов Ш.М., Зарипов Р.Р., Латыпова Л.Р., Абдрах-
2014.
манов И.Б. ХГС. 2019, 55, 660-664. [Salikhov Sh.M.,
24.
Schümperli M.T., Hammond C., Hermans I. ACS Catal.
Zaripov R.R., Latypova L.R., Abdrakhmanov I.B.
2012, 2, 1108-1117. doi 10.1021/cs300212q
Chem. Heterocycl. Compd. 2019, 55, 660-664.] doi
10.1007/s10593-019-02513-6
25.
Гатауллин Р.Р., Афонькин И.С., Фатыхов А.А.,
14.
Salikhov Sh.М., Zaripov R.R., Кrasko S.А., Latypo-
Спирихин Л.В., Абдрахманов И.Б. Изв. АН, Сер.
va L.R., Gubaidullin N.М., Аbdrakhmanov I.B., Zai-
хим. 2000, 118-120. [Gataullin R.R., Afon’kin I.S.,
kov G.E., Sofina S.Yu. Вестн. Казан. технологич.
Fatykhov A.A., Spirikhin L.V., Abdrakhmanov I.B.
ун-та. 2014, 17, 211-215.
Russ. Chem. Bull. 2000, 49, 122-124.]
15.
Гатауллин Р.Р., Афонькин И.С., Фатыхов A.A.,
26.
Гатауллин Р.Р., Насыров М.Ф., Дьяченко Д.И., Фа-
Абдрахманов И.Б. ХГС. 2002, 38, 367-371. [Gataul-
тыхов А.А., Шитикова О.В., Спирихин Л.В., Абдра-
lin R.R., Afon’kin I.S., Fatykhov A.A., Abdrakhma-
хманов И.Б. Изв. АН, Сер. хим. 2002, 118-121.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020
1464
САЛИХОВ и др.
[Gataullin R.R., Nasyrov M.F., Dyachenko D.I., Fa-
27. Breitmaier E., Voelter W. Carbon
13C NMR
tykhov A.A., Shitikova O.V., Spirikhin L.V., Abdra-
Spectroscopy: High Resolution Methods and
khmanov I.B. Russ. Chem. Bull. 2002, 51, 124-
Applications in Organic Chemistry and Biochemistry.
127.]
Weinheim: Wiley-VCH. 1990.
Intramolecular Heterocyclization
of ortho-(1-Cycloalkenyl)anilines: III.
Synthesis of Optically Active 4Н-3,1-Benzoxazine
Derivatives Based on α-Aminoacids
Sh. М. Salikhova, *, R. R. Zaripovb, **, and I. B. Abdrakhmanova
a Ufa Institute of Chemistry, Ufa Scientific Center of the Russian Academy of Sciences,
450054, Russia, Republic of Bashkortostn, Ufa, pr. Oktyabrya 71
*e-mail: Salikhov@anrb.ru
b Bashkir State Agrarian University, 450001, Russia, Republic of Bashkortostn, Ufa, ul. 50 let Octyabrya 34
**e-mail: zramil87@mail.ru
Received June 8, 2020; revised June 19, 2020; accepted June 26, 2020
A new approach is proposed for the synthesis of optically active 3,1-benzoxazines based on α-amino acids. The
formation of the target products is preceded by the reaction of the interaction of ortho-(cyclopent-1-enyl)aniline
and N-Boc-(R)-amino acids, the removal of the N-protective group and heterocyclization by the action of HCl(g).
Keywords: benzoxazines, ortho-(cyclopent-1-enyl)aniline, α-aminoacids, intramolecular heterocyclization
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 9 2020