ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 1, с. 7-20
УДК 547-327
СИНТЕЗ АЦИЛАМИНОПРОИЗВОДНЫХ КАРКАСНОГО
СТРОЕНИЯ В АЗОТНОКИСЛЫХ СРЕДАХ
© 2021 г. Ю. Н. Климочкин, М. В. Леонова, Е. А. Ивлева*,
А. И. Казакова, М. С. Заборская
ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
*e-mail: ivleva.ea@samgtu.ru
Поступила в редакцию 05.10.2020 г.
После доработки 16.10.2020 г.
Принята к публикации 19.10.2020 г.
Разработан эффективный метод получения вторичных амидов на основе реакции Риттера каркасных
субстратов с широким рядом нитрилов в дымящей азотной кислоте и ее смесях.
Ключевые слова: реакция Риттера, дымящая азотная кислота, амиды, каркасные соединения
DOI: 10.31857/S0514749221010018
ВВЕДЕНИЕ
изводные и непосредственно углеводороды.
Модификации реакции Риттера при использова-
Одной из наиболее важных и изученных реак-
нии
1-адамантанолов включают использование
ций с участием карбокатионов является реакция
таких реагентов и сред как FeCl3 и AgSbF6 [10],
Риттера, заключающаяся в N-алкилировании орга-
Ca(OTf)2 и BuNPF6 [11], трифторметансульфокис-
нических нитрилов или синильной кислоты [1]. В
лота и ее ангидрид [12, 13], Pb(OAc)4 в среде триф-
качестве алкилирующих агентов используются ал-
торуксусной кислоты [14], Cu-катализаторы [15],
кены, спирты алифатического или ароматического
комплекс поливинилполипирролидона и трифто-
ряда и другие прекурсоры карбокатионов. Реакция
рида бора [16], ионная жидкость [BMIM-SO3H]·
Риттера имеет важное препаративное значение как
[OTf] [17]. Из 1-галогенадамантанов в условиях
ключевая стадия в получении первичных аминов,
реакции Риттера (1-адамантил)ацетамид получа-
что особенно актуально для химии каркасных со-
ют в присутствии комплексных солей нитрония
единений. Амины адамантанового ряда нашли
и нитрозония [18-20], а также с использованием
применение в качестве фармацевтических пре-
катализаторов на основе соединений и комплек-
паратов и в качестве полупродуктов для синтеза
сов марганца [21]. Реакцию также проводят в
лекарственных средств [2-4]. На основе аминов
среде серной кислоты [22, 23]. Особый интерес
адамантанового ряда получены структурно раз-
представляет синтез
(1-адамантил)ацетамидов
нообразные соединения, проявляющие широкий
напрямую из углеводородов. Существующие спо-
спектр биологической активности [5-9].
собы включают использование следующих си-
Реакция Риттера представлена в литературе
стем: CAN/NaN3 [24], [BMIM-PF6]/NO+PF6- [17],
различными модификациями, которые, в виду
HNO3/H2SO4/олеум [25], AlCl3/CH2Cl2 [26], H2SO4
многочисленности, мы рассмотрим на примерах
[27, 28] и H2SO4/t-BuOH [29]. Имеется пример ис-
получения практически важных (1-адамантил)-
пользования нитроксипроизводных адамантано-
ацетамида и (3,5-диметил-1-адамантил)ацетами-
вого ряда в качестве исходных соединений [30].
да. Исходными субстратами для их получения
В статье [31] представлен способ получения за-
являются соответствующие спирты, галогенпро-
мещенных (1-адамантил)ацетамидов (выход 65-
7
8
КЛИМОЧКИН и др.
79%) из адамантана и алкиладамантанов, который
превращаются в (1-адамантил)ацетамиды 14-26
заключается в нитроксилировании углеводородов
при добавлении в реакционную смесь ацетонитри-
дымящей азотной кислотой с последующим до-
ла в качестве нуклеофила.
бавлением ацетамида. При замене ацетамида на
При использовании других нитрилов был син-
ацетонитрил выход увеличивается до 97% [32],
тезирован ряд N-адамантилированных амидов
а в системе 90%-ная HNO3-CCl4 составляет 74%
27-35 (схема 2). Условия синтеза соединений 27-
[33].
35 представлены в табл. 2. Ацетонциангидрин в
В продолжении исследований по изучению
азотнокислой среде является синтетическим экви-
особенностей взаимодействия каркасных субстра-
валентом синильной кислоты в реакции Риттера.
тов с дымящей азотной кислотой и ее смесями и
Применение ацетонциангидрина в качестве ни-
разработке на этой основе подходов к синтезу
трильной компоненты в условиях реакции дает ис-
функциональных производных в азотнокислых
ключительно (1-адамантил)формамид (35).
средах [31, 34-40] мы разработали новую моди-
Устойчивость двойной связи и ароматических
фикацию реакции Риттера. В настоящей работе
фрагментов (синтез соединений 27-29, 31, 32) в
нами показаны границы применимости метода на
дымящей азотной кислоте объясняется тем, что
примере использования широкого ряда каркасных
скорость адамантилирования по Риттеру значи-
субстратов, в том числе мостиковых адамантанов,
тельно выше скорости нитрования, а промежу-
родственных адамантану структур, а также нитри-
точно образующийся нитрилиевый ион за счет
лов различного строения.
сопряжения снижает π-основность ненасыщенной
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
системы и ее реакционную способность по отно-
шению к электрофильной атаке.
В качестве исходных соединений использова-
ли следующие субстраты: адамантан (1), алкила-
Реакция с избытком динитрила янтарной кис-
дамантаны 2-6 и функциональные производные
лоты сопровождается превращением цианогруп-
7-13, полученные на их основе. Первоначально из
пы в карбамоильную и образованием продукта
соединений 1-13 в среде дымящей азотной кис-
36. При использовании эквимолярного количества
лоты с последующим добавлением ацетонитрила
динитрила янтарной кислоты в реакции образу-
был синтезирован ряд (адамант-1-ил)ацетамидов
ется продукт диадамантилирования 37 (схема 3).
14-26 (схема 1). Условия синтеза соединений 14-
Условия синтеза представлены в табл. 2.
26 представлены в табл. 1.
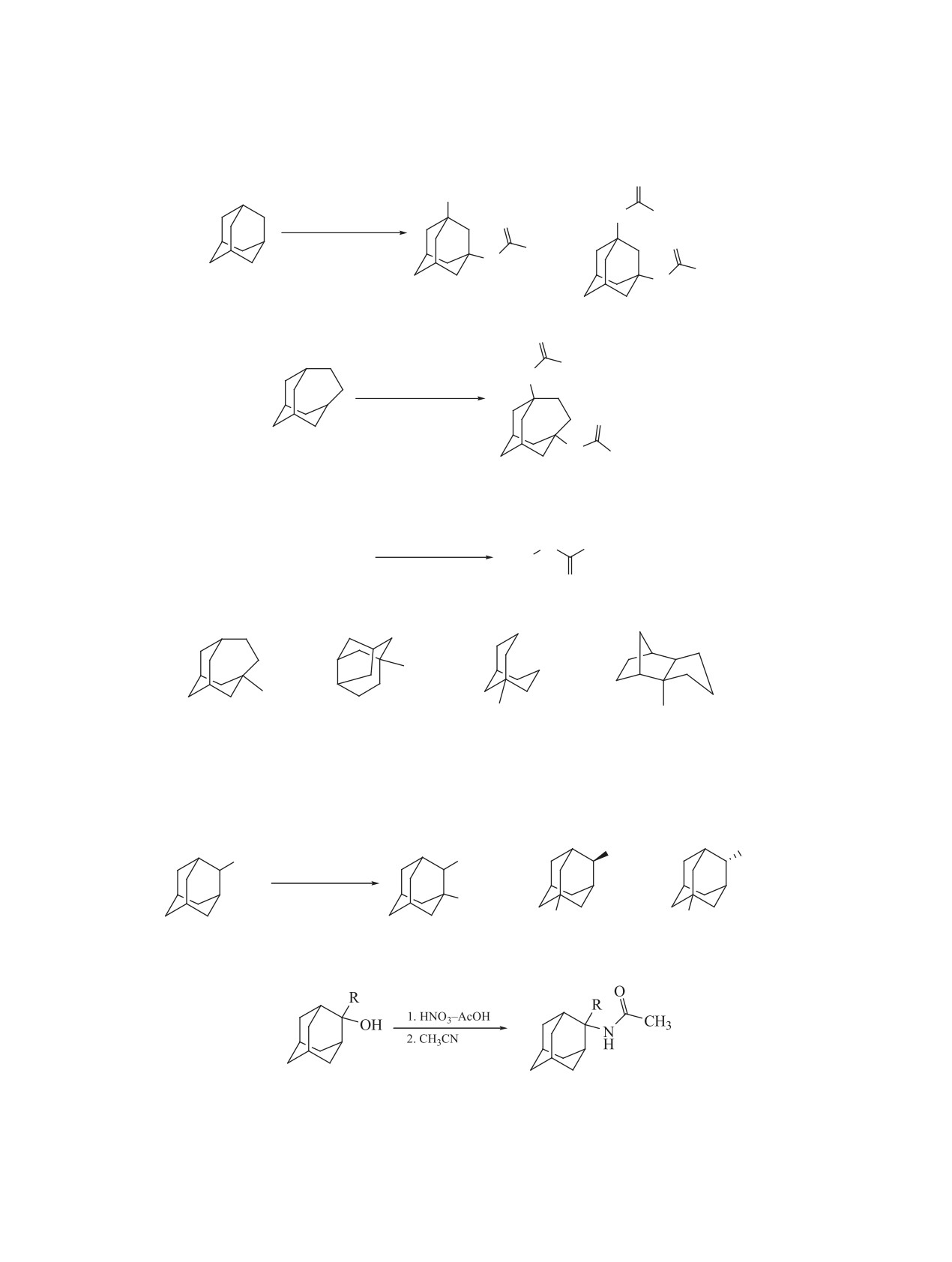
Адамантилирование в среде азотной кисло-
Реакции протекают через стадию образования
ты циануксусной кислоты и ее производных ос-
1-нитроксиадамантанов [30, 41], которые далее
ложняется нитрованием полученных продуктов
Схема 1
R1
R1
O
1. HNO
3
R2
2. CH3CN
R2
CH3
N
H
R3
R3
1-13
14-26
R1 = R2 = R3 = H (1, 14); R1 = CH3, R2 = R3 = H (2, 15); R1 = C2H5, R2 = R3 = H (3, 16);
R1 = R2 = CH3, R3 = H (4, 17); R1 = R2 = R3 = CH3 (5, 18); R1 = R2 = C2H5, R3 = H (6, 19); R1 = COOH,
R2 = R3 = H (7, 20); R1 = COOH, R2 = CH3, R3 = H (8, 21); R1 = CF3, R2 = R3 = H (9, 22); R1 = 4-CH3-C6H4,
R2 = R3 = H (10); R1 = 4-CH3-3,5-(NO2)2C6H2, R2 = R3 = H (23); R1 = R2 = 4-CH3-C6H4, R3 = H (11);
R1 = R2 = 4-CH3-3,5-(NO2)2C6H2, R3 = H (24); R1 = CH2OH, R2 = R3 = H (12); R1 = CH2ONO2,
R2 = R3 = H (25); R1 = R2 = CH2OAc, R3 = H (13, 26).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
СИНТЕЗ АЦИЛАМИНОПРОИЗВОДНЫХ КАРКАСНОГО СТРОЕНИЯ
9
Таблица 1. Условия синтеза соединений 14-26
Субстрат, №
HNO3, экв
CH3CN, экв
Температура, °С
Времяa, ч
Продукт
Выход, %
1
13
7
25
1
14
97
2
15
5
20
1
15
89
3
15
10
15
1.5
16
90
4
20
10
15
1
17
86
5
25
10
20
2
18
94
6
18
4
20
1
19
73
7
57
14
20
3
20
92
8
58
15
20
3
21
88
9
40
16
20
2
22
81
10
54
17
20
2
23
79
11
54
17
20
2
24
72
12
30
5
20
1
25
66
13
69
6
15
15
26
55
a После добавления нитрила в реакционную смесь
до α-нитропроизводных, которые были выделе-
новой кислоты (39), из 2-цианацетамида - кисло-
ны через натриевые соли. Так, в реакции с циан-
та 38, а в случае циануксусного эфира - смесь
уксусной кислотой получена смесь 3-[(адамант-
этил-3-[(адамант-1-ил)амино]-2-нитро-3-оксопро-
1-ил)амино]-2-нитро-3-оксопропионовой кисло-
пионата (40) и этил-3-[(адамант-1-ил)амино]-3-
ты (38) и 3-[(адамант-1-ил)амино]-3-оксопропио-
оксопропионата (41) (схема 4).
Схема 2
O
O
1. HNO3
1. HNO3
H
R
2. (H3C)2C(OH)CN
2. RCN
N
N
H
H
35
1
27-34
R = CH=CH2 (27), C6H5 (28), 3-O2NC6H4 (29), CH2CH2OCH3 (30), 2-ClC6H4 (31), 4-BrC6H4 (32),
CH2CONH2 (33), CH2CH2-1-Mor (34).
Схема 3
O
NH2
1. HNO3
2. NCCH2CH2CN
N
O
(2 экв)
H
1
36
H
O
N
3
1. HNO
2. NCCH2CH2CN
(1 экв)
N
O
H
37
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
10
КЛИМОЧКИН и др.
Таблица 2. Условия синтеза соединений 27-38
R
HNO3, экв
RCN, экв
Температура, °С
Времяa, ч
Продукт
Выход, %
CH2=CN
13
4
10
1
27
70
C6H5
13
3
20
2
28
85
3-O2NC6H4
13
1
20
3
29
55
CH2CH2OCH3
11
1.7
25
1.5
30
73
2-ClC6H4
10
1.1
25
1
31
63
4-BrC6H4
10
1.1
25
0.5
32
68
CH2CONH2
10
1.9
25
1
33
35
CH2CH2-1-Morb
10
1.7
25
1
34
90
C(CH3)2OH
10
1
20
1
35
90
CH2CH2CN
13
2
25
2
36
75
CH2CH2CN
13
1
25
2
37
49
CH2CONH2
15
1.8
10
3
38
33
a После добавления нитрила в реакционную смесь
b Выделен в виде гидрохлорида
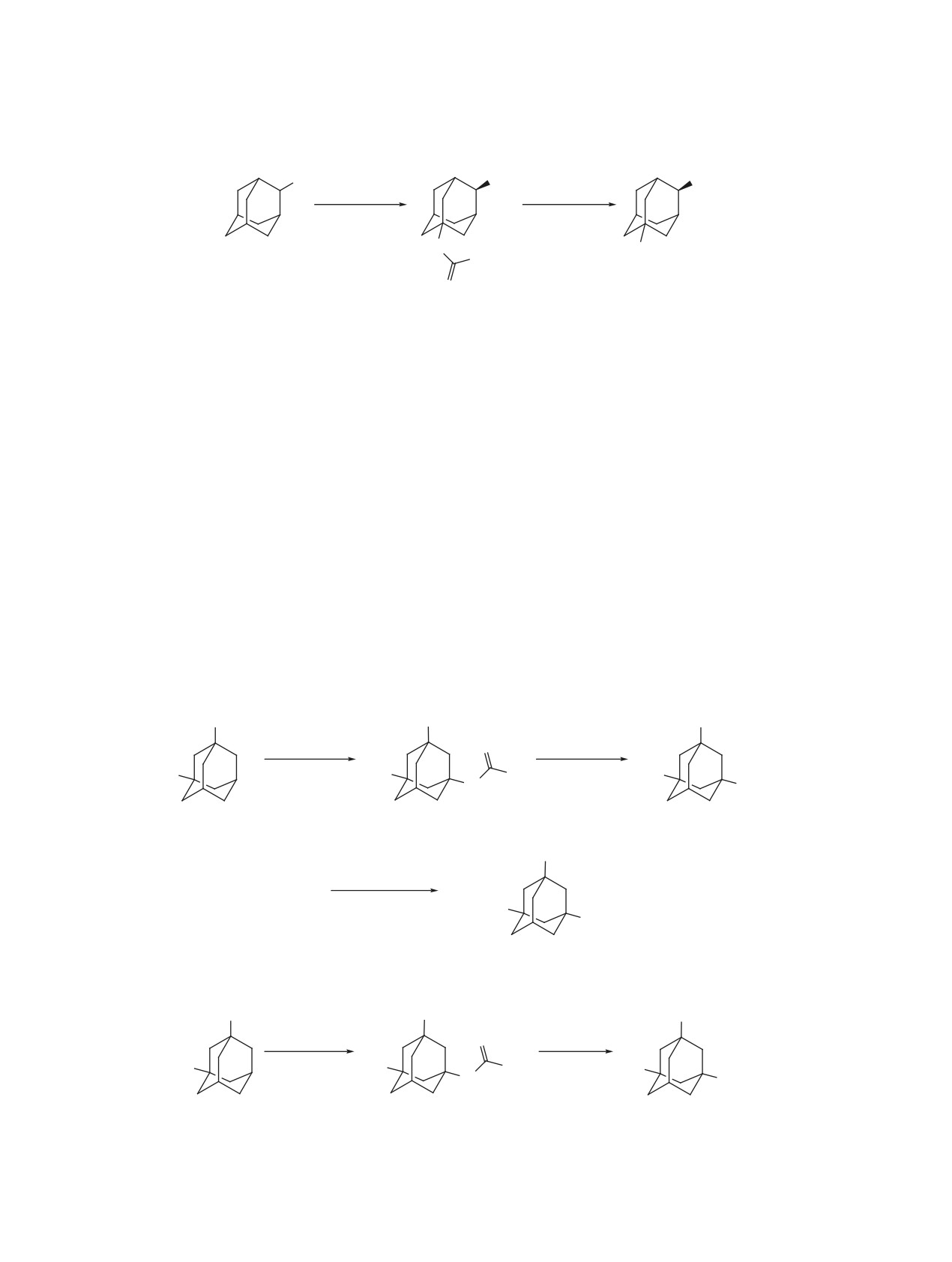
В реакции адамантана (1) с 80 экв 100%-ной
В спектре ЯМР 13С амида 52 содержится 12
азотной кислоты и ацетонитрилом образуется
сигналов, из которых поглощение при 23.7 и
(3-ацетамидоадамант-1-ил)нитрат (42) наряду с
169.2 м.д. соответствует атомам углерода ацетами-
ногруппы.
(адамантан-1,3-диил)диацетамидом (43) (схема 5).
В аналогичных условиях был получен (гомоада-
2-Метиладамантан (53) в условиях реакции
мантан-3,6-диил)диацетамид (44) из гомоадаман-
дает смесь изомерных продуктов: (2-метилада-
тана (45) с выходом 49%. Образования продук-
мант-1-ил)ацетамида (54), Z-(4-метиладамант-1-
тов трансформации каркаса - 1,3-дизамещенных
ил)ацетамида (55) и E-(4-метиладамант-1-ил)аце-
производных адамантана, обнаружено не было. В
тамида (56) (схема 7). По данным спектров ЯМР
спектре ЯМР 13С присутствует 5 сигналов, что ха-
соотношение продуктов 54, 55 и 56 составляет
рактерно для 3,6-дизамещенных производных го-
1.9:1:1.25.
моадамантана. Атомам углерода ацетаминогрупп
(2-Алкиладамант-2-ил)ацетамиды
60-62 уда-
соответствуют сигналы 23.7 и 168.1 м.д. соответ-
лось получить только с использованием соответ-
ственно.
ствующих спиртов 57-59 (схема 8).
Разработанная модификация реакции Риттера
Наличие в структуре исходных субстратов
распространена на родственные адамантану кар-
атомов или функциональных групп, лабильных в
касные углеводороды 45-48 (схема 6).
дымящей азотной кислоте, диктует необходимость
Схема 4
O
O
O
O
1. HNO3
X
+
X
2. NCCH2COX
N
N
H NO2
H
1
38, 40
39, 41
X = OH (38, 39), OC2H5 (40, 41).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
СИНТЕЗ АЦИЛАМИНОПРОИЗВОДНЫХ КАРКАСНОГО СТРОЕНИЯ
11
Схема 5
O
ONO2
HN
CH3
1. HNO3, 80 экв, 6 ч
O
+
2. CH3CN
O
CH
3
N
H
CH3
N
H
1
42
43
O
CH3
HN
1. HNO3, 80 экв, 6 ч
2. CH3CN
O
N
H CH3
45
44
Схема 6
H
1. HNO3-AcOH
N CH3
RH
R
2. CH3CN
O
45-48
49-52
R =
(45, 49),
(46, 50),
(47, 51),
(48, 52),
использования смеси азотная кислота - уксусный
На основании данных спектров ЯМР 13С и резуль-
ангидрид для проведения реакции Риттера [40, 41].
татов, полученных ранее при нитроксилировании
Таким образом из 2-фторадамантана (63) был по-
63 [42], была установлена Z-конфигурация ами-
лучен соответствующий амид 64 с выходом 54%.
да 64. Подобная селективность были отмечена в
Схема 7
CH3
CH3
CH3
CH3
1. HNO3-AcOH
+
+
2. CH3CN
NHAc
AcHN
AcHN
53
54
55
56
Схема 8
57-59
60-62
R = CH3 (57, 60), C2H5 (58, 61), i-C3H7 (59, 62).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
12
КЛИМОЧКИН и др.
Схема 9
F
F
F
CH3CN
1. NaOH, ЭГ
HNO3-Ac2O
2. HCl
HN
NH3+ Cl-
CH3
O
63
64
65
источнике [43] при изучении сольволиза 5-фтор-2-
метаболизма мемантина - 3-гидроксиметил-5-ме-
адамантилтозилатов, поскольку по данным [44]
тиладамантан-1-амину [45, 46], охарактеризован-
утверждается, что атом фтора в E-конфигурации
ному в виде гидрохлорида 68. Из соединения 26
оказывает максимальное дезактивирующее влия-
аналогично был получен аминодиол 69 в виде ги-
ние на анти-положение, так как стабилизация ка-
дрохлорида (схема 10).
тионного центра происходит за счет сверхсопря-
На основе
1,3-бис(трифторметил)адамантана
жения связей С-С, расположенных в антиперипла-
(70) был получен фторированный аналога меман-
нарной конфигурации к реагирующей связи С-Н.
тина. По причине сильного дезактивирующего эф-
Из амида 64 был получен гидрохлорид Z-4-
фекта двух трифторметильных групп в соединении
фторадамантан-1-амина (65) (схема 9).
70 получить соответствующее ацетаминопроиз-
В подобных условиях из (3-метиладамант-1-ил)-
водное 71 удалось только в присутствии 20%-ного
метанола (66) получен (3-ацетоксиметил-5-метил-
олеума. Кислотным гидролизом амида 71 син-
адамант-1-ил)ацетамид (67), щелочной гидролиз
тезирован гидрохлорид
3,5-бис(трифторметил)-
которого открывает путь к основному продукту
адамантан-1-амина (72) (схема 11).
Схема 10
CH2OH
CH2OAc
CH2OH
CH3CN
O
1. NaOH, ЭГ
HNO3-Ac2O
2. HCl
H3C
H3C
CH3
H3C
N
NH3+Cl-
H
66
67
68
CH2OH
1. NaOH, ДЭГ
26
2. HCl
HOH2C
–
NH3+ Cl
69
Схема 11
CF3
CF3
CF3
CH3CN
O
HCl-H2O
HNO3-олеум
F3C
F3C
CH3
F3C
N
NH3
+ Cl-
H
71
72
70
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
СИНТЕЗ АЦИЛАМИНОПРОИЗВОДНЫХ КАРКАСНОГО СТРОЕНИЯ
13
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(3,5-Диметиладамант-1-ил)ацетамид (17) по-
лучен из 1,3-диметиладамантана (4). Выход 85%,
ИК спектры регистрировались на спектрометре
т.пл. 110-111°С (гексан) (лит. т.пл. 110°С [31]).
Shimadzu IR Affinity-1 (Япония). Спектры ЯМР
1Н и 13C зарегистрированы на спектрометре JEOL
(3,5,7-Триметиладамант-1-ил)ацетамид
(18)
NMR-ECX400 (Япония) (400, 100 МГц, соответ-
получен из 1,3,5-триметиладамантана (5). Выход
ственно), внутренний стандарт ТМС. Химические
94%, т.пл. 194-195°С (гексан) (лит. т.пл. 194-195°С
сдвиги сигналов определены в шкале δ, м.д.
[31]).
Температуры плавления определены капилляр-
(3,5-Диэтиладамант-1-ил)ацетамид (19) по-
ным методом на приборе SRS OptiMelt MPA 100
лучен из 1,3-диэтиладамантана (6). Выход 73%,
(Германия), не корректировались. Элементный
т.пл. 116-117°С (гексан) (лит. т.пл. 117.5-118°С
анализ выполнен на элементном анализаторе
[53]).
EuroVector 3000 EA (Италия) с использованием в
качестве стандарта L-цистина.
3-Ацетамидо-1-адамантанкарбоновая кис-
лота (20) получена из 1-адамантанкарбоновой
Соединения 10, 11 были получены по методу
кислоты (7). Выход 92%, т.пл. 260-261°С (ацетон)
[47]. Соединения 12, 66 синтезированы по методи-
(лит. т.пл. 257-258°С [54]).
ке [48]. 1,3-Бис(ацетоксиметил)адамантан (13) по-
лучен по методу [49]. Соединения 45-47 и 53 полу-
3-Ацетамидо-5-метил-1-адамантанкарбо-
новая кислота (21) получена из 3-метил-1-ада-
чены по методикам, представленным в статье [50].
2-Метил-2-адамантанол (57) и 2-этил-2-адаманта-
мантанкарбоновой кислоты (8). Выход 88%, т.пл.
нол (58) получены по методу [51]. 2-Изопропил-
262-264°С (бензол) (лит. т.пл. 265-266°С [55]).
2-адамантанол
(59) синтезирован по методике
(3-Трифторметиладамант-1-ил)ацетамид
[52]
(22) получен из 1-трифторметиладамантана (9).
Общая методика синтеза (адамант-1-ил)-
Выход 81%, т.пл. 94-95°С (этанол) (лит. т.пл. 98°С
ациламидов 14-37. К 98%-ной азотной кислоте
[56]).
при перемешивании порциями добавляли исход-
[3-(4-Метил-3,5-динитрофенил)адамант-1-
ный субстрат (1-13) при температуре не выше 15-
ил]ацетамид (23) получен из 1-(4-метилфенил)-
20°С и выдерживали до полного растворения (0.5-
адамантана (10). Выход 79%, т.пл. 159-160°С (бен-
1.5 ч). Затем при перемешивании порциями до-
зол-гептан). ИК спектр, ν, см-1: 3230, 1640, 1550,
бавляли соответствующий нитрил, выдерживали
1525, 1340. Спектр ЯМР 1H (DMSO-d6), δ, м.д.:
необходимое время при определенной температу-
1.75 c (3Н, CH3), 1.70-2.17 м (12Н, CHAd), 2.48 c
ре (табл. 1, 2) и выливали на измельченный лед.
(3Н, СН3), 2.53-2.58 м (2Н, CHAd), 7.38 c (1Н, NH),
Выпавший осадок отфильтровывали, промывали
7.89 c (2Н, CHаром). Спектр ЯМР 13C (DMSO-d6),
водой до нейтральной среды, сушили и перекри-
δ, м.д.: 20.8 (CH3), 24.5 (CH3), 30.1 (CH), 36.2, 38.0
сталлизовывали.
(CH2), 40.3 (CH2), 41.2 (CH2), 44.9 (CH2), 53.1,
При использовании ацетонитрила получили
122.1, 123.7 (CH), 149.1, 151.6, 169.9. Найдено, %:
следующие соединения.
С 61.19; Н 6.26; N 11.30. C19H23N3O5. Вычислено,
%: С 61.12; Н 6.21; N 11.25.
(Адамант-1-ил)ацетамид (14) получен из ада-
[3,5-Бис(4-метил-3,5-динитрофенил)ада-
мантана (1). Выход 97%, т.пл. 149-151°С (гексан)
(лит. т.пл. 149-151°С [31]).
мант-1-ил]ацетамид (24) получен из 1,3-бис(4-ме-
тилфенил)адамантана (11). Выход 72%, т.пл. 297-
(3-Метиладамант-1-ил)ацетамид (15) полу-
300°С (бензол-гептан). ИК спектр, ν, см-1: 3220,
чен из 1-метиладамантана (2). Выход 89%, т.пл.
1640, 1550, 1525, 1340. Спектр ЯМР 1H (DMSO-d6),
112-113°С (гексан) (лит. т.пл. 112-112.5°С [30]).
δ, м.д.: 1.79 c (3Н, CH3), 1.85-2.37 м (13Н, CHAd),
(3-Этиладамант-1-ил)ацетамид (16) получен
2.46 c (6Н, СН3), 7.41 c (1Н, NH), 8.18 c (4Н,
из 1-этиладамантана (3). Выход 90%, т.пл. 104-
CHаром). Спектр ЯМР 13C (DMSO-d6), δ, м.д.: 20.8
105°С (гексан) (лит. т.пл. 104-104.5°С [30]).
(CH3), 24.4 (CH3), 26.9 (CH), 33.4, 40.2 (CH2), 41.4
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
14
КЛИМОЧКИН и др.
(CH2), 45.1 (CH2), 45.4 (CH2), 52.9, 122.2, 123.4
N1-(Адамант-1-ил)малонамид (33) получен из
(CH), 149.0, 151.8, 169.9. Найдено, %: С 56.50; Н
адамантана (1) и 2-цианоацетамида. Выход 35%,
4.86; N 12.76. C26H27N5O9. Вычислено, %: С 56.42;
т.пл. 166-167°С (ацетон-гексан) (лит. т.пл. 166-
Н 4.92; N 12.65.
167°С [58]).
(3-Ацетамидоадамант-1-ил)метилнитрат
Хлорид 4-{[3-(адамант-1-ил)амино]оксопро-
(25) получен из 1-адамантилметанола (12). Выход
пил}морфолиния (34) получен из адамантана (1)
66%, т.пл. 94-96°С (гексан) (лит. т.пл. 97-100°С
и 3-морфолинопропионитрила. После окончания
[57]).
реакции смесь разбавляли водой, нейтрализовали
с помощью гидрокарбоната натрия, экстрагиро-
[3,5Бис(ацетоксиметил)адамант-1-ил]аце-
вали толуолом. Экстракт обрабатывали соляной
тамид (26) получен из 1,3-бис(ацетоксиметил)-
кислотой. Выпавший осадок отфильтровывали.
адамантана (13). Выход 55%, т.пл. 125-127°С (ди-
Выход 90%, т.пл. 205-208°С (лит. т.пл. 205-208°С
этиловый эфир). Спектр ЯМР 1H (CDCl3), δ, м.д.:
[59]).
1.24-1.50 м (6Н, CHAd), 1.78-1.82 м (4Н, CHAd),
(Адамант-1-ил)формамид
(35) получен из
1.90-2.04 м (6Н, СН3, CHAd), 2.05 с (6Н, CH3),
адамантана (1) и ацетонциангидрина. Выход 90%,
2.20-2.24 м (1Н, CHAd), 3.74 с (4Н, CH2), 7.25 с
т.пл. 140-142°С (гексан) (лит. т.пл. 140-141°С
(1Н, NH). Спектр ЯМР 13C (CDCl3), δ, м.д.: 21.0
[60]).
(CH3), 24.5 (CH3), 28.8 (CH), 35.5, 37.7 (CH2), 40.1
(CH2), 40.5 (CH2), 42.5 (CH2), 52.8, 72.7 (CH2),
(Адамант-1-ил)сукцинамид (36) получен из
170.0, 171.3. Найдено, %: С 64.16; Н 8.15; N 4.22.
адамантана (1) и 2 экв динитрила янтарной кисло-
C18H27NO5. Вычислено, %: С 64.07; Н 8.07; N
ты. Выход 75%, т.пл. 166-167°С (бензол) (лит. т.пл.
4.15.
166-167°С [58]).
(Адамант-1-ил)акриламид
(27) получен из
Ди(адамант-1-ил)сукцинамид (37) получен из
адамантана (1) и акрилонитрила. Выход 70%, т.пл.
адамантана (1) и 1 экв динитрила янтарной кис-
148-149°С (диэтиловый эфир) (лит. т.пл. 148-
лоты. Выход 49%, т.пл. 272-273°С (изопропанол)
149°С [15]).
(лит. т.пл. 272-273°С [58]).
(Адамант-1-ил)бензамид (28) получен из ада-
3-[(Адамант-1-ил)амино]-2-нитро-3-оксо-
мантана (1) и бензонитрила. Выход 85%, т.пл. 149-
пропионовая кислота (38). К 40 мл (0.95 моль)
150°С (гексан) (лит. т.пл. 147-148°С [15]).
98%-ой азотной кислоты при 20°С добавляли 9 г
(0.066 моль) адамантана (1), выдерживали 0.5 ч
(Адамант-1-ил)-3-нитробензамид
(29) по-
до полного растворения и при температуре не бо-
лучен из адамантана (1) и 3-нитробензонитрила.
лее 10°С небольшими порциями добавляли 10 г
Выход 55%, т.пл. 160-162°С (хлороформ) (лит.
(0.12 моль) циануксусной кислоты. Реакционную
т.пл. 160-162°С [58]).
массу выдерживали 1 ч при 10°С и выливали на
(Адамант-1-ил)-3-метоксипропанамид
(30)
лед. Выпавшее масло экстрагировали хлорофор-
получен из адамантана (1) и 3-метоксипропио-
мом (3×30 мл), объединенные экстракты обраба-
нитрила. Выход 73%, т.пл. 91-92°С (гексан) (лит.
тывали насыщенным раствором карбоната натрия,
т.пл. 91-92°С [58]).
выпавший ярко-желтый осадок натриевой соли
отфильтровывали и растворяли в метаноле. К рас-
(Адамант-1-ил)-2-хлорбензамид (31) получен
твору добавляли 1.5 мл соляной кислоты, выпав-
из адамантана (1) и 2-хлорбензонитрила. Выход
ший осадок хлорида натрия отфильтровывали.
63%, т.пл. 148-151°С (гексан) (лит. т.пл. 148-151°С
Маточный раствор упаривали, остаток перекри-
[58]).
сталлизовывали из бензола. Выход 3.32 г (26%),
(Адамант-1-ил)-4-бромбензамид (32) получен
т.пл. 98-99°С (разл.). ИК спектр, ν, см-1: 3290,
из адамантана (1) и 4-бромбензамида. Выход 68%,
3080, 3020, 1680, 1590, 1580, 1310. Спектр ЯМР 1H
т.пл. 163-166°С (бензол) (лит. т.пл. 169-170°С
(DMSO-d6), δ, м.д.: 1.71-2.12 м (15Н, CHAd), 6.40 с
[15]).
(1Н, NH), 6.64 с (1Н, CH), 7.36 с (1Н, OH). Спектр
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
СИНТЕЗ АЦИЛАМИНОПРОИЗВОДНЫХ КАРКАСНОГО СТРОЕНИЯ
15
ЯМР 13С (DMSO-d6), δ, м.д.: 29.1 (CH), 35.8 (CH2),
ла, выдерживали 4 ч при 20°С, выливали на лед
41.1 (CH2), 52.4, 88.6 (CH), 159.9, 168.9. Найдено,
и нейтрализовали карбонатом натрия. Выпавший
%: С 55.40; H 6.24; N 9.78. C13H18N2O5. Вычислено,
осадок отфильтровывали, сушили и перекристал-
%: C 55.31; H 6.34; N 9.93. После упаривания хло-
лизовывали из хлороформа. Выход 1.7 г (27%),
роформных вытяжек дополнительно выделили
т.пл. 225-227°С (лит. т.пл. 226-228°С [61]). Из ма-
4.5 г (29%) 3-[(адамант-1-ил)амино]-3-оксопро-
точного раствора экстракцией дополнительно вы-
пионовой кислоты (39), т.пл. 139-140°С (разл.,
делили 3.5 г (55%) (3-ацетамидоадамант-1-ил)-
хлороформ-гептан). ИК спектр, ν, см-1: 3410,
нитрата (42), т.пл. 129-131°С (лит. т.пл. 129-
1715, 1605, 1255. Спектр ЯМР 1H (DMSO-d6), δ,
131°С [40]).
м.д.: 1.71-2.05 м (15Н, CHAd), 3.25 с (2Н, CH2),
(Гомоадамантан-3,6-диил)диацетамид
(44)
6.27 с (1Н, NH), 8.58 с (1Н, OH). Спектр ЯМР 13С
получен аналогично из гомоадамантана
(45).
(DMSO-d6), δ, м.д.: 28.9 (CH), 32.5 (CH2), 36.4
Выход 49%, т.пл. 217-222°С (хлороформ-бен-
(CH2), 41.0 (CH2), 52.3, 169.9, 170.3. Найдено, %:
зол) (лит. т.пл. 232-234°С [62]). ИК спектр, ν,
С 65.90; H 8.06; N 6.00. C13H19NO3. Вычислено, %:
см-1: 3260, 1630. Спектр ЯМР 1H (DMSO-d6), δ,
C 65.82; H 8.16; N 5.93.
м.д.: 1.42 с (2Н, CHhomoAd), 1.71 с (6Н, CH3), 1.91
с (14Н, CHhomoAd), 7.24 с (2Н, NH). Спектр ЯМР
3-[(Адамант-1-ил)амино]-2-нитро-3-оксо-
13С (DMSO-d6), δ, м.д.: 23.7 (СН3), 27.5 (С1,8), 34.7
пропионовая кислота (38) получена аналогично
(С9), 35.4 (С4,5), 42.1 (С2,7,10,11), 55.0 (С3,6), 168.1.
в реакции адамантана (1) с 2-цианоацетамидом.
Найдено, %: С 68.25; H 9.00; N 10.70. C15H24N2O2.
Выход 33%, т.пл. 98-99°С (разл.)
Вычислено, %: C 68.18; H 9.09; N 10.61.
Этил-3-[(адамант-1-ил)амино]-2-нитро-3-ок-
Общая методика синтеза соединений 49-52,
сопропионат (40) получен аналогично в реакции
60-62. К суспензии соединения 45-48, 53, 57-59
адамантана (1) с цианоуксусным эфиром. Выход
в уксусной кислоте (2 экв) при перемешивании по
12%, т.пл. 112-113°С (разл., гексан-хлороформ).
каплям добавляли 13 экв 100%-ной азотной кис-
ИК спектр, ν, см-1: 3305, 3080, 1765, 1670, 1575,
лоты при 20°С. Реакционную смесь перемешива-
1560, 1310. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.32 т
ли до полного растворения углеводорода. Затем по
(3Н, CH3, J 7.3 Гц), 1.67-2.15 м (15Н, CHAd), 4.25
каплям прибавляли 3.3 экв ацетонитрила, выдер-
к (2Н, CH2, J 7.3 Гц), 5.67 с (1Н, NH), 6.70 с (1Н,
живали 2 ч и выливали на лед. Выпавший осадок
СH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 13.6 (CH3),
отфильтровывали, промывали водой до нейтраль-
29.2 (CH), 36.0 (CH2), 40.7 (CH2), 51.9, 62.7 (CH2),
ной среды, сушили и перекристаллизовывали.
87.9 (CH), 158.6, 168.4. Найдено, %: С 58.12; H
(Гомоадамант-3-ил)ацетамид (49) получен из
7.15; N 9.11. C15H22N2O5. Вычислено, %: C 58.06;
гомоадамантана (45). Выход 90%, т.пл. 139-140°С
H 7.10; N 9.03. Из хлороформных вытяжек выде-
(гептан) (лит. т.пл. 136-137°С [63]).
лен этил-3-[(адамант-1-ил)амино]-3-оксопропи-
онат (41) с выходом 17%, т.пл. 101-103°С (гексан).
(Протоадамант-6-ил)ацетамид (50) получен
ИК спектр, ν, см-1: 3305, 3080, 1765, 1670. Спектр
из протоадамантана (46). Выход 89%, т.пл. 99-
ЯМР 1H (CDCl3), δ, м.д.: 1.30 т (3Н, CH3, J 7.3 Гц),
100°С (гексан) (лит. т.пл. 99.5-100°С [64]).
1.65-2.18 м (15Н, CHAd), 3.19 c (2H, CH2), 4.17 к
(Бицикло[3.3.1]нонан-1-ил)ацетамид (51) по-
(2Н, CH2, J 7.3 Гц), 5.75 с (1Н, NH). Спектр ЯМР
лучен из бицикло[3.3.1]нонана (47). Выход 92%,
13С (CDCl3), δ, м.д.: 13.6 (CH3), 29.0 (CH), 36.1
т.пл. 84-86°С (гексан) (лит. т.пл. 89°С [65]).
(CH2), 40.6 (CH2), 45.8 (CH2), 52.3, 63.5 (CH2),
(эндо-Трицикло[5.2.1.02,6]декан-2-ил)ацета-
169.7, 172.1. Найдено, %: С 67.96; H 8.65; N 5.36.
мид (52) получен из эндо-триметиленнорборнана
C15H23NO3. Вычислено, %: C 67.90; H 8.74; N 5.28.
(48) после элюирования смеси продуктов бен-
(Адамантан-1,3-диил)диацетамид
(43).
К
золом на силикагеле. Выход 8.5%, Rf 0.12 (хло-
85 мл (2 моль) 100%-ой азотной кислоты добавля-
роформ), т.пл. 124-126°С (гексан). ИК спектр, ν,
ли 3.4 г (0.025 моль) адамантана (1) и выдержи-
см-1: 3260, 3070, 1640. Спектр ЯМР 1H (CDCl3), δ,
вали 6 ч при 20°С. Затем в реакционную массу по
м.д.: 1.22-2.48 м (15Н, CH), 1.87 с (3Н, СН3), 7.35
каплям добавляли 15 мл (0.475 моль) ацетонитри-
с (1Н, NH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 22.6,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
16
КЛИМОЧКИН и др.
23.7 (СН3), 24.0, 26.2, 29.0, 34.2, 41.2, 41.6, 46.7,
ангидрида прибавляли 15 мл (0.35 моля) 98%-ой
54.5 (С6), 71.6 (С2), 169.2. Найдено, %: С 74.62; H
азотной кислоты при температуре не более 5°С.
9.97; N 7.31. C12H19NO. Вычислено, %: C 74.57; H
Выдерживали 1 ч, выливали на лед, экстрагирова-
9.91; N 7.25.
ли эфиром. Эфирные вытяжки промывали водой,
сушили сульфатом натрия, эфир упаривали, а оста-
Смесь (2-метиладамант-1-ил)ацетамида (54),
ток перекристаллизовывали из гептана. Выход
Z-(4-метиладамант-1-ил)ацетамида (55), E-(4-
2.2 г (54%), т.пл. 142-143°С (лит. т.пл. 141-143°С
метиладамант-1-ил)ацетамида (56) из 2-мети-
[67]).
ладамантана (53). Содержание соединений 53, 54
и 55 в смеси по данным ЯМР составляет 46, 24 и
(3-Ацетоксиметил-5-метиладамант-1-ил)-
30% соответственно. Выход 75%, т.пл. 93-94°С
ацетамид (67) получен аналогично из (3-метила-
(гексан). ИК спектр, ν, см-1: 3260, 1640. Спектр
дамант-1-ил)метанола (66). Выход 81%, т.пл. 30-
ЯМР 1H (CDCl3), δ, м.д.: 0.88-1.04 м (3Н, СН3),
35°С. ИК спектр, ν, см-1: 3270, 1725, 1640, 1080.
1.34-2.18 м (14Н, СНAd), 1.78 с (3Н, СН3), 6.85-
Спектр ЯМР 1H (CDCl3), δ, м.д.: 0.89 c (3H, CH3),
7.01 м (1Н, NH). Спектр ЯМР 13С (CDCl3), δ, м.д.:
1.24-1.87 м (12Н, CHAd), 1.96 c (3Н, СН3), 2.01
14.2, 17.8, 18.5, 24.2, 24.3, 24.4, 28.8, 29.2, 29.3,
с (3Н, CH3), 2.21-2.24 м (1Н, CHAd), 3.64 с (2Н,
29.6, 29.8, 30.2, 34.3, 34.8, 34.9, 35.1, 36.4, 37.1,
CH2), 7.20 с (1Н, NH). Спектр ЯМР 13C (CDCl3), δ,
37.5, 37.7, 37.9, 39.1, 39.2, 42.0, 42.1, 42.7, 51.4,
м.д.: 21.0 (CH3), 24.5 (CH3), 29.0 (CH3), 29.2 (CH),
51.7, 54.3, 168.8, 169.0, 169.1.
32.4, 34.4, 37.7 (CH2), 40.1 (CH2), 40.6 (CH2), 42.3
(CH2), 52.7, 72.7 (CH2), 170.0, 171.3. Найдено, %: С
(2-Метиладамант-2-ил)ацетамид (60) полу-
68.86; H 9.06; N 5.08. C16H25NO3. Вычислено, %: C
чен из 2-метиладамантан-2-ола (57). Выход 84%,
68.79; H 9.02; N 5.01.
т.пл. 154-156°С (гексан) (лит. т.пл. 156-162°С
[66]).
Гидрохлорид Z-4-фторадамантан-1-амина
(65). Смесь 2 г (0.009 моль) соединения 63, 1.9 г
(2-Этиладамант-2-ил)ацетамид (61) получен
(0.047 моль) гидроксида натрия и 30 мл этилен-
из 2-этиладамантан-2-ола (58). Выход 80%, т.пл.
гликоля нагревали при кипении в течение 10 ч.
126-128°С (гексан). ИК спектр, ν, см-1: 3250, 3070,
Реакционную смесь разбавляли
50 мл воды,
1630. Спектр ЯМР 1H (CDCl3), δ, м.д.: 0.77 д (3Н,
продукт экстрагировали диэтиловым эфиром
CH3, J 6.0 Гц), 1.52-2.30 м (19Н, СНAd, CH2, CH3),
(4×10 мл), органические фракции сушили над
5.15 с (1Н, NH). Спектр ЯМР 13С (CDCl3), δ, м.д.:
твердой щелочью и затем пропускали газообраз-
12.3 (CH3), 24.2 (CH3), 24.8 (CH), 27.8 (CH2), 31.1
ный HCl. Выпавший осадок отфильтровывали и
(CH), 32.4 (CH2), 34.3 (CH2), 38.7 (CH2), 54.3, 169.7.
сушили. Выход 0.88 г (45%), т.пл. > 350°С. ИК
Найдено, %: С 76.05; H 10.39; N 6.38. C14H23NO.
спектр, ν, см-1: 3430, 2020, 1610, 1000. Спектр
Вычислено, %: C 75.97; H 10.47; N 6.33.
ЯМР 1H (DMSO-d6), δ, м.д.: 1.55-2.58 м (13Н,
(2-Изопропиладамант-2-ил)ацетамид
(62)
CHAd), 4.61 д (1Н, CH, JHF 50.5 Гц), 8.60 с (3Н,
получен из
2-изопропиладамантан-2-ола
(59).
NH3+). Спектр ЯМР 13С (DMSO-d6), δ, м.д.: 28.8
Выход 62%, т.пл. 117-120°С (гексан). ИК спектр,
(CH), 30.6 д (СН, 2JCF 26.8 Гц), 31.6 (CH2), 36.8
ν, см-1: 3300, 3100, 1610. Спектр ЯМР 1H (CDCl3),
(CH2), 41.2 (CH2), 52.1, 94.8 д (1JCF 276.8 Гц).
δ, м.д.: 0.79 д (6Н, CH3, J 6.0 Гц), 1.85 c (3H, CH3),
Найдено, %: С 58.46; H 8.40; N 6.86. C10H17ClFN.
1.63-2.15 м (15Н, СНAd, CH), 5.25 с (1Н, NH).
Вычислено, %: C 58.39; H 8.33; N 6.81.
Спектр ЯМР 13С (CDCl3), δ, м.д.: 22.3 (CH3), 24.7
Гидрохлорид
3-гидроксиметил-5-метилада-
(CH), 25.1 (CH3), 31.9 (CH), 32.5 (CH2), 34.3 (CH2),
мантан-1-амина
(68) получен аналогично из
35.4 (CH2), 37.9 (CH2), 54.5, 170.0. Найдено, %: С
(3-ацетоксиметил-5-метиладамант-1-ил)ацетами-
76.63; H 10.79; N 6.00. C15H25NO. Вычислено, %:
да (67). Время реакции составило 20 ч. Выход
C 76.55; H 10.71; N 5.95.
63%, т.пл. > 300°С. ИК спектр, ν, см-1: 3220, 2080,
Z-(4-Фторадамант-1-ил)ацетамид
(64).
К
1600. Спектр ЯМР 1H (DMSO-d6), δ, м.д.: 0.85 с
смеси 3 г (0.019 моль) 2-фторадамантана (63),
(3Н, СН3), 1.24-2.18 м (13Н, CHAd), 3.06 с (2Н,
5 мл ацетонитрила и 8 мл (0.08 моль) уксусного
СН2), 4.46 с (1Н, ОН), 8.17 с (3Н, NH3+). Спектр
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
СИНТЕЗ АЦИЛАМИНОПРОИЗВОДНЫХ КАРКАСНОГО СТРОЕНИЯ
17
ЯМР 13С (DMSO-d6), δ, м.д.: 29.1 (CH3), 29.2 (CH),
1595. Спектр ЯМР 1H (DMSO-d6), δ, м.д.: 1.65-1.80
32.3, 33.1, 37.6 (CH2), 40.3 (CH2), 40.8 (CH2), 42.8
м (6Н, CHAd), 1.95-2.01 м (4Н, CHAd), 2.10-2.12 м
(CH2), 53.0, 69.8 (CH2). Найдено, %: С 62.27; H
(2Н, CHAd), 2.41 уш.с (1Н, CHAd), 8.41 с (1Н, NH3+).
9.49; N 6.09. C12H22ClNO. Вычислено, %: C 62.19;
Спектр ЯМР 13С (DMSO-d6), δ, м.д.: 27.9 (CH),
H 9.57; N 6.04.
31.7 (CH2), 32.9 (CH2), 37.8 (CH2), 39.6 (CH2),
40.9 к (2JCF 26.8 Гц), 52.7, 130.0 к (1JCF 279.9 Гц).
Гидрохлорид
3,5-бис(гидроксиметил)ада-
Найдено, %: С 44.59; H 5.05; N 4.37. C12H16ClF6N.
мантан-1-амина (69) получен аналогично из со-
Вычислено, %: C 44.53; H 4.98; N 4.33.
единения 26 и диэтиленгликоля. Время реакции
составило 15 ч. Выход 87%, т.пл. > 300°С. Спектр
ВЫВОДЫ
ЯМР 1H (DMSO-d6), δ, м.д.: 1.00-1.12 м (2Н,
Предложена новая модификация реакции
CHAd), 1.20-1.31 м (4Н, CHAd), 1.41-1.51 м (4Н,
Риттера, основанная на применении дымящей
CHAd), 1.64-1.72 м (2Н, CHAd), 2.14 с (1Н, CHAd),
азотной кислоты как реакционной среды и ни-
3.01 с (4Н, CH2), 4.35 уш.с (2Н, ОН), 8.20 с (3Н,
трилов как внешних нуклеофилов. Разработанная
NH3+). Спектр ЯМР 13С (DMSO-d6), δ, м.д.: 28.9
модификация позволяет получать вторичные ами-
(CH), 37.3 (CH2), 37.8, 39.9 (CH2), 40.0 (CH2), 42.2
ды, содержащие каркасный фрагмент, с высокими
(CH2), 52.9, 70.9 (CH2). Найдено, %: С 58.27; H
выходами непосредственно из углеводородов и их
8.86; N 5.73. C12H22ClNO2. Вычислено, %: C 58.17;
производных, содержащих акцепторные замести-
H 8.95; N 5.65.
тели.
[3,5-Бис(трифторметил)адамант-1-ил]аце-
БЛАГОДАРНОСТИ
тамид (71). К смеси 200 мл 20%-го олеума и
Исследование выполнено с использованием на-
10 мл (0.42 моль) 100%-ой азотной кислоты при
учного оборудования центра коллективного поль-
перемешивании при температуре не выше 20°С
зования СамГТУ «Исследование физико-химиче-
по каплям добавляли раствор 10 г (0.036 моль)
ских свойств веществ и материалов». Соединения
1,3-бис(трифторметил)адамантана (70) в 80 мл
1-8, 47 взяты из коллекции реактивов кафедры
ацетонитрила. Реакционную смесь оставляли на
органической химии СамГТУ. Фторсодержащие
ночь и затем выливали на лед. Выпавший осадок
производные адамантана были предоставлены
отфильтровывали, промывали насыщенным рас-
Александровым А.М. из Института биоорганиче-
твором гидрокарбоната натрия, водой, сушили и
ской химии и нефтехимии им. В.П. Кухаря НАН
перекристаллизовывали из гексана. Выход 7.0 г
Украины.
(58%), т.пл. 145-147°С. ИК спектр, ν, см-1: 3320,
3075, 1658. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.67-
ФОНДОВАЯ ПОДДЕРЖКА
1.79 м (6Н, CHAd), 1.92-2.01 м (7Н, CHAd, CH3),
Работа выполнена при финансовой поддержке
2.10-2.13 м (2Н, CHAd), 2.40 уш. с (1Н, CHAd),
Минобрнауки РФ в рамках проектной части госу-
5.39 с (1Н, NH). Спектр ЯМР 13С (CDCl3), δ, м.д.:
дарственного задания № 0778-2020-0005.
24.5 (СH3), 27.6 (CH), 31.7 (CH2), 33.0 (CH2), 37.8
КОНФЛИКТ ИНТЕРЕСОВ
(CH2), 39.7 (CH2), 41.1 к (2JCF 26.8 Гц), 51.5, 130.1
к (1JCF 279.9 Гц), 169.9. Найдено, %: С 51.27; H
Авторы заявляют об отсутствии конфликта ин-
5.20; N 4.31. C14H17F6NO. Вычислено, %: C 51.06;
тересов.
H 5.17; N 4.26.
СПИСОК ЛИТЕРАТУРЫ
Гидрохлорид
3,5-бис(трифторметил)ада-
1. Ritter J.J., Minieri P.P. J. Am. Chem. Soc. 1948. 70,
мантан-1-амина (72). Смесь 3 г (0.0084 моль)
4045-4048. doi 10.1021/ja01192a022
[3,5-бис(трифторметил)адамант-1-ил]ацетамида
2. Wanka L., Iqbal K., Schreiner P.R. Chem. Rev. 2013,
(71) и 75 мл 18%-ной соляной кислоты нагревали
113, 3516-3604. doi 10.1021/cr100264t
при кипении в течение 18 ч. Растворитель упари-
3. Spilovska K., Zemek F., Korabecny J., Nepovimova E.,
вали в вакууме. Остаток перекристаллизовывали
Soukup O., Windisch M., Kuca K. Curr. Med. Chem.
из смеси хлороформ-метанол. Выход 2.0 г (69%),
2016, 23, 3245-3266. doi 10.2174/092986732366616
т.пл. 143-146°С. ИК спектр, ν, см-1: 2912, 2862,
0525114026
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
18
КЛИМОЧКИН и др.
4.
Stockdale T.P., Williams C.M. Chem. Soc. Rev. 2015,
17.
Kalkhambkar R.G., Waters S.N., Laali K.K.
44, 7737-7763. doi 10.1039/C4CS00477A
Tetrahedron Lett. 2011, 52, 867-871. doi 10.1016/
5.
Burmistrov V., Morisseau C., Karlov D., Pitushkin D.,
j.tetlet.2010.12.028
Vernigora A., Rasskazova E., Butov G.M., Ham-
18.
Bach R.D., Holubka J.W., Taaffee T.A. J. Org. Chem.
mock B.D. Bioorg. Med. Chem. Lett. 2020, 30, 127430.
1979, 44, 1739-1740. doi 10.1021/jo01324a044
doi 10.1016/j.bmcl.2020.127430
19.
Bach R.D., Taaffee T.H., Rajan S.J. J. Org. Chem.
6.
Zhulenkovs D., Rudevica Z., Jaudzems K., Turks M.,
1980, 45, 165-167. doi 10.1021/jo01289a034
Leonchiks A. Bioorg. Med. Chem. 2014, 22, 5988-
20.
Olah G.A., Balaram Gupta B.G., Narang S.C. Synthesis.
6003. doi 10.1016/j.bmc.2014.09.011
1979, 1979, 274-276. doi 10.1055/s-1979-28644
7.
Shiryaev V.A., Radchenko E.V., Palyulin V.A., Zefi-
21.
Хуснутдинов Р.И., Щаднева Н.А., Маякова Ю.Ю.,
rov N.S., Bormotov N.I., Serova O.A., Shishkina L.N.,
Хисямова Л.Ф., Джемилев У.М. ЖОрХ. 2011, 47,
Baimuratov M.R., Bormasheva K.M., Gruzd Y.A.,
1650-1653. [Khusnutdinov R.I., Shchadneva N.A.,
Ivleva E.A., Leonova M.V., Lukashenko A.V., Osi-
Mayakova Yu.Yu., Khisamova L.F., Dzhemilev U.M.
pov D.V., Osyanin V.A., Reznikov A.N., Shadriko-
Russ. J. Org. Chem. 2011, 47, 1682-1685.] doi 10.1134/
va V.A., Sibiryakova A.E., Tkachenko I.M., Klimoch-
S1070428011110042
kin Yu.N. Eur. J. Med. Chem. 2018, 158, 214-235. doi
22.
Stetter H., Mayer J., Schwarz M., Wulff K. Chem. Ber.
10.1016/j.ejmech.2018.08.009
1960, 93, 226-230. doi 10.1002/cber.19600930133
8.
Rohde J.J., Pliushchev M.A., Sorensen B.K., Wod-
23.
Ren H., Jing H., Pingkai O., Lin J., Jing L. Asian
ka D., Shuai Q., Wang J., Fung S., Monzon K.M.,
J. Chem. 2012, 24, 5107-5110.
Chiou W.J., Pan L., Deng X., Chovan L.E., Ramaiya A.,
24.
Nair V., Suja T.D., Mohanan K. Tetrahedron Lett. 2005,
Mullally M., Henry R.F., Stolarik D.A.F., Imade H.M.,
46, 3217-3219. doi 10.1016/j.tetlet.2005.03.048
Marsh K.C., Beno D.W.A., Fey T.A., Droz B.A., Bru-
ne M.E., Camp H.S., Sham H.L., Uli Frevert E.,
25.
Wanka L., Cabrele C., Vanejews M., Schreiner P.R. Eur.
Jacobson P.B., Link J.T. J. Med. Chem. 2007, 50, 149-
J. Org. Chem. 2007, 2007, 1474-1490. doi 10.1002/
164. doi 10.1021/jm0609364
ejoc.200600975
9.
Onajole O.K., Belewa X.V., Coovadia Y., Goven-
26.
Olah G.A., Wang Q. Synthesis. 1992, 1992, 1090-1092.
der T., Kruger H.G., Maguire G.E.M., Naidu D., So-
doi 10.1055/s-1992-26311
mai B., Singh N., Govender P. Med. Chem. Res. 2011,
27.
Vu D.B., Nguyen T.V., Le S.T., Phan C.D. Org.
20, 1394-1401. doi 10.1007/s00044-010-9490-3
Process Res. Dev. 2017, 21, 1758-1760. doi 10.1021/
10.
Jefferies L.R., Cook S.P. Tetrahedron. 2014, 70, 4204-
acs.oprd.7b00242
4207. doi 10.1016/j.tet.2014.03.072
28.
Veedhi S., Babu S.R. Org. Process Res. Dev. 2013, 17,
11.
Yaragorla S., Singh G., Saini P.L., Reddy M.K.
1597-1602. doi 10.1021/op400234w
Tetrahedron Lett. 2015, 55, 4657-4660. doi 10.1016/
29.
Madhra M.K., Sharma M., Khanduri C.H. Org.
j.tetlet.2014.06.068
Process Res. Dev. 2007, 11, 922-923. doi 10.1021/
12.
Garcia Martinez A., Martinez Alvarez R., Teso Vi-
op700138p
lar E., Garcia Fraile A., Hanack M., Subramanian L.R.
30.
Моисеев И.К., Багрий Е.И., Климочкин Ю.Н., Дол-
Tetrahedron Lett. 1989, 30, 581-582. doi 10.1016/
гополова Т.Н., Земцова М.Н., Трахтенберг П.Л.
S0040-4039(00)95260-2
Изв. АН. СССР. Сер. хим. 1985, 34, 2144-2146.
13.
Плахотник В.М., Ковтун В.Ю., Яшунский В.Г.
[Moiseev I.K., Bagrii E.I., Klimochkin Yu.N.,
ЖОрХ.
1982,
18,
1001-1005.
[Plakhotnik V.M.,
Dolgopolova T.N., Zemtsova M.N., Trakhtenberg P.L.
Kovtun V.Yu., Yashunskiy V.G. J. Org. Chem. USSR.
Russ. Chem. Bull. 1985, 34, 1983-1985.] doi 10.1007/
1982, 18, 867-871.]
BF00953951
14.
Jones S.R., Mellor J.M. J. Chem. Soc. Perkin Trans 1.
31.
Климочкин Ю.Н., Багрий Е.И., Долгополова Т.Н.,
1976, 2576-2581. doi 10.1039/P19760002576
Моисеев И.К. Изв. АН. СССР. Сер. хим. 1988, 4,
15.
Байгузина А.Р., Лутфуллина А.Р., Хуснутди-
878-880. [Klimochkin Yu.N., Bagrii E.I., Dolgopolo-
нов Р.И. ЖОрХ. 2018, 54, 1121-1126. [Bayguzi-
va T.N., Moiseev I.K. Russ. Chem. Bull. 1988, 4, 757-
na A.R., Lutfullina A.R, Khusnutdinov R.I. Russ.
759.] doi 10.1007/BF01455495
J. Org. Chem. 2018, 54, 1127-1133.] doi 10.1134/
32.
Моисеев И.К., Климочкин Ю.Н. А.C.
1197393
S1070428018080031
(1984). СССР. Б.И. 2006, № 26.
16.
Lakouraj M.M., Mokhtary M. Monatsh. Chem. 2009,
33.
Bakke J.M., Storm C.B. Acta Chem. Scand. 1989. 43,
140, 53-56. doi 10.1007/s00706-008-0007-4
399-400.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
СИНТЕЗ АЦИЛАМИНОПРОИЗВОДНЫХ КАРКАСНОГО СТРОЕНИЯ
19
34.
Климочкин Ю.Н., Моисеев И.К. ЖОрХ. 1988, 24,
va A.I., Klimochkin Yu.N. Russ. J. Org. Chem., 2020,
557-560.
56, 1562-1569.] doi 10.1134/S1070428020090109
35.
Климочкин Ю.Н., Ивлева Е.А., Скоморохов М.Ю.
50.
Климочкин Ю.Н., Леонова М.В., Ивлева Е.А.
ЖОрХ. 2020, 56, 1344-1352. [Klimochkin Yu.N., Ivle-
ЖОрХ. 2020, 56, 1516-1526.
va E.A., Skomorokhov M.Yu. Russ. J. Org. Chem. 2020,
51.
Landa S., Vais S., Burkhard J. Collect. Czech. Chem.
56, 1525-1531.] doi 10.1134/S1070428020090043
Commun. 1967. 32, 570-575.
36.
Леонова М.В., Скоморохов М.Ю., Моисеев И.К.,
52.
Fry J.L., Engler E.M., Schleyer P.v.R. J. Am. Chem.
Климочкин Ю.Н. ЖОрХ.
2015,
51,
1737-1743.
Soc. 1972. 94, 4628-4634.
[Leonova M.V., Skomorokhov M.Yu., Moiseev I.K.,
Klimochkin Yu.N. Russ. J. Org. Chem. 2015, 51, 1703-
53.
Henkel J.G., Hane J.T., Gianutsos G. J. Med. Chem.
1709.] doi 10.1134/S1070428015120064
1982, 25, 51-56. doi 10.1021/jm00343a010
37.
Ivleva E.A., Klimochkin Yu.N. Org. Prep.
54.
Новиков С.С., Хардин А.П., Бутенко Л.Н., Ку-
Proced. Int.
2017,
49,
155-162. doi
10.1080/
лиев И.А., Новаков И.А. ЖОрХ. 1980, 16, 1433-
00304948.2017.1291004
1435.
[Novikov S.S., Khardin A.P., Butenko L.N.,
Kulev I.A., Novakov I.A. J. Org. Chem. USSR. 1980,
38.
Климочкин Ю.Н., Юдашкин А.В., Жилкина Е.О.,
16, 1231-1232.]
Ивлева Е.А., Моисеев И.К., Ошис Я.Ф. ЖОрХ. 2017,
53, 959-964. [Klimochkin Yu.N., Yudashkin A.V.,
55.
Степанов Ф.Н., Сребродольский Ю.Т. ЖОрХ. 1966,
Zhilkina E.O., Ivleva E.A., Moiseev I.K., Oshis Ya.F.
2, 1612-1615. [Stepanov F.N., Srebrodol’skii Yu.T. J.
Russ. J. Org. Chem. 2017, 53, 971-976.] doi 10.1134/
Org. Chem. USSR. 1966, 2, 1590-1592.]
S1070428017070028
56.
Feldhoff R., Haas A., Lieb M. J. Fluorine Chem. 1994,
39.
Ивлева Е.А., Погуляйко А.В., Климочкин Ю.Н.
67, 245-251. doi 10.1016/0022-1139(93)02968-K
ЖОрХ. 2018, 54, 1283-1289. [Ivleva E.A., Pogulyai-
57.
Fokin A.A., Peleshanko S.A., Gunchenko P.A., Gu-
ko A.V., Klimochkin Yu.N. Russ. J. Org. Chem. 2018,
sev D.V., Schreiner P.R. Eur. J. Org. Chem.
54, 1294-1300.] doi 10.1134/S107042801809004X
2000,
2000,
3357-3362. doi
10.1002/1099-
40.
Климочкин Ю.Н., Ивлева Е.А., Моисеев И.К.
0690(200010)2000:19<3357::AID-EJOC3357>
ЖОрХ. 2020, 56, 1353-1362.
3.0.CO;2-R
41.
Моисеев И.К., Климочкин Ю.Н., Земцова М.Н.,
58.
Климочкин Ю.Н., Моисеев И.К., Бореко Е.И., Вла-
Трахтенберг П.Л. ЖОрХ.
1984,
20,
1435-1438.
дыко Г.В., Коробченко Л.В. Хим.-фарм. ж. 1989,
[Moiseev I.K., Klimochkin Yu.N., Zemtsova M.N.,
23,
418-421.
[Klimochkin Yu.N., Moiseev I.K.,
Trakhtenberg P.L. J. Org. Chem. USSR. 1984, 20,
Boreko E.I.,
Vladyko G.V., Korobchenko L.V.
1307-1309.]
Pharm. Chem. J. 1989, 23, 304-307.] doi 10.1007/
42.
Климочкин Ю.Н., Леонова М.В., Моисеев И.К.,
BF00758419
Александров А.М. ЖОрХ. 1997, 33, 387-392.
59.
Климочкин Ю.Н., Моисеев И.К., Владыко Г.В., Ко-
43.
Xie M., le Noble W.J. J. Org. Chem. 1989, 54, 3839-
робченко Л.В., Бореко Е.И. Хим.-фарм. ж. 1991,
3841. doi 10.1021/jo00277a019
25, 46-49. [Klimochkin Yu.N., Moiseev I.K., Vlady-
44.
Adcock W., Trout N.A. J. Org. Chem. 1991, 56, 3229-
ko G.V., Korobchenko L.V., Boreko E.I. Pharm. Chem.
3238. doi 10.1021/jo00010a012
J. 1991, 25, 485-488.] doi 10.1007/BF00772005
45.
Wessemann W., Schollmeyer J.D., Sturm G. Arzheim.
60.
Sasaki T., Eguchi S., Katada T. J. Org. Chem. 1974, 39,
Frosch. 1977. 27, 1471-1477.
1239-1242. doi 10.1021/jo00923a017
46.
Литвин Е.А., Колыванов Г.Б., Жердев В.П. Фар-
61.
Климочкин Ю.Н., Ивлева Е.А., Сержантова А.С.,
макокинетика и фармакодинамика. 2012, 1, 18-
Ширяев А.К., Моисеев И.К. ЖОрХ.
2017,
53,
24.
1156-1161. [Klimochkin Yu.N., Ivleva E.A., Ser-
47.
Moисеев И.К., Дорошенко Р.И. ЖОрХ. 1982. 18,
zhantova A.S., Shiryaev A.K., Moiseev I.K. Russ.
1233-1236.
J. Org. Chem. 2017, 53, 1170-1175.] doi 10.1134/
48.
Liu Z., Yang S., Jin X., Zhang G., Guo B., Chen H.,
S1070428017080024
Yu P., Sun Y., Zhang Z., Wang Y. Med. Chem. Commun.
62.
Fokin A.A., Gunchenko P.A., Kulik N.I., Iksano-
2017, 8, 135-147. doi 10.1039/c6md00509h
va S.V., Krasutsky P.A., Gogoman I.V., Yurchen-
49.
Ивлева Е.А., Казакова А.И., Климочкин Ю.Н.
ko A.G. Tetrahedron.
1996,
52,
5857-5866. doi
ЖОрХ. 2020, 56, 1392-1401. [Ivleva E.A., Kazako-
10.1016/0040-4020(96)00215-3
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
20
КЛИМОЧКИН и др.
63. Степанов Ф.Н., Гутс С.С. Изв. АН СССР. Сер.
Kukhar’ V.P. J. Org. Chem. USSR. 1987, 23, 2101-
хим. 1970, 2, 430-434. [Stepanov F.N., Guts S.S.
2103.]
Russ. Chem. Bull. 1970, 19, 373-376.] doi 10.1007/
66. Шокова Э.А., Мусулу Т., Лузиков Ю.Н., Кова-
BF00853388
лев В.В. ЖОрХ. 1999, 35, 869-881. [Shokova E.A.,
64. Karim A., Mckervey M.A. J. Chem. Soc. Perkin
Mousoulou T., Luzikov Yi N., Kovalev V.V. Russ.
Trans. 1. 1974, 2475-2479. doi 10.1039/P19740002475
J. Org. Chem. 1999, 35, 844-856.]
65. Баклан В.Ф., Хильчевский А.Н., Кухарь В.П. ЖОрХ.
67. Vincent F., Tardivel R., Mison P. Tetrahedron. 1976,
1987, 23, 2381-2384. [Baklan V.F., Khil’chevskii A.N.,
32, 1681-1688. doi 10.1016/0040-4020(76)85158-7
Synthesis of Acylamino Derivatives of Cage Structure
in Nitric Acid Medias
Yu. N. Klimochkin, M. V. Leonova, E. A. Ivleva*, A. I. Kazakova, and M. S. Zaborskaya
Samara State Technical University, ul. Molodogvardeiskaya, 244, Samara, 443100 Russia
*e-mail: ivleva.ea@samgtu.ru
Received October 5, 2020; revised October 16, 2020; accepted October 19, 2020
An efficient method for preparing of secondary amides based on the Ritter reaction of cage substrates with a
wide range of nitriles in fuming nitric acid and its mixtures has been developed.
Keywords: Ritter reaction, fuming nitric acid, amides, cage compounds
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021