ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 1, с. 21-28
УДК 547.745 + 547.756
ВЗАИМОДЕЙСТВИЕ ПИРРОЛО[2,1-c][1,4]ОКСАЗИН-
1,6,7-ТРИОНОВ С 3-(АРИЛАМИНО)-5,5-ДИМЕТИЛ-
2-ЦИКЛОГЕКСЕН-1-ОНАМИ.
СИНТЕЗ СПИРО[ИНДОЛ-3,2'-ПИРРОЛОВ]
© 2021 г. Н. А. Третьяков, М. В. Дмитриев, А. Н. Масливец*
ФГБОУ ВО «Пермский государственный национальный исследовательский университет»,
Россия, 614990 Пермь, ул. Букирева, 15
*e-mail: koh2@psu.ru
Поступила в редакцию 06.10.2020 г.
После доработки 17.10.2020 г.
Принята к публикации 19.10.2020 г.
8-Ароил-3,4-дигидропирроло[2,1-c][1,4]оксазин-1,6,7(1Н)-трионы реагируют с 3-(ариламино)-5,5-диме-
тил-2-циклогексен-1-онами с образованием 1-арил-3'-ароил-4'-гидрокси-1'-(2-гидроксиалкил)-6,6-диме-
тил-6,7-дигидроспиро[индол-3,2'-пиррол]-2,4,5'(1Н,1'Н,5Н)-трионов, структура которых подтверждена
методом рентгеноструктурного анализа.
Ключевые слова: пирролооксазинтрион, енаминокетон, 5,5-диметил-2-циклогексен-1-он, спиро[ин-
дол-3,2'-пиррол]трион, РСА
DOI: 10.31857/S051474922101002X
ВВЕДЕНИЕ
пами β-CH и NH енаминофрагмента енаминов
атомов С2=О и С1=О с замыканием пиррольного
Существуют три направления взаимодей-
цикла и переэтерефикацией ε-лактона в γ-лак-
ствия гетарено[е]пиррол-2,3-дионов с енаминами.
тон и образованием спиро[фуран-2,3'-индолов]
Спиро-гетероциклизации
3-ацилпирроло[1,2-а]-
(схема 1) [12].
[1,4]бензоксазин-1,2,4-трионов под действием
Реакции
пирроло[2,1-c][1,4]оксазин-1,6,7-
карбоциклических [1-5], гетероциклических [6-8]
трионов с енаминами ранее не изучались.
и ациклических енаминов [9, 10] протекают по схе-
ме последовательной атаки группами β-CH и NH
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
енаминофрагмента енаминов атомов С3а и С4=О
Кипячением
8-ароил-3,4-дигидропирроло-
пирролобензоксазинтрионов с расщеплением
[2,1-c][1,4]оксазин-1,6,7(1Н)-трионов
1a-h с
3-
оксазинонового цикла по связи С4-О5. 3-Ароил-
(ариламино)циклогексенонами 2a, b в соотно-
5-фенилпирроло[1,2-а]хиноксалин-1,2,4-трионы
шении 1:1 в безводном хлороформе в течение 5-
взаимодействуют с
3-аминоциклогекс-2-енона-
10 мин (до исчезновения красной окраски ис-
ми с последовательной атакой группами β-CH
ходных пирролооксазинтрионов) происходит об-
и NH енаминофрагмента енаминов атомов С3а
разование
1-арил-3'-ароил-4'-гидрокси-1'-(2-ги-
и С2=О и образованием мостиковых 2,7b-ме-
дроксиалкил)-6,6-диметил-6,7-дигидроспиро[ин-
танобензо[5,6][1,4]диазепино[1,7-a]хиноксалинов
дол-3,2'-пиррол]2,4,5'(1Н,1'Н,5Н)-трионов
3a-i
[11].
3-Ароилпирроло[1,2-с][4,1]бензоксазепин-
(схема 2) [13], структура которых подтверждена
1,2,4-трионы взаимодействуют с 3-аминоцикло-
методом рентгеноструктурного анализа (РСА) на
гекс-2-енонами с последовательной атакой груп-
примере соединения 3f (рис. 1).
21
22
ТРЕТЬЯКОВ и др.
Схема 1
R
N
O
X = O
N
O
OH
COAr
O
OH
R = H, CH2Ph, цикло-C6H11, CH2CH=CH2,
Ph, 4-MeOC6H4, 4-ClC6H4;
Ar = Ph, 4-MeOC6H4, 4-BrC6H4.
H
N
H
X O
R
N O
O
O
N
COAr
X = N
N
ArOC
O
O
O
N
HO R
R = CH2Ph, CH2CH=CH2;
Ar = 4-MeOC6H4, 4-BrC6H4.
R
N
O
X = CH2O
COAr
O
O
N
H
O
CH2OH
R = CH2Ph, 4-BrC6H4;
Ar = Ph, 4-ClC6H4.
Соединения 3a-i - высокоплавкие светло-жел-
дублеты протонов метиленовых групп циклогек-
тые кристаллические вещества, растворимые в
сенона (2.03-2.05, 2.21-2.26, 2.33-2.36 и 2.64-
ДМСО и ДМФА, ацетоне, этилацетате, хлорофор-
2.66 м.д.), уширенные синглеты протонов спир-
ме, 1,4-диоксане, труднорастворимые в аромати-
товой и енольной групп ОН (4.46-4.79 и 11.85-
ческих углеводородах, нерастворимые в алканах и
12.32 м.д.).
воде.
В спектрах ЯМР 13С соединений 3a-i присут-
В ИК спектрах соединений 3a-i присутству-
ствуют характерные сигналы атомов углерода
ют уширенные сигналы групп OH (3464-3546 и
кетонных карбонильных групп ароильного фраг-
3054-3175 см-1), лактамной карбонильной груп-
мента (190.4-190.6 м.д.), группы С4=О (187.8-
пы С5'=О (1736-1763 см-1), кетонных карбониль-
189.2 м.д.) и группы С2=О (173.8-174.8 м.д.),
ных групп С2=О (1691-1708 см-1), С4=О (1646-
лактамной карбонильной группы С5'=О (166.1-
1672 см-1) и группы С=О ароильного фрагмента
167.2 м.д.), атома C4'OH (164.9-166.0 м.д.), а также
(1624-1635 см-1).
спиро-углеродного атома С3(2') (67.6-68.1 м.д.).
В спектрах ЯМР 1Н соединений 3a-i присут-
Соединение 3f кристаллизуется в центросим-
ствуют характеристические сигналы: протонов
метричной пространственной группе триклин-
метильных групп (0.79-0.82 и 1.05-1.06 м.д.),
ной сингонии в виде сольвата с ацетонитрилом
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
ВЗАИМОДЕЙСТВИЕ ПИРРОЛО[2,1-c][1,4]ОКСАЗИН-1,6,7-ТРИОНОВ
23
Схема 2
H
N
Ar2
H
Ar2
N
R O O
Ar2
N
O
O
R
O O
O
2a, b
HO
N
O
N
O
O
Ar1
O
N
R
Ar1
O
Ar1
O
O
OH
O
OH
1a-h
3a-i
1a-h, R = H, Ar1 = Ph (а), 4-ClC6H4 (b), 4-BrC6H4 (c), 4-MeC6H4 (d), R = Me, Ar1 = Ph (e), 4-ClC6H4 (f),
4-BrC6H4 (g), 4-MeC6H4 (h); 2a, b, Ar2 = Ph (а), 4-BrC6H4 (b); 3a-i, Ar2 = Ph, R = H, Ar1 = Ph (а),
4-ClC6H4 (b), 4-BrC6H4 (c), 4-MeC6H4 (d), Ar2 = 4-BrC6H4, R = H, Ar1 = Ph (e), 4-ClC6H4 (f),
4-BrC6H4 (g), 4-MeC6H4 (h), Ar2 = 4-BrC6H4, R = Me, Ar1 = Ph (i).
в соотношении 1:1. Значения всех длин связей,
ки группами β-CH и NH енаминофрагмента ена-
валентных и торсионных углов лежат в интерва-
минов 2a, b атомов С8а и С1 соединений 1a-h и
ле ожидаемых значений. Пиррольные циклы пло-
последующего раскрытия оксазинового цикла по
ские. Циклогексановое кольцо находится в кон-
связи С1-O2 по схеме, близкой к описанной ранее
формации софа, атом C9 выходит из плоскости
для пирролобензоксазинтрионов [1-10].
остальных атомов цикла на 0.62 Å. Гидроксильная
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
группа гидроксиэтильного фрагмента участвует
Спектры ЯМР 1Н и 13C записывали на спек-
в образовании трехцентровой водородной связи:
трометре Bruker Avance III HD 400 (Швейцария)
внутримолекулярной водородной связи (ВВС)
[рабочая частота 400 (1Н) и 100 (13С) МГц] в
O6-H6∙∙∙O3 и межмолекулярной водородной связи
ДМСО-d6, внутренний стандарт - остаточные сиг-
(МВС) O6-H6∙∙∙O1 (см. таблицу). Молекулы в кри-
налы растворителя (2.50 м.д. для ядер 1H, 39.5 м.д.
сталле образуют центросимметричные димеры за
для ядер 13С). Спектры ЯМР 1Н и 13С записыва-
счет двух МВС O2-H2···O6 и O6-H6∙∙∙O1 (рис. 2).
ли сразу после растворения образца. ИК спектры
По-видимому, соединения
3a-i образуются
записывали на спектрофотометре Perkin Elmer
вследствие последовательной нуклеофильной ата-
Spectrum Two (Perkin Elmer, США) в вазелиновом
масле. Элементный анализ выполняли на анали-
заторе vario Micro cube (Германия). Температуру
O3
O6 H2 O2
6
H
O1
O1
H6
O2
3
O
H2
6
O
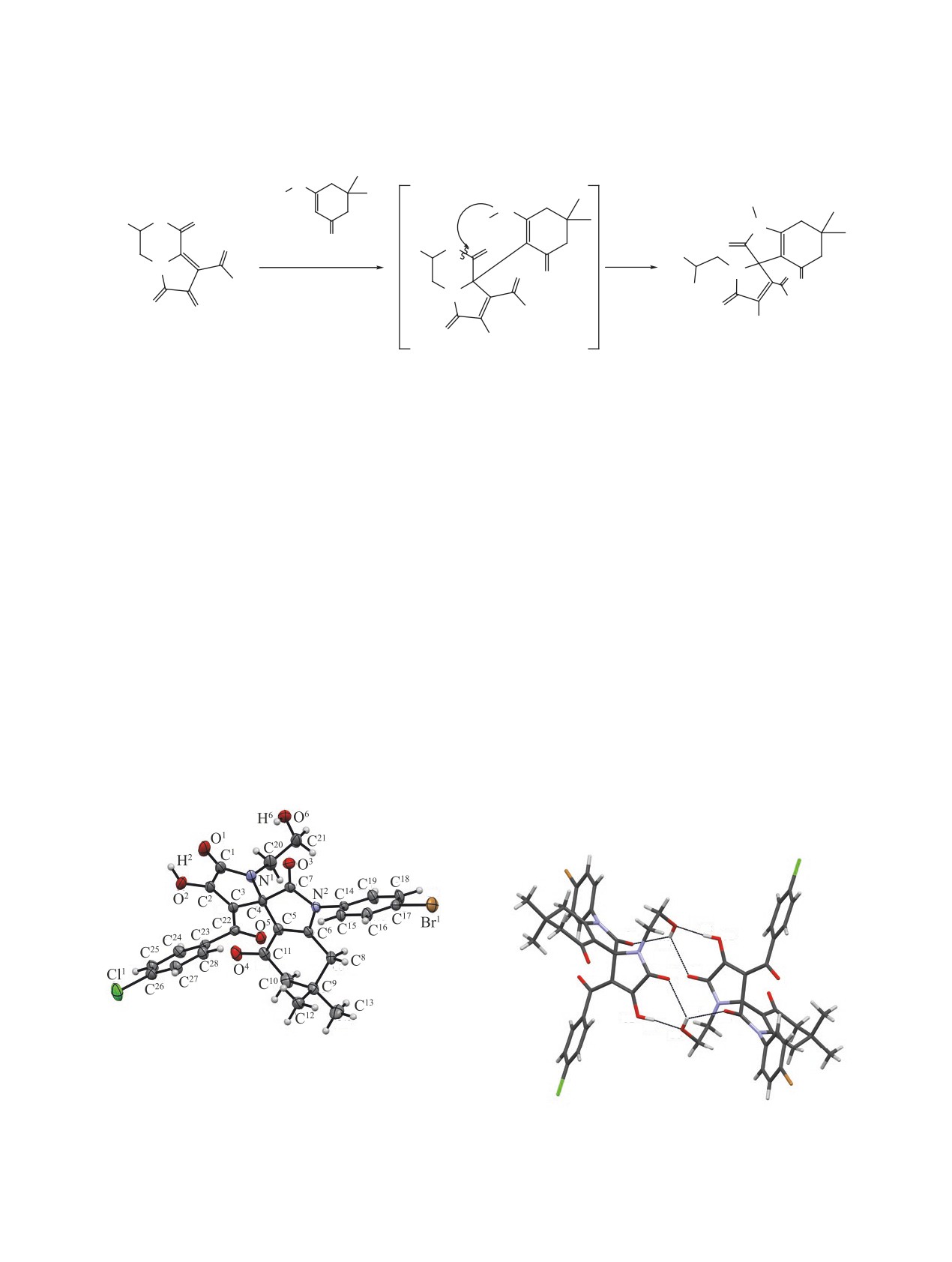
Рис. 1. Общий вид молекулы 1-(4-бромфенил)-4'-гид-
рокси-1'-(2-гидроксиэтил)-6,6-диметил-3'-(4-хлорбен-
зоил)-6,7-дигидроспиро[индол-3,2'-пиррол]-2,4,5'-
(1H,1'H,5H)-триона (3f) по данным РСА в тепловых
эллипсоидах 30% вероятности. Молекула ацетонитри-
Рис. 2. Образование центросимметричных димеров в
ла не изображена
кристалле соединения 3f
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
24
ТРЕТЬЯКОВ и др.
Параметры водородных связей в кристалле соединения 3f
D-H···A
d(D-H), Е
d(H···A), Е
d(D···A), Е
Угол DHA, град
O2-H2···O6 [2-x, 1-y, 1-z]
0.86(5)
1.72(5)
2.575(4)
172(4)
O6-H6∙∙∙O1 [2-x, 1-y, 1-z]
0.73(6)
2.42(6)
2.924(5)
128(6)
O6-H6∙∙∙O3
0.73(6)
2.39(6)
2.930(4)
133(6)
плавления определяли на аппарате Mettler Toledo
C5'=O), 1626 (ArC=O). Спектр ЯМР 1Н, δ, м.д.:
MP70 (Швейцария). Индивидуальность синте-
0.82 с (3Н, Ме), 1.05 с (3Н, Ме), 2.05 д (1Н, CH2,
зированных соединений подтверждали методом
J 15.9 Гц), 2.23 д (1Н, CH2, J 18.1 Гц), 2.35 д
ТСХ на пластинах Merck Silica gel 60 F254, элю-
(1Н, CH2, J 15.9 Гц), 2.64 д (1Н, CH2, J 18.3 Гц),
енты - толуол, этилацетат, толуол-этилацетат, 5:1,
3.10-3.18 м (1H, NCH2CH2OH), 3.39-3.47 м (3H,
проявляли парами иода и УФ излучением 254 нм.
NCH2CH2OH), 4.79 уш.с (1Н, OН), 7.45-7.54 м
(5Наром), 7.56-7.63 м (3Наром), 7.67 д (2Наром, J
Рентгеноструктурный анализ (РСА) выполнен
7.1 Гц), 11.85 уш.с (1Н, OН). Спектр ЯМР 13C,
на монокристальном дифрактометре Xcalibur Ruby
δ, м.д.: 26.5, 28.8, 33.9, 36.2, 43.5, 50.5, 58.6, 67.8
(Oxford Diffraction, Англия) с ССD-детектором по
[С3(2')], 108.6, 117.4, 127.4, 128.1, 128.6, 129.5,
стандартной методике (MoKα-излучение, 295(2) K,
132.6, 133.4, 137.5, 152.4, 165.9 (C4'OH),
166.3
ω-сканирование с шагом 1°). Поглощение учте-
(C5'=O), 174.3 (C2=O), 189.2 (C4=O), 190.5 (COAr).
но эмпирически с использованием алгоритма
Найдено, %: C 69.47; H 5.22; N 5.57. C28H26N2O6.
SCALE3 ABSPACK [14]. Структура расшифрова-
Вычислено, %: C 69.12; H 5.39; N 5.76.
на с помощью программы SHELXT [15] и уточ-
нена полноматричным методом наименьших ква-
Соединения 3b-d получены аналогично соеди-
дратов (МНК) по F2 в анизотропном приближении
нению 3a.
для всех неводородных атомов с использованием
4'-Гидрокси-1'-(2-гидроксиэтил)-6,6-диме-
программы SHELXL [16] с графическим интер-
тил-3'-(4-хлорбензоил)-1-фенил-6,7-дигид-
фейсом OLEX2 [17]. Атомы водорода групп OH
роспиро[индол-3,2'-пиррол]-2,4,5'(1H,1'H,-
уточнены независимо в изотропном приближении.
5H)-трион (3b). Получен из 0.301 г (0.985 ммоль)
При уточнении остальных атомов водорода ис-
соединения 1b, 0.212 г (0.985 ммоль) соединения
пользована модель наездника.
2a. Выход 0.401 г (79%), т.пл. 185-187°С (толу-
Исходные пирролоокзазинтрионы 1a-h синте-
ол). ИК спектр, ν, см-1: 3546 (NCH2CH2OH), 3116
зированы взаимодействием соответствующих ге-
(C4'OН), 1750, 1693, 1651 (C2=O, C4=O, C5'=O),
тероциклических енаминов с оксалилхлоридом по
1628 (ArC=O). Спектр ЯМР 1Н, δ, м.д.: 0.82 с (3Н,
ранее описанной методике [18]. Исходные енами-
Ме), 1.05 с (3Н, Ме), 2.05 д (1Н, CH2, J 15.9 Гц),
нокетоны 2a, b синтезированы по ранее описанной
2.23 д (1Н, CH2, J 18.1 Гц), 2.35 д (1Н, CH2, J
методике [19].
16.1 Гц), 2.65 д (1Н, CH2, J 18.1 Гц), 3.11-3.17 м
3'-Бензоил-4'-гидрокси-1'-(2-гидроксиэтил)-
(1H, NCH2CH2OH), 3.37-3.46 м (3H, NCH2CH2OH),
6,6-диметил-1-фенил-6,7-дигидроспиро[индол-
4.64 уш.с (1Н, OН), 7.47 т (2Наром, J 7.3 Гц), 7.52
3,2'-пиррол]-2,4,5'(1H,1'H,5H)-трион
(3a). К
т (1Наром, J 7.3 Гц), 7.56 д (2Наром, J 8.6 Гц), 7.60
раствору 0.35 г (1.3 ммоль) соединения 1a в 15
д (2Наром, J 7.6 Гц), 7.65 д (2Наром, J 8.1 Гц), 11.96
мл сухого хлороформа добавляли раствор 0.28 г
уш.с (1Н, OН). Спектр ЯМР 13C, δ, м.д.: 26.5, 28.7,
(1.3 ммоль) соединения 2a в 5 мл сухого хлоро-
33.9, 36.2, 43.4, 50.5, 58.6, 67.6 [С3(2')], 108.5, 116.9,
форма, кипятили 5 мин, растворитель удаляли,
127.3, 128.1, 129.5, 130.4, 133.3, 136.2, 137.4, 153.0,
перекристаллизовывали в толуоле, осадок отфиль-
165.9 (C4'OH), 166.1 (C5'=O), 174.2 (C2=O), 187.8
тровывали. Выход 0.585 г (94%), т.пл. 231-233°С
(C4=O), 190.5 (COAr). Найдено, %: C 64.92; H 4.52;
(толуол). ИК спектр, ν, см-1: 3529 (NCH2CH2OH),
N 5.14. C28H25ClN2O6. Вычислено, %: C 64.55; H
3155 (C4'OН), 1749, 1691, 1650 (C2=O, C4=O,
4.84; N 5.38.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
ВЗАИМОДЕЙСТВИЕ ПИРРОЛО[2,1-c][1,4]ОКСАЗИН-1,6,7-ТРИОНОВ
25
3'-(4-Бромбензоил)-4'-гидрокси-1'-(2-гид-
роспиро[индол-3,2'-пиррол]-2,4,5'(1H,1'H,-
роксиэтил)-6,6-диметил-1-фенил-6,7-ди-
5H)-трион (3e). К раствору 0.350 г (1.29 ммоль)
гидроспиро[индол-3,2'-пиррол]-2,4,5'(1H,1'H,-
соединения 1a в 15 мл сухого хлороформа добав-
5H)-трион (3c). Получен из 0.345 г (0.991 ммоль)
ляли раствор 0.380 г (1.29 ммоль) соединения 2b в
соединения 1c, 0.213 г (0.991 ммоль) соединения
5 мл сухого хлороформа, кипятили 5 мин, раство-
2a. Выход 0.479 г (86%), т.пл. 182-184°С (толу-
ритель удаляли, перекристаллизовывали в толуо-
ол). ИК спектр, ν, см-1: 3546 (NCH2CH2OH), 3115
ле, осадок отфильтровывали. Выход 0.727 г (99%),
(C4'OН), 1750, 1693, 1646 (C2=O, C4=O, C5'=O),
т.пл. 180-182°С (толуол). ИК спектр, ν, см-1: 3480
1627 (ArC=O). Спектр ЯМР 1Н, δ, м.д.: 0.82 с (3Н,
(NCH2CH2OH), 3054 (C4'OН), 1763, 1694, 1650
Ме), 1.05 с (3Н, Ме), 2.05 д (1Н, CH2, J 15.9 Гц),
(C2=O, C4=O, C5'=O), 1635 (ArC=O). Спектр ЯМР
2.22 д (1Н, CH2, J 18.1 Гц), 2.36 д (1Н, CH2, J
1Н, δ, м.д.: 0.83 с (3Н, Ме), 1.06 с (3Н, Ме), 2.05 д
15.9 Гц), 2.65 д (1Н, CH2, J 18.1 Гц), 3.11-3.17 м
(1Н, CH2, J 16.0 Гц), 2.25 д (1Н, CH2, J 18.1 Гц),
(1H, NCH2CH2OH), 3.39-3.47 м (3H, NCH2CH2OH),
2.33 д (1Н, CH2, J 15.9 Гц), 2.64 д (1Н, CH2, J
4.46 уш.с (1Н, OН), 7.47 д (2Наром, J 7.1 Гц), 7.52
18.1 Гц), 3.05-3.13 м (1H, NCH2CH2OH), 3.38-3.48
т (1Наром, J 7.3 Гц), 7.58 д (2Наром, J 8.6 Гц), 7.61
м (3H, NCH2CH2OH), 4.71 уш.с (1Н, OН), 7.41-7.45
д (2Наром, J 7.6 Гц), 7.70 д (2Наром, J 8.6 Гц), 12.00
м (4Наром), 7.53 т (1Наром, J 7.3 Гц), 7.67 д (2Наром,
уш.с (1Н, OН). Спектр ЯМР 13C, δ, м.д.: 26.5, 28.8,
J 7.1 Гц), 7.81 д (2Наром, J 8.7 Гц), 12.22 уш.с (1Н,
33.9, 36.2, 43.5, 50.5, 58.6, 67.7 [С3(2')], 108.6, 116.9,
OН). Спектр ЯМР 13C, δ, м.д.: 18.4, 26.6, 28.7, 33.8,
126.5, 127.4, 128.8, 129.5, 130.5, 131.3, 133.3, 136.6,
36.1, 43.4, 50.6, 56.0, 58.7, 67.8 [С3(2')], 109.3, 121.7,
153.1, 166.0 (C4'OH), 166.2 (C5'=O), 174.2 (C2=O),
127.8, 128.6, 129.5, 131.9, 132.5, 132.8, 138.1, 164.9
188.1 (C4=O), 190.6 (COAr). Найдено, %: C 59.85;
(C4'OH), 167.2 (C5'=O), 174.8 (C2=O), 187.9 (C4=O),
H 4.21; N 4.61. C28H25BrN2O6. Вычислено, %: C
190.4 (COAr). Найдено, %: C 59.84; H 4.32; N 4.67.
59.48; H 4.46; N 4.95.
C28H25BrN2O6. Вычислено, %: C 59.48; H 4.46; N
4'-Гидрокси-1'-(2-гидроксиэтил)-6,6-диме-
4.95.
тил-3'-(4-метилбензоил)-1-фенил-6,7-дигид-
Соединения 3f-i получены аналогично соеди-
роспиро[индол-3,2'-пиррол]-2,4,5'(1H,1'H,-
нению 3e.
5H)-трион (3d). Получен из 0.272 г (0.947 ммоль)
соединения 1d, 0.203 г (0.947 ммоль) соединения
1-(4-Бромфенил)-4'-гидрокси-1'-(2-гид-
2a. Выход 0.363 г (77%), т.пл. 177-179°С (толу-
роксиэтил)-6,6-диметил-3'-(4-хлорбензоил)-
ол). ИК спектр, ν, см-1: 3539 (NCH2CH2OH), 3144
6,7-дигидроспиро[индол-3,2'-пиррол]-2,4,5'-
(C4'OН), 1750, 1692, 1651 (C2=O, C4=O, C5'=O),
(1H,1'H,5H)-трион
(3f). Получен из
0.344 г
1628 (ArC=O). Спектр ЯМР 1Н, δ, м.д.: 0.80 с (3Н,
(1.13 ммоль) соединения 1b, 0.331 г (1.13 ммоль)
Ме), 1.05 с (3Н, Ме), 2.03 д (1Н, CH2, J 16.1 Гц), 2.21
соединения 2b. Выход 0.648 г (96%), т.пл. 207-
д (1Н, CH2, J 18.1 Гц), 2.34 д (1Н, CH2, J 15.9 Гц),
209°С (толуол). ИК спектр, ν, см-1:
3479
2.37 с (3Н, Ме), 2.64 д (1Н, CH2, J 18.1 Гц),
(NCH2CH2OH), 3094 (C4'OН), 1757, 1703, 1662
3.09-3.17 м (1H, NCH2CH2OH), 3.39-3.47 м (3H,
(C2=O, C4=O, C5'=O), 1624 (ArC=O). Спектр ЯМР
NCH2CH2OH), 4.73 уш.с (1Н, OН), 7.28 д (2Наром,
1Н, δ, м.д.: 0.81 с (3Н, Ме), 1.06 с (3Н, Ме), 2.05 д
J 7.8 Гц), 7.48 д (2Наром, J 7.1 Гц), 7.52 т (1Наром, J
(1Н, CH2, J 15.9 Гц), 2.26 д (1Н, CH2, J 18.1 Гц),
7.3 Гц), 7.57-7.62 м (4Наром), 12.03 уш.с (1Н, OН).
2.35 д (1Н, CH2, J 15.9 Гц), 2.66 д (1Н, CH2, J
Спектр ЯМР 13C, δ, м.д.: 21.1, 26.5, 28.8, 33.8, 36.2,
18.1 Гц), 3.07-3.15 м (1H, NCH2CH2OH), 3.36-3.50
43.4, 50.5, 58.6, 67.8 [С3(2')], 108.6, 117.6, 127.3,
м (3H, NCH2CH2OH), 4.63 уш.с (1Н, OН), 7.43 д
128.7, 128.8, 129.5, 133.4, 134.9, 143.0, 151.8, 165.8
(2Наром, J 8.8 Гц), 7.55 д (2Наром, J 8.8 Гц), 7.65 д
(C4'OH), 166.4 (C5'=O), 174.3 (C2=O), 188.7 (C4=O),
(2Наром, J 8.8 Гц), 7.81 д (2Наром, J 8.8 Гц), 12.12
190.4 (COAr). Найдено, %: C 69.82; H 5.38; N 5.43.
уш.с (1Н, OН). Спектр ЯМР 13C, δ, м.д.: 26.4, 28.7,
C29H28N2O6. Вычислено, %: C 69.59; H 5.64; N
33.9, 36.1, 43.5, 50.5, 58.7, 67.6 [С3(2')], 108.7, 116.9,
5.60.
121.9, 128.3, 129.4, 130.4, 132.5, 136.1, 137.5, 153.0,
3'-Бензоил-1-(4-бромфенил)-4'-гидрокси-
165.5 (C4'OH), 166.1 (C5'=O), 174.0 (C2=O), 187.9
1'-(2-гидроксиэтил)-6,6-диметил-6,7-дигид-
(C4=O), 190.6 (COAr). Найдено, %: C 56.43; H 3.82;
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
26
ТРЕТЬЯКОВ и др.
N 4.38. C28H24BrClN2O6. Вычислено, %: C 56.06; H
188°С (толуол). ИК спектр, ν, см-1: 3476 (NCH2CH2·
4.03; N 4.67.
OH), 3095 (C4'OН), 1747, 1698, 1656 (C2=O, C4=O,
C5'=O), 1629 (ArC=O). Спектр ЯМР 1Н, δ, м.д.:
Рентгеноструктурное исследование соеди-
0.79 с (3Н, Ме), 1.05 с (3Н, Ме), 2.03 д (1Н, CH2,
нения 3f. Сингония кристалла (C28H24BrClN2O6∙
J 16.1 Гц), 2.24 д (1Н, CH2, J 18.1 Гц), 2.35 д (1Н,
C2H3N, M 640.90) триклинная, пространствен-
CH2, J 22.0 Гц), 2.36 с (3Н, Ме), 2.66 д (1Н, CH2, J
ная группа P-1, a 8.6375(16) Å, b 11.0918(14) Å,
18.1 Гц), 3.07-3.14 м (1H, NCH2CH2OH), 3.36-3.48
c
16.352(2) Å, α
79.102(12), β
81.161(14), γ
м (3H, NCH2CH2OH), 4.55 уш.с (1Н, OН), 7.27 д
71.477(14)°, V 1451.3(4) Å3, Z 2, dвыч 1.467 г/см3, μ
(2Наром, J 7.8 Гц), 7.44 д (2Наром, J 8.6 Гц), 7.57 д
1.556 мм-1. Окончательные параметры уточнения:
(2Наром, J 8.1 Гц), 7.81 д (2Наром, J 8.6 Гц), 12.12
R1 0.0553 [для 4242 отражений с I > 2σ(I)], wR2
уш.с (1Н, OН). Спектр ЯМР 13C, δ, м.д.: 21.1, 26.4,
0.1428 (для всех 6697 независимых отражений), S
28.8, 33.9, 36.1, 43.5, 50.5, 58.7, 67.8 [С3(2')], 108.7,
1.019.
117.6, 121.8, 124.5, 128.7, 128.8, 129.4, 132.5, 134.8,
Результаты РСА соединения 3f зарегистриро-
143.1, 153.8, 165.4 (C4'OH), 166.3 (C5'=O), 174.1
ваны в Кембриджском центре кристаллографиче-
(C2=O), 188.8 (C4=O), 190.5 (COAr). Найдено, %:
ских данных под номером CCDC 2035546 и могут
C 60.50; H 4.42; N 4.50. C29H27BrN2O6. Вычислено,
%: C 60.11; H 4.70; N 4.83.
data_request/cif.
3'-Бензоил-1-(4-бромфенил)-4'-гидрокси-1'-
3'-(4-Бромбензоил)-1-(4-бромфенил)-4'-гид-
(2-гидроксипропил)-6,6-диметил-6,7-ди-
рокси-1'-(2-гидроксиэтил)-6,6-диметил-6,7-
гидроспиро[индол-3,2'-пиррол]-2,4,5'(1H,1'H,-
дигидроспиро[индол-3,2'-пиррол]-2,4,5'(1H,-
5H)-трион (3i). Получен из 0.301 г (1.06 ммоль)
1'H,5H)-трион
(3g). Получен из
0.262 г
соединения 1e, 0.310 г (1.06 ммоль) соединения
(0.748 ммоль) соединения 1c, 0.220 г (0.748 ммоль)
2b. Выход 0.458 г (75%), т.пл. 239-241°С (толу-
ол). ИК спектр, ν, см-1: 3475 (NCH2CHOH), 3175
соединения 2b. Выход 0.424 г (88%), т.пл. 211-
(C4'OН), 1736, 1708, 1672 (C2=O, C4=O, C5'=O),
213°С (толуол). ИК спектр, ν, см-1:
3464
1627 (ArC=O). Соотношение диастереомеров
(NCH2CH2OH), 3151 (C4'OН), 1731, 1701, 1660
70:30. Спектр ЯМР 1Н, δ, м.д. (мажорный): 0.80
(C2=O, C4=O, C5'=O), 1630 (ArC=O). Спектр ЯМР
с (3Н, Ме), 0.98 д (3Н, Ме, J 6.2 Гц), 1.05 с (3Н,
1Н, δ, м.д.: 0.81 с (3Н, Ме), 1.05 с (3Н, Ме), 2.05 д
Ме), 2.03 д (1Н, CH2, J 15.9 Гц), 2.22 д (1Н, CH2, J
(1Н, CH2, J 15.9 Гц), 2.26 д (1Н, CH2, J 18.1 Гц),
17.9 Гц), 2.34 д (1Н, CH2, J 16.0 Гц), 2.64 д (1Н,
2.35 д (1Н, CH2, J 16.1 Гц), 2.66 д (1Н, CH2, J
CH2, J 18.0 Гц), 2.99 д.д (1H, NCH2CHOH, J 14.1,
18.1 Гц), 3.07-3.15 м (1H, NCH2CH2OH), 3.36-3.50
4.3 Гц), 3.43 д.д (1H, NCH2CHOH, J 14.1, 4.3 Гц),
м (3H, NCH2CH2OH), 4.56 уш.с (1Н, OН), 7.43 д
3.79-3.86 м (1H, NCH2CHOH), 4.68 уш.с (1Н,
(2Наром, J 8.6 Гц), 7.56 д (2Наром, J 8.6 Гц), 7.70 д
OН), 7.41 д (2Наром, J 8.6 Гц), 7.47 т (2Наром, J
(2Наром, J 8.8 Гц), 7.81 д (2Наром, J 8.6 Гц), 12.32
7.9 Гц), 7.58 т (1Наром, J 7.3 Гц), 7.65 д (2Наром, J
уш.с (1Н, OН). Спектр ЯМР 13C, δ, м.д.: 26.4, 28.8,
7.1 Гц), 7.81 д (2Наром, J 8.7 Гц), 12.19 уш.с (1Н,
33.9, 36.1, 43.5, 50.5, 58.7, 67.6 [С3(2')], 108.7, 116.9,
OН). Спектр ЯМР 13C, δ, м.д. (мажорный): 19.2,
121.9, 126.5, 129.4, 130.5, 131.3, 132.5, 132.6, 136.5,
26.3, 28.9, 33.8, 36.1, 48.5, 50.5, 64.5, 68.1 [С3(2')],
153.1, 165.5 (C4'OH), 166.1 (C5'=O), 174.0 (C2=O),
108.6, 117.8, 121.7, 128.1, 128.5, 129.4, 132.4, 132.7,
188.0 (C4=O), 190.6 (COAr). Найдено, %: C 52.56;
137.6, 165.4 (C4'OH), 167.1 (C5'=O), 173.8 (C2=O),
H 3.49; N 4.08. C28H24Br2N2O6. Вычислено, %: C
189.2 (C4=O), 190.5 (COAr). Спектр ЯМР 1Н, δ, м.д.
52.20; H 3.75; N 4.35.
(минорный): 0.82 с (3Н, Ме), 1.02 д (3Н, Ме, J
1-(4-Бромфенил)-4'-гидрокси-1'-(2-гид-
6.2 Гц), 1.06 с (3Н, Ме), 2.05 д (1Н, CH2, J 15.9 Гц),
роксиэтил)-6,6-диметил-3'-(4-метилбензоил)-
2.22 д (1Н, CH2, J 17.9 Гц), 2.34 д (1Н, CH2, J
6,7-дигидроспиро[индол-3,2'-пиррол]-2,4,5'-
16.0 Гц), 2.63 д (1Н, CH2, J 18.0 Гц), 2.84 д.д
(1H,1'H,5H)-трион
(3h). Получен из
0.278 г
(1H, NCH2CHOH, J 14.1, 4.3 Гц), 3.43 д.д (1H,
(0.975 ммоль) соединения 1d, 0.287 г (0.975 ммоль)
NCH2CHOH, J 14.1, 4.3 Гц), 3.65-3.69 м (1H,
соединения 2b. Выход 0.468 г (83%), т.пл. 186-
NCH2CHOH), 4.68 уш.с (1Н, OН), 7.41 д (2Наром,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
ВЗАИМОДЕЙСТВИЕ ПИРРОЛО[2,1-c][1,4]ОКСАЗИН-1,6,7-ТРИОНОВ
27
J 8.6 Гц), 7.47 т (2Наром, J 7.9 Гц), 7.58 т (1Наром, J
Maslivets A.N. Mendeleev Commun. 2004, 14, 75-76.
7.3 Гц), 7.65 д (2Наром, J 7.1 Гц), 7.82 д (2Наром, J
doi 10.1070/MC2004v014n02ABEH001897
8.7 Гц), 12.19 уш.с (1Н, OН). Спектр ЯМР 13C, δ,
7.
Рачева Н.Л., Шкляев Ю.В., Рожкова Ю.С., Масли-
м.д. (минорный): 21.3, 26.5, 28.7, 33.9, 36.1, 48.5,
вец А.Н. ЖОрХ. 2007, 43, 1335-1338. [Racheva N.L.,
50.5, 64.9, 67.9 [С3(2')], 108.6, 117.8, 121.8, 128.1,
Shklyaev Yu.V., Rozhkova Yu.S., Maslivets A.N. Russ.
128.5, 129.4, 132.5, 132.7, 137.5, 165.4 (C4'OH),
J. Org. Chem. 2007, 43, 1330-1333.] doi 10.1134/
166.7 (C5'=O), 173.8 (C2=O), 189.2 (C4=O), 190.5
S1070428007090114
(COAr). Найдено, %: C 60.50; H 4.34; N 4.52.
8.
Коновалова В.В., Шкляев Ю.В., Масливец А.Н.
C29H27BrN2O6. Вычислено, %: C 60.11; H 4.70; N
ЖОрХ. 2012,
48,
1257-1258.
[Konovalova V.V.,
4.83.
Shklyaev Yu.V., Maslivets A.N. Russ. J. Org.
Chem.
2012,
48,
1257-1258.] doi
10.1134/
ВЫВОДЫ
S1070428012090205
Предложенная в настоящей работе реакция
9.
Рачева Н.Л., Белова М.А., Масливец А.Н. ЖОрХ.
представляет собой новый удобный препаратив-
2008, 44, 587-591. [Racheva N.L., Belova M.A.,
ный метод синтеза труднодоступных функцио-
Maslivets A.N. Russ. J. Org. Chem. 2008, 44, 582-
нально замещенных спиро[индол-3,2'-пирролов],
586.] doi 10.1134/S1070428008040192
содержащих гидроксиэтильный фрагмент, способ-
10.
Рачева Н.Л., Алиев З.Г., Белова М.А., Машевс-
ный к дальнейшей химической функционализа-
кая И.В., Масливец А.Н. ЖОрХ. 2008, 44, 710-714.
ции.
[Racheva N.L., Aliev Z.G., Belova M.A., Mashevs-
ФОНДОВАЯ ПОДДЕРЖКА
kaya I.V., Maslivets A.N. Russ. J. Org. Chem. 2008, 44,
701-705.] doi 10.1134/S1070428008050114
Исследование выполнено при финансовой
поддержке РФФИ в рамках научного проекта
11.
Bozdyreva K.S., Maslivets A.N., Aliev Z.G.
№ 19-33-90222, Правительства Пермского края и
Mendeleev Commun. 2005, 15, 163-164. doi 10.1070/
MC2005v015n04ABEH002138
Минобрнауки России (проект № FSNF-2020-0008).
12.
Масливец А.А., Масливец А.Н. ЖОрХ. 2015, 51,
КОНФЛИКТ ИНТЕРЕСОВ
1213-1214. [Maslivets A.A., Maslivets A.N. Russ.
Авторы заявляют об отсутствии конфликта ин-
J. Org. Chem. 2015, 51, 1194-1195.] doi 10.1134/
тересов.
S1070428015080254
СПИСОК ЛИТЕРАТУРЫ
13.
Третьяков Н.А., Масливец А.Н. ЖОрХ. 2019, 55,
1630-1632. [Tretyakov N.A., Maslivets A.N. Russ.
1. Машевская И.В., Толмачева И.А., Тиунова О.Ю.,
J. Org. Chem. 2019, 55, 1618-1620.] doi 10.1134/
Алиев З.Г., Масливец А.Н. ХГС. 2002, 418, 563-565.
S1070428019100257
2. Машевская И.В., Дувалов А.В., Толмачева И.А.,
Алиев З.Г., Масливец А.Н. ЖОрХ. 2004, 40, 1405-
14.
CrysAlisPro,
Agilent
Technologies,
Version
1409. [Mashevskaya I.V., Duvalov A.V., Tolmache-
1.171.37.33.
va I.A., Aliev Z.G., Maslivets A.N. Russ. J. Org.
15.
Sheldrick G.M. Acta Crystallogr., Sect. A. 2015, 71,
Chem. 2004, 40, 1359-1363.] doi 10.1007/s11178-
3-8. doi 10.1107/S2053273314026370
005-0020-6
16.
Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
3. Рачева Н.Л., Шуров С.Н., Алиев З.Г., Масли-
3-8. doi 10.1107/S2053229614024218
вец А.Н. ЖОрХ. 2007, 43, 103-110. [Racheva N.L.,
17.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
Shurov S.N., Aliev Z.G., Maslivets A.N. Russ.
ward J.A.K., Puschmann H. J. Appl. Cryst. 2009, 42,
J. Org. Chem. 2007, 43, 108-116.] doi 10.1134/
S1070428007010149
339-341. doi 10.1107/S0021889808042726
4. Рачёва Н.Л., Алиев З.Г., Масливец А.Н. ЖОрХ.
18.
Третьяков Н.А., Дмитриев М.В., Масливец А.Н.
2008, 44, 848-851.
ЖОрХ. 2020, 56, 1203-1210. [Tretyakov N.A., Dmit-
riev M.V., Maslivets A.N. Russ. J. Org. Chem. 2020,
5. Рачёва Н.Л., Алиев З.Г., Масливец А.Н. ЖОрХ.
2008, 44, 943-944.
56, 1367-1373.] doi 10.1134/S1070428020080060
6. Mashevskaya I.V., Duvalov A.V., Rozhkova Yu.S.,
19.
Schaefer H.J., Ellenberg W. Heterocycles. 1989, 28,
Shklyaev Yu.V., Racheva N.L., Bozdyreva K.S.,
979-985. doi 10.3987/COM-88-S117
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
28
ТРЕТЬЯКОВ и др.
Interaction of Pyrrolo[2,1-c][1,4]oxazine-1,6,7-triones with
3-(Arylamino)-5,5-dimethyl-2-cyclohexen-1-ones.
Synthesis of Spiro[indole-3,2'-pyrrole]
N. A. Tretyakov, M. V. Dmitriev, and A. N. Maslivets*
Perm State University, ul. Bukireva, 15, Perm, 614990 Russia
*e-mail: koh2@psu.ru
Received October 6, 2020; revised October 17, 2020; accepted October 19, 2020
8-Aroyl-3,4-dihydropyrrolo[2,1-c][1,4]oxazine-1,6,7(1H)-triones react with 3-(arylamino)-5,5-dimethyl-2-cy-
clohexene-1-ones to form 1-aryl-3'-aroyl-4'-hydroxy-1'-(2-hydroxyalkyl)-6,6-dimethyl-6,7-dihydrospiro[indole-
3,2'-pyrrole]-2,4,5'(1H,1'H,5H)-triones, the structure of which was confirmed by X-ray diffraction.
Keywords: pyrroloxazintrione, enaminoketone, 5,5-dimethyl-2-cyclohexen-1-one, spiro[indole-3,2'-pyrrole],
X-ray diffraction
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021