ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 1, с. 50-60
УДК 547.567.5
ГАЛОГЕНИРОВАНИЕ N'-(АРИЛСУЛЬФОНИЛ)-
N-[2,6(3,5)-ДИАЛКИЛ-4-ОКСОЦИКЛОГЕКСА-2,5-ДИЕН-
1-ИЛИДЕН]БЕНЗОЛКАРБОКСИМИДАМИДОВ
И ИХ ВОССТАНОВЛЕННЫХ ФОРМ
© 2021 г. А. П. Авдеенкоa, *, С. А. Коноваловаa, С. В. Шишкинаb
a Донбасская государственная машиностроительная академия,
Украина, 84313 Краматорск-13, ул. Академическая, 72
*е-mail: chimist@dgma.donetsk.ua
b ГНУ НТК «Институт монокристаллов» НАН Украины, Украина, 61001 Харьков, просп. Науки, 60
Поступила в редакцию 19.10.2020 г.
После доработки 26.10.2020 г.
Принята к публикации 28.10.2020 г.
В результате галогенирования N'-(арилсульфонил)-N-[2,6(3,5)-диалкил-4-оксоциклогекса-2,5-диен-1-
илиден]бензолкарбоксимидамидов и их восстановленных форм получены продукты, содержащие до
четырех атомов галогена. Варьирование условий галогенирования позволяет регулировать степень гало-
генирования только в случае 2,6(3,5)диметилпроизводных. Для 2,6(3,5)-диметил- и 3,5-диизопропилпро-
изводного получены продукты максимально возможной степени галогенирования. Наличие объемных
трет-бутильных групп в хиноидном ядре значительно снижает степень галогенирования - присоеди-
нение молекулы галогена идет только по одной связи С=С хиноидного ядра. Аксиальное расположение
алкильных заместителей в циклогексеновых продуктах свидетельствует о син-присоединении молекулы
галогена к двойной связи С=С хиноидного ядра.
Ключевые слова: хинонимин, 4-иминоциклогекса-2,5-диен-1-он, хлорирование, бромирование, рент-
геноструктурный анализ, син-присоединение
DOI: 10.31857/S0514749221010067
ВВЕДЕНИЕ
вызывать опасные эффекты in vivo. Они несут от-
ветственность за цитотоксичность, иммуноток-
Хинонимины и их производные, содержащие
сичность и канцерогенез [4]. С другой стороны,
структуру
4-иминоциклогекса-2,5-диен-1,4-она,
они могут быть цитопротекторами, могут прояв-
являются представителями многочисленного се-
лять противовоспалительную активность и вызы-
мейства хиноидных соединений, которые встре-
вать модификацию окислительно-восстановитель-
чаются в природных продуктах, эндогенных био-
ного статуса [1]. Механизмы этих воздействий
химических веществах, лекарственных средствах,
очень сложны и зависят от большого количества
объектах окружающей среды и/или образуются в
факторов, в том числе, от окислительно-восстано-
результате метаболизма ароматических соедине-
вительного потенциала хинонимина и его электро-
ний [1, 2]. Важность образования хиноидных со-
фильности. На относительный вклад этих свойств
единений при использовании лекарственных пре-
в биологическую активность хиноидных соедине-
паратов, природных продуктов, при влиянии хи-
ний влияет их химическая структура, в частности,
микатов на окружающую среду зачастую недооце-
эффекты заместителей у атома азота и в хиноид-
нивается. С одной стороны хинонимины являются
ном ядре, а также возможные модификации само-
высокоактивными метаболитами [3], способными
го хиноидного ядра [5].
50
ГАЛОГЕНИРОВАНИЕ N'-(АРИЛСУЛЬФОНИЛ)-N-[2,6(3,5)-ДИАЛКИЛ-4-...
51
Галогенирование хиноидных соединений, вто-
E-изомеров определяется конформационным объ-
ричных метаболитов в биосинтезе натуральных
емом заместителей [11]. Согласно литературным
продуктов, может играть важную роль в установ-
данным, изомеризация относительно связи C=N
лении их биологической активности [6]. В част-
фрагмента ArSO2N=C(Ph) подобных соединений
ности, галогенсодержащие хиноидные системы
в спектрах ЯМР 1Н не проявляется, так как из-за
проявляют гепатотоксические [3] и канцерогенные
объемных заместителей Ph и ArSO2 для них харак-
свойства [7], противораковую активность [8].
терно только транс-расположение относительно
связи C=N данного фрагмента [10].
В связи с этим важным является выявление
особенностей галогенирования хиноидных си-
В соединении 13 атомы хлора у атомов С2 и С6
стем, что позволит в дальнейшем прогнозировать
имеют одинаковый конформационный объем, но
вероятность образования галогенсодержащих про-
sp3-гибридизованный атом С6 выходит из плоско-
дуктов и их влияние на биологические объекты в
сти циклогексенового ядра, благодаря чему более
зависимости от структурных особенностей исход-
выгодным становится существование Е-изомера,
ных хиноидных соединений [9].
в котором заместитель у атома азота транс-рас-
положен по отношению к двойной связи С2=С3.
Целью данной работы является выявление
Кроме того, объемные заместители в положениях
основных закономерностей галогенирования
2 и 6 хиноидного ядра делают невозможным вра-
симметричнозамещенных в хиноидном ядре
щение вокруг связи С-N, соединяющей иминные
N'-(арилсульфонил)-N-[2,6(3,5)-диалкил-4-оксо-
фрагменты. На основании этого можно предполо-
циклогекса-2,5-диен-1-илиден]бензолкарбокси-
жить, что соединение 13 существует в растворе в
мидамидов и их восстановленных форм - N'-
виде конформеров А и B (рис. 1). Возможно также
(арилсульфонил)-N-[4-гидрокси-2,6(3,5)-диалкил-
существование их энантиомеров за счет наличия
фенил]бензолкарбоксимидамидов. В качестве ал-
хирального атома С5, но различия в простран-
кильных заместителей в положениях 3 и 5 хино-
ственном строении энантиомеров не проявляются
идного ядра использовались группы Ме, i-Pr, t-Bu,
в спектрах ЯМР 1Н [12].
что позволяет выявить влияние природы замести-
телей в хиноидном ядре на ход галогенирования.
Согласно спектральным данным соединение 14
так же существует в виде конформеров А и В, но
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
изопропильная группа в положении 5 циклогексе-
Хлорирование 3,5-диалкилзамещенных бензо-
нового ядра обоих конформеров находится в ак-
лкарбоксимидамидов 1a, b, 2, 3, 4a, b, 5, 6 прово-
сиальном положении (рис. 1), что и наблюдалось
дили газообразным хлором до полного насыщения
ранее в продуктах галогенирования N-(3,5-ди-
реакционного раствора хлором, бромирование -
изопропил-4-оксоциклогекса-2,5-диен-1-илиден)-
раствором брома в соответствующем растворите-
бензамидов [13]. В спектре ЯМР 1Н соединения
ле с соотношением, 1:5. В качестве растворителей
14 для группы 5-i-Pr мультиплет атома водорода
использовали хлороформ, уксусную кислоту и
в группе СН проявляется в области δ 3.05-3.18
смесь ДМФА-АсОН, 1:5. Результаты галогениро-
(конформер А), 2.95-3.18 (конформер B) м.д., а ду-
вания
3,5-диметилзамещенных бензолкарбокси-
блет дублетов двух метильных групп - в области δ
мидамидов 1a, b и 4a, b представлены на схеме 1, а
0.92-1.41 (изомер А), 1.07-1.41 (конформер B) м.д.
бензолкарбоксимидамидов 2, 3 и 5, 6 - на схеме 2.
В спектре ЯМР 13С сигналы атомов углерода
Идентификация некоторых продуктов гало-
группы СН двух изопропильных групп проявля-
генирования представляла определенные труд-
ются при δ 35.18 и 32.25 (конформер А), 36.71 и
ности, так как в спектрах ЯМР 1Н соединений
32.35 (конформер B) м.д., что характерно для изо-
13-15 присутствовал двойной набор сигналов.
меров с аксиальным расположением изопропиль-
Для данных соединений характерно наличие Z,E-
ной группы [13]. Сигналы sp3-гибридизованных
изомерии не только относительно связи C=N хино-
атомов углерода С5, С6 в спектре ЯМР 13С присут-
идного ядра, но и относительно связи C=N фраг-
ствуют при δ 85.56 и 91.75 (конформер А), 85.43 и
мента ArSO2N=C(Ph) [10], а стабильность Z- или
90.13 (конформер B) м.д.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
52
АВДЕЕНКО и др.
Схема 1
Me
OH
Ph
ArSO2N
N
Me
H
Hlg
7a, b, 8a, b
[O]
Me
O
Ph
ArSO2N
N
Me
Hlg
9a, b, 10a, b
Me
Me
Me
Br
OH
3
Ph
Hlg2
O
Hlg
Ph
2
2
5
ArSO2N
N
Me
ArSO2N
N
H
N
Me
H
6
Br
1a, b
11a, b
4a, b
[O]
Me
Br
O
Ph
ArSO2N
N
Me
Br
12a, b
Cl
Me
Cl
O
Ph
Cl
TsN
N
Me
Cl
13
1, 4, 7-12, Ar = 4-МеC6H4 (a), 4-ClC6H4 (b); 7, 9, Hlg = Cl; 8, 10, Hlg = Br.
Характерной
особенностью спектра ЯМР 1Н
заместитель у атома азота син-расположен по от-
соединения 15 является проявление сигнала хино-
ношению к двойной связи С2=С3, так как атом во-
идного протона H2 в виде очень уширенного син-
дорода Н2 имеет значительно меньший конформа-
глета при δ 6.71 м.д., а протонов метильных групп
ционный объем, чем атомы хлора в положении 6
трет-бутильной группы у атома С3 - в виде слож-
циклогексенового ядра. Для соединения 15, так же
ного набора сигналов в области δ 1.23-1.62 м.д.
как и в случае соединений 13, 14, возможно суще-
Данный факт свидетельствует о наличии в раство-
ствование конформеров А и B (рис. 1), но наличие
ре динамического процесса изомеризации. В отли-
водорода в положении 2 делает возможным затор-
чие от соединений 13, 14, для соединения 15 более
моженное вращение вокруг связи C-N, связываю-
предпочтительным является Z-изомер, в котором
щей иминные фрагменты, и переход конформеров
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
ГАЛОГЕНИРОВАНИЕ N'-(АРИЛСУЛЬФОНИЛ)-N-[2,6(3,5)-ДИАЛКИЛ-4-...
53
Схема 2
Cl
Cl
O
Ph
Cl
TsN
N
Cl
14
R
R
Cl
3
Cl
O Hlg2
O
Hlg2
OH
Ph
2
Ph
Ph
5
Cl
TsN
N
R
ArSO2N
N
R
6
TsN
N
H
2, 3
15
5, 6
Br
Br
O
TsN
H
Ph
N
Br
16
2, 5, R = i-Pr; 3, 6, R = t-Bu.
А и B друг в друга, что и приводит к значительно-
мов углерода С5, С6 при δ 86.43 и 94.45 м.д. и ато-
му уширению сигналов в спектрах ЯМР 1Н и 13С.
мов углерода трет-бутильных групп С(Me)3 при δ
В спектре ЯМР 13С соединения 15 присутствуют
42.92 и 37.06 м.д., что свидетельствует об аксиаль-
уширенные синглеты sp3-гибридизованных ато-
ном расположении трет-бутильной группы.
Cl
TsN
Cl
Cl
C
N
O
Cl
Me
C
N
O
Me
Cl
TsN
Cl
13, E-изомер: А
13, E-изомер: В
Cl
Cl
TsN
Cl
Cl
C
N
O
C
N
O
Cl
TsN
Cl
i-Pr
i-Pr
14, E-изомер: А
14, E-изомер: В
Cl
Cl
TsN
Cl
Cl
C
N
O
C
N
O
Cl
TsN
Cl
t-Bu
t-Bu
15, Z-изомер: А
15, Z-изомер: B
Рис. 1. Пространственные конформеры соединений 13-15
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
54
АВДЕЕНКО и др.
сыщенных атомов гексенового цикла находится
C9
в аксиальном положении [соответствующий тор-
8
C
C7
сионный угол Сsp2(cycl)-Csp2(cycl)-Csp3(cycl)-
C10
1
Cl2
O
Csp3(t-butyl) составляет 89.2(3) град]. Заместитель
C3
Cl1
C4
при атоме азота экзоциклической двойной связи
C2
C5
C=N находится в син-положении по отношению
N2
C6
C1
Cl3
к эндоциклической двойной связи [торсионный
N1
C14
угол Сsp2(cycl)-Csp2(cycl)=N-Csp2 cоставляет
O2
C12
11
C
-8.4(5) град]. Две двойные связи C=N разверну-
S1
C13
O3
ты практически ортогонально [торсионный угол
Csp2(cycl)=N-Csp2=N 86.9(4) град]. Сульфогруппа
син-перипланарна связи N-Csp2 [торсионный угол
N-Csp2=N-S -7.4(4) град], а толильный замести-
Рис. 2. Молекулярное строение N'-(4-метилбензол-
тель находится в ар-конформации по отношению к
1-сульфонил)-N-(3,5-ди-трет-бутил-5,6,6-трихлор-
связи Сsp2=N и развернут ортогонально связи N-S
4-оксоциклогекс-2-ен-1-илиден)бензолкарбоксимида-
мида (15) по данным РСА. Эллипсоиды тепловых ко-
[торсионные углы Csp2=N-S-Car 176.3(3) град,
лебаний приведены с 50% вероятностью
N-S-Car-Car 94.9(3) град].
В спектре ЯМР 1Н соединения 16 присутству-
Результаты галогенирования 2,6-диметилпро-
ет уширенный сигнал атома Н2, синглет атома Н6,
изводных 17, 18 представлены на схеме 3. Следует
синглет одной трет-бутильной группы, а сигналы
отметить, что соединение 23, также как и сое-
протонов арильных фрагментов уширены. Данный
динения 13, 14 может существовать в виде двух
факт свидетельствует о наличии в растворе данно-
конформеров А и B Е-изомера, что проявляется в
го соединения динамического процесса изомери-
спектрах ЯМР 1Н наличием двойного набора сиг-
зации, аналогичного соединению 15. Наличие в
налов.
спектре ЯМР 1Н синглета только одной трет-бу-
Полученные галогенсодержащие продукты 9,
тильной группы при δ 1.06 м.д. свидетельствует
10, 21, 22 могут быть использованы в качестве
о замещении трет-бутильной группы у двойной
синтонов для синтеза на их основе производных
связи С2=С3 атомом брома. Подобное замещение
индола, которые образуются в результате нукле-
трет-бутильной группы на галоген ранее наблю-
офильного замещения атомов галогена в хино-
далось в реакции 2,6-ди-трет-бутил-4-(гидрокси-
идном ядре на индол [16]. Следует отметить, что
имин)циклогекса-2,5-диен-1-она с S2Cl2 в присут-
производные индола являются перспективными
ствии N-этилдиизопропиламина и 1-хлор-2,5-пир-
агентами для поиска новых, в частности, противо-
ролидиндиона в тетрагидрофуране [14].
раковых, препаратов [17].
С целью подтверждения структуры соединения
Таким образом, на основании представленного
15 нами выполнен его РСА (рис. 2). Согласно дан-
эксперимента можно сделать заключение, что при
ным РСА трет-бутильная группа у sp3-гибриди-
галогенировании бензолкарбоксимидамидов 1-3,
зованного атома углерода, как и предполагалось,
17 основными процессами в реакционной систе-
находится в аксиальном положении, а заместитель
ме являются присоединение молекулы галогена,
у атома азота N1 син-расположен по отношению к
дегидрогалогенирование и гидрогалогенирова-
двойной связи циклогексенового ядра.
ние. Условия проведения реакции в наибольшей
По данным РСА, частично насыщенный кар-
степени влияют на галогенирование 3,5-диметил-
боцикл находится в конформации полукрес-
(1a, b) и 2,6-диметил- (17a, b) производных. Про-
ло (параметры складчатости [15]: S = 0.68, Θ =
дукты максимально возможной степени хлори-
28.1 град, Ψ = 29.8 град). Насыщенные атомы угле-
рования 13, 14 получены при галогенировании
рода отклоняются от среднеквадратичной пло-
3,5-диметил- (1), 3,5-диизопропил- (2) и 2,6-ди-
скости остальных атомов цикла на 0.31 и -0.33 Å.
метил- (17a, b) производных. Наличие объемных
трет-Бутильный заместитель при одном из на-
трет-бутильных групп в хиноидном ядре соеди-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
ГАЛОГЕНИРОВАНИЕ N'-(АРИЛСУЛЬФОНИЛ)-N-[2,6(3,5)-ДИАЛКИЛ-4-...
55
Схема 3
Hlg
Me
OH
Ph
ArSO2N
N
Hlg
H
Me
19a, b, 20a, b
[O]
Hlg
3
Me
Me
2
O
Me
O
Ph
Ph
Hlg2
Hlg2
Ph
5
ArSO2N
N
N
6
ArSO2N
N
Hlg
H
Me
Me
Me
17a, b
18a, b
21a, b, 22a, b
Cl
Cl
Cl
Me
O
Ph
4-TolSO2N
N
Cl
Me
23
17-22, Ar = 4-МеC6H4 (а), 4-ClC6H4 (b); 19, 21, Hlg = Cl; 20, 22, Hlg = Br.
нения 3 значительно снижает степень галогениро-
в молекуле исходных бензолкарбоксимидамидов
вания - получены продукты присоединения моле-
4-6. Затем возможно как электрофильное замеще-
кулы галогена только по одной связи С=С хиноид-
ние атома водорода на атом галогена, так и после-
ного ядра 15, 16.
довательное окисление, присоединение молекулы
галогена, дегидрогалогенирование и т.д.
В случае восстановленных форм 4-6, 18 на
первом этапе галогенирования наиболее вероят-
Структура конечных продуктов галогениро-
ным является электрофильное замещение атома
вания - циклогексеновых структур с аксиальным
водорода аминофенольного ядра на атом галогена
расположением алкильных групп свидетельствует
Схема 4
N
O
N
O
N
O
H
i-Pr
i-Pr
H
H
i-Pr
Brδ+
Br
Br Br
Br
δ-
Br
A
B
H
H
N
O
N
O
Br
Br
Br
Br
i-Pr
i-Pr
C
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
56
АВДЕЕНКО и др.
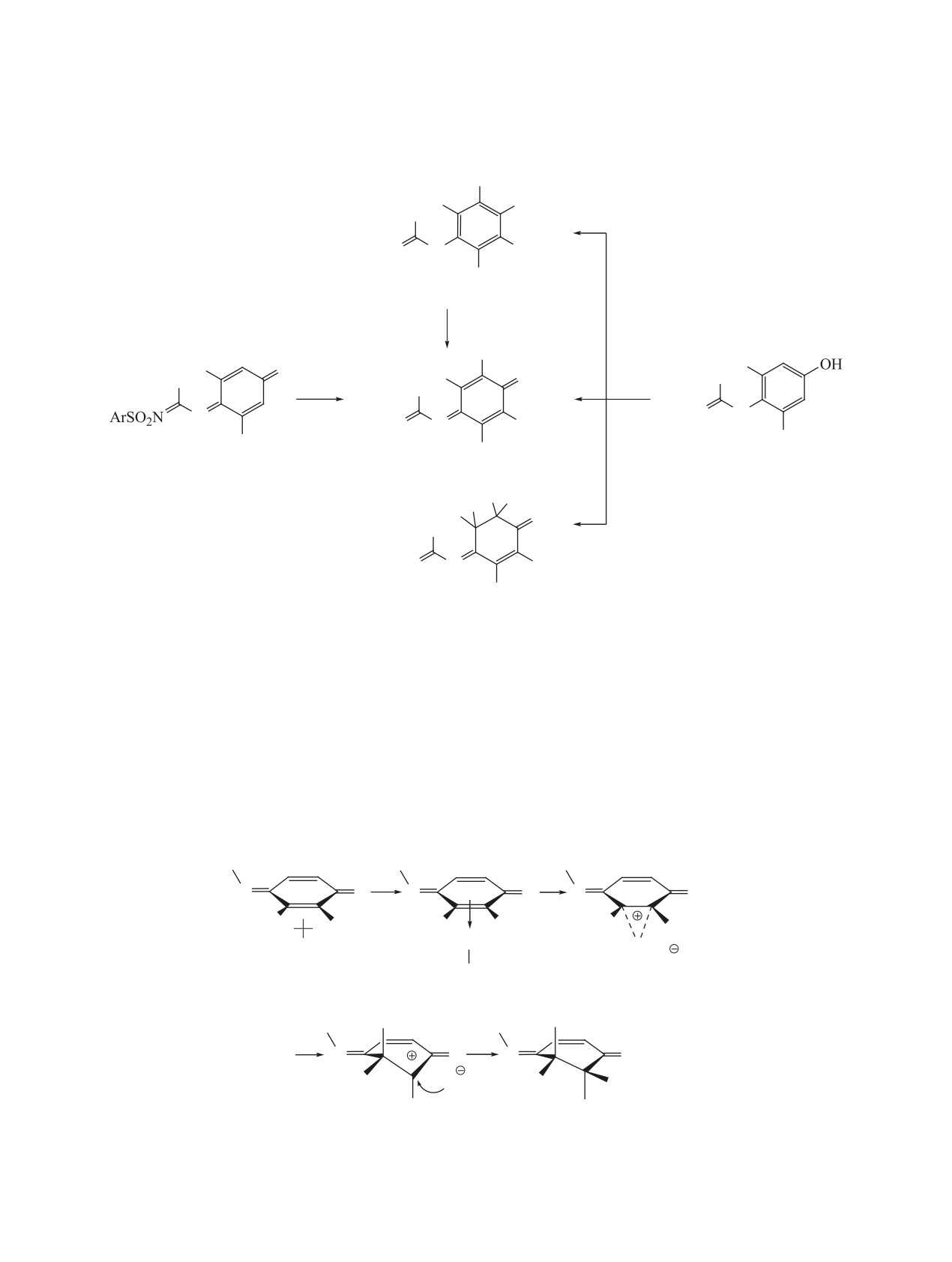
о том, что они образуются в результате син-присо-
Кембриджский банк структурных данных (e-mail:
единения молекулы галогена к двойной связи хи-
deposit@ccdc.cam.ac.uk) под номером CCDC
ноидного ядра [13] (схема 4). На первом этапе ре-
1983897.
акции образуется π-коплекс А, который превраща-
N'-(Арилсульфонил)-N-[2,6(3,5)-диалкил-4-
ется в циклический галогенониевый ион B. Затем
оксоциклогекса-2,5-диен-1-илиден]бензолкар-
образуется карбокатион С. Ранее с помощью кван-
боксимидамиды 1а, b, 2, 3, 17a, b и N'-(арилсуль-
тово-химических расчетов было показано, что для
фонил)-N-[4-гидрокси-2,6(3,5)-диалкилфенил]-
карбокатиона 3,5-диизопропилпроизводных более
бензолкарбоксимидамиды 4а, b, 5, 6, 18a, b син-
выгодным является аксиальное расположение изо-
тезированы по методикам, приведенным в работе
пропильной группы [13]. На заключительном эта-
[18]. Перекристаллизовывали из уксусной кисло-
пе реакции присоединяется ион галогена.
ты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Хлорирование бензолкарбоксимидамидов
Спектры ЯМР 1Н получены на приборе Varian
1-6, 17, 18. В раствор 2 ммоль исследуемых соеди-
VXR-300 с рабочей частотой 300 МГц, спектры
нений в 3 мл CHCl3, АсОН, смеси ДМФА-АсОН,
ЯМР 13С - с рабочей частотой 75.4 МГц относи-
1:5, пропускали сухой газообразный хлор со ско-
тельно ТМС (внутренний стандарт). Для ТСХ
ростью 15-20 мл/мин при температуре 30-40°С
применяли пластины Silufol UV-254. В качестве
до полного насыщения раствора хлором. В случае
растворителя использовали хлороформ, элюент
хлорирования в хлороформе после выпаривания
бензол-гексан, 10:1, проявление - УФ светом.
растворителя образовывалась маслоподобная мас-
Температуры синтезированных соединений из-
са, кристаллизующаяся при добавлении метанола.
мерены в запаянных капиллярах в приборе Тиле.
При хлорировании в АсОН или смеси ДМФА-
РСА проведен на дифрактометре «Xcalibur-3».
АсОН, 1:5, реакционную массу оставляли на сут-
Рентгеноструктурное исследование соеди-
ки при комнатной температуре и осаждали осадок
нения 15. Кристаллы соединения 15 моноклин-
водой. Продукты хлорирования перекристаллизо-
ные, C28H31N2O3SCl3, при 20°С, a 20.5496(6),
вывали из уксусной кислоты.
b 8.6441(2), c 17.7248(5) Å, β 113.870(3)°, V
Продукты 9a, b получены в ДМФА или смеси
2879.2(2) Å3, Mr 581.96, Z 4, пространственная
ДМФА-АсОН, 1:5, продукт 13 - в хлороформе
группа P21/c, dвыч 1.343 г/см3, μ(MoKα) 0.423 мм-1,
из соединений 1a, b. При хлорировании 3,5-ди-
F(000) 1216. Параметры элементарной ячейки и
метилпроизводных 4a, b в хлороформе получены
интенсивности 31337 отражений (6539 незави-
продукты 7a, b, в смеси ДМФА-АсОН, 1:5 - бен-
симых, Rint 0.032) измерены на дифрактометре
золкарбоксимидамиды 9a, b, в ДМФА - соеди-
«Xcalibur-3» (MoKα-излучение, ССD-детектор,
нение 13. При хлорировании соединений 2, 5 в
графитовый монохроматор, ω-сканирование,
хлороформе и АсОН получено циклогексеновое
2θмакс 55°).
соединение максимально возможной степени хло-
Структура расшифрована прямым методом по
рирования 14. При хлорировании соединений 3, 6
комплексу программ SHELXTL [15]. Положения
в хлороформе и АсОН получено соединение 15.
атомов водорода выявлены из разностного синте-
за электронной плотности и уточнены по модели
При хлорировании хинонмоноиминов 17a, b в
хлороформе и смеси ДМФА-АсОН, 1:5, получены
наездника с Uизо = nUэкв неводородного атома, свя-
производные 21a, b. При хлорировании восста-
занного с данным водородным (n 1.5 для метиль-
ных групп и n 1.2 для остальных атомов водорода).
новленных форм 18a, b в хлороформе получены
Структура уточнена по F2 полноматричным МНК
соединения 19a, b. При хлорировании соединения
в анизотропном приближении для неводородных
18a в смеси ДМФА-АсОН, 1:5, до полного насы-
атомов до wR2 0.140 по 6454 отражениям [R1 0.055
щения раствора выделен продукт 23.
по 3751 отражениям с F > 4σ(F), S 1.032].
Соединения 7a, b идентичны бензолкарбокси-
Координаты атомов, а также полные таблицы
мидамидам, полученным ранее в результате ги-
длин связей и валентных углов депонированы в
дрогалогенирования соединений 1a, b [18], бен-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
ГАЛОГЕНИРОВАНИЕ N'-(АРИЛСУЛЬФОНИЛ)-N-[2,6(3,5)-ДИАЛКИЛ-4-...
57
золкарбоксимидамиды 9a, b - полученным ранее
ход 79%, т.пл. 128-130°С. Спектр ЯМР 1Н (CDCl3),
при окислении соединений 7a, b тетраацетатом
δ, м.д.: 1.23 уш.с (9Н, 5-t-Bu), 1.23-1.62 м (9Н, 3-t-
свинца в уксусной кислоте [18]. Характеристики
Bu), 2.44 с (3Н, Ts), 6.71 уш.с (1Н, Н2), 7.33 д (2Н,
соединений 21a, b соответствуют литературным
Ts, J 8.4 Гц), 7.95 д (2Н, Ts, J 8.4 Гц), 7.41-7.88 м
данным [18].
(5Н, Ph). Найдено, %: Cl 17.98, 18.25; N 4.63, 4.87;
S 5.35, 5.56. C28H31Cl3N2O3S. Вычислено, %: Cl
N'-(4-Метилбензол-1-сульфонил)-N-(3,5-ди-
18.27; N 4.81; S 5.51.
метил-2,5,6,6-тетрахлор-4-оксоциклогекс-2-
ен-1-илиден)бензолкарбоксимидамид (13). Вы-
N'-(4-метилбензол-1-сульфонил)-N-(2,6-ди-
ход 82%, т.пл. 144-145°С. Спектр ЯМР 1Н (CDCl3),
метил-3,5,5,6-тетрахлор-4-оксоциклогекс-2-
δ, м.д.: 2.43 с (3Н, Ts), 7.32 д (2Н, Ts, J 6.6 Гц),
ен-1-илиден)бензолкарбоксимидамид (23). Вы-
7.93 д (2Н, Ts, J 6.6 Гц), 7.40-7.85 м (5Н, Ph). Кон-
ход
49%, т.пл.
135-136°С. Спектр ЯМР
1Н
формер А: 2.20 с (3Н, 5-Ме), 2.22 с (3Н, 3-Ме).
(CDCl3), δ, м.д., конформер А: 2.25 уш.с (3Н,
Конформер В: 2.18 с (3Н, Ме5), 2.25 с (3Н, Ме3).
6-Ме), 2.32 с (3Н, 2-Ме), 2.45 с (3Н, Ts), 7.35 д
Найдено, %: Cl 26.59, 26.84; N 5.17, 5.33; S 6.04;
(2Н, Ts, J 8.4 Гц), 7.88 д (2Н, Ts, J 8.4 Гц), 7.42-
6.29. C22H18Cl4N2O3S. Вычислено, %: Cl 26.64; N
7.82 м (5Н, Ph). Конформер В: 2.16 с (3Н, 6-Ме),
5.26; S 6.02.
2.32 с (3Н, 2-Ме), 2.44 с (3Н, Ts), 7.33 д (2Н, Ts, J
8.1 Гц), 7.93 д (2Н, Ts, J 8.1 Гц), 7.42-7.80 м (5Н,
N'-(4-Метилбензол-1-сульфонил)-N-(3,5-ди-
Ph). Найдено, %: Cl 26.39, 26.54; N 5.11, 5.38; S
изопропил-2,5,6,6-тетрахлор-4-оксоцикло-
6.00, 6.24. C22H18Cl4N2O3S. Вычислено, %: Cl
гекс-2-ен-1-илиден)бензолкарбоксимидамид
26.64; N 5.26; S 6.02.
(14). Выход 72%, т.пл. 197-198°С. Спектр ЯМР 1Н
(CDCl3), δ, м.д.: 2.44 с (3Н, Ts), 7.33 д (2Н, Ts, J
Бромирование бензолкарбоксимидамидов
8.4 Гц), 7.91 д (2Н, Ts, J 8.4 Гц), 7.43-7.84 м (5Н,
1-6, 17, 18. К раствору 2 ммоль исследуемых со-
Ph). Конформер А: 0.92-1.28 д.д (6Н, 5-i-Pr, J
единений в 3 мл CHCl3, AcOH, смеси ДМФА-
7.2 Гц), 1.31-1.41 д.д (6Н, 3-i-Pr, J 6.4 Гц), 3.05-
АсОН, 1:5, по каплям при перемешивании добав-
3.18 м (1Н, СН, 5-i-Pr), 3.27-3.43 м (1Н, СН, 3-i-Pr).
ляли раствор брома в соответствующем раствори-
Конформер В: 1.07-1.12 д.д (6Н, 5-i-Pr, J 7.2 Гц),
теле при температуре 50-70°С, создавая соотно-
1.27-1.41 д.д (6Н, 3-i-Pr, J 6.4 Гц), 2.95-3.18 м (1Н,
шение исходное вещество-бром 1:5.
СН, 5-i-Pr), 3.27-3.43 м (1Н, СН, 3-i-Pr). Спектр
При бромировании в хлороформе после вы-
ЯМР 13С (CDCl3), δ, м.д., конформер А: 19.02
паривания растворителя образовывалась масло-
(Me, i-Pr), 20.13 (Me, Ts), 20.15 (Me, i-Pr), 32.25
образная масса, кристаллизующаяся при добав-
(CH, i-Pr), 35.18 (CH, i-Pr), 85.56 (С5), 91.75 (С6),
лении метанола. При бромировании в АсОН или
126.93 (C2,6'', Ph), 127.38 (C4', Ts), 128.31 (C2,6', Ts),
смеси ДМФА-АсОН, 1:5, продукт выпадал в оса-
128.77 (C3,5'', Ph), 129.25 (C3,5', Ts), 132.37 (C4'', Ph),
док после стояния в течение суток или осаждался
133.34 (С2), 138.60 (C1'', Ph), 143.31 (C1', Ts), 149.73
водой. Продукты бромирования перекристаллизо-
(С3), 150.93 (С1=N), 162.52 (С7=N), 185.41 (С4=О).
вывали из уксусной кислоты.
Конформер B: 20.13 (Me, Ts), 20.82 (Me, i-Pr), 21.66
(Me, i-Pr), 32.35 (CH, i-Pr), 36.71 (CH, i-Pr), 85.43
В результате бромирования соединений 1a, b,
(С5), 90.13 (С6), 126.93 (C2,6'', Ph), 127.38 (C4', Ts),
4a, b в смеси ДМФА-АсОН, 1:5, получены со-
128.31 (C2,6', Ts), 128.77 (C3,5'', Ph), 129.25 (C3,5',
единения 11a, b. При бромировании в хлороформе
Ts), 132.37 (C4'', Ph), 133.34 (С2), 138.60 (C1'', Ph),
соединений 4a, b получены продукты 8a, b, а со-
143.31 (C1', Ts), 149.73 (С3), 150.93 (С1=N), 162.52
единений 1a, b - продукты 10a, b.
(С7=N), 185.41 (С4=О). Найдено, %: Cl 23.81;
Соединения 8a, b идентичны бензолкарбокси-
24.10; N 4.75, 4.99; S 5.28, 5.63. C26H26Cl4N2O3S.
мидамидам, полученным ранее в результате гид-
Вычислено, %: Cl 24.10; N 4.76; S 5.45.
робромирования исходных 2a, b [18], бензолкар-
N'-(4-Метилбензол-1-сульфонил)-N-(3,5-ди-
боксимидамиды 10a, b, 12a, b - полученным ранее
трет-бутил-5,6,6-трихлор-4-оксоциклогекс-2-
при окислении соединений 8a, b, 11a, b тетрааце-
ен-1-илиден)бензолкарбоксимидамид (15). Вы-
татом свинца в уксусной кислоте [18].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
58
АВДЕЕНКО и др.
Продукты бромирования соединений 2, 5 иден-
1-илиден)бензолкарбоксимидамид (16). Выход
тифицировать, к сожалению, не удалось ввиду об-
59%, т.пл. 175-176°С. Спектр ЯМР 1Н (CDCl3),
разования сложных смесей. В результате броми-
δ, м.д.: 1.06 с (9Н, t-Bu), 2.42 с (3Н, Ts), 5.91 c
рования соединений 3, 6 в хлороформе получено
(1Н, Н5), 6.61 уш.с (1Н, Н3), 7.31 д (2Н, Ts, J
соединение 16.
8.1 Гц), 7.94 д (2Н, Ts, J 8.1 Гц), 7.32-7.77 м (5H,
Ph). Найдено, %: Br 43.21, 43.55; N 3.86, 4.17; S
Характеристики соединений 20a, b, 22a, b соот-
4.29, 4.58. C24H22Br4N2O3S. Вычислено, %: Br
ветствуют литературным данным [18].
43.30; N 3.80; S 4.34.
N-(2-Бром-4-гидрокси-3,5-диметилфенил)-
N'-(4-метилбензол-1-сульфонил)бензолкарбок-
N-(2-Бром-3,5-диметил-4-оксоциклогекса-
симидамид (8а). Выход 85%, т.пл. 220-221°С.
2,5-диен-1-илиден)-N'-(4-метилбензол-1-суль-
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2.11 д (3Н,
фонил)бензолкарбоксимидамид
(10а). Выход
Ме3, J 1.2 Гц), 2.28 с (3Н, Ме5), 2.36 с (3Н, Ts),
68%, т.пл. 202-203°С. Спектр ЯМР 1Н (CDCl3), δ,
6.78 уш.с (1Н, Н2), 7.46 д (2Н, Ts, J 7.8 Гц), 7.93 д
м.д.: 1.99 д (3Н, Ме3, J 1.2 Гц), 2.33 с (3Н, Ме5),
(2Н, Ts, J 7.8 Гц), 7.79-8.04 м (5Н, Ph), 8.96 с (NH),
2.41 с (3Н, Ts), 6.58 д (1Н, Н2, J 1.2 Гц), 7.30 д (2Н,
10.11 c (OH). Найдено, %: Br 16.73, 16.90; N 5.44,
Ts, J 7.8 Гц), 7.88 д (2Н, Ts, J 7.8 Гц), 7.41-7.82 м
5.82; S 6.73, 6.91. C22H21BrN2O3S. Вычислено, %:
(5Н, Ph). Найдено, %: Br 16.94, 17.20; N 5.83, 6.06;
Br 16.88; N 5.92; S 6.77.
S 6.54, 6.79. C22H19BrN2O3S. Вычислено, %: Br
16.95; N 5.94; S 6.80.
N-(2-Бром-4-гидрокси-3,5-диметилфенил)-
N'-(4-[хлорбензол-1-сульфонил)бензолкарбок-
N-(2-Бром-3,5-диметил-4-оксоциклогекса-
симидамид (8b). Выход 69%, т.пл. 247-248°С.
2,5-диен-1-илиден)-N'-(4-хлоробензол-1-суль-
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2.12 д (3Н,
фонил)бензолкарбоксимидамид
(10b). Выход
Ме3, J 1.2 Гц), 2.27 с (3Н, Ме5), 6.78 уш.с (1Н, Н2),
84%, т.пл. 194-195°С. Спектр ЯМР 1Н (CDCl3), δ,
7.70 д (2Н, 4-ClC6H4, J 7.8 Гц), 7.79-8.04 м (5Н, Ph),
м.д.: 2.00 д (3Н, Ме3, J 1.2 Гц), 2.34 с (3Н, Ме3),
8.15 д (2Н, 4-ClC6H4, J 7.8 Гц), 8.85 с (NH), 10.25
6.59 д (1Н, Н2, J 1.2 Гц), 7.43-7.82 м (5Н, Ph), 7.47
c (OH). Найдено, %: Br + Cl 23.16, 23.31; N 5.49,
д (2Н, 4-ClC6H4, J 9.0 Гц), 7.95 д (2Н, 4-ClC6H4, J
5.70; S 6.22, 6.48. C21H18BrClN2O3S. Вычислено,
9.0 Гц). Найдено, %: Br + Cl 23.18, 23.55; N 5.70,
%: Br + Cl 23.36; N 5.67; S 6.49.
5.88; S 6.49, 6.71. C21H16BrClN2O3S. Вычислено,
N-(2,6-Дибром-4-гидрокси-3,5-диметил-
%: Br + Cl 23.46; N 5.70; S 6.52.
фенил)-N'-(4-метилбензол-1-сульфонил)бензол-
Окисление бензолкарбоксимидамидов 8a, b,
карбоксимидамид (11а). Выход 70%, т.пл. 290-
11a, b. Соединения 8a, b, 11a, b окисляли тетра-
291°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2.29
ацетатом свинца в уксусной кислоте по методике
с (6Н, Ме3,5), 2.36 с (3Н, Ts), 7.46 д (2Н, Ts, J
[18]. В результате получены бензолкарбоксими-
7.8 Гц), 7.93 д (2Н, Ts, J 7.8 Гц), 7.79-8.04 м (5Н,
дамиды 10a, b, 12a, b. Перекристаллизовывали из
Ph), 9.15 с (NH), 10.36 c (OH). Найдено, %: Br 28.77,
уксусной кислоты.
28.95; N 4.69, 5.02; S 5.74, 5.91. C22H20Br2N2O3S.
Вычислено, %: Br 28.94; N 5.07; S 5.81.
N-(2,6-Дибром-3,5-диметил-4-оксоцикло-
гекса-2,5-диен-1-илиден)-N'-(4-метилбензол-
N-(2,6-Дибром-4-гидрокси-3,5-диметил-
1-сульфонил)бензолкарбоксимидамид
(12а).
фенил)-N'-(4-хлорбензол-1-сульфонил)бензол-
Выход 68%, т.пл. 184-186°С. Спектр ЯМР 1Н
карбоксимидамид (11b). Выход 69%, т.пл. 290-
(CDCl3), δ, м.д.: 2.28 с (6Н, Ме3,5), 2.41 с (3Н, Ts),
292°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2.28 с
7.28 д (2Н, Ts, J 7.8 Гц), 7.86 д (2Н, Ts, J 7.8 Гц),
(6Н, Ме3,5), 7.70 д (2Н, 4-ClC6H4, J 7.8 Гц), 7.79-
7.43-7.80 м (5Н, Ph). Найдено, %: Br 29.05,
8.04 м (5Н, Ph), 8.15 д (2Н, 4-ClC6H4, J 7.8 Гц), 9.45
с (NH), 10.10 c (OH). Найдено, %: Br + Cl 33.84,
29.31; N 4.88, 5.16; S 5.79, 6.03. C22H18Br2N2O3S.
34.01; N 4.91, 5.23; S 5.60, 5.81. C21H17Br2ClN2O3S.
Вычислено, %: Br 29.04; N 5.09; S 5.83.
Вычислено, %: Br + Cl 34.09; N 4.89; S 5.60.
N-(2,6-Дибром-3,5-диметил-4-оксоцикло-
N'-(4-Метилбензол-1-сульфонил)-N-(3,5,6-
гекса-2,5-диен-1-илиден)-N'-(4-хлоробензол-1-
трибром-5-трет-бутил-4-оксоциклогекса-2-ен-
сульфонил)бензолкарбоксимидамид (12b). Вы-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
ГАЛОГЕНИРОВАНИЕ N'-(АРИЛСУЛЬФОНИЛ)-N-[2,6(3,5)-ДИАЛКИЛ-4-...
59
ход 91%, т.пл. 170-171°С. Спектр ЯМР 1Н (CDCl3),
6.
Neumann C.S., Fujimori D.G., Walsh C.T. Chem. Biol.
δ, м.д.: 2.30 с (6Н, Ме3,5), 7.44-7.80 м (5Н, Ph), 7.46
2008, 15, 99-109. doi 10.1016/j.chembiol.2008.01.006
д (2Н, 4-ClC6H4, J 8.4 Гц), 7.92 д (2Н, 4-ClC6H4, J
7.
Huang C.-H., Ren F.-R., Shan G.-Q., Qin H., Mao L.,
8.4 Гц). Найдено, %: Br + Cl 33.95, 34.11; N 4.61,
Zhu B.-Z. Chem. Res. Toxicol. 2015, 28, 831-837. doi
4.90; S 5.47, 5.68. C21H15Br2ClN2O3S. Вычислено,
10.1021/tx500486z
%: Br + Cl 34.21; N 4.91; S 5.62.
8.
Rivera-Ávalos E., de Loera D., Araujo-Huitrado J.G.,
Escalante-García I.L., Muñoz-Sánchez M.A., Her-
ВЫВОДЫ
nández H., López J.A., López L. Molecules. 2019, 24,
В результате галогенирования N'-(арилсульфо-
4285. doi 10.3390/molecules24234285
нил)-N-[2,6(3,5)-диалкил-4-оксоциклогекса-2,5-
9.
Limban C., Nuţă D.C., Chiriţă C., Negreș S., Arse-
диен-1-илиден]бензолкарбоксимидамидов и их
ne A.L., Goumenou M., Karakitsios S.P., Tsatsa-
восстановленных форм получены продукты, со-
kis A.M., Sarigiannise D.A. Toxicol Rep. 2018, 5, 943-
держащие до четырех атомов галогена. Варь-
953. doi 10.1016/j.toxrep.2018.08.017
ирование условий галогенирования позволяет
10.
Леденева О.П. Автореф. дис. … канд. хим. наук.
регулировать степень галогенирования только в
Днепропетровск. 2016.
случае диметилпроизводных. При галогенирова-
11.
Blanco F., Alkorta I., Elguero J. Croat. Chem. Acta.
нии 3,5-диизопропил- и 3,5-ди-трет-бутилпроиз-
2009, 82, 173-183.
водных получены циклогексеновые структуры с
12.
Labuta J., Ishihara S., Šikorský T., Futera Z., Shun-
аксиально расположенными алкильными замести-
do A., Hanyková L., Burda J.V., Ariga K., Hill J.P.
телями у sp3-гибридизованного атома углерода ци-
Nat Commun. 2013, 4, 2188. doi 10.1038/ncomms3188
клогексенового ядра, что характерно для продук-
13.
Авдеенко А.П., Пироженко В.В., Шишкин О.В.,
тов син-присоединения молекулы галогена к связи
Шишкина С.В., Коновалова С.А., Лудченко О.Н.
С=С хиноидного ядра.
ЖорХ. 2008, 44, 547-557. [Avdeenko A.P., Pirozhen-
КОНФЛИКТ ИНТЕРЕСОВ
ko V.V., Shishkin O.V., Shishkina S.V., Konovalo-
va S.A., Ludchenko O.N. Russ. J. Org. Chem. 2008,
Авторы заявляют об отсутствии конфликта ин-
44, 542-552.] doi 10.1134/S1070428008040131
тересов
14.
Polo C., Ramos V., Torroba T. Tetrahedron. 1998, 54,
СПИСОК ЛИТЕРАТУРЫ
223-232. doi 10.1016/S0040-4020(97)10272-1
15.
Sheldrick G.M. Acta Crystallogr., Sect. A. 2008, 64,
1. Bolton J.L., Dunlap T. Chem. Res. Toxicol. 2017, 30,
13-37. doi 10.1021/acs.chemrestox.6b00256
112-122. doi 10.1107/S0108767307043930
2. Авдеенко А.П., Коновалова С.А. Хинонимины: от
16.
Ibis C., Sahinler Ayla S., Tulegenova D., Bahar H.
противораковых препаратов до молекулярных
Russ. J. Org. Chem. 2019, 55, 546-553. doi 10.1134/
компьютеров. Краматорск: ДГМА, 2018, 238-388.
S1070428019040213
[Avdeenko A.P., Konovalova S.A. Quinone Imines:
17.
Vallri K.K., Nagaraju P.V.V.S., Viswanath I.V.K.,
from Anti-cancer Drugs to Molecular Computers.
Singh R.V. Russ. J. Org. Chem. 2020, 56, 524-533. doi
Kramatorsk: DSEA, 2018, 238-388.]
10.1134/S1070428020030252
3. Ramesh M., Bharatam P.V. Drug Metab. Let. 2019, 13,
18.
Авдеенко А.П., Коновалова С.А., Пироженко В.В.,
64-76. doi 10.2174/1872312812666180913120736
Леденева О.П., Санталова А.А. ЖорХ. 2011, 47,
4. Klopčič I., Dolenc M.S. Chem. Res. Toxicol. 2019, 32,
1020-1028. [Avdeenko A.P., Konovalova S.A., Piro-
1-34. doi 10.1021/acs.chemrestox.8b00213
zhenko V.V., Ledeneva O.P., Santalova A.A. Russ.
5. Monks T.J., Jones D.C. Curr. Drug Metab. 2002, 3,
J. Org. Chem. 2011, 47, 1035-1044.] doi 10.1134/
425-438. doi 10.2174/1389200023337388
S1070428011070116
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
60
АВДЕЕНКО и др.
Halogenation of N'-(Arylsulfonyl)-N-[2,6(3,5)-dialkyl-
4-oxocyclohexa-2,5-dien-1-ylidene]benzenecarboximidamides
and their Reduced Forms
A. P. Avdeenkoa, *, S. A. Konovalovaa, and S. V. Shishkinab
a Donbass State Engineering Academy, ul. Akademicheskaya, 72, Kramatorsk, 84313 Ukraine
*е-mail: chimist@dgma.donetsk.ua
b Institute of Single Crystals, National Academy of Sciences of Ukraine, prosp. Nauki, 60, Kharkiv, 61001 Ukraine
Received October 19, 2020; revised October 26, 2020; accepted October 28, 2020
Products, containing up to four halogen atoms, have been obtained in halogenation of N'-(arylsulfonyl)-N-(3,5-
dialkyl-4-oxocyclohexa-2,5-diene-1-ylidene)benzenecarboximidamides and their reduced forms. Varying the
halogenation conditions makes it possible to control the degree of halogenation only for 2,6(3,5)-dimethyl deriv-
atives. The products of the highest possible degree of halogenation have been obtained for the 2,6(3,5)-dimeth-
yl- and 3,5-diisopropyl derivatives. The presence of the bulky tert-butyl groups in the quinoid ring significantly
reduces the degree of halogenation, and the addition of halogen molecule only occurs to one C=C bond of the
quinoid ring. The axial arrangement of the alkyl substituents in the cyclohexene products proves the syn-addition
of the halogen molecule to the C=C bond of the quinoid ring.
Keywords: quinone imine, 4-iminocyclohexa-2,5-dien-1-one, chlorination, bromination, X-ray, cis-addition
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021