ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 1, с. 83-91
УДК 547.7/.8 + 547.551 + 542.97
СИНТЕЗ N-ЗАМЕЩЕННЫХ ТЕТРА(ГЕКСА)-
ОКСАЗАСПИРОАЛКАНОВ С УЧАСТИЕМ
АМИНОКИСЛОТ И Sm-СОДЕРЖАЩИХ
КАТАЛИЗАТОРОВ
© 2021 г. Н. Н. Махмудиярова*, И. Р. Ишмухаметова, К. Р. Шангараев,
Е. С. Мещерякова, А. Г. Ибрагимов
ФГБУН «Институт нефтехимии и катализа РАН», Россия, 450075 Уфа, просп. Октября, 141
*e-mail: natali-mnn@mail.ru
Поступила в редакцию 03.11.2020 г.
После доработки 10.11.2020 г.
Принята к публикации 13.11.2020 г.
Разработан эффективный метод синтеза N-замещенных тетра(гекса)оксазаспироалканов реакцией геп-
таоксадиспироалканов и пентаоксаспироалканов с аминокислотами (глицин, аланин, лейцин, валин,
триптофан) с участием Sm-содержащих катализаторов.
Ключевые слова: катализ, аминокислоты, гептаоксадиспироалканы, пентаоксаспироалканы, тетра(гекса)-
оксазаспироалканы, РСА
DOI: 10.31857/S0514749221010092
ВВЕДЕНИЕ
роалканами в условиях ранее осуществленных
нами каталитических реакций рециклизации.
Каталитическая рециклизация гептаоксака-
Предварительно проведенные эксперименты по-
нов и пентаоксаканов с первичными алкил(арил,
зволили установить, что синтез целевых N-за-
гетарил)аминами, замещенными гидразинами и
мещенных гексаоксазаспироалканов 5-7 с наибо-
α,ω-диаминами является эффективным спосо-
лее высокими выходами и селективностью могут
бом селективного синтеза новых N-замещенных
быть осуществлены реакцией аминокислот (гли-
тетраоксазаспироалканов [1-3], гексаоксазадиспи-
цин, аланин, лейцин, валин, триптофан) с гепта-
роалканов [4], гексаоксазадиспироалканиламинов
оксадиспироалканами с участием катализаторов
[5], трипероксициклоундеканов [6], перспектив-
на основе лантаноидов (схема 1). В качестве ка-
ных в качестве биологически активных соедине-
тализаторов нами были выбраны Sm(NO3)3·6H2O,
ний, обладающих противоопухолевой активно-
а также указанная соль, закрепленная на поверх-
стью [2, 3, 5, 7]. Сведения о синтезе N-замещенных
ности γ-Al2O3 [содержание Sm(NO3)3 на Al2O3 со-
тетра(гекса)оксазаспироалканов c аминокислот-
ставляет 11.2%].
ным фрагментом на момент начала наших иссле-
дований в литературе отсутствовали.
Установили, что при взаимодействии гли-
цина
1а с эквимольным количеством
6,7,13,-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
14,16,18,19-гептаоксадиспиро[4.2.48.75]нонаде-
В развитии проводимых нами исследований в
каном 2 в условиях ~ 20°С, ТГФ, 6 ч с использо-
области синтеза новых тетра(гекса)оксазаспиро-
ванием 5 мол % катализатора Sm(NO3)3·6H2O [1]
алканов [1-7], мы изучили реакцию аминокислот
образуется
2-(6,7,13,14,18,19-гексаокса-16-азади-
с гептаоксадиспироалканами и пентаоксаспи-
спиро[4.2.48.75]нонадекан-16-ил)уксусная кисло-
83
84
МАХМУДИЯРОВА и др.
Схема 1.
( )n
O
O
O
O
1
O
R
O
O
(
)n
(
)n
(
)n
O O
O
O
O
O
O
O
R1
COOH
HOOC
COOH
O
2-4
8-10
( )n
O
H2N
H
N
H
H
N
Sm(NO3)3·6H2O
Sm(NO3)3·6H2O
O
R
R
O
R
O
O O
( )
n
R1
5a-e, 6a-c, 7a-d
1a-f
11a, 12a-d, 13b, d
n = 1, R1 = H (2, 5a-e);
R = H (a), CH3 (b), CH2CH(CH3)2 (c),
n = 1 (8, 11a), 2 (9, 12a-d),
n = 2, R1 = 4-Me (3, 6a-c);
CH(CH3)2 (d), (CH2)2SCH3 (e).
8 (10, 13b, d).
n = 3, R1 = H (4, 7a-d).
та 5а с выходом 80%. В отсутствии катализатора
реакциях гетероциклизации растворителя обу-
реакция не проходит. При катализе реакции с по-
словлен хорошей растворимостью в них как ис-
мощью 5 мол % Sm(NO3)3/γ-Al2O3 выход макро-
ходных реагентов 1, так и целевых макрогетероци-
гетероцикла
5а удается повысить до
84%.
клов 5-7 (табл. 1).
Повторное (трехкратное) применение гетероген-
Разработанный подход к синтезу азатрипе-
ного катализатора Sm(NO3)3/γ-Al2O3 не приводит
роксидов успешно применили для синтеза аза-
к существенному снижению выхода целевого про-
дипероксидов реакцией пентаоксаспироалканов
дукта 5а.
8-10 с аминокислотами 1a-f. Обнаружили, что в
В условиях 5 мол % Sm(NO3)3/γ-Al2O3, 20°С,
разработанных для азатрипероксидов условиях
6 ч в реакцию с 6,7,13,14,16,18,19-гептаоксади-
[5 мол % Sm(NO3)3/γ-Al2O3, 20°С, 6 ч] 6,7,-
спиро[4.2.48.75]нонадеканом 2 были вовлечены
9,11,12-пентаоксаспиро[4.7]додекан
8 вступа-
ет в реакцию с глицином 1а с образованием
аланин 1b, лейцин 1c, валин 1d, триптофан 1e с
получением соответствующих
6,7,13,14,18,19-
2-(6,7,11,12-тетраокса-9-азаспиро[4.7]додекан-
9-ил)уксусной кислоты с выходом 91%. Реакция
гексаокса-16-азадиспиро[4.2.48.75]нонадекан-16-
илуксусных кислот 5b-e с выходами 84-92%.
7,8,10,12,13-пентаоксаспиро[5.7]тридекана
9 и
1,2,4,6,7-пентаоксаспиро[7.11]нонадекана
10 с
Для выяснения возможности проведения дан-
аминокислотами
1а-d приводит к индивиду-
ной реакции с участием других гептаоксади-
альным
2-алкил-(7,8,12,13-тетраокса-10-азаспи-
спироалканов в реакцию с аминокислотами
ро[5.7]тридекан-10-ил)уксусным кислотам 12a-d
1a-e в разработанных условиях были вовлечены
и
2-алкил-(1,2,6,7-тетраокса-4-азаспиро[7.11]но-
3,12-диметил-7,8,15,16,18,20,21-гептаоксадиспи-
надекан-4-ил)уксусным кислотам 13b, d с выхо-
ро[5.2.59.76]геникозан
3 и
8,9,17,18,20,22,23-
дами 65-88%, соответственно.
гептаоксадиспиро[6.2.610.77]трикозан
4. В ре-
зультате с участием катализатора Sm(NO3)3/γ-
Структуры гекса(тетра)оксазаспироалканил-
Al2O3 удалось синтезировать
2-алкил-(3,12-ди-
уксусных кислот 5-7, 11-13 установлены с по-
метил-7,8,15,16,20,21-гексаокса-18-азадиспиро-
мощью ЯМР одномерной 1Н, 13С и двумерной
[5.2.59.76]геникозан-18-ил)уксусные кислоты 6a-c
спектрометрии (HSQC, COSY, HMBC), а также
и 2-алкил-(8,9,17,18,22,23-гексаокса-20-азадиспи-
maldi-toff-toff масс-спектрометрии и РСА (см.
ро[6.2.610.77]трикозан-20-ил)уксусные
кислоты
рисунок). Следует отметить, что для соединений
7a-d с выходами 76-90% (схема 1). Выбор в этих
5-7, 11-13 сигналы протонов представляют со-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
СИНТЕЗ N-ЗАМЕЩЕННЫХ ТЕТР
А(ГЕКСА)ОКСАЗАСПИРОАЛКАНОВ
85
Таблица 1. Влияние природы растворителя на выход гексаоксазаспироалканов
№ п/п
Растворитель
Соединение
Выход, %
1
EtOAc + CH2Cl2
5b
84
2
EtOAc + EtOH
5с
90
3
CH2Cl2
5d
88
4
EtOAc + H2O
5e
75
5
EtOAc + CH2Cl2
6a
76
6
EtOAc + EtOH
6b
82
7
EtOAc + H2O
6c
78
8
EtOAc + H2O
7a
85
9
EtOAc + CH2Cl2
7b
82
10
EtOAc + EtOH
7c
85
11
EtOAc
7d
86
бой наложенные друг на друга мультиплеты, а в
ных групп разупорядочены по двум положениям
спектрах ЯМР 13С наблюдается увеличенное ко-
(см. рисунок). Длины связей эндоциклических
личество сигналов, что связано с наличием мно-
C-N связей меньше по сравнению со стандартной
гокомпонентного конформационного равновесия в
величиной (1.47 Å) и составляют 1.400(6), 1.408(5),
растворе дейтерированного хлороформа. Данный
1.399(6) и 1.419(5) Å соответственно для С3-N4,
факт подробно описан и подтвержден нами ранее
С3'-N4', C5-N4 и C5'-N4' связей. Экзоциклические
на примере азатрипероксидов [1-6].
C-N связи длиннее, чем эндоциклические и
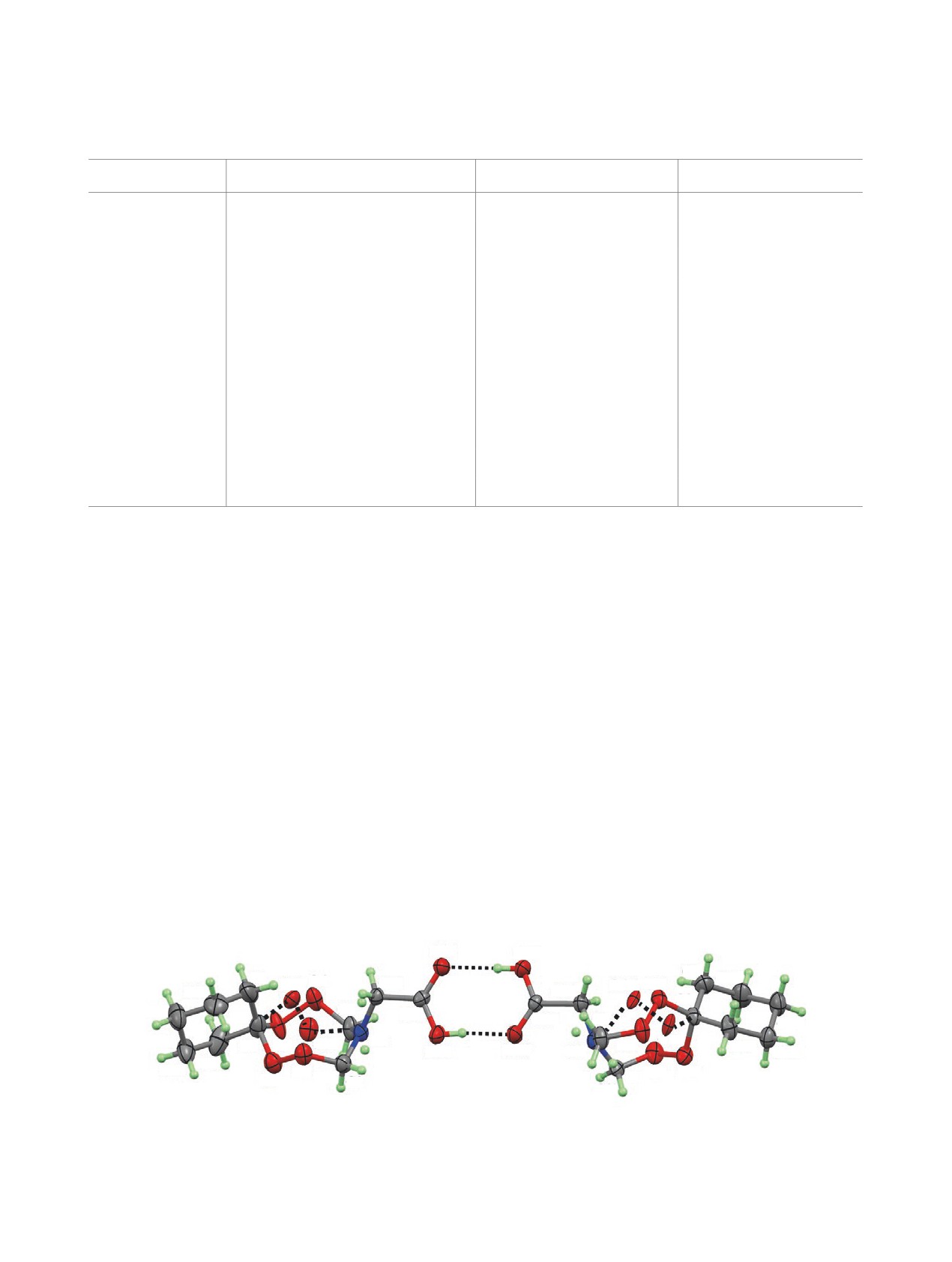
Для соединения 12а (см. рисунок) получены
составляют - N4-C14 = 1.456(5) и N4'-C14' =
кристаллы из смеси растворителей гексан-EtOAc,
1.437(7) Å. Сумма углов при атоме азота ΣN4' =
взятых в соотношении 5:1 при комнатной темпе-
353.0 и ΣN4 = 356.2°, что соответствует sp2-ти-
ратуре.
пу гибридизации. Циклогексановые фрагменты
принимают конформацию кресло. Торсионные
Молекулы соединения
12а формируют мо-
углы N4-C14-C15-O16 и N4'-C14'-C15'-O16' равны
ноклинные кристаллы, пространственная груп-
-29.4(5) и -11.8(5)°, соответственно. Амплитуда
па Р-1. Независимая часть элементарной ячейки
включает в себя два конформера - кресло-кресло и
складчатости циклогексановых фрагментов со-
твист-ванна-кресло (Z 4, Z' 2), которые формиру-
ставляет Q = 0.559(7) и Q' = 0.537(6) Å, что меньше
ют циклический димер [R_2^2 (8)] за счет О-Н∙∙∙О
по сравнению с амплитудой складчатости идеаль-
водородных связей. Атомы кислорода пероксид-
ного циклогексана (0.63 Å) [8].
O16
O17'
C9'
C9
C10'
O7a
O6
C14
O7'
O6a'
10
C14'
C
C11
C5
C8'
C15
C15'
C5'
C11'
N4
C8
O7
O6a
O6'
O7'a
C13'
O17
O16'
N4'
C12'
C13
1'
C12
O2
O2' O
O1
C3
C3'
Независимая часть элементарной ячейки в кристаллах соединения 12а. Неводородные атомы представлены эллипсоидами
тепловых колебаний (р = 30%)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
86
МАХМУДИЯРОВА и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ски и уточняли по модели «наездника». Параметры
кристалла 12а и условия рентгеноструктурного
Одномерные спектры ЯМР 1Н и 13С, а также
эксперимента приведены в табл. 2. Координаты
двумерные гомо- (COSY) и гетероядерные (1H-13C
атомов и их температурные параметры для со-
HSQC, 1H-13C HMBC) спектры зарегистрирова-
единения
12а депонированы в Кембриджской
ны на спектрометре Bruker Avance 500 (500 МГц
для ядер 1Н, 126 МГц для ядер 13С, если не ука-
ccdc.cam.ac.uk; номер депозита CCDC 2041861).
зано иначе) в CDCl3 при 25°C по стандартным
методикам фирмы Bruker (Германия), внутренний
2-(7,8,15,16,20,21-Гексаокса-18-азадиспи-
стандарт ТМС. Mасс-спектры MALDI TOF/TOF
ро[5.2.59.76]геникозан-18-ил)уксусная кисло-
положительных ионов (матрица - синапиновая
та (5а). Выход 0.30 г (84%), белое масло, Rf 0.75
кислота) записаны на масс-спектрометре Bruker
(PE-Et2O, 10:1). Спектр ЯМР 1Н (CDCl3), δ, м.д.:
АutoflexTM III Smartbeam. Подготовка проб для
1.65-1.79 м (8Н, CH2), 1.87-1.95 м (8Н, CH2),
регистрации масс-спектров проведена по методике
3.67-3.69 м (2H, CH2), 5.10-5.14 м (4Н, CH2), 9.97
«сухой капли»: в отдельной пробирке смешивали
с (1Н, ОH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.4,
растворы матричного и анализируемого веществ
24.5, 33.2, 33.7, 33.8, 67.9, 92.3, 92.5, 120.1, 120.2,
(50:1-100:1), после этого каплю раствора наноси-
120.4, 170.1. Масс-спектр (MALDI TOF/TOF), m/z:
ли на мишень и сушили потоком теплого возду-
360 [M - H]+. Найдено, %: C 53.16; H 7.51; N 3.86.
ха. Пробу с мишени переводят в газовую фазу с
C16H27NO8. Вычислено, %: C 53.18; H 7.53; N 3.88.
помощью лазерных импульсов (200 импульсов с
2-(6,7,13,14,18,19-Гексаокса-16-азадиспи-
частотой 100 Гц). В качестве источника лазерного
ро[4.2.48.75]нонадекан-16-ил)пропионовая кис-
излучения применяли твердотельный УФ-лазер с
лота (5b). Выход 0.28 г (84%), белое масло, Rf
длиной волны излучения 355 нм. Элементный ана-
0.71 (PE-Et2O, 10:1). Спектр ЯМР 1Н (CDCl3), δ,
лиз выполнен на анализаторе фирмы Сarlo Erba
м.д.: 0.90-0.91 (2H, CH3), 3.57-3.59 м (1H, CH),
1108. Контроль за ходом реакций осуществляли
5.15-5.20 м (4Н, CH2), 9.97 с (1Н, ОH). Спектр
методом ТСХ на пластинах Sorbfil (ПТСХ-АФ-В),
ЯМР 13С (CDCl3), δ, м.д.: 22.3, 24.5, 24.6, 33.5, 33.6,
элюент гексан-EtOAc, 10:1, проявление в парах I2.
66.8, 91.7, 91.8, 120.0, 120.1, 170.0. Масс-спектр
Для колоночной хроматографии использован си-
(MALDI TOF/TOF), m/z: 346 [M - H]+. Найдено, %:
ликагель КСК (100-200 мкм).
. Вычислено, %:
C 51.85; H 7.22; N 4.00. C15H25NO8
Исходные реагенты кетоны и монозамещен-
C 51.87; H 7.25; N 4.03.
ные гидразины использовали фирмы Acros.
2-(6,7,13,14,18,19-Гексаокса-16-азадиспи-
Тетрагидрофуран, гексан, EtOAc, петролейный
эфир, Et2O (марки «ч») перегоняли перед исполь-
ро[4.2.48.75]нонадекан-16-ил)-4-метилпентано-
вая кислота (5с). Выход 0.34 г (90%), белое масло,
зованием. Реагенты I2, MgSO4 марки «ч». Синтез
гептаоксадиспироалканов 2-4 и пентаоксаканов
Rf 0.73 (PE-Et2O, 10:1). Спектр ЯМР 1Н (CDCl3), δ,
8-10 осуществлен согласно описанным методикам
м.д.: 0.90-0.91 (6H, CH3), 1.49-1.50 (1H, CH), 1.59-
[4, 9].
1.60 (2H, CH2), 1.75-1.79 м (8Н, CH2), 1.87-1.89 м
(8Н, CH2), 3.77-3.79 м (2H, CH2), 5.13-5.25 м (4Н,
Рентгеноструктурный анализ соединения 11а
CH2), 9.98 с (1Н, ОH). Спектр ЯМР 13С (CDCl3),
выполнен на автоматическом четырехкружном
δ, м.д.: 22.9, 24.4, 24.5, 25.4, 33.7, 33.8, 38.7, 67.5,
дифрактометре Agilent Xcalibur (Gemini, Eos)
91.4, 91.5, 119.0, 119.1, 171.2. Масс-спектр (MALDI
(графитовый монохроматор, MoKα-излучение, λ =
TOF/TOF), m/z: 388 [M - H]+. Найдено, %: C 55.50;
0.71073, ω-сканирование, 2θмакс 62°). Сбор и пер-
H 8.00; N 3.58. C18H31NO8. Вычислено, %: C 55.51;
вичная обработка данных выполнены с помощью
H 8.02; N 3.60.
программы CrysAlisPro Oxford Diffraction Ltd. [10].
Структура расшифрована и уточнена в рамках
2-(6,7,13,14,18,19-Гексаокса-16-азадиспи-
программ SHELXТ [11] и SHELXL [12]. Неводо-
ро[4.2.48.75]нонадекан-16-ил)-3-метилбутано-
родные атомы уточнены в анизотропном прибли-
вая кислота (5d). Выход 0.32 г (88%), белое масло,
жении. Атомы водорода рассчитывали геометриче-
Rf 0.72 (PE-Et2O, 10:1). Спектр ЯМР 1Н (CDCl3),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
СИНТЕЗ N-ЗАМЕЩЕННЫХ ТЕТР
А(ГЕКСА)ОКСАЗАСПИРОАЛКАНОВ
87
Таблица 2. Кристаллографические параметры и детали уточнения кристаллической структуры 12а
Параметр
Значение параметра
Брутто-формула
C10H17NO6
Молекулярная масса
247.25
Температура, K
293(2)
Сингония
триклинная
Пространственная группа
P-1
a, Å
6.3428(5)
b, Å
10.3466(13)
c, Å
19.0468(15)
α, град
78.754(9)
β, град
82.207(6)
γ, град
77.034(8)
V, Å3
1189.2(2)
Z
4
dвыч, г/см3
1.381
μ, мм-1
0.114
F(000)
528.0
Диапазон измерения 2θ, град
4.306-58.268
Диапазон индексов
-8 ≤ h ≤ 8, -12 ≤ k ≤ 13, -25 ≤ l ≤ 19
Число измеренных отражений
9778
Число независимых отражений
5453 (Rint = 0.0536)
Добротность уточнения по F2 (S)
1.026
Заключительный R-фактор [I ≥ 2σ(I)]
R1 = 0.0975, wR2 = 0.2089
R-фактор (по всему массиву)
R1 = 0.1941, wR2 = 0.2648
Остаточные пики электронной плотности, мин/макс, e Å-3
0.35/-0.25
δ, м.д.: 0.91-0.92 (3H, CH3), 1.66-1.67 м (8Н, CH2),
тановая кислота (5e). Выход 0.30 г (75%), белое
1.91-1.96 м (8Н, CH2), 3.67-3.69 м (1Н, CH), 5.12-
масло, Rf 0.76 (PE-Et2O, 10:1). Спектр ЯМР 1Н
5.26 м (4Н, CH2), 9.97 с (1Н, OH). Спектр ЯМР
(CDCl3), δ, м.д.: 1.68-1.73 м (8H, CH2), 1.81-1.83 м
(2Н, CH2), 1.91-1.94 м (8Н, CH2), 1.95-2.00 м (2Н,
13С (CDCl3), δ, м.д.: 22.5, 24.4, 24.5, 33.2, 33.7,
CH2), 2.12-2.15 м (3Н, CH3), 3.70-3.73 м (1Н, CH),
67.9, 92.3, 92.5, 120.2, 120.3, 170.5. Масс-спектр
5.13-5.19 м (4Н, CH2), 9.98 с (1Н, ОH). Спектр
(MALDI TOF/TOF), m/z: 374 [M - H]+. Найдено, %:
ЯМР 13С (CDCl3), δ, м.д.: 17.3, 23.2, 24.4, 24.5,
C 54.37; H 7.77; N 3.70. C17H29NO8. Вычислено, %:
33.7, 33.8, 38.3, 67.9, 92.4, 92.5, 120.2, 120.3, 172.2.
C 54.39; H 7.79; N 3.73.
Масс-спектр (MALDI TOF/TOF), m/z: 406 [M - H]+.
2-(6,7,13,14,18,19-Гексаокса-16-азадиспи-
Найдено, %: C 50.09; H 7.15; N 3.41. C17H29NO8S.
ро[4.2.48.75]нонадекан-16-ил)-4-(метилтио)бу-
Вычислено, %: C 50.11; H 7.17; N 3.44.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
88
МАХМУДИЯРОВА и др.
2-(3,12-Диметил-7,8,15,16,20,21-гексаокса-
TOF/TOF), m/z: 388 [M - H]+. Найдено, %: C 55.49;
18-азадиспиро[5.2.59.76]геникозан-18-ил)ук-
H 8.00; N 3.58. C18H31NO8. Вычислено, %: C 55.51;
сусная кислота (6a). Выход 0.28 г (76%), белое
H 8.02; N 3.60.
масло, Rf 0.74 (PE-Et2O, 10:1). Спектр ЯМР 1Н
2-(8,9,17,18,22,23-Гексаокса-20-азадиспи-
(CDCl3), δ, м.д.: 0.91-1.02 м (6Н, CH3), 1.38-1.62 м
ро[6.2.610.77]трикозан-20-ил)пропановая кис-
(10Н, СН, CH2), 1.85-1.99 м (8Н, CH2), 3.75-3.78 м
лота (7b). Выход 0.33 г (82%), белое масло, Rf
(2Н, CH2), 5.16-5.21 м (4Н, СН2), 10.37 м (1Н, ОН).
0.77 (PE-Et2O, 10:1). Спектр ЯМР 1Н (CDCl3),
Спектр ЯМР 13С (CDCl3), δ, м.д.: 20.9, 21.4, 25.6,
δ, м.д.: 1.52-1.66 м (16Н, Н2С), 1.87-2.10 м (8Н,
30.0, 30.6, 30.7, 34.7, 68.0, 91.8, 92.4, 109.8, 174.3.
Н2С), 3.70-3.71 м (1Н, CH), 5.11-5.14 м (4Н, CH2),
Масс-спектр (MALDI TOF/TOF), m/z: 388 [M - H]+.
9.79 с (1Н, ОH). Спектр ЯМР 13С (CDCl3), δ, м.д.:
Найдено, %: C 55.49; H 8.01; N 3.58. C18H31NO8.
19.7, 22.7, 24.2, 29.8, 29.9, 32.9, 33.5, 67.9, 91.7,
Вычислено, %: C 55.51; H 8.02; N 3.60.
92.3, 113.9, 114.3, 173.9. Масс-спектр (MALDI
2-(3,12-Диметил-7,8,15,16,20,21-гексаокса-
TOF/TOF), m/z: 402 [M - H]+. Найдено, %: C 56.54;
18-азадиспиро[5.2.59.76]геникозан-18-ил)про-
H 8.21; N 3.45. C19H33NO8. Вычислено, %: C 56.56;
пановая кислота (6b). Выход 0.32 г (82%), белое
H 8.24; N 3.47.
масло, Rf 0.72 (PE-Et2O, 10:1). Спектр ЯМР 1Н
2-(8,9,17,18,22,23-Гексаокса-20-азадиспиро-
(CDCl3), δ, м.д.: 1.02-1.03 м (6Н, CH3), 1.16-1.26 м
[6.2.610.77]трикозан-20-ил)-4-метилпентановая
(3Н, CH3), 1.40-1.64 м (10Н, СН, CH2), 1.86-1.92 м
кислота (7с). Выход 0.37 г (85%), белое масло,
(8Н, CH2), 3.76-3.78 м (1Н, CH), 5.17-5.22 м (4Н,
Rf 0.74 (PE-Et2O, 10:1). Спектр ЯМР 1Н (CDCl3),
СН2), 10.33 м (1Н, ОН). Спектр ЯМР 13С (CDCl3),
δ, м.д.: 0.97-0.99 м (6Н, СН3), 1.50-1.64 м (18Н,
δ, м.д.: 20.9, 21.5, 29.2, 30.0, 30.6, 30.7, 34.7, 68.0,
Н2С), 1.78-2.09 м (8Н, Н2С), 3.67-3.70 м (1Н, CH),
91.8, 92.4, 109.9, 174.0. Масс-спектр (MALDI TOF/
5.11-5.24 м (4Н, CH2), 9.62 с (1Н, ОH). Спектр
TOF), m/z: 402 [M - H]+. Найдено, %: C 56.54; H
ЯМР 13С (CDCl3), δ, м.д.: 22.7, 24.2, 25.5, 29.8,
8.22; N 3.45. C19H33NO8. Вычислено, %: C 56.56;
30.0, 31.8, 32.7, 32.9, 33.5, 67.8, 91.7, 92.4, 113.9,
H 8.24; N 3.47.
114.5, 173.8. Масс-спектр (MALDI TOF/TOF), m/z:
2-(3,12-Диметил-7,8,15,16,20,21-гекса-
444 [M - H]+. Найдено, %: C 59.29; H 8.80; N 3.12.
окса-18-азадиспиро[5.2.59.76]геникозан-
C22H39NO8. Вычислено, %: C 59.31; H 8.82; N 3.14.
18-ил)-4-метилпентановая кислота (6с). Выход
2-(8,9,17,18,22,23-Гексаокса-20-азадиспиро-
0.34 г (78), белое масло, Rf 0.70 (PE-Et2O, 10:1).
[6.2.610.77]трикозан-20-ил)-3-метилбутановая
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.89-0.92 м (6Н,
кислота (7d). Выход 0.36 г (86%), желтое масло,
CH3), 0.99-1.01 м (6Н, CH3), 1.36-1.61 м (13Н, СН,
CH2), 1.83-1.97 м (8Н, CH2), 3.73-3.76 м (1Н, CH),
Rf 0.79 (PE-Et2O, 10:1). Спектр ЯМР 1Н (CDCl3),
δ, м.д.: 0.82-0.93 м (6Н, СН3), 1.31-1.52 м (18Н,
5.14-5.19 м (4Н, СН2), 10.44 м (1Н, ОН). Спектр
ЯМР 13С (CDCl3), δ, м.д.: 20.9, 21.4, 25.5, 30.6,
Н2С), 1.78-2.15 м (9Н, СН, Н2С), 3.68-3.70 м
30.7, 31.1, 34.7, 68.0, 91.8, 92.5, 109.7, 173.9. Масс-
(1Н, CH), 5.08-5.27 м (4Н, CH2), 9.64 с (1Н, ОH).
спектр (MALDI TOF/TOF), m/z: 444 [M - H]+.
Спектр ЯМР 13С (CDCl3), δ, м.д.: 20.8, 25.4, 30.5,
Найдено, %: C 59.29; H 8.80; N 3.12. C22H39NO8.
30.6, 33.3, 34.6, 67.8, 91.7, 92.2, 109.5, 110.1, 174.1.
Вычислено, %: C 59.31; H 8.82; N 3.14.
Масс-спектр (MALDI TOF/TOF), m/z: 430 [M - H]+.
Найдено, %: C 58.43; H 8.62; N 3.23. C21H37NO8.
2-(8,9,17,18,22,23-Гексаокса-20-азадиспи-
Вычислено, %: C 58.45; H 8.64; N 3.25.
ро[6.2.610.77]трикозан-20-ил)уксусная кислота
(7а). Выход 0.32 г (85%), белый порошок, т.пл.
2-(6,7,11,12-Тетраокса-9-азадиспиро[4.7]-
64-66°С, масло, Rf 0.78 (PE-Et2O, 10:1). Спектр
додекан-9-ил)уксусная кислота
(11а). Выход
ЯМР 1Н (CDCl3), δ, м.д.: 1.58-1.74 м (16Н, Н2С),
0.20 г (91%), белое масло, Rf 0.75 (PE-Et2O, 10:1).
1.87-2.06 м (8Н, Н2С), 3.77-3.88 м (2Н, CH2), 5.09-
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.44-1.92 м (8Н,
5.31 м (4Н, CH2), 9.65 с (1Н, ОH). Спектр ЯМР 13С
CH2), 3.82-3.89 м (2Н, CH2), 5.04-5.32 м (4Н, CH2),
(CDCl3), δ, м.д.: 22.7, 22.8, 29.9, 32.4, 33.0, 68.0,
9.95 c (1Н, OH). Спектр ЯМР 13С (CDCl3), δ, м.д.:
91.8, 92.5, 115.1, 116.2, 174.1. Масс-спектр (MALDI
24.4, 22.6, 28.8, 29.5, 67.6, 91.8, 106.1, 106.3, 170.1.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
СИНТЕЗ N-ЗАМЕЩЕННЫХ ТЕТР
А(ГЕКСА)ОКСАЗАСПИРОАЛКАНОВ
89
Масс-спектр (MALDI TOF/TOF), m/z: 232 [M - H]+.
2-(1,2,6,7-Тетраокса-4-азаспиро[7.11]нона-
Найдено, %: C 46.33; H 6.46; N 6.00. C9H15NO6.
декан-4-ил)пропановая кислота (13b). Выход
Вычислено, %: C 46.35; H 6.48; N 6.01.
0.23 г (67%), белое масло, Rf 0.72 (PE-Et2O, 10:1).
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.21-1.75 м (22Н,
2-(7,8,12,13-Тетраокса-10-азаспиро[5.7]три-
CH2), 3.41-3.51 м (1Н, CH), 5.07-5.31 м (4Н, CH2),
декан-10-ил)уксусная кислота
(12а). Выход
9.71 с (1Н, ОH). Спектр ЯМР 13С (CDCl3), δ, м.д.:
0.21 г (88%), белое масло, Rf 0.77 (PE-Et2O, 10:1).
19.2, 19.3, 21.8, 22.2, 22.3, 22.6, 24.2, 24.7, 25.9,
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.27-1.91 м (10Н,
26.1, 26.2, 26.9, 68.3, 92.4, 93.6, 113.2, 175.0. Масс-
CH2), 3.87-3.90 м (2Н, CH2), 5.11-5.30 м (4Н, CH2),
спектр (MALDI TOF/TOF), m/z: 344 [M - H]+.
9.75 c (1Н, OH). Спектр ЯМР 13С (CDCl3), δ, м.д.:
Найдено, %: C 59.09; H 9.03; N 4.03. C17H31NO6.
24.4, 22.7, 24.9, 25.2, 27.0, 67.9, 91.8, 92.5, 107.4,
Вычислено, %: C 59.11; H 9.05; N 4.05.
173.2. Масс-спектр (MALDI TOF/TOF), m/z: 246
4-(Метилтио)-2-(1,2,6,7-тетраокса-4-азаспи-
[M - H]+. Найдено, %: C 48.56; H 6.90; N 5.65.
ро[7.11]нонадекан-4-ил)бутановая
кислота
C10H17NO6. Вычислено, %: C 48.58; H 6.93; N 5.67.
0.70
(13е). Выход 0.26 г (65%), белое масло, Rf
2-(7,8,12,13-Тетраокса-10-азаспиро[5.7]три-
(PE-Et2O, 10:1). Спектр ЯМР 1Н (CDCl3), δ, м.д.:
декан-10-ил)пропановая кислота (12b). Выход
0.91-0.97 м (6Н, СН3), 1.17-1.71 м (23Н, СН, CH2),
0.21 г (83%), белое масло, Rf 0.70 (PE-Et2O,
3.30-3.47 м (1Н, CH), 5.13-5.29 м (4Н, CH2), 9.70
10:1). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.88-0.96
с (1Н, ОH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 18.2,
м (3Н, СН3), 1.44-1.91 м (10Н, CH2), 3.97-3.99 м
18.8, 22.1, 22.2, 23.8, 24.2, 25.7, 26.6, 29.9, 30.2,
(1Н, CH), 5.03-5.22 м (4Н, CH2), 9.72 c (1Н, OH).
64.8, 92.5, 93.5, 113.7, 175.6. Масс-спектр (MALDI
Спектр ЯМР 13С (CDCl3), δ, м.д.: 21.0, 22.4, 22.5,
TOF/TOF), m/z: 404 [M - H]+. Найдено, %: C 56.25;
24.9, 25.9, 26.9, 29.6, 29.8, 66.9, 91.8, 110.1, 110.5,
H 8.68; N 3.43. C19H35NO6S. Вычислено, %: C
173.4. Масс-спектр (MALDI TOF/TOF), m/z: 260
56.27; H 8.70; N 3.45.
[M - H]+. Найдено, %: C 50.55; H 7.31; N 5.34.
ВЫВОДЫ
C11H19NO6. Вычислено, %: C 50.57; H 7.33; N 5.36.
Разработан эффективный метод синтеза
4-Метил-2-(7,8,12,13-тетраокса-10-азаспи-
N-замещенных гекса(тетра)оксазаспироалканов
ро[5.7]тридекан-10-ил)пентановая
кислота
реакцией гептаоксадиспироалканов и пентаокса-
(12с). Выход 0.23 г (77%), белое масло, Rf 0.73
спироалканов с аминокислотами (глицин, аланин,
(PE-Et2O, 10:1). Спектр ЯМР 1Н (CDCl3), δ, м.д.:
лейцин, 2-метилаланин, валин, триптофан) с уча-
0.89-0.92 м (3Н, СН3), 1.27-2.13 м (13Н, СН, CH2),
стием Sm-содержащих катализаторов.
3.77-3.95 м (1Н, CH), 5.12-5.32 м (4Н, CH2), 10.00
БЛАГОДАРНОСТИ
c (1Н, OH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 19.5,
19.7, 22.4, 22.5, 24.3, 29.3, 30.1, 32.5, 67.8, 93.8,
Структурные исследования синтезированных
107.4, 173.9. Масс-спектр (MALDI TOF/TOF), m/z:
соединений выполнены в Центре коллективного
302 [M - H]+. Найдено, %: C 55.41; H 8.30; N 4.60.
пользования «Агидель» при Институте нефтехи-
C14H25NO6. Вычислено, %: C 55.43; H 8.31; N 4.62.
мии и катализа РАН.
ФОНДОВАЯ ПОДДЕРЖКА
3-Метил-2-(7,8,12,13-тетраокса-10-азаспи-
ро[5.7]тридекан-10-ил)бутановая кислота (12d).
Исследование выполнено при финансовой под-
Выход 0.24 г (85%), белое масло, Rf 0.71 (PE-
держке Российского фонда фундаментальных ис-
Et2O, 10:1). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.88-
следований (проект РФФИ № 20-30-90002).
0.95 м (6Н, СН3), 1.44-1.91 м (11Н, СН, CH2), 3.98-
КОНФЛИКТ ИНТЕРЕСОВ
4.00 м (1Н, CH), 5.15-5.32 м (4Н, CH2), 9.72 c (1Н,
Авторы заявляют об отсутствии конфликта ин-
OH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 20.3, 22.4,
тересов.
22.5, 25.3, 25.4, 27.0, 29.6, 29.8, 69.0, 91.8, 110.1,
110.5, 173.6. Масс-спектр (MALDI TOF/TOF), m/z:
СПИСОК ЛИТЕРАТУРЫ
288 [M - H]+. Найдено, %: C 53.95; H 7.99; N 4.82.
1. Makhmudiyarova N.N., Khatmullina G.M., Rakhi-
C13H23NO6. Вычислено, %: C 53.97; H 8.01; N 4.84.
mov R.Sh., Meshcheryakova E.S., Ibragimov A.G.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
90
МАХМУДИЯРОВА и др.
Dzhemilev U.M. Tetrahedron. 2016, 72, 3277-3281.
360-367.
[Makhmudiyarova N.N., Koroleva L.S.,
doi 10.1016/j.tet.2016.04.055
Meshcheryakova E.S., Ibragimov A.G. Russ. J.
2. Tyumkina T.V., Makhmudiyarova N.N., Kiyamutdino-
Org. Chem.
2020,
56,
378-384.] doi
10.31857/
va G.M., Meshcheryakova E.S., Bikmukhame-
S0514749220030027
tov K.Sh., Abdullin M.F., Khalilov L.M., Ibragi-
7. Makhmudiyarova N.N., Shangaraev K.R., Dzhemile-
mov A.G., Dzhemilev U.M. Tetrahedron. 2018, 74,
va L.U., Tuymkina T.V., Mescheryakova E.S.,
1749-1758. doi 10.1016/j.tet.2018.01.045
D’yakonov V.A., Ibragimov A.G., Dzhemilev U.M.
3. Mахмудиярова Н.Н., Рахимов Р.Ш., Тюмкина Т.В.,
RSC Adv.
2019,
9,
29949-29958. doi
10.1039/
Мещерякова Е.С., Ибрагимов А.Г., Джемилев У.М.
ЖОрХ. 2019, 55, 714-728. [Makhmudiyarova N.N.,
c9ra06372b
Rakhimov R.Sh., Tyumkina T.V., Meshcheryakova E.S.,
8. Cremer D., Pople J.A. J. Am. Chem. Soc. 1975,
Ibragimov A.G., Dzhemilev U.M. Russ. J. Org. Chem.
97, 1354-1358. doi 10.1021/ja00839a011
2019, 55, 620-632.] doi 10.1134/S1070428019050075
9. Makhmudiyarova N.N., Khatmullina G.M., Rakhi-
4. Makhmudiyarova N.N., Ishmukhametova I.R.,
mov R.Sh., Ibragimov A.G., Dzhemilev U.M. Arkivoc.
Tyumkina T.V., Ibragimov A.G., Dzhemilev U.M.
Tetrahedron Lett. 2018, 59, 3161-3164. doi 10.1016/
2016, 427-433. doi 10.24820/ark.5550190.p009.565
j.tetlet.2018.07.010
10. CrysAlis PRO, Yarnton, Oxfordshire, England: Agilent
5. Makhmudiyarova N.N., Ishmukhametova I.R.,
Tecnologies, 2012.
Dzhemileva L.U., Tyumkina T.V., D’yakonov V.A.,
11. Sheldrick G.M. Acta Crystallogr. Sect. A. 2015, 71,
Ibragimov A.G., Dzhemilev U.M. RSC Adv. 2019, 9,
3-8. doi 10.1107/S2053273314026370
18923-18929. doi 10.1039/C9RA02950H
6. Махмудиярова Н.Н., Королева Л.С., Меще-
12. Sheldrick G. M. Acta Crystallogr. Sect. C. 2015, 71,
рякова Е.С., Ибрагимов А.Г. ЖОрХ.
2020,
56,
3-8. doi 10.1107/S2053229614024218
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021
СИНТЕЗ N-ЗАМЕЩЕННЫХ ТЕТР
А(ГЕКСА)ОКСАЗАСПИРОАЛКАНОВ
91
Synthesis of N-Substituted Tetra(hexa)oxazaspiroalkanes
with the Participation of Amino Acids
and Sm-containing Catalysts
N. N. Makhmudiyarova*, I. R. Ishmukhametova, K. R. Shangaraev,
E. S. Meshcheryakova, and A. G. Ibragimov
Institute of Petrochemistry and Catalysis, Russian Academy of Sciences,
prosp. Oktyabrya, 141, Ufa, 450075 Russia
*e-mail: natali-mnn@mail.ru
Received November 3, 2020; revised November 10, 2020; accepted November 13, 2020
An efficient method for the synthesis of N-substituted tetra(hexa)oxazaspiroalkanes by the reaction of
heptaoxadispiroalkanes and pentaoxaspiroalkanes with amino acids (glycine, alanine, leucine, valine, tryptophan)
with the participation of Sm-containing catalysts has been developed.
Keywords: catalysis, amino acids, heptaoxadispiroalkanes, pentaoxaspiroalkanes, tetra(hexa)oxazaspiroalkanes,
X-ray structural analysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 1 2021