ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 12, с. 1717-1726
УДК 547.781 + 547.828 + 543.421/.422
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
НОВЫХ ХАЛКОНОВ, СОДЕРЖАЩИХ
2-ХЛОРИМИДАЗО[1,2-а]ПИРИДИНОВЫЙ ФРАГМЕНТ
© 2021 г. А. Н. Чухланцеваa, b, Д. А. Ермоловb, И.В Лунеговb, И. Г. Мокрушинb,
Е. В. Шкляеваb, Г. Г. Абашевa, b, *
a Институт технической химии - филиал ФГБУН «Пермского федерального исследовательского центра УрО РАН»,
Россия, 614013 Пермь, ул. Академика Королева, 3
b ФГБОУ ВО «Пермский государственный национальный исследовательский университет»,
Россия, 614900 Пермь, ул. Букирева, 15
*e-mail: gabashev@psu.ru
Поступила в редакцию 04.06.2021 г.
После доработки 16.06.2021 г.
Принята к публикации 18.06.2021 г.
Получены новые халконы, включающие 2-хлоримидазо[1,2-а]пиридиновый фрагмент; изучены их
оптические свойства; на основе данных спектров поглощения и испускания определены сдвиги Стокса
и ширина запрещенной зоны, рассчитаны коэффициенты молярного поглощения и квантовые выходы
флуоресценции. Появление в структуре халкона дополнительного тиофенового фрагмента привело
к уменьшению ширины запрещенной зоны, к увеличению сдвига Стокса, к красному сдвигу полосы
испускания и к резкому росту квантового выхода до 22%. Полученные халконы термически устойчивы
и обладают хорошими пленкообразующими свойствами, полученные пленки демонстрируют упорядо-
ченную структуру.
Ключевые слова: 2-хлоримидазо[1,2-а]пиридин, 1-азаиндализин, карбазол, халкон, ширина запрещен-
ной зоны, π-сопряженные соединения, хромофоры
DOI: 10.31857/S0514749221120065
ВВЕДЕНИЕ
ния. Варьирование оптических и электрохимиче-
ских свойств соединения может достигаться как
Известно, что замещенные имидазо[1,2-а]пири-
введением различных функциональных групп в
дины (1-азаиндолизины) являются важными гете-
1-азаиндолизиновом цикле [6], так и увеличением
роциклическими соединениями благодаря широ-
протяженности π-сопряженной системы хромо-
кому спектру биологической и фармакологической
форной единицы [7]; такие изменения в структуре
активности [1-3]. В настоящее время замещенные
соединения сказываются на квантовом выходе и на
1-азаиндолизины изучаются с точки зрения их ис-
области поглощения УФ-ВИД-спектров [8].
пользования в области оптоэлектроники, напри-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
мер, для создания устройств, излучающих белый
свет, и устройств для гибридной флуоресценции/
В продолжение наших работ, посвященных
фосфоресценции (F/P-WOLED) [4, 5]. Такой ин-
хромофорам, включающим 2-хлоримидазо[1,2-а]-
терес связан с тем, что соединениям, включаю-
пиридиновый фрагмент [9], нами выполнен синтез
щим 1-азаиндолиновый фрагмент, часто присуще
халконов, содержащих одновременно 2-хлорими-
голубое свечение с высоким квантовым выходом,
дазо[1,2-а]пиридиновый и карбазольный фрагмен-
хорошие электронные и транспортные свойства,
ты. Для введения 1-азаиндолизинового гетероцик-
достаточно высокие энергии триплетного состоя-
ла в структуру целевых соединений использовали
1717
1718
ЧУХЛАНЦЕВА и др.
Схема 1
Cl
NH2
ClCH2CO2H, Et3N, H2O
POCl3, PhCH3
HN
N
N
N
N
90°C, 5 ч
115°C, 16 ч
O
OH
1, 75%
2, 62%
N
POCl3, ДМФА, PhCl
Cl
N
70°C, 5 ч
O
3, 90%
методику, аналогичную [9-11], исходным соедине-
метилкетона
7, который можно рассматривать
нием в которой служит доступный 2-аминопири-
как «расширенный» тиофеновым фрагментом ме-
дин (схема 1).
тилкетон 5, использована реакция Вильсмейера-
Хаака-Арнольда (схема 2) [13].
На схеме 2 показан синтез метилкетонов 5 и
7, которые далее были использованы как мети-
Конденсация 2-хлоримидазо[1,2-a]пиридин-3-
леновая компонента в конденсациях Кляйзена-
карбальдегида с метилкетонами 5 и 7 привела к
Шмидта. Метилкетон 5 получен ацетилированием
образованию соответствующих халконов 8 и 9
9-гексадецил-9H-карбазола [12]. Для получения
(схема 3).
Схема 2
C16H33Br, NaOH, ДМСО
N
rt, 48 ч
N
H
C16H33
4, 73%
O
O
Cl
H
Me
CH3COBr, SnCl4, CH2Cl2
POCl3, ДМФА
rt, 24 ч
60°C, 5 ч
N
N
C16H
33
C16H33
5, 63%
6, 96%
O
1) Na2·9H2O, ДМФА
2) ClCH2COCH3
Me
3) K2CO3, H2O
S
1) 60°C, 2 ч
2) 60°C, 3 ч
3) 60°C, 10 мин
N
C16H33
7, 28%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА НОВЫХ ХАЛКОНОВ
1719
Схема 3
O
Cl
R
N
R
Me
N
Cl
5, 7
N
O
10% EtOH/KOH
N
O
rt, 12 ч
3
8, 40%, 9, 21%
S
R =
N
N
C16H
33
C
16H33
5, 8
7, 9
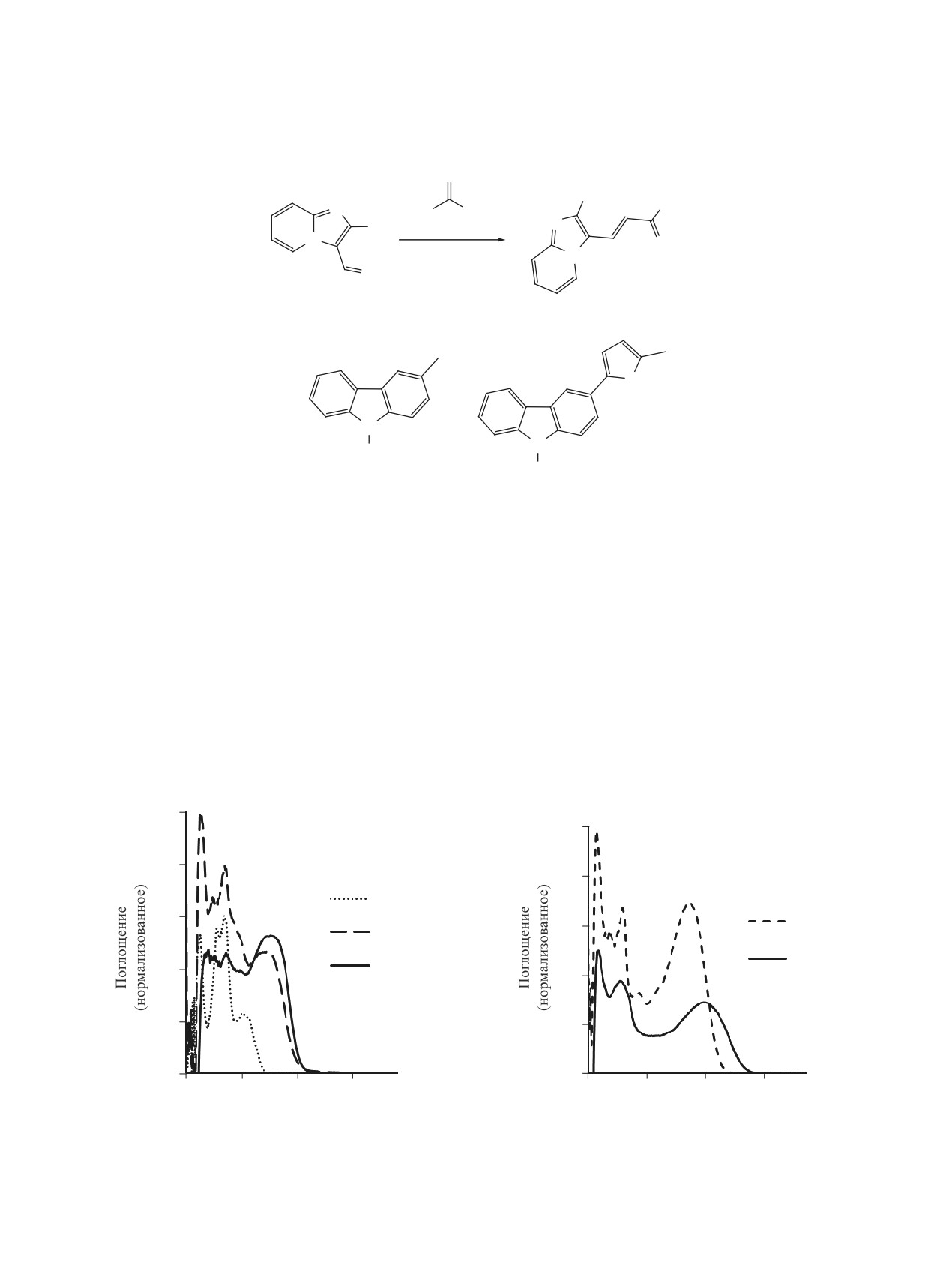
Изучены оптические свойства растворов син-
атома хлора. Батохромное смещение наблюдается
тезированных соединений в CHCl3. Исследование
при переходе от хлорпропеналя 6 к соединению 7
оптических характеристик полученных соедине-
(рис. 1), что можно объяснить расширением цепи
ний 5-7 показало, что при переходе от метилке-
сопряжения, а его небольшое значение (5 нм), ско-
рее всего, связано с появлением в цепи сопряже-
тона 5 к хлорпропеналю 6 происходит значитель-
ния электронодонорного тиофенового фрагмента.
ный сдвиг красной границы начала поглощения
в длинноволновую область спектра ~ на 70 нм
На основе данных УФ-спектров поглощения
(рис. 1). Такое сильное батохромное смещение
и спектров испускания были определены сдвиги
связано, во-первых, с удлинением цепи сопряже-
Стокса (Δλ), рассчитаны значения ширины опти-
ния, а во-вторых, с усилением электроноакцептор-
ческой запрещенной зоны (Egopt) по уравнению
ных свойств электронодефицитной части молеку-
Egopt = 1240/λonset [14]. Характеристики всех иссле-
лы, за счет появления в ней альдегидной группы и
дуемых соединений приведены в таблице.
1
1
0.8
0.8
5
0.6
8
0.6
6
9
7
0.4
0.4
0.2
0.2
0
0
220
320
420
520
λ, нм
230
330
430
530
λ, нм
Рис. 1. УФ-спектры поглощения растворов соедине-
Рис. 2. УФ-спектры поглощения растворов халконов 8,
ний 5-7 в CHCl3 (с 5×10-5 моль/л)
9 в CHCl3 (с 5×10-5 моль/л)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
1720
ЧУХЛАНЦЕВА и др.
Оптические характеристики синтезированных соединений 5-9
Соединение
λmabxs, нм (ε, моль-1·см-1)
λonset, нм
λmemx, нм
D
Egopt, эВ
Φ, %
5
246, 274, 288, 321
367
390
69
3.38
6
247, 267, 290, 365
437
451
86
2.83
7
293, 373
442
458
85
2.81
8
288(287114), 318(13581), 403(28700)
476
468
65
2.61
3.4
9
247(21116), 286(15948), 428(12240)
515
539
111
2.41
22
Для халконов 8 и 9 определены коэффициенты
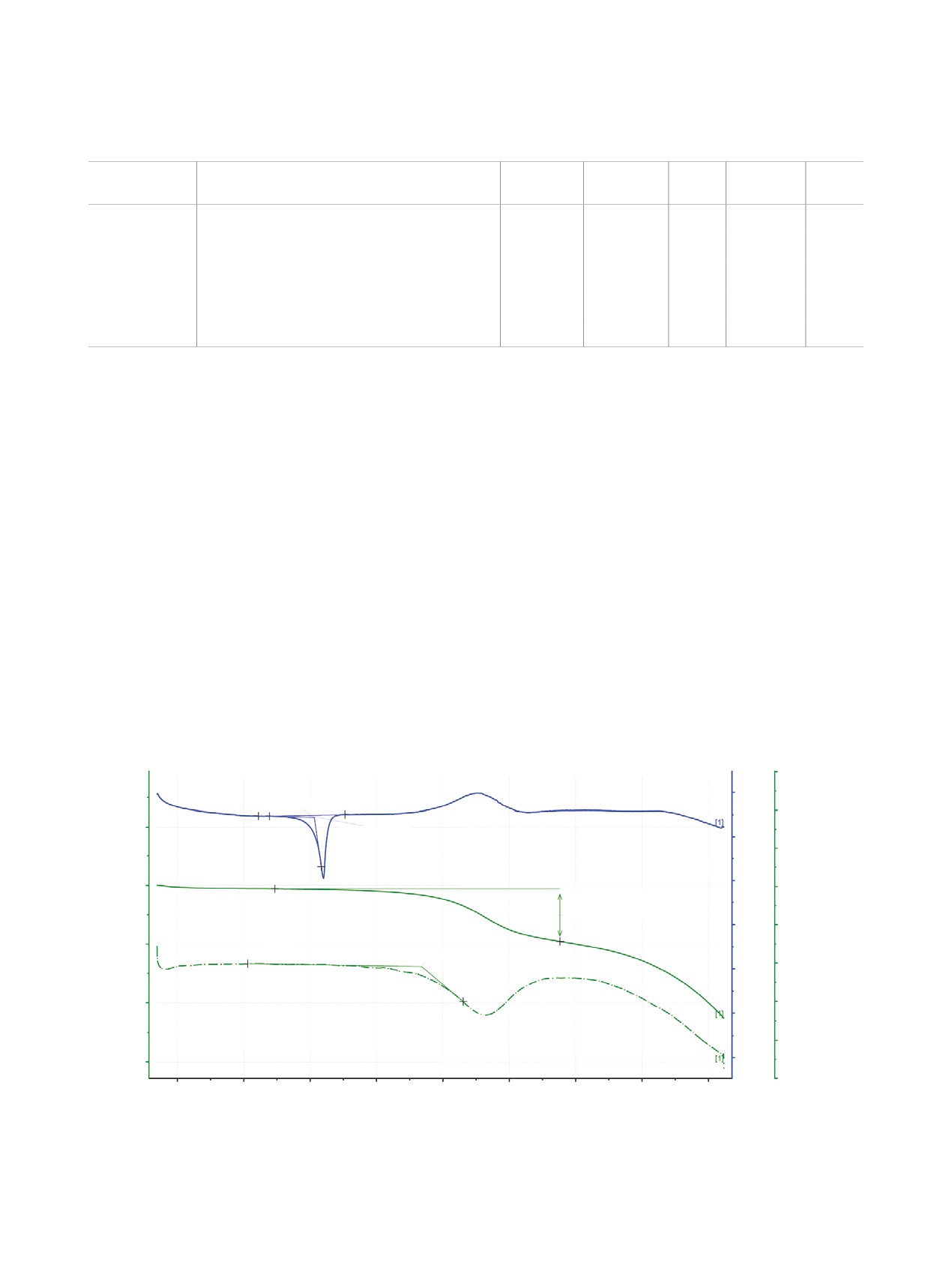
Для определения термических свойств халкона
молярного поглощения и квантовые выходы флу-
8 был выполнен его синхронный термический ана-
оресценции [15], которые измерены относительно
лиз на приборе Netsch STA449 F1 Jupiter, совме-
спиртового раствора 3-аминофталимида, исполь-
щенном с масс-спектрометром QMS 443 Aeolos, на
зуемого в качестве стандарта (см. таблицу).
рис. 3 показаны его термогравиметрические (ТГ)
кривые и кривые дифференциальной сканирую-
Установлено, что при появлении тиофеново-
щей калориметрии (ДСК). Температура плавления
го фрагмента в структуре халкона (соединение 9)
вещества составляет 153°C, энтальпия плавления
его квантовый выход флуоресценции увеличил-
ся больше чем в 6 раз. Такой результат является
около 145 Дж/г. Ход термогравиметрической кри-
прямым следствием введения дополнительного
вой свидетельствует о ненулевом давлении насы-
тиофенового фрагмента в структуру хромофора,
щенного пара расплава. Установлено, что халкон
что было показано нами ранее на примерах дру-
8 устойчив в интервале температур до 230°C, та-
гих хромофоров [16, 17]. Если сравнивать положе-
кая термоустойчивость делает его перспективным
ния максимумов поглощения в спектрах халконов
для использования в материалах для органической
8 и 9, то очевиден батохромный сдвиг на 28 нм
электроники. Дальнейшее повышение темпера-
(рис. 2).
туры приводит к разложению халкона. Описание
ДСК, мВт/мг
ТГ, %
ДТГ, %/мин
↑экзо
10
0
153.3°C
8
120
-146.3 Дж/г
-2
6
-4
100
4
Изменение массы -17.94%
Остаток массы 80.87%
-6
2
80
234°C
0
-8
-2
60
-10
-4
-12
40
-6
50
100
150
200
250
300
350
400
450
T, °C
Рис. 3. ТГ/ДСК кривые халкона 8
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА НОВЫХ ХАЛКОНОВ
1721
характера термической деструкции требует допол-
нительных исследований.
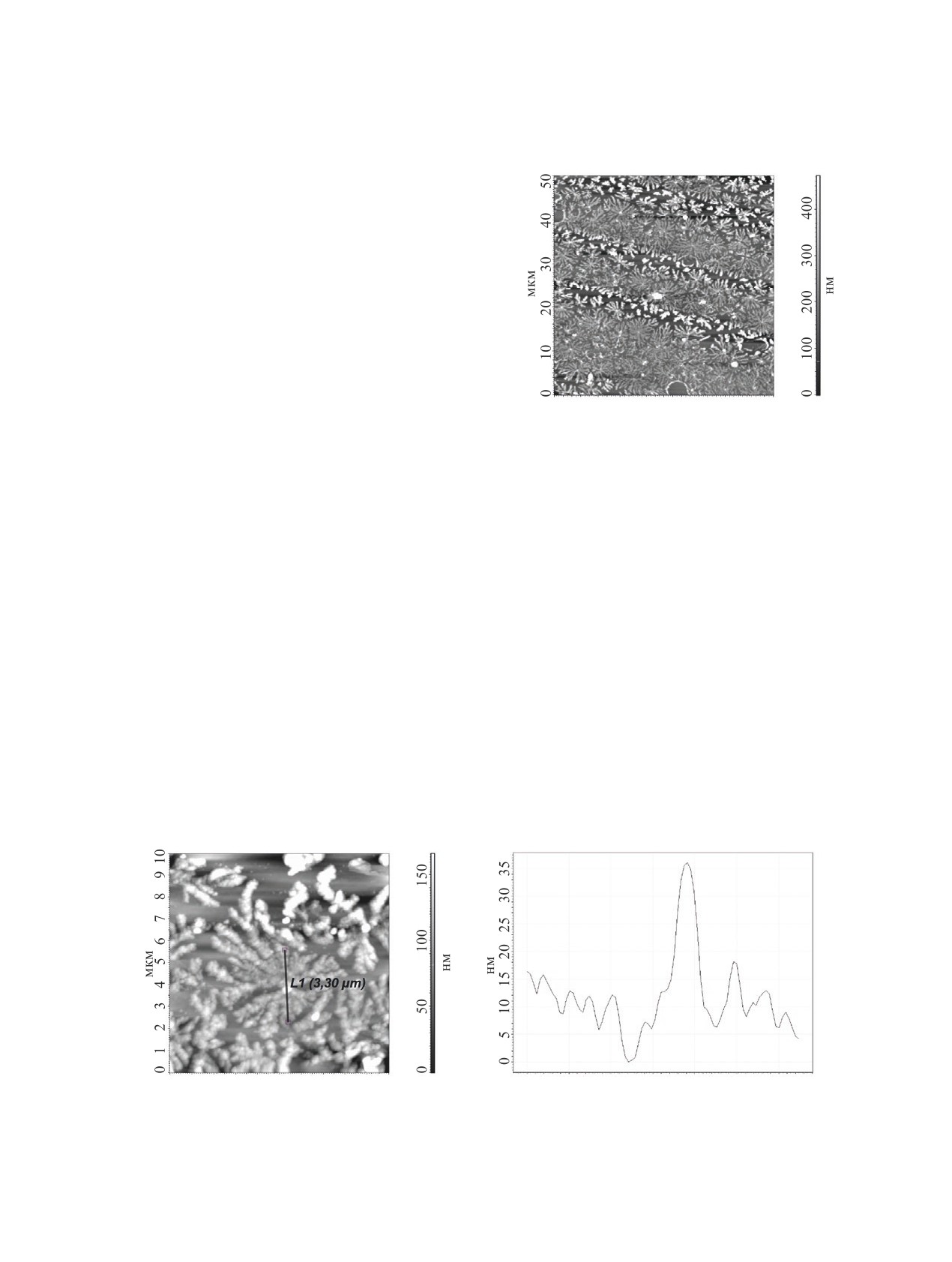
Тонкие пленки халкона 8 получены на стеклян-
ной подложке методом центрифугирования из рас-
твора хлорбензола. На рис. 4 показано изображе-
ние пленки, на котором четко видна упорядочен-
ная структура, состоящая из дендритообразных
сростков кристаллов; толщина полученной пленки
составляет от 200 до 300 нм. На рис. 5, a изобра-
жена структура отдельного образования с ярко вы-
раженным центром кристаллизации. Диаметр оди-
ночных дендритообразных структур колеблется в
интервале от 3.30 до 4.37 мкм с характерной тол-
0
10
20
30
40
50
мкм
щиной одной ветви на периферии от 30 до 50 нм
Рис. 4. 2D-СМ изображение поверхности пленки хал-
и до 500 нм ближе к центру (рис. 5, b). На каждой
кона 8 (размер 50×50 мкм)
ветви выделяются отдельные фрагменты с харак-
терным размером, соответствующим примерному
тренний стандарт - ГМДС, 0.055 м.д.), масс-спек-
размеру молекул ~40 Å. Можно предположить, что
тры - на приборе Agilent Technologies 6890N/5975B
такие дендритообразные структуры образовались
(Agilent Technologies, США) (энергия ионизации
за счет взаимодействия между электроноакцеп-
70 эВ). ИК спектры соединений записаны для
торной частью молекулы (1-азаиндолизина и про-
растворов в CHCl3 на спектрометре Spectrum Two
пенонового фрагмента) халкона и ее электронодо-
FTIR (PerkinElmer, Inc, США). Элементный ана-
норной частью (N-алкилированного карбазольного
лиз выполнен на приборе CHNS-932 LECO Corp
фрагмента). Скорее всего, такие структуры имеют
(Elementar, Германия). Сигналы протонов тиофе-
стопочный характер. Укладка стопок в линии обе-
нового цикла обозначены как как «Th», сигналы
спечивается наличием Ван-дер-Ваальсовых взаи-
протонов карбазольного цикла - как «Cz», сигна-
модействий между длинными гексадецильными
лы протонов 2-хлоримидазо[1,2-a]пиридинового
заместителями.
цикла - как «IP». УФ-спектры растворов соеди-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
нений получены на спектрофотометре Shimadzu
Спектры ЯМР 1Н зарегистрированы на прибо-
UV-2600 (Shimadzu Corp., Япония) в CHCl3 (с
ре Bruker Avance 400 (Bruker, США) в CDCl3 (вну-
10-5 моль/л), размер кюветы 10×10×40 мм. Спект-
a
b
0
1
2
3
4
5
6
7
8
9 10
0
0.5
1.0
1.5
2.0
2.5
3.0
мкм
мкм
Рис. 5. 2D-АСМ изображение поверхности пленки халкона 8 (размер 10×10 мкм) - a; распределение по толщине в выбран-
ном участке пленки (размер 3.5 мкм×40 нм) - b
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
1722
ЧУХЛАНЦЕВА и др.
ры флуоресценции растворов соединений за-
фильтрованием, промывали на фильтре холодным
писаны на спектрофлуорофотометре Shimadzu
этанолом (не более 20-30 мл), сушили на воздухе.
RF-5301 (Shimadzu Corp., Япония) в хлоро-
Выход 4.4 г (75%), белый мелкокристаллический
форме CHCl3 (с 10-5 моль/л), размер кюветы
порошок, т.пл. 256°C (257-258°C [18]). ИК спектр,
10×10×40 мм, растворитель - CHCl3. Термог-
ν, см-1: 1474 (C=N), 1669 (С=O), 3185 уш.с (N-H),
равиметрический анализ выполнен на приборе
3379 уш.с (О-Н). C7H8N2O2.
NETSCH STA 449F7 Jupiter (Германия), тигель -
2-Хлоримидазо[1,2-a]пиридин
(2)
[11]. К
DSC/TG pan Al2O3, диапазон - 35-7000°С, ско-
кипящему раствору 2-(2-имино-1,2-дигидропири-
рость изменения температуры (ΔT)
50°C/мин.
дин-1-ил) уксусной кислоты (1) (4.39 г, 0.029 моль)
Пленки получены методом вращающейся под-
в 40 мл толуола прикапывали POCl3 (8.2 мл,
ложки из растворов соединений в PhCl на прибо-
0.09 моль), после чего кипятили 16 ч, охлаждали
ре Spin 12000 с применением линейного набора
до комнатной температуры и добавляли 100 мл
скоростей до значения в 1000 об/мин; время вра-
холодной воды, перемешивали 15 мин, образо-
щения составляло 20 с; концентрация вещества -
вавшиеся слои разделяли. Водный слой нейтра-
5 мг/мл. Структура поверхности пленок иссле-
лизовывали 10%-ным водным раствором NaOH
дована на атомно-силовом микроскопе NTegro-
при охлаждении в ледяной бане, выпавший серый
Prima, полуконтактный режим сканирования 1 мкм
осадок отфильтровывали, растворяли в дихлорме-
зондом, кантиливер NSG 10, резонансная частота
тане (ДХМ), сушили над прокаленным Na2SO4.
170 кГц. Полученные данные обрабатывали в про-
Фильтрат экстрагировали CH2Cl2 (4×50 мл), объ-
единенные органические слои промывали на-
© NT-MDT; Used Packages: JEDI Libraries, Toolbar
сыщенным раствором NaCl, сушили безводным
2000 by J. Russell, TBX by A.A. Denisov. Нанесение
Na2SO4, растворитель удаляли на роторном испа-
пленок на подложку проводили в перчаточном гер-
рителе, остаток - порошок светло-желтого цвета
метичном боксе «Nitrogen Glove Box PlasLabs»
очищали колоночной хроматографией на силикаге-
(США), заполненном сухим аргоном. Температуру
ле (элюент - ДХМ). Выход 2.76 г (62%), мелкокри-
плавления определяли с помощью прибора Mettler
сталлическое белое вещество, т.пл. 75°С (76-77°С
Toledo MP 70 Melting Point System (Mettler Toledo,
[19]). ИК спектр, ν, см-1: 2853, 1653, 1462, 1377,
США). Ход реакций и индивидуальность получен-
974. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 6.83 т.д (1Н,
ных веществ контролировали с помощью ТСХ на
IP, J 6.9, 1.2 Гц), 7.21 т.д (1Н, IP, J 7.5, 1.5 Гц), 7.53
пластинах Sorbfil (ImidLTD, Россия, Краснодар) в
д (1Н, IP, J 9.3 Гц), 8.04 д.т (1Н, IP, J 6.9, 1.2 Гц);
разных системах растворителей. Разделение сме-
7.49 c (1H, IP). C7H5ClN2
сей, очистка целевых продуктов выполнены на
колонках, заполненных силикагелем (Lancaster,
2-Хлоримидазо[1,2-a]пиридин-3-карбальде-
Silicagel 60, 0.060-0.2 мм). В работе использованы
гид (3) [20]. К раствору 2-хлоримидазо[1,2-a]пи-
коммерчески доступные реагенты: 2-аминопири-
ридина (2) (2.55 г, 0.017 моль) и ДМФА (1.59 мл,
дин (Alfa Aesar), карбазол (Alfa Aesar), ацетилбро-
0.022 моль) в 50 мл предварительно высушенного
мид (Sigma-Aldrich).
и перегнанного хлорбензола при перемешивании
2-(2-Имино-1,2-дигидропиридин-1-ил)ук-
прикапывали POCl3 (3.06 мл, 0.033 моль). Затем
сусная кислота (1) [11]. К раствору хлоруксус-
реакционную массу перемешивали в течение 5 ч
ной кислоты (3.67 г, 0.039 моль) в 6 мл воды при
при 70°C. По завершении реакции смесь охлажда-
комнатной температуре прикапывали Et3N (4.32 г,
ли, выливали в лед (pH 1.0), дважды экстрагирова-
6.1 мл, 0.046 моль), после чего перемешивали
ли дихлорметаном (ДХМ), избыток растворителя
10 мин и добавляли 2-аминопиридин (4.32 г,
удаляли. Выход 4.87 г (90%), белые игольчатые
0.046 моль). Полученную коричневую реакцион-
кристаллы, т.пл. 130°С. ИК спектр, ν, см-1: 1708
ную массу перемешивали в течение 5 ч при 90°C,
(HC=O). Спектр ЯМР 1H (CDCl3), δ, м.д.: 7.18 т.д
охлаждали до комнатной температуры, разбавля-
(1Н, IP, J 6.9, 1.2 Гц), 7.61 т.д (1Н, IP, J 6.9,1.5 Гц),
ли 4 мл этанола и дополнительно перемешива-
7.71 д.т (1Н, IP, J 9.0, 1.2 Гц), 9.49 д.т (1Н, IP, J 7.2,
ли еще 2 ч при 5°C. Выпавший осадок собирали
1.2 Гц), 9.98 c (1H, CHO). Масс-спектр, m/z (I, %):
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА НОВЫХ ХАЛКОНОВ
1723
182 (29) [M + 2Н]+, 181 (40) [M + H]+, 180 (87), 179
вали раствор метилкетона 5 (2.67 г, 6.17 ммоль) в
(100), 99 (18), 90 (13.5), 78 (15), 63 (10), 51 (11).
10 мл ДМФА. По окончании смешивания реаген-
C8H5ClN2O.
тов реакционную массу нагревали в течение 3 ч
при 60°С, охлаждали до комнатной температуры
9-Гексадецил-9Н-карбазол
(4) получен со-
и медленно выливали в 10%-ный водный раствор
гласно методике
[21]. К суспензии карбазола
ацетата натрия. Добавлением ацетата натрия доби-
(8.35 г, 0.05 моль) в 160 мл ДМСО добавляли 1-
вались того, чтобы значение pH полученной мас-
бромгексадекан (15.26 г, 15.3 мл, 0.1 моль) и NaOH
сы составило 4.0. Выделившийся осадок отфиль-
(50 г, 1.25 моль). Реакционную массу перемеши-
тровывали, промывали водой и использовали для
вали 48 ч при комнатной температуре, после чего
дальнейших превращений без дополнительной
выливали в воду со льдом, выпавший осадок от-
очистки. Выход 2.85 г (96%), темно-оранжевое
фильтровывали. Выход 14.3 г (73%), белое аморф-
аморфное вещество, т.пл. 61°С. Спектр ЯМР 1H
ное твердое вещество, т.пл. 56-58°C (57°C [22])
(CDCl3), δ, м.д.: 0.87 т (3H, CH3, J 7.2 Гц), 1.22-
Спектр 1Н ЯМР (CDCl3), δ, м.д.: 0.86 т (3Н, СН3, J
1.37 м (26H, 13CH2), 1.83-1.89 м (2H, NCH2CH2),
6.9 Гц), 1.23-1.40 м (26Н, 13СН2), 1.85-1.90 м (2Н,
4.23-4.32 м (2H, NCH2), 6.78 д (1H, ClCH=CH, J
NCH2CH2), 4.32 т (2Н, CH2N, J 6.9 Гц), 7.14 т (2Н,
7.2 Гц), 7.29 т (1H, Cz, J 8.0 Гц), 7.42 т (1H, Cz,
Cz, J 7.8 Гц), 7.31 д (2Н, Cz, J 8.1 Гц), 7.37 т (2Н,
J 8.6 Гц), 7.50-7.60 м (2H, Cz), 7.85 д (1H, Cz, J
Cz, J 6.9 Гц), 8.01 д (2Н, Cz, J 8.1 Гц). C28H41N.
8.8 Гц), 8.13 д (1H, Cz, J 7.6 Гц), 8.55 c (1H, Cz),
3-Ацетил-9Н-9-гексадецил-9Н-карбазол
(5).
10.25 д (1H, CHO, J 6.8 Гц). Найдено, %: C 77.67; H
Получен по методике
[23]. К раствору
8.78; N 2.79. C31H42ClNO. Вычислено, %: C 77.55;
N-гексадецилкарбазола (3.92 г, 0.01 моль) в аб-
H 8.82; N 2.92. M 480.13.
солютном ДХМ (50 мл) приливали SnCl4 (5.21 г,
2-Ацетил-5-(9-гексадецил-9Н-карбазол-3-
2.34 мл, 0.02 моль) и перемешивали реакционную
смесь в течение 10 мин, затем при постоянном
ил)тиофен (7). Получен по методике, аналогичной
[13]. К раствору Na2S·9H2O (2.14 г, 8.91 ммоль)
перемешивании прикапывали CH3COBr (1.23 г,
в ДМФА (40 мл) добавляли пропеналь 6 (2.85 г,
0.74 мл, 0.01 моль). Реакционную смесь переме-
шивали при комнатной температуре в течение
5.94 ммоль). Реакционную массу перемешивали
при 60°C в течение 3 ч, затем при этой же темпе-
24 ч и выливали в смесь льда и соляной кислоты.
Продукт экстрагировали ДХМ, органические слои
ратуре добавляли водный раствор K2CO3 (0.82 г,
объединяли, промывали водой до pH 7.0, раствори-
5.94 ммоль, в 1 мл воды), после чего перемеши-
тель удаляли. Твердый остаток очищали колоноч-
вание продолжали еще 10 мин при этой же тем-
ной хроматографией на силикагеле (элюент ДМХ-
пературе, охлаждали до комнатной температуры и
гексан, 1:1). Выход 2.76 г (63%), светло-бежевое
выливали в воду. Образовавшийся осадок отфиль-
аморфное вещество, т.пл. 56°С (56-58°С [12]).
тровывали, промывали на фильтре водой и очища-
Спектр ЯМР 1H (CDCl3), δ, м.д.: 0.85 т (3H, CH3, J
ли колоночной хроматографией (элюент - ДХМ).
6.8 Гц), 1.22-1.37 м (26H, 13CH2), 1.83-1.89 м (2H,
Выход 0.84 г (28%), желто-зеленое кристалли-
NCH2CH2), 2.71 с (3H, COCH3), 4.30 т (2H, NCH2,
ческое вещество, т.пл. 96-98°С. Спектр 1H ЯМР
J 7.2 Гц), 7.28 т (1H, Cz, J 8.6 Гц), 7.39 д (2H, Cz,
(CDCl3), δ, м.д.: 0.86 т (3H, CH3, J 6.8 Гц), 1.22-1.37
J 8.6 Гц), 7.42 д (1H, Cz, J 8.2 Гц), 8.10-8.15 м (2H,
м (26H, 13CH2), 1.83-1.89 м (2H, NCH2CH2), 2.57
Cz), 8.73 c (1H, Cz). Найдено, %: C 83.14; H 10.05;
с (3H, COCH3), 4.26-4.31 м (2H, NCH2), 7.26-7.28
N 3.15. C30H43NO. Вычислено, %: C 83.09; H 9.99;
м (1H, Cz), 7.35 д (1H, Th, J 4.0 Гц), 7.40 д (2H, Cz,
N 3.23 M 433.68.
J 8.4 Гц), 7.47 т (1H, Cz, J 8.4 Гц), 7.67 д (1H, Th, J
4.0 Гц), 7.75 д.д (1H, Cz, J 8.4, 1.6 Гц), 8.11 д (1H,
3-(9-Гексадецил-9Н-карбазол-3-ил)-3-хлор-
Cz, J 7.6 Гц), 8.36 c (1H, Cz). Найдено, %: C 79.29;
пропеналь (6). Получен по методике, близкой
H 8.56; N 2.62; S 6.09. C34H45NOS. Вычислено, %:
[13]. POCl3 (3.36 г, 2.05 мл, 22.21 ммоль) медленно
C 79.17; H 8.79; N 2.72; S 6.22. M 515.80.
добавляли к ДМФА (2.16 г, 2.29 мл, 29.62 ммоль)
при 0°С, после чего смесь перемешивали при этой
1,3-Дизамещенные проп-2-ен-1-оны
8,
9
же температуре в течение 1 ч, а затем прикапы-
(общая методика) [24]. К раствору 2-хлорими-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
1724
ЧУХЛАНЦЕВА и др.
дазо[1,2-a]пиридин-3-карбальдегида
(3)
(0.18 г,
спективными для исследования в качестве мате-
0.001 моль) и 3-ацетил-9Н-9-гексадецил-9Н-кар-
риалов для органической электроники. Введение
базола (5) (0.43 г, 0.001 моль) или 2-ацетил-5-(9-
дополнительного донорного тиофенового фраг-
гексадецил-9Н-карбазол-3-ил)тиофена (7) (0.52 г,
мента в структуру халкона приводит к уменьше-
0.001 моль) в 25 мл C2H5OH приливали 25 мл 10%-
нию ширины запрещенной зоны соединения и к
ного раствора KOH в C2H5OH, перемешивали при
значительному увеличению квантового выхода
комнатной температуре 12 ч, затем выливали в
флуоресценции (от 3.4 до 22%).
воду, образовавшийся осадок отфильтровывали,
ФОНДОВАЯ ПОДДЕРЖКА
очищали колоночной хроматографией на силика-
Работа выполнена при финансовой поддержке
геле.
правительства Пермского края.
1-[9-(Гексадецил-9Н-карбазол-3-ил)]-3-(2-
ИНФОРМАЦИЯ ОБ АВТОРАХ
хлоримидазо[1,2-a]пиридин-3-ил)проп-2-ен-
Чухланцева Анна Николаевна, ORCID: http://
1-он (8). Выход 0.37 г (40%), желтое кристалли-
orcid.org/0000-0002-9590-2650
ческое вещество, т.пл. 153°С. Спектр 1H ЯМР
(CDCl3), δ, м.д.: 0.86 т (3H, CH3, J 7.2 Гц), 1.22-
Ермолов Денис Артемович, ORCID: http://
1.37 м (26H, 13CH2), 1.87-1.92 м (2H, NCH2CH2),
orcid.org/0000-0002-7344-1216
4.33 т (2H, NCH2, J 7.2 Гц), 7.06 т (1H, IP, J 6.8 Гц),
Лунегов Игорь Владимирович, ORCID: http://
7.30 т (1H, Cz, J 7.6 Гц), 7.38 т (1H, Cz, J 8.8 Гц),
orcid.org/0000-0002-8204-3084
7.42-7.52 м (2H, CH=CHCO, 1H, IP), 7.64 д (1H,
Мокрушин Иван Геннадьевич, ORCID: http://
Cz, J 8.8 Гц), 8.12 д (2H, Cz, J 6.8 Гц), 8.18 т (1H,
orcid.org/0000-0002-4095-8366
IP, J 7.6 Гц), 8.24 д (1H, Cz, J 8.0 Гц), 8.40 д (1H, IP,
Шкляева Елена Викторовна, ORCID: http://
J 6.8 Гц), 8.86 c (1H, Cz). Найдено, %: C 76.67; H
orcid.org/0000-0002-3440-7402
7.66; N 6.89. C38H46ClN3O. Вычислено, %: C 76.55;
H 7.78; N 7.05. M 596.26.
Абашев Георгий Георгиевич, ORCID: http://
orcid.org/0000-0002-2910-8547
1-{5-[9-(Гексадецил-9H-карбазол-3-ил)тио-
фен-2-ил]}-3-(2-хлоримидазо[1,2-a]пиридин-3-
КОНФЛИКТ ИНТЕРЕСОВ
ил)проп-2-ен-1-он (9). Выход 0.23 г (21%), оран-
Авторы заявляют об отсутствии конфликта ин-
жевое аморфное вещество, т.пл. 167°С. Спектр 1H
тересов.
ЯМР (CDCl3), δ, м.д.: 0.86 т (3H, CH3, J 7.2 Гц),
СПИСОК ЛИТЕРАТУРЫ
1.22-1.36 м
(26H,
13CH2),
1.63-1.68 м
(2H,
1. Moraski G.C., Markley L.D., Cramer J., Hipskind P.A.,
NCH2CH2), 4.20 т (2H, NCH2, J 5.6 Гц), 7.06 т (1H,
Boshoff H., Bailey M.A., Alling T., Ollinger J., Pa-
IP, J 6.8 Гц), 7.40-7.44 м (2H, IP), 7.44 д (1H, Th,
rish T., Miller M.J. Bioorg. Med. Chem. 2012, 7, 2214-
J 4.4 Гц), 7.42-7.51 м (2H, Cz), 7.63 д (1H, Cz, J
2220. doi 10.1021/ml400088y
8.8 Гц), 7.69-7.70 м (2H, Cz), 7.80 д.д (1H, Cz, J 8.8,
2. Cecile E., Gueiffier A. Mini-Rev. Med. Chem. 2007, 7,
2.0 Гц), 7.82 д (1H, CH=CHCO, J 14.4 Гц), 7.88 д
888-899. doi 10.2174/138955707781662645
(1H, Th, J 4.0 Гц), 8.05 д (1H, CH=CHCO, J 15.5 Гц),
3. Trapani G. J. Med. Chem. 1999, 42, 3934-3941. doi
8.40 д (1H, IP, J 6.8 Гц), 8.86 c (1H, Cz). Найдено,
10.1021/jm991035g
%: C 74.48; H 7.09; N 6.02; S 4.55. C42H48ClN3OS.
4. Firmansyah D., Banasiewicz M., Deperasinska I.,
Вычислено, %: C 74.36; H 7.13; N 6.19; S 4.73. M
Makarewicz A., Kozankiewicz B., Gruko D.T. Chem.
678.38.
Asian J.
2014,
9,
2483-2493. doi
10.1002/
asia.201402201
ВЫВОДЫ
5. Wan J., Zheng C.-J., Fung M.-K, Liu X.-K., Lee C.-S,
Получен ряд новых халконов, содержащих
Zhang X.-H. J. Mater. Chem. 2012, 22, 4502-4510. doi
2-хлоримидазо[1,2-а]пиридиновый фрагмент. По
10.1039/c2jm14904d
данным спектров поглощения установлено, что
6. Tashrifi Z., Mohammadi-Khanaposhtani M., Larija-
синтезированные халконы обладают значениями
ni, B., Mahdavi M. Eur. J. Org. Chem. 2020, 3, 269-
Egopt, равными 2.61 и 2.41 эВ, что делает их пер-
284. doi 10.1002/ejoc.201901491
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА НОВЫХ ХАЛКОНОВ
1725
7.
Yamaguchi Y., Matsubara Y., Ochi T., Wakamiya T.,
shev G.G. Chem. Heterocycl. Compd. 2016, 52, 379-
Yoshida Z.-I. J. Am. Chem. Soc. 2008, 130, 13867-
387. doi 10.1007/s10593-016-1899-2
13869. doi 10.1021/ja8040493
17.
Selivanova D.G., Gorbunov A.A., Mayorova O.A.,
8.
Pan Y.Y., Huang J., Wang Z.M., Yu D.W., Yang B.,
Vasyanin A.N., Lunegov I.V., Shklyaeva E.V., Aba-
Ma Y.G. RSC Adv. 2017, 7, 26697-26703. doi 10.1039/
shev G.G. Beilstein J. Org. Chem. 2017, 13, 1583-
c7ra02559a
1595. doi 10.3762/bjoc.13.158
9.
Антуфьева А.Д., Ахматзянова Д.Р., Дмитриев М.В.,
18.
Bazin M.-A., Marhadour S., Tonnerre A., Marchand P.
Шкляева Е.В., Абашев Г.Г. ЖОХ.
2018,
88,
Tetrahedron Lett. 2013, 54, 5378-5382. doi 10.1016/
922-926.
[Antuf’eva A.D., Akhmatzyanova D.R.,
j.tetlet.2013.07.113
Dmitriev M.V., Shklyaeva E.V., Abashev G.G. Russ.
19.
Kumar S., Sharma N., Maurya I.K., Bhasin A.K.K.,
J. Gen. Chem. 2018, 88, 1103-1107.] doi 10.1134/
Wangoo N., Brandão P., Sharma R.K. Eur. J.
s1070363218060099
Med. Chem.
2016,
123,
916-924.] doi
10.1016/
10.
Ахматзянова Д.Р., Антуфьева А.Д., Шкляева Е.В.,
j.ejmech.2016.07.076
Абашев Г.Г. Вестн. перм. унив. хим. 2016, 4, 61-71.
20.
Deane F.M., Miller C.M., Maguire A.R., McCar-
[Akhmatzyanova D.R., Antuf’eva A.D., Shklyae-
va E.V., Abashev G.G. Vestn. Perm. Univ. Khim. 2016,
thy F.O. J. Heterocycl. Chem. 2011, 48, 814-823. doi
4, 61-71.] doi 10.17072/2223-1838-2016-61-71
10.1002/jhet.598
11.
Maxwel B.D., Boye O.G., Ohta, K. J. Label. Compd.
21.
Бакиев А.Н., Шкляева Е.В., Лунегов И.В., Мокру-
Radiopharm. 2005, 48, 397-406. doi 10.1002/jlcr.934
шин И.Г., Абашев Г.Г. ЖОХ. 2014, 84, 1117-1123.
[Bakiev A.N., Shklyaeva E.V., Lunegov I.V., Mokru-
12.
Qian C., Cao K., Liu X., Zhang X., Xu D., Xue P.,
Lu R. Chin. Sci. Bull. 2012, 57, 4264-4271. doi
shin I.G., Abashev G.G. Russ. J. Gen. Chem. 2014, 84,
1313-1319.] doi 10.1134/S1070363214070111
10.1007/s11434-012-5454-y
13.
Su W., Weng Y., Jiang L., Yang Y., Zhao L., Chen Z.,
22.
Przypis L., Walczak K.Z. J. Org. Chem. 2019, 84,
Li Z., J. Li. New J. Org. Synth. 2010, 42, 503-555. doi
2287-2296. doi 10.1021/acs.joc.8b02821
10.1080/00304948.2010.513911
23.
Решетова М.Д., Борисова Н.Е. Вестн. МГУ, сер. 2.
14.
Meng H., Zheng J., Lovinger A. J., Wang B.-C., Van
Хим. 1999. 40, 43-46. [Reshetova M.D., Borisov N.E.
Patten P.G., Bao Z. Chem. Mater. 2003, 15, 1778-1787.
Vestn. MGU, Ser. Khim. 1999, 40, 43-46.]
doi 10.1021/cm020866z
24.
Сюткин Р.В., Абашев Г.Г., Шкляева Е.В., Кудряв-
15.
Fery-Forgues S., Lavabre D. J. Chem. Educ. 1999, 76,
цев П.Г. ЖОрХ. 2011, 47, 532-538. [Syutkin R.V.,
1260-1264. doi 10.1021/ed076p1260
Abashev G.G., Shklyaeva E.V., Kudryavtsev P.G.
16.
Bakiev A.N., Selivanova D.G., Lunegov I.V., Vasya-
Russ. J. Org. Chem. 2011, 47, 530-536.] doi 10.1134/
nin A.N., Maiorova O.A., Gorbunov A.A., Aba-
S1070428011040117
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
1726
ЧУХЛАНЦЕВА и др.
Synthesis and Physiochemical Properties of New Chalcones
Containing 2-Chlorimidazo[1,2-a]pyridine Fragment
A. N. Chukhlantsevaa, b, D. A. Ermolovb, I. V. Lunegovb, I. G. Mokrushinb,
E. V. Shklyaevab, and G. G. Abasheva, b, *
a Department of Technical Chemistry of the Ural Branch of the Russian Academy of Sciences,
ul. Akademika Koroleva, 3, Perm, 614013 Russia
b Perm State National Research University, ul. Bukireva, 15, Perm, 614900 Russia
*e-mail: gabashev@psu.ru
Received June 4, 2021; revised June 16, 2021; accepted June 18, 2021
New chalcones containing a 2-chloroimidazo[1,2-a]pyridine (1-azaindolizine) fragment were synthesized. Their
optical properties were studied; the Stokes shifts and optical band gap values were calculated on the basis of
the UV-vis absorption and emission spectral data; the molar absorption coefficients and fluorescence quan-
tum yields were estimated. Incorporation of an additional thiophene fragment into the structure of a chalcone
molecule has resulted in the reduction of a bandgap value, enlargement of a Stokes shift value, red shift of the
emission band and in a sharp rise of the fluorescence quantum yield up to 22%. The obtained chalcones were
found to be thermally stable and to have good film-forming properties. The well-ordered structure is inherent
to the prepared films.
Keywords: 2-chlorimidazo[1,2-a]pyridine, 1-azaindalizine, chalcone, carbazole, band gap, π-conjugated com-
pounds, chromophores
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021