ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 12, с. 1766-1771
УДК 547.822. 7’551.547,7/8
СИНТЕЗ И СВОЙСТВА АРИЛУРЕТАН-
И АРИЛТИОУРЕТАНПРОИЗВОДНЫХ СЕРО-
И АЗОТСОДЕРЖАЩИХ АМИНОАЛКАНОЛОВ
© 2021 г. К. О. Искендерова*
Азербайджанский государственный педагогический университет,
Азербайджан, 1143 Баку, просп. Г. Джавида, 113
*e-mail: iradam@rambler.ru
Поступила в редакцию 16.04.2021 г.
После доработки 25.04.2021 г.
Принята к публикации 27.04.2021 г.
В результате систематических исследований впервые были синтезированы производные арилуренатов
и арилтиоуретанов взаимодейтсивем морфолин- и пиперидинсодержащих алкилтиопропанолов, а также
арилоксизамещенных пентилтиопропанолов. С использованием современных методов физико-химиче-
ского анализа определены их структуры, состав и свойства. Синтезированные вещества могут исполь-
зоваться в качестве антикоррозионной и антимикробной присадки для масла «М-11».
Ключевые слова: синтез, серо- и азотсодержащие аминоалканолы, морфолин, пиперидин, арилуретаны
и арилтиоуретаны, антикоррозионные и антимикробные свойства
DOI: 10.31857/S0514749221120120
ВВЕДЕНИЕ
Одним из современных направлений органиче-
ской химии является синтез разнообразных био-
Большинство органических соединений, на-
логически активных соединений и расширение их
шедшее широкое применение в различных обла-
спектра действия.
стях промышленности - серо- и азотсодержащие
Основное количество этих органических со-
органические соединения. Спрос на серо- и азот-
единений нашло широкое применение в промыш-
содержащие органические соединения, применяе-
ленности в качестве ингибитиров коррозии метал-
мые в различных отраслях экономики в последные
лов, присадок к минеральным маслам, лекарствен-
годы, дал толчок к развитию нового направления
ных препаратов, пестицидов, пластических мате-
в синтетической органичеслой химии, многофунк-
риалов. По мере того, как жизнь продолжается и
циональных серо- и азотсодержащих соединений.
ужасточаются трубования к охране окружающей
Особое внимание было уделено приобретению
среды потребность в синтезе новых соединений с
новых представителей этих органических со-
новыми, более полезными свойствами возрастает
единений, входящих в состав полусинтетических
и многие соединения, которые успешно приме-
антибиотиков, антисептиков, противомикробных
нялись, снимаются с производства и заменяются
препаратов. Одной из наиболее важных проблем
новыми. Примерами органических соединений,
современной химмотологии является защита мо-
содержащих атомы азота и серы, являются произ-
торных масел, топлива и других нефтепродуктов
водные уретана и тиоуретана [3, 4].
от окисления и микробиологического разложения
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
во время длительного хранения или эксплуатации,
что осушествляется на высоком уровне с помо-
Цель настоящей работы - синтез сера- и азотсо-
щью серо- и азотсодержащими соединений [1, 2].
держащих аминоалканолов и синтез на их основе
1766
СИНТЕЗ И СВОЙСТВА АРИЛУРЕТАН- И АРИЛТИОУРЕТАНПРОИЗВОДНЫХ
1767
Схема 1
O
O
R'
N
N
+
N C O
RS
H
R'
RS
O N
OH
O
1-4
5-9
10-29
R = C2H5 (1, 10-14), н-C3H7 (2, 15-19), н-C4H9 (3, 20-24), н-C5H11 (4, 25-29);
R' = H (5, 10, 14, 18, 25), о-CH3 (6, 11, 16, 21, 26), м-CH3 (7, 12, 18, 22, 27),
п-CH3 (8, 13, 19, 23, 28), п-Cl (9, 14, 20, 24, 29).
новых функционально замещенных производных
Синтезированные
1-алкилтио-3-(N-морфоли-
арилуретанов и арилтиоуретанов.
но)-2-N-арилуретаноилоксипропаны 10-29 белые,
Для получения новых представителей этих со-
кристаллические соединения с характерным запа-
хом, растворимые в ацетоне, хлороформе, бензоле,
единений осушествлены реакции 1-(N-морфоли-
но не растворимые в воде.
но)-3-алкилтио-2-пропанола с ароматическими
изоцианатами 5-9 и синтезированы производные
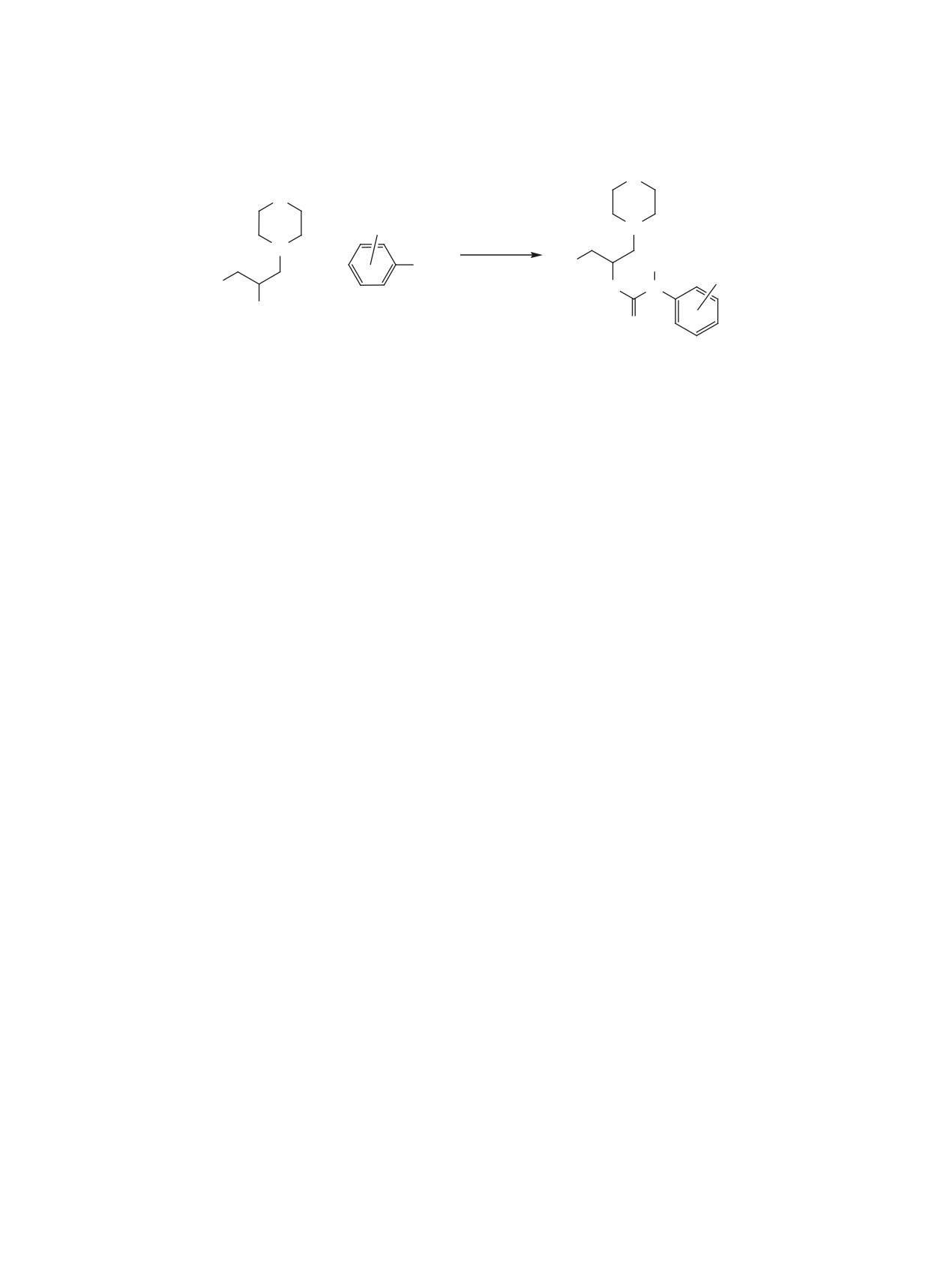
Структура и состав синтезированных веществ
1-алкилтио-3-(N-морфолино)-2-N-арилуретаноил-
10-29 были установлены методами элементного
оксипропанов 10-29 (схема 1).
анализа, ИК-, 13C , 1H ЯМР спектроскопии, а их
Взаимодействие 1-(N-морфолино)-3-алкилтио-
чистота контролировалась с помощью тонкослой-
2-пропанола 1-4 с арилизоцианатами 5-9 про-
ной хроматаграфии (см. рисунок).
водят в сухой бензольной среде при температуре
В ИК спектрах 1-алкилтио-3-(N-морфолино)-
75-80°С в течение 8-10 ч при стехиометрическом
2-арилуретаноилоксипропанов 10-29 полосы по-
соотношении компонентов. Можно предположить
глощения в области 3430-3470 см-1, характерные
что, при взаимодействии изоцианатов со спиртами
для гидроксильной группы (νOH) (первичные со-
эти два процесса протекают одновременно. Таким
единения 1-4), не проявляется. В ИК спектре про-
образом, сначала свободные электроны кислорода
являются полосы интенсивного калебания в обла-
в спирте направляются к углероду в изоцианате и
сти 1710-1730 см-1 характерные для групп карбо-
в то же время электроны в атоме азота в молекуле
нилуретана (νOCONH) и валентные колебания при
изоцианата направляются к атому водорода в ги-
3270-3310 см-1, соответствующие колебаниям νNH
дроксильной группе. Можно предположить, что
группы.
механизм образования уретанов, основанный на
взаимодействии изоцианатов и спиртов основан на
Строение синтезированных соединений 10-29
разрыве двойной связи между атомами углерода и
установлено данными спектров ЯМР 1H. Триплет
азота и образовании новых связей N-Н и С-О.
в области 0.9 м.д. соответствует сигналам прото-
10
9
8
7
6
5
4
3
2
1
0
м.д.
Спектр ЯМР 1H 1-алкилтио-3-(N-морфолино)-2-N-aрилуретаноилоксипропана
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
1768
ИСКЕНДЕРОВА
Схема 2
O
O
R'
N
(C2H5)3N
N
+
NCS
RS
H
R'
RS
O N
OH
S
1-4
30-31
32-39
R = C2H5 (1, 32, 33), н-C3H7 (2, 34, 35), н-C4H9 (3, 36, 37), н-C5H11 (4, 38, 39);
R' = H (30, 32, 34, 36, 38), о-CH3 (31, 33, 35, 37, 39).
нов CH3 группы. Мультиплеты в областях 2.6-
анатами происходит в присутствии триэтиламина
2.8 м.д. соответствуют сигналам протонов групп
в сухой бензольной среде.
SCH2, OCH2, NCH2. Пентет в области 3.7 м.д. со-
Сравнительные исследования отдельных об-
ответствует сигналам протонов - OCH - группы.
разцов синтезированных соединений с использу-
Неэквивалентные протоны ароматического коль-
емым в настоящее время на практике ИНХП-21
ца дают сигнал в виде двух синглетов в области
подтвердили их высокие антикоррозионные и ан-
6.8-7.1 м.д.
тимикробные свойства. Установлено, что антикор-
Расположенные в ароматическом ядре о-, м-,
розионные свойства исследованных 1-алкилтио-
п-CH3-группы дают сигналы в виде синглетов в
3-(N-морфолино)-2-N-арилуретанов и арилтиоу-
области 2.2-2.4 м.д.
ретанов находятся приблизительно на одинаковом
уровне с ИНХП-21.
Структура синтезированных
1-алкилтио-3-
(N-морфолино)-2-N-арилуретаноилокси-пропанов
В результате проведенных исследований уста-
новлено, что синтезированные и исследованные
также подтверждена методом 13C ЯМР.
соединения могут быть использованы в качестве
В самом слабом поле по плотности атомы угле-
антикоррозионной и антимикробной присадки для
рода метильной, метиленовой и метиновой груп-
масла «М-11».
пы проявляют сигналы в областях 14.7, 25.8, 39.1,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
74.7 м.д.
Спектры ЯМР полученных соединений реги-
Сигналы по плотности атомов углерода аро-
стрировали на спектрофотометре «Bruker-250»,
матического кольца в поле соответствуют 114.6 и
ИК спектры - на спектрометре «Nicolet IS-10».
130.7 м.д.
Элементный анализ проводился на анализаторе
Среди производных тиоуретанов много соеди-
«Euro EA3028 HT».
нений, обладающих инсектицидными, фунгицид-
Синтез
1-алкилтио-3-(N-морфолино)-2-N-
ными, гербицидными свойствами. В некоторых
арилтиоуретаноилоксипропанов
10-29 про-
классах соединений содержатся противомикроб-
водят при 80-85°С в течение 8-10 ч в равных
ные и антисептические вещества.
мольных соотношениях исходных компонентов.
Исходя из вышесказанного осуществлена реак-
Синтезированные соединения представляют со-
ция
1-(N-морфолино)-3-алкилтио-2-пропанола с
бой кристаллы желтовотого цвета, имеют специ-
арилизотиоцианатами и синтезированы производ-
фический запах, хорошо растворимы в органиче-
ные
1-алкилтио-3-(N-морфолино)-2-N-арилтио-
ских растворителях (ацетон, хлороформ, бензол
уретаноилоксипропанов (схема 2).
и др.).
Установлено, что взаимодействие
1-(N-мор-
Строение синтезированных веществ изучены с
фолино)-3-алкилтио-2-пропанола с арилизотиоци-
использованием данных ИК и 1H ЯМР спектров.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
СИНТЕЗ И СВОЙСТВА АРИЛУРЕТАН- И АРИЛТИОУРЕТАНПРОИЗВОДНЫХ
1769
В спектрах соединений отсутствует полосы по-
(5 мм рт.ст.), nD20 1.4984, d420 0950. ИК спектр, ν,
глащения в области 3500-3900 и 1990-2140 см-1
см-1: 2900 (CH3), 2860 (CH2), 3470, 1130 (OH),
характерные для гидроксильных групп и изоциа-
735 (C-S). Спектр ЯМР 1H, δ, м.д.: 1.35 т (3H,
натной группы.
SCH2CH3, J 6.8 Гц), 2.60-2.80 м (14H, 2SCH2,
3CH2N, 2CH2O), 3.20 т (1H, OCH, J 6.4 Гц), 4.85
В ИК спектрах синтезированных фенилзаме-
с (1H, OH). Найдено,%: C 52.41; H 9.10; N 6.65; S
щенных тиоуретанов наблюдаются валентные ко-
15.37. C9H19NSO2. Вычислено. %: C 52.68; H 9.27;
лебания в области 3240-3290 см-1, характеризую-
N 6.83; S 15.61.
щие наличие N-H связи. Валентные колебания в
области 1540-1560 см-1 соответствуют фрагмен-
1-Пропилтио-3-(N-морфолино)-пропан-2-
ту - NHCS, полосы поглощения при 730-735 и
ол (2). а Реакция взаимодействия 1-пропилтио-
1220-1240 см-1 соотнесены валентным колебани-
3-хлорпропан-2-ола и морфолина. 1-Пропилтио-
ям С-S связи.
3-(N-морфолино)-пропан-2-ол (2) получают при
Строение синтезированных соединений 10-29
взаимодействии 17.4 г (0.2 моль) морфолина и
подтверждены спектрами ЯМР 1H. Триплет в об-
16.85 г (0.1 моль) 1-пропилтио-3-хлорпропана-2.
ласти 0.9-1.25 м.д. соответствует сигналам СН3-
Выход 19.7 г (90%), т.кип 113-114°C (1 мм рт.ст.),
группы. Мультиплеты в областях 2.56-2.81 м.д. со-
nD20 1.4943, d420 1.0439. ИК спектр, ν, см-1: 2920
ответствуют сигналам СН2-группы. Мультиплеты
(CH3), 2880 (CH2), 3470, 1130 (OH), 730 (C-S).
в области 7.0 м.д. соответствуют сигналам про-
Спектр ЯМР 1H, δ, м.д.: 0.92 т (3H, J 7.8 Гц), 1.40-
тонов, находящихся в мета- и пара-положениях
1.62 м (2H, CH2), 2.30-2.48 м (4H, H2C-S-CH2),
ароматического кольца. Мультиплеты в области
2.60-2.82 (10H, 3NCH2, 2OCH2), 3.72-3.98 м (1H,
CH), 4.80 с (1H, OH). Найдено, %: C 54.53; H 9.14;
7.34 м.д. соответствуют сигналам протонов аро-
матического кольца в орто-положении. Синглеты
N 6.07; S 14.42. C10H21NSO2. Вычислено, %: C
54.79; H 9.59; N 6.39; S 14.61.
в области 2.12-2.40 м.д. соответствуют сигна-
лам СН3-группы находящейся в орто-, мета- и
б. Реакция взаимодействия морфолина с 3-про-
пара-положениях бензольного кольца.
пилтиолом, 2-эпоксипропаном, 1-пропилтио-3-(N-
Синтез
1-алкилтио-3-(N-морфолино)-про-
морфолино)-пропан-2-олом (2). Помещают 13.2 г
пан-2-олов
1-4.
1-Алкилтио-3-(N-морфолино)-
(0.1 моль) 3-пропилтио-1,2-эпоксипропана, 43 г
пропан-2-олы 1-4 синтезировали по следующей
(0.15 моль) морфолина и 50 мл воды в трехгор-
общей методике [5-11]. Для получения этих ве-
лую реакционную колбу и интенсивно переме-
ществ были впервые синтезированы алкилтио-
шивают. В это время температура реакционной
3-хлорпропан-2-олы известными методами. В ре-
смеси повышается до 40°C. Затем смесь переме-
акционную колбу помещают 0.2 моль морфолина,
шивают при 65-70°C в течение 3 ч. Смесь охлаж-
30 мл толуола и через капельную воронку добав-
дают и экстрагируют при использовании 30 мл
ляют
0.1 моль соответствующего
1-алкилтио-
эфира. Органический слой отделяют и сушат над
3-хлорпропан-2-ола при температуре 115-120°С.
Na2SO4. После удаления эфира остаток разделяют
Затем смесь перемешивают при той же темпера-
на фракции под вакуумом. Получают 18.6 г (85%)
туре в течение 5 ч. Реакционную колбу охлаждают
вещества при температуре кипения 113-114°C
до комнатной температуры, добавляют 50-150 мл
(1 мм рт.ст.). Все физико-химические параметры
5%-го раствора Na2CO3. В сепараторе органиче-
веществ полученные методами а и б совпадают с
ский слой отделяют от водного слоя и промывают
полученным методом а.
водой в качестве нейтральной среды, сушат над
1-Бутилтио-3-(N-морфолино)-пропан-2-ол
безводным MgSO4. Остаток после удаления толуо-
(3). Вводится 9.13 г (0.05 моль) 1-бутилтио-3-
ла перегоняется в вакууме.
хлор-2-пропанола по каплям в колбу, содержа-
1-Этилтио-3-(N-морфолино)-пропан-2-ол (1)
щую 8.7 г (0.1 моль) морфолина, при интенсив-
получают при взаимодействии 17.4 г (0.2 моль)
ном перемешивании при 115-120°C. Затем смесь
морфолина и 15.45 г (0.1 моль) 1-этилтио-3-хлор-
нагревают при той же температуре в течение 3-
пропана-2. Выход 18 г (87.8%), т.кип. 105-106°C
4 ч. Затем реакционную смесь охлаждают до
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
1770
ИСКЕНДЕРОВА
комнатной температуры. Хлороводородную соль
СПИСОК ЛИТЕРАТУРЫ
морфолина отделяют от реакционной смеси филь-
1.
Гасанов В.С., Курбанова В.А., Бабаева Г.В., Дия-
трованием и промывают осушенным эфиром.
рова М.Р., Рагимов Б.Б., Искендерова К.О. ЖОрХ.
Непрореагировавший
1-бутилтио-3-хлор-2-про-
2000, 36, 1807-1809. [Gasanov V.S., Kurbanova V.A.,
панол сначала перегоняют в вакууме. Затем ос-
Babayeva Q.V., Diyarova M.R., Ragimov B.B.,
новной продукт реакции возгоняется в вакууме.
Iskenderova K.O. Zh. Org. Khim. 2000, 36, 1807-
Основная фракция кипит - 122-123°С (1 мм рт.ст.).
1809.]
Выход 19.2 г (82.4%), nD20 1.4912, d420 1.0238.
2.
Чумаков Ю.И., Медников А.И., Вирник Р.И. А.С.
ИК спектр, ν, см-1: 3450 (OH), 2910 (CH3), 2850
№ 118584 СССР, 1959. [Chumakov Yu.I., Medni-
(CH2), 1135 (OH), 1050 (C-N), 735 (C-S). Спектр
kov A.I., Virnik R.I. C.A. no. 118584, SSSR, 1959]
ЯМР 1H, δ, м.д.: 0.90 т (3H, J 6.2 Гц), 1.46-1.50 м
3.
Гасанов В.С., Махмудова А.А., Бабаева Г.В., Искен-
(4Н, СН2СН2), 2.53 д.д (4H, CH2SCH2, J 11.2 Гц),
дерова К.О., Кахраманова С.Н. Изв. Вузов, Сер.
3.73-3.78 м (1H, CH), 3.58 с (1H, OH), 2.63, 2.38 д.д
Хим. и хим. технол. 2014, 57, 32-35. [Gasanov V.S.,
(2H, CH2-N, J 7.2 Гц), 2.67, 2.67 д.д (4H, CH2-N-
Makhmudova A.A., Babaeva G.V., Iskenderova K.O.,
CH2, J 7.4 Гц), 3.65, 3.65 д.д (4H, CH2-O-CH2, J
Kakhramanova S.N. Izv. Vuzov, Khim. Khim Tekhnol.
2014, 57, 32-35.]
7.6 Гц). Найдено,%: C 56.23; H 9.65; N 5.87; S
13.52. C11H23NSO2. Вычислено,%: C 56.65; H 9.87;
4.
Мамедбейли E.H., Джафаров И.А., Kaзымова Т.Г.,
N 6.00; S 13.73.
Мирзоева Т.Г., Искендерова К.О. ЖПХ.
2013,
86, 1208-1213. [Mamedbeyli E.G., Dzhafarov I.A.,
ВЫВОДЫ
Kazimova T.G., Mirzoeva M.A., Iskenderova K.O.
Синтезированы серо- и азотсодержащие амино-
J. Appl. Chem. 2013, 86, 1184-1189.] doi 10.1134/
S1070427213080065
алканы, которые были получены взаимодействием
1-хлор-3-алкилтио-2-пропанолов с вторичными
5.
Виноградова И.Е. Противоизносрые присадки к
гетероциклическими аминами: пиперидином и
маслам. М.: Химия. 1972, 120. [Vinogradova İ.T.
Antiwear Additives to Oils. M: Khimya, 1972, 120 (in
морфолином.
Russian).]
В результате систематических исследова-
6.
Kuliyev A.M. Chemistry and Technology of Additivts
ний впервые были синтезированы 1-алкилтио-
to Oils and Fuels. M.: Khimya 1985, 45 (in Russian).
3-(N-морфолино)-2-N-арил-уретаноилоксипропа-
7.
Гасанов В.С., Аллекперов Р.К. ЖОрХ. 1983, 19,
ны и 1-алкилтио-3-(N-морфолино)-2-N-арилтио-
1203-1208. [Gasanov V.S., Alekperov R.K. Zh. Org.
уретаноил-оксипропаны при взаимодействии
Khim. 1983, 19, 1203-1208.]
1-(N-морфолино)-3-алкилтио-2-пропанола
1-4 с
8.
Buckler J.N., Meek T., Banwell M.G., Carr P.D.
арилизоцианатами и арилтиоизоцианатами в при-
Nat.Prod.
2017,
80,
2088-2094. doi
10.1021/
сутствии триэтиламина.
acs.jnatprod.7b00303
Изучены структуры, определены состав и свой-
9.
Thongbai B., Surup F., Mohr K., Kuhnert E.,
ства синтезированных соединений, которые могут
Hyde K.D., Stadler M. J. Nat. Prod. 2013, 76, 2141-
быть использованы в качестве антикоррозионной
2144. doi 10.1021/np400609f
и антимикробной присадки для масла «М-11».
10.
Поткин В.И., Петкевич С.К., Курман П.В., Левков-
ская Г.Г., Ивашкевич Л.С., Ляхов А.С. ХГС. 2014,
ИНФОРМАЦИЯ ОБ АВТОРАХ
50, 1624-1631. [Potkin V.I., Petkevich S.K., Kur-
Искендерова Камала Осман Кызы, ORCID:
man P.V., Levkovskaya G.G., Ivashkevich L.S.,
Lyakhov A.S. Chem. Heterocycl. Compd. 2014, 50,
1495-1502.] doi 10.1007/s10593-014-1614-0
КОНФЛИКТ ИНТЕРЕСОВ
11.
Ma X., Yan Q., Banwell M.G., Ward J.S.
Авторы заявляют об отсутствиии конфликта
Org. Lett.
2018,
20,
142-145. doi
10.1021/
интересов.
acs.orglett.7b03495
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021
СИНТЕЗ И СВОЙСТВА АРИЛУРЕТАН- И АРИЛТИОУРЕТАНПРОИЗВОДНЫХ
1771
Synthesis and Properties of Arylurethane
and Arylthiourethane Derivatives of Sulfur-
and Nitrogen-Containing Aminoalkanols
K. O. Iskenderova*
Azerbaijan State Pedagogical University, Baku, prosp. H. Javida, 113, Azerbaijan, 1143 Baku
*e-mail: iradam@rambler.ru
Received April 16, 2021; revised April 25, 2021; accepted April 27, 2021
As a result of systematic studies, derivatives of arylurenates and arylthiourethanes were synthesized for the first
time with the interaction of morpholine- and piperidine-containing alkylthiopropanols, as well as aryloxy-sub-
stituted pentylthiopropanols. Using modern methods of physicochemical analysis, their structures, composition
and properties have been determined. The synthesized substances can be used as anticorrosive and antimicrobial
additives for the «M-11» oil.
Keywords: synthesis, sulfur- and nitrogen-containing aminoalkanols, morpholine, piperidine, arylurethanes
and arylthiourethanes
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 12 2021