ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 2, с. 219-229
УДК 547-4
СИНТЕЗ ПРОИЗВОДНЫХ ДИАМАНТАНА
В АЗОТНОКИСЛЫХ СРЕДАХ
© 2021 г. Ю. Н. Климочкин, Е. А. Ивлева*, М. С. Заборская
ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
*e-mail: ivleva.ea@samgtu.ru
Поступила в редакцию 18.11.2020 г.
После доработки 29.11.2020 г.
Принята к публикации 30.11.2020 г.
Реакцией диамантана c азотной кислотой или смесью HNO3-AcOH и последующим добавлением азот-
содержащих нуклеофилов синтезирован ряд его 1-моно- и 1,4-дифункциональных производных. 1-Ме-
тилтиокарбониламинодиамантан получен из 1-диамантанола и метилтиоцианата в среде серной кислоты.
Ключевые слова: диамантоиды, диамантан, дымящая азотная кислота, азотнокислые среды, азотсодер-
жащие нуклеофилы, функционализация
DOI: 10.31857/S0514749221020087
ВВЕДЕНИЕ
ном выделении диамантоидов из нефти [6-8].
Функциональные производные диамантоидов на-
Диамантоиды - каркасные углеводороды, со-
шли свое применение в качестве субстратов при
держащие конденсированные адамантановые
получении полимерных композиционных мате-
фрагменты с различным пространственным соч-
риалов, в супрамолекулярной химии для молеку-
ленением (рис. 1). Их структура напоминает кри-
лярного распознавания «гость-хозяин», для фор-
сталлическую решетку алмаза, что определяет
мирования самоорганизующихся монослоев на
исключительные физические и химические свой-
поверхности благородных металлов и т.д. [3, 9].
ства: высокую термическую и термоокислитель-
За счет наноразмерной структуры (0.5-2 нм) диа-
ную стабильность, гидрофобность, конформа-
мантоиды вносят существенный вклад в развитие
ционную жесткость, устойчивость к окислению
нанотехнологий [4].
и облучению [1-5]. До недавнего времени эти
соединения являлись малодоступными, однако в
Среди представителей класса диамантоидов
2003 году были опубликованы работы об успеш-
наиболее изученным является адамантан, произ-
4
13
3
5
12
11
2
7
6
1
10
8
14
9
адамантан диамантан
триамантан
[121]тетрамантан
[123]тетрамантан
[1(2,3)4]пентамантан
низшие диамантоиды
высшие диамантоиды
Примеры диамантоидов
219
220
КЛИМОЧКИН и др.
водные которого успешно используются как в ме-
вращения его производных в структурные блоки
дицине, так и в других областях [10-12]. Не менее
для синтеза веществ и материалов с комплексом
интересным объектом исследования представляет-
ценных свойств для широкого спектра примене-
ся следующий член ряда - диамантан, на основе
ния: от биомедицины до нанотехнологий. Поэтому
функциональных производных которого получены
актуальной является задача поиска эффективного
смазки для биоматериалов, обладающие хороши-
метода направленной функционализации диаман-
ми трибологическими характеристиками [13], со-
тана, позволяющая за одну синтетическую опе-
единения с биологической активностью [14, 15],
рацию получить целевую молекулу. Решением
жидкокристаллические материалы [16], металлор-
представляется использование дымящей азотной
ганические каркасы [17]. Производные диаманта-
кислоты в качестве реакционной среды, хоро-
на также нашли свое применение в качестве струк-
шо зарекомендовавшей себя в синтезе широкого
турных субъединиц в создании наноматериалов
ряда функциональных производных адамантана
[18-22], в супрамолекулярной химии [23-25].
[41-49].
Функционализация диамантоидов, в частности
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
диамантана, отличается невысокой селективно-
Молекула диамантана (1) несколько более на-
стью и сопровождается образованием изомерных
пряжена по сравнению с адамантаном и содержит
продуктов, что связано с наличием в структуре
два типа предмостиковых атомов углерода - меди-
двух типов предмостиковых атомов углерода [3].
альные (С1,2,6,7,11,12) и апикальные (С4,9) (рис. 1).
Синтез галоген- и гидроксипроизводных диаман-
Реакционная способность апикальных положений
тана осуществляется с использованием электро-
заметно ниже [50], что может быть помимо ста-
филов и окислителей и может протекать по ион-
тистических причин объяснено индукционным
ному [26, 27] или радикальному механизмам [28].
эффектом, незначительным уплощением конфи-
Имеются сведения о синтезе ацетиламинопроиз-
гурации медиальным атомов углерода и наличием
водных диамантана в системах CH3CN/CBrCl3/
1,3-несвязанных взаимодействий, обусловленных
Mo(CO)6 [29], CH3CN/CBr4/H2O/FeHY-mmm [30]
геометрией каркаса. Относительная скорость ре-
и Br2/CH3CN/CH2Cl2 [31]. С использованием си-
акции диамантана (1) с дымящей азотной кисло-
стемы NHPI/CAN/TsCN/Li2CO3 в дихлорэтане
той оказалась более высокой [51], чем ожидалось
проводят введение цианогруппы в молекулу диа-
из данных по скоростям сольволиза и расчетов
мантана и 4-метоксикарбонилдиамантана с обра-
методом силового поля [50]. Нитроксилирование
зованием смесей изомерных цианопроизводных
[32]. В реакции диамантана с тетрафторборатом
диамантана (1) протекает в 14.8 раз быстрее, чем
адамантана [51].
нитрония в среде нитрометана образуется смесь
1- и 4-нитродиамантанов, при этом преобладает
При взаимодействии с азотной кислотой и ее
замещенный по 1-ому положению изомер [33]. В
смесями скорость реакции определяется диффу-
условиях анодного окисления диамантана в при-
зионными факторами ввиду очень низкой раство-
сутствии ацетонитрила доминирует продукт меди-
римости диамантана (1). Особенностями нитрок-
ального замещения [34].
силирования углеводорода 1 являются крайняя
Для получения остальных функциональных
гидролитическая неустойчивость 1-нитроксиди-
производных диамантана в качестве субстратов
амантана (A), а также относительно высокое со-
используют предварительно синтезированные га-
держание 1-нитродиамантана (2) и дизамещенных
логен- или гидроксипроизводные. Таким образом
продуктов в реакционной смеси. Колоночной хро-
синтезируют карбоновые кислоты [35, 36], азот-
матографией на силикагеле помимо нитросоеди-
содержащие [37] и арилзамещенные производные
нения 2 были выделены 1,4-динитроксидиамантан
[38], фосфор- и серосодержащие диамантаны [39,
(3), 1-диамантанол (4) и 1,4-диамантандиол (5)
40].
(схема 1).
Поиск эффективных методов функционализа-
Высокая региоселективность нитроксилирова-
ции диамантана является важным условием пре-
ния по медиальному положению не противоречит
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
СИНТЕЗ ПРОИЗВОДНЫХ ДИАМАНТАНА В АЗОТНОКИСЛЫХ СРЕДАХ
221
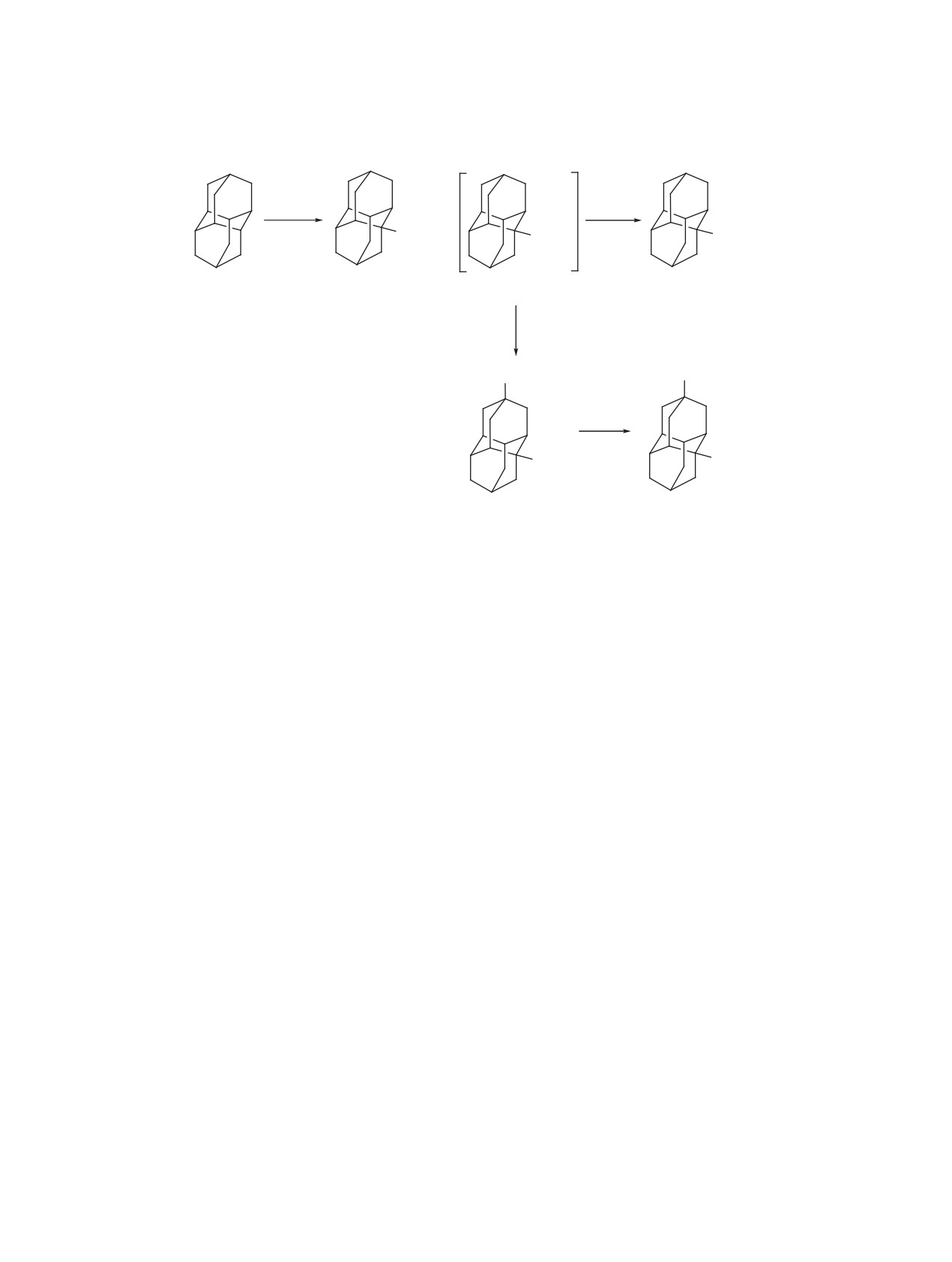
Схема 1
HNO3
H2O
+
20°C
NO2
ONO2
OH
1
2
A
4
HNO3
ONO2
OH
H2O
ONO2
OH
3
5
результатам [50], полученным при бромировании
ния диамантана (1) осуществляли непосредствен-
соединения 1. Характеристики и параметры спек-
но в дымящей азотной кислоте, либо ее смеси с
тра ЯМР 13С спирта 4 соответствуют литератур-
уксусной кислотой.
ным данным [52-54]. Спектр ЯМР 13С динитра-
Известно, что гидролиз нитроксипроизводных
та 3 содержит 10 сигналов, что характерно для
приводит к спиртам [55], однако процесс ослож-
1,4-дизамещения в каркасе диамантана. Атомы
няется побочными реакциями окисления и нитро-
углерода, связанные с ONO2-группами, проявля-
вания. Причиной являются окислы азота, выделя-
ются при 87.0 и 90.4 м.д. [27]. Для введения второй
ющиеся при нитроксилировании и образующиеся
нитроксигруппы на первый взгляд наиболее пред-
при термическом разложении азотной кислоты.
почтительно положение 9 каркаса диамантана,
Проведение гидролиза в присутствии мочевины
однако образуется 1,4-дизамещенное производ-
позволяет эффективно связывать окислы азота.
ное 3. Подобная избирательность наблюдалась и
Добавлением в реакционную смесь нитроксили-
при бромировании 1-бромдиамантана в условиях
рования раствора мочевины в 10%-ной уксусной
кинетического контроля [50]. Высокая селектив-
кислоте был получен 1-диамантанол (4) (схема 2)
ность 1,4-дизамещения вероятно может быть свя-
[46]. Нитроксилирование соединения 1 осущест-
зана со специфическим для системы диамантана
вляли в смеси HNO3-AcOH.
(1) механизмом передачи полярных эффектов за-
местителей через связи, в результате чего усили-
Молекула мочевины является амбидентным ну-
вается дезактивирующее влияние нитроксигруппы
клеофилом, так как имеет два реакционных центра
на положение 9 каркаса. Строение образующегося
при электрофильной атаке. Мономолекулярное
из динитрата 3 диола 5 подтверждено данными
замещение в кислых средах приводит к бо-
ЯМР спектров. В спектре ЯМР 13С четвертичные
лее термодинамически стабильным продуктам
атомы углерода, связанные с ОН-группами, резо-
N-алкилирования в результате устанавливающе-
нируют при 65.1 и 67.5 м.д. [27].
гося равновесия между O- и N-алкилмочевинами.
Синтез функциональных производных прово-
Синтез N-(1-диамантил)мочевины (6) осуществля-
дили с добавлением в реакционную смесь нитрок-
ли через стадию нитроксилирования диамантана
силирования диамантана (1) азотсодержащих ну-
(1) в смеси HNO3-AcOH с последующим добав-
клеофилов: мочевины, ацетонитрила, формамида,
лением водного раствора мочевины и нагреванием
этилкарбамата. При этом стадию нитроксилирова-
реакционной смеси при 50°С [56]. Выход продукта
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
222
КЛИМОЧКИН и др.
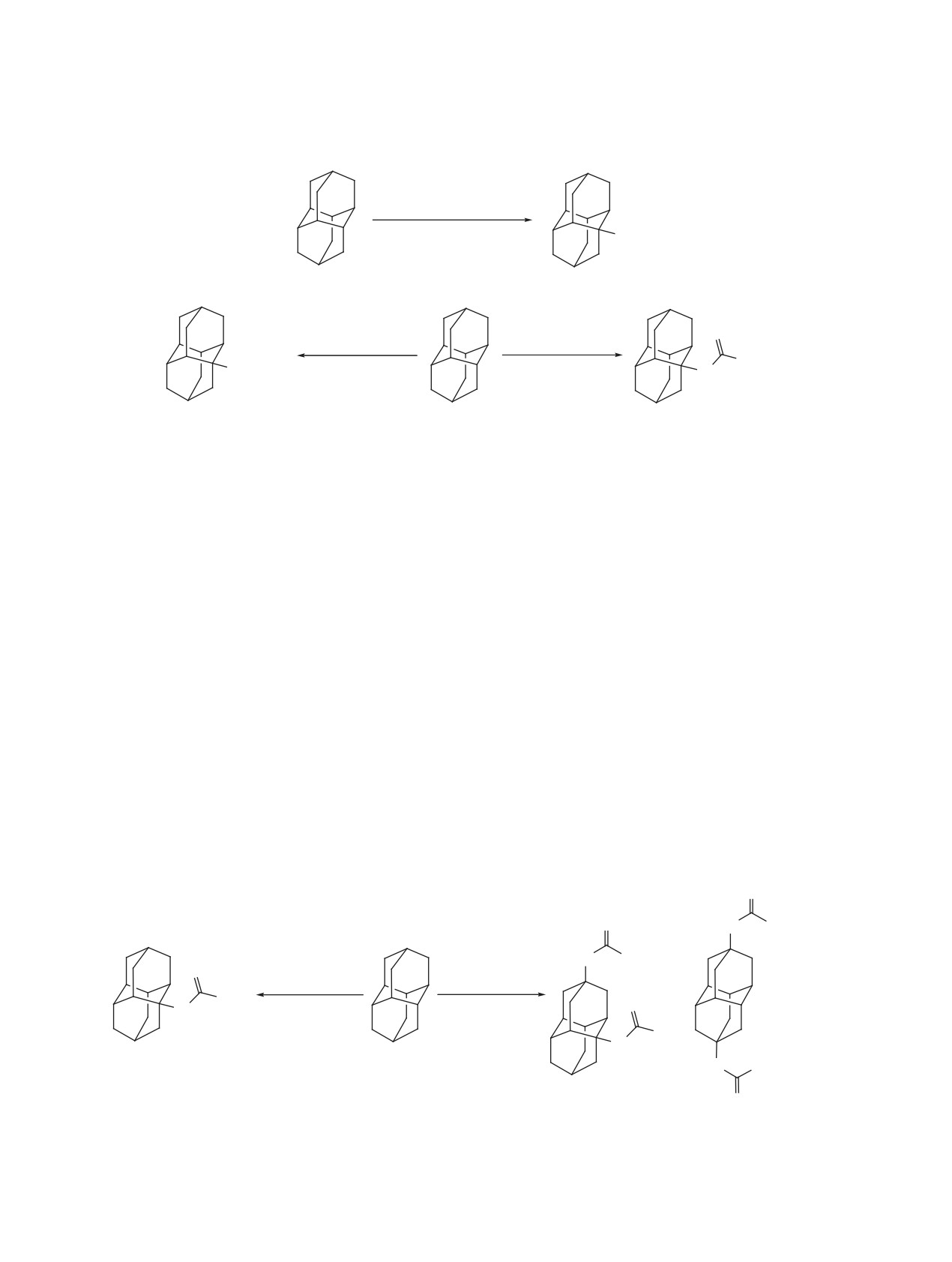
Схема 2
1. HNO3-AcOH,
2. CO(NH2)2-AcOH-H2O,
100°C
OH
1
4
1. HNO3-AcOH,
1. HNO3-AcOH,
2. CO(NH2)2-H2O,
2. CO(NH2)2-H2O,
O
90°C
50°C
-
NH2
3. NaOH
NH
3
+Cl
N
4. HCl
H
7
1
6
6 составил только 30%. Причиной столь низкого
гидрохлорида 1-аминодиамантана 6 содержит 10
выхода является неустойчивость как самой моче-
характерных для медиального замещения сигна-
вины, так и N-(1-диамантил)мочевины (6) в азот-
лов, из которых резонанс при 55.6 м.д. относит-
нокислой среде. В спектре ЯМР 1Н сигнал прото-
ся к связанному с аминогруппой атому углерода.
на NH-группы, связанной с каркасом диамантана,
Сигналов, отвечающих апикальному аминопроиз-
проявляется в виде синглета при 7.08 м.д. В спек-
водному [57], в спектре ЯМР 13С амина 6 не обна-
тре ЯМР 13С сигнал четвертичного атома углеро-
ружено.
да, связанного с аминокарбамоильным фрагмен-
Нитроксилирование диамантана (1) в смеси
тов, проявляется при 55.3 м.д.
HNO3-AcOH и последующее добавление ацетони-
При проведении стадии взаимодействия с мо-
трила приводит к образованию продукта реакции
чевиной при температуре 90°С наблюдается со-
Риттера - 1-ацетиламинодиамантану (8) с выходом
провождающаяся бурным газовыделением экзо-
85% (схема 3). Добавление в реакционную смесь
термическая реакция, приводящая к 1-аминодиа-
концентрированной серной кислоты приводит к
мантану. Продукт выделяли в виде гидрохлорида
увеличению кислотности среды, что позволяет за
(7) при последовательном проведении нейтрали-
счет окисления связи С-Н каркаса ввести еще одну
зации реакционной массы раствором щелочи, экс-
ацетиламиногруппу в каркас диамантана [58]. В
тракции амина в виде свободного основания и на-
результате была выделена смесь продуктов, состо-
сыщением экстракта сухим хлороводородом [44].
ящая из 1,4- (9), 4,9-диацетиламинодиамантанов
Выход продукта 7 составил 84%. Спектр ЯМР 13С
(10) и промежуточного 1-ацетиламиноадамантана
Схема 3
O
O
HN CH3
1. HNO3-AcOH
HN CH3
O
1. HNO3-AcOH
2. CH3CN
2. CH3CN
3. H2SO4
+
+
8
CH3
O
N
H
CH3
N
H
HN CH3
O
8
1
9
10
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
СИНТЕЗ ПРОИЗВОДНЫХ ДИАМАНТАНА В АЗОТНОКИСЛЫХ СРЕДАХ
223
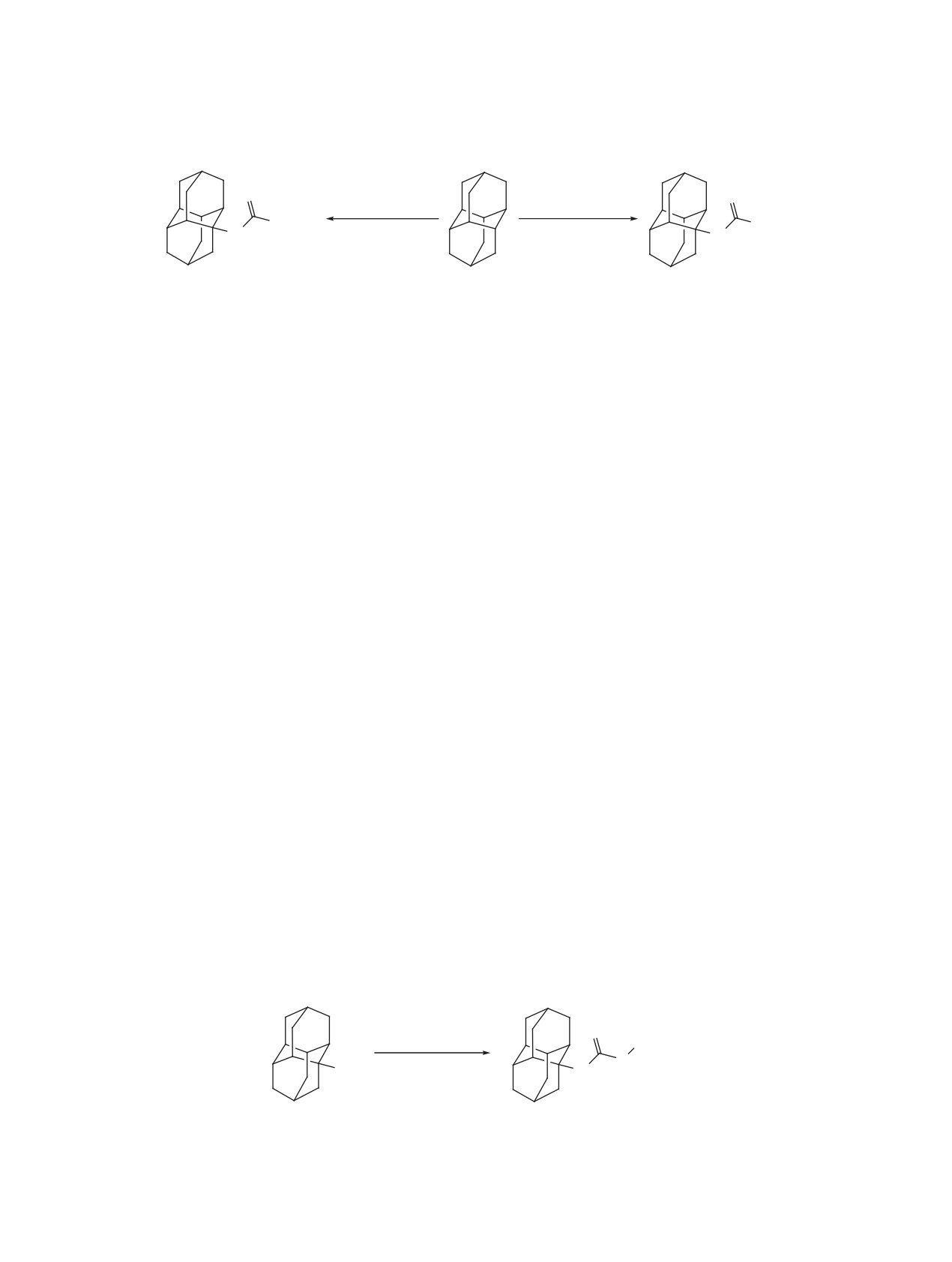
Схема 4
1. HNO3-AcOH
1. HNO3
O
O
2. H2NCOOC2H5
2. HCONH2, 85°C
OC2H5
H
N
N
H
H
12
1
11
(8) в соотношении 2:2.5:1 (схема 3), о чем свиде-
побочного продукта колоночной хроматографи-
тельствуют наличие пяти сигналов четвертич-
ей выделен 1-нитродиамантан (2) с выходом 9%.
ных атомов углерода, связанных с NH-группами,
В спектре ЯМР 13С соединения 12 наблюдается
в области 49-56 м.д. и пяти сигналов четвертич-
13 сигналов, из которых поглощение при 14.8, 60.0
ных атомов углерода ацетиламиногрупп в обла-
и 155.5 м.д. соответствует этильным и карбониль-
сти 169.0-169.3 м.д в спектре ЯМР 13С. В спектре
ному атомам углерода карбаматного фрагмента, а
ЯМР 1Н полученной смеси продуктов также при-
резонанс при 54.8 м.д. отвечает атому С1 диаман-
сутствует пять сигналов протонов NH групп в виде
танового каркаса.
синглетов при 7.07-7.26 м.д. Предположительно, в
Широко используемая в химии каркасных
присутствии концентрированной серной кислоты
соединений реакция Риттера может быть рас-
происходит изомеризация 1,4-дизамещенного про-
пространена и на тиоцианаты, электрофильное
изводного в термодинамически более стабильный
N-алкилирование которых через промежуточный
4,9-дизамещенный изомер.
резонансно-стабилизированный тионитрилиевый
При взаимодействии диамантана (1) с дымя-
ион приводит к S-алкилмонотиокарбаматам. Вы-
щей азотной кислотой, последующем добавлении
сокий окислительный потенциал дымящей азот-
формамида и нагреванием реакционной смеси при
ной кислоты ограничивает спектр возможных со-
85°С образуется 1-формиламинодиамантан
(11)
единений для использования их в качестве нукле-
(схема 4). В реакции необходимо использовать
офилов для функционализации каркасных соеди-
большой избыток формамида, так как значитель-
нений. К таким реагентам относятся тиоцианаты,
ная его часть нитрозируется и разлагается. Без
которые в азотной кислоте быстро окисляются до
нагревания реакция не идет, что можно объяснить
сульфокислот. Поэтому синтез 1-метилтиокарбо-
низкой нуклеофильностью формамида. Выход
ниламиноадамантана (13) проводили из 1-диаман-
продукта 11 составляет 96%. В спектре ЯМР 1Н
танола (4) и метилтиоцианата в среде 94%-ной
продукта 11 сигнал протона NH группы резониру-
H2SO4 (схема 5). Во избежание прохождения изо-
ет в виде синглета при 7.86 м.д. В спектре ЯМР
меризации в кислой среде синтез проводили путем
13С сигнал протона четвертичного атома углерода
добавления 1-диамантанола (4) к предварительно
проявляется при 55.4 м.д.
полученному раствору метилтиоцианата в серной
При использовании этилкарбамата в качестве
кислоте. В спектре ЯМР 13С соединения 13 чет-
нуклеофила образуется
(1-диамантил)этилкар-
вертичный атом углерода каркаса проявляется при
бамат (12) с выходом 58% (схема 4). В качестве
56.0 м.д.
Схема 5
O
H2SO4-CH3SCN
CH3
20°C
S
OH
N
H
4
13
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
224
КЛИМОЧКИН и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ацетон, 4:1), т.пл. 288-291°С [53]. ИК спектр, ν,
см-1: 3260, 1105, 1025. Спектр ЯМР 1H (CDCl3),
ИК спектры регистрировались на спектроме-
δ, м.д.: 1.29-1.76 м (14Н, CHдиам), 1.90-1.99 м (5Н,
тре Shimadzu IR Affinity-1 (Япония) в таблетках
CHдиам), 1.52 с (1Н, OH). [54] Спектр ЯМР 13C
KBr. Спектры ЯМР 1Н и 13C зарегистрированы на
(CDCl3), δ, м.д.: 25.5 (CH), 30.6 (CH), 32.7 (CH2),
спектрометре JEOL NMR-ECX400 (Япония) (400,
36.9 (CH), 37.7 (CH2), 38.2 (CH2), 40.1 (CH), 43.6
100 МГц, соответственно) с использованием оста-
(CH), 46.6 (CH2), 70.9 (Cчетв) [52].
точного сигнала дейтерированного растворителя
в качестве внутреннего стандарта. Химические
При элюировании диэтиловым эфиром - 0.19 г
сдвиги сигналов определены в шкале δ м.д.
(32%)
1,4-диамантандиола
(5)
(4 фракция), Rf
Температуры плавления определены капилляр-
0.24 (гексан-ацетон, 4:1), т.пл. 265-268°С [53].
ным методом на приборе SRS OptiMelt MPA 100
ИК спектр, ν, см-1: 3390, 1110. Спектр ЯМР 1H
(Германия), не корректировались. Элементный
(DMSO-d6), δ, м.д.: 1.14-1.63 м (10Н, CHдиам),
анализ выполнен на элементном анализаторе
1.74-2.09 м (8Н, CHдиам), 2.54 уш.с (2Н, OH).
EuroVector 3000 EA (Италия) с использованием в
Спектр ЯМР 13C (DMSO-d6), δ, м.д.: 29.5 (CH), 36.2
качестве стандарта L-цистина. Разделение смесей
(CH2), 37.7 (CH), 38.0 (CH), 38.2 (CH2), 45.2 (CH),
проводили с использованием силикагеля Merck
45.25 (CH2), 45.3 (CH2), 65.1 (Cчетв), 67.5 (Cчетв)
Kieselgel 0.040-0.063 мм. Тонкослойную хрома-
[27].
тографию проводили с использованием пластин
1-Диамантанол
(4).
К суспензии
1.5 г
«Сорбфил ПТСХ-АФ А» (5-17 мкм).
(0.008 моль) диамантана (1) в 2.5 мл ледяной
Нитроксилирование диамантана (1). К 5.6 мл
уксусной кислоты при 15-20°С при перемеши-
(0.13 моль) 98%-ной азотной кислоты при охлаж-
вании добавляли по каплям 3.3 мл (0.08 моль)
дении добавляли 0.5 г (0.0027 моль) диамантана
98%-ной азотной кислоты. Реакционную массу
(1). Реакционную смесь выдерживали 24 ч при
выдерживали в течение 1 ч при 20°С при переме-
комнатной температуре и выливали в измельчен-
шивании, а затем при охлаждении добавляли рас-
ный лед. Выпавшее масло экстрагировали этила-
твор 3.6 г (0.06 моль) карбамида в 10 мл 10%-ой
цетатом (5×5 мл), объединенные органические
уксусной кислоты. Полученную смесь нагревали
фракции промывали насыщенным раствором ги-
до 100°С и выдерживали 1 ч. После охлаждения
дрокарбоната натрия, затем водой и сушили над
смесь нейтрализовали 40%-ным раствором ги-
хлористым кальцием. Растворитель упаривали,
дроксида натрия до нейтральной среды, охлажда-
остаток очищали колоночной хроматографией на
ли и выпавший осадок отфильтровывали. Выход
силикагеле.
0.59 г (36%), т.пл. 289-291°С [46].
При элюировании гексаном получили 0.065 г
N-(1-Диамантил)мочевина (6). К суспензии
(10%) 1-нитродиамантан (2) (1 фракция), Rf 0.68
1.5 г (0.008 моль) диамантана (1) в 1 мл уксусной
(хлороформ), т.пл. 233-236°С [33]. ИК спектр, ν,
кислоты при температуре не выше 20°С добавляли
см-1: 1528, 1356, 800.
по каплям 3 мл (0.07 моль) 100%-ой азотной кис-
лоты. Реакционную массу выдерживали при пере-
При элюировании ССl4 - 0.11 г (13%) 1,4-ди-
мешивании до полного растворения диамантана
нитроксидиамантан (3) (2 фракция), Rf 0.59 (гек-
(4.5 ч), затем при эффективном охлаждении добав-
сан-ацетон, 4:1), т.пл. 89-93°С. ИК спектр, ν,
ляли 1.5 г (0.025 моль) карбамида. Реакционную
см-1: 1645, 1280, 860. Спектр ЯМР 1H (CDCl3), δ,
смесь нагревали до 50°С и выдерживали при
м.д.: 1.69-1.87 м (4Н, CHдиам), 1.99-2.57 м (14Н,
этой температуре в течение 2 ч. После охлажде-
CHдиам). Спектр ЯМР 13C (CDCl3), δ, м.д.: 29.8
ния смесь выливали на лед, выпавший осадок
(СH), 34.6 (CH2), 35.5 (CH2), 38.2 (CH2), 38.7 (CH),
отфильтровывали, промывали водой и сушили.
39.2 (CH), 39.2 (CH2), 41.8 (CH), 87.0 (Cчетв), 90.4
Выход 0.59 г (30%), т.пл. 163-164°С. ИК спектр,
(Cчетв) [27].
ν, см-1: 3475, 3350, 1626, 1554. Спектр ЯМР 1H
При элюировании хлороформом - 0.076 г (14%)
(DMSO-d6), δ, м.д.: 1.28-1.63 м (10Н, CHдиам),
1-диамантанол (4) (3 фракция), Rf 0.36 (гексан-
1.74-1.97 м (9Н, CHдиам), 2.16 уш.с (2Н, NH2), 7.08
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
СИНТЕЗ ПРОИЗВОДНЫХ ДИАМАНТАНА В АЗОТНОКИСЛЫХ СРЕДАХ
225
c (1H, NH). Спектр ЯМР 13C (DMSO-d6), δ, м.д.:
водорода. Затем по каплям прибавляли 1.3 мл
25.1 (CH), 28.6 (CH), 32.9 (CH2), 37.0 (CH), 37.6
(0.017 моль) ацетонитрила, выдерживали 2 ч и до-
(CH2), 38.3 (CH2), 38.5 (CH), 38.6 (CH), 41.9 (CH2),
бавляли по каплям 6.4 мл (0.12 моль) 96%-ной сер-
55.3 (Cчетв), 169.0 (Cчетв). Найдено, %: С 73.20; H
ной кислоты. Реакционную смесь выдерживали
8.89; N 11.45. C15H22N2O. Вычислено, %: C 73.13;
при комнатной температуре в течение 12 ч, выли-
H 9.00; N 11.37.
вали на измельченный лед и доводили до рН 9 ги-
дрокарбонатом натрия. Выпавший маслообразный
Гидрохлорид 1-аминодиамантана (7). К сус-
продукт отделяли и суспендировали в 20 мл этил-
пензии 1.5 г (0.008 моль) диамантана (1) в 1 мл
ацетата. Осадок фильтровали, промывали водой и
уксусной кислоты при температуре не выше 20°С
сушили. Выход 0.86 г. Смесь состоит из (1-диаман-
добавляли по каплям 3 мл (0.07 моль) 100%-ой
тил)ацетамида (8), 1,4-диацетиламинодиамантана
азотной кислоты. Реакционную массу выдержи-
(9) и 4,9-диацетиламинодиамантана (10) в соот-
вали при перемешивании до полного растворе-
ношении 1:2:2.5. Спектр ЯМР 1H (DMSO-d6), δ,
ния диамантана (4.5 ч), затем при эффективном
охлаждении добавляли 1.5 г (0.025 моль) карба-
м.д.: 1.25-1.31 м (4Н, СНдиам), 1.48-2.03 м (63Н,
мида. Реакционную смесь нагревали до 90°С и
СНдиам), 2.29 с (4Н, СНдиам), 7.07 с (1Н, NH), 7.13
выдерживали при этой температуре в течение
с (1Н, NH), 7.16 с (1Н, NH), 7.21 с (1Н, NH), 7.26
2 ч. После охлаждения смесь выливали в воду и
с (1Н, NH). Спектр ЯМР 13C (DMSO-d6), δ, м.д.:
нейтрализовали гидроксидом натрия. Выпавший
24.2 (CH3), 24.27 (CH3), 24.3 (CH3), 25.1 (CH3),
осадок экстрагировали диэтиловым эфиром
25.7 (CH3), 27.8 (CH), 28.4 (CH), 28.6 (CH), 32.2
(2×50 мл), объединенные эфирные вытяжки на-
(CH2), 32.9 (CH2), 36.8 (CH2), 36.9 (CH2), 37.0
сыщали сухим хлористым водородом. Выпавший
(CH), 37.4 (CH), 37.6 (CH), 37.7 (CH), 38.1 (CH),
продукт отфильтровывали, промывали эфиром и
38.2 (CH2), 38.5 (CH), 38.6 (CH), 41.3 (CH2), 41.7
сушили. Выход 1.6 г (84%), т.пл. 262-265°С [57].
(CH2), 41.9 (CH2), 42.0 (CH2), 49.4 (Cчетв), 49.6
ИК спектр, ν, см-1: 2055, 1610, 1500. Спектр ЯМР
(Cчетв), 54.5 (Cчетв), 54.9 (Cчетв), 55.3 (Cчетв), 169.0
1H (DMSO-d6), δ, м.д.: 1.22-1.56 м (11Н, CHдиам),
(Cчетв), 169.07 (Cчетв), 169.1 (Cчетв), 169.18 (Cчетв),
1.66-2.03 м (8Н, CHдиам), 7.65 с (3Н, NH3+). Спектр
169.2 (Cчетв).
ЯМР 13C (DMSO-d6), δ, м.д.: 24.5 (CH), 27.6 (CH),
N-(1-Диамантил)формамид
(11). К
3.3 мл
31.2 (CH2), 36.1 (CH), 36.6 (CH), 37.7 (CH2), 38.4
(0.08 моль) дымящей азотной кислоты при пере-
(CH2), 38.7 (CH), 41.2 (CH2), 55.6 (Cчетв).
мешивании порциями добавляли 1.5 г (0.008 моль)
N-(1-Диамантил)ацетамид (8). К суспензии 1 г
диамантана
(1) при температуре
20°С. Ре-
(0.0053 моль) диамантана (1) в 0.6 мл уксусной
акционную смесь перемешивали до полного рас-
кислоты при перемешивании по каплям добавляли
творения углеводорода. Затем по каплям добавля-
3 мл (0.072 моль) 100%-ной азотной кислоты при
ли 2.9 мл (0.072 моль) формамида при температуре
20°С. Реакционную смесь перемешивали до пол-
20-25°С. Полученную смесь медленно нагревали
ного растворения углеводорода. Затем по каплям
до 85°С, выдерживали в течение 2 ч, затем охла-
прибавляли 0.9 мл (0.017 моль) ацетонитрила,
ждали до 10°С и выливали в измельченный лед.
выдерживали 2 ч и выливали на лед. Выпавший
Выпавший осадок отфильтровывали, промывали
осадок отфильтровывали, промывали водой до
водой и сушили. Выход 1.77 г (96%), т.пл. 133-
нейтральной среды, сушили и перекристалли-
134°С. ИК спектр, ν, см-1: 3310, 1687. Спектр ЯМР
зовывали из метанола. Выход 1.1 г (85%), т.пл.
1H (DMSO-d6), δ, м.д.: 1.42-1.73 м (12Н, CHдиам),
166.0-168.5°С [59].
1.82-2.14 м (7Н, CHдиам), 7.86 с (1Н, NH), 8.29 c
Синтез диацетиламинопроизводных ди-
(1H, CHO). Спектр ЯМР 13C (DMSO-d6), δ, м.д.:
амантана 9, 10. К 3.3 мл (0.08 моль) дымящей
24.2 (CH), 28.5 (CH), 32.2 (CH2), 33.5 (CH2), 36.4
азотной кислоты при перемешивании порциями
(CH2), 38.7 (CH), 39.1 (CH), 43.3 (CH), 44.4 (CH2),
добавляли 1.5 г (0.008 моль) диамантана (1) при
55.4 (Cчетв), 162.1 (Cчетв). Найдено, %: С 77.97; H
температуре не выше 20°С. Реакционную смесь
9.07; N 6.14. C15H21NO. Вычислено, %: C 77.88; H
перемешивали до полного растворения угле-
9.15; N 6.05.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
226
КЛИМОЧКИН и др.
N-(1-Диамантил)этилкарбамат
(12). К су-
ВЫВОДЫ
спензии 1 г (0.0053 моль) диамантана (1) в 1.5 мл
Предложен метод направленной функционали-
уксусной кислоты при перемешивании при 20°С
зации связей С-Н диамантана, заключающийся в
добавляли 3.5 мл (0.083 моль) 98%-ой азотной
предварительном нитроксилировании углеводоро-
кислоты. Реакционную смесь перемешивали
да в дымящей азотной кислоте или ее смеси с ук-
в течение 1.5 ч при 20°С, а затем добавляли 3 г
сусной кислотой и последующим добавлении азот-
(0.036 моль) этилкарбамата. Реакционную смесь
содержащих нуклеофилов. Полученные 1-моно- и
выдерживали в течение 2 ч при перемешивании
1,4-дифункциональные производные могут найти
и выливали на измельченный лед. Продукт экс-
применение в качестве молекулярной платформы
трагировали ССl4 (3×10 мл), объединенные ор-
при получении новых материалов и биологически
ганические экстракты промывали насыщенным
активных веществ.
раствором гидрокарбоната натрия, затем водой и
БЛАГОДАРНОСТИ
сушили сульфатом натрия. Продукт очищали ко-
лоночной хроматографией. Получено 0.11 г (9%)
Работа выполнена с использованием научно-
1-нитродиамантана (2) (1 фракция, элюент - гек-
го оборудования центра коллективного пользова-
сан). При дальнейшем элюировании выделили 2
ния СамГТУ «Исследование физико-химических
фракцию - продукт 12. Выход 0.82 г (58%), т.пл.
свойств веществ и материалов». Диамантан (1)
98-100°С (гексан). ИК спектр, ν, см-1: 3320, 1695,
был предоставлен И. Янку (Высшая школа хими-
1530, 1285, 1235, 1080. Спектр ЯМР 1H (CDCl3), δ,
ческой технологии, Прага).
м.д.: 1.14 т (3Н, СН3, J 7.3 Гц), 1.30-2.15 м (19Н,
ФОНДОВАЯ ПОДДЕРЖКА
СНдиам), 3.94 с (2Н, СН2), 6.26 с (1Н, NH). Спектр
Работа выполнена при финансовой поддержке
ЯМР 13C (CDCl3), δ, м.д.: 14.8 (СН3), 25.3 (CH),
Минобрнауки РФ в рамках проектной части госу-
29.0 (CH), 32.8 (CH2), 37.2 (CH), 37.5 (CH2), 38.3
дарственного задания № 0778-2020-0005.
(CH2), 39.0 (CH), 39.6 (CH), 42.3 (CH2), 54.8 (C1),
60.0 (CH2), 155.5 (Cчетв). Найдено, %: С 74.50; H
КОНФЛИКТ ИНТЕРЕСОВ
8.97; N 5.22. C17H25NO2. Вычислено, %: C 74.18;
Авторы заявляют об отсутствии конфликта ин-
H 9.09; N 5.09.
тересов.
S-Метил-(1-диамантил)карбамотиоат (13). К
СПИСОК ЛИТЕРАТУРЫ
8 мл 94%-ной серной кислоты при 20°С добавля-
1. Schwertfeger H., Fokin A.A., Schreiner P.R. Angew.
ли 2 г (0.027 моль) метилтиоцианата, а затем 1 г
Chem., Int. Ed. 2008, 47, 1022-1036. doi 10.1002/
(0.005 моль) 1-диамантанола (4). Реакционную
anie.200701684
массу выдерживали 0.5 ч при 20°С при перемеши-
2. Нехаев А.И., Багрий Е.И., Максимов А.Л. Нефте-
вании, выливали на измельченный лед. Продукт
химия. 2011, 51, 97-106. [Nekhaev A.I., Bagrii E.I.,
экстрагировали диэтиловым эфиром (3×20 мл),
Maximov A.L. Petroleum Chem. 2011, 51, 86-95.] doi
эфирные вытяжки промывали раствором гидро-
10.1134/S0965544111020095
карбоната натрия, водой и сушили сульфатом
3. Gunawan M.A., Hierso J.-C., Poinsot D., Fokin A.A.,
натрия. Растворитель упаривали, остаток пере-
Fokina N.A., Tkachenko B.A., Schreiner P.R. New J.
кристаллизовывали из метанола. Выход 0.39 г
Chem. 2014, 38, 28-41. doi 10.1039/c3nj00535f
(29%), т.пл. 130-132°С. ИК спектр, ν, см-1: 3378,
4. Yeung K.-W., Dong Y., Chen L., Tang C.-Y.,
3322, 1677, 1495, 1185. Спектр ЯМР 1H (CDCl3),
Law W.-C., Tsui G.C.-P. Nanotechnol. Rev. 2020,
δ, м.д.: 1.26-1.67 м (9Н, СНдиам), 1.73-2.09 м (10Н,
9, 650-669. doi 10.1515/ntrev-2020-0051
СНдиам), 2.45 с (2Н, СН2), 6.28 с (1Н, NH). Спектр
5. de Araujo P.L.B., Mansoori G.A., de Araujo E.S. Int. J.
ЯМР 13C (CDCl3), δ, м.д.: 20.8 (СН3), 27.3 (CH),
Oil, Gas Coal Technol. 2012, 5, 316-367. doi 10.1504/
29.0 (CH), 30.5 (CH2), 34.2 (CH2), 35.8 (CH), 37.3
IJOGCT.2012.048981
(CH2), 38.4 (CH), 40.6 (CH), 41.6 (CH2), 56.0 (Cчетв),
6. Marchand A.P. Science. 2003, 299, 52-53 doi 10.1126/
168.1 (Cчетв). Найдено, %: С 69.28; Н 8.51; N 5.14;
science.1079630
S 11.48. С16Н23NОS. Вычислено, %: С 69.21; Н
7. Dahl J.E.P., Liu S., Carlson R.M.K. Science. 2003,
8.30; N 5.05; S 11.56.
299, 96-99. doi 10.1126/science.1078239
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
СИНТЕЗ ПРОИЗВОДНЫХ ДИАМАНТАНА В АЗОТНОКИСЛЫХ СРЕДАХ
227
8.
Dahl J.E.P., Moldowan J.M., Peakman T.M., Clar-
22.
Narasimha K.T., Ge C., Fabbri J.D., Clay W., Tkachen-
dy, J.C., Lobkovsky E., Olmstead M.M., May P.W.,
ko B.A., Fokin A.A., Schreiner P.R., Dahl J.E., Carl-
Davis T.J., Steeds J.W., Peters K.E., Pepper A.,
son R.M.K., Shen Z.X., Melosh N.A. Nature
Ekuan A., Carlson, R.M.K. Angew. Chem., Int. Ed.
Nanotechnol.
2016,
11,
267-273. doi
10.1038/
2003, 42, 2040-2044. doi 10.1002/anie.200250794
NNANO.2015.277
9.
Zhou Y., Brittain A.D., Kong D., Xiao M., Meng Y.,
23.
Sigwalt D., Šekutor M., Cao L., Zavalij P. Y., Hostas J.,
Sun L. J. Mater. Chem. C. 2015, 3, 6947-6961. doi
Ajani H., Hobza P., Mlinaric-Majerski K., Glaser R.,
10.1039/C5TC01377A
Isaacs L. J. Am. Chem. Soc. 2017, 139, 3249-3258. doi
10.
Wanka L., Iqbal K., Schreiner P.R. Chem. Rev. 2013,
10.1021/jacs.7b00056
113, 3516-3604. doi 10.1021/cr100264t
24.
Šekutor M., Molčanov K., Cao L., Isaacs L., Glaser R.,
11.
Stockdale T.P., Williams C.M. Chem. Soc. Rev. 2015,
Mlinarić-Majerski K. Eur. J. Org. Chem. 2014, 2014,
44, 7737-7763. doi 10.1039/C4CS00477A
2533-2542. doi 10.1002/ejoc.201301844
12.
Spilovska K., Zemek F., Korabecny J., Nepovimova E.,
25.
Lopatina Y.Yu., Vorobyova V.I., Fokin A.A.,
Soukup O., Windisch M., Kuca K. Curr. Med. Chem.
Schreiner P.R., Marchenko A.A., Zhuk T.S. J. Phys.
2016, 23, 3245-3266. doi 10.2174/092986732366616
Chem. C. 2019, 123, 27477-27482. doi 10.1021/
0525114026
acs.jpcc.9b06625
13.
Zhou Y., Dahl J., Carlson R., Liang H. Carbon. 2015,
26.
Vodicka L., Isaev S.D., Burkhard J., Janku J. Collect.
86, 132-138. doi 10.1016/j.carbon.2015.01.017
Czech. Chem. Commun. 1984, 491, 1900-1906. doi
10.1135/cccc19841900
14.
Codony S., Valverde E., Leiva R., Brea J., Loza M.I.,
Morisseau C., Hammock B.D., Vázquez S. Bioorg.
27.
Fokina N.A., Tkachenko B.A., Merz A., Serafin M.,
Med. Chem.
2019,
27,
115078. doi
10.1016/
Dahl J.E.P., Carlson R.M.K., Fokin A.A., Schrei-
j.bmc.2019.115078
ner P.R. Eur. J. Org. Chem. 2007, 2007, 4738-4745.
doi 10.1002/ejoc.200700378
15.
Yang P.-S., Wang J.-J., Wang Y.-H., Jan W.-C.,
Cheng S.-P., Hsu Y.-C. Oncology Lett. 2016, 11, 3551-
28.
Gunchenko P.A., Li J., Liu B., Chen H., Pashenko A.E.,
3557. doi 10.3892/ol.2016.4430
Bakhonsky V.V., Zhuk T.S., Fokin A.A. Mol. Catal.
2018, 447, 72-79. doi 10.1016/j.mcat.2017.12.017
16.
Gushiken T., Ujiie S., Ubukata T., Yokoyama Y. Bull.
Chem. Soc. Jpn. 2011, 84, 269-282. doi 10.1246/
29.
Хуснутдинов Р.И., Щаднева Н.А., Хисямова Л.Ф.,
bcsj.20100259
Маякова Ю.Ю., Джемилев У.М. ЖОрХ. 2011, 47,
1861-1862. [Khusnutdinov R.I., Shchadneva N.A.,
17.
Carrington E.J., McAnally C.A., Fletcher A.J.,
Khisamova L.F., Mayakova Yu.Yu., Dzhemilev U.M.
Thompson S.P., Warren M., Brammer L. Nature Chem.
Russ. J. Org. Chem. 2011, 47, 1898-1900.] doi 10.1134/
2017, 9, 882-889. doi 10.1038/NCHEM.2747
S1070428011120220
18.
Nakanishi Y., Omachi H., Fokina N.A., Schreiner P.R.,
30.
Хуснутдинов Р.И., Щаднева Н.А., Маякова Ю.Ю.,
Becker J., Dahl J.E.P., Carlson R.M.K., Shinohara H.
Юламанова А.А., Хазипова А.Н., Кутепов Б.И. ЖОХ.
Chem. Commun. 2018, 54, 3823-3826. doi 10.1039/
2018, 88, 574-579. [Khusnutdinov R.I., Shchadne-
c7cc09832d
va N.А., Mayakova Yu.Yu., Yulamanova А.А., Khazi-
19.
Gunawan M.A., Moncea O., Poinsot D., Keskes M.,
pova А.N., Kutepov B.I. Russ. J. Gen. Chem. 2018, 88,
Domenichini B., Heintz O., Chassagnon R., Herbst F.,
658-663.] doi 10.1134/S1070363218040084
Carlson R.M.K., Dahl J.E.P., Fokin A.A., Schrei-
31.
Fokin A.A., Tkachenko B.A., Gunchenko P.A., Gu-
ner P.R., Hierso J.-C. Adv. Funct. Mater. 2018, 1705786.
sev D.V., Schreiner P.R. Chem. Eur. J. 2005, 11, 7091-
doi 10.1002/adfm.201705786
7101. doi 10.1002/chem.200500031
20.
Gao H.-Y., Šekutor M., Liu L., Timmer A., Schreyer H.,
32.
Berndt J.-P., Erb F.R., Ochmann L., Beppler J., Schrei-
Mönig H., Amirjalayer S., Fokina N.A., Studer A.,
ner P.R. Synlett. 2019, 30, 493-498. doi 10.1055/
Schreiner P.R., Fuchs H. J. Am. Chem. Soc. 2019, 141,
s-0037-1610403
315-322. doi 10.1021/jacs.8b10067
33.
Olah G.A., Ramaiah P., Rao C.B., Sandford G., Go-
21.
Moncea O., Casanova-Chafer J., Poinsot D., Och-
lam R., Trivedi N.J., Olah J.A. J. Am. Chem. Soc. 1993,
mann L., Mboyi C.D., Nasrallah H.O., Llobet E., Mak-
ni I., El Atrous M., Brandes S., Rousselin Y., Domeni-
115, 7246-7249. doi 10.1142/9789812791405_0127
chini B., Nuns N., Fokin A.A., Schreiner P.R., Hier-
34.
Гунченко П.А., Новиковский А.А., Бык М.В., Фо-
so J.-C. Angew. Chem,. Int. Ed. 2019, 58, 9933-9938.
кин А.А. ЖОрХ. 2014, 50, 1768-1773. [Gunchen-
doi 10.1002/anie.201903089
ko P.A., Novikovskii A.A., Byk M.V., Fokin A.A.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
228
КЛИМОЧКИН и др.
Russ. J. Org. Chem. 2014, 50, 1749-1754.] doi
53, 959-964. [Klimochkin Yu.N., Yudashkin A.V.,
10.1134/S1070428014120057
Zhilkina E.O., Ivleva E.A., Moiseev I.K., Oshis Ya.F.
35.
Vodicka L., Janku J., Burkhard J. Collect. Czech.
Russ. J. Org. Chem. 2017, 53, 971-976.] doi 10.1134/
Chem. Commun. 1983, 48, 1162-1172. doi 10.1135/
S1070428017070028
cccc19831162
47.
Ивлева Е.А., Погуляйко А.В., Климочкин Ю.Н.
36.
Fokina N.A., Tkachenko B.A., Dahl J.E.P., Carl-
ЖОрХ. 2018, 54, 1283-1289. [Ivleva E.A., Pogulyai-
son R.M.K., Fokin A.A., Schreiner P.R. Synthesis.
ko A.V., Klimochkin Yu. N. Russ. J. Org. Chem. 2018,
2012, 44, 259-264. doi 10.1055/s-0031-1289617
54, 1294-1300.] doi 10.1134/S107042801809004X
37.
Davis M.C., Nissan D.A. Synth. Commun. 2006, 36,
48.
Климочкин Ю.Н., Ивлева Е.А., Моисеев И.К.
2113-2119. doi 10.1080/00397910600636600
ЖОрХ. 2020, 56, 1353-1362. [Klimochkin Yu.N.,
38.
Гунченко П.А., Черниш Л.В., Тихончук Е.Ю., Бэ-
Ivleva E.A., Moiseev I.K. Russ. J. Org. Chem. 2020,
кер Д., Шрайнер П.Р., Фокин А.А. Журн. орг. фарм.
56, 1532-1539.] doi 10.1134/S1070428020090055
хім. 2020, 18, 16-22. [Gunchenko P.A., Chernish L.V.,
49.
Моисеев И.К., Климочкин Ю.Н., Земцова М.Н.,
Tikhonchuk E.Yu., Becker J., Schreiner P.R., Fo-
Трахтенберг П.Л. ЖОрХ.
1984,
20,
1435-1438.
kin A.A. J. Org. Pharm. Chem. 2020, 18, 16-22.] doi
[Moiseev I.K., Klimochkin Yu.N., Zemtsova M.N.,
10.24959/ophcj.20.199807
Trakhtenberg P.L. J. Org. Chem. USSR. 1984, 20,
39.
Fokin A.A., Yurchenko R.I., Tkachenko B.A., Foki-
1307-1309.]
na N.A., Gunawan M.A., Poinsot D., Dahl J.E.P.,
50.
Gund T.M., Schleyer P.v.R., Unruh G.D., Gleicher G.J.
Carlson R.M.K., Serafin M., Cattey H., Hierso J.-C.,
J. Org. Chem. 1974, 39, 2995-3003. doi 10.1021/
Schreiner P.R. J. Org. Chem. 2014, 79, 5369-5373.
jo00934a011
doi 10.1021/jo500793m
51.
Климочкин Ю.Н., Абрамов О.В., Моисеев И.К., Во-
40.
Moncea O., Gunawan M.A., Poinsot D., Cattey H.,
логин М.Ф., Леонова М.В., Багрий Е.И. Нефтехи-
Becker J., Yurchenko R.I., Butova E.D., Hausmann H.,
мия. 2000, 40, 454-457.
Šekutor M., Fokin A.A., Hierso J.-C., Schreiner P.R.
J. Org. Chem. 2016, 81, 8759-8769. doi 10.1021/acs.
52.
Duddeck H., Hollowood F., Karim A., McKervey A.
joc.6b01219
J. Chem. Soc. Perkin 2. 1979, 3, 360-365. doi 10.1039/
P29790000360
41.
Климочкин Ю.Н., Багрий Е.И., Долгополова Т.Н.,
Моисеев И.К. Изв. АН. СССР. Сер. хим. 1988, 37,
53.
Janků J., Burkhard J., Vodička L. Z. Chem. 1981, 21,
878-880. [Klimochkin Yu.N., Bagrii E.I., Dolgopolo-
325-326. doi 10.1002/zfch.19810210905
va T.N., Moiseev I.K. Russ. Chem. Bull. 1988, 37, 757-
54.
Gund T.M., Nomura M., Schleyer P.v.R. J. Org. Chem.
759.] doi 10.1007/BF01455495
1974, 39, 2987-2994. doi 10.1021/jo00934a010
42.
Климочкин Ю.Н., Моисеев И.К. ЖОрХ. 1988, 24,
55.
Bochan R., Merrow R.T., Dolah R.W. Chem. Rev.
557-560.
1955, 55, 485-510. doi 10.1021/cr50003a001
43.
Климочкин Ю.Н., Ивлева Е.А., Скоморохов М.Ю.
56.
Климочкин Ю.Н., Моисеев И.К. ЖОрХ. 1987, 23,
ЖОрХ. 2020, 56, 1344-1352. [Klimochkin Yu.N., Ivle-
2025.
va E.A., Skomorokhov M.Yu. Russ. J. Org. Chem. 2020,
56, 1525-1531.] doi 10.1134/S1070428020090043
57.
Cahill P.A. Tetrahedron Lett. 1990, 31, 5417-5420.
doi 10.1016/S0040-4039(00)97861-4
44.
Леонова М.В., Скоморохов М.Ю., Моисеев И.К.,
Климочкин Ю.Н. ЖОрХ. 2015, 51, 1737-1743. [Leo-
58.
Климочкин Ю.Н., Ивлева Е.А., Сержантова А.С.,
nova M.V., Skomorokhov M.Yu., Moiseev I.K., Kli-
Ширяев А.К., Моисеев И.К. ЖОрХ. 2017, 53, 1156-
mochkin Yu.N. Russ. J. Org. Chem. 2015, 51, 1703-
1161.
[Klimochkin Yu.N., Ivleva E.A., Serzhanto-
1709.] doi 10.1134/S1070428015120064
va A.S., Shiryaev A.K., Moiseev I.K. Russ. J. Org.
45.
Ivleva E.A., Klimochkin Yu.N. Org. Prep.
Chem.
2017,
53,
1170-1175.] doi
10.1134/
Proced. Int.
2017,
49,
155-162. doi
10.1080/
S1070428017080024
00304948.2017.1291004
59.
Gund T.M., Nomura M., Williams V.Z. Schleyer P.v.R.
46.
Климочкин Ю.Н., Юдашкин А.В., Жилкина Е.О.,
Tetrahedron Lett. 1970, 56, 4875-4878. doi 10.1016/
Ивлева Е.А., Моисеев И.К., Ошис Я.Ф. ЖОрХ. 2017,
S0040-4039(00)99732-6
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
СИНТЕЗ ПРОИЗВОДНЫХ ДИАМАНТАНА В АЗОТНОКИСЛЫХ СРЕДАХ
229
Synthesis of Diamantane Derivatives in Nitric Acid Medias
Yu. N. Klimochkin, E. A. Ivleva*, and M. S. Zaborskaya
Samara State Technical University, Molodogvardeiskaya ul., 244, Samara, 443100 Russia
*e-mail: ivleva.ea@samgtu.ru
Received November 18, 2020; revised November 29, 2020; accepted November 30, 2020
A number of some 1-mono- and 1,4-difunctional derivatives were synthesized by reactions of diamantane with
nitric acid or a mixture of HNO3-AcOH and the subsequent addition of nitrogen-containing nucleophiles.
1-Methylthiocarbonylaminodiamantane was obtained from 1-diamantanol and methylthiocyanate in sulfuric
acid.
Keywords: diamantoids, diamantane, fuming nitric acid, nitric acid medias, nitrogen-containing nucleophiles,
functionalization
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021