ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 2, с. 259-267
УДК 547.853.7+547.792.1
ТРЕХКОМПОНЕНТНЫЕ КОНДЕНСАЦИИ
3-АМИНО-1,2,4-ТРИАЗОЛОВ, МЕТИЛОВЫХ ЭФИРОВ
3-(2-АМИНОЗАМЕЩЕННЫХ-4-МЕТИЛПИРИМИДИН-
5-ИЛ)-3-ОКСОПРОПИОНОВЫХ КИСЛОТ И РЯДА С1
СИНТОНОВ КАК УДОБНЫЙ ПОДХОД К ПИРИМИДИН-
5-ИЛ-1,2,4-ТРИАЗОЛО[1,5-а]ПИРИМИДИНАМ
© 2021 г. А. Ю. Потаповa, *, В. А. Поликарчукa, Б. В. Папоновb, И. В. Леденеваa,
Н. В. Столповскаяa, Д. В. Крыльскийc, Х. С. Шихалиевa
a ФГБОУ ВО «Воронежский государственный университет», Россия, 394018 Воронеж, Университетская пл., 1
*e-mail: pistones@mail.ru
b ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»,
Россия, 308015 Белгород, ул. Победы, 85
c ФГУП «НИИ прикладной акустики», Россия, 141980 Дубна, ул. 9 Мая, 7А
Поступила в редакцию 02.12.2020.
После доработки 11.12.2020 г.
Принята к публикации 14.12.2020 г.
Разработан удобный синтетический подход к полизамещенным дигидро- или гетероароматическим
1,2,4-триазоло[1,5-a]пиримидинам, содержащим в положении 5 4-метилпиримидиновый фрагмент, за-
мещенный в положение 2 циклическим амином и связанный с триазолопиримидиновым бициклом через
свое положение 5. Подход основан на использовании оригинальных трехкомпонентных конденсаций
3-амино-1,2,4-триазолов, метиловых эфиров 3-(2-аминозамещенных-4-метилпиримидин-5-ил)-3-оксопро-
пионовых кислот и ряда С1 синтонов, синтетическими эквивалентами, которых являются ароматические
альдегиды, триэтилортоформиат или ДМФДМА.
Ключевые слова: триазолопиримидин, 4-метилпиримидин, эфир 1,3-кетокарбоновой кислоты, синтон
С1, трехкомпонентная конденсация, молекулярная гибридизация, региоселлективность
DOI: 10.31857/S0514749221020129
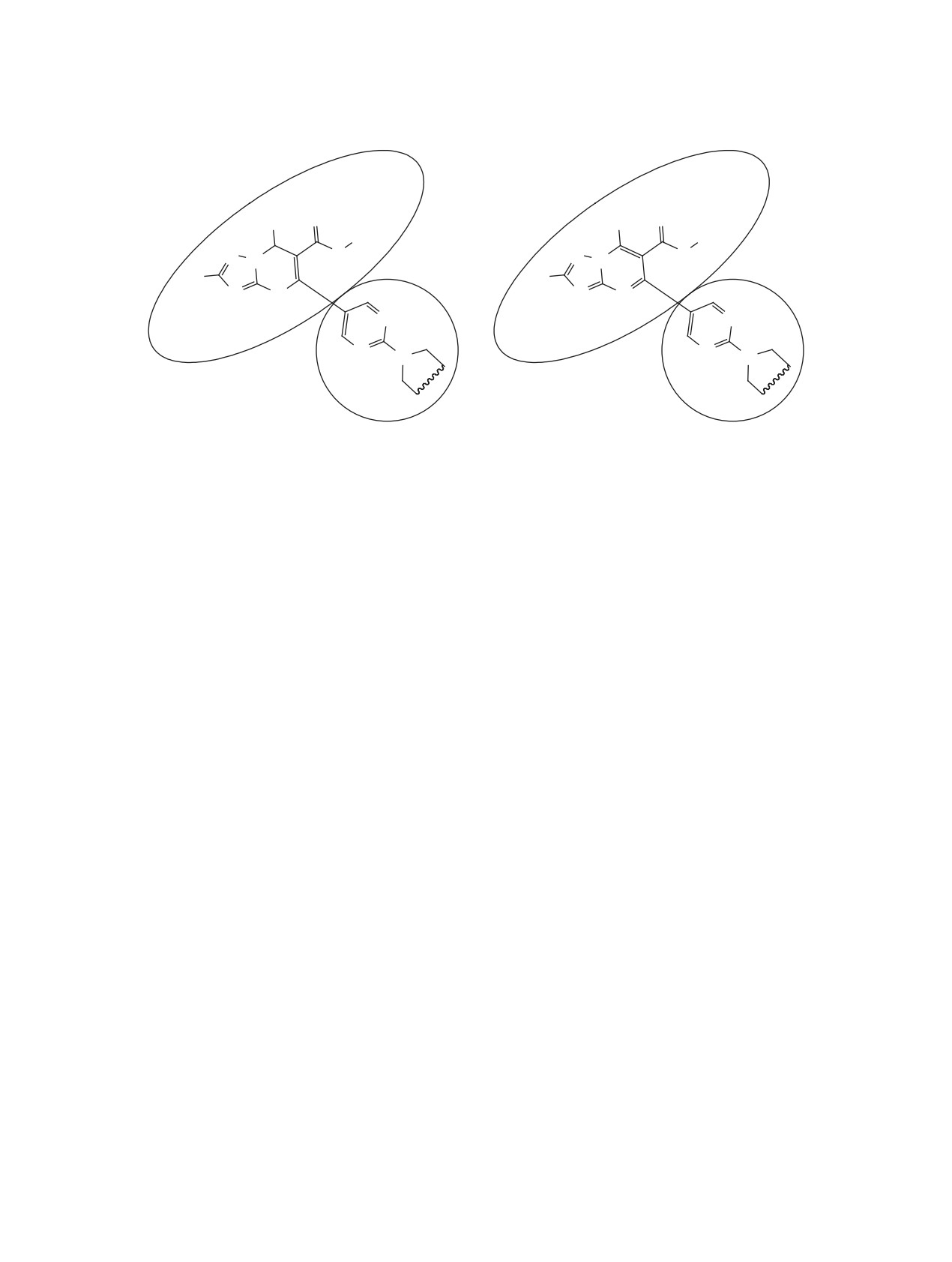
ВВЕДЕНИЕ
скаффолд, обладающий выраженными антибак-
териальными и противоопухолевыми свойствами
В контексте поиска новых гибридных мульти-
[2]. Более того, в последние годы производные
таргентных молекул [1], содержащих фрагменты,
1,2,4-триазоло[1,5-a]пиримидина рассматривают-
один из которых обладал бы антибактериальной,
ся как перспективные ингибиторы обратной транс-
а другой антикоагулянтной активностью, нами
криптазы ряда вирусов [3]. Вторым компонентом
предложено скомпилировать скаффолды 1,2,4-три-
системы выступает 4-метилпиримидиновый фраг-
азоло[1,5-a]пиримидина и 2-циклоалкиламиноза-
мент, замещенный в положение 2 циклическим
мещенного пиримидина (рис. 1).
амином и связанный с положением 5 триазолопи-
Первый компонент структуры - частично ги-
римидинового бицикла через свое положение 5
дрированный или гетероароматический бицикл
II. Такой скаффолд интересен, прежде всего как
1,2,4-триазоло[1,5-a]пиримидина I интересен, как
ингибитор эндотелин-превращающего фермента 1
259
260
ПОТАПОВ и др.
I
I
R2
O
R2
O
CH3
CH3
N
O
O
N
N N
R1
R1
N N
N N
H
N
N
N N
N N
II
II
Рис 1. Частично гидрированная и гетероароматическая гибридные молекулы 6-карбометокси-7-(2-аминозамещен-
ных-4-метилпиримидин-5-ил)-2-R1-1,2,4-триазоло[1,5-a]-пиримидинов
[4] и белка сосудистой адгезии [5] и, следователь-
ских протонов арильных циклов в области 6.88-
но, может рассматриваться как перспективный
7.60 м.д. и характерные сигналы протонов карбо-
для создания новых антикоагулянтов. Кроме того,
метокси групп при ~3.70 м.д. Сигналы протонов
4-метилпиримидины, замещенные в положение 2
NH- и СН-групп новообразованного пиримиди-
циклическими аминами могут выступать в каче-
нового цикла видны при ~12.00 и 5.45 м.д. соот-
стве активаторов рецептора инсулиноподобного
ветственно. Сигналы протонов триазольного и
фактора роста [6] и ингибитора некоторых фосфо-
пиримидинового циклов присутствуют в области
диэстераз [7].
7.82 и 8.79 м.д., соответственно. В масс-спектрах
веществ
4a-d наблюдаются соответствующие
Трехкомпонентные реакции 1,3-дикарбониль-
пики протонированных молекулярных ионов. На
ных соединений с 3-амино-1,2,4-триазолами и аль-
основании этих данных синтезированным продук-
дегидами [8-12] или с ортоформиатами или диме-
там реакции можно приписать структуру метило-
тилацеталем диметилформамида (ДМФДМА) [9,
вых эфиров
5-(4-метил-2-R-пиримидин-5-ил)-7-
13-15] описаны в литературе и являются удобны-
арил-4,7-дигидро[1,2,4]триазоло[1,5-a]пирими-
ми методами для формирования полизамещенных
триазолопиримидиновых систем.
дин-6-карбоновых кислот 4a-d.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
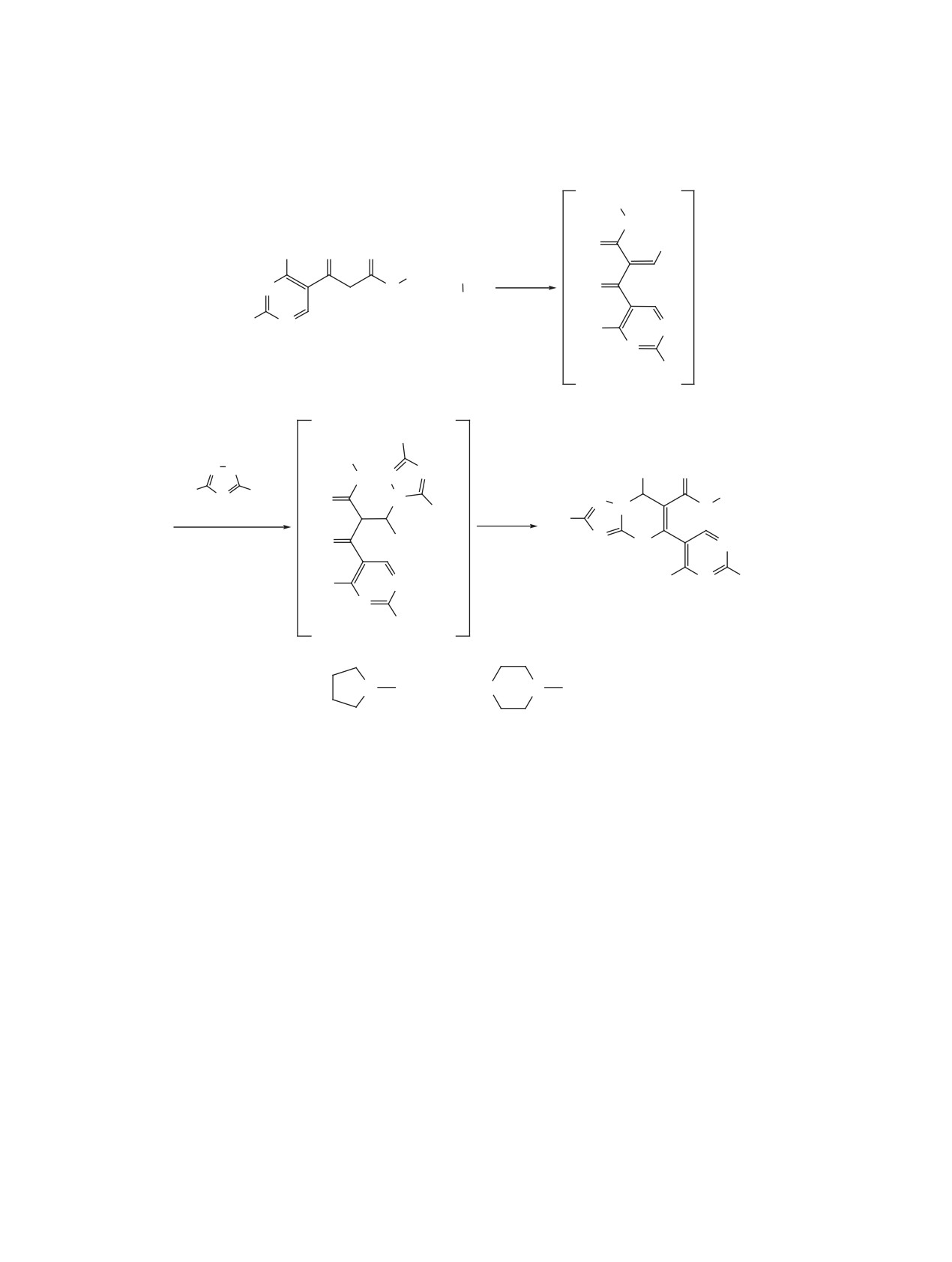
Предполагается, что данное взаимодействие
начинается с конденсации эфиров 1 с альдегида-
В данной работе мы распространили это вза-
ми по типу реакции Кневенагеля с образованием
имодействие на синтезированные нами ранее
промежуточных арилиденовых производных A.
метиловые эфиры
3-(2-R-4-метилпиримидин-5-
Дальнейшее присоединение эндокциклической
ил)-3-оксопропионовых кислот
1a, b, которые
NH группы аминотриазолов 3 по двойной С=С
вводились в реакцию с ароматическими альдеги-
связи интермедиата A приводит к формированию
дами 2a, b и 5-R-3-амино-1,2,4-триазолами 3a, b
(схема 1). Как оказалось, длительное кипячение
промежуточного аддукта В. Последующая гетеро-
циклизация аддукта В по экзоциклической амино-
эквимолярной смеси реагентов в изопропиловом
группе аминотриазола приводит к конечным пири-
спирте или диоксане приводит к образованию
мидин-5-илтриазоло[1,5-a]пиримидинам 4.
продуктов реакции 4a-d, выделенных с выходами
48-64%. Существенного влияния природы раство-
При попытке синтеза в этой трехкомпонентой
рителя на выходы продуктов и время реакции не
конденсации 7-незамещенных эфиров 5-(4-метил-
наблюдалось.
2-R-пиримидин-5-ил)-4,7-дигидро[1,2,4]триазо-
В спектрах ЯМР 1Н соединений 4a-d наблю-
ло[1,5-a]пиримидин-6-карбоновых кислот с ис-
даются соответствующие сигналы ароматиче-
пользованием в качестве альдегидной компоненты
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
ТРЕХКОМПОНЕНТНЫЕ КОНДЕНСАЦИИ
261
Схема 1. Трехкомпонентная конденсация эфиров 3-(2-аминозамещенных-4-метилпиримидин-5-ил)-3-
оксопропионовых кислот с 5-R-3-амино-1,2,4-триазолами и ароматическими альдегидами
H3C
O
O
Ar
CH3
O
O
CH3
CHO
N
O
+
O
Ar
i-PrOH,
reflux
R1
N
H3C
N
N
1a, b
2a, b
R1
A
R2
H3C
N
NH
N
Ar O
O
N
R2
NH2
CH3
N
O
N
N
N
O
3a, b
NH2
R2
i-PrOH, reflux
O
Ar
N N
N
48-64%
H
H3C
N R1
H3C
N
N
4a-d
R1
B
R1 =
N
(1a, 4a, c);
O
N
(1b, 4b, d);
Ar = C6H5 (2a, 4a, b), 4-CH3O-C6H4 (2b, 4c, d), R2 = H (3a, 4a, c), CH3 (3b, 4b, d);
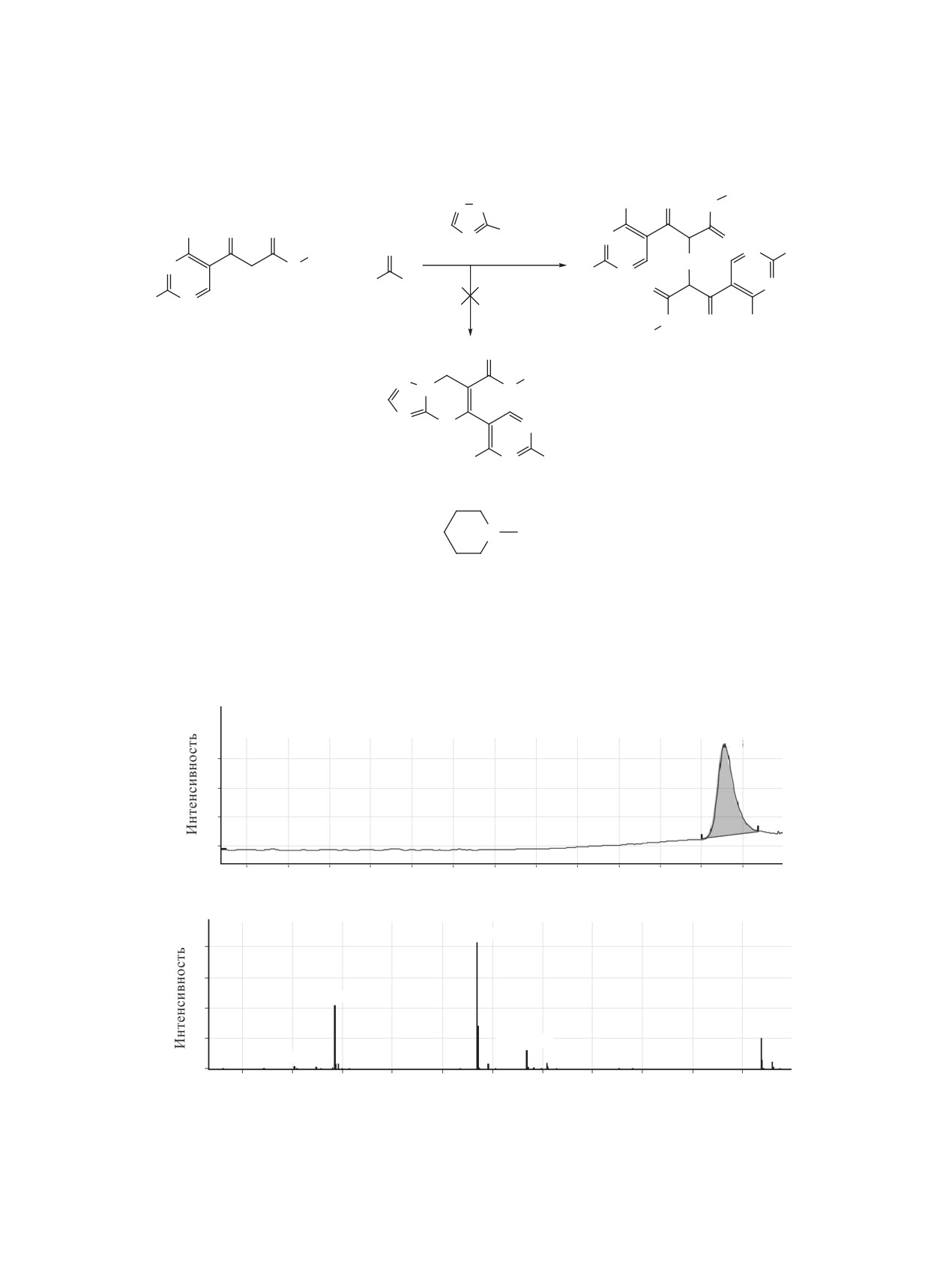
реакции формальдегида, целевые продукты полу-
При использовании в качестве аналога аль-
чены не были. Установлено, что основным про-
дегидной компоненты реакции ДМФДМА, во
дуктом этого взаимодействия является соедине-
взаимодействии с эфирами 3-(4-метил-2-R-пири-
ние 5 - продукт взаимодействия формальдеги-
мидин-5-ил)-3-оксопропионовых кислот 1a-c и
да с двумя молекулами метил
3-(2-пипери-
5-амино-1,2,4-триазолами 3a-c найдено, что ре-
дин-1-ил-4-метилпиримидин-5-ил)-3-оксопропио-
зультатом этой реакции является сложная трудно-
ната 1c (схема 2).
разделимая смесь веществ. Однако при последова-
тельном проведении процесса, удалось направить
В спектре ЯМР 1Н этого вещества присут-
взаимодействие в сторону образования трехком-
ствуют только характерные сигналы протонов
понентных продуктов реакции - метиловых эфи-
метил
3-(2-пиперидин-1-ил-4-метилпиримидин-
ров 7-(2-R-4-метилпиримидин-5-ил)-2-R1-[1,2,4]-
5-ил)-3-оксопропионата связанные метиленовой
триазоло[1,5-a]пиримидин-6-карбоновой кислоты
группой, сигнал протонов которой наблюдается
6a-e (схема 3).
в виде двух мультиплетов при 1.95-2.02 и 2.15-
2.19 м.д. Результаты масс-спектроскопического
В спектрах ЯМР 1Н полученных соединений 6
исследования этого соединения также свидетель-
наблюдаются синглетные сигналы протонов кар-
ствуют в пользу диметилового эфира 2,4-бис[(4-
бометоксигруппы в области 3.65-3.78 м.д. и сигна-
метил-2-пиперидин-1-илпиримидин-5-ил)карбо-
лы протонов новообразованного пиримидинового
нил]глутаровой кислоты 5 (рис. 2).
цикла при 8.82-9.39 м.д. Кроме того, в этих спек-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
262
ПОТАПОВ и др.
Схема 2. Синтез диметилового эфира 2,4-бис[(4-метил-2-пиперидин-1-илпиримидин-5-ил)карбонил]глутаровой
кислоты
CH3
N
NH
CH3
O O
CH3
O
O
NH2
N
N
O
O
N
R1
CH3
3a
H2C
N
O
+
R1
N
H H
i-PrOH
O
N
R1
N
reflux
O
O
CH3
H
3C
1с
O
5
CH3
N
N
O
N
N
N
H
H3C
N R1
R1 =
N
(1c, 5),
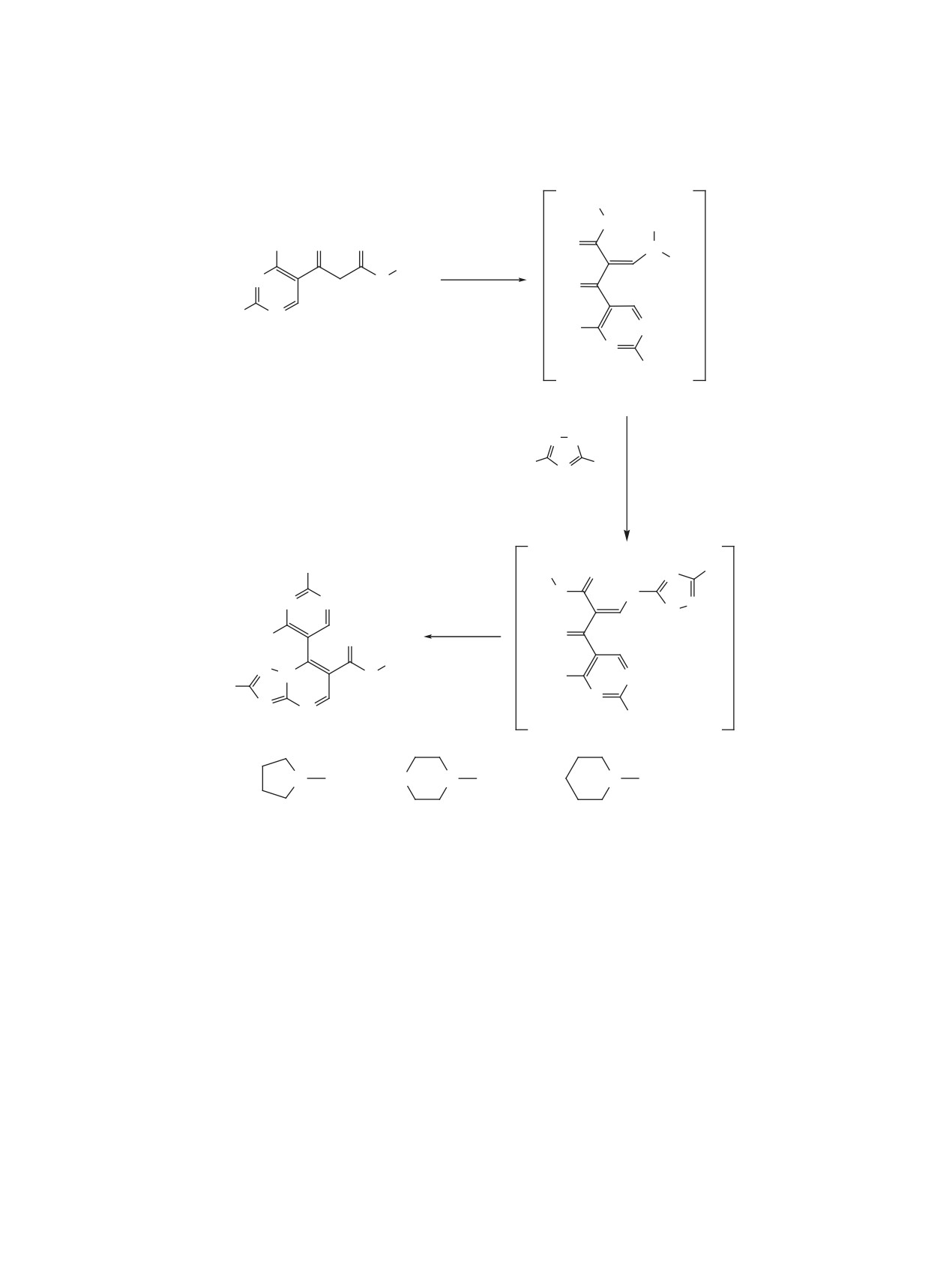
трах появляются сигналы протонов незамещен-
Предполагается, что образовавшийся на пер-
ного триазольного цикла (для веществ 6a, c) при
вом этапе енаминон B, взаимодействует с 5-ами-
8.24 м.д., а для остальных производных наблюда-
нотриазолом с отщеплением диметиламина, при-
ются сигналы протонов соответствующих триазо-
чем в этом взаимодействии участвует наиболее
льных заместителей.
реакционно-способная экзоциклическая амино-
×105
*6.266
4
3
2
1
0.5
1
1.5
2
2.5
3
3.5
4
4.5
5
5.5
6
6.5
τ, мин
×104
567.6435
4
3
284.3263
2
1
666.8104
204.2398
0
100
200
300
400
500
600
700
800
900
1000
1100
m/z, Да
Рис. 2. ВЖХМС анализ соединения 5
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
ТРЕХКОМПОНЕНТНЫЕ КОНДЕНСАЦИИ
263
Схема 3. Синтез метиловых эфиров 7-(2-аминозамещенных-4-метилпиримидин-5-ил)-2-R1-[1,2,4]триазоло-
[1,5-a]пиримидин-6-карбоновой кислоты
H3C
O
CH3
CH3
O
O
O
N
CH3
CH3
DMFDMA
N
O
i-PrOH,
O
reflux
R1
N
H3C
N
1a-c
N
R1
C
N
NH
R2
NH2
N
-NH(CH3)2
3a-c
i-PrOH,
reflux
R1
R2
H3C
O
N
O
HN
N N
N
N
H
H3C
O
O
–H2O
CH3
44-71%
N
N
O
H3C
N
R2
N
N
N
R1
6a-e
D
R1 =
N
(1a, 6e);
O
N
(1b, 6c, d);
N
(1c, 6a, b);
R2 = H (3a, 6a, c), C6H5 (3b, 6b, d), CH3S (3c, 6e).
группа аминотриазола. Реализовавшийся на этом
метод ионизации - двойное электрораспыление
этапе интермедиат С, претерпевает циклизацию
(dual-ESI). Запись и регистрация сигналов прово-
в конечный продукт 6, за счет взаимодействия
дилась в положительной полярности; небулайзер
эндоциклических амино- и карбонильной групп, с
(N2) 20 psig, газ-осушитель (N2) 6 мл/мин, 325°C;
отщеплением молекулы воды.
диапазон обнаружения масс составляет 50-2000
Дальтон. Напряжение на капилляре 4.0 кВ, фраг-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ментаторе +191 В, скиммере +66 В, OctRF 750 В.
Спектры ЯМР 1Н синтезированных соедине-
Условия хроматографирования: колонка Poroshell
ний регистрировались на спектрометре Bruker
120 EC-C18 (4.6×50 мм, 2.7 мкм). Градиентное
DRX-500 (500 МГц) в ДМСО-d6, внутренний стан-
элюирование: ацетонитрил-вода
(0.1% му-
дарт ТМС. Хроматографический анализ проводил-
равьиной кислоты), скорость потока 0.4 мл/мин.
ся на приборе Agilent Technologies 1260 infinity с
Программное обеспечение для обработки резуль-
масс-детектором Agilent 6230 TOF LC/MS (время-
татов исследований
- MassHunter Workstation/
пролетный детектор масс высогого разрешения),
Data Acquisition V.06.00. Температуры плавления
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
264
ПОТАПОВ и др.
определяли с помощью прибора «Stuart SMP30».
Метиловый эфир
5-(2-N-пирролидинил-4-
Контроль за индивидуальностью реагентов и по-
метилпиримидин-5-ил)-7-(4-метоксифенил)-
лученных веществ, а также за ходом реакции осу-
4,7-дигидро[1,2,4]триазоло[1,5-a]пиримидин-
ществляли методом ТСХ на пластинах Merck TLC
6-карбоновой кислоты
(4с). Выход
0.86 г
Silica gel 60 F254 в системе CHCl3-MeОН, 10:1
(48%), белые мелкие иголки, т.пл. 189-191°C.
(проявление хроматограмм в УФ свете).
Cпектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.49-1.55
м (4Н, CH2CH2пирролид), 2.59 с (3H, CH3), 3.60 с
Исходные
3-(2-R-4-метилпиримидин-5-ил)-3-
(3Н, СН3О), 3.70 с (3Н, СН3О), 3.81-3.92 м (4Н,
оксопропионовые кислоты 1a-с были синтезиро-
CH2NCH2), 5.45 с (1Н, СН), 6.91 д (2Наром, J
ваны по методике, описанной в нашей предыду-
7.8 Гц), 7.21 д (2Наром, J 7.8 Гц), 7.82 с (1Нтриаз),
щей работе [16].
8.79 с (1Н, Hпиримид), 11.98 с (1Н, NH) Масс-
Метиловый эфир
5-(4-метил-2-R-пирими-
спектр, m/z: 448.2088 [М + Н]+. C23H25N7O3. [M +
дин-5-ил)-7-арил-4,7-дигидро[1,2,4]триазоло-
H]+ 448.2093.
[1,5-a]пиримидин-6-карбоновой кислоты 4a-d
Метиловый эфир 2-метил-5-(2-N-морфоли-
(общая методика). Смесь 4 ммоль эфира 3-(2-R-4-
лил-4-метилпиримидин-5-ил)-7-(4-метоксифе-
метилпиримидин-5-ил)-3-оксопропионовой кис-
нил)-4,7-дигидро[1,2,4]триазоло[1,5-a]пирими-
лоты 1a, b, 4 ммоль альдегида 2a, b, и 4 ммоль
дин-6-карбоновой кислоты (4d). Выход 1.03 г
3-амино-1,2,4-триазола 3a, b кипятили с обратным
(54%), белые мелкие иголки, т.пл. 189-200°C.
холодильником в 5 мл изопропилового спирта в
Cпектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2.05 с (3Н,
течение 4 ч. Выпавший после охлаждения реакци-
СН3), 2.59 с (3H, CH3), 3.60 с (3Н, СН3О), 3.70 с
онной массы осадок фильтровали, промывали изо-
(3Н, СН3О), 3.81 т (4Н, CH2NCH2морф, J 8.2 Гц),
пропиловым спиртом и перекристаллизовывали из
3.97 т (4Н, CH2ОCH2морф, J 8.2 Гц), 5.45 с (1Н,
смеси изопропиловый спирт-диметилформамид.
СН), 6.90 д (2Наром, J 7.8 Гц), 7.20 д (2Наром, J
Метиловый эфир
5-(2-N-пирролидинил-4-
7.8 Гц), 8.78 с (1Нпиримид), 11.97 с (1Н, NH). Масс-
метилпиримидин-5-ил)-7-фенил-4,7-дигидро-
спектр, m/z: 478.2194 [М + Н]+. C24H27N7O4. [М +
[1,2,4]триазоло[1,5-a]пиримидин-6-карбоно-
Н]+ 478.2199.
вой кислоты
(4a). Выход
1.07 г
(64%), бе-
Диметиловый эфир 2,4-бис[(2-N-пипериди-
лые мелкие иголки, т.пл.
195-197°C. Cпектр
нил-4-метилпиримидин-5-ил)карбонил]глута-
ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.49-1.55 м (4Н,
ровой кислоты (5). Смесь 4 ммоль эфира 3-(2-R-4-
CH2CH2пирролид), 2.59 с (3H, CH3), 3.70 с (3Н,
метилпиримидин-5-ил)-3-оксопропионовой кис-
СН3О), 3.81-3.92 м (4Н, CH2NCH2), 5.45 с (1Н,
лоты 1c, 4 ммоль 40%-го раствора формалина, и
СН), 6.93 т (1Наром, J 7.8 Гц), 7.19-7.23 м (2Наром),
4 ммоль аминотриазола 3а кипятили с обратным
7.58-7.61 м (2Наром), 7.82 с (1Н, Hтриаз), 8.79 с
холодильником в 5 мл изопропилового спирта,
(1Н, Hпиримид), 11.98 с (1Н, NH). Масс-спектр, m/z:
в течение 2 ч. Выпавший из реакционной массы
418.1995 [М + Н]+. C22H23N7O2. [M + H]+ 418.1987.
осадок фильтровали и промывали изопропиловым
Метиловый эфир 2-метил-5-(2-N-морфоли-
спиртом. Выход 1.03 г (54%), белое аморфное веще-
ство, т.пл. 211-213°C. Cпектр ЯМР 1Н (ДМСО-d6),
лил-4-метилпиримидин-5-ил)-7-фенил-4,7-ди-
δ, м.д.: 1.49-1.71 м (12Н, 2CH2CH2CH2пиперид),
гидро[1,2,4]триазоло[1,5-a]пиримидин-6-карбо-
1.95-2.02 м (1Н, СН2), 2.15-2.19 м (1Н, СН2), 2.56
новой кислоты (4b). Выход 1.04 г (60%), белые
с (2H, 2CH3), 3.69 с (6Н, 2СН3О), 3.80-3.94 м (8Н,
мелкие иголки, т.пл. 184-186°C. Cпектр ЯМР 1Н
2CH2NCH2), 5.14-5.16 м (2Н, 2СН), 8.59 с (2Н,
(ДМСО-d6), δ, м.д.: 2.06 с (3Н, СН3), 2.59 с (3H,
Hпиримид). Масс-спектр, m/z: 567.2936 [М + Н]+.
CH3), 3.70 с (3Н, СН3О), 3.82 т (4Н, CH2NCH2морф,
C29H38N6O6. [М + Н]+ 567.2928.
J 8.2 Гц), 3.98 т (4Н, CH2ОCH2морф, J 8.2 Гц), 5.45
с (1Н, СН), 6.95 т (1Наром, J 7.8 Гц), 7.22-7.25 м
Метиловый эфир 7-[2-(N-пирролидинил)-4-
(2Наром), 7.57-7.61 м (2Наром), 8.79 с (1Н, Hпиримид),
метилпиримидин-5-ил]-[1,2,4]триазоло[1,5-a]-
11.98 с (1Н, NH). Масс-спектр, m/z: 448.2098 [М +
пиримидин-6-карбоновой кислоты
6а-е (об-
Н]+. C23H25N7O3. [M + H]+ 448.2093.
щая методика). Смесь 6 ммоль эфира 3-(2-R-4-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
ТРЕХКОМПОНЕНТНЫЕ КОНДЕНСАЦИИ
265
метилпиримидин-5-ил)-3-оксопропионовой кис-
δ, м.д.: 2.13 с (3H, CH3), 3.75 т (4H, CH2NCH2, J
лоты 1a-c, 6 ммоль диметилацеталя диметилфор-
5.0 Гц), 3.78 с (3H, CH3O), 3.86 т (4H, CH2OCH2,
мамида кипятили с обратным холодильником в
J 5.5 Гц), 7.12 т (1Hаром, J 7.4 Гц), 7.40 т (2Hаром, J
6 мл изопропилового спирта, в течение 2 ч. К ох-
8.1 Гц), 7.76 д (2Hаром, J 8.1 Гц), 8.21 с (1H,
лажденной реакционной массе добавляли 5 ммоль
CHпирим), 8.84 с (1H, CHпирим). Масс-спектр, m/z:
соответствующего
5-амино-1,2,4-триазола
3a-c.
432.1788 [М + Н]+. C22H21N7O3. [М + Н]+ 432.1780.
Выпавший после охлаждения реакционной массы
Метиловый эфир
7-[2-(N-пирролидинил)-
осадок фильтровали, промывали изопропиловым
4-метилпиримидин-5-ил]-2-метилмеркапто-
спиртом и перекристаллизовывали из смеси изо-
1,2,4-триазоло[1,5-a]пиримидин-6-карбоновой
пропиловый спирт - диметилформамид.
кислоты (6е). Выход 1.01 г (44%), белое аморф-
ное вещество, т.пл. 161-163°C. Cпектр ЯМР 1Н
Метиловый эфир 7-[2-(N-пиперидил)-4-ме-
тилпиримидин-5-ил]-1,2,4-триазоло[1,5-a]пи-
(ДМСО-d6), δ, м.д.: 1.53-1.60 м (4Н, CH2CH2), 2.15
с (3H, CH3), 2,38 с (3H, CH3S), 3.78 т (4H, CH2NCH2,
римидин-6-карбоновой кислоты
(6а). Выход
J 5.8 Гц), 3.77 с (3H, CH3O), 8.76 с (1H, CHпирим),
1.20 г (59%), белое аморфное вещество, т.пл. 182-
8.87 с (1H, CHпирим). Масс-спектр, m/z: 386.1388
185°C. Cпектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.51-
[М + Н]+. C17H19N7O2S. [М + Н]+ 386.1395.
1.56 м (6H, CH2CH2CH2), 2.16 с (3H, CH3), 3.65 т
(4H, CH2NCH2, J 5.0 Гц), 3.74 с (3H, CH3O), 8.24
ВЫВОДЫ
с (1H, CHтриаз), 8.73 с (1H, CHпирим), 9.31 с (1H,
Был разработан удобный синтетический под-
CHпирим). Масс-спектр, m/z: 354.1670 [М + Н]+.
ход к полизамещенным дигидро- или гетероаро-
C17H19N7O2. [М + Н]+ 354.1674.
матическим
1,2,4-триазоло[1,5-a]пиримидинам,
Метиловый эфир
7-[2-(N-пиперидил)-4-
содержащим в положении 5 4-метилпиримидино-
метилпиримидин-5-ил]-2-фенил-1,2,4-триазо-
вый фрагмент, замещенный в положение 2 цикли-
ло[1,5-a]пиримидин-6-карбоновой
кислоты
ческим амином и связанный с триазолопирими-
(6b). Выход 1.53 г (69%), белое аморфное веще-
диновым бициклым через свое положение 5. Это
ство, т.пл. 268-270°C. Cпектр ЯМР 1Н (ДМСО-d6),
позволяет создать целевую библиотеку новых ги-
δ, м.д.: 1.51-1.57 м (6H, CH2CH2CH2), 2.16 с (3H,
бридных молекул, содержащих в своей структуре
CH3), 3.76 т (4H, CH2NCH2, J 5.0 Гц), 3.73 с (3H,
два привилегированных скаффолда, один из кото-
CH3O), 7.02 т (1Hаром, J 7.4 Гц), 7.31 т (2Hаром, J
рых обладал бы антибактериальной, а другой ан-
8.1 Гц), 7.73 д (2Hаром, J 8.1 Гц), 8.78 с (1H,
тикоагулянтной активностью.
CHпирим), 9.39 с (1H, CHпирим). Масс-спектр, m/z:
ФОНДОВАЯ ПОДДЕРЖКА
430.1995 [М + Н]+. C23H23N7O2. [М + Н]+ 430.1987.
Исследование выполнено за счет гранта
Метиловый эфир 7-[2-(N-морфолилил)-4-ме-
Российского научного фонда (проект № 18-74-
тилпиримидин-5-ил]-1,2,4-триазоло[1,5-a]пи-
10097).
римидин-6-карбоновой кислоты
(6c). Выход
КОНФЛИКТ ИНТЕРЕСОВ
1.13 г (53%), белое аморфное вещество, т.пл. 268-
270°C. Cпектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2.14 с
Авторы заявляют об отсутствии конфликта ин-
(3H, CH3), 3.72 т (4H, CH2NCH2, J 5.0 Гц), 3.78 с
тересов.
(3H, CH3O), 3.84 т (4H, CH2OCH2, J 5.0 Гц), 8.24
СПИСОК ЛИТЕРАТУРЫ
с (1H, CHтриаз), 8.75 с (1H, CHпирим), 8.82 с (1H,
1. Kumar H.M.S., Herrmann L., Tsogoeva S.B. Bioorg.
CHпирим). Масс-спектр, m/z: 356.1466 [М + Н]+.
Med. Chem. Lett. 2020, 30, 127514. doi 10.1016/
C16H17N7O3. [М + Н]+ 356.1466.
j.bmcl.2020.127514
Метиловый эфир
7-[2-(N-морфолилил)-4-
2. Singh P.K., Choudhary S., Kashyap A., Verma H., Ka-
метилпиримидин-5-ил]-2-фенил-1,2,4-триазо-
pil S., Kumar M., Arora M., Silakari О. Bioorg. Chem.
ло[1,5-a]пиримидин-6-карбоновой
кислоты
2019, 88, 102919. doi 10.1016/j.bioorg.2019.102919
(6d). Выход 1.53 г (71%), белое аморфное веще-
3. Desantis J., Massari S., Corona A., Astolfi A., Sabati-
ство, т.пл. 202-204°C. Cпектр ЯМР 1Н (ДМСО-d6),
ni S., Manfroni G., Palazzotti D., Cecchetti V., Panne-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
266
ПОТАПОВ и др.
couque Ch., Tramontano E., Tabarrini O. Molecules.
10. Липсон В.B., Орлов В.Д., Десенко С.М., Шишки-
2020, 25, 1183. doi 10.3390/molecules25051183
на C.В., Шишкин O.B., Широбокова М.Г. ХГС.
2000, 36, 1190-1196. [Lipson V.V., Orlov V.D., Desen-
4. Berger Y., Dehmlow H., Blum-Kaelin D., Kitas E.A.,
ko S.M., Shishkin O.V., Shishkina S.V., Shiroboko-
Löffler B.-M., Aebi J.D., Juillerat-Jeanneret L. J. Med.
va M.G. Chem. Heterocycl. Compd. 2000, 36, 1039-
Chem. 2005, 48, 483-498. doi 10.1021/jm040857x
1043.] doi 10.1023/A:1002777714158
5. Yamaki S., Koga Y., Nagashima A., Kondo M., Shi-
mada Y., Kadono K., Moritomo A., Yoshihara K.
11. Липсон В.В., Бородина В.В., Широбокова М.Г. Укр.
хим. журн. 2005, 71, 95-99.
Bioorg. Med. Chem.
2017,
25,
4110-4122. doi
10.1016/j.bmc.2017.05.059
12. Shaabani A., Rahmati A., Farhang E., Rezayan A.H.
6. Kumar C.V., Kavitake S., Kumar S.S., Cornwall P.,
Monatsh. Chem. 2007, 138, 615-618. doi 10.1007/
s00706-007-0641-2
Ashok M., Bhagat S., Manjunatha S.G., Nam-
biar S. Org. Process Res. Dev. 2012, 16, 1416-1421.
13. Крыльский Д.В., Шихалиев Х.С., Потапов А.Ю.
doi 10.1021/op300120r
Изв. вузов. Хим. и хим. технол. 2005, 48, 72-74.
7. Sakamoto T., Koga Y., Hikota M., Matsuki K., Muraka-
14. Шихалиев Х.С., Крыльский Д.В., Потапов А.Ю.,
mi M., Kikkawa K., Fujishige K., Kotera J., Omori K.,
Крысин М.Ю. Изв. РАН. Серия хим. 2005, 54, 2805-
Morimoto H., Yamada K. Bioorg. Med. Chem. Lett.
2806. [Shikhaliev Kh.S., Kryl’skii D.V., Potapov A.Yu.,
2014, 24, 5460-5465. doi 10.1016/j.bmcl.2014.10.008
Krysin M.Yu. Russ. Chem. Bull. 2005, 54, 2903-2904.]
doi 10.1007/s11172-006-0207-1
8. Липсон В.В., Десенко С.М., Широбокова М.Г.,
Бородина В.В. ХГС. 2003, 39, 1383-1387. [Lip-
15. Титова Ю.А., Филатова Е.С., Федорова О.В., Руси-
son V.V., Desenko S.M., Shirobokova M.G., Borodi-
нов Г.Л., Чарушин В.Н. ЖОрХ. 2019, 55, 871-878.
na V.V. Chem. Heterocycl. Compd. 2003, 39, 1213-
[Titova Yu.A., Filatova E.S., Fedorova O.V., Rusi-
1217.] doi 10.1002/chin.200420157
nov G.L., Charushin V.N. Russ. J. Org. Chem. 2019,
55, 775-781.] doi 10.1134/S0514749219060065
9. Липсон В.B., Десенко С.М., Шишкина C.В., Широ-
бокова М.Г., Шишкин O.B., Орлов В.Д. ХГС. 2003,
16. Потапов А.Ю., Фалалеев А.В., Шихалиев Х.С.,
39, 1190-1196. [Lipson V.V., Desenko S.M., Shishki-
Шаталов Г.В. Изв. РАН. Серия хим. 2014, 63, 2198-
na S.V., Shirobokova M.G., Shishkin O.V., Orlov V.D.
2200. [Potapov A.Yu., Falaleev A.V., Shikhaliev Kh.S.,
Chem. Heterocycl. Compd. 2003, 39, 1041-1047.] doi
Shatalov G.V. Russ. Chem. Bull. 2014, 63, 2198-2200.]
10.1023/B:COHC.0000003522.71893.77
doi 10.1007/s11172-014-0720-6
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
ТРЕХКОМПОНЕНТНЫЕ КОНДЕНСАЦИИ
267
Three-Component Condencations of 3-Amino-1,2,4-triazoles,
Methyl 3-(2-Amino-Substituted-4-methylpyrimidin-5-yl)-
3-oxopropionoates and a Serie of C1-Synthone Compounds
as the Convenient Approach to Pyrimidin-5-yl-1,2,4-
triazolo[1,5-a]pyrimidines
A. Yu. Potapovа, *, V. A. Polikarchukа, B. V. Paponovb, I. V. Ledenyovaа,
N. V. Stolpovskayaа, D. V. Kryl’skiic, and Kh. S. Shikhalievа
a Voronezh State University, Universitetskaya pl., 1, Voronezh, 394006 Russia
*e-mail: pistones@mail.ru
b Belgorod National Research University, ul. Pobedy, 85, Belgorod, 308015 Russia
c Research Institute of Applied Acoustics, ul. 9 Maya, 7A, Dubna, 141981 Russia
Received December 2, 2020; revised December 11, 2020; accepted December 14, 2020
A convenient synthetic approach to polysubstituted dihydro or heteroaromatic 1,2,4-triazolo[1,5-a]pyrimidines
derivatives containing at position 5 a 4-methylpyrimidine moiety substituted at position 2 with a cyclic amines
and linked to the triazolopyrimidine bicycle through its position 5 was developed as a set of three-component
condensations of 3-amino-1,2,4-triazoles, methyl ester of 3-(2-R-4-methylpyrimidin-5-yl) -3-oxopropionic acid
and a series of C1 synthons. A series of aromatic aldehydes, triethylorthoformate or DMFDMA were used as
synthetic equivalents of C1 synthons.
Keywords: triazolopyrimidine, 4-methylpyrimidine, 1,3-ketocarboxylic acid ester, synthon C1, three-component
condensation, molecular hybridization, regioselectivity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021