ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 2, с. 268-279
УДК 547.1-304.2, 547.478.41
СИНТЕЗ ХИРАЛЬНЫХ ЛИГАНДОВ НА ОСНОВЕ
1-(АДАМАНТАН-1-ИЛ)ЭТАН-1,2-ДИАМИНА
© 2021 г. П. А. Маньковаa, *, А. Н. Резниковa, В. А. Ширяевa, М. Р. Баймуратовa,
В. Б. Рыбаковb, Ю. Н. Климочкинa
a ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
*e-mail: manja1910@yandex.ru
b ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
Россия, 119991 Москва, Ленинские горы, 1/3
Поступила в редакцию 21.11.2020 г.
После доработки 28.11.2020 г.
Принята к публикации 29.11.2020 г.
Восстановлением оксима 1-(адамантан-1-ил)-2-азидоэтан-1-она LiAlH4 получен рацемический 1-(ада-
мантан-1-ил)этан-1,2-диамин и проведена его раскристаллизация l-винной кислотой. Полученный с
выходом 20% индивидуальный энантиомер дериватизирован в 4-(адамантан-1-ил)имидазолидин-2-тион,
для которого установлена абсолютная конфигурация методом РСА и с помощью ВЭЖХ определен энан-
тиомерный избыток, который составил 96%. На основе рацемического и хирального (1S)-1-(адамантан-
1-ил)этан-1,2-диаминов синтезированы лиганды диаминового и дииминового строения, каталитическая
активность комплексов которых с Ni(II), Cu(II) и Mn(II) изучена на модельных реакциях Михаэля, Анри
и эпоксидирования.
Ключевые слова: вицинальные диамины, адамантан, хиральность, лиганды
DOI: 10.31857/S0514749221020130
ВВЕДЕНИЕ
металлов, таких как Ti, Zr, V, Mn, Fe, Cu, Co, Ni
и др. [10-15]. Отмечена перспективность металл-
Нерацемические вицинальные диамины и их
органических координационных полимеров, син-
производные, а также комплексы таких лигандов
тезированных из хиральных лигандов саленового
с переходными металлами активно применяются
типа и проявляющих каталитическую активность
как хиральные катализаторы в асимметрических
в реакции эпоксидирования [16]. Комплексы са-
синтезах. Хиральные органокатализаторы диами-
ланового строения (VII) оказались более гидро-
нового (I), диамидного (II) и дисульфамидного
литически стабильными катализаторами, чем их
(III) строения (рис. 1) способны энантиоселек-
саленовые аналоги (VI) (рис. 1). Также некоторые
тивно катализировать альдольную конденсацию,
платиновые хелаты проявляют противораковую
реакции Михаэля, Манниха, Дильса-Альдера, ал-
активность и низкую токсичность по сравнению
лилирования и др. [1]. Стоит выделить симметрич-
с другими Pt-соединениями, применяющимися в
ные хиральные катализаторы типа IV и V (рис. 1),
противоопухолевой химиотерапии [17-20].
способствующие энантиоселективному присое-
динению по Михаэлю, а также α-аминированию
Хиральные 1,2-диамины используются в каче-
α-цианокетонов [2-9]. Оптически активные сале-
стве оптически активных расщепляющих реаген-
новые комплексы (VI) (рис. 1) являются одними из
тов рацемических соединений [21, 22] и как вспо-
самых универсальных асимметрических катализа-
могательные сольватирующие агенты для опре-
торов и координируют широкий ряд переходных
деления энантиомерной чистоты хиральных кар-
268
СИНТЕЗ ХИР
АЛЬНЫХ ЛИГАНДОВ
269
Ar
SO2CF3
NH2
N
Ph
NH
CHO
CHO
NH2
N
Ph
NH
SO2CF3
Ar
I
II
III
Bn
Bn
Bn
Bn
Ph
NH
Br
HN
Ph
NH
Br
HN
Ni
Ni
Ph
NH
Br
HN Ph
NH
Br
HN
Bn
Bn
Bn
Bn
IV
V
R1
R1
R1
R1
N
N
NH NH
R2
M
R2
M
O O
O O
L
L
R2
R2
VI
VII
Рис. 1. Хиральные органокатализаторы и металлокомплексные катализаторы диаминового строения
боновых кислот с помощью ЯМР-спектроскопии
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
[23]. Молекулы с вицинально расположенными
Органические комплексы, имеющие в своей
аминогруппами зарекомендовали себя как удоб-
структуре каркасные фрагменты, демонстрируют
ные исходные соединения в синтезе гетероцикли-
высокую каталитическую активность в асимме-
ческих систем [24-26], а также подобные струк-
трических реакциях [34-36], что делает перспек-
турные фрагменты входят в состав некоторых био-
тивным изучение вицинальных диаминов с али-
логически активных молекул [27].
циклическим фрагментом, таким как адамантан, в
качестве исходных соединений для синтеза лиган-
Вицинальные диамины адамантанового ряда
дов. Объектом исследования выбран 1-(адаман-
нашли применение как предшественники в син-
тан-1-ил)этан-1,2-диамин
(4). Нами предложен
тезе молекул с трипаноцидным и противовирус-
новый подход к синтезу диамина 4 из 1-(адаман-
ным действием [28, 29], также описаны способы
тан-1-ил)-2-азидоэтан-1-она (1) [37] (схема 1). На
получения некоторых из каркасных 1,2-диаминов
первой стадии получен азидооксим 2 реакцией ази-
[28-32].
докетона 1 с гидроксиламином, далее проводили
На данный момент существуют подходы к по-
восстановление алюмогидридом лития в среде абсо-
лучению разнообразных вицинальных диаминов
лютного диэтилового эфира. 1-(Адамантан-1-ил)-
[10, 33], однако данные методы применимы лишь
этан-1,2-диамин дигидрохлорид
[(RS)-3·2HCl]
получен в виде рацемической смеси с суммарным
для конкретных субстратов, а получение прекур-
выходом 53% за две стадии. Для дальнейших пре-
соров вицинальных диаминов зачастую требует
вращений диамин (RS)-3·2HCl переводили в сво-
сложных условий и мало доступных реагентов, в
бодное основание 3.
связи с этим растет необходимость поиска новых
и эффективных методов синтеза вицинальных ди-
Для разделения (RS)-3 на энантиомеры приме-
аминов каркасного строения.
няли метод раскристаллизации. В качестве рас-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
270
МАНЬКОВА и др.
Схема 1
1. LiAlH4, Et2O
NH2OH·HCl, AcONa·3H2O,
0°C-rt, 4 ч
EtOH-H2O, ∆, 6 ч
2. HCl
N3
N
NH2
3
2HCl
O
NH2
N OH
1
2
(RS)-3·2HCl
щепляющего реагента использовались l-винная,
аминов
[39,
40]. При модификации диамина
(2R,3R)-дибензоилвинная и d-камфорсульфоновая
(RS)-3 этилхлорформиатом получен дикарбамат
кислоты, однако успешный результат был получен
(RS)-4 (схема 2), для которого не удалось подо-
лишь с помощью l-винной кислоты путем трех по-
брать условий разделения энантиомеров методом
следовательных кристаллизаций тартратной соли
ВЭЖХ. В связи с этим была проведена дериватиза-
диамина в смеси вода-этанол [38]. Выход энанти-
ция диамина (RS)-3 сероуглеродом с получением
омерно обогащенного диамина (S)-3 составил 20%
имидазолидин-2-тиона (RS)-5, имеющего конфор-
(схема 2).
мационно жесткий гетероциклический фрагмент,
Энантиомерная чистота нерацемических ди-
что позволило осуществить разделение (рис. 2).
аминов определяется с помощью обращенно-фа-
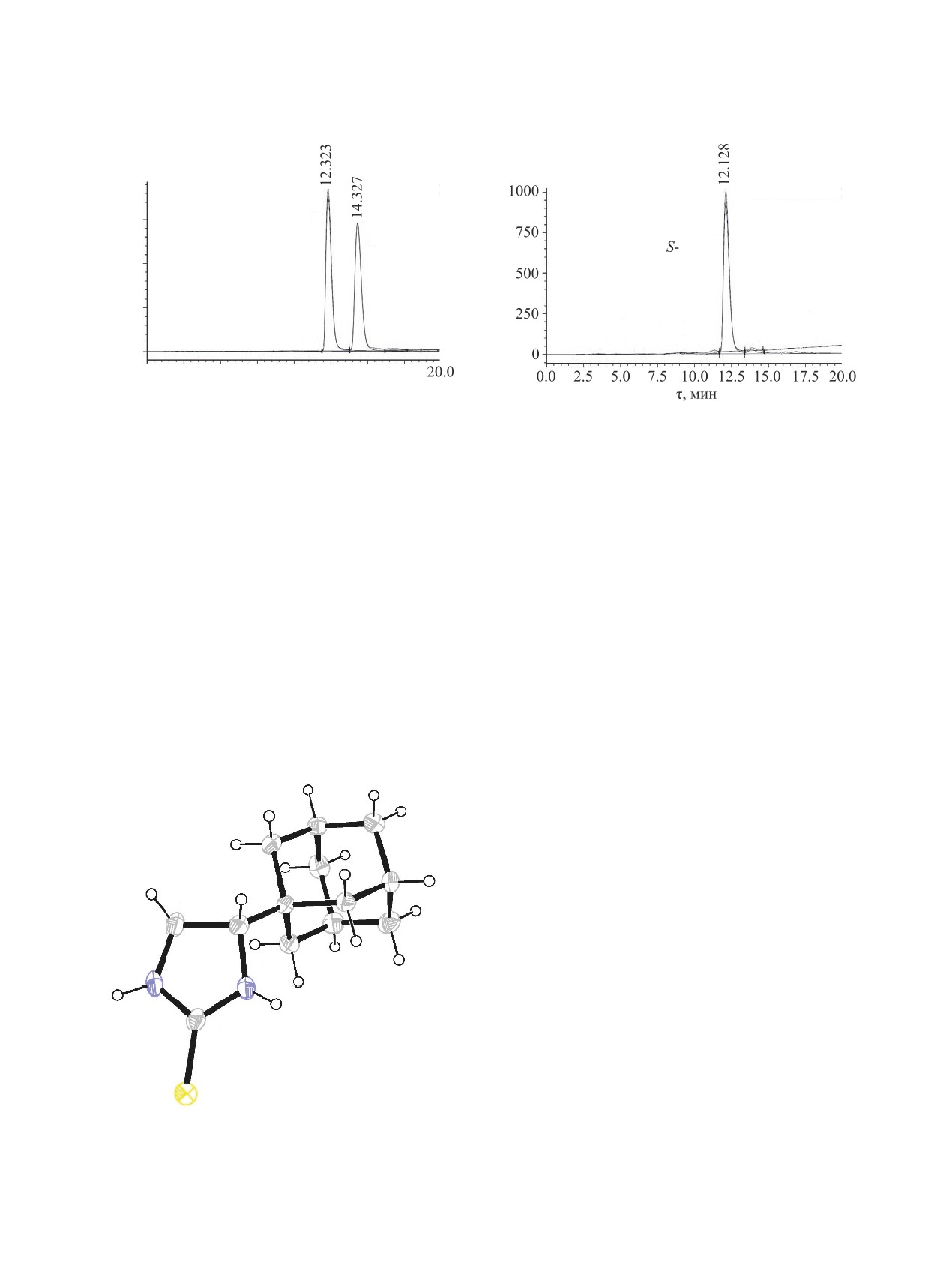
Методом ВЭЖХ установлен энантиомерный из-
зовой ВЭЖХ, при этом часто используют предва-
быток
4-(адамантан-1-ил)имидазолидин-2-тиона
рительную дериватизацию. Описано применение
[(S)-5] равный 96% (рис. 3). Благодаря явлению
м-метилбензоилхлорида и ацетилацетона для де-
аномального рассеяния рентгеновских лучей,
риватизации циклогексан-, этан- и пропан-1,2-ди-
которое проявляется в присутствии «тяжелого»
Схема 2
COOEt
N
H
NH
COOEt
(RS)-4
2ClCOOEt,
THF-H2O,
K2CO3
rt, 4 ч
1. L-винная кислота,
NaOH
EtOH-H2O
NH2
NH2
NH2
H2O, rt
2. NaOH, H2O,
2HCl
rt
NH2
NH2
NH2
(RS)-3∙2HCl
(RS)-3
(S)-3
1. CS2, EtOH-H2O,
2. HCl
1. CS2, EtOH-H2O,
2. HCl,
∆, 3 ч
∆, 6 ч
∆, 3 ч
∆, 6 ч
NH
NH
HN
HN
S
S
(RS)-5
(S)-5
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
СИНТЕЗ ХИР
АЛЬНЫХ ЛИГАНДОВ
271
U, мВ
U, мВ
1500
S-
R-
1000
500
0
0.0
2.5
5.0
7.5
10.0
12.5
15.0
17.5
τ, мин
Рис. 2. Хроматограмма 4-(адамантан-1-ил)имидазоли-
Рис 3. Хроматограмма (4S)-4-(адамантан-1-ил)имида-
дин-2-тиона [(RS)-5]
золидин-2-тиона [(S)-5]
атома серы в молекуле (S)-5, удалось однозначно
(S)-3 синтезирован диимин саленового типа (S)-9
установить его абсолютную (4S)-конфигурацию
(схема 4).
{параметр Флэка χ = 0.00(2) [41]} (рис. 4).
Комплекс 8, полученный взаимодействием без-
В ходе работы синтезированы потенциальные
водного бромида никеля(II) с диамином (RS)-3,
лиганды для асимметрического синтеза (схема 3).
интересен как катализатор в реакции Михаэля
N,N'-Дизамещенные имины (RS)-6 и (S)-6 полу-
[2-8], однако при проведении модельной реакции
чены в ходе взаимодействия диаминов (RS)-3 и
диэтилмалоната с β-нитростиролом в присутствии
(S)-3 c бензальдегидом. Восстановление связей
2 мол % комплекса не обнаружено продукта при-
C=N диимина (RS)-6 проводили боргидридом на-
соединения по Михаэлю как при комнатной темпе-
трия.
1-(Адамантан-1-ил)-N,N'-дибензилэтан-1,2-
ратуре, так и при нагревании (50°С).
диамин дигидрохлорид (7·2HCl) переводили в
Каталитическая активность комплексов (S)-3 и
свободное основание (RS)-7.
(S)-6 с Cu(II) была исследована в реакции Анри,
Взаимодействием
3,5-ди(трет-бутил)салици-
для которой используются катализаторы подобно-
го типа [43-45]. Из бензальдегида (11) и нитроме-
лового альдегида и нерацемического диамина
тана (12) в присутствии 5 мол % гидрата ацетата
меди(II) и лигандов (S)-3 или (S)-6 получен 2-ни-
С44
тро-1-фенилэтанол-1 (13) с выходом 45 и 38% со-
С43
ответственно, однако без какого-либо энантиомер-
ного обогащения (схема 5).
С45
С42
C48
Комплекс 10 получен последовательным взаи-
С40
С5
модействием лиганда (S)-9 с тетрагидратом ацета-
С4
С41
С46
та марганца(II) и хлоридом лития (схема 4). Ката-
С47
лизаторы такого типа применяются в реакциях
С49
эпоксидирования алкенов [46-49]. Реакция окис-
ления стирола (14) в условиях катализа комплек-
N1
N3
сом марганца 10 (2 мол %) протекает с образова-
С2
нием только рацемического эпоксида 15 с выходом
35% (схема 6).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
S2
ИК спектры регистрировались на ИК спектро-
Рис. 4. Молекулярная структура (S)-5 (CCDC 1969827)
[42]
метре Shimadzu IR Affinity-1. Спектры ЯМР 1H
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
272
МАНЬКОВА и др.
Схема 3
1. NaBH4, MeOH
2PhCHO, MgSO4,
N
rt, 4 ч
NH
MeOH, ∆, 6 ч
2. HCl
NH2
Ph
Ph
N
HN
NH2
·2HCl
Ph
Ph
(RS)-3
(RS)-6
(RS)-7∙2HCl
(S)-3
(S)-6
Bn
NH
Br
NaOH, H2O
NH
NiBr2, CH3CN
Ni
rt
∆, 6 ч
Ph
Br
HN
NH
Bn
Ph
(RS)-7
8
и 13С зарегистрированы на спектрометре JEOL
EuroVector EA-3000. Угол вращения измеряли на
NMR-ECX 400 (400 и 100 МГц соответственно).
приборе Rudolph Research Analytical (Autopol V
Температуры плавления определены на прибо-
Plus Automatic Polarimeter) на длине волны 589 нм
ре OptiMelt MPA100. Элементный анализ вы-
в кювете длиной 10 см при температуре 25°С.
полнен на автоматическом CHNS-анализаторе
Энантиомерный состав определен методом ВЭЖХ
Схема 4
CHO
t-Bu
N
OH
2
N
t-Bu
t-Bu
NH2
i-PrOH, ∆, 4 ч
HO
t-Bu
NH2
t-Bu
OH
t-Bu
(S)-3
(S)-9
1. Mn(OAc)2·4H2O,
EtOH, ∆, 6 ч
t-Bu
2. LiCl, ∆, 2 ч
N
N
O
Mn
Cl
O
t-Bu
t-Bu
t-Bu
10
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
СИНТЕЗ ХИР
АЛЬНЫХ ЛИГАНДОВ
273
Схема 5
5 мол % Cu(OAc)2∙H2O
5 мол % (S)-3 или (S)-6
OH
i-PrOH, rt, 24 ч
PhCHO + CH3NO2
NO2
Ph
11
12
13
Схема 6
2 мол % 10,
H2O2, CH3COOH,
CH3CN, rt, 24 ч
Ph
Ph
O
14
15
на Shimadzu Prominence с использованием колон-
да лития в 50 мл эфира. По окончании прикапы-
ки Chiralpak AD-3R в условиях ацетонитрил-вода,
вания реакционную смесь перемешивали при ком-
30:70 (0-10 мин), ацетонитрил (10-20 мин); ско-
натной температуре 4 ч, снова охлаждали до 5°C
рость потока 0.2 мл/мин. Рентгеноструктурный
и последовательно прикапывали 0.65 мл воды,
анализ выполнен на дифрактометре STOE STADI
0.65 мл 15%-го раствора гидроксида натрия и
VARI PILATUS-100K.
1.95 мл воды. Реакционную смесь перемешива-
ли при комнатной температуре 1 ч. Осадок от-
1-(Адамантан-1-ил)-2-азидоэтан-1-он (1) по-
фильтровывали, промывали эфиром (3×10 мл),
лучен из
1-(адамантан-1-ил)-2-бромэтан-1-она
фильтрат упаривали. Полученный маслянистый
[50] реакцией с азидом натрия [37].
остаток растворяли в минимальном количестве
1-(Адамантан-1-ил)-2-азидоэтан-1-он оксим
метанола, добавляли 0.3 мл конц. HCl, выпавший
(2). Раствор 5.07 г (73 ммоль) гидрохлорида ги-
осадок отфильтровывали. После добавления к ма-
дроксиламина и 9.92 г (73 ммоль) NaOAc·3H2O
точному раствору диэтилового эфира выпадает
в 30 мл воды прибавляли при перемешивании к
очередная порция продукта. Выход 0.75 г (70%),
раствору 14.60 г (66 ммоль) 1-(адамантан-1-ил)-2-
бесцветные кристаллы, т.пл. 297°C с разл. ИК
азидоэтан-1-она (1) в 50 мл этанола. Реакционную
спектр, ν, см-1: 2900, 2846, 1614, 1519, 1492, 1026,
смесь кипятили при перемешивании 6 ч, охлаж-
1004. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 1.44-1.47
дали до комнатной температуры. Выпавшие кри-
м (3H, 3СНAd), 1.53-1.66 м (9H, 9CHAd), 1.91 с (3Н,
сталлы отфильтровывали и перекристаллизовы-
3СНAd), 2.86-2.92 м (1Н, CHСН2NH2), 3.01 д (1Н,
вали из бензола. Выход 11.69 г (75%), бесцветные
СН2NH2·HCl, 3J 8.9 Гц), 3.22 д (1Н, СН2NH2·HCl,
кристаллы, т.пл. 136-137°C. ИК спектр, ν, см-1:
2J 13.9 Гц), 8.60 уш.с (6H, 2NH2·HCl). Спектр ЯМР
3228, 2900, 2848, 2088, 1645, 1454, 1247, 939, 931.
13С (DMSO-d6), δ, м.д.: 27.8 (3СНAd), 36.5 (СAd),
Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.65-1.76 м (12Н,
36.3 (3СН2Ad), 37.3 (3СН2Ad), 38.4 (CH2), 58.6 (СН).
12СНAd), 2.04 с (3Н, 3СНAd), 3.98 с (2Н, CH2N3),
Найдено, %: C 54.00; H 8.99; N 10.53. C12H24Cl2N2.
9.38 с (1H, ОН). Спектр ЯМР 13С (CDCl3), δ,
Вычислено, %: C 53.93; H 9.05; N 10.48.
м.д.: 27.9 (3CHAd), 36.5 (3CH2Ad), 38.7 (CAd), 39.0
(3CH2Ad), 41.3 (СН2), 161.3 (C=N). Найдено, %: C
(RS)-1-(Адамантан-1-ил)этан-1,2-диамин
61.45; H 7.80; N 23.87. C12H18N4O. Вычислено, %:
[(RS)-3]. К раствору 1.30 г (4.87 ммоль) диги-
C 61.52; H 7.74; N 23.91.
дрохлорида
1-(адамантан-1-ил)этан-1,2-диамина
(RS)-1-(Адамантан-1-ил)этан-1,2-диамин
[(RS)-3·2HCl] в 15 мл воды при перемешивании
дигидрохлорид
[(RS)-3·2HCl]. Раствор
1 г
добавляли 0.39 г (9.73 ммоль) гидроксида на-
(4.26 ммоль)
1-(адамантан-1-ил)-2-азидоэтан-1-
трия. Реакционную смесь перемешивали 15 мин,
оноксима (2) в 15 мл сухого диэтилового эфира
экстрагировали хлористым метиленом (3×5 мл).
прибавляли при перемешивании к охлажденной
Органические вытяжки сушили над Na2SO4, упа-
до 5°C суспензии 0.65 г (17 ммоль) алюмогидри-
ривали. Выход 0.85 г (90%), бесцветное масло.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
274
МАНЬКОВА и др.
ИК спектр, ν, см-1: 3250, 2897, 2845, 1589, 1446,
м (4Н, 2СН2O), 4.65-4.67 м (1H, NH), 4.88-4.92 м
812.
(1Н, NH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 14.6
(СН3CH2), 14.7 (СН3CH2), 28.2 (3СНAd), 35.8 (CAd),
(1S)-1-(Адамантан-1-ил)этан-1,2-диамин
36.9 (3CH2Ad), 38.6 (3CH2Ad), 40.7 (СН2NН), 60.3
[(S)-3]. В 20 мл воды суспензировали 1.00 г
(СНNН), 60.9 (СН2O), 61.0 (СН2O), 157.4 (C=О),
(5.10 ммоль) 1-(адамантан-1-ил)этан-1,2-диамина
157.8 (C=О). Найдено, %: C 63.81; H 8.99; N 8.24.
[(RS)-3], при перемешивании добавляли раствор
C18H30N2О4. Вычислено, %: C 63.88; H 8.93; N
1.57 г (10.20 ммоль) l-винной кислоты в 5 мл воды
8.28.
и перемешивали 15 мин. Реакционную смесь охла-
ждали до 5°C и прикапывали при перемешивании
(RS)-4-(Адамантан-1-ил)имидазолидин-2-
7 мл этанола до выпадения кристаллов. Осадок от-
тион (5). К раствору 0.28 г (1.44 ммоль) 1-(адаман-
фильтровывали, растворяли в минимальном коли-
тан-1-ил)этан-1,2-диамина [(RS)-3] в смеси 8 мл
честве горячей воды, отфильтровывали, охлажда-
этанола и 2 мл воды добавляли 0.087 мл (0.11 г,
ли до комнатной температуры, добавляли этанола
1.59 ммоль) сероуглерода. Реакционную смесь на-
в 2 раза больше, чем воды, оставляли на 24 ч при
гревали в течение 3 ч, добавляли 3 капли конц. со-
5°C, выпавший осадок отфильтровывали и прово-
ляной кислоты и кипятили еще 6 ч. Растворитель
дили переосаждение еще 2 раза до постоянного
упаривали, остаток перекристаллизовывали из
угла оптического вращения {[α]D25 +25.2° (с 1.0,
этанола. Выход 0.28 г (81%), бесцветные кристал-
H2O)}. Соль диамина 0.45 г (1.31 ммоль) с l-вин-
лы, т.пл. 260°C с разл. ИК спектр, ν, см-1: 3290,
ной кислотой растворяли в 20 мл воды и при пере-
3167, 2897, 2846, 1537, 1506, 1487, 1446, 1213,
мешивании добавляли 0.21 г (5.24 ммоль) гидрок-
1186. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 1.26-
1.29 м (3Н, 3СНAd), 1.44-1.47 м (3Н, 3СНAd), 1.53-
сида натрия. Реакционную смесь перемешивали
15 мин, экстрагировали хлористым метиленом
1.63 м (6Н, 6СНAd), 1.89 с (3Н, 3СНAd), 3.34-3.36
м (3Н, СН2 и СН), 7.84 с (1H, NH), 8.10 с (1Н, NH).
(3×5 мл), сушили над Na2SO4, упаривали. Выход
Спектр ЯМР 13С (DMSO-d6), δ, м.д.: 27.9 (3СНAd),
относительно рацемического диамина 0.2 г (20%),
35.4 (CAd),
37.0
(3CH2Ad),
37.5
(3CH2Ad),
44.2
бесцветное масло, [α]D25 +11.0° (с 1.0, CHCl3).
(CH2), 66.2 (CH), 182.9 (C=S). Найдено, %: C 66.11;
Полученный (S)-3 растворяли в минимальном ко-
H 8.57; N 11.82 S 13.50. C13H20N2S. Вычислено, %:
личестве метанола, добавляли 0.1 мл конц. HCl,
C 66.06; H 8.53; N 11.85, S 13.56.
выпавший осадок отфильтровывали. Выход 0.22 г
(76%), бесцветные кристаллы, т.пл. 284°C с разл.,
(4S)-4-(Адамантан-1-ил)имидазолидин-2-
[α]D25 +13.5° (с 0.2, H2O).
тион [(S)-5] получен по аналогичной методике из
0.02 г
(1S)-1-(адамантан-1-ил)этан-1,2-диамина
(RS)-Диэтил (1-(адамантан-1-ил)этан-1,2-ди-
[(S)-3] с выходом 0.018 г (75%), бесцветные кри-
ил)дикарбамат (4). К раствору 0.19 г (0.98 ммоль)
сталлы, т.пл. 254°С с разл., ee 96%, [α]D25 -22.5° (с
1-(адамантан-1-ил)этан-1,2-диамина
[(RS)-3] и
0.1, CH2Cl2). Анализ ВЭЖХ: tr 12.323 мин [(S)-5,
0.54 г (3.9 ммоль) карбоната калия в 11 мл ТГФ
98%], 14.327 мин [(R)-5, 2%].
и 1.8 мл воды при перемешивании добавляли
0.19 мл (0.21 г, 1.96 ммоль) этилхлорформиата.
РСА соединения (S)-5. Кристаллы выращены
Реакционную смесь перемешивали при комнат-
из этанола путем медленного испарения раство-
ной температуре 4 ч, упаривали ТГФ, к остатку
рителя при комнатной температуре. C13H20N2S,
добавляли 30 мл воды, экстрагировали хлористым
M 236.37, кристаллы моноклинные, простран-
метиленом (3×5 мл). Органические вытяжки су-
ственная группа P21, a 6.7571(4), b 8.4301(4),
шили над Na2SO4, упаривали. Выход 0.27 г (81%),
c 11.2418(7) Å, β 104.615(5)°; V 619.65(6) Å3,
бесцветные кристаллы, т.пл.
158-159°C. ИК
dрасч 1.267 мг/см3, Z 2, F(000) 256, l 1.5418 Å, m
спектр, ν, см-1: 3315, 2900, 2846, 1691, 1533, 1442,
2.097 мм-1, всего отражений/независимых от-
1257, 1240, 1082, 1056. Спектр ЯМР 1Н (CDCl3),
ражений 1939/1186, T 295(2) K, θ 4.064-70.509°,
δ, м.д.: 1.20-1.23 м (6Н, 2СН3CH2), 1.50-1.70 м
R1 0.0300, ωR2 0.0397 для [I > 2σ(I)], R1 0.0590,
(12Н, 12СНAd), 1.97 с (3Н, 3СНAd), 3.15-3.18 м
ωR2 0.0443 для всех данных, параметр Флека χ =
(1Н, СНNН), 3.33-3.36 м (2Н, СН2NН), 4.05-4.10
0.00(2).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
СИНТЕЗ ХИР
АЛЬНЫХ ЛИГАНДОВ
275
(RS)-1-(Адамантан-1-ил)-N,N'-дибензили-
бавляли диэтиловый эфир, выпавший осадок от-
денэтан-1,2-диамин [(RS)-6]. К раствору 0.2 г
фильтровывали. Выход 0.14 г (43%), бесцветные
(1.03 ммоль) 1-(адамантан-1-ил)этан-1,2-диамина
кристаллы, т.пл. 190°C с разл. ИК спектр, ν, см-1:
[(RS)-3] в 15 мл метанола добавляли при переме-
2900, 2848, 1593, 1444, 748, 694. Спектр ЯМР 1Н
шивании 0.25 г (2.06 ммоль) сульфата магния и
(DMSO-d6), δ, м.д.: 1.44-1.71 м (12Н, 12СНAd),
0.21 мл (0.22 г, 2.06 ммоль) бензальдегида, на-
1.88 с (3H, 3CHAd), 3.12-3.18 м (1Н, CH), 3.33-3.42
гревали при кипении и перемешивании
6 ч.
м (1H, СН), 4.20-4.27 м (4H, 2СН2), 4.42-4.49
Реакционную смесь охлаждали до комнатной
м (1H, СН), 7.37-7.40 м (6Наром), 7.62-7.74 м
температуры, растворитель упаривали, к остатку
(4Наром). 8.48-8.67 м (1H, NH·HCl), 9.86-10.18 м
добавляли 20 мл воды, экстрагировали хлорофор-
(3H, NH·2HCl). Спектр ЯМР 13С (DMSO-d6), δ,
мом (3×5 мл), органические вытяжки сушили над
м.д.: 27.8 (3СНAd), 35.2 (СAd), 36.0 (3СН2Ad), 36.7
Na2SO4, упаривали. Остаток перекристаллизовы-
(3CH2Ad), 51.6 (2СН2), 57.1 (СН2), 63.9 (СН), 128.9
вали из этанола. Выход 0.28 г (73%), бесцветные
(2CHаром), 129.1 (2CHаром), 129.6 (CHаром), 129.7
кристаллы, т.пл. 119-120°C. ИК спектр, ν, см-1:
(CHаром), 130.6 (CHаром), 131.0 (2CHаром), 131.8
2899, 2845, 1641, 1450, 759, 690. Спектр ЯМР 1Н
(CHаром), 131.6 (Cаром), 132.1 (Cаром). Найдено, %:
(DMSO-d6), δ, м.д.: 1.53-1.72 м (12Н, 12СНAd),
C 69.86; H 8.19; N 6.22. C26H36Cl2N2. Вычислено,
1.94 с (3H, 3CHAd), 2.94 д (1H, СН2, 2J 11.2 Гц),
%: C 69.79; H 8.11; N 6.26.
3.42-3.47 м (1H, СН), 4.10 д (1H, СН2, 2J 11.2 Гц),
(RS)-1-(Адамантан-1-ил)-N,N'-дибензилэтан-
7.31-7.34 м (6Наром), 7.54-7.59 м (4Наром), 8.00 с
1,2-диамин [(RS)-7]. К раствору 0.1 г (0.27 ммоль)
(1H, N=CH), 8.11 с (1H, N=CH). Спектр ЯМР 13С
дигидрохлорида (1S)-1-(адамантан-1-ил)-N,N'-ди-
(DMSO-d6), δ, м.д.: 28.5 (3СНAd), 35.9 (СAd), 37.3
бензилэтан-1,2-диамина [(RS)-7·2HCl] в 10 мл
(3СН2Ad), 39.6 (3CH2Ad), 60.1 (СН2), 80.4 (СН),
воды при перемешивании добавляли
0.02 г
128.1 (2CHаром), 128.2 (2CHаром), 129.0 (4CHаром),
(0.54 ммоль) гидроксида натрия. Реакционную
130.8 (CHаром), 130.9 (CHаром),
136.6
(2Cаром),
смесь перемешивали
15 мин, экстрагировали
161.0 (N=CH), 162.5 (N=CH). Найдено, %: C 84.23;
хлористым метиленом (3×3 мл). Органические
H 8.20; N 7.57. C26H30N2. Вычислено, %: C 84.28;
вытяжки сушили над Na2SO4, упаривали. Выход
H 8.16; N 7.56.
0.07 г (88%), бесцветное масло. ИК спектр, ν, см-1:
3061, 3028, 2899, 2845, 1494, 1452, 750, 696, 480,
(1S)-1-(Адамантан-1-ил)-N,N'-дибензилиден-
416, 410.
этан-1,2-диамин [(S)-6] получен по аналогич-
ной методике из 0.1 г (1S)-1-(адамантан-1-ил)-
[(RS)-1-(Адамантан-1-ил)-N,N'-дибензил-
этан-1,2-диамина [(S)-3] с выходом 0.1 г (69%),
этан-1,2-диамин](дибромо)никель (8). К раство-
бесцветные кристаллы, т.пл.
125-126°C,
[α]D25
ру 0.07 г (0.19 ммоль) 1-(адамантан-1-ил)-N,N'-ди-
+119.0° (с 0.1, CHCl3).
бензилэтан-1,2-диамина [(RS)-7] в 5 мл ацетони-
трила добавляли 0.02 г (0.09 ммоль) безводного
(RS)-1-(Адамантан-1-ил)-N,N'-дибензилэтан-
бромида никеля и кипятили 6 ч. Выпавший при
1,2-диамин дигидрохлорид
[(RS)-7·2HCl]. К
охлаждении осадок отфильтровывали. Выход
раствору 0.27 г (0.70 ммоль) 1-(адамантан-1-ил)-
0.04 г (22%), светло-фиолетовые кристаллы, т.пл.
N,N'-дибензилиденэтан-1,2-диамина
[(RS)-6] в
305°C с разл. ИК спектр, ν, см-1: 3380, 3245, 3055,
15 мл метанола при перемешивании порционно
2895, 2846, 1560, 1446, 1008, 931, 910, 740, 696,
добавляли 0.28 г (7.30 ммоль) боргидрида натрия.
634, 480, 416. Найдено, %: C 52.60; H 5.85; N 4.68.
Реакционную смесь перемешивали при комнатной
C26H34Br2N2Ni. Вычислено, %: C 52.66; H 5.78; N
температуре 4 ч, растворитель упаривали, к остат-
4.72.
ку добавляли 20 мл воды, экстрагировали хлори-
стым метиленом (3×5 мл), сушили над Na2SO4,
[(1S)-1-(Адамантан-1-ил)этан-1,2-диил]бис-
упаривали. Остаток растворяли в минимальном
(азанилиден)бис(метанилиден)бис(2,4-ди-
количестве метанола, добавляли 0.1 мл конц. HCl,
трет-бутилфенол) [(S)-9]. К раствору 0.05 г
выпавшие кристаллы отфильтровывали, раство-
(0.26 ммоль) (1S)-1-(адамантан-1-ил)этан-1,2-ди-
ряли в минимальном количестве метанола, до-
амина [(S)-3] в 5 мл изопропанола добавляли при
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
276
МАНЬКОВА и др.
перемешивании 0.12 г (0.52 ммоль) 3,5-ди(трет-
ли 48 ч при комнатной температуре и 50°C, раство-
бутил)салицилового альдегида, нагревали при ки-
ритель упаривали. Остаток пропускали через слой
пении 4 ч. Реакционную смесь охлаждали до ком-
силикагеля, элюент - хлороформ. В реакционной
натной температуры, выпавший осадок отфиль-
смеси присутствовали лишь исходные вещества.
тровывали. Выход 0.07 г (70%), желтые кристаллы,
Реакция Анри. Раствор 9.4 мг (4.72×10-5 моль)
т.пл. 188-190°C, [α]D25 +204.8° (с 0.5, CH2Cl2). ИК
Cu(OAc)2·H2O и 4.72×10-5 моль соответствующе-
спектр, ν, см-1: 3400, 2951, 2904, 2846, 1649, 1438,
го лиганда в 2 мл изопропанола выдерживали
1359, 1172, 877, 773. Спектр ЯМР 1Н (CDCl3), δ,
30 мин, добавляли 0.29 г (0.25 мл, 4.7 ммоль) ни-
м.д.: 1.23 с (9Н, 3СН3), 1.24 с (9Н, 3СН3), 1.38 с
трометана (12), 6.1 мг (4.72×10-5 моль) этилдиизо-
(9Н, 3СН3), 1.43 с (9Н, 3СН3), 1.63-1.75 м (12Н,
пропиламина, 0.1 г (0.1 мл, 0.94 ммоль) бензаль-
12СНAd), 2.03 с (3Н, 3СНAd), 2.97-3.00 м (1Н, СН2),
дегида (11). Реакционную смесь выдерживали
3.55-3.61 м (1Н, СН), 4.13-4.16 м (1Н, СН2), 6.96 д
18 ч, растворитель упаривали. Остаток пропуска-
(1Наром, 4J 2.0 Гц), 7.01 д (1Наром, 4J 2.4 Гц), 7.30 д
ли через слой силикагеля, элюент - петролейный
(1Наром, 4J 2.8 Гц), 7.32 д (1Наром, 4J 2.8 Гц), 8.19 с
эфир-этилацетат, 9:1. Лиганд (S)-3 использовали в
(1H, N=CH), 8.25 с (1H, N=CH), 13.71 с (2H, OH).
количестве 17.5 мг, выход 2-нитро-1-фенилэтано-
Спектр ЯМР 13С (CDCl3), δ, м.д.: 28.5 (3СНAd),
ла-1 (13) 0.07 г (45%), бесцветное масло. Лиганд
29.4 (3CH3), 29.5 (3CH3), 31.5 (6CH3), 34.1 (2С),
(S)-6 использовали в количестве 9.2 мг, выход
35.0 (2C), 35.7 (CAd), 37.1 (3СН2Ad), 39.6 (3CH2Ad),
2-нитро-1-фенилэтанола-1 (13) 0.06 г (38%), бес-
58.8 (СН2), 80.2 (СН), 117.8 (Cаром), 117.9 (Cаром),
цветное масло. ИК спектр, ν, см-1: 3032, 1695,
125.9 (CHаром), 126.3 (CHаром), 126.8 (2CHаром),
1546, 1494, 1454, 1417, 1377, 761, 698 [лит. (51)].
136.3 (Cаром), 136.5 (Cаром), 139.8 (2Cаром), 158.1
(2Cаром-OH), 166.6 (N=CH), 167.4 (N=CH). Най-
Эпоксидирование. К раствору 0.06 г (0.1 мл,
дено, %: C 80.53; H 9.92; N 4.48. C42H62N2O2. Вы-
0.87 ммоль) стирола (14) и 4.2 мг (8.7×10-6 моль)
числено, %: C 80.46; H 9.97; N 4.47.
комплекса 10 в 3 мл ацетонитрила добавляли
0.73 г (0.7 мл, 12.2 ммоль) уксусной кислоты и
[(1S)-1-(Адамантан-1-ил)этан-1,2-диил]бис-
0.04 г (0.2 мл, 1.0 ммоль) 33%-ной перекиси водо-
(азанилиден)бис(метанилиден)бис(2,4-ди-
рода. Через 24 ч к реакционной смеси добавляли
трет-бутилфенят)(хлор)марганца (10). К рас-
насыщ. раствор NaHCO3 до pH 7, экстрагирова-
твору 0.04 г (0.10 ммоль) [(1S)-1-(адамантан-1-
ли хлористым метиленом (3×3 мл), сушили над
ил)этан-1,2-диил]бис(азанилиден)бис(метанили-
Na2SO4, упаривали. Остаток пропускали через
ден)бис(2,4-ди-трет-бутилфенола)
[(S)-9]
в
слой силикагеля, элюент - петролейный эфир-
5 мл этанола добавляли 0.13 г (0.51 ммоль)
хлористый метилен, 2:1, Rf 0.25 [лит. (52)]. Выход
Mn(OAc)2·4H2O, смесь перемешивали и на-
2-фенилоксирана (15) 0.04 г (35%).
гревали при кипении 6 ч, добавляли 0.021 г
(0.51 ммоль) LiCl и нагревали при кипении еще
ВЫВОДЫ
2 ч. Реакционную смесь охлаждали, добавляли
В работе предложен новый подход к синтезу
20 мл воды, выпавший осадок отфильтровывали.
рацемического и хирального 1-(адамантан-1-ил)-
Выход 0.03 г (60%), коричневые кристаллы, т.пл.
этан-1,2-диаминов [(RS)-3 и (S)-3]. Предложен
210°C с разл., [α]D25 -1106° (с 0.05, CH2Cl2). ИК
новой способ дериватизации для ВЭЖХ вици-
спектр, ν, см-1: 3400, 2948, 2906, 2852, 1619, 1596,
нальных диаминов реакцией с сероуглеродом.
1531, 1461, 1249, 1176, 840. Найдено, %: C 70.44;
Полученные лиганды диаминового и саленового
H 8.51; N 3.96. C42H60ClMnN2O2. Вычислено, %: C
типа введены в модельные реакции Михаэля, Анри
70.52; H 8.45; N 3.92.
и эпоксидирования, однако в результате наблюда-
Методики модельных реакций. Реакция
лось образование рацемических продуктов 13 и
Михаэля. К раствору 0.11 г (0.73 ммоль) β-нитро-
15. Вероятно, это связаны с отсутствием замести-
стирола и 0.11 г (0.1 мл, 0.66 ммоль) диэтилмало-
теля при метиленовом атоме углерода в исследу-
ната в 1 мл хлороформа добавляли 2 мол % ком-
ющихся лигандах, что снижает конформационную
плекса никеля 8. Реакционную смесь перемешива-
жесткость образующихся хелатных комплексов.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
СИНТЕЗ ХИР
АЛЬНЫХ ЛИГАНДОВ
277
Стоит также отметить, что объемный адамантиль-
8.
Сибирякова А.Э., Резников А.Н., Рыбаков В.Б., Кли-
ный заместитель, входящий в состав диаминовых
мочкин Ю.Н. ЖОрХ. 2017, 53, 167-170. [Sibiryako-
va A.E., Reznikov A.N., Rybakov V.B., Klimoch-
лигандов, не препятствовал катализу в реакциях
kin Y.N. Russ. J. Org. Chem. 2017, 53, 153-156.] doi
Анри и эпоксидирования, в связи с этим необхо-
10.1134/S1070428017020014
димы исследования других хиральных диаминов,
9.
Kim D.Y. Bull. Korean Chem. Soc. 2008, 29, 2036-
содержащих адамантильный заместитель.
2038. doi 10.5012/bkcs.2008.29.10.2036
БЛАГОДАРНОСТИ
10.
González-Sabín J., Rebolledo F., Gotor V. Chem. Soc.
Работа выполнена с использованием обо-
Rev. 2009, 38, 1916-1925. doi 10.1039/B818679K
рудования (дифрактометра STOE STADI VARI
11.
Shaw S., White J.D. Chem. Rev. 2019, 119, 9381-9426.
PILATUS-100K), приобретенного по программе
doi 10.1021/acs.chemrev.9b00074
развития МГУ.
12.
Canali L., Sherrington D.C. Chem. Soc. Rev. 1999, 28,
85-93. doi 10.1039/A806483K
ФОНДОВАЯ ПОДДЕРЖКА
13.
Venkataramanan N.S., Kuppuraj G., Rajagopal S.
Исследование выполнено при финансовой
Coord. Chem. Rev. 2005, 249, 1249-1268. doi 10.1016/
поддержке РФФИ в рамках научного проекта
j.ccr.2005.01.023
№ 20-31-70001 (синтез производных вицинальных
14.
Cozzi P.G. Chem. Soc. Rev. 2004, 33, 410-421. doi
диаминов) и РНФ № 18-13-00447 (синтез ком-
10.1039/B307853C
плексов металлов и их каталитических свойств).
15.
Baleizao C., Garcia H. Chem. Rev. 2006, 106, 3987-
Структурные исследования выполнены при фи-
4043. doi 10.1021/cr050973n
нансовой поддержке Минобрнауки РФ в рам-
16.
Song F., Wang C., Falkowski J.M., Ma L., Lin W.
ках проектной части государственного задания
J. Am. Chem. Soc. 2010, 132, 15390-15398. doi
№ 0778-2020-0005.
10.1021/ja1069773
КОНФЛИКТ ИНТЕРЕСОВ
17.
Atwood D.A. Coord. Chem. Rev. 1997, 165, 267-296.
doi 10.1016/S0010-8545(97)90159-4
Авторы заявляют об отсутствии конфликта ин-
18.
Pessoa J.C., Correia I. Coord. Chem. Rev. 2019, 388,
тересов.
227-247. doi 10.1016/j.ccr.2019.02.035
СПИСОК ЛИТЕРАТУРЫ
19.
Ganot N., Briaitbard O., Gammal A., Tam J., Hoch-
1. Zlotin S.G., Kochetkov S.V. Russ. Chem. Rev. 2015,
man J., Tshuva E.Y. ChemMedChem. 2018, 13, 2290-
84, 1077-1099. doi 10.1070/RCR4562
2296. doi 10.1002/cmdc.201800551
2. Evans D.A., Seidel D. J. Am. Chem. Soc. 2005, 127,
20.
Bakhonsky V.V., Pashenko A.A., Becker J., Haus-
9958-9959. doi 10.1021/ja052935r
mann H., De Groot H.J., Overkleeft H.S., Fokin A.A.,
Schreiner P.R. Dalton Trans. 2020, 49, 14009-14016.
3. Evans D.A., Mito S., Seidel D. J. Am. Chem. Soc. 2007,
doi 10.1039/D0DT02391D
129, 11583-11592. doi 10.1021/ja0735913
4. Huang S., Scherer K., Ni B. Catal. Commun. 2017,
21.
Kawashima M., Hirata R. Bull. Chem. Soc. Jpn. 1993,
66, 2002-2005. doi 10.1246/bcsj.66.2002
102, 67-70. doi 10.1016/j.catcom.2017.08.024
22.
Alexakis A., Mangeney P., Lensen N., Tranchier J.P.,
5. Reznikov A.N., Sibiryakova A.E., Baimuratov M.R.,
Gosmini R., Raussou S. Pure Appl. Chem. 1996, 68,
Golovin E.V., Rybakov V.B., Klimochkin Y.N. Beilstein
531-534. doi 10.1351/pac199668030531
J. Org. Chem. 2019, 15, 1289-1297. doi 10.3762/
bjoc.15.127
23.
Fulwood R., Parker D. J. Chem. Soc., Perkin Trans. 2.
1994, 1, 57-64. doi 10.1039/P29940000057
6. Reznikov A.N., Kapranov L.E., Ivankina V.V.,
Sibiryakova A.E., Rybakov V.B., Klimochkin Y.N.
24.
Weinhardt K., Beard C.C., Dvorak C., Marx M.,
Helv. Chim. Acta. 2018, 101, e1800170. 10.1002/
Patterson J., Roszkowski A., Schuler M., Unger S.H.,
hlca.201800170
Wagner P.J., Wallach M.B. J. Med. Chem. 1984, 27,
616-627. doi 10.1021/jm00371a011
7. Резников А.Н., Климочкин Ю.Н. ЖОрХ. 2012, 48,
1555-1558. [Reznikov A.N., Klimochkin Y.N. Russ.
25.
Katritzky A.R., He H.Y., Verma A.K. Tetrahedron
J. Org. Chem. 2012, 48, 1526-1529.] doi 10.1134/
Asymmetry. 2002, 13, 933-938. doi 10.1016/S0957-
S1070428012120056
4166(02)00220-3
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
278
МАНЬКОВА и др.
26.
Petasis N.A., Patel Z.D. Tetrahedron Lett. 2000, 41,
39.
Walsh P.J., Smith D.K., Castello C. J. Chem. Educ.
9607-9611. doi 10.1016/S0040-4039(00)01717-2
1998, 75, 1459-1462. doi 10.1021/ed075p1459
27.
Michalson E.T., Szmuszkovicz J. Progress in Drug
40.
Asan A., Isildak I. Microchim. Acta. 1999, 132, 13-16.
Research. Ed. E. Jucker. Basel: Birkhäuser Basel.
doi 10.1007/s006040050036
1989, 33, 135-149. doi 10.1007/978-3-0348-9146-2_6
41.
Flack H.D. Acta Crystallogr., Sect. A. 1983, 39, 876-
28.
Papanastasiou I., Tsotinis A., Foscolos G.B., Pratha-
881. doi 10.1107/S0108767383001762
lingam S.R., Kelly J.M. J. Heterocycl. Chem. 2008, 45,
42.
Mankova P.A., Klimochkin Y.N., Rybakov V.B.
1401-1406. doi 10.1002/jhet.5570450524
CCDC
1969827: Experimental Crystal Structure
29.
Tataridis D., Fytas G., Kolocouris A., Fytas C.,
Determination, 2019. doi 10.5517/ccdc.csd.cc243rtv
Kolocouris N., Foscolos G.B., Padalko E., Neyts J.,
43.
Liu F., Gou S., Li L. Appl. Organometall. Chem. 2014,
De Clercq E. Bioorg. Med. Chem. Lett. 2007, 17, 692-
28, 186-193. doi 10.1002/aoc.3107
696. doi 10.1016/j.bmcl.2006.10.092
44.
Liu F., Gou S., Li L., Yan P., Zhao C. J. Mol.
30.
Stetter H., Löhr V., Simos A. Liebigs Ann. Chem.
Catal. A: Chem. 2013, 379, 163-168. doi 10.1016/
1977, 1977, 999-1004. doi 10.1002/jlac.197719770613
j.molcata.2013.08.014
31.
Alaa A.M., El Bialy S.A.A., Goda F.E., Kunieda T.
45.
Коняев В.Н., Пай З.П., Хлебникова Т.Б. ЖОрХ. 2020,
Tetrahedron Lett. 2004, 45, 8073-8077. doi 10.1016/
56, 557-567. [Konev V.N., Pai Z.P., Khlebnikova T.B.
j.tetlet.2004.08.164
Russ. J. Org. Chem. 2020, 56, 604-612.] doi 10.1134/
32.
Fokin A.A., Pashenko A.E., Bakhonsky V.V.,
S1070428020040077
Zhuk T.S., Chernish L.V., Gunchenko P.A., Kush-
46.
Jacobsen E.N., Zhang W., Muci A.R., Ecker J.R.,
ko A.O., Becker J., Wende R.C., Schreiner P.R.
Deng L. J. Am. Chem. Soc. 1991, 113, 7063-7064. doi
Synthesis. 2017, 49, 2003-2008. doi 10.1055/s-0036-
10.1021/ja00018a068
1588694
47.
Garcia-Bosch I., Ribas X., Costas M. Adv. Synth. Catal.
33.
Lucet D., Le Gall T., Mioskowski C. Angew.
2009, 351, 348-352. doi 10.1002/adsc.200800650
Chem., Int. Ed. 1998, 37, 2580-2627. doi 10.1002/
(SICI)1521-3773(19981016)37:19<2580::AID-
48.
Jeong Y.C., Choi S., Yu K., Ahn K.H. Bull. Korean
ANIE2580>3.0.CO;2-L
Chem. Soc.
2003,
24,
537-538. doi
10.5012/
bkcs.2003.24.5.537
34.
Agnew-Francis K.A., Williams C.M. Adv. Synth. Catal.
2016, 358, 675-700. doi 10.1002/adsc.201500949
49.
Smith K., Liu C.H. Chem. Commun. 2002, 886-887.
35.
Iwamoto H., Imamoto T., Ito H. Nat. Commun. 2018, 9,
doi 10.1039/B200246A
1-10. doi 10.1038/s41467-018-04693-9
50.
Vogt D., Weber J., Ihlefeld K., Brüggerhoff A., Pros-
36.
Mino T., Nishikawa K., Asano M., Shima Y., Ebisa-
chak E., Stark H. Bioorg. Med. Chem. 2014, 22, 5354-
wa T., Yoshida Y., Sakamoto M. Org. Biomol. Chem.
5367. doi 10.1016/j.bmc.2014.07.044
2016, 14, 7509-7519. doi 10.1039/C6OB01354F
51.
Chandrasekhar S., Shrinidhi A. Synth. Commun. 2014,
37.
Sternbach L.H., Ning R.Y. J. Med. Chem. 1970, 13,
44, 1904-1913. doi 10.1080/00397911.2013.876652
1251-1252. doi 10.1021/jm00300a071
52.
Li X., Shen Q., Zhang G., Zhang D., Zheng A.,
38.
Hawkins C.J., Peachey R.M. Aust. J. Chem. 1976, 29,
Guan F., Sun Y. Catal. Commun. 2013, 41, 126-131.
33-48. doi 10.1071/CH9760033
doi 10.1016/j.catcom.2013.07.028
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
СИНТЕЗ ХИР
АЛЬНЫХ ЛИГАНДОВ
279
Synthesis of Chiral Ligands Based
on 1-(Adamantan-1-yl)ethane-1,2-diamine
P. А. Mankovaa, *, А. N. Reznikova, V. А. Shiryaeva, М. R. Baimuratova,
V. B. Rybakovb, and Y. N. Klimochkina
a Samara State Technical University, ul. Molodogvardeyskaya, 244, Samara, 443100 Russia
*e-mail: manja1910@yandex.ru
b Lomonosov Moscow State University, Leninskie Gory, 1/3, Moscow, 119991 Russia
Received November 21, 2020; revised November 28, 2020; accepted November 29, 2020
Reduction of 1-(adamantan-1-yl)-2-azidoethan-1-one oxime with LiAlH4 gave racemic 1-(adamantan-1-yl)-
ethane-1,2-diamine, which resolved with l-tartaric acid. The individual enantiomer was obtained with a yield of
20% and derivatized into 4-(adamantan-1-yl)imidazolidine-2-thione. The absolute configuration of derivatized
diamine was established by X-ray diffraction analysis and the enantiomeric excess (96%) was determined using
HPLC. Diamine and diimine ligands were synthesized on the basis of racemic and chiral (1S)-1-(adamantan-1-
yl)ethane-1,2-diamine. The catalytic activity nickel(II), copper(II) and manganese(II) complexes were studied
using model Michael, Henri and epoxidation reactions.
Keywords: vicinal diamines, adamantane, chirality, ligands
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021