ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 2, с. 280-284
КРАТКИЕ СООБЩЕНИЯ
УДК 547.315.1 + 547.513 + 547.789
НИЗКОТЕМПЕРАТУРНАЯ ХЕМО-
И СТЕРЕОСЕЛЕКТИВНАЯ [2+2]-ЦИКЛОДИМЕРИЗАЦИЯ
5-ЭТЕНИЛИДЕН-4,5-ДИГИДРО-1,3-ТИАЗОЛА:
ПОДХОД К УНИКАЛЬНЫМ ПРОИЗВОДНЫМ
1,3-БИС(МЕТИЛЕН)ЦИКЛОБУТАНА
© 2021 г. О. А. Тарасова, Н. А. Недоля*, А. И. Албанов, Б. А. Трофимов
ФГБУН «Иркутский институт химии им. А.Е. Фаворского СО РАН», Россия, 664033 Иркутск, ул. Фаворского, 1
*e-mail: na_nedolya@mail.ru
Поступила в редакцию 11.11.2020 г.
После доработки 25.11.2020 г.
Принята к публикации 29.11.2020 г.
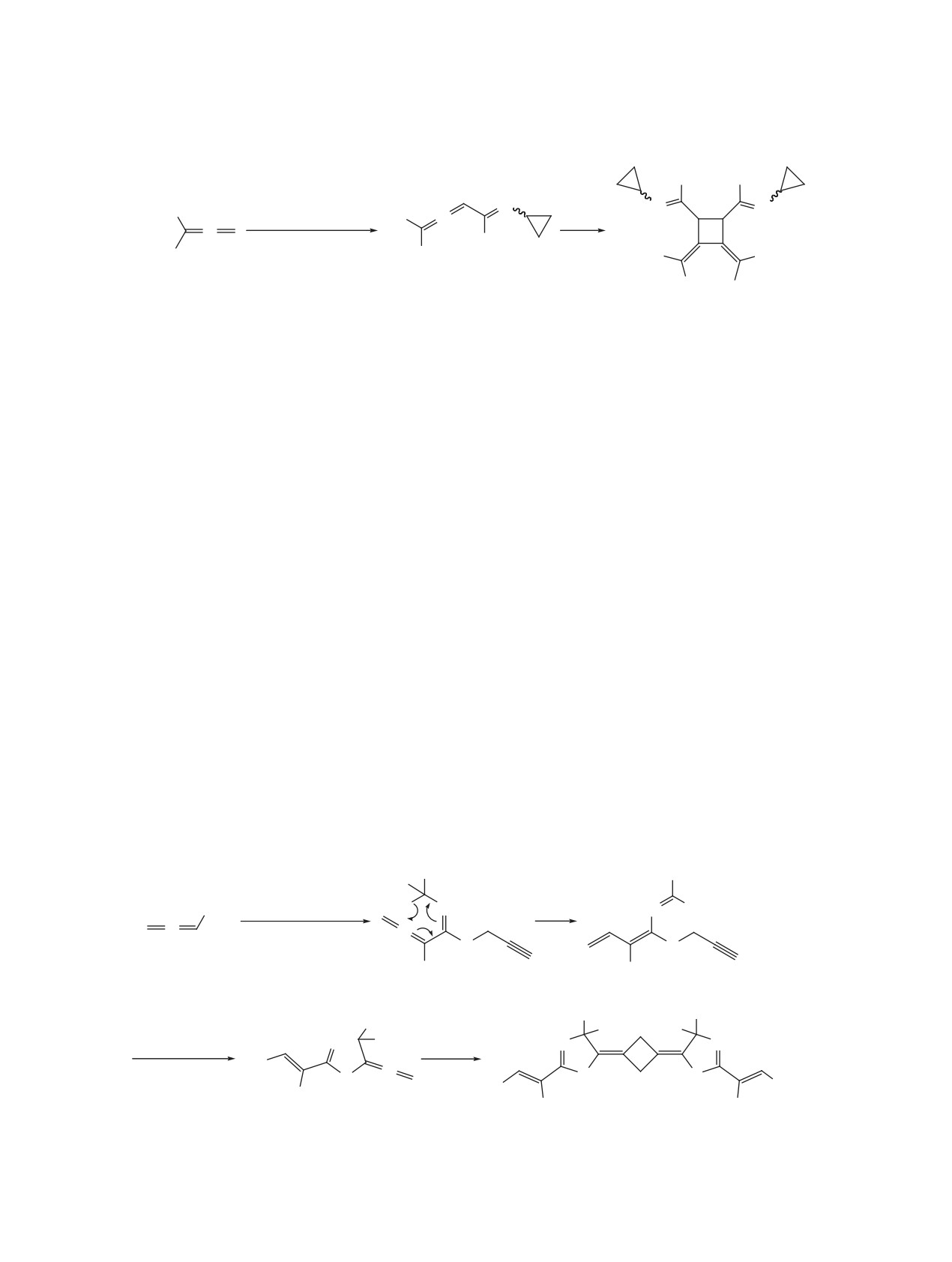
Обнаружена необычная [2+2]-циклодимеризация 5-этенилиден-4,5-дигидро-1,3-тиазола, полученного
из литиированного метоксиаллена, изопропилизотиоцианата и пропаргилбромида, в высокофункцио-
нализированный 1,3-бис(метилен)циклобутан.
Ключевые слова: 1-литио-1-метоксиаллен, изотиоцианат, пропаргилбромид, азатриены, 5-этенили-
ден-4,5-дигидро-1,3-тиазол, [2+2]-циклодимеризация, производное 1,3-бис(метилен)циклобутана
DOI: 10.31857/S0514749221020142
Фотохимическая, термическая (> 200°C) и ка-
клопропилизотиоцианата (схема 1), при длитель-
тализируемая переходными металлами [2+2]-ци-
ном выдерживании при пониженной температуре
клодимеризация алленов представляет интерес
(-18÷-15°С) превращается в диметил-N,N'-ди-
как с теоретической, так и с синтетической точки
циклопропил-3,4-бис(1-метилэтилиден)циклобу-
зрения, например, как один из атом-экономных
тан-1,2-дикарбимидотиоат (2). Его образование
методов получения замещённых циклобутанов
обусловлено впервые обнаруженной нами для
[1-9], которые, в свою очередь, находят широкое и
1-аза-1,3,4-триеновых систем межмолекулярной
разнообразное применение [9-13]. Однако регио-
[2+2]-циклодимеризацией соединения 1, протека-
и стереоселективность этой реакции, как прави-
ющей в отличие от известных алленов [1-9] прак-
ло, низкая. В большинстве случаев циклобутаны
тически исключительно по типу «голова к голове».
выделяются в виде смеси изомеров [1, 3, 4, 8] или
По-видимому, первый пример [2+2]-циклоди-
циклических димеров, тримеров, олигомеров и по-
меризации функционализированных гетероал-
лимеров [8], что сильно ограничивает синтетиче-
ленов описан почти 50 лет назад [15], когда при
скую значимость этой реакции.
синтезе 1-[2-(винилокси)этокси]аллена из винил-
Ранее нами обнаружено, что алленилимидотио-
пропаргилового диэфира этиленгликоля (КОН/
ат (1) (смесь E- и Z-изомеров, ~9:1 [14]), практиче-
EtOH, 130°С, 5 ч, в запаянной ампуле), наряду с
ски с количественным выходом синтезированный
ожидаемым 1-[2-(винилокси)этокси]алленом (вы-
из γ-литиированного 3-метил-1,2-бутадиена и ци-
ход ~40%), выделен его димер, по ИК спектрам,
280
НИЗКОТЕМПЕР
АТУРНАЯ ХЕМО- И СТЕРЕОСЕЛЕКТИВНАЯ [2+2]-ЦИКЛОДИМЕРИЗАЦИЯ
281
Схема 1
SMe SMe
1. BuLi, ТГФ-гексан
2. цикло-C3H5N=C=S
N
Me
N
N
3. MeI
Me
C
C
SMe
Me
Me
Me
Me
Me
Me
1
2
химическим и физическим свойствам соответ-
Как и в случае алленилимидотиоата 1, процесс
ствующий
1,3-диметилен-2,4-бис[2-(винилокси)-
характеризуется высокой хемо- и стереоселектив-
этокси]циклобутану. Позже допускалось, что этот
ностью. Следует также отметить, что [2+2]-ци-
циклобутан может иметь и 1,2-расположение за-
клодимеризация алленов с образованием произ-
местителей [16]. Подчеркнём, что при этом обра-
водных 1,3-бис(метилен)циклобутана - обычно
зование циклов наблюдалось при сравнительно
минорный процесс [1].
высокой температуре. Однако, как отмечено выше,
(5E,5'E)-5,5'-(1E,3E)-Циклобутан-1,3-ди-
такая димеризация возможна и при отрицательных
илиденбис{2-[(1Z)-1-метоксипроп-1-ен-1-ил]-
температурах.
4,4-диметил-4,5-дигидро-1,3-тиазол}
(6).
a.
В настоящей работе мы показали, что 4,4-ди-
Раствор 55 ммоль BuLi в 22 мл гексана прибавля-
метил-2-[(1Z)-1-метоксипроп-1-ен-1-ил]-5-этенил-
ли к раствору 6.00 г (85.7 ммоль) метоксиаллена
иден-4,5-дигидро-1,3-тиазол (3), полученный из
в 50 мл ТГФ при интенсивном перемешивании в
α-литиированного метоксиаллена, изопропили-
атмосфере аргона при -100°С. Перемешивали 5
зотиоцианата и пропаргилбромида (через одно-
мин при -55÷-52°С, охлаждали до -80°С и при-
реакторный синтез и
[1,5]-сигматропную изо-
бавляли 5.06 г (50.1 ммоль) изопропилизотиоци-
меризацию 1-аза-1,3,4-триена 4 в сопряжённый
аната. Реакционную массу перемешивали 23 мин
2-аза-1,3,5-триен
5, его депротонирование по
при -33÷-30°С, охлаждали до -80°C, прибавляли
S-метиленовому фрагменту и внутримолекуляр-
8.50 г (71.4 ммоль) пропаргилбромида и убирали
ную циклизацию по иминогруппе) [17], подобно
охлаждающую баню. Перемешивали 1 ч при ком-
алленилимидотиоату 1, также подвергается низко-
натной температуре, охлаждали до -80°C и при-
температурной [2+2]-циклодимеризации, но в от-
бавляли 50 мл насыщенного водного раствора
личие от последнего продуктом реакции является
NH4Cl. Органический слой отделяли, водный обра-
не 1,2-, а 1,3-бис(метилен)циклобутан 6 (схема 2).
батывали диэтиловым эфиром (3×40 мл), объеди-
Схема 2
Me
Me
1. BuLi, ТГФ-гексан
Me
2. i-PrN=C=S
OMe
3. HC≡CCH2Br
H
N
∆
N Me
C
C
S
S
OMe
OMe
4
5
Me
Me
Me
Me
Me
t-BuONa
N Me
N
N
ДМСО-ТГФ
Me
~ -30°С, 30 мин
C
-18°C
S
S
S
Me
Me
MeO
OMe
MeO
3
6
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
282
ТАРАСОВА и др.
нённую органическую фракцию промывали водой
лиден-4,5-дигидро-1,3-тиазола
(3) (Z-изомер).
(3×50 мл), сушили MgSO4. Растворитель удаляли
Соединение 3. ИК спектр (плёнка), ν, см-1: 3041
при пониженном давлении (сначала на роторном
сл, 2974 с, 2928 с, 2852 ср, 1953 сл (=С=), 1652 ср,
испарителе при температуре бани ~35°C, затем
1602 с, 1543 ср, 1448 с, 1376 сл, 1363 сл, 1320 с,
при 1-2 мм рт.ст.). Получали смесь проп-2-ил-N-
1249 ср, 1218 сл, 1157 ср, 1068 с, 971 сл, 921 с,
изопропил-2-метоксибута-2,3-диенимидотиоата
866 ср, 826 сл, 713 сл, 683 сл, 604 сл, 576 сл, 492
(1-аза-1,3,4-триена,
4), N-(1-метилэтилиден)-
сл. Спектр ЯМР 1Н, δ, м.д.: 1.45 с [6H, (CH3)2C],
2-метокси-1-(проп-2-инилсульфанил)бута-
1.77 д (3H, СН3СН=, 3J 7.1 Гц), 3.68 с (3H, OСН3),
1,3-диен-1-амина (2-аза-1,3,5-триена, 5) и 1-изо-
5.12 с (2H, CH2=C=), 5.75 к (1H, СН3СН=, 3J
пропил-3-метокси-2-(проп-2-инилсульфа-
7.1 Гц). Спектр ЯМР 13С, δ, м.д.: 11.0 (СН3СН=),
нил)-1Н-пиррола (7) в соотношении ~43:55:2 (по
28.4
[(CH3)2C],
59.7 (OСН3),
81.2 (C4),
83.6
данным ЯМР 1H). Дальнейшее нагревание про-
(CH2=C=), 111.0 (C5), 119.5 (СН3СН=), 149.5 (=C-
дуктов реакции при температуре бани 52-58°С
O), 157.6 (C=N), 198.0 (=C=). Отнесение сигналов
(12 мин на роторном испарителе, затем 5 мин при
в спектрах ЯМР 1H и 13С соединения 3 сделано с
~1 мм рт.ст.) привело к количественной изомери-
помощью 2D спектров NOESY, HSQC и HMBC.
зации 1-аза-1,3,4-триена 4 в 2-аза-1,3,5-триен 5.
Спектр ЯМР 15N, δ, м.д.: -60.1. Масс-спектр, m/z
Получали 10.16 г (97%) тёмно-коричневой под-
(Iотн, %): 210 (23) [M + 1]+, 209 (56) [M]+, 194 (48),
вижной жидкости - 2-аза-1,3,5-триена 5 с при-
179 (5), 178 (6), 139 (6), 130 (6), 124 (22), 113 (11),
месью (~7%) пиррола 7 (по данным ЯМР 1Н).
112 (100), 109 (7), 108 (8), 97 (58), 82 (12), 79 (23),
Соединение 5. ИК спектр (плёнка), ν, см-1: 3291 с
77 (15), 71 (12), 70 (15), 69 (12), 68 (7), 65 (11), 59
(HC≡). Спектр ЯМР 1Н, δ, м.д.: 1.93 с, 2.17 с [6H,
(12), 58 (24), 56 (12), 55 (15), 53 (16). Найдено,
(CH3)2C=N], 2.18 т (1H, HC≡, 4J 2.6 Гц), 3.36 д
%: С 63.24; Н 7.35; N 6.50; S 15.18. C11H15NOS.
(2H, SСН2, 4J 2.6 Гц), 3.64 с (3H, OCH3), 4.96 д.д,
Вычислено, %: С 63.12; Н 7.22; N 6.69; S 15.32.
5.24 д.д (2H, CH2=CH, 3Jтранс 17.2, 3Jцис 10.9, 2Jгем
в. Образец соединения 3 (0.30 г), хранившийся
1.9 Гц), 5.89 д.д (1H, CH2=CH, 3Jтранс 17.2, 3Jцис
при отрицательной температуре (-18÷-15°С) дли-
10.9 Гц). Спектр ЯМР 13С, δ, м.д.: 17.6 (SCH2),
тельное время (несколько месяцев), пропускали
21.6, 28.0 [(CH3)2C=N], 58.7 (OCH3), 70.4 (HC≡),
через тонкий слой нейтрального Al2O3 и выделя-
80.6 (C≡), 110.9 (CH2=CH), 126.1 (CH2=CH), 132.0
ли 0.21 г смеси соединений 3 и 6 в соотношении
(=C-S),
138.9
(=C-O), 175.1 (C=N). Отнесение
55:45 (по данным ЯМР 1Н). Выход димера 6, рас-
сигналов в спектрах ЯМР 1H и 13С соединения 5
сделано с помощью 2D спектров COSY, NOESY и
считанный по спектру ЯМР 1Н, составил 0.094 г
(31%). Соединение 6. Спектр ЯМР 1Н, δ, м.д.:
HMBC.
СН=, 3J
1.53 с [12Н, 4,4'-С(CH3)2], 1.80 д (6Н, 2CH3
б. К охлаждённому до -60°С раствору 3.06 г
7.1 Гц), 2.87 c (4Н, 2СН2), 3.70 с (6Н, 2OCH3), 5.80
(13.6 ммоль) 2-аза-1,3,5-триена 5 (с ~7% примесью
к (2Н, 2CH3СН=, 3J 7.1 Гц). Спектр ЯМР 13СJmod, δ,
пиррола 7) в 22 мл ТГФ и 5 мл ДМСО прибавляли
м.д.: 11.13 (2CH3СН=), 26.40 [4,4'-С(CH3)2], 28.69
1.50 г (15.6 ммоль, 1.15 экв) t-BuONa, перемеши-
(2CH2С=),
59.78
(2OCH3),
84.50
[4,4'-С(CH3)2],
вали 30 мин при ~ -30°С, охлаждали до -60°С и
119.87 (2CH3СН=), 129.00 (2CH2С=), 133.98 (C5,5'),
обрабатывали 20 мл воды. После разделения слоёв
149.65 [2(CH3O)C=], 157.94 (C2,2'). Отнесение сиг-
продукты из водной фракции экстрагировали ди-
налов в спектре ЯМР 13С соединения 6 сделано
этиловым эфиром (4×20 мл), объединённую орга-
с помощью 2D спектра HMBC. Спектр ЯМР 15N,
ническую фракцию промывали водой (3×20 мл),
δ, м.д.: -55.2. Масс-спектр, m/z (Iотн, %): 418 (62)
сушили MgSO4. Растворители удаляли при пони-
[M]+, 403 (60), 306 (20), 224 (86), 209 (100), 191
женном давлении при ~20°С. В остатке получили
(33), 139 (70), 124 (48), 97 (27), 71 (36), 55 (36).
2.60 г тёмно-коричневой подвижной жидкости, из
которой методом колоночной хроматографии на
Спектры ЯМР зарегистрированы на прибо-
нейтральном Al2O3 (элюент - гексан, затем смесь
ре Bruker DPX-400 (Германия) [400.13 (1Н) и
гексан-Et2O, 10:1) выделяли 1.64 г (58%) 4,4-ди-
100.62 (13С) МГц]; гомо- и гетероядерные кор-
метил-2-(1-метоксипроп-1-ен-1-ил)-5-этени-
реляции COSY, NOESY (tm 1.1 c), HMBC, HSQC
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
НИЗКОТЕМПЕР
АТУРНАЯ ХЕМО- И СТЕРЕОСЕЛЕКТИВНАЯ [2+2]-ЦИКЛОДИМЕРИЗАЦИЯ
283
проведены на приборе Bruker AV-400 (Германия)
Cyclobutanes. Ed. A. de Meijere. Stuttgart-N.Y.: Georg
в CDCl3, рабочая частота 40.6 МГц (15N), вну-
Thieme Verlag, 2014, E 17e.
тренний стандарт - ГМДС (δН 0.05 м.д.), CDCl3
3.
Jacobs T.L., McClenon J.R., Muscio O.J., Jr. J. Am.
(δС 77.00 м.д.) и MeNO2 (δN 0.00 м.д.). ИК спек-
Chem. Soc. 1969, 91, 6038-6041.
тры записаны на спектрометре Bruker Vertex 70
4.
Pasto D.J. J. Am. Chem. Soc. 1979, 101, 37-46. doi
(Германия) в тонком слое. Контроль за ходом реак-
10.1021/ja00495a007
ций и чистотой полученных соединений осущест-
5.
Hoover F.W., Lindsey R.V., Jr. J. Org. Chem. 1969, 34,
вляли методами ТСХ (на пластинах Silica gel 60
3051-3052. doi 10.1021/jo01262a057
F254) и ЯМР 1Н. Для колоночной хроматографии
6.
Azizoğlu A., Özen R., Hökelek T., Balci M. J. Org.
использовали нейтральный Al2O3. ТГФ очищали
Chem. 2004, 69, 1202-1206. doi 10.1021/jo035450z
диспергированным KOH (~50 г/л), кипячением и
7.
Jiang D., Li Q., Fu M., Zhao X., Meng Q., Zhao L.
перегонкой над Na в присутствии бензофенона в
Catal. Sci. Technol. 2019, 9, 1273-1278. doi 10.1039/
атмосфере аргона. ДМСО абсолютировали пере-
c8cy02434k
гонкой с t-BuOK. Метоксиаллен и изопропилизо-
8.
Saito S., Hirayama K., Kabuto C., Yamamoto Y. J. Am.
тиоцианат синтезированы по методикам [18, 19]
Chem. Soc. 2000, 122, 10776-10780. doi 10.1021/
соответственно. Бутиллитий (2.5 М раствор в гек-
ja002241c
сане) и другие использованные в работе реагенты
9.
Eguchi H., Nishiyama H., Inagi S., Tomita I. Asian
и растворители - коммерческие препараты. Для
J. Org. Chem.
2017,
6,
165-168. doi
10.1002/
охлаждения применяли жидкий азот.
ajoc.201600564
10.
The Chemistry of Cyclobutanes (Patai Series: The
ВЫВОДЫ
Chemistry of Functional Groups). Eds. Z. Rappoport,
Открыта необычная автотрансформация вы-
J.F. Liebman. Chichester: John Wiley & Sons Ltd.,
сокофункционализированных алленов с
«экзо-
2005.
тическими» заместителями, легко получаемых
11.
Piers E., Boehringer E.M., Yee J.G.K. J. Org. Chem.
из доступных алленовых карбанионов, изоти-
1998, 63, 8642-8643.
оцианатов и алкилирующих агентов, приводя-
12.
Yokozawa T., Tsuruta E.-I. Macromolecules. 1996, 29,
щая к 1,3-бис(метилен)циклобутанам с 4,5-диги-
8053-8056.
дро-1,3-тиазольными и 1-метоксипроп-1-ен-1-иль-
13.
Belluš D., Ernst B. Angew. Chem., Int. Ed. 1988, 27,
ными заместителями, являющимся перспектив-
797-827.
ными структурными блоками для органического
14.
Недоля Н.А., Тарасова О.А., Албанов А.И., Уша-
синтеза и фармакологии.
ков И.А., Брандсма Л. ЖОрХ. 2007, 43, 463-466.
БЛАГОДАРНОСТИ
[Nedolya N.A., Tarasova O.A., Albanov A.I., Usha-
kov I.A., Brandsma L. Russ. J. Org. Chem. 2007, 43,
Работа выполнена с использованием оборудо-
463-467.] doi 10.1134/S1070428007030268
вания Байкальского аналитического центра кол-
15.
Атавин А.С., Лавров В.И., Сидорова О.Н., Трофи-
лективного пользования СО РАН.
мов Б.А. ЖОрХ. 1971, 7, 235-240.
КОНФЛИКТ ИНТЕРЕСОВ
16.
Трофимов Б.А. Гетероатомные производные аце-
тилена. М.: Наука, 1981, 45-46.
Авторы заявляют об отсутствии конфликта ин-
17.
Nedolya N.A., Tarasova O.A., Albanov A.I., Klyba L.V.,
тересов.
Trofimov B.A. Tetrahedron. 2017, 73, 1085-1097. doi
СПИСОК ЛИТЕРАТУРЫ
10.1016/j.tet.2016.12.064
1. Alcaide B., Almendros P., Aragoncillo C. Chem. Soc.
18.
Hoff S., Brandsma L., Arens J.F. Recl. Trav. Chim.
Rev. 2010, 39, 783-816. doi 10.1039/b913749a
Pays-Bas. 1968, 87, 916-924.
2. Houben-Weyl Methods of Organic Chemistry:
19.
Trofimov B.A., Nedolya N.A., Gerasimova V.V.,
Carbocyclic Four-Membered Ring Compounds,
Voronkov M.G. Sulfur Lett. 1988, 8, 73-78.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021
284
ТАРАСОВА и др.
Low-Temperature Chemo- and Stereoselective
[2+2]-Cyclodimerization of 5-Ethenylidene-4,5-dihydro-
1,3-thiazole: Approach to Unique Derivatives
of 1,3-Bis(methylene)cyclobutane
O. A. Tarasova, N. A. Nedolya*, A. I. Albanov, and B. A. Trofimov
A.E. Favorsky Irkutsk Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences,
ul. Favorskogo, 1, Irkutsk, 664033 Russia
*e-mail: na_nedolya@mail.ru
Received November 11, 2020; revised November 25, 2020; accepted November 29, 2020
An unusual [2+2]-cyclodimerization of 5-ethenylidene-4,5-dihydro-1,3-thiazole, obtained from lithiated
methoxyallene, isopropyl isothiocyanate, and propargylbromide, into highly functionalized 1,3-bis(methylene)-
cyclobutane is found.
Keywords: 1-lithio-1-methoxyallene, isothiocyanate, propargylbromide, azatrienes, 5-ethenylidene-4,5-di-
hydro-1,3-thiazole, [2+2]-cyclodimerization, 1,3-bis(methylene)cyclobutane derivative
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 2 2021