ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 3, с. 373-383
УДК 547-305
РЕАКЦИИ КАРКАСНЫХ СУБСТРАТОВ
С S-НУКЛЕОФИЛАМИ
© 2021 г. Ю. Н. Климочкин, Е. А. Ивлева*, В. А. Ширяев
ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
*e-mail: ivleva.ea@samgtu.ru
Поступила в редакцию 14.12.2020 г.
После доработки 20.12.2020 г.
Принята к публикации 24.12.2020 г.
Реакцией спиртов адамантанового ряда или их нитратов с S-нуклеофилами в среде 94%-ной серной
кислоты синтезирован ряд новых серосодержащих производных каркасного строения: тиокарбаматов,
изотиоцианатов, дитиокарбаматов. Ди-(1-адамантил)дисульфид получен взаимодействием 1-нитрокси-
адамантана с нонагидратом сульфида натрия в 94%-ной серной кислоте.
Ключевые слова: S-нуклеофилы, адамантан, каркасные соединения, серная кислота, функционализация,
нитроксипроизводные адамантана, гидроксипроизводные адамантана
DOI: 10.31857/S0514749221030058
ВВЕДЕНИЕ
присутствии катализаторов кислотной природы
[17-22] в данной работе мы представляем синтез
Серосодержащие производные каркасных со-
ряда серосодержащих соединений адамантанового
единений нашли свое применение в качестве суб-
ряда. В качестве исходных каркасных субстратов
стратов в синтезе веществ и материалов приклад-
были использованы нитроксипроизводные и спир-
ного значения. Их используют для формирования
ты, в том числе содержащие акцепторные группы,
самоорганизующихся монослоев на поверхности
а в качестве S-нуклеофилов - тиоцианаты, роданид
золота [1-6], в создании кластеров наноразмерной
калия и соли дитиокарбаминовой кислоты.
структуры [7-8], а также в синтезе биологически
активных молекул [9-13]. Некоторые из серосодер-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
жащих производных адамантана сами проявляют
Широко используемая в химии каркасных
разнообразный спектр биологической активности.
соединений реакция Риттера может быть рас-
Например, адамантилтиомочевины, содержащие
пространена и на тиоцианаты, электрофильное
ароматический фрагмент, выступают ингибитора-
N-алкилирование которых через промежуточный
ми растворимой эпоксидгидролазы [14]; адаман-
резонансно-стабилизированный тионитрилиевый
тилтиомочевины, содержащие гетероароматиче-
ион приводит к S-алкилмонотиокарбаматам [28,
ский фрагмент, проявляют антипролиферативную
29]. Для установления границ применимости и
активность [15]; N-адамантилированные тиокар-
расширения ассортимента тиокарбаматов каркас-
баматы обладают вирусингибирующим действием
ного строения в качестве исходных субстратов
[16].
нами были использованы нитроксипроизводные
Продолжая исследования по разработке удоб-
адамантанового ряда
1-3, содержащие акцеп-
ных в препаративном отношении методов синтеза
торные группы в узловом положении каркаса
функциональных производных на основе карбо-
(схема 1). Выход тиокарбаматов 5-7 составил
катионных превращений каркасных субстратов в
66-72%. Тиокарбамат
8 протоадамантановой
373
374
КЛИМОЧКИН и др.
Схема 1
H
CH3SCN
N S
R-OX
R
CH3
H
2SO4
O
1-4
5-8
X = NO2, R = 3F3C-1-Ad (1, 5); R = 3-HOOC-1-Ad (2, 6); R = 3-HOOCCH2-1-Ad (3, 7);
X = H, R = 6-протоадамантил (4, 8).
структуры, которая способна к изомеризации в
перенос может быть подавлен при проведении
адамантан в серной кислоте, был синтезирован
реакции в трифторуксусной кислоте, где получен
добавлением 6-протоадамантанола (4) к предвари-
2-(1-адамантил)-2-метилтиокарбониламиноада-
тельно полученному раствору метилтиоцианата в
мантан (11) с выходом 16% (схема 2). Строение
серной кислоте (схема 1).
тиоуретанов 10 и 11 однозначно подтверждается
характером поглощения метильных групп в спек-
Спектр ЯМР 13С протоадамантанового про-
трах ЯМР 1Н и 13С.
изводного 8 содержит 12 сигналов, поглощение
которых при 55.9 и 165.2 м.д. отвечает атому С6
При взаимодействии спирта 9 с бензилтио-
каркаса и карбонильному углероду тиоуретаново-
цианатом также происходит перегруппировка
го фрагмента.
первичного карбокатиона, однако основным на-
правлением реакции становится алкилирование
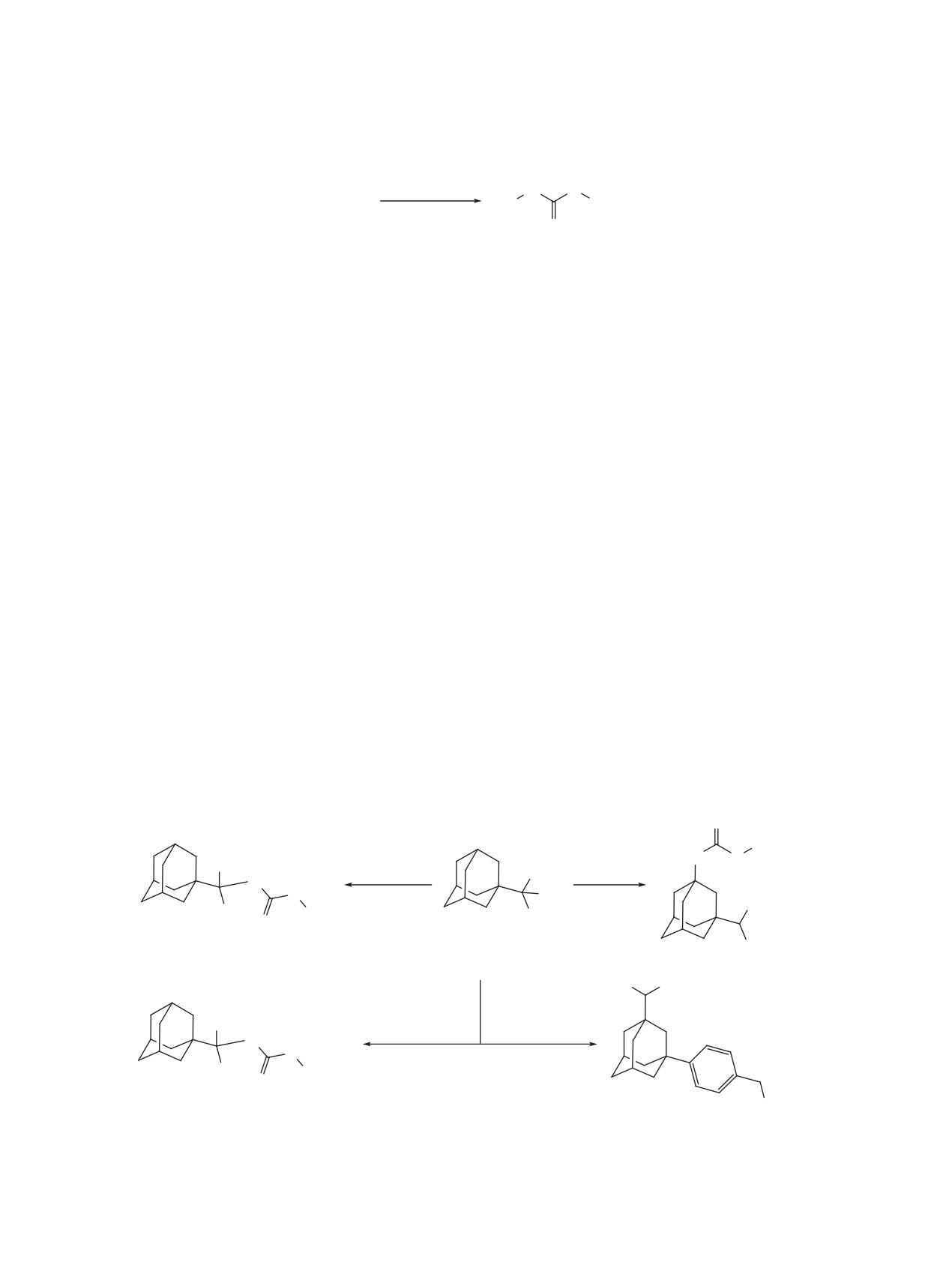
Адамантилизопропанол 9 в условиях реакции
по Фриделю-Крафтсу с образованием 1-изопро-
с метилтиоцианатом претерпевает обусловленную
пил-3-[(4-изотиоцианатометил)фенил]адамантана
межмолекулярным гидридным переносом пере-
(13). При добавлении серной кислоты к раствору
группировку [30] и дает 1-метилтиокарбонилами-
спирта 9 и бензилтиоцианата в хлороформе при
но-3-изопропиладамантан (10) (схема 2). Это ста-
0°C изомеризации не происходит и образуется
новится косвенным подтверждением пониженной
тиокарбамат 12 (схема 2).
(по сравнению с нитрилами) реакционной способ-
ности тиоцианатов в реакции Риттера, поскольку
Продукт 13 был получен и из спирта 14. По-
при взаимодействии с ацетонитрилом спирт 9 не
видимому, в данных условиях происходит бы-
дает продукта перегруппировки [30]. Гидридный
страя изомеризация тиоцианата в изотиоцианат,
Схема 2
O
CH3
HN S
CH3
H
CH3SCN
CH3
CH3SCN
N
S
CF3COOH
OH H2SO4
CH
3
CH3
CH3
CH3
O
CH3
11
9
10
H3C
CH3
CH3
H
C6H5CH2SCN
C6H5CH2SCN
N
S
H2SO4-CHCl3
H2SO4
CH3
CH2C6H5
O
NCS
12
13
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 3 2021
РЕАКЦИИ КАРКАСНЫХ СУБСТР
АТОВ С S-НУКЛЕОФИЛАМИ
375
Схема 3
H3C
CH3
CH3
H3C
CH3
N
CH
3
1.
HN
HCl
N
C6H5CH2SCN
13
H2SO4
C2H5OH
H
N
2. HCl
N
OH
S
14
15
способный подвергаться электрофильной атаке
(схема 4). Изомерных тиоцианатов выделено не
только по бензольному кольцу. Строение соеди-
было. Вероятно, образующиеся в незначительных
нения 13 косвенно подтверждено его реакцией с
количествах 1-адамантилтиоцианаты, как это из-
N-метилпиперазином до соответствующей тиомо-
вестно из литературы [36], в кислой среде быстро
чевины 15 (схема 3).
перегруппировываются в изотиоцианопроизво-
дные.
Химическое поведение амбидентного по своей
природе роданид-аниона в реакциях нуклефильно-
Спектры ИК соединений 21-25 содержат ин-
го замещения демонстрирует концепцию ЖМКО
тенсивные, широкие и расщепленные полосы по-
[31, 32]. В бимолекулярных процессах нуклео-
глощения при 2065-2090 см-1 и пики в области
670-690 см-1, отвечающие асимметричным и сим-
фильным центром выступает легко поляризуемый
атом серы, в то время как электрофильная атака
метричным колебаниям группы NCS. В спектрах
ЯМР 13С полученных соединений сигналы четвер-
карбокатионов направлена преимущественно на
тичных атомов углерода, связанных с атомом азо-
атом азота, где сосредоточен наибольший отрица-
та, проявляются при 58-60 м.д.
тельный заряд [33, 34]. Существующие способы
получения 1-адамантилизотиоцианата (21) вклю-
Для качественной оценки реакционной спо-
чают реакции галогенидов адамантана с родани-
собности соединения
21 были синтезированы
дом калия в ДМФА [35], с триметилсилилизотио-
некоторые производные на его основе (схема 5).
цианатом в присутствии тетрахлорида титана [36],
Объемный каркасный фрагмент вызывает замет-
реакции 1-аминоадамантана с сероуглеродом [37,
ное снижение электрофильной активности изотио-
38], фенилизотиоцианатом [39] и другими реаген-
цианата 21. Двухчасовым кипячением с изопропи-
тами [40-44], раскрытие 1,3-дегидроадамантана
ловым спиртом получен О-изопропилтиокарбамат
под действием роданида калия [45].
26. С гидразин-гидратом изотиоцианат 21 дает
тиосемикарбазид 27.
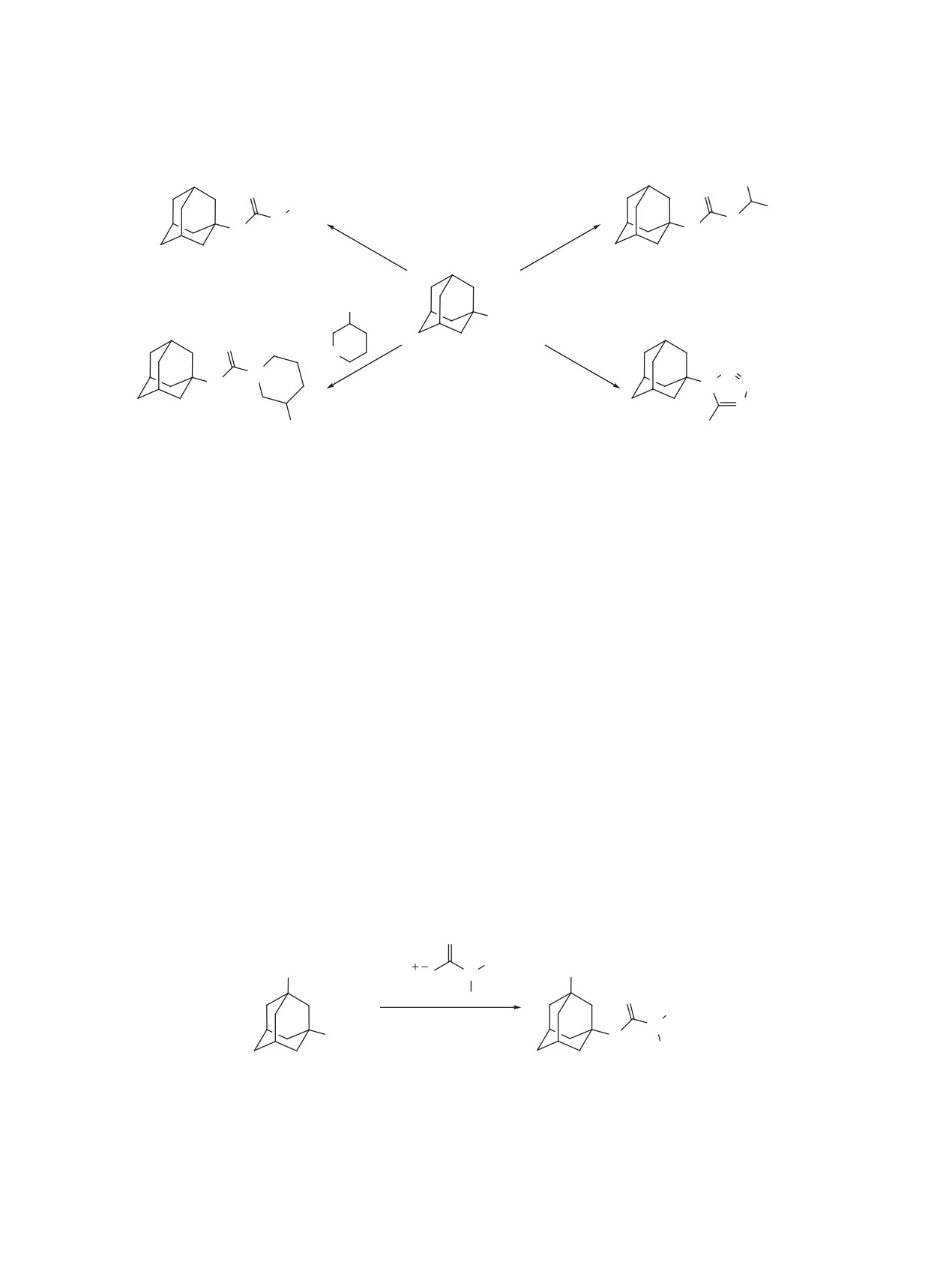
Взаимодействие нитроксипроизводных ада-
мантанового ряда 16-20 с роданидом калия в
Присоединение азид-аниона к 21 ведет к на-
среде концентрированной серной кислоты при-
триевой соли меркаптотетразола 28, обработкой
водит к образованию изотиоцианатов 21-25 [46]
которой уксусной кислотой получен 5-(1-адаман-
Схема 4
R1
R1
KNCS
R2
H2SO4
R2
ONO2
NCS
R3
R3
16-20
21-25
R1 = R2 = R3 = H (16, 21); R1 = CH3, R2 = R3 = H (17, 22); R1 = C2H5, R2 = R3 = H (18, 23);
R1 = R2 = CH3, R3 = H (19, 24); R1 = R2 = R3 = CH3 (20, 25).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 3 2021
376
КЛИМОЧКИН и др.
Схема 5
H3C
S
S
NH2
CH3
N
O
N
H
N2H4·H2O
(CH3)2CHOH
N
H
H
NaOH
27
26
OH
NCS
S
21
HN
NaN3
C2H5OH
N
N
1,4-диоксан-H2O
N
N
N
H
N
OH
HS
29
28
тил)-1-меркаптотетразол (28). Реакцией 21 с 3-
матам 30-33 (схема 6) [48]. Вероятно, в условиях
гидроксипиперидином синтезирована замещенная
реакции скорость электрофильной атаки адаман-
тиомочевина 29, строение которой доказано дан-
тильного катиона выше скорости разложения ди-
ными спектра ЯМР 1Н.
тиокарбаминовой кислоты.
Две неподеленные пары электронов и высокая
Характерной особенностью спектров ЯМР
поляризуемость двухвалентной серы определяют
1Н соединений 30-33 стало заметное уширение
активность серосодержащих анионов в реакци-
сигналов протонов метиленовых групп при 3.70-
ях нуклеофильного замещения. Соли дитиокар-
4.04 м.д., соседствующих с атомом азота дитио-
баминовой кислоты использовались для синтеза
карбаматного фрагмента.
дитиоуретанов по реакции SN2-замещения [47],
Из реакции 1-нитроксиадамантана (16) с нона-
однако применение дитиокарбаминовых кислот,
гидратом сульфида натрия в среде концентриро-
как нуклеофилов в процессах с участием карбо-
ванной серной кислоты вместо ожидаемых 1-ада-
катионов не известно, поскольку в кислой среде
мантилмеркаптана либо бис-(1-адамантил)суль-
дитиокарбаматы металлов быстро разлагаются с
фида выделен только ди-(1-адамантил)дисульфид
образованием сероуглерода. Установлено, что вза-
(34) (схема 7).
имодействие нитратов 16-18 с натриевыми солями
N,N-дизамещенных дитиокарбаминовых кислот в
Образование дисульфида 34 связано с быстрым
94%-ной серной кислоте приводит к образованию
окислением первичного меркаптоадамантана вы-
продуктов S-адамантилирования
- дитиокарба-
деляющейся из нитрата 16 азотной кислотой.
Схема 6
S
R1
R
R
Na
S
N
R2
S
1
R
H2SO4
N
ONO2
S
R2
16-18
30-33
R = H, R1 = R2 = C2H5 (30), R = CH3, R1 = R2 = C2H5 (31), R = R1 = R2 = C2H5 (32),
R = C2H5, R1 + R2 = (CH2)5 (33).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 3 2021
РЕАКЦИИ КАРКАСНЫХ СУБСТР
АТОВ С S-НУКЛЕОФИЛАМИ
377
Схема 7
Na2S·9H2O
S
H2SO4
S
ONO2
16
34
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
выдерживали при перемешивании при -10°С в
течение 1 ч и выливали на измельченный лед.
ИК спектры регистрировались на спектроме-
Выпавший осадок отфильтровывали, промывали
тре Shimadzu IR Affinity-1 (Япония) в таблетках
водой до нейтральной среды и сушили. Продукты
KBr. Спектры ЯМР 1Н и 13C зарегистрированы на
очищали перекристаллизацией.
спектрометре JEOL NMR-ECX400 (Япония) (400,
100 МГц, соответственно) с использованием оста-
S-Метил-(3-трифторметил-1-адамантил)-
точного сигнала дейтерированного растворителя
карбамотиоат (5) получен из 2 г (0.007 моль) сое-
в качестве внутреннего стандарта. Химические
динения 1, 15 мл 94%-ной серной кислоты и 2 мл
сдвиги сигналов определены в шкале δ м.д.
(0.03 моль) метилтиоцианата и перекристаллизо-
Температуры плавления определены капилляр-
ван из гексана. Выход 1.41 г (69%), т.пл. 107-109°С.
ным методом на приборе SRS OptiMelt MPA 100
ИК спектр, ν, см-1: 3215, 1645, 1540, 1180, 1135.
(Германия), не корректировались. Элементный
Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.47-2.29 м (14Н,
анализ выполнен на элементном анализаторе
СНAd), 2.17 с (3Н, CH3), 6.91 с (1Н, NH). Спектр
EuroVector 3000 EA (Италия) с использованием в
ЯМР 13C (CDCl3), δ, м.д.: 27.8 (CH3), 29.0 (CH),
качестве стандарта L-цистина. Разделение смесей
33.4 (CH2), 37.8 (CH2), 39.0 (CH2), 40.0 (CH2), 40.8
проводили с использованием силикагеля Merck
к (Счетв, 2JCF 26.8 Гц), 55.6 (Cчетв), 128.6 к (Счетв,
Kieselgel 0.040-0.063 мм. Тонкослойную хрома-
1JCF 279.9 Гц), 164.9 (Cчетв). Найдено, %: C 53.16;
тографию проводили с использованием пластин
H 6.27; N 4.70; S 10.86. C13H18F3NOS. Вычислено,
«Сорбфил ПТСХ-АФ А» (5-17 мкм). Синтез со-
%: C 53.23; H 6.19; N 4.77; S 10.93.
единений 2, 3 осуществляли по методу [24]. Спир-
3-{[(Метилтио)карбонил]амино}адаман-
ты 4, 9 и 14 получали по методикам [49] и [50] со-
тан-1-карбоновая кислота (6) получена из 2 г
ответственно. Нитраты 16-20 синтезировали по
(0.008 моль) кислоты 2, 16 мл 94%-ной серной
описанным ранее методам [18, 51].
кислоты и 2 мл (0.03 моль) метилтиоцианата и пе-
3-Трифторметил-1-адамантилнитрат (1) син-
рекристаллизована из смеси гептан-2-пропанол.
тезирован по методу [24] из 5 г 1-трифтормети-
Выход 1.60 г (72%), т.пл. 213-217°С. ИК спектр,
ладамантана. Выход 6.1 г (94%), nD20 1.4638. ИК
ν, см-1: 3300, 1695, 1650, 1525, 1290, 1210. Спектр
спектр, ν, см-1: 1620, 1275, 1180, 1135, 857. Спектр
ЯМР 1H (CDCl3), δ, м.д.: 1.50-2.55 м (14Н, СНAd),
ЯМР 1H (CDCl3), δ, м.д.: 1.73-1.80 м (2Н, СНAd),
2.17 с (3Н, CH3), 6.75 с (1Н, NH), 10.94 с (1Н, OH).
1.98-2.45 м (12Н, СНAd). Спектр ЯМР 13C (CDCl3),
Спектр ЯМР 13C (CDCl3), δ, м.д.: 28.0 (CH3), 28.1
δ, м.д.: 30.3 (CH), 33.9 (CH2), 38.0 (CH2), 39.5
(CH), 36.1 (CH2), 38.6 (CH2), 39.5 (CH2), 40.1 (C),
(CH2), 40.9 к (Счетв, 2JCF 26.8 Гц), 42.3 (CH2), 89.7
41.7 (CH2), 55.1 (Cчетв), 165.3 (Cчетв), 179.8 (Cчетв).
(Cчетв), 130.0 к (Счетв, 1JCF 279.9 Гц). Найдено, %:
Найдено, %: C 57.91; H 7.18; N 5.13; S 11.84.
C 49.75; H 5.37; N 5.20. C11H14F3NO3. Вычислено,
C13H19NO3S. Вычислено, %: C 57.97; H 7.11; N
%: C 49.81; H 5.32; N 5.28.
5.20; S 11.90.
Реакции нитроксипроизводных 1-3 с ме-
3-{[(Метилтио)карбонил]амино}-1-адаман-
тилтиоцианатом. К 94%-ной серной кислоте при
тилуксусная кислота
(7) получена из
2 г
перемешивании при 20-25°С добавляли субстрат
(0.008 моль) кислоты 3, 16 мл 94%-ной серной
1-3. Реакционную смесь охлаждали до -10°С и
кислоты и 2 мл (0.03 моль) метилтиоцианата и пе-
по каплям добавляли метилтиоцианат таким обра-
рекристаллизована из смеси гептан-2-пропанол.
зом, чтобы температура не превышала 0°С. Смесь
Выход 1.46 г (66%), т.пл. 156-159°С. ИК спектр,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 3 2021
378
КЛИМОЧКИН и др.
ν, см-1: 3290, 1715, 1635, 1530, 1285, 1220. Спектр
S-Метил-[2-(1-адамантил)пропан-2-ил]кар-
ЯМР 1H (CDCl3), δ, м.д: 1.47-2.27 м (14Н, СНAd),
бамотиоат (11). К раствору 0.9 мл (0.014 моль) ме-
2.06 с (2Н, CH2), 2.15 с (3Н, CH3), 6.65 с (1Н, NH),
тилтиоцианата в 10 мл трифторуксусной кислоты
12.35 с (1Н, OH). Спектр ЯМР 13C (CDCl3), δ,
добавляли 1 г (0.005 моль) спирта 9 при комнат-
м.д.: 27.6 (СH3), 28.5 (CH), 32.7 (Cчетв), 36.3 (CH2),
ной температуре. Реакционную смесь оставляли
39.6 (CH2), 41.7 (CH2), 45.1 (CH2), 48.4 (CH2),
на ночь, избыток трифторуксусной кислоты упа-
54.8 (Cчетв), 165.0 (Cчетв), 172.9 (Cчетв). Найдено,
ривали. Остаток очищали колоночной хроматогра-
%: C 59.28; H 7.55; N 4.86; S 11.25. C14H21NO3S.
фией на силикагеле (элюент - гексан) и перекри-
Вычислено, %: C 59.34; H 7.47; N 4.94; S 11.31.
сталлизовывали из метанола. Выход 0.22 г (16%),
Реакции спиртов 4, 9 с метилтиоцианатом.
т.пл. 68-70°С. ИК спектр, ν, см-1: 3340, 1685, 1500,
К 94%-ной серной кислоте при перемешивании
1205, 1190. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.28
при 20°С порциями последовательно добавляли
с (6Н, СН3), 1.45-2.00 м (15Н, CHAd), 2.24 с (3Н,
метилтиоцианат и спирт 4, 9. Реакционную смесь
СН3), 5.04 с (1Н, NH). Спектр ЯМР 13C (CDCl3),
выдерживали при перемешивании при 20°С в те-
δ, м.д.: 24.1 (CH3), 28.2 (CH3), 29.2 (CH), 34.3
чение 30 мин и выливали на измельченный лед.
(CH2), 35.9 (CH2), 37.0 (Cчетв), 56.3 (Cчетв), 166.4
Продукт экстрагировали диэтиловым эфиром
(Cчетв). Найдено, %: C 67.29; H 9.52; N 5.17; S
(3×10 мл), объединенные органические экстракты
11.89. C15H25NOS. Вычислено, %: C 67.37; H 9.42;
промывали водой (4×5 мл), сушили над безводным
N 5.24; S 11.99.
сульфатом натрия и упаривали. Остаток очищали
S-Бензил-[2-(1-адамантил)пропан-2-ил]кар-
перекристаллизацией.
бамотиоат (12). К раствору 1 г (0.005 моль) спир-
S-Метил-(6-протоадамантил)карбамотиоат
та 9 и 1.5 г (0.01 моль) бензилтиоцианата в 5 мл
(8) получен из 1 г (0.007 моль) 6-протоадаманта-
хлороформа при 0°С при перемешивании по ка-
нола (4), 8 мл 94%-ной серной кислоты и 1.8 мл
плям добавляли 4 мл 94%-ной серной кислоты.
(0.027 моль) метилтиоцианата и перекристаллизо-
Реакционную смесь выдерживали 1 ч при 0°С,
ван из гексана. Выход 0.92 г (63%), т.пл. 89-91°С.
разбавляли водой и экстрагировали хлороформом
ИК спектр, ν, см-1: 3300, 1640, 1520, 1200, 860.
(3×7 мл). Объединенные органические фракции
Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.35-2.25 м (15Н,
промывали водой, сушили хлоридом кальция, рас-
CH), 2.26 с (3Н, СН3), 5.15 с (1Н, NH). Спектр ЯМР
творитель упаривали. Остаток перекристаллизо-
13C (CDCl3), δ, м.д.: 27.7 (CH3), 33.0 (CH2), 34.0
вывали из метанола. Выход 0.87 г (51%), т.пл. 62-
(CH2), 34.8 (CH2), 34.9 (CH), 35.0 (CH), 36.3 (CH2),
65°С. ИК спектр, ν, см-1: 3360, 1690, 1493, 1208,
37.4 (CH2), 40.9 (CH2), 44.9 (CH2), 55.9 (Счетв),
1180, 690. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.26
165.2 (Счетв). Найдено, %: C 63.88; H 8.57; N 6.16; S
с (6Н, СН3), 1.50-1.95 м (15Н, CHAd), 3.98 с (2Н,
14.16. C12H19NOS. Вычислено, %: C 63.96; H 8.50;
СН2), 7.09 с (1Н, NH), 7.18-7.35 м (5Наром). Спектр
N 6.22; S 14.23.
ЯМР 13C (CDCl3), δ, м.д.: 24.3 (CH3), 29.0 (CH),
S-Метил-(3-изопропил-1-адамантил)карба-
33.4 (CH2), 35.9 (CH2), 37.1 (Cчетв), 57.0 (Cчетв),
мотиоат (10) получен из 2 г (0.01 моль) спир-
127.0 (CH), 127.9 (CH), 128.7 (Cчетв), 130.9 (CH),
та 9, 10 мл 94%-ной серной кислоты и 3.7 мл
166.2 (Cчетв). Найдено, %: С 73.29; Н 8.29; N 4.14;
(0.055 моль) метилтиоцианата и перекристаллизо-
S 9.22. С21Н29NОS. Вычислено, %: С 73.42; Н 8.51;
ван из гексана. Выход 2.36 г (86%), т.пл. 126-128°С.
N 4.08; S 9.33.
ИК спектр, ν, см-1: 3320, 1660, 1520, 1203. Спектр
ЯМР 1H (CDCl3), δ, м.д.: 0.84 с (6Н, CH3), 1.26
1-Изопропил-3-[(4-изотиоцианатометил)фе-
с (1Н, CH), 1.35-2.21 м (14Н, CHAd), 2.16 с (3Н,
нил]адамантан (13) получен аналогично соедине-
CH3), 6.82 с (1Н, NH). Спектр ЯМР 13C (CDCl3),
нию 10 из 1 г (0.005 моль) спирта 9, 5 мл 94%-ной
δ, м.д.: 7.5 (CH3), 24.3 (CH), 27.9 (CH3), 28.7 (CH),
серной кислоты и 1.5 г (0.01 моль) бензилтиоциа-
34.3 (Cчетв), 38.0 (CH2), 38.7 (CH2), 40.0 (CH2),
ната с выходом 25% и из 1 г (0.005 моль) спирта 14,
42.3 (CH2), 55.6 (Cчетв), 164.8 (Cчетв). Найдено,
5 мл 94%-ной серной кислоты и 1.5 г (0.01 моль)
%: C 67.27, H 9.51; N 5.14; S 11.90. C15H25NOS.
бензилтиоцианата с выходом 28%. Бесцветное
Вычислено, %: C 67.37; H 9.42; N 5.24; S 11.99.
масло, Rf 0.61 (хлороформ). ИК спектр, ν, см-1:
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 3 2021
РЕАКЦИИ КАРКАСНЫХ СУБСТР
АТОВ С S-НУКЛЕОФИЛАМИ
379
3035, 2195, 1498, 700. Спектр ЯМР 1H (CDCl3), δ,
1-Изотиоцианато-3-метиладамантан (22) из
м.д.: 0.78 д (6H, CH3, J 7.3 Гц), 1.50-2.02 м (15Н,
1.5 г (0.007 моль) 3-метил-1-адамантилнитрата
CHAd, CH), 4.46 с (2Н, СН2), 7.22-7.40 м (5Наром).
(17). Выход 0.81 г (55%), т.пл. 90°С (ацетон-вода)
Спектр ЯМР 13C (CDCl3), δ, м.д.: 7.9 (CH3), 24.4
[16].
(CH), 29.1 (CH), 33.7 (Cчетв), 34.3 (CH2),
35.1
1-Изотиоцианато-3-этиладамантан
(23) из
(Cчетв), 37.8 (CH2), 39.9 (CH2), 47.8 (CH2), 127.4
1.5 г (0.007 моль) 3-этил-1-адамантилнитрата (18).
(CH), 129.8 (CH), 130.3 (Cчетв), 131.2 (Cчетв), 131.7
Продукт экстрагировали хлороформом. Выход
(Cчетв). Найдено, %: С 77.57; Н 8.27; N 4.19; S 9.74.
1.15 г (78%), т.кип. 138°C (2 мм рт.ст.), nD20 1.5504.
С21Н27NS. Вычислено, %: С 77.49; Н 8.36; N 4.30;
ИК спектр, ν, см-1: 2090, 680. Спектр ЯМР 1H
S 9.85.
(CDCl3), δ, м.д.: 0.87 с (3Н, СН3, J 7.3 Гц), 1.32 к
Гидрохлорид N-[4-(3-изопропил-1-адаман-
(2Н, СН2, J 7.3 Гц), 1.45-2.00 м (8Н, СHAd), 2.05-
тил)бензил]-4-метилпиперазин-1-карботио-
2.44 м (6Н, СHAd). Спектр ЯМР 13C (CDCl3), δ,
амида (15). Раствор 0.32 г (0.001 моль) соедине-
м.д.: 7.4 (CH3), 28.8 (CH), 32.0 (Cчетв), 33.4 (CH2),
ния 13, 10 мл этанола и 0.5 мл N-метилпиперазина
35.4 (CH2), 37.7 (CH2), 38.2 (CH2), 41.3 (CH2), 59.4
выдерживали при комнатной температуре в те-
(Cчетв). Найдено, %: С 70.40; Н 8.49; N 6.46; S
чение 15 ч и выливали в воду. Выпавший осадок
14.32. C13H19NS. Вычислено, %: С 70.54; Н 8.65;
отфильтровывали, сушили, растворяли в бензоле
N 6.33; S 14.48.
и пропускали газообразный НCl. Осадок отфиль-
1-Изотиоцианато-3,5-диметиладамантан (24)
тровывали и перекристаллизовывали из смеси эта-
из 1.5 г (0.007 моль) 3,5-диметил-1-адамантилни-
нол-бензол. Выход 0.3 г (65%), т.пл. 171-174°C.
трата (19). Продукт экстрагировали хлороформом.
ИК спектр, ν, см-1: 3240, 2560, 1620, 1500, 695.
Выход 1.05 г (71%), т.кип. 140°C (3 мм рт.ст.), nD20
Спектр ЯМР 1H (DMSO-d6), δ, м.д.: 0.81 д (6H,
1.5474 [16].
CH3, J 7.3 Гц), 1.46-2.12 м (15Н, CHAd, CH), 2.42
c (2Н, СН2), 3.21-3.63 м (4Н, СН2), 3.84-4.36 м
1-Изотиоцианато-3,5,7-триметиладамантан
(25) из 1.5 г (0.006 моль) 3,5,7-триметил-1-ада-
(4Н, СН2), 4.49 с (2Н, СН2), 7.18-7.34 м (4Наром),
8.62 уш.с (2H, NH). Спектр ЯМР 13C (DMSO-d6),
мантилнитрата (20). Выход 0.97 г (66%), т.кип.
143°C (2 мм рт.ст.), т.пл. 51-52°C (метанол). ИК
δ, м.д.: 7.8 (CH3), 24.4 (CH), 30.0 (CH), 33.9 (Cчетв),
34.4 (CH2), 36.8 (CH3), 37.8 (CH2), 39.4 (CH2), 43.2
спектр, ν, см-1: 2080, 670. Спектр ЯМР 1H (CDCl3),
(CH2), 45.2 (CH2), 46.3 (CH2), 47.1 (CH2), 126.0
δ, м.д.: 0.85 c (9H, CH3), 1.86 c (6H, CHAd), 2.14
(CH), 128.9 (CH), 135.4 (Cчетв), 144.8 (Cчетв), 174.4
c (6H, CHAd). Спектр ЯМР 13C (CDCl3), δ, м.д.:
(Cчетв). Найдено, %: 67.48; Н 8.82; N 8.99; S 6.81.
29.8 (CH3), 32.0 (Cчетв), 38.4 (CH2), 40.9 (CH2),
С26Н40ClN3S. Вычислено, %: С 67.57; Н 8.72; N
58.8 (Cчетв). Найдено, %: С 71.55; Н 9.02; N 5.84;
9.09; S 6.94.
S 13.51. C14H21NS. Вычислено, %: С 71.44; Н 8.99;
N 5.95; S 13.62.
Синтез изотиоцианатов 21-25.
О-Изопропил-(1-адамантил)карбамотиоат
1-Изотиоцианатоадамантан (21). К 100 мл
(26). К раствору 2 г (0.05 моль) гидроксида натрия
94%-ной серной кислоты при температуре не бо-
в 30 мл изопропилового спирта и 20 мл воды добав-
лее 20°C добавляли 20 г (0.1 моль) 1-нитрокси-
ляли 2 г (0.01 моль) соединения 21. Полученную
адамантана (16), затем при 15-20°C порциями
смесь нагревали при кипении 2 ч и выливали в
прибавляли 15 г (0.15 моль) тиоцианата калия.
200 мл воды. Выпавший осадок отфильтровывали,
Реакционную смесь выдерживали в течение 2 ч
промывали водой, сушили и перекристаллизовы-
при 20°C и выливали на 1 кг льда. Выпавший
вали из смеси гексан-ацетон (5:1). Выход 2.05 г
осадок отфильтровывали, промывали водой до
(78%), т.пл. 190°C (разл.). ИК спектр, ν, см-1: 3255,
нейтральной реакции, сушили и перекристаллизо-
1540. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.42 д (6Н,
вывали из этанола. Выход 12.7 г (64%), т.пл. 172-
СН3, J 7.3 Гц), 1.70-2.20 м (15Н, СHAd), 5.60 с (1Н,
173°С [16].
СН), 6.61 с (1Н, NH). Спектр ЯМР 13C (CDCl3), δ,
Аналогично получены следующие соединения.
м.д.: 24.4 (CH3), 29.0 (CH), 36.7 (CH2), 40.3 (CH2),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 3 2021
380
КЛИМОЧКИН и др.
55.2 (Cчетв), 76.4 (CH), 188.2 (Cчетв). Найдено,
вали в течение 1 ч при 10°C и выливали на лед.
%: С 66.26; Н 9.28; N 5.41; S 12.52. C14H23NOS.
Выпавший осадок отфильтровывали, промывали
Вычислено, %: С 66.36; Н 9.15; N 5.53; S 12.65.
водой, сушили и перекристаллизовывали.
N-(1-Адамантил)гидразинкарботиоамид
(1-Адамантил)диэтилкарбамодитиоат
(30)
(27). Смесь 1 г (0.005 моль) соединения 21 и 10 мл
получен из 7.3 г (0.037 моль) 1-нитроксиадаман-
гидразин-гидрата нагревали при кипении в тече-
тана (16), 20 мл 94%-ной серной кислоты и 8.5 г
ние 3 ч, охлаждали, выпавший осадок отфильтро-
(0.05 моль) диэтилдитиокарбамата натрия. Выход
вывали и перекристаллизовывали из смеси 2-про-
6.0 г (64%), т.пл. 92-94°C. ИК спектр, ν, см-1:
панол-ДМФА. Выход 0.96 г (85%), т.пл. 181-184°C
1400, 1295, 1250, 1200. Спектр ЯМР 1H (CDCl3),
[52].
δ, м.д.: 1.23 с (6Н, СН3), 1.68-2.35 м (15Н, CHAd),
3.72 с (2Н, СН2), 3.89 с (2Н, СН2). Спектр ЯМР 13C
1-(1-Адамантил)-1Н-тетразол-5-тиол
(28).
(CDCl3), δ, м.д.: 9.3 (CH3), 10.8 (CH3), 28.9 (CH),
Раствор 1 г (0.005 моль) соединения 21 и 1 г
34.3 (CH2), 38.8 (CH2), 46.2 (CH2), 47.0 (CH2), 50.9
(0.015 моль) азида натрия в 25 мл диоксана и
(Cчетв), 189.1 (Cчетв). Найдено, %: С 63.42; Н 9.01;
5 мл воды нагревали при кипении в течение 8 ч.
N 4.86; S 22.54. С15Н25NS2. Вычислено, %: С 63.55;
Реакционную смесь разбавляли 100 мл воды, вы-
Н 8.89; N 4.94; S 22.62.
павший осадок непрореагировавшего 21 (0.3 г)
отфильтровывали, фильтрат упаривали до объема
(3-Метил-1-адамантил)диэтилкарбамоди-
тиоат (31) получен из 2 г (0.009 моль) нитра-
10 мл и выпавший при охлаждении осадок моно-
та 17, 10 мл 94%-ной серной кислоты и 2.21 г
гидрата натриевой соли 1-(1-адамантил)-1Н-тет-
(0.013 моль) диэтилдитиокарбамата натрия. Выход
разол-5-тиола перекристаллизовывали из смеси
2.08 г (74%). Очищен колоночной хроматографи-
бензол-метанол. Выход 0.53 г (41%), т.пл. 222°C.
ей (элюент - гексан), т.пл. 26-28°C. ИК спектр, ν,
ИК спектр, ν, см-1: 3450-3250, 2150, 1610, 1380,
см-1: 1410, 1260, 1135. Спектр ЯМР 1H (CDCl3),
1290. Подкислением водного раствора соли уксус-
δ, м.д.: 0.83 с (3Н, СН3), 1.25 с (6Н, СН3), 1.40-
ной кислотой и перекристаллизацией выпавшего
2.60 м (14Н, CHAd), 3.70 с (2Н, СН2), 3.87 с (2Н,
осадка из бензола получили 0.4 г (34%) продукта
СН2). Спектр ЯМР 13C (CDCl3), δ, м.д.: 9.4 (CH3),
28, т.пл. 171-172°C (разл.) [13]. ИК спектр, ν, см-1:
10.8 (CH3), 29.0 (CH), 30.3 (CH3), 32.0 (Cчетв),
3055, 1500, 1310.
),
33.7 (CH2), 37.6 (CH2), 39.8 (CH2), 42.1 (CH2
N-(1-Адамантил)-3-гидроксипиперидин-1-
46.1 (CH2), 46.9 (CH2), 50.9 (Cчетв), 189.0 (Cчетв).
карботиоамид (29). Смесь 1 г (0.005 моль) со-
Найдено, %: С 64.50; Н 9.22; N 4.63; S 21.42.
единения 21 и 0.5 г (0.005 моль) 3-гидроксипипе-
С16Н27NS2. Вычислено, %: С 64.59; Н 9.15; N 4.71;
ридина в 10 мл этанола нагревали при кипении
S 21.55.
в течение 10 ч и охлаждали. Выпавший осадок
(3-Этил-1-адамантил)диэтилкарбамоди-
отфильтровывали и перекристаллизовывали из
тиоат (32) получен из 2 г (0.009 моль) нитрата 18,
этанола. Выход 0.8 г (54%), т.пл. 139-141°C [53].
10 мл
94%-ной серной кислоты и
2.21 г
ИК спектр, ν, см-1: 3460, 3270, 1610, 1500. Спектр
(0.013 моль) диэтилдитиокарбамата натрия. Очи-
ЯМР 1H (CDCl3), δ, м.д.: 1.58-2.27 м (19Н, CHAd,
щен колоночной хроматографией (элюент - хло-
CH2), 3.23-3.35 м (2Н, CH2), 3.72-3.83 м (1Н, СН),
роформ), Rf 0.58 (хлороформ). Выход 2.1 (76%),
4.13-4.25 м (2Н, CH2), 4.59 с (1Н, ОН), 6.35 с (1Н,
nD20 1.5781. ИК спектр, ν, см-1: 1410, 1265, 1210.
NH).
Спектр ЯМР 1H (CDCl3), δ, м.д.: 0.84 т (3Н, СН3, J
Реакции нитроксипроизводных 16-18 с на-
7.3 Гц), 1.19 к (2Н, СН2, J 7.3 Гц), 1.27 с (6Н, СН3),
триевыми солями N,N-дизамещенных дитио-
1.35-2.40 м (14Н, CHAd), 3.73 с (2Н, СН2), 3.91 с
карбаминовых кислот. К раствору нитроксипро-
(2Н, СН2). Спектр ЯМР 13C (CDCl3), δ, м.д.: 7.5
изводного 16-18 в 94%-ной серной кислоте при
(CH3), 9.3 (CH3), 10.7 (CH3), 28.7 (CH), 31.9 (Cчетв),
перемешивании при 10°C порциями добавляли
32.1 (CH2), 33.8 (CH2), 37.6 (CH2), 39.7 (CH2), 41.8
натриевую соль N,N-дизамещенной дитиокарба-
(CH2), 46.0 (CH2), 46.9 (CH2), 50.7 (Cчетв), 189.3
миновой кислоты. Реакционную смесь выдержи-
(Cчетв). Найдено, %: С 65.41; Н 9.48; N 4.39; S
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 3 2021
РЕАКЦИИ КАРКАСНЫХ СУБСТР
АТОВ С S-НУКЛЕОФИЛАМИ
381
20.47. С17Н29NS2. Вычислено, %: С 65.54; Н 9.38;
№ 20-73-00254). Исследование спектральных ха-
N 4.50; S 20.58.
рактеристик выполнено при финансовой поддерж-
ке Минобрнауки РФ в рамках проектной части
(3-Этил-1-адамантил)пиперидинкарбамо-
государственного задания № 0778-2020-0005.
дитиоат (33) получен из 2 г (0.009 моль) нитра-
та 18, 10 мл 94%-ной серной кислоты и 2.22 г
КОНФЛИКТ ИНТЕРЕСОВ
(0.012 моль) натриевой солью пиперидиндитио-
Авторы заявляют об отсутствии конфликта ин-
карбаминовой кислоты. Очищен перекристалли-
тересов.
зацией из метанола. Выход 2.29 г (79%), т.пл. 125-
128°C. ИК спектр, ν, см-1: 1420, 1215, 960. Спектр
СПИСОК ЛИТЕРАТУРЫ
ЯМР 1H (CDCl3), δ, м.д.: 0.78 т (3Н, СН3, J 7.3 Гц),
1.
Dameron A.A., Charles L.F., Weiss P.S. J. Am. Chem.
1.14 к (2Н, СН2, J 7.3 Гц), 1.37-2.38 м (20Н, CHAd,
Soc. 2005, 127, 8697-8704. doi 10.1021/ja042621o
CH2), 4.04 с (4Н, СН2). Спектр ЯМР 13C (CDCl3), δ,
2.
Kim M., Hohman J.N., Morin E.I., Daniel T.A.,
м.д.: 7.4 (CH3), 25.1 (CH2), 25.6 (CH2), 26.2 (CH2),
Weiss P.S. J. Phys. Chem. A. 2009, 113, 3895-3903. doi
29.0 (CH), 31.3 (Cчетв), 32.0 (CH2), 37.5 (CH2), 38.6
10.1021/jp810048n
(CH2), 42.3 (CH2), 43.4 (CH2), 49.7 (CH2), 51.3
3.
Kim J., Jeong H., Seong S., Kim M., Kim D.,
(CH2), 189.6 (Cчетв). Найдено, %: С 66.74; Н 9.11; N
Hwang W.-T., Jang Y., Choi B.Y., Koo J., Park S.B.,
4.25; S 19.74. С18Н29NS2. Вычислено, %: С 66.82;
Noh J., Lee T. Curr. Appl. Phys. 2017, 17, 1459-1464.
Н 9.03; N 4.33; S 19.82.
doi 10.1016/j.cap.2017.08.013
4.
Drexler C.I., Causey C.P., Mullen T.J. Scanning. 2015,
Ди-(1-адамантил)дисульфид
(34). К рас-
37, 6-16. doi 10.1002/sca.21173
твору 5.2 г (0.026 моль) нитрата 16 в 20 мл 94%-
ной серной кислоты порциями добавляли 5 г
5.
Jobbins M.M., Raigoza A.F., Kandel S.A. J. Phys.
Chem. C. 2011, 115, 25437-25441. doi 10.1021/
(0.021 моль) нонагидрата сульфида натрия. Ре-
jp209866c
акционную смесь выдерживали при переме-
6.
Kitagawa T., Nakanishi S., Mizuno A., Niwa Y., Taba-
шивании в течение 15 мин и выливали на лед.
ta H., Hirai K., Okazaki T. Arkivoc. 2018, 131-144.
Выпавший осадок отфильтровывали, промывали
doi 10.24820/ark.5550190.p010.356
водой, сушили и перекристаллизовывали из этано-
7.
Lin X., Cong H., Sun K., Fu X., Kang W., Wang X.,
ла. Выход 3.3 г (75%), т.пл. 215-218°С [54].
Jin S., Wu R., Liu C., Huang J. Nano Res. 2020, 13,
ВЫВОДЫ
366-372. doi 10.1007/s12274-020-2615-1
Предложены методы получения серосодержа-
8.
Bestgen S., Yang X., Issac I., Fuhr O., Roesky P.W.,
щих производных за счет реализации карбокати-
Fenske D. Chem. Eur. J. 2016, 22, 9933-9937. doi
10.1002/chem.201602158
онных превращений нитрокси- и гидроксипро-
изводных каркасного строения в среде 94%-ной
9.
Perricone S.C., Humphrey S.J., Skaletzky L.L., Gra-
ham B.E., Zandt R.A., Zind G.R. J. Med. Chem. 1994,
серной кислоты в присутствии S-нуклеофилов.
37, 3693-3700. doi 10.1021/jm00048a005
Полученные тиокарбаматы, изотиоцианаты и ди-
тиокарбаматы каркасного строения могут быть
10.
Kadi A.A., El-Brollosy N.R., Al-Deeb O.A., Ha-
bib E.E., Ibrahim T.M., El-Emam A.A. Eur. J.
использованы для изучения биологической актив-
Med. Chem.
2007,
42,
235-242. doi
10.1016/
ности и в качестве структурных блоков в синтезе
j.ejmech.2006.10.003
новых материалов с комплексом ценных свойств.
11.
Taha M., Ismail N.H., Imran S., Wadood A., Rahim F.,
БЛАГОДАРНОСТИ
Riaz M. Bioorg. Med. Chem. 2015, 23, 7211-7218. doi
Работа выполнена с использованием научно-
10.1016/j.bmc.2015.10.017
го оборудования центра коллективного пользова-
12.
Nasr T., Bondock S., Youns M., Fayad W., Zaghary W.
ния СамГТУ «Исследование физико-химических
Eur. J. Med. Chem. 2017, 141, 603-614. doi 10.1016/
свойств веществ и материалов».
j.ejmech.2017.10.016
13.
Zarubaev V.V., Golod E.L., Anfimov P.M., Shtro A.A.,
ФОНДОВАЯ ПОДДЕРЖКА
Saraev V.V., Gavrilov A.S., Logvinov A.V., Kiselev O.I.
Синтез соединений выполнен при финансовой
Bioorg. Med. Chem. 2010, 18, 839-848. doi 10.1016/
поддержке Российского научного фонда (проект
j.bmc.2009.11.047
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 3 2021
382
КЛИМОЧКИН и др.
14.
Burmistrov V., Morisseau C., Pitushkin D., Karlov D.,
7-20. [Klimochkin Yu.N., Leonova M.V., Ivleva E.A.,
Fayzullin R.R., Butov G.M., Hammock B.D. Bioorg.
Kazakova A.I., Zaborskaya M.S. Russ. J. Org. Chem.
Med. Chem. Lett. 2018, 28, 2302-2313. doi 10.1016/
2021, 57.] doi 10.1134/S1070428021010012
j.bmcl.2018.05.024
28.
Riemschneider R. J. Am. Chem. Soc. 1956, 78, 844-
15.
Hu H., Lin C., Ao M., Ji Y., Tang B., Zhou X., Fang M.,
847. doi 10.1021/ja01585a038
Zeng J., Wu Z. RSC Adv. 2017, 7, 51640-51651. doi
29.
Климочкин Ю.Н., Моисеев И.К. ЖОрХ. 1987, 23,
10.1039/c7ra08149a
2026.
16.
Климочкин Ю.Н., Моисеев И.К., Абрамов О.В.,
30.
Raber D.J., Fort R.C., Wiskott E., Woodworth C.W.,
Владыко Г.В., Коробченко Л.В., Бореко Е.И. Хим.-
Schleyer P.v.R., Weber J., Stetter H. Tetrahedron. 1971,
фарм. ж. 1991, 25, 49-51. [Klimochkin Yu.N., Moise-
27, 3-18. doi 10.1016/S0040-4020(01)92392-0
ev I.K., Abramov O.V., Vladyko G.V., Korobchen-
31.
Pearson R.C., Songstad J. J. Am. Chem. Soc. 1967, 89,
ko L.V., Boreko E.I. Pharm. Chem. J. 1991, 25, 489-
1827-1836. doi 10.1021/ja00984a014
492.] doi 10.1007/BF00772006
32.
Ho T.-L. Chem. Rev. 1975, 75, 1-20. doi 10.1021/
17.
Моисеев И.К., Дорошенко Р.И. ЖОрХ. 1983, 19,
cr60293a001
1117-1118.
33.
Luskin L.S., Gantert G.E., Craig W.E. J. Am. Chem.
18.
Моисеев И.К., Багрий Е.И., Климочкин Ю.Н., Дол-
Soc. 1956, 78, 4965-4967. doi 10.1021/ja01600a043
гополова Т.Н., Трахтенберг П.Л., Земцова М.Н. Изв.
34.
Wagner E.L. J. Chem. Phys. 1965, 43, 2728-2735. doi
АН. СССР. Сер. хим. 1985, 34, 2141-2143. [Moise-
10.1063/1.1697201
ev I.K., Bagrii E.I., Klimochkin Yu.N., Dolgopolo-
va T.N., Zemtsova M.N., Trakhtenberg P.L. Russ. Chem.
35.
Stetter H., Wulff C. Chem. Ber. 1962, 95, 2302-2304.
Bull. 1985, 34, 1980-1982.] doi 10.1007/BF00953950
doi 10.1002/cber.19620950932
19.
Ширяев А.К., Моисеев И.К. ЖОрХ. 2001, 37, 781-
36.
Sasaki T., Nakanishi A., Ohno M. J. Org. Chem. 1981,
782. [Shiryaev A.K., Moiseev I.K. Russ. J. Org. Chem.
46, 5445-5447. doi 10.1021/jo00339a050
2001, 37, 746-747.] doi 10.1023/A:1012428724127
37.
Spilovska K., Korabecny J., Kral J., Horova A., Musi-
20.
Моисеев И.К., Стулин Н.В., Юдашкин А.В., Кли-
lek K., Soukup O., Drtinova L., Gazova Z., Siposo-
мочкин Ю.Н. ЖОХ. 1985, 55, 1655-1656.
va K., Kuca K. Molecules. 2013, 18, 2397-2418. doi
10.3390/molecules18022397
21.
Климочкин Ю.Н., Вологин М.Ф., Коржев И.Р.,
Багрий Е.И. Нефтехимия. 2001, 41, 30-32.
38.
Munch H., Hansen J.S., Pittelkow M., Christensen J.B.,
Boas U. Tetrahedron Lett. 2008, 49, 3117-3119. doi
22.
Ивлева Е.А., Ткаченко И.М., Климочкин Ю.Н.
10.1016/j.tetlet.2008.03.045
ЖОрХ. 2016, 52, 1567-1572. [Ivleva E.A., Tkachen-
ko I.M., Klimochkin Yu. N. Russ. J. Org. Chem. 2016,
39.
Бурмистров В.В., Бутов Г.М., Питушкин Д.А.
ЖОрХ. 2015, 51, 1828-1829. [Burmistrov V.V., Bu-
52, 1558-1564.] doi 10.1134/S1070428016110026
tov G.M., Pitushkin D.A. Russ. J. Org. Chem. 2015, 51,
23.
Ивлева Е.А., Морозова А.И., Сучилин И.Д., Ширя-
1795-1796.] doi 10.1134/S1070428015120246
ев А.К., Климочкин Ю.Н. ЖОрХ. 2020, 56, 1242-
1250. [Ivleva E.A., Morozova A.I., Suchilin I.D., Shi-
40.
Scattolin T., Klein A., Schoenebeck F. Org. Lett. 2017,
ryaev A.K., Klimochkin Yu.N. Russ. J. Org. Chem. 2020,
19, 1831-1833. doi 10.1021/acs.orglett.7b00689
56, 1399-1406.] doi 10.1134/S1070428020080102
41.
Zhen L., Fan H., Wang X., Jiang L. Org. Lett. 2019, 21,
24.
Климочкин Ю.Н., Ивлева Е.А., Моисеев И.К.
2106-2110. doi 10.1021/acs.orglett.9b00383
ЖОрХ. 2020, 56, 1353-1362. [Klimochkin Yu.N.,
42.
Nam K.D., Han M., Yoon J., Kim E.-A., Cho S.-W.,
Ivleva E.A., Moiseev I.K. Russ. J. Org. Chem. 2020,
Hahn H.-G. Bull. Korean Chem. Soc. 2013, 34, 274-
56, 1532-1539.] doi 10.1134/S1070428020090055
277. doi 10.5012/bkcs.2013.34.1.271
25.
Ивлева Е.А., Казакова А.И., Климочкин Ю.Н.
43.
Wei J., Liang S., Jiang L., Yi W. J. Org. Chem. 2020,
ЖОрХ. 2020, 56, 1392-1400. [Ivleva E.A., Kazako-
85, 12374-12381. doi 10.1021/acs.joc.0c01634
va A.I., Klimochkin Yu.N. Russ. J. Org. Chem. 2020,
44.
Fu Z., Yuan W., Chen N., Yang Z., Xu J. Green Chem.
56, 1562-1569.] doi 10.1134/S1070428020090109
2018, 20, 4484-4491. doi 10.1039/c8gc02261e
26.
Хуснутдинов Р.И., Щаднева Н.А., Маякова Ю.Ю.,
45.
Бутов Г.М., Мохов В.М., Бурмистров В.В.,
Кашфетдинова Г.З., Хазипова А.Н. ЖОрХ. 2020, 56,
Саад К.Р., Питушкин Д.А. ЖОрХ. 2014, 50, 1293-
1891-1896.
1295. [Butov G.M., Mokhov V.M., Burmistrov V.V.,
27.
Климочкин Ю.Н., Леонова М.В., Ивлева Е.А.,
Saad K.R., Pitushkin D.A. Russ. J. Org. Chem. 2014,
Казакова А.И., Заборская М.С. ЖОрХ. 2021, 57,
50, 1276-1278.] doi 10.1134/S1070428014090073
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 3 2021
РЕАКЦИИ КАРКАСНЫХ СУБСТР
АТОВ С S-НУКЛЕОФИЛАМИ
383
46. Климочкин Ю.Н., Стулин Н.В., Моисеев И.К. А.C.
Russ. J. Org. Chem. 2017, 53, 971-976.] doi 10.1134/
1309528 (1987) СССР. Б.И. 2006, № 36.
S1070428017070028
47. Walter W., Bode K.-D. Angew. Chem. 1967, 79, 285-
51. Моисеев И.К., Климочкин Ю.Н., Земцова М.Н.,
297. doi 10.1002/ange.19670790702
Трахтенберг П.Л. ЖОрХ. 1984, 20, 1435-1438.
48. Климочкин Ю.Н., Моисеев И.К. А.C.
1759877
52. Oliver J.E., Stokes J.B. J. Med. Chem. 1970, 13, 779-
(1990) СССР. Б.И. 1992, № 33.
780. doi 10.1021/jm00298a060
49. Полис Я.Ю., Рагуэль Б.П. А.C. 304248 (1969) СССР.
53. Kreutzberger A., Schröders H.-H. Tetrahedron
Б.И. 1971, № 17.
Lett.
1970,
11,
4921-4924. doi
10.1016/S0040-
50. Климочкин Ю.Н., Юдашкин А.В., Жилкина Е.О.,
4039(00)99744-2
Ивлева Е.А., Моисеев И.К., Ошис Я.Ф. ЖОрХ. 2017,
53, 959-964. [Klimochkin Yu.N., Yudashkin A.V.,
54. Joergensen F.S., Snyder J.P. J. Org. Chem. 1980, 45,
Zhilkina E.O., Ivleva E.A., Moiseev I.K., Oshis Ya.F.
1015-1020. doi 10.1021/jo01294a020
Reaction of Cage Substrates with S-Nucleophiles
Yu. N. Klimochkin, E. A. Ivleva*, and V. A. Shiryaev
Samara State Technical University, ul. Molodogvardeiskaya, 244, Samara, 443100 Russia
*e-mail: ivleva.ea@samgtu.ru
Received December 14, 2020; revised December 20, 2020; accepted December 24, 2020
Thiocarbamates, isothiocyanates and dithiocarbamates of adamantane series were synthesized by reactions of
nitroxy and hydroxy derivatives with S-nucleophiles in 94% sulfuric acid. Di-(1-adamanthyl) disulfide was
obtained by reaction of 1-nitroxy adamantane with sodium sulfide nonahydrate in 94% sulfuric acid.
Keywords: S-nucleophile, adamantane, cage compounds, sulfuric acid, functionalization, nitroxy derivatives
of adamantane, hydroxyl derivatives of adamantane
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 3 2021